Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Тахикардия индуцированной кардиомиопатия как модель хронической сердечной недостаточности у свиней
В этой статье
Резюме
Здесь мы представляем протокол производить тахикардия индуцированной кардиомиопатия в свиней. Эта модель представляет собой мощный способ для изучения гемодинамики прогрессивного хронической сердечной недостаточности и эффекты лечения.
Аннотация
Для многих экспериментов понять гемодинамики или для проверки эффектов новых методов лечения необходима стабильная и надежная модель хронической сердечной недостаточности. Здесь мы представляем такой модели, тахикардия индуцированной кардиомиопатия, который может быть получен путем быстрого сердца, ходить в свиней.
Один ходить свинца является введено transvenously в полностью анестезированные здоровых свиней, чтобы верхушки правого желудочка и зациклена. Его другом конце дорзально затем туннель в паравертебральных регион. Там он подключен к внутренней изменение сердца кардиостимулятор подразделение, которое затем имплантируется в кармане подкожной.
После 4-8 недель быстрого желудочков ходить на скорости 200-240 ударов/мин осмотр показал признаки тяжелой сердечной недостаточности - тахипноэ, спонтанное синуса тахикардия и усталость. Эхокардиография и Рентген показал дилатация всех камер сердца, излияния и тяжелой систолической дисфункцией. Эти выводы соответствуют хорошо декомпенсированного Дилатационная кардиомиопатия также сохраняются и после прекращения ходить.
Эта модель тахикардия индуцированной кардиомиопатия может использоваться для изучения патофизиологии прогрессивного хронической сердечной недостаточности, особенно гемодинамических изменений, вызванных новых методов лечения, как механические кровообращения поддерживает. Эта методология легко выполнить, и результаты являются надежными и воспроизводимость.
Введение
Различные новые методы лечения сердечной недостаточности (ВЧ), особенно растущее во всем мире использование механических кровообращения поддерживает и экстракорпоральной мембранной оксигенации (Эмо) в клинической практике, отражающие в доклинические экспериментальные испытания. Основное внимание уделялось гемодинамических изменений, вызванных исследуемого лечения условий, а именно на системного артериального давления1, сократимости миокарда, давление и объем изменений в камерах сердца и сердца работы2,3, приток артериальной крови в системных и периферических артерий, наряду с метаболической компенсации4 - региональные ткани насыщенность, легочной перфузии и анализ газа крови. Другие исследования направлены на долгосрочные последствия кровообращения поддержки5, сопутствующего воспаления или возникновении гемолиза. Все эти виды исследования нужна стабильная biomodel застойной ВЧ.
Большинство опубликованных экспериментов на покинул желудочков (LV) производительность и гемодинамики механических кровообращения поддержки были проведены на экспериментальной модели острого ВЧ2,6,,78 , 9 , 10, или даже на полностью нетронутыми сердца. С другой стороны в клинической практике, механические кровообращения поддерживает часто применяются в состояние декомпенсации кровообращения, которая развивается на основании ранее настоящего хронические болезни сердца. В таких ситуациях механизмов адаптации полностью разработаны и могут играть важную роль в непоследовательности результатов наблюдается согласно «остроты или хронизации» основной болезни сердца11. Таким образом модель стабильной хронической ВЧ может предложить новые идеи в патофизиологических механизмов и гемодинамики. Хотя есть причины, почему использование хронической HF моделей скудные - много времени подготовке, нестабильность сердечного ритма, этические вопросы и смертности - их преимущества очевидны, как они предлагают присутствие долгосрочных нейрогуморальные активации, Общие системные адаптация, функциональные изменения кардиомиоцитов и структурные изменения сердца мышцы и клапанов12,13.
В целом наличие и разнообразие животных моделей, используемых для исследования гемодинамики широк и предлагает выбор для многих конкретных потребностей. Для этих экспериментов, главным образом свинину, собак, овец, или с мышиным меньше параметров модели, в настоящее время выбраны и предложение хорошее Моделирование ожидаемого человека телесных реакций14. Кроме того формы единого органа эксперименты становятся более частыми15. Чтобы достоверно имитировать патофизиологии HF, тираж искусственно ухудшается. Повреждение сердца может быть вызвано различными методами, часто ишемии, аритмии, давление перегрузки или кардиотоксический эффект препаратов, с любым из них ведет к ухудшению гемодинамики модели. Для получения истинной модели хронической HF, время должна быть обеспечена для разработки долгосрочной адаптации всего организма. Такая надежная и стабильная модель хорошо представлена тахикардия индуцированной кардиомиопатия (ТИЦ), который может быть получен путем быстрого сердца, ходить в подопытных животных.
Было показано, что в предрасположенных сердца, долговечные непрекращающихся тахиаритмиями может привести к систолической дисфункции и растяжений с снижение сердечного выброса. Условие, именуемый как Тиц был впервые описано в 1913 году16, широко используемая в экспериментах с 196217и в настоящее время общепризнанным расстройства. Его происхождение может лежать в различных видах аритмий - суправентрикулярной и желудочковая тахикардия может привести к постепенным ухудшением систолической функции, бивентрикулярная дилатация и прогрессивного клинические признаки ВЧ включая асцит, отеки, летаргия и в конечном итоге сердечной декомпенсации, ведущих к терминал ВЧ и, если не лечить, смерть.
Подобные эффекты кровообращения подавления были замечены путем введения высокого уровня сердца, ходить в животных моделях. В модель свинину, сокращение предсердий или желудочков сердечного ритма над 200 ударов в минуту является достаточно мощным, чтобы побудить HF конце этапа в течение 3-5 недель (прогрессивный фаза) с характеристиками TIC, хотя межличностных различий18, 19. Эти выводы соответствуют хорошо декомпенсированного кардиомиопатия и являются, главное, также сохраняются после прекращения стимуляции (хроническая фаза)19,20,21,22, 23.
Свиней, собак или баранину TIC модели неоднократно были подготовлены для изучения патофизиологии ВЧ14, как изменения в LV имитировать характеристики Дилатационная кардиомиопатия24. Гемодинамические характеристики хорошо описаны - увеличение желудочков конечного диастолического давления, снижение сердечного выход, расширение системного сосудистого сопротивления и дилатация обоих желудочков. В противоположность этому последовательно не наблюдается гипертрофия стены, и даже стены истончение был охарактеризован некоторыми исследователями25,26. С прогрессированием желудочков измерений регургитация на Предсердно-желудочковые клапаны развивается26.
В этой публикации мы представляем протокол производить TIC, долгосрочный быстро сердца электрокардиостимуляции в свиней. Этот biomodel является мощным средством для изучения декомпенсированного Дилатационная кардиомиопатия, гемодинамика прогрессивного хронический ВЧ с низкого сердечного выброса и эффекты лечения.
протокол
Этот экспериментальный протокол был рассмотрен и одобрен организационного комитета экспертов животного на первый факультет, Университет Чарльз и была исполнена на экспериментальной лаборатории университета, Кафедра физиологии, первый факультет Медицина, Карлов университет в Праге, Чешская Республика, в соответствии с законом № 246/1992 Coll. о защите животных от жестокого обращения. Все животные были лечение и уход в соответствии с руководство по уходу и использования лабораторных животных, 8-е издание, опубликована издательством национальных академий, 2011. Все процедуры были выполнены согласно стандартным ветеринарных конвенций и по завершении каждого исследования, был принесен в жертву животное и патанатомия выполнена. Из-за подходящих анатомии, пять здоровых гибридных женский свиньи (Sus scrofa domestica) до 6 месяцев были включены в этом эксперименте. Их средний вес был 66 ± 20 кг в день сбора данных.
1. Общая анестезия
- После 1 день поста инициировать анестезии администрацией внутримышечное введение мидазолама (0,3 мг/кг) и кетамина гидрохлорид (15-20 мг/кг) в ягодичной области.
- Вставьте периферические канюли в Вену маргинальных уха для внутривенного применения.
- Администрировать внутривенного болюсов пропофол (2 мг/кг) и морфина (0,1 - 0,2 мг/кг).
- Обеспечить животных с кислородом через маски и заранее orotracheal интубация с манжетами эндотрахеальной трубки диаметром 6,5-7,5 мм.
- Продолжить общее внутривенной анестезии сочетанием пропофола (6-12 мг/кг/ч), мидазоламом (0,1 - 0,2 мг/кг/ч) и морфин (0,1 - 0,2 мг/кг/ч), регулировки дозы согласно индивидуальных ответов - подавить спонтанного дыхания, роговицы рефлексы, и опорно ответ. Защитите глаза животного с мазь для предотвращения сухости.
- Управлять механической вентиляции автоматическое устройство замкнутого цикла, набор для вентиляции адаптивной поддержки для поддержания целевых конца Приливные CO2 38-42 мм рт.ст и насыщенность адекватного гемоглобин 95-99%. Мониторинг всех жизненно важных функций, особенно сердечного ритма и температуру тела.
- Прикрепите животного, обеспечение ее ноги нежно к таблице операции в лежачем положении.
- Применять антибиотики широкого спектра - 1 g Цефазолин внутривенно через канюлю вен уха.
2. желудочковая свинца имплантации
- Найдите хирургических сайтов и брить кожу должным образом с помощью бритвы (1) югулярной региона выше ключично мышц и (2) одностороннее паравертебральных региона на задней стороне шеи животного.
- С помощью УЗИ сосудистого зонда, визуализировать внешней яремной вены и Марк его расположение на коже. Найдите сонной артерии, а также во избежание его повреждения.
- После дезинфекции кожи широкий, используя повидон йод накройте стерильные хирургические портьера с отверстием над помеченной югулярной региона.
- Подготовить все необходимые инструменты для вживления ритмоводителя и держать их стерильными. Это важно для поддержания стерильную среду во всей процедуре.
- Вырезать кожу параллельных выше внешней яремной вены, мелкие подкожные карман в мягких тканей не более 10 мм глубиной. Не допускайте каких-либо крупных судов.
- Из нижней части предварительно карман вставьте внешней яремной вены, используя стандартный метод Seldinger оболочкой. Во-первых вставьте soft наконечник проволочного проводника через 12G прокола иглой и затем над проволочного ввести 7-французский слезоточивый пластиковых прочь интродьюсер ножнах с расширителя.
- Под руководством флюорографическая ввести 58 см, ходить через этот оболочка и положение его кончика к вершине правого желудочка. Затем извлеките футляр и зафиксировать кончик активного электрода в миокарде при помощи винтов из своей спирали.
- Тест стимуляции параметры - ведущий зондирования сигнал электрокардиограммы желудочков и импеданс должен быть стабильным, стимуляции порог должен быть ниже амплитудой 1 V с 0,4 мс длительностью импульса.
- Вытащить резиновую манжету на стимуляции свинца и исправить оба вместе, чтобы в нижней части предварительно югулярной подкожной карман, два потока швы не рассасывающиеся шовные плетеные. Главное должен быть вставлен достаточной длины, ходить свинца, учитывая возможного роста в будущем животного.
3. подкожной свинца туннелирование
- Переверните животное на его стороне и лечить боковой региона ранее бритой кожи к магистрали, а затем накрыть стерильные хирургические портьера с отверстием. Убедитесь, что югулярной подкожной карман и ведущим остаются стерильными.
- Разрезать боковым кожи к магистрали и образуют глубокий, просторные, подкожной карман. Использование тупой подготовки и остановить любые возможные кровотечения.
- Возьмите мягкий каучук удлинитель из стерильных инфузионных набор и отрезаны оба ее конца. С помощью инструмента туннелирования, преформ прямой подкожный туннель, соединяющий шейных и спинной подкожной карманы с этой удлинитель.
- Подключите свободный конец трубки к желудочковой свинца, потянув его на IS-1 разъема и привлечь ведущих через туннель преформированных в спинной карман подкожной дорзально вытягивая трубка. Это может быть полезным для безопасного соединения с шелковый галстук.
- Удалите средство туннелирования и расширение трубки, подвергая желудочков свинца из спинной карман подкожно.
4. Водитель сердечного ритма имплантации
- Настройка блока Кардиостимулятор имплантируемый двухкамерный сердца с «Y» соединяет часть. Подключение «Y» позволяет конвергентной связи как кардиостимулятор результатов анкет и соединены вместе для одного шага привести (рис. 1 и рис. 2). Этот параметр будет позднее предоставить широкий спектр шага частоты.
- После подключения ходить свинца, закрепите все винты соединения IS-1 в группе заголовок кардиостимулятора и соединения свинца «Y».
- Скройте весь электрокардиостимуляции в глубокая дорсальная подвесные системы. Там должно быть достаточно места, чтобы комфортно разместить блок кардиостимулятора и любые избыточные свинца.
- Проверьте окончательные параметры стимуляции. Убедитесь, что желудочков сердца электрокардиостимуляции возможен от обоих выходов кардиостимулятора.
- Промойте повидон йод и закрыть оба подкожной карманы. Использование рассасывающиеся плетеный поток шовные слои фиброзной ткани и не рассасывающиеся шовные для адаптации кожи.
5. послеоперационный уход
- До тех пор, пока он приходит в сознание достаточно внимательно наблюдать животных.
- Продолжить в широкий спектр внутривенного схемы антибиотикотерапии до заживления раны - Цефазолин 1 г каждые 12 ч. Администрирование анальгетиков в соответствующих дозирования, например, морфин 0,2 мг/кг каждые 6-12 ч в течение 3 дней подкожно. При необходимости, корректировать дозу надлежащим образом предотвратить боль.
- Поместите животное в комфортабельный, спокойный объекта при комнатной температуре. Разрешить свободный доступ к воде и подходящее питание.
- Платье раны с стерильных скрабы регулярно, чтобы сохранить чистый исцеления.
- Чтобы обеспечить отдых после хирургической процедуры, держите кардиостимулятор, тормозится родной сердечного ритма для по крайней мере 3 дней.
- Удаление кожи не рассасывающиеся швы при полностью исцелен, примерно 10-14 дней после процедуры.
6. ходить протокол
- Начните ходить протокол после достаточного периода покоя. Первоначально увеличьте темп сердечного ритма желудочков до 200 уд/мин, установив режим D00 Двухкамерный кардиостимулятор, 100 уд/мин и сопутствующе обстоятельств Настройка AV задержки до 300 мс (точно соответствовать ПАСЕ ПАСЕ интервал, см. таблицу 1). Выберите однополярного электрокардиостимуляции в обоих мероприятий.
- Шагам увеличьте темп сердечного ритма до 220 ударов/мин после 1 недели и 240 ударов/мин после 2 недель (рис. 3). Держите постоянно ходить на этой частоте, если только оно не переносится гемодинамически. Если ВЧ слишком быстро прогрессирует, снизить темп сердечных сокращений до повышения его снова после еще на неделю.
- Используйте аускультацию сердца, ЭКГ и кардиостимулятором допроса ежедневно для проверки частоты сердечных сокращений и постоянной электрокардиостимуляции параметров, включая батареи.
7. сердечная недостаточность индукции и мониторинг
- Обеспечение регулярного ухода специализированных ветеринаром и контролировать состояние общего здоровья животного. Клинические наблюдения увеличения собственного сердца и дыхания ставки, оценки периферийных пульсоксиметрии и сокращения в спонтанной физической активности или аппетит предоставляют сведения о ВЧ прогрессии.
- Использовать преимущества беспроводных чрескожной кардиостимулятор допроса и, если возможно, непрерывная запись ЭКГ - частые-поддерживается желудочковая тахикардия (VT) являются признаком прогрессирования тяжелых кв.
- Используйте эхокардиографические оценок раскрыть сердце структурные и функциональные изменения. Обратите внимание, чтобы найти окно оптимального изображения согласно свинину анатомии и дилатации сердца - для представления типичных 4 камеры, место датчика справа чуть ниже мечевидный и угол его шеи или левого плеча. Для представления короткий оси используйте межреберные windows. После нескольких недель должно быть заметно снижение фракции выброса желудочка в родной сердечного ритма и Атриовентрикулярная regurgitations.
Примечание: Существуют значительные межличностных различия высокий уровень желудочков ходить терпимости. Таким образом частый мониторинг и индивидуально адаптированы Настройка протокола стимуляции являются необходимыми.

Рисунок 1: сердце ходить блок схема. Двухкамерный кардиостимулятор (1), «Y» в форме адаптер (2) проведение конвергентно обоих выходов кардиостимулятор вместе для одного шага привести (3). Кончик провода зафиксированном в апикальной части RV полости (4). Этот параметр обеспечивает широкий спектр высоких частот ходить. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Сердце электрокардиостимуляции исполнимых Рентген (A) и фотографии (B) двухкамерный Электрокардиостимулятор (1), «Y» в форме адаптер (2), и желудочковая электрокардиостимуляции привести (3). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Желаемый HR | Стоимость установка кардиостимулятора | ПАСЕ ПАСЕ интервал |
| уд/мин | уд/мин | MS |
| 200 | 100 | 300 |
| 220 | 110 | 270 |
| 240 | 120 | 250 |
| 250 | 125 | 240 |
Таблица 1: параметры кардиостимулятор. Чтобы разрешить высокий уровень сердца, ходить с блоком имплантированных в дом-модифицированных Двухкамерный кардиостимулятор, в таблице нужный темп сердечных сокращений (HR) и сопоставления ПАСЕ ПАСЕ интервала значений. Кардиостимулятором должно быть присвоено D00 режим работы в размере половины желаемого HR, и AV задержки присвоено соответствующее ПАСЕ ПАСЕ интервал в миллисекундах.
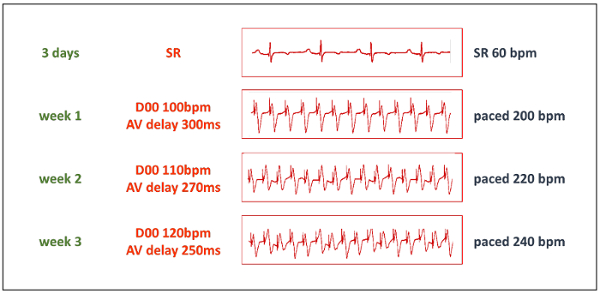
Рисунок 3 : Электрокардиостимуляция протокол. Прогрессивные фаза индукции TIC начинается после отдыха продолжительностью 3 дня. Затем, кардиостимулятором устанавливается режим D00 с частотой 50% от требуемой частоты темп стимуляции, и AV задержки установлен соответствующий ПАСЕ ПАСЕ интервал (см. таблицу 1). Благодаря «Y» в форме адаптер оба выхода кардиостимулятор проводятся один ходить свинца. BPM = ударов в минуту. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты
Тестирование модели: После того, как признаки декомпенсированной хронической ВЧ стали видными, искусственной вентиляции и анестезии вводили снова после принципы, описанные выше, но дозирования была скорректирована ввиду низкого сердечного вывода2...
Обсуждение
Хронический ВЧ является основной проблемой здравоохранения, значительно способствует заболеваемости и смертности. Патогенез и прогрессирования ВЧ в организме человека является сложным, поэтому соответствующие животной модели имеет решающее значение для изучения основных механизм?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана Карлова университета научно-исследовательских грантов GA Великобритании № 538216 и GA Великобритании № 1114213.
Материалы
| Name | Company | Catalog Number | Comments |
| Medication | |||
| midazolam | Roche | Dormicum | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| propofol | B.Braun | Propofol | anesthetic |
| cefazolin | Medochemie | Azepo | antibiotic |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| povidone iodine | Egis Praha | Betadine | disinfection |
| morphine | Biotika Bohemia | Morphin 1% inj | analgetic |
| Tools | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| cauterizer | |||
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Prolene | Ethicon | 8433H | non-absorbable suture |
| Diagnostic devices | |||
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| Acuson P5-1 | Siemens Healthcare | echocardiographic probe | |
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| 3PSB, 4PSB and 6PSB | Transonic Systems | perivascular flow probes | |
| TS420 | Transonic Systems | perivascular flow module | |
| TruWave | Edwards Lifesciences | T001660A | fluid-filled pressure transducer |
| 7.0F VSL Pigtail | Transonic Systems | pressure sensor catheter | |
| INVOS 5100C Cerebral/Somatic Oximeter | Somanetics/Medtronic | near infrared spectroscopy | |
| CCO Combo Catheter | Edwards Lifesciences | 744F75 | Swan-Ganz pulmonary artery catheter |
| Vigillace II | Edwards Lifesciences | VIG2E | cardiac output monitor |
| 7.0F VSL Pigtail | Transonic Systems | pressure-volume catheter | |
| ADV500 | Transonic Systems | pressure-volume system | |
| LabChart and PowerLab | ADInstruments | data acquisition and analysis system | |
| Prism 6 | GraphPad | statistical analysis software | |
| Pacing devices | |||
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| Effecta DR | Biotronic | 371199 | dual-chamber pacemaker |
| Tendril STS | St. Jude Medical | 2088TC/58 | ventricular pacing lead |
| Lead permanent adapter | Osypka | Article 53422 | convergent "Y" connecting part |
| Lead permanent adapter | Osypka | Article 53904 | convergent "Y" connecting part |
| Tear-Away Introducer 7F | B.Braun | 5210593 | tear away introducer sheath |
| Split Cath Tunneler | medComp | AST-L | tunneling tool |
| infusion line | MPH Medical Devices | 2200045 | connecting line |
Ссылки
- Ostadal, P., et al. Direct comparison of percutaneous circulatory support systems in specific hemodynamic conditions in a porcine model. Circ Arrhythm Electrophysiol. 5 (6), 1202-1206 (2012).
- Ostadal, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow negatively affects left ventricular performance in a porcine model of cardiogenic shock. J Transl Med. 13, 266 (2015).
- Shen, I., et al. Left ventricular dysfunction during extracorporeal membrane oxygenation in a hypoxemic swine model. Ann Thorac Surg. 71 (3), 868-871 (2001).
- Hala, P., et al. Regional tissue oximetry reflects changes in arterial flow in porcine chronic heart failure treated with venoarterial extracorporeal membrane oxygenation. Physiol Res. 65 (Supplementum 5), S621-S631 (2016).
- Church, J. T., et al. Normothermic Ex-Vivo Heart Perfusion: Effects of Live Animal Blood and Plasma Cross-Circulation. ASAIO J. , (2017).
- Bavaria, J. E., et al. Changes in left ventricular systolic wall stress during biventricular circulatory assistance. Ann Thorac Surg. 45 (5), 526-532 (1988).
- Shen, I., et al. Effect of extracorporeal membrane oxygenation on left ventricular function of swine. Ann Thorac Surg. 71 (3), 862-867 (2001).
- Ostadal, P., et al. Novel porcine model of acute severe cardiogenic shock developed by upper-body hypoxia. Physiol Res. 65 (4), 711-715 (2016).
- Ostadal, P., et al. Noninvasive assessment of hemodynamic variables using near-infrared spectroscopy in patients experiencing cardiogenic shock and individuals undergoing venoarterial extracorporeal membrane oxygenation. J Crit Care. 29 (4), e611-e695 (2014).
- Mlcek, M., et al. Hemodynamic and metabolic parameters during prolonged cardiac arrest and reperfusion by extracorporeal circulation. Physiol Res. 61 (Suppl 2), S57-S65 (2012).
- Tarzia, V., et al. Extracorporeal life support in cardiogenic shock: Impact of acute versus chronic etiology on outcome. J Thorac Cardiovasc Surg. 150 (2), 333-340 (2015).
- Howard, R. J., Stopps, T. P., Moe, G. W., Gotlieb, A., Armstrong, P. W. Recovery from heart failure: structural and functional analysis in a canine model. Can J Physiol Pharmacol. 66 (12), 1505-1512 (1988).
- Moe, G. W., Armstrong, P. Pacing-induced heart failure: a model to study the mechanism of disease progression and novel therapy in heart failure. Cardiovasc Res. 42 (3), 591-599 (1999).
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Aust N Z J Med. 29 (3), 395-402 (1999).
- Trahanas, J. M., et al. Achieving 12 Hour Normothermic Ex Situ Heart Perfusion: An Experience of 40 Porcine Hearts. ASAIO J. 62 (4), 470-476 (2016).
- Gossage, A. M., Braxton Hicks, J. A. On auricular fibrillation. Quarterly Journal of Medicine. 6, 435-440 (1913).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20 (1), 39-40 (1962).
- Spinale, F. G., Grine, R. C., Tempel, G. E., Crawford, F. A., Zile, M. R. Alterations in the myocardial capillary vasculature accompany tachycardia-induced cardiomyopathy. Basic Res Cardiol. 87 (1), 65-79 (1992).
- Shinbane, J. S., et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 29 (4), 709-715 (1997).
- Moe, G. W., Stopps, T. P., Howard, R. J., Armstrong, P. W. Early recovery from heart failure: insights into the pathogenesis of experimental chronic pacing-induced heart failure. J Lab Clin Med. 112 (4), 426-432 (1988).
- Takagaki, M., et al. Induction and maintenance of an experimental model of severe cardiomyopathy with a novel protocol of rapid ventricular pacing. J Thorac Cardiovasc Surg. 123 (3), 544-549 (2002).
- Tomita, M., Spinale, F. G., Crawford, F. A., Zile, M. R. Changes in left ventricular volume, mass, and function during the development and regression of supraventricular tachycardia-induced cardiomyopathy. Disparity between recovery of systolic versus diastolic function. Circulation. 83 (2), 635-644 (1991).
- Schmitto, J. D., et al. Large animal models of chronic heart failure (CHF). J Surg Res. 166 (1), 131-137 (2011).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259 (1 Pt 2), H218-H229 (1990).
- Chow, E., Woodard, J. C., Farrar, D. J. Rapid ventricular pacing in pigs: an experimental model of congestive heart failure. Am J Physiol. 258 (5 Pt 2), H1603-H1605 (1990).
- Howard, R. J., Moe, G. W., Armstrong, P. W. Sequential echocardiographic-Doppler assessment of left ventricular remodelling and mitral regurgitation during evolving experimental heart failure. Cardiovasc Res. 25 (6), 468-474 (1991).
- Roberts, F., Freshwater-Turner, D. Pharmacokinetics and anaesthesia. Contin Educ Anaesth Crit Care Pain. 7 (1), 25-29 (2007).
- Carter, B. S., Farrell, C., Owen, C. Microsurgical clip obliteration of middle cerebral aneurysm using intraoperative flow assessment. J Vis Exp. (31), (2009).
- Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications. J Biomed Opt. 12 (6), 062104 (2007).
- Mateu Campos, M. L., et al. Techniques available for hemodynamic monitoring. Advantages and limitations. Med Intensiva. 36 (6), 434-444 (2012).
- Baan, J., et al. Continuous measurement of left ventricular volume in animals and humans by conductance catheter. Circulation. 70 (5), 812-823 (1984).
- Ellenbroek, G. H., et al. Primary Outcome Assessment in a Pig Model of Acute Myocardial Infarction. J Vis Exp. (116), (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. J Vis Exp. (111), (2016).
- van Hout, G. P., et al. Admittance-based pressure-volume loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiol Rep. 2 (4), e00287 (2014).
- Kass, D. A., et al. Comparative influence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 76 (6), 1422-1436 (1987).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Hendrick, D. A., Smith, A. C., Kratz, J. M., Crawford, F. A., Spinale, F. G. The pig as a model of tachycardia and dilated cardiomyopathy. Lab Anim Sci. 40 (5), 495-501 (1990).
- Wyler, F., et al. The Gottinger minipig as a laboratory animal. 5. Communication: cardiac output, its regional distribution and organ blood flow (author's transl). Res Exp Med (Berl). 175 (1), 31-36 (1979).
- Cruz, F. E., et al. Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol. 16 (3), 739-744 (1990).
- Umana, E., Solares, C. A., Alpert, M. A. Tachycardia-induced cardiomyopathy. Am J Med. 114 (1), 51-55 (2003).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circ Heart Fail. 2 (3), 262-271 (2009).
- Xanthos, T., et al. Baseline hemodynamics in anesthetized landrace-large white swine: reference values for research in cardiac arrest and cardiopulmonary resuscitation models. J Am Assoc Lab Anim Sci. 46 (5), 21-25 (2007).
- Little, W. C. Diastolic dysfunction beyond distensibility: adverse effects of ventricular dilatation. Circulation. 112 (19), 2888-2890 (2005).
- Montgomery, C., Hamilton, N., Ianuzzo, C. D. Effects of different rates of cardiac pacing on rat myocardial energy status. Mol Cell Biochem. 102 (2), 95-100 (1991).
- Qin, F., Shite, J., Mao, W., Liang, C. S. Selegiline attenuates cardiac oxidative stress and apoptosis in heart failure: association with improvement of cardiac function. Eur J Pharmacol. 461 (2-3), 149-158 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены