Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cardiomyopathie induite par la tachycardie comme un modèle de l’insuffisance cardiaque chronique chez le porc
Dans cet article
Résumé
Nous présentons ici un protocole pour produire une cardiomyopathie induite par la tachycardie chez les porcs. Ce modèle représente un moyen puissant pour l’étude de l’hémodynamique de l’insuffisance cardiaque chronique progressive et les effets du traitement appliqué.
Résumé
De nombreuses expériences pour comprendre l’hémodynamique ou pour tester les effets des nouvelles méthodes de traitement, il faut un modèle fiable et stable de l’insuffisance cardiaque chronique. Nous présentons ici un tel modèle de cardiomyopathie induite par la tachycardie, qui peut être produite par cardiaque rapide rythme chez le porc.
Une seule électrode de stimulation est transvenously introduit dans complètement anesthésiés porcs sains, à l’apex du ventricule droit et obsédé. Son autre extrémité puis intégrée sur le dos dans la région de paravertébraux. Là, il est connecté à une unité de stimulateur interne mis à jour le cœur qui est ensuite implantée dans une poche sous-cutanée.
Après 4 à 8 semaines de stimulation ventriculaire rapide au taux de 200 à 240 battements/min, examen physique a révélé des signes d’insuffisance cardiaque sévère - tachypnée, tachycardie sinusale spontanée et la fatigue. L’échocardiographie et des rayons x a montré une dilatation des cavités cardiaques, épanchements pleuraux et dysfonction systolique sévère. Ces résultats correspondent bien à la cardiomyopathie dilatée décompensée et sont aussi conservés après la cessation de la stimulation.
Ce modèle de cardiomyopathie induite par la tachycardie peut être utilisé pour l’étude de la physiopathologie de l’arrêt du coeur chronique progressive, en particulier les variations hémodynamiques causées par nouvelles modalités de traitement mécaniques circulatoires supports similaires. Cette méthodologie est facile à réaliser et les résultats sont robustes et reproductibles.
Introduction
La variété des nouvelles méthodes de traitement pour l’insuffisance cardiaque (IC), en particulier l’utilisation croissante dans le monde entier des supports circulatoires mécaniques et oxygénation extracorporelle (ECMO) dans la pratique clinique, se penche dans les essais précliniques expérimentales. L’accent a été mis sur les modifications hémodynamiques causées par les modalités de traitement examinés, à savoir sur la pression artérielle systémique1, la contractilité myocardique, la pression et les changements de volume dans les cavités cardiaques et coeur travail2,3, débit sanguin artériel systémique et périphérique artères, ainsi que de la compensation métabolique4 - saturation du tissu régional, perfusion pulmonaire et analyse des gaz sanguins. D’autres études portent sur les effets à long terme de l’assistance circulatoire5, inflammation concomitante ou survenue d’une hémolyse. Tous ces types d’études ont besoin d’un biomodel stable de HF congestifs.
La plupart des expériences publiées sur laissée performance (LV) ventriculaire et hémodynamique d’assistance circulatoire mécanique ont été réalisées sur des modèles expérimentaux d’aiguë HF2,6,7,8 , 9 , 10, ou même sur des coeurs complètement intact. En revanche, dans la pratique clinique, supports circulatoires mécaniques sont souvent appliquées dans un état de décompensation circulatoire qui se développe pour des raisons déjà présent cardiopathie chronique. Dans de telles situations, les mécanismes d’adaptation sont entièrement développées et peuvent jouer un rôle important dans l’incohérence des résultats observés selon « l’acuité ou chronicité » de cardiopathie sous-jacente11. Par conséquent, un modèle stable chronique HF peut offrir de nouvelles connaissances sur les mécanismes physiopathologiques et hémodynamique. Bien qu’il existe des raisons pour lesquelles l’utilisation de modèles de HF chroniques est rare - préparation de votre temps, instabilité du rythme cardiaque, des questions éthiques et taux de mortalité - leurs avantages sont évidents, car ils offrent à long terme sans activation neuro-humoraux, adaptation générale systémique, modifications fonctionnelles des cardiomyocytes et les modifications structurelles du coeur muscle et les valves12,13.
En général, la disponibilité et la variété de modèles animaux utilisés pour des études hémodynamiques est larges et offre le choix pour beaucoup de besoins spécifiques. Pour ces expériences, pour la plupart porcins, canins, ovins, ou avec un plus petit murin de paramètres modèles, font l’objet choisi et offre une bonne simulation de réactions corporelles humaine attendue14. En outre, formes d’expériences d’organe unique sont de plus en plus fréquentes15. Pour sûrement mimer la physiopathologie de l’IC, la circulation est étant artificiellement détériorée. Dommages au coeur peuvent résulter de différentes méthodes, souvent par ischémie, arythmie, une surcharge de pression ou effets cardiotoxiques des médicaments, avec n’importe lequel d'entre eux conduisant à une détérioration hémodynamique du modèle. Pour produire un véritable modèle de HF chronique, temps doit être fourni pour développer l’adaptation à long terme de l’organisme entier. Tel un modèle fiable et stable est représentée par cardiomyopathie induite par la tachycardie (TIC), qui peut être produite par cardiaque rapide rythme des animaux de laboratoire.
Il a été démontré que dans les coeurs prédisposés, tachyarythmies incessantes de longue durée peuvent entraîner dysfonction systolique et dilatation avec débit cardiaque diminué. L’État dénommé TIC a d’abord été décrite en 191316, largement utilisé dans des expériences depuis 196217et est maintenant une maladie reconnue. Son origine peut se trouver dans divers types d’arythmies - fois supraventriculaire et ventriculaire tachycardie peuvent conduire à une détérioration progressive de la fonction systolique et biventriculaire dilatation progressives signes cliniques de HF notamment ascite, oedèmes, léthargie et une décompensation cardiaque en fin de compte menant à borne HF et, si non traitée, la mort.
Des effets similaires de répression circulatoire ont été observés par l’introduction de taux élevé cardiaques rythme dans des modèles animaux. Dans un modèle porcin, une fréquence cardiaque auriculaire ou ventriculaire, plus de 200 battements/minute est assez puissante pour induire la terminale HF dans une période de 3 à 5 semaines (phase progressive) avec caractéristiques des TIC, bien que les différences interindividuelles existent18, 19. ces conclusions correspondent bien aux cardiomyopathie décompensée et sont, ce qui est important, conservé aussi après la cessation de la stimulation (phase chronique)19,20,21,22, 23.
Porcins, canins ou ovines modèles TIC ont été préparés à plusieurs reprises pour étudier la physiopathologie des HF14, comme les modifications apportées à la LV reproduire les caractéristiques d’une cardiomyopathie dilatée,24. Les caractéristiques hémodynamiques sont bien décrits - pressions télédiastolique ventriculaires accrues, cardiaque baisse de sortie, a augmenté la résistance vasculaire systémique et la dilatation des deux ventricules. En revanche, hypertrophie de la paroi n’est pas toujours respecté, et amincissement de la paroi même a été décrit par certains chercheurs25,26. Avec une progression de dimensions ventriculaires, régurgitation sur valves atrioventriculaires développe26.
Dans cette publication, nous présentons un protocole pour produire un TIC par un rythme cardiaque rapide à long terme chez le porc. Cette biomodel représente des moyens puissants pour étudier la myocardiopathie dilatée décompensée, hémodynamique progressive chronique HF avec un débit cardiaque faible et les effets du traitement appliqué.
Protocole
Ce protocole expérimental a été revu et approuvé par le Comité d’experts Animal institutionnels à la première faculté de médecine de l’Université Charles et a été réalisée au laboratoire expérimental Université, département de physiologie, première faculté de Médecine, l’Université Charles à Prague, République tchèque, conformément à la loi n° 246/1992 sur la protection des animaux contre la cruauté. Tous les animaux ont été traités et pris en charge conformément au Guide pour les soins et utilisation des animaux de laboratoire, 8e édition, publié par National Academies Press, 2011. Toutes les procédures ont été réalisés selon les conventions standard vétérinaires et à la fin de chaque étude, l’animal a été sacrifié et une autopsie effectuée. En raison de l’anatomie approprié, cinq sain croisés femelle porcine (Sus scrofa domestica) jusqu'à 6 mois d’âge ont été inclus dans cette expérience. Leur poids moyen a été de 66 ± 20 kg lors de la journée de collecte de données.
1. anesthésie générale
- Après 1 jour de jeûne, initier l’anesthésie par voie intramusculaire de midazolam (0,3 mg/kg) et le chlorhydrate de kétamine (15-20 mg/kg) à la région fessière.
- Insérer la canule périphérique dans la veine marginale oreille pour des applications de drogues par voie intraveineuse.
- Administrer un bolus intraveineux de propofol (2 mg/kg) et de la morphine (0,1 - 0,2 mg/kg).
- Fournir des animaux avec de l’oxygène via un masque facial et avance l’intubation orotrachéale avec une canule endotrachéale avec un diamètre de 6,5 à 7,5 mm.
- Continuer l’anesthésie intraveineuse totale par combinaison du propofol (6-12 mg/kg/h), midazolam (0,1 - 0,2 mg/kg/h) et de la morphine (0,1 - 0,2 mg/kg/h), réglage les doses selon les réactions individuelles - supprimer les respirations spontanées, réflexes cornéens, et réponse motrice. Protéger les yeux de l’animal avec l’onguent pour prévenir le dessèchement.
- Exploiter la ventilation mécanique par un dispositif automatique de boucle fermée valeur ventilation adaptative de soutien afin de maintenir la cible fin d’expiration CO2 de 38 à 42 mmHg et la saturation de l’hémoglobine suffisant de 95 à 99 %. Surveiller toutes les fonctions vitales, en particulier la fréquence cardiaque et la température corporelle.
- Attacher l’animal en sécurisant ses jambes doucement pour la table d’opération en décubitus dorsal.
- Administrer des antibiotiques à large spectre - 1 g de céfazoline par voie intraveineuse par l’intermédiaire de la canule de veine d’oreille.
2. Implantation de plomb ventriculaire
- Localiser des sites chirurgicaux et raser la peau correctement à l’aide d’un rasoir à (1) la région jugulaire au-dessus du muscle sternocléidomastoïdien et (2) la région paravertébraux unilatérale à l’arrière du cou de l’animal.
- À l’aide de la sonde d’échographie vasculaire, visualiser la veine jugulaire externe et marquez son emplacement sur la peau. Localiser l’artère carotide ainsi pour éviter toute sa blessure.
- Après la désinfection de la peau large à l’aide de povidone iodée, couvrir avec un drapé chirurgical stérile avec le trou au-dessus de la région jugulaire marquée.
- Préparer tous les outils nécessaires pour l’implantation de stimulateur cardiaque et gardez-les stérile. Il est crucial de maintenir un environnement stérile tout au long de la procédure.
- Couper la peau parallèle au-dessus de la veine jugulaire externe, forment une poche sous-cutanée peu profonde dans les tissus mous, pas plus de 10 mm de profondeur. N’exposez pas les gros vaisseaux.
- Du fond de la poche préformée, insérez une gaine dans la veine jugulaire externe, en utilisant la technique de Seldinger standard. Tout d’abord, introduire un guide de pointe souple à travers une aiguille de ponction de 12G et ensuite sur le fil guide introduire un introducteur loin de larme en plastique 7-Français avec un dilatateur.
- Sous contrôle radioscopique, introduire un 58 cm stimulation plomb dans cette gaine et positionner sa pointe à l’apex du ventricule droit. Ensuite, retirer la gaine et fixer l’extrémité active de l’électrode sur le myocarde dévisser son hélice.
- Tester les paramètres de stimulation - le signal de télédétection de plomb d’ECG ventriculaire et impédance doit être stable, le seuil de stimulation doit être inférieure à une amplitude de 1 V avec 0,4 ms de durée d’impulsion.
- Tirez un manchon en caoutchouc sur l’électrode de stimulation et fixer les deux ensemble au fond de la poche sous-cutanée jugulaire préformée en deux mailles de fil de suture non résorbable tressée. Ce qui est important, assez de longueur de l’électrode de stimulation doit être insérée, compte tenu de la croissance future possible de l’animal.
3. sous-cutanée plomb Tunneling
- Retourner l’animal sur son flanc et désinfecter la peau préalablement rasée région latérale à la colonne vertébrale, puis recouvrant d’un champ chirurgical stérile avec un trou. Veillez à ce que la poche sous-cutanée jugulaire et le plomb restent stériles.
- Couper la peau latérale de la colonne vertébrale et former une poche sous-cutanée, spacieuse et profonde. Utilisez la préparation terne et arrêter tout saignement possible.
- Prenez un tube d’extension de caoutchouc souple d’une perfusion stérile défini et coupez ses deux extrémités. À l’aide d’un outil de tunneling, préforme un tunnel sous cutané direct reliant les poches sous-cutanées jugulaires et dorsales avec ce tube d’extension.
- Branchez extrémité libre du tube du ventriculaire en tirant sur son connecteur IS-1 et tirer le fil à travers le tunnel préformé dans la poche sous-cutanée dorsale en tirant le tube sur le dos. Il peut être utile sécuriser la connexion avec une cravate de soie.
- Retirez l’outil tunneling et le tube de rallonge, exposant le plomb ventriculaire dans la poche sous-cutanée dorsale.
4. Implantation de stimulateur cardiaque
- Mettre en place l’unité de stimulateur cardiaque implantable de double chambre avec le « Y » reliant la partie. La connexion « Y » permet une connexion convergente de deux stimulateur sorties d’être rejoint et reliés entre eux pour le rythme seul plomb (Figure 1 et Figure 2). Cette configuration offrira plus tard une large gamme de fréquences de stimulation.
- Après raccordement de l’électrode de stimulation, serrer toutes les vis de connexion de l’IS-1 à l’unité d’en-tête de stimulateur cardiaque et la connexion de plomb « Y ».
- Masquer toute stimulation de système dans la poche dorsale profonde. Il doit y avoir suffisamment d’espace pour accueillir l’unité de stimulateur cardiaque et un câble superflu.
- Vérifiez que les paramètres de stimulation finales. Assurez-vous qu’il est possible des deux sorties de stimulateur de stimulation ventriculaire cardiaque.
- Rincer avec la povidone iodée et fermer les deux poches sous-cutanées. Fil tressé résorbable utilisation pour suturer les couches de tissu fibreux et de suture non résorbable pour l’adaptation de la peau.
5. postopératoire soins
- Observez attentivement l’animal jusqu'à ce qu’il reprend conscience suffisante.
- Continuer dans un schéma d’antibiothérapie intraveineuse large spectre jusqu'à ce que les plaies sont cicatrisées - céfazoline 1 g chaque analgésiques d’administrer de 12 h. à ouvrir de dosage, par exemple, la morphine 0,2 mg/kg toutes les 6 à 12 h pendant 3 jours par voie sous-cutanée. Si nécessaire, faire des ajustements de dose pour prévenir les douleurs.
- Placer l’animal dans un établissement confortable, calm, à la température ambiante. Permettre le libre accès à l’eau et d’une alimentation adaptée.
- Habiller les plaies avec stériles gommages régulièrement pour conserver propre guérison.
- Pour fournir le reste après l’intervention chirurgicale, garder le stimulateur inhibé par le rythme cardiaque native au moins 3 jours.
- Enlever les sutures non-absorbables peau lorsque complètement guéri, environ 10-14 jours après l’intervention.
6. Protocole de stimulation
- Commencer le protocole de stimulation après un temps de repos suffisant. Au départ, augmente le rythme cardiaque ventriculaire à 200 battements/min en définissant le stimulateur double chambre mode D00 100 battements/min et en même temps ajuster le délai AV à 300 ms (pour correspondre exactement à l’APCE pour l’APCE intervalle, voir tableau 1). Sélectionnez le rythme unipolaire à deux sorties.
- Augmenter progressivement le rythme cardiaque à 220 battements/min après 1 semaine et à 240 battements/min après 2 semaines (Figure 3). Gardez continue rythme à cette fréquence à moins qu’il n’est pas toléré sur le plan hémodynamique. Si le HF progresse trop rapidement, réduire le rythme cardiaque avant d’augmenter à nouveau après une autre semaine.
- L’auscultation du rythme cardiaque, ECG et interrogatoire de stimulateur cardiaque tous les jours permet de vérifier le rythme cardiaque et la constante stimulation des paramètres, y compris la vie de la batterie.
7. insuffisance cardiaque Induction et surveillance
- Assurer un entretien régulier par un vétérinaire spécialisé et surveiller l’état de santé général de l’animal. Des observations cliniques de plus en plus native cardiaque et taux respiratoires, évaluation de l’oxymétrie de pouls périphériques et la réduction dans l’activité physique spontanée ou appétit fournissent des informations sur la progression de HF.
- Utiliser l’avantage d’interrogatoire sans fil stimulateur transcutané et, si possible, un enregistrement ECG continu - fréquente tachycardie ventriculaire non soutenue (VT) est un signe de progression de HF sévère.
- Évaluation échocardiographique permet de révéler les modifications structurales et fonctionnelles cardiaques. Faire attention pour trouver une fenêtre d’image optimale selon l’anatomie porcin et de dilatation du coeur - pour une vue typique 4 chambre, placer le transducteur à droite juste en dessous de la xiphoïde et angle pour pointer vers le cou ou l’épaule gauche. Pour les courtes-axe vues, utilisez windows intercostaux. Réduction de la fraction d’éjection ventriculaire en rythme cardiaque native et régurgitations auriculo-ventriculaire doit être perceptible après quelques semaines.
NOTE : Importantes différences interindividuelles de tolérance de stimulation ventriculaire taux élevé existent. Par conséquent, une surveillance fréquente et ajustement individuellement adaptée du protocole de stimulation sont nécessaires.

Figure 1 : schéma d’unité stimulation du coeur. Le stimulateur double chambre (1), un adaptateur en « Y » (2) tenue convergente les deux sorties de stimulateur ensemble à un rythme unique conduisent (3). La pointe du plomb est fixée dans la partie apicale de la cavité de RV (4). Ce paramètre offre une large gamme de fréquences de stimulation élevés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Unité de rythme de coeur Rayons x (A) et (B) la photographie du stimulateur double chambre (1), un « Y » en forme de carte (2), et la stimulation ventriculaire d’exécution (3). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| HR désiré | Taux de Set de stimulateur cardiaque | Rythme pour rythmer l’intervalle |
| battements/min | battements/min | MS |
| 200 | 100 | 300 |
| 220 | 110 | 270 |
| 240 | 120 | 250 |
| 250 | 125 | 240 |
Tableau 1 : paramètres de Pacemaker. Pour permettre à taux élevé cardiaque rythme avec l’appareil stimulateur double chambre in-house-modifiés, le tableau montre la désiré au rythme la fréquence cardiaque (FC) et le rythme correspondant au rythme des valeurs de l’intervalle. Le stimulateur cardiaque doit être défini au mode de fonctionnement D00 à raison de la moitié du HR désiré, puis le délai AV affectez-lui le rythme correspondant pour rythmer l’intervalle, en millisecondes.
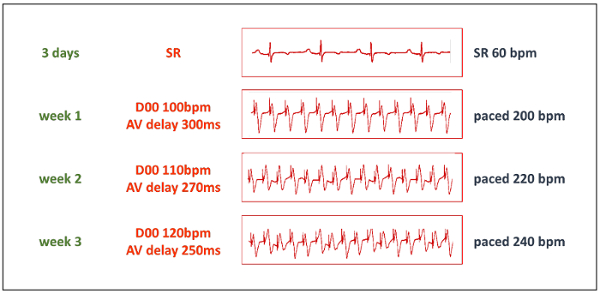
Figure 3 : Protocole de stimulation. La phase progressive de l’induction de TIC démarre après une période de repos de 3 jours. Puis, le stimulateur cardiaque est réglé sur mode D00 avec une fréquence de stimulation de 50 % de la fréquence au rythme souhaitée, et délai de AV est défini à l’APCE correspondant pour rythmer l’intervalle (voir tableau 1). Grâce à l’adaptateur en « Y », les deux sorties de stimulateur cardiaque sont effectués à une seule électrode de stimulation. BPM = battements/minute. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Résultats
Essais du modèle : Après les signes de HF chronique décompensée sont développa, anesthésie et ventilation artificielle ont été administrés à nouveau suivant les principes décrits ci-dessus, mais le dosage a été ajusté en raison de la faible cardiaque sortie27. En raison de possibles cardiodepressive effets des anesthésiques, attention surveillance intensive des fonctions vitales est nécessaire.
Discussion
HF chronique est un problème de santé majeur qui contribue grandement à la morbidité et la mortalité. La pathogénie et la progression de HF chez l’être humain est complexe, donc un modèle animal approprié est essentiel d’étudier les mécanismes sous-jacents et de tester les nouvelles thérapeutiques qui visent à gêner la progression de la maladie grave native. Afin d’étudier sa pathogenèse, modèles animaux de grande taille sont utilisés pour les essais expérimentaux.
En ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par les subventions de recherche de l’Université Charles GA UK No 538216 et GA UK No 1114213.
matériels
| Name | Company | Catalog Number | Comments |
| Medication | |||
| midazolam | Roche | Dormicum | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| propofol | B.Braun | Propofol | anesthetic |
| cefazolin | Medochemie | Azepo | antibiotic |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| povidone iodine | Egis Praha | Betadine | disinfection |
| morphine | Biotika Bohemia | Morphin 1% inj | analgetic |
| Tools | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| cauterizer | |||
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Prolene | Ethicon | 8433H | non-absorbable suture |
| Diagnostic devices | |||
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| Acuson P5-1 | Siemens Healthcare | echocardiographic probe | |
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| 3PSB, 4PSB and 6PSB | Transonic Systems | perivascular flow probes | |
| TS420 | Transonic Systems | perivascular flow module | |
| TruWave | Edwards Lifesciences | T001660A | fluid-filled pressure transducer |
| 7.0F VSL Pigtail | Transonic Systems | pressure sensor catheter | |
| INVOS 5100C Cerebral/Somatic Oximeter | Somanetics/Medtronic | near infrared spectroscopy | |
| CCO Combo Catheter | Edwards Lifesciences | 744F75 | Swan-Ganz pulmonary artery catheter |
| Vigillace II | Edwards Lifesciences | VIG2E | cardiac output monitor |
| 7.0F VSL Pigtail | Transonic Systems | pressure-volume catheter | |
| ADV500 | Transonic Systems | pressure-volume system | |
| LabChart and PowerLab | ADInstruments | data acquisition and analysis system | |
| Prism 6 | GraphPad | statistical analysis software | |
| Pacing devices | |||
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| Effecta DR | Biotronic | 371199 | dual-chamber pacemaker |
| Tendril STS | St. Jude Medical | 2088TC/58 | ventricular pacing lead |
| Lead permanent adapter | Osypka | Article 53422 | convergent "Y" connecting part |
| Lead permanent adapter | Osypka | Article 53904 | convergent "Y" connecting part |
| Tear-Away Introducer 7F | B.Braun | 5210593 | tear away introducer sheath |
| Split Cath Tunneler | medComp | AST-L | tunneling tool |
| infusion line | MPH Medical Devices | 2200045 | connecting line |
Références
- Ostadal, P., et al. Direct comparison of percutaneous circulatory support systems in specific hemodynamic conditions in a porcine model. Circ Arrhythm Electrophysiol. 5 (6), 1202-1206 (2012).
- Ostadal, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow negatively affects left ventricular performance in a porcine model of cardiogenic shock. J Transl Med. 13, 266 (2015).
- Shen, I., et al. Left ventricular dysfunction during extracorporeal membrane oxygenation in a hypoxemic swine model. Ann Thorac Surg. 71 (3), 868-871 (2001).
- Hala, P., et al. Regional tissue oximetry reflects changes in arterial flow in porcine chronic heart failure treated with venoarterial extracorporeal membrane oxygenation. Physiol Res. 65 (Supplementum 5), S621-S631 (2016).
- Church, J. T., et al. Normothermic Ex-Vivo Heart Perfusion: Effects of Live Animal Blood and Plasma Cross-Circulation. ASAIO J. , (2017).
- Bavaria, J. E., et al. Changes in left ventricular systolic wall stress during biventricular circulatory assistance. Ann Thorac Surg. 45 (5), 526-532 (1988).
- Shen, I., et al. Effect of extracorporeal membrane oxygenation on left ventricular function of swine. Ann Thorac Surg. 71 (3), 862-867 (2001).
- Ostadal, P., et al. Novel porcine model of acute severe cardiogenic shock developed by upper-body hypoxia. Physiol Res. 65 (4), 711-715 (2016).
- Ostadal, P., et al. Noninvasive assessment of hemodynamic variables using near-infrared spectroscopy in patients experiencing cardiogenic shock and individuals undergoing venoarterial extracorporeal membrane oxygenation. J Crit Care. 29 (4), e611-e695 (2014).
- Mlcek, M., et al. Hemodynamic and metabolic parameters during prolonged cardiac arrest and reperfusion by extracorporeal circulation. Physiol Res. 61 (Suppl 2), S57-S65 (2012).
- Tarzia, V., et al. Extracorporeal life support in cardiogenic shock: Impact of acute versus chronic etiology on outcome. J Thorac Cardiovasc Surg. 150 (2), 333-340 (2015).
- Howard, R. J., Stopps, T. P., Moe, G. W., Gotlieb, A., Armstrong, P. W. Recovery from heart failure: structural and functional analysis in a canine model. Can J Physiol Pharmacol. 66 (12), 1505-1512 (1988).
- Moe, G. W., Armstrong, P. Pacing-induced heart failure: a model to study the mechanism of disease progression and novel therapy in heart failure. Cardiovasc Res. 42 (3), 591-599 (1999).
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Aust N Z J Med. 29 (3), 395-402 (1999).
- Trahanas, J. M., et al. Achieving 12 Hour Normothermic Ex Situ Heart Perfusion: An Experience of 40 Porcine Hearts. ASAIO J. 62 (4), 470-476 (2016).
- Gossage, A. M., Braxton Hicks, J. A. On auricular fibrillation. Quarterly Journal of Medicine. 6, 435-440 (1913).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20 (1), 39-40 (1962).
- Spinale, F. G., Grine, R. C., Tempel, G. E., Crawford, F. A., Zile, M. R. Alterations in the myocardial capillary vasculature accompany tachycardia-induced cardiomyopathy. Basic Res Cardiol. 87 (1), 65-79 (1992).
- Shinbane, J. S., et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 29 (4), 709-715 (1997).
- Moe, G. W., Stopps, T. P., Howard, R. J., Armstrong, P. W. Early recovery from heart failure: insights into the pathogenesis of experimental chronic pacing-induced heart failure. J Lab Clin Med. 112 (4), 426-432 (1988).
- Takagaki, M., et al. Induction and maintenance of an experimental model of severe cardiomyopathy with a novel protocol of rapid ventricular pacing. J Thorac Cardiovasc Surg. 123 (3), 544-549 (2002).
- Tomita, M., Spinale, F. G., Crawford, F. A., Zile, M. R. Changes in left ventricular volume, mass, and function during the development and regression of supraventricular tachycardia-induced cardiomyopathy. Disparity between recovery of systolic versus diastolic function. Circulation. 83 (2), 635-644 (1991).
- Schmitto, J. D., et al. Large animal models of chronic heart failure (CHF). J Surg Res. 166 (1), 131-137 (2011).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259 (1 Pt 2), H218-H229 (1990).
- Chow, E., Woodard, J. C., Farrar, D. J. Rapid ventricular pacing in pigs: an experimental model of congestive heart failure. Am J Physiol. 258 (5 Pt 2), H1603-H1605 (1990).
- Howard, R. J., Moe, G. W., Armstrong, P. W. Sequential echocardiographic-Doppler assessment of left ventricular remodelling and mitral regurgitation during evolving experimental heart failure. Cardiovasc Res. 25 (6), 468-474 (1991).
- Roberts, F., Freshwater-Turner, D. Pharmacokinetics and anaesthesia. Contin Educ Anaesth Crit Care Pain. 7 (1), 25-29 (2007).
- Carter, B. S., Farrell, C., Owen, C. Microsurgical clip obliteration of middle cerebral aneurysm using intraoperative flow assessment. J Vis Exp. (31), (2009).
- Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications. J Biomed Opt. 12 (6), 062104 (2007).
- Mateu Campos, M. L., et al. Techniques available for hemodynamic monitoring. Advantages and limitations. Med Intensiva. 36 (6), 434-444 (2012).
- Baan, J., et al. Continuous measurement of left ventricular volume in animals and humans by conductance catheter. Circulation. 70 (5), 812-823 (1984).
- Ellenbroek, G. H., et al. Primary Outcome Assessment in a Pig Model of Acute Myocardial Infarction. J Vis Exp. (116), (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. J Vis Exp. (111), (2016).
- van Hout, G. P., et al. Admittance-based pressure-volume loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiol Rep. 2 (4), e00287 (2014).
- Kass, D. A., et al. Comparative influence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 76 (6), 1422-1436 (1987).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Hendrick, D. A., Smith, A. C., Kratz, J. M., Crawford, F. A., Spinale, F. G. The pig as a model of tachycardia and dilated cardiomyopathy. Lab Anim Sci. 40 (5), 495-501 (1990).
- Wyler, F., et al. The Gottinger minipig as a laboratory animal. 5. Communication: cardiac output, its regional distribution and organ blood flow (author's transl). Res Exp Med (Berl). 175 (1), 31-36 (1979).
- Cruz, F. E., et al. Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol. 16 (3), 739-744 (1990).
- Umana, E., Solares, C. A., Alpert, M. A. Tachycardia-induced cardiomyopathy. Am J Med. 114 (1), 51-55 (2003).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circ Heart Fail. 2 (3), 262-271 (2009).
- Xanthos, T., et al. Baseline hemodynamics in anesthetized landrace-large white swine: reference values for research in cardiac arrest and cardiopulmonary resuscitation models. J Am Assoc Lab Anim Sci. 46 (5), 21-25 (2007).
- Little, W. C. Diastolic dysfunction beyond distensibility: adverse effects of ventricular dilatation. Circulation. 112 (19), 2888-2890 (2005).
- Montgomery, C., Hamilton, N., Ianuzzo, C. D. Effects of different rates of cardiac pacing on rat myocardial energy status. Mol Cell Biochem. 102 (2), 95-100 (1991).
- Qin, F., Shite, J., Mao, W., Liang, C. S. Selegiline attenuates cardiac oxidative stress and apoptosis in heart failure: association with improvement of cardiac function. Eur J Pharmacol. 461 (2-3), 149-158 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon