Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kronik kalp yetmezliği model domuz olarak taşikardi kaynaklı kardiyomiyopati
Bu Makalede
Özet
Burada, taşikardi kaynaklı kardiyomiyopati içinde domuz üretmek için bir protokol mevcut. Bu model ilerici kronik kalp yetmezliği hemodinami ve uygulanan tedavinin etkilerini incelemek için güçlü bir şekilde temsil eder.
Özet
Kronik kalp yetmezliği istikrarlı ve güvenilir modeli birçok deney hemodinami anlamak veya yeni tedavi yöntemleri etkilerini sınamak için gereklidir. Burada, taşikardi kaynaklı kardiyomiyopati, hızlı kalp domuz içinde Volta tarafından üretilen tarafından böyle bir model mevcut.
Bir tek hız ayarlama kurşun sağ ventrikül doruk için tam anaesthetized sağlıklı domuz içine tanıttı transvenously olduğunu ve sabitlenmiş. Onun diğer ucunu sonra dorsally paravertebral bölgesine tünel. Orada, o zaman subkutan cebinde implante in-house değiştirilmiş kalp kalp pili birimine bağlı.
200-240 atım/dk oranlarda hızlı Ventriküler pacing, 4-8 hafta sonra fizik muayene takipne, spontan sinüs taşikardisi ve yorgunluk ağır kalp yetmezliği - belirtileri ortaya koydu. Ekokardiyografi ve x-ışını genişleme tüm kalp Odaları, efüzyon ve şiddetli sistolik disfonksiyon gösterdi. Bu bulgular de dekompanse dilate kardiyomiyopati karşılık gelen ve pacing bırakma sonra da korunur.
Bu modeli taşikardi kaynaklı kardiyomiyopati, ilerici kronik kalp yetmezliği, özellikle mekanik dolaşım destekler gibi yeni tedavi yaklaşımları nedeniyle hemodinamik değişiklikler Patofizyoloji eğitim için kullanılabilir. Bu metodoloji gerçekleştirmek kolay ve güçlü ve tekrarlanabilir sonuçlar vardır.
Giriş
Kalp yetmezliği (HF), mekanik dolaşım destekler ve ekstrakorporeal membran oksijenasyonu (ECMO) klinik uygulamada, özellikle büyüyen dünya çapında kullanım için yeni tedavi yöntemleri çeşitli preklinik deneysel test yansıtan. Ana odak tarafından muayene tedavi şekilleri, yani sistemik kan basıncı1' de, miyokard contractility, basınç kaynaklanan hemodinamik değişikliklerin ve kalp odaları ve kalp iş2,3birim değişiklikler olmuştur, arteryel kan akışında sistemik ve periferik arter, metabolik tazminat4 - birlikte bölgesel doku sıcaklığı, akciğer perfüzyon ve kan gazı analizi. Diğer çalışmalar dolaşım destek5, eşlik eden iltihabı veya hemoliz oluşumunu uzun vadeli etkileri yönlendirilmektedir. Bu tür çalışma konjestif HF istikrarlı bir biomodel gerekir.
Ventrikül (LV) performans üzerinde yayımlanmış deneyler çoğunu yaptı ve hemodinami mekanik dolaşım desteğinin akut HF2,6,7,8 deneysel modeller üzerinde gerçekleştirilen , 9 , 10, hatta tamamen bozulmamış kalpleri üzerinde. Öte yandan, klinik uygulamada, mekanik dolaşım destekler kez gerekçesiyle daha önce mevcut kronik kalp hastalığı geliştirir dolaşım dekompansasyon statüsünde uygulanıyor. Böyle durumlarda adaptasyon mekanizmaları tam olarak gelişmiş ve tutarsızlık keskinliği "veya" kronikleşme göre gözlenen sonuçlar önemli roller oynayabileceği altta yatan kalp hastalığı11. Bu nedenle, kronik HF istikrarlı bir model patofizyolojik mekanizmaları ve hemodinami yeni görüşler sunabilir. Olmasına rağmen neden kronik HF modelleri kullanımını kıt - nedenler zaman alıcı hazırlık, kalp ritmi, etik sorular ve ölüm oranı - istikrarsızlık gibi uzun vadeli neurohumoral harekete geçirmek varlığı sundukları avantajları açık,, Genel sistemik adaptasyon, cardiomyocytes işlev değişiklikleri ve yapısal değişiklikler kalp kas ve vanalar12,13.
Genel olarak, kullanılabilirlik ve hemodinamik çalışmalar için kullanılan hayvan modelleriyle geniş ve birçok özel ihtiyaçları için bir seçim sunar. Bu deneyler, çoğunlukla domuz, köpek, ovine, ya da daha küçük ayarları antikorundan ile modelleri, teslim ediliyor seçilmiş ve teklif beklenen insan bedensel tepkiler14iyi simülasyonu. Ayrıca, formları tek organ deneyleri daha sık15gelmektedir. Güvenilir bir şekilde HF Patofizyoloji taklit etmek için dolaşım yapay kötüleşti. Kalbe zarar çeşitli yöntemlerle kez iskemi, aritmi, basınç aşırı ya da ilaçların, Kardiyotoksik etkileri ile birisi-in bunlar model hemodinamik bozulma önde gelen neden olabilir. Kronik HF gerçek bir model oluşturmak için bütün organizmanın uzun vadeli adaptasyon geliştirmek için sağlanan zaman vardır. Böyle bir güvenilir ve istikrarlı model hızlı kardiyak pacing deneysel hayvan tarafından üretilen de taşikardi kaynaklı kardiyomiyopati (TIC) ile temsil edilir.
Yatkın hearts oyununda, sistolik disfonksiyon ve genişleme düşük kardiyak çıkışı ile uzun süreli sürekli tachyarrhythmias yol açabilir gösterilmiştir. TIC ilk olarak anılacaktır durumu 191316deneylerde 1962 yılından bu yana17, yaygın olarak kullanılan, açıklanan ve artık iyi tanınan bir hastalıktır. Onun kökenli aritmiler çeşitli yalan - Supraventriküler ve ventriküler taşikardi sistolik fonksiyonu, biventriküler dilatasyon ve klinik belirtileri progressive asit, edemas, uyuşukluk da dahil olmak üzere HF ilerici bozulmasına yol açabilir ve sonuçta kardiyak dekompansasyon terminal HF için önde gelen ve eğer tedavi değil, ölüm.
Dolaşım bastırma benzer etkileri yüksek oranda giriş tarafından hayvan modellerinde pacing kardiyak tespit edildi. 18, görülmemelidir farklılıklar mevcuttur bir domuz modelinde bir Atriyal veya Ventriküler kalp hızı 200 vuruş/dakika üzerinden son aşama HF TIC, özellikleri ile 3-5 hafta (ilerici faz) bir dönemde ikna etmek için güçlü olsa da 19. bu bulgular de dekompanse kardiyomiyopati ve vardır, önemlisi, ayrıca korunmuş (kronik faz)19,20,21,22, pacing bırakma sonra karşılık gelen 23.
LV değişikliklere dilate kardiyomiyopati24özelliklerini taklit gibi domuz, köpek veya ovine TIC modelleri art arda HF14, Patofizyoloji eğitim için hazırlanmıştır. Hemodinamik de açıklanan - artan ventrikül end-diastolik basınç, azalmış kalp çıkışı, artmış sistemik vasküler direnci ve her iki genişleme nelerdir. Buna ek olarak, duvar hipertrofisi sürekli olarak görülmektedir değil ve hatta duvar inceltme bazı araştırmacılar25,26tarafından tanımlanmıştır. Ventrikül boyutları ilerleme ile Regürjitasyon atriyoventriküler kapaklar üzerinde26geliştirir.
Bu yayında, biz tik tarafından uzun vadeli hızlı kardiyak pacing içinde domuz üretmek için bir protokol mevcut. Bu biomodel dekompanse dilate kardiyomiyopati, ilerici kronik HF düşük kardiyak çıkışı ile hemodinami ve uygulanan tedavinin etkilerini incelemek için güçlü anlamına gelir temsil eder.
Protokol
Bu deneysel protokol gözden geçirildi ve ilk Tıp Fakültesi Charles Üniversitesi, kurumsal hayvan uzman Komitesi tarafından onaylanmış ve Üniversitesi deneysel laboratuarda, fizyoloji bölümü ilk Fakültesi gerçekleştirildi Charles Üniversitesi Tıp Prag, Çek Cumhuriyeti, uygun olarak hareket No 246/1992 Coll., Hayvan Zulmüne karşı korunması. Tüm hayvanları tedavi ve bakım için rehber göre bakım ve kullanım laboratuvar hayvanlarının, 8 edition, 2011 Ulusal akademiler Press tarafından yayımlandı. Tüm yordamlar standart veteriner kurallarına göre gerçekleştirilen ve her çalışma bitiminde hayvan kurban edildi ve bir nekropsi uygulandı. Uygun anatomi nedeniyle sağlıklı beş ilâ dişi domuz (Sus scrofa domestica) melez yaş 6 ay bu deneyde dahil edildi. Onların ortalama vücut ağırlığı 66 ± 20 kg veri toplama gündü.
1. genel anestezi
- Oruç 1 gün sonra anestezi midazolam (0.3 mg/kg) ve gluteal bölge için ketamin hidroklorür (15-20 mg/kg) kas içi İdaresi tarafından başlatın.
- Periferik kanül intravenöz ilaç uygulamaları için marjinal kulak ven içine yerleştirin.
- Propofol (2 mg/kg) ve morfin (0.1 - 0.2 mg/kg) intravenöz boluses yönetmek.
- Hayvanlar bir yüz maskesi ve 6.5-7.5 mm çapında kelepçeli endotrakeal tüp ile önceden orotracheal entübasyon ile oksijen sağlamak.
- Toplam intravenöz anestezi propofol kombinasyonu tarafından devam (6-12 mg/kg/s), midazolam (0.1 - 0.2 mg/kg/s) ve morfin (0.1 - 0.2 mg/kg/s), ayarlama tek tek yanıt göre-doz spontan nefes, kornea refleksleri, bastırmak ve motorik yanıt. Hayvanın gözleri kuruluğu önlemek için merhem ile koruyun.
- Mekanik havalandırma bir kapalı çevrim otomatik cihaz tarafından hedef bitiş tidal CO2 / 38-42 mmHg ve yeterli hemoglobin doygunluk % 95-99 korumak için uyarlamalı destek havalandırma için ayarla çalışır. Tüm hayati fonksiyonları, özellikle kalp hızı ve vücut sıcaklığını izlemek.
- Hayvan bacakları yavaşça sırtüstü pozisyonda operasyon Masası için güvence tarafından iliştirin.
- Geniş spektrumlu antibiyotik - 1 g sülfadiyazin intravenöz kulak ven kanülü aracılığıyla yönetmek.
2. ventrikül kurşun implantasyon
- Cerrahi siteler bulun ve deri düzgün boyun kas yukarıda Şah (1 bölge ve hayvanın boynun arka tarafında (2 tek taraflı paravertebral bölgesinde bir jilet kullanarak tıraş.
- Ultrason vasküler sonda kullanarak, dış juguler ven görselleştirmek ve cilt üzerindeki konumu işaretleyin. De onun yaralanma önlemek için Şah damarı bulun.
- Povidone iyot kullanarak geniş cilt dezenfeksiyon işleminden sonra bir steril cerrahi örtüsü delikle işaretli Şah bölge üzerinde kapak.
- Kalp pili implantasyon için tüm gerekli araçları hazırlamak ve onları steril tutmak. Bu prosedür boyunca steril bir ortam sağlamak önemlidir.
- Deriyi yukarıda dış juguler ven paralel kesme, sığ bir subkutan cep değil daha fazla 10 mm derin yumuşak doku oluşturmak. Herhangi bir büyük gemilerin maruz bırakmayın.
- Ön şekillendirilmesi cep altından bir kılıf dış juguler standart Seldinger tekniği kullanarak ven, yerleştirin. İlk olarak, yumuşak uçlu embolisinin bir 12 G ponksiyon iğne yerleştirin ve 7-Fransızca plastik gözyaşı uzak uygulayıcıya kılıf ile bir DİLATÖR embolisinin tanıtmak.
- Floroskopik rehberliği altında 58 cm kurşunun ötesini bu kılıf pacing tanıtmak ve ucu sağ ventrikül doruk için pozisyon. O zaman, kılıf kaldırın ve onun sarmal vidalama ile etkin Miyokardiyum için elektrot ucunu bağlayacaktın.
- Pacing parametreleri - Ventriküler Elektrokardiyogram kurşun hissedilen sinyalini test ve empedans kararlı olmalıdır, pacing eşik 1 V bir genliği darbe süresi 0.4 ms ile aşağıda olmalı.
- Ön şekillendirilmesi Şah subkutan cep dibine birlikte her ikisi de iki örgülü absorbe olmayan dikiş iplik dikiş tarafından tamir ve kauçuk kılıfı pacing kurşun çekin. Önemlisi, hayvan gelecekteki olası büyüme dikkate alınarak yeterli uzunlukta hız ayarlama müşteri adayının eklenmelidir.
3. deri altı kurşun tünel
- Hayvan yan çevirin ve daha önce traş cilt bölge lateral omurgasına dezenfekte sonra steril cerrahi örtüsü ile bir delik ile kapak. Şah subkutan cep ve kurşun steril kalır emin olun.
- Cilt lateral omurgaya kesin ve derin, geniş, subkutan cep formu. Herhangi bir olası kanamayı durdurmak ve mat hazırlık kullanın.
- Steril bir infüzyon ayarla ve her iki uçlarından kesmek--dan yumuşak kauçuk uzatma tüpü al. Bir tünel oluşturma aracını kullanarak, doğrudan bir subkutan tünel Şah ve dorsal cilt altı cepler bu uzatma tüpü ile bağlanma preform.
- BE-1 halkayı çekerek ventrikül adayına tüp 's ücretsiz ucunu bağlayın ve tüp dorsally çekerek kurşun ön şekillendirilmesi tünelinden dorsal subkutan cebine çizin. İpek bir kravat ile güvenli bağlantı için yararlı olabilir.
- Tünel oluşturma aracı ve dorsal subkutan cebinden ventrikül kurşun maruz uzatma tüpü çıkarın.
4. kalp pili implantasyon
- İmplante edilebilir çift-odası kalp pili üniteyi "bölümünü bağlama Y ile" ayarlayın. "Y" bağlantı her iki kalp pili yakınsak bir bağlantı sağlar katıldı ve birbirine bağlı tek pacing için çıkış yol (Resim 1 ve Şekil 2). Bu ayarı daha sonra çok çeşitli frekansları pacing sağlayacaktır.
- Pacing kurşun bağlandıktan sonra kalp pili üstbilgi birim ve "Y" kurşun bağlantısı'nda tüm be-1 bağlantı vidaları sıkıştırın.
- Sistem derin sırt cebinde pacing tüm gizleme. Konforlu kalp pili birim karşılamak için yeterli alan ve herhangi bir gereksiz kurşun olması gerekir.
- Son hız ayarlama parametrelerini kontrol edin. Kardiyak Ventriküler pacing her iki kalp pili çıktılardan diğerine mümkün olduğundan emin olun.
- Povidone iyot ile Temizleme ve her ikisi de subkutan cepler kapatın. Kullanım absorbe fibröz doku katmanları ve cilt adaptasyon için absorbe olmayan Dikiş dikiş iplik örgülü.
5. ameliyat sonrası bakım
- Yeterli bilincinin tekrar yerine geleceğinden hayvan dikkatle gözlemlemek.
- Yaraları iyileşene kadar - bir geniş bir yelpaze damardan antibiyotik rejimi içinde devam sülfadiyazin 1 her 12 h. Yönet analjezikler uygun dozaj, Örneğin, morfin g 0.2 mg/kg her 6-12 h subkutan enjeksiyon tarafından 3 gündür. Gerekirse, yeterince acı önlemek için doz ayarlamaları yapın.
- Hayvan rahat, sakin tesis oda sıcaklığında yerleştirin. Su ve uygun beslenmesi ücretsiz erişim sağlar.
- Düzenli olarak temiz şifa korumak için steril önlük yaralarıyla elbise.
- Cerrahi işlem sonrası dinlenme sağlamak için en az 3 gün boyunca yerel kalp ritmi tarafından inhibe kalp pili tutun.
- Ne zaman tam olarak iyileşti, yaklaşık 10-14 gün sonra yordamı absorbe olmayan deri dikiş kaldırın.
6. hız ayarlama iletişim kuralı
- Pacing protokol bir yeterli dinlenme süresinden sonra başlayın. Başlangıçta, çift-odası kalp pili D00 moduna ayarlayarak 200 atım/dk, 100 atım/dk ve kullanılazlar (hızı aralığı bkz. Tablo 1tam olarak eşleşmesi için) 300 ms AV ertelemeyi ayarlama için tempolu ventrikül kalp hızı artırmak. Her iki çıkış tek kutuplu pacing seçin.
- Stepwise 220 atım/dk 1 hafta sonra ve 2 hafta (şekil 3) sonra 240 atım/dk tempolu kalp hızı artırmak. Hemodinamik tolere sürece bu frekansta pacing sürekli tutmak. HF çok hızlı ilerler, başka bir hafta sonra tekrar artırmadan önce tempolu kalp hızını azaltın.
- Kalp atışı, EKG ve kalp pili sorgulama günlük oskültasyon kalp hızı ve pil ömrü dahil olmak üzere parametreleri, pacing sabit doğrulamak için kullanın.
7. kalp yetmezliği indüksiyon ve izleme
- Hayvanın genel sağlık durumunu izlemek ve özel bir veteriner tarafından düzenli bakım emin olun. Yerel kalp ve solunum fiyatlar, periferik Nabız oksimetri ve azaltma değerlendirilmesi spontan fiziksel aktivite ya da iştah artması klinik gözlemler HF ilerleme hakkında bilgi sağlar.
- Kablosuz Transkutanöz kalp pili sorgulama avantajı kullanın ve mümkünse, sürekli ECG kayıt - sigara sürekli sık ventrikül tachycardias (VT) şiddetli HF ilerleme belirtisi vardır.
- Ekokardiyografik değerlendirme yapısal ve fonksiyonel kalp değişiklikleri ortaya çıkarmak için kullanın. Domuz anatomi ve kalp dilatasyon - tipik 4 odası görünümü için göre en uygun görüntü penceresinin bulmak için dikkat dönüştürücü sağdaki xiphoid hemen altında yer ve boyun veya sol omuz üzerine gelin için açı. Kısa eksenli görünümleri için interkostal windows kullanın. Ventrikül Ejeksiyon Fraksiyonu yerli kalp ritmi ve Atriyoventriküler kusma azaltılması bir kaç hafta sonra fark olmalıdır.
Not: Yüksek oranda Ventriküler pacing hoşgörünün görülmemelidir farklılıklar mevcut. Bu nedenle, sık sık izleme ve hız ayarlama iletişim kuralı tek tek adapte düzeltilmesi gereklidir.

Şekil 1: hız ayarlama birim şematik kalp. Çift-odası kalp pili (1), (2) convergently iletken bir "Y" şeklinde bağdaştırıcısı (3) bir tek pacing için birlikte her iki kalp pili çıkışlarını yol. Müşteri adayının ipucu RV boşluğu (4) apikal parçası haline sabitlenmiş. Bu ayar yüksek hız ayarlama Frekanslar geniş bir dizi sağlar. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2 : Kalp birimini pacing X-ışını(a)ve fotoğraf (1) çift-odası kalp pili (B), (2) bağdaştırıcısı "Y" şeklinde ve Ventriküler pacing yol (3). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| İstenen Saat | Set kalp pili oranı | Hızı aralığı hızı |
| atım/dk | atım/dk | MS |
| 200 | 100 | 300 |
| 220 | 110 | 270 |
| 240 | 120 | 250 |
| 250 | 125 | 240 |
Tablo 1: kalp pili parametreleri. Yüksek oranda kardiyak pacing implante içinde house değiştiren çift-odası kalp pili ünitesi ile izin vermek için tabloda istenen tempolu kalp hızı (İK) ve hızı aralığı değerleri eşleşen hızını gösterir. Kalp pilinin D00 çalışma modu istenen İK yarısı oranında için ayarlanmış olması gerekir ve AV gecikme için karşılık gelen hızı aralığı milisaniye cinsinden hızı ayarlayın.
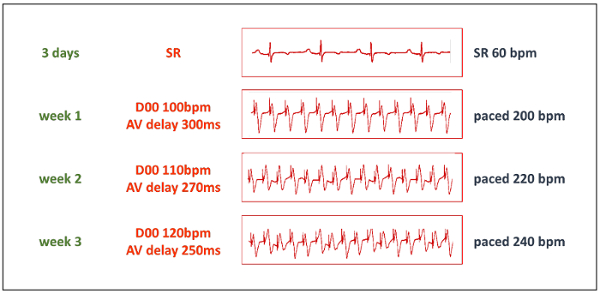
Şekil 3 : Protokolü pacing. TIC indüksiyon ilerici faz 3 gün istirahat bir süre sonra başlar. O zaman, kalp pili D00 moduna istenen tempolu frekans % 50'si pacing frekansta ile ayarla ve AV gecikme için eşleşen hızı aralığı hızı ayarlayın (bkz. Tablo 1). "Y" şeklinde adaptörü sayesinde, iki kalp pili çıkışlarını pacing götürecek bir tek yapılmaktadır. BPM vuruş/dakika =. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Sonuçlar
Modelini sınama: Sonra dekompanse kronik HF belirtileri önemli oldu, anestezi ve suni havalandırma yine yukarıda açıklanan ilkeler aşağıdaki yönetilen, ama dozaj nedeniyle düşük kardiyak ayarlandı27çıktı. Anestezi mümkün cardiodepressive etkileri nedeniyle dikkatli yoğun hayati fonksiyonları kontrol gereklidir.
Hayvan sırtüstü pozisyonda bağlıydı ve tüm invaziv...
Tartışmalar
Kronik HF morbidite ve mortalite için büyük ölçüde katkıda bulunan önemli bir sağlık sorunu var. Patogenez ve HF ilerlemesini insanlarda bu yüzden karmaşık, uygun bir hayvan modeli temel mekanizmaları araştırmaya ve yerel şiddetli hastalık ilerlemesi ile müdahale amacı roman therapeutics test etmek önemlidir. Onun patogenezi okumaya, büyük hayvan modeller deneysel test etmek için kullanılıyor.
Genel olarak, kronik HF cerrahi modelleri yakından bu hastalığı taklit....
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser Charles Üniversitesi araştırma hibe GA İngiltere'de No 538216 ve GA İngiltere'de No 1114213 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Medication | |||
| midazolam | Roche | Dormicum | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| propofol | B.Braun | Propofol | anesthetic |
| cefazolin | Medochemie | Azepo | antibiotic |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| povidone iodine | Egis Praha | Betadine | disinfection |
| morphine | Biotika Bohemia | Morphin 1% inj | analgetic |
| Tools | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| cauterizer | |||
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Prolene | Ethicon | 8433H | non-absorbable suture |
| Diagnostic devices | |||
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| Acuson P5-1 | Siemens Healthcare | echocardiographic probe | |
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| 3PSB, 4PSB and 6PSB | Transonic Systems | perivascular flow probes | |
| TS420 | Transonic Systems | perivascular flow module | |
| TruWave | Edwards Lifesciences | T001660A | fluid-filled pressure transducer |
| 7.0F VSL Pigtail | Transonic Systems | pressure sensor catheter | |
| INVOS 5100C Cerebral/Somatic Oximeter | Somanetics/Medtronic | near infrared spectroscopy | |
| CCO Combo Catheter | Edwards Lifesciences | 744F75 | Swan-Ganz pulmonary artery catheter |
| Vigillace II | Edwards Lifesciences | VIG2E | cardiac output monitor |
| 7.0F VSL Pigtail | Transonic Systems | pressure-volume catheter | |
| ADV500 | Transonic Systems | pressure-volume system | |
| LabChart and PowerLab | ADInstruments | data acquisition and analysis system | |
| Prism 6 | GraphPad | statistical analysis software | |
| Pacing devices | |||
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| Effecta DR | Biotronic | 371199 | dual-chamber pacemaker |
| Tendril STS | St. Jude Medical | 2088TC/58 | ventricular pacing lead |
| Lead permanent adapter | Osypka | Article 53422 | convergent "Y" connecting part |
| Lead permanent adapter | Osypka | Article 53904 | convergent "Y" connecting part |
| Tear-Away Introducer 7F | B.Braun | 5210593 | tear away introducer sheath |
| Split Cath Tunneler | medComp | AST-L | tunneling tool |
| infusion line | MPH Medical Devices | 2200045 | connecting line |
Referanslar
- Ostadal, P., et al. Direct comparison of percutaneous circulatory support systems in specific hemodynamic conditions in a porcine model. Circ Arrhythm Electrophysiol. 5 (6), 1202-1206 (2012).
- Ostadal, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow negatively affects left ventricular performance in a porcine model of cardiogenic shock. J Transl Med. 13, 266 (2015).
- Shen, I., et al. Left ventricular dysfunction during extracorporeal membrane oxygenation in a hypoxemic swine model. Ann Thorac Surg. 71 (3), 868-871 (2001).
- Hala, P., et al. Regional tissue oximetry reflects changes in arterial flow in porcine chronic heart failure treated with venoarterial extracorporeal membrane oxygenation. Physiol Res. 65 (Supplementum 5), S621-S631 (2016).
- Church, J. T., et al. Normothermic Ex-Vivo Heart Perfusion: Effects of Live Animal Blood and Plasma Cross-Circulation. ASAIO J. , (2017).
- Bavaria, J. E., et al. Changes in left ventricular systolic wall stress during biventricular circulatory assistance. Ann Thorac Surg. 45 (5), 526-532 (1988).
- Shen, I., et al. Effect of extracorporeal membrane oxygenation on left ventricular function of swine. Ann Thorac Surg. 71 (3), 862-867 (2001).
- Ostadal, P., et al. Novel porcine model of acute severe cardiogenic shock developed by upper-body hypoxia. Physiol Res. 65 (4), 711-715 (2016).
- Ostadal, P., et al. Noninvasive assessment of hemodynamic variables using near-infrared spectroscopy in patients experiencing cardiogenic shock and individuals undergoing venoarterial extracorporeal membrane oxygenation. J Crit Care. 29 (4), e611-e695 (2014).
- Mlcek, M., et al. Hemodynamic and metabolic parameters during prolonged cardiac arrest and reperfusion by extracorporeal circulation. Physiol Res. 61 (Suppl 2), S57-S65 (2012).
- Tarzia, V., et al. Extracorporeal life support in cardiogenic shock: Impact of acute versus chronic etiology on outcome. J Thorac Cardiovasc Surg. 150 (2), 333-340 (2015).
- Howard, R. J., Stopps, T. P., Moe, G. W., Gotlieb, A., Armstrong, P. W. Recovery from heart failure: structural and functional analysis in a canine model. Can J Physiol Pharmacol. 66 (12), 1505-1512 (1988).
- Moe, G. W., Armstrong, P. Pacing-induced heart failure: a model to study the mechanism of disease progression and novel therapy in heart failure. Cardiovasc Res. 42 (3), 591-599 (1999).
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Aust N Z J Med. 29 (3), 395-402 (1999).
- Trahanas, J. M., et al. Achieving 12 Hour Normothermic Ex Situ Heart Perfusion: An Experience of 40 Porcine Hearts. ASAIO J. 62 (4), 470-476 (2016).
- Gossage, A. M., Braxton Hicks, J. A. On auricular fibrillation. Quarterly Journal of Medicine. 6, 435-440 (1913).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20 (1), 39-40 (1962).
- Spinale, F. G., Grine, R. C., Tempel, G. E., Crawford, F. A., Zile, M. R. Alterations in the myocardial capillary vasculature accompany tachycardia-induced cardiomyopathy. Basic Res Cardiol. 87 (1), 65-79 (1992).
- Shinbane, J. S., et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 29 (4), 709-715 (1997).
- Moe, G. W., Stopps, T. P., Howard, R. J., Armstrong, P. W. Early recovery from heart failure: insights into the pathogenesis of experimental chronic pacing-induced heart failure. J Lab Clin Med. 112 (4), 426-432 (1988).
- Takagaki, M., et al. Induction and maintenance of an experimental model of severe cardiomyopathy with a novel protocol of rapid ventricular pacing. J Thorac Cardiovasc Surg. 123 (3), 544-549 (2002).
- Tomita, M., Spinale, F. G., Crawford, F. A., Zile, M. R. Changes in left ventricular volume, mass, and function during the development and regression of supraventricular tachycardia-induced cardiomyopathy. Disparity between recovery of systolic versus diastolic function. Circulation. 83 (2), 635-644 (1991).
- Schmitto, J. D., et al. Large animal models of chronic heart failure (CHF). J Surg Res. 166 (1), 131-137 (2011).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259 (1 Pt 2), H218-H229 (1990).
- Chow, E., Woodard, J. C., Farrar, D. J. Rapid ventricular pacing in pigs: an experimental model of congestive heart failure. Am J Physiol. 258 (5 Pt 2), H1603-H1605 (1990).
- Howard, R. J., Moe, G. W., Armstrong, P. W. Sequential echocardiographic-Doppler assessment of left ventricular remodelling and mitral regurgitation during evolving experimental heart failure. Cardiovasc Res. 25 (6), 468-474 (1991).
- Roberts, F., Freshwater-Turner, D. Pharmacokinetics and anaesthesia. Contin Educ Anaesth Crit Care Pain. 7 (1), 25-29 (2007).
- Carter, B. S., Farrell, C., Owen, C. Microsurgical clip obliteration of middle cerebral aneurysm using intraoperative flow assessment. J Vis Exp. (31), (2009).
- Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications. J Biomed Opt. 12 (6), 062104 (2007).
- Mateu Campos, M. L., et al. Techniques available for hemodynamic monitoring. Advantages and limitations. Med Intensiva. 36 (6), 434-444 (2012).
- Baan, J., et al. Continuous measurement of left ventricular volume in animals and humans by conductance catheter. Circulation. 70 (5), 812-823 (1984).
- Ellenbroek, G. H., et al. Primary Outcome Assessment in a Pig Model of Acute Myocardial Infarction. J Vis Exp. (116), (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. J Vis Exp. (111), (2016).
- van Hout, G. P., et al. Admittance-based pressure-volume loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiol Rep. 2 (4), e00287 (2014).
- Kass, D. A., et al. Comparative influence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 76 (6), 1422-1436 (1987).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Hendrick, D. A., Smith, A. C., Kratz, J. M., Crawford, F. A., Spinale, F. G. The pig as a model of tachycardia and dilated cardiomyopathy. Lab Anim Sci. 40 (5), 495-501 (1990).
- Wyler, F., et al. The Gottinger minipig as a laboratory animal. 5. Communication: cardiac output, its regional distribution and organ blood flow (author's transl). Res Exp Med (Berl). 175 (1), 31-36 (1979).
- Cruz, F. E., et al. Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol. 16 (3), 739-744 (1990).
- Umana, E., Solares, C. A., Alpert, M. A. Tachycardia-induced cardiomyopathy. Am J Med. 114 (1), 51-55 (2003).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circ Heart Fail. 2 (3), 262-271 (2009).
- Xanthos, T., et al. Baseline hemodynamics in anesthetized landrace-large white swine: reference values for research in cardiac arrest and cardiopulmonary resuscitation models. J Am Assoc Lab Anim Sci. 46 (5), 21-25 (2007).
- Little, W. C. Diastolic dysfunction beyond distensibility: adverse effects of ventricular dilatation. Circulation. 112 (19), 2888-2890 (2005).
- Montgomery, C., Hamilton, N., Ianuzzo, C. D. Effects of different rates of cardiac pacing on rat myocardial energy status. Mol Cell Biochem. 102 (2), 95-100 (1991).
- Qin, F., Shite, J., Mao, W., Liang, C. S. Selegiline attenuates cardiac oxidative stress and apoptosis in heart failure: association with improvement of cardiac function. Eur J Pharmacol. 461 (2-3), 149-158 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır