このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
豚の慢性心不全モデルとして頻拍誘発性心筋
要約
ここでは、豚の頻拍誘発型心筋症を生成するためのプロトコルを提案する.このモデルは、進行性の慢性心不全の血行動態や応用治療の効果を研究する強力な方法を表します。
要約
慢性心不全の安定性と信頼性の高いモデルは、血行動態を理解したり、新しい治療法の効果をテストする多くの実験に必要です。頻拍誘発型心筋症による、急速な心臓の豚でペーシングによって作り出すことができるようなモデルを紹介します。
単一のペーシング リードは右心室の頂点に、完全に麻酔の健康な豚に導入された transvenously を執着します。もう一方の端は、傍脊柱領域に、背側トンネリングされます。そこに、皮下ポケットに移植した社内の変更の心ペース メーカー単位に接続されています。
200-240 拍/分の速度で急速な心室ペーシングの 4-8 週間後診察には重症心不全 - 自然洞性頻脈、呼吸促迫、疲労の兆候が明らかにしました。心エコー検査と x 線は、心腔、体腔液、シストリック機能障害の拡張を示した。これらの所見は非代償性拡張型心筋症にも対応し、ペーシングの中止後も保持されます。
頻拍誘発型心筋症のこのモデルは、病態の進行性慢性心不全、特に血行動態変化による機械的循環サポートのような新しい治療法を研究するため使用できます。この方法は簡単に実行できます、結果は堅牢で再現。
概要
心不全 (心不全)、機械的循環サポートと膜型人工肺 (ecmo) 臨床の現場での特に成長している世界的な使用に対する新しい治療法の様々 な臨床実験で反映しています。血行動態の変化によって引き起こさ検査治療すなわち全身血圧1、心筋収縮力、圧力および心腔と心の仕事2,3, での体積変化にされている主な焦点全身動脈と末梢動脈に代謝補償4 - と共に地域組織彩度、肺の血流と血液ガス分析の動脈血流。他の研究は、循環サポート5、併用の炎症、または溶血の発生の長期的な影響されます。研究のすべてのこれらの種類には、うっ血性心不全の安定した biomodel が必要があります。
公開実験のほとんど左心室 (LV) 性能と機械的循環補助の血行動態は急性心不全2,6,7,8の実験モデルで行われています。,9,10、または完全にそのままの心にも。その一方で、臨床実習では、機械的循環サポートは、開発以前の敷地内現在慢性心疾患循環不全の状態では適用よくされています。このような状況に適応メカニズムを完全に開発し、「鋭さや慢性」によると観測結果の矛盾で重要な役割を果たすことの基になる心臓病11。したがって、安定した慢性心不全モデルは血行動態および病態生理学的メカニズムに新しい洞察力を提供できます。慢性心不全モデルの使用が乏しければ - 理由がありますが時間のかかる準備, 心臓のリズム、倫理的な質問、および死亡率 - の不安定性の利点に多くの長期の神経体液性活性化の存在を提供します。一般的な全身の適応、心筋細胞の機能変化と心臓の筋肉や弁12,13の構造変化。
一般に、可用性とさまざまな血行力学的研究に使用される動物モデルは広い、多くの特定のニーズに最適を提供しています。これらの実験は、主にブタ、イヌ、ヒツジ、または小さく設定マウス選択されており期待される人間の身体反応14の良いシミュレーション モデルであります。さらに、単一臓器の実験の形態はより頻繁に15になっています。確実に心不全の病態を模倣、循環は人為的に劣化します。心臓への障害可能性があります、さまざまな方法で多くの場合虚血、不整脈、圧負荷、または心毒性薬剤の効果によってとモデルの血行動態の悪化につながるの。慢性心不全の真のモデルを生成するには、時間は全体の生物の長期的な適応を開発するために提供されます。このような信頼性と安定したモデルは頻拍誘発型心筋症 (TIC)、急速な心臓の実験動物におけるペーシングによって作り出すことができるによってよく表されます。
それは、心の傾向の中で長期にわたる絶え間ない頻脈性不整脈は収縮機能障害と心拍出量の低下による拡張術につながることを示されています。チックは最初と呼ばれる条件 1913年16, 1962年17、以来広く実験でに記載されている、今よく知られている障害です。その起源は各種不整脈であることができる - 上室性と心室性頻脈の収縮機能、両心室の拡張、腹水、浮腫、無気力など HF の進歩的な臨床症状の悪化につながることができます。、と最終的に心臓の代償不全がターミナル心不全に至ると、治療しないと、死。
循環抑制の同様の効果は心臓ペーシング動物モデルで高率の導入によって観察されました。18,存在する個人差が豚モデルで 200 拍/分で心房または心室心拍、tic、特性を持つ 3-5 週間 (進歩的な段階) の期間の末期心不全を誘発するのには十分に強力な19ですこれらの所見に対応しても代償性心筋症とは、重要なのは、21,2220,(慢性期)19、、、をペーシングの中止後も保持。23。
ブタやイヌ、ヒツジのチック モデルは、LV への変更は、拡張型心筋症24の特性を模倣するよう繰り返し HF14の病態を検討する調製しました。血行動態の特性がよく述べ増加心室末期圧力、減らされた心臓出力、全身血管抵抗と両方の心室の肥大を増加しました。対照的に、壁の肥大が一貫して、観測されていないと一部研究者25,26によって記述されていたも減します。室寸法の進行とは、房室弁の逆流は26を開発しています。
この文書では、豚の長期的な高速心臓ペーシングによってチックを生成するプロトコルを提案します。この biomodel は、非代償性拡張型心筋症、低心拍出量と進行性慢性心不全の血行動態と応用治療の効果を研究するための強力な手段を表します。
プロトコル
この実験的なプロトコルに見直された最初医学部、カレル大学で機関の動物専門家委員会による承認し、大学実験室、生理学教室第一部で行われました。動物に対する虐待行為の保護に関する医学、チャールズ大学プラハ、チェコ共和国で、法律第 246/1992 年高専、に従って。すべての動物が扱われ、気遣われる心配のためのガイドに従い、国民アカデミーの出版物、によって 2011 年に公開された第 8 版は、実験動物の使用。すべてのプロシージャは、獣医の標準規則に従って行われたと各研究の完了時に動物が犠牲になったし、剖検では。まで雌豚 (Sus イノシシ イエバエ) を交雑 5 健康的な適切な解剖学のため生後 6 ヶ月は、この実験に含まれていた。彼らの平均体重のデータ コレクションの一日 66 ± 20 kg だった。
1. 全身麻酔
- 1 日断食、ミダゾラム 0.3 mg/kg の塩酸ケタミン (15-20 mg/kg)、臀部に筋肉内投与による麻酔を開始します。
- 静脈内の薬剤のアプリケーションの耳静脈に末梢のカニューレを挿入します。
- プロポ フォール (2 mg/kg) とモルヒネ (0.1 - 0.2 mg/kg) の静脈ボーラスを管理します。
- 顔のマスクと事前 6.5 7.5 mm の直径のカフ付き気管内チューブの気管挿管を介して酸素を動物を提供します。
- プロポ フォールの組み合わせによる全静脈麻酔を続ける (6-12 mg/kg/h)、ミダゾラム (0.1 - 0.2 mg/kg/h) とモルヒネ (0.1 - 0.2 mg/kg/h)、調整 - 個々 の応答によると用量角膜反射は、自発呼吸を抑制して運動応答。動物の目の乾燥を防ぐために軟膏を保護します。
- 閉ループ自動デバイス ・ ターゲット呼気 CO2 38 42 mmhg と十分なヘモグロビン飽和度 95-99% を維持する適応サポート換気セットで機械的人工換気を動作します。すべての重要な機能、特に心拍数と体温を監視します。
- 仰臥位で操作テーブルにそっと足を確保することにより、動物を取り付けます。
- 広いスペクトル抗生物質 - 耳静脈カニューレを通して静脈内セファゾリン 1 g を管理します。
2. 心室鉛注入
- 施術部位を見つけて正しく胸鎖乳突筋の上 (1) 頸領域と (2) 動物の首の背面側に一方的な傍脊柱領域にかみそりを使用して肌を剃る。
- 超音波血管プローブを使用して、外頚静脈を視覚化し、皮膚上の場所をマークします。その損傷を防ぐためにも頚動脈を探します。
- 広い皮膚消毒は、ポビドン ヨードを使用して後、穴と滅菌手術用ドレープ マーク頸静脈地域をカバーします。
- ペース メーカー植え込み術のすべての必要なツールを準備してそれらを滅菌。プロシージャ全体の無菌環境を維持するために重要です。
- 外頚静脈上平行切り傷、深さ 10 mm 以上、軟部組織の浅い皮下ポケットを形成します。すべての大型船が公開されません。
- 前もって形成されたポケットの底から標準セルジンガー法を用いた外頸静脈にシースを挿入します。まず、12 G 穿刺針から柔らかい先端ガイドワイヤーを挿入し、ガイドワイヤー上、散大と 7 フランス プラスチック涙離れてイントロデューサを導入します。
- 透視下このシースを介してリードをペーシング 58 cm を紹介し、その先端右の心室の頂点に位置します。鞘を削除し、そのらせんをねじ込むによって心筋に電極のアクティブな先端を凝視します。
- ペーシング パラメーター - 心室の心電図から鉛検出信号をテストしインピー ダンスが安定していなければならない、ペーシング閾値が振幅 1 V のパルス幅 0.4 ms 以下にする必要があります。
- ペーシング リードをゴムの袖を引いて、2 つの非吸収性縫合糸編組スレッド ステッチによって前もって形成された頸静脈皮下ポケットの下に一緒に両方を修正します。重要なは、動物の将来の可能な成長を考慮した、ペーシング リードの長さが十分を挿入する必要があります。
3. 皮下リード トンネル
- その側に動物を裏返し、バックボーン領域横以前剃毛肌を消毒し、孔を有する滅菌手術用覆布でカバーします。頸静脈皮下ポケットとリードに無菌のままであることを確認します。
- バックボーンに横方向の皮膚をカットし、深く、広々 とした、皮下ポケットを形成します。退屈な準備を使用し、任意の可能な出血を停止します。
- その両端を切りセット滅菌注入から柔らかいゴム製のエクス テンション チューブを取る。トンネルのツールを使用すると、頸と背の皮下ポケットを接続するこのエクス テンション チューブで直接皮下トンネルをプリフォームします。
- 1 コネクタ上に引っ張ることで心室リードにチューブのもう一方の端を接続し、背側チューブを引いて背の皮下ポケットに前もって形成されたトンネルを介してリードを描きます。シルク ネクタイとの接続をセキュリティで保護することができます。
- トンネルのツールと背の皮下ポケットから心室リードの公開延長チューブの両方を削除します。
4. ペース メーカー植え込み術
- 「Y」パーツを接続すると両室埋込型心臓ペース メーカー ユニットを設定します。"Y"接続により、両方のペース メーカーの収束接続に参加して単一のペーシングに一緒に接続する出力リード (図 1および図 2)。この設定は後でペーシング周波数の広い範囲を提供します。
- ペーシング リードを接続した後、ペース メーカー ヘッダー ユニット、"Y"のリード接続は 1 接続ネジがすべてを固定します。
- ペーシング システム深い背側のポケットに全体を非表示には。ペース メーカーのユニットを収容する十分なスペースと、冗長な鉛の必要があります。
- 最終的なペーシング パラメーターを確認します。心臓心室ペーシング ペース メーカーの両方の出力から可能であることを確認します。
- ポビドン ヨードでフラッシュして、両方の皮下ポケットを閉じる。使用吸収性の縫合線維組織層、皮膚の適応のための非吸収性縫合糸編組。
5. 術後のケア
- それは十分な意識を取り戻すまで、動物を慎重に観察します。
- 広いスペクトルの静脈内抗生物質療法で傷が癒されるを続行セファゾリン 1 g のすべての 12 h. 管理の鎮痛薬の適切な投与量、例えば、モルヒネ 0.2 mg/kg 皮下注射によって 3 日間のすべての 6-12 h。必要な場合は、十分に痛みを防ぐために用量調整を行います。
- 部屋の温度で快適で静かな施設で動物を配置します。水と適切な栄養に無料アクセスをできます。
- 癒しの清潔を維持するために定期的に滅菌スクラブと傷をドレスアップします。
- 手術後残りの部分を提供するために、少なくとも 3 日間ネイティブ心臓のリズムによって抑制されたペース メーカーを維持します。
- 完全に治癒、術後後約 10-14 日と非吸収性皮膚縫合を削除します。
6. ペーシングのプロトコル
- 十分な休息期間後ペーシングのプロトコルを開始します。当初、両室ペース メーカーを D00 モードに設定すると、200 拍/分、100 拍/分、および付随して 300 ms (間隔、ペースの表 1を参照してくださいにペースと一致) へ AV ディレイを調整するペースで心室心拍数を高めます。単極ペーシング両方の出力を選択します。
- 220 拍/分 1 週間後と 2 週間 (図 3) 後 240 拍/分のペースでの心拍数を高める段階的。連続循環動態容認されていない限り、この周波数でペースを維持します。HF が余りにすぐに進行する場合は、一週間後に再度増加する前にペースで心拍数を減らします。
- 心拍、心電図、ペース メーカー尋問毎日聴診を心拍数および電池の寿命などのパラメーターをペーシング定数を確認します。
7. 心不全誘導と監視
- 専門獣医師による定期的なケアを確保し、動物の一般的な健康状態を監視します。自発的な身体活動や食欲の増加するネイティブの心と呼吸速度、末梢パルス酸素濃度計、および削減の評価の臨床的観察は、心不全の進行に関する情報を提供します。
- 無線の経皮ペースメーカ尋問の利点を使用し、可能であれば、連続心電図記録 - 頻繁に非持続性心室頻拍 (VT)、重度の心不全の進行のサイン。
- 心エコー法による評価を使用して、心臓の構造と機能の変化を明らかにします。ブタの解剖学および心臓膨張 - 典型的な 4 室表示に従って最適な画像ウィンドウを見つけるに注意を払う、剣状の下右に探触子を配置し、角度の首や左肩をポイントします。短い軸ビュー、肋間 windows を使用します。ネイティブの心拍で房室 regurgitations 室駆出率の低減は、数週間後顕著なする必要があります。
注: 高速心室ペーシング トレランスの大きな個人差が存在します。したがって、頻繁に監視とペーシングのプロトコルの個別に適合させる調整が必要です。

図 1: 心臓ペーシング ユニット概略図。両室ペース メーカー (1)、(2) 実施 convergently"Y"字型アダプター単一ペーシングに一緒に両方のペース メーカーの出力 (3) を導きます。リードの先端は右心室キャビティ (4) の頂端部に釘付けになった。この設定は、高いペーシング周波数の広い範囲を提供します。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 心臓のペーシングのユニットX 線 (A)、両室ペース メーカー (1) の写真 (B)、"Y"形アダプター (2) と (3) 心室ペーシング リードします。この図の拡大版を表示するのにはここをクリックしてください。
| 必要な時間 | 設定ペース メーカー率 | 間隔のペースにペース |
| ビート/分 | ビート/分 | ms |
| 200 | 100 | 300 |
| 220 | 110 | 270 |
| 240 | 120 | 250 |
| 250 | 125 | 240 |
表 1: ペース メーカー パラメーター 。心臓ペーシングの社内変更デュアルチャンバーのぺース ユニット高率をできるように、テーブルは必要なペースで心拍数 (HR) とペース間隔の値に一致するペースを示します。ペース メーカーは必要な時間の半分のレートで D00 操作モードに設定する必要があります、AV ディレイは間隔 (ミリ秒) をペースに対応するペースに設定。
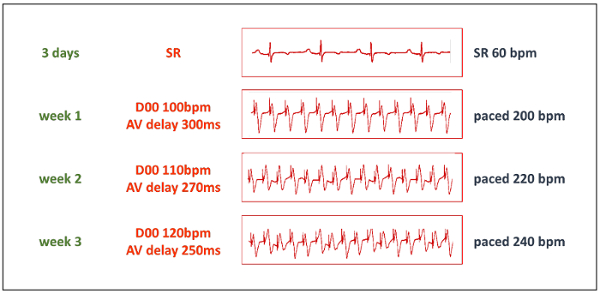
図 3: プロトコルをペーシングします。3 日間の休息期間後 TIC 誘導の進歩的な段階を開始します。ペース メーカーが必要なペースで周波数の 50% のペーシング周波数 D00 モードに設定し、AV 遅延間隔のペースに一致するペースを設定 (表 1 参照)。"Y"字型アダプターのおかげで両方のペース メーカーの出力を単一のペーシング リードを行っています。bpm のビート/分を =。この図の拡大版を表示するのにはここをクリックしてください。
結果
モデルをテスト:非代償性の慢性心不全の兆候が顕著になった後、麻酔・人工呼吸管理は再度、上記原則に従う投与された低心による調整された投与27を出力します。麻酔薬の影響で可能な cardiodepressive、重要な機能の集中的な注視が必要です。
動物は、仰臥位で接続されていた、すべての侵?...
ディスカッション
慢性心不全の罹患率と死亡率に大きく貢献する主要な健康問題であります。病態と人間の心不全の進行は、適切な動物モデルが基になっているメカニズム解明のため、ネイティブの深刻な病気の進行を妨害することを目指す治療をテストするのには重要なので、複雑です。その病因を研究するには、実験の大動物モデルを使用されています。
一般に、慢性心不全の外科?...
開示事項
著者が明らかに何もありません。
謝辞
この作品は、カレル大学研究助成金ジョージア州英国号 538216 とジョージア州英国号 1114213 によって支持されました。
資料
| Name | Company | Catalog Number | Comments |
| Medication | |||
| midazolam | Roche | Dormicum | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| propofol | B.Braun | Propofol | anesthetic |
| cefazolin | Medochemie | Azepo | antibiotic |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| povidone iodine | Egis Praha | Betadine | disinfection |
| morphine | Biotika Bohemia | Morphin 1% inj | analgetic |
| Tools | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| cauterizer | |||
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Prolene | Ethicon | 8433H | non-absorbable suture |
| Diagnostic devices | |||
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| Acuson P5-1 | Siemens Healthcare | echocardiographic probe | |
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| 3PSB, 4PSB and 6PSB | Transonic Systems | perivascular flow probes | |
| TS420 | Transonic Systems | perivascular flow module | |
| TruWave | Edwards Lifesciences | T001660A | fluid-filled pressure transducer |
| 7.0F VSL Pigtail | Transonic Systems | pressure sensor catheter | |
| INVOS 5100C Cerebral/Somatic Oximeter | Somanetics/Medtronic | near infrared spectroscopy | |
| CCO Combo Catheter | Edwards Lifesciences | 744F75 | Swan-Ganz pulmonary artery catheter |
| Vigillace II | Edwards Lifesciences | VIG2E | cardiac output monitor |
| 7.0F VSL Pigtail | Transonic Systems | pressure-volume catheter | |
| ADV500 | Transonic Systems | pressure-volume system | |
| LabChart and PowerLab | ADInstruments | data acquisition and analysis system | |
| Prism 6 | GraphPad | statistical analysis software | |
| Pacing devices | |||
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| Effecta DR | Biotronic | 371199 | dual-chamber pacemaker |
| Tendril STS | St. Jude Medical | 2088TC/58 | ventricular pacing lead |
| Lead permanent adapter | Osypka | Article 53422 | convergent "Y" connecting part |
| Lead permanent adapter | Osypka | Article 53904 | convergent "Y" connecting part |
| Tear-Away Introducer 7F | B.Braun | 5210593 | tear away introducer sheath |
| Split Cath Tunneler | medComp | AST-L | tunneling tool |
| infusion line | MPH Medical Devices | 2200045 | connecting line |
参考文献
- Ostadal, P., et al. Direct comparison of percutaneous circulatory support systems in specific hemodynamic conditions in a porcine model. Circ Arrhythm Electrophysiol. 5 (6), 1202-1206 (2012).
- Ostadal, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow negatively affects left ventricular performance in a porcine model of cardiogenic shock. J Transl Med. 13, 266 (2015).
- Shen, I., et al. Left ventricular dysfunction during extracorporeal membrane oxygenation in a hypoxemic swine model. Ann Thorac Surg. 71 (3), 868-871 (2001).
- Hala, P., et al. Regional tissue oximetry reflects changes in arterial flow in porcine chronic heart failure treated with venoarterial extracorporeal membrane oxygenation. Physiol Res. 65 (Supplementum 5), S621-S631 (2016).
- Church, J. T., et al. Normothermic Ex-Vivo Heart Perfusion: Effects of Live Animal Blood and Plasma Cross-Circulation. ASAIO J. , (2017).
- Bavaria, J. E., et al. Changes in left ventricular systolic wall stress during biventricular circulatory assistance. Ann Thorac Surg. 45 (5), 526-532 (1988).
- Shen, I., et al. Effect of extracorporeal membrane oxygenation on left ventricular function of swine. Ann Thorac Surg. 71 (3), 862-867 (2001).
- Ostadal, P., et al. Novel porcine model of acute severe cardiogenic shock developed by upper-body hypoxia. Physiol Res. 65 (4), 711-715 (2016).
- Ostadal, P., et al. Noninvasive assessment of hemodynamic variables using near-infrared spectroscopy in patients experiencing cardiogenic shock and individuals undergoing venoarterial extracorporeal membrane oxygenation. J Crit Care. 29 (4), e611-e695 (2014).
- Mlcek, M., et al. Hemodynamic and metabolic parameters during prolonged cardiac arrest and reperfusion by extracorporeal circulation. Physiol Res. 61 (Suppl 2), S57-S65 (2012).
- Tarzia, V., et al. Extracorporeal life support in cardiogenic shock: Impact of acute versus chronic etiology on outcome. J Thorac Cardiovasc Surg. 150 (2), 333-340 (2015).
- Howard, R. J., Stopps, T. P., Moe, G. W., Gotlieb, A., Armstrong, P. W. Recovery from heart failure: structural and functional analysis in a canine model. Can J Physiol Pharmacol. 66 (12), 1505-1512 (1988).
- Moe, G. W., Armstrong, P. Pacing-induced heart failure: a model to study the mechanism of disease progression and novel therapy in heart failure. Cardiovasc Res. 42 (3), 591-599 (1999).
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Aust N Z J Med. 29 (3), 395-402 (1999).
- Trahanas, J. M., et al. Achieving 12 Hour Normothermic Ex Situ Heart Perfusion: An Experience of 40 Porcine Hearts. ASAIO J. 62 (4), 470-476 (2016).
- Gossage, A. M., Braxton Hicks, J. A. On auricular fibrillation. Quarterly Journal of Medicine. 6, 435-440 (1913).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20 (1), 39-40 (1962).
- Spinale, F. G., Grine, R. C., Tempel, G. E., Crawford, F. A., Zile, M. R. Alterations in the myocardial capillary vasculature accompany tachycardia-induced cardiomyopathy. Basic Res Cardiol. 87 (1), 65-79 (1992).
- Shinbane, J. S., et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 29 (4), 709-715 (1997).
- Moe, G. W., Stopps, T. P., Howard, R. J., Armstrong, P. W. Early recovery from heart failure: insights into the pathogenesis of experimental chronic pacing-induced heart failure. J Lab Clin Med. 112 (4), 426-432 (1988).
- Takagaki, M., et al. Induction and maintenance of an experimental model of severe cardiomyopathy with a novel protocol of rapid ventricular pacing. J Thorac Cardiovasc Surg. 123 (3), 544-549 (2002).
- Tomita, M., Spinale, F. G., Crawford, F. A., Zile, M. R. Changes in left ventricular volume, mass, and function during the development and regression of supraventricular tachycardia-induced cardiomyopathy. Disparity between recovery of systolic versus diastolic function. Circulation. 83 (2), 635-644 (1991).
- Schmitto, J. D., et al. Large animal models of chronic heart failure (CHF). J Surg Res. 166 (1), 131-137 (2011).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259 (1 Pt 2), H218-H229 (1990).
- Chow, E., Woodard, J. C., Farrar, D. J. Rapid ventricular pacing in pigs: an experimental model of congestive heart failure. Am J Physiol. 258 (5 Pt 2), H1603-H1605 (1990).
- Howard, R. J., Moe, G. W., Armstrong, P. W. Sequential echocardiographic-Doppler assessment of left ventricular remodelling and mitral regurgitation during evolving experimental heart failure. Cardiovasc Res. 25 (6), 468-474 (1991).
- Roberts, F., Freshwater-Turner, D. Pharmacokinetics and anaesthesia. Contin Educ Anaesth Crit Care Pain. 7 (1), 25-29 (2007).
- Carter, B. S., Farrell, C., Owen, C. Microsurgical clip obliteration of middle cerebral aneurysm using intraoperative flow assessment. J Vis Exp. (31), (2009).
- Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications. J Biomed Opt. 12 (6), 062104 (2007).
- Mateu Campos, M. L., et al. Techniques available for hemodynamic monitoring. Advantages and limitations. Med Intensiva. 36 (6), 434-444 (2012).
- Baan, J., et al. Continuous measurement of left ventricular volume in animals and humans by conductance catheter. Circulation. 70 (5), 812-823 (1984).
- Ellenbroek, G. H., et al. Primary Outcome Assessment in a Pig Model of Acute Myocardial Infarction. J Vis Exp. (116), (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. J Vis Exp. (111), (2016).
- van Hout, G. P., et al. Admittance-based pressure-volume loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiol Rep. 2 (4), e00287 (2014).
- Kass, D. A., et al. Comparative influence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 76 (6), 1422-1436 (1987).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Hendrick, D. A., Smith, A. C., Kratz, J. M., Crawford, F. A., Spinale, F. G. The pig as a model of tachycardia and dilated cardiomyopathy. Lab Anim Sci. 40 (5), 495-501 (1990).
- Wyler, F., et al. The Gottinger minipig as a laboratory animal. 5. Communication: cardiac output, its regional distribution and organ blood flow (author's transl). Res Exp Med (Berl). 175 (1), 31-36 (1979).
- Cruz, F. E., et al. Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol. 16 (3), 739-744 (1990).
- Umana, E., Solares, C. A., Alpert, M. A. Tachycardia-induced cardiomyopathy. Am J Med. 114 (1), 51-55 (2003).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circ Heart Fail. 2 (3), 262-271 (2009).
- Xanthos, T., et al. Baseline hemodynamics in anesthetized landrace-large white swine: reference values for research in cardiac arrest and cardiopulmonary resuscitation models. J Am Assoc Lab Anim Sci. 46 (5), 21-25 (2007).
- Little, W. C. Diastolic dysfunction beyond distensibility: adverse effects of ventricular dilatation. Circulation. 112 (19), 2888-2890 (2005).
- Montgomery, C., Hamilton, N., Ianuzzo, C. D. Effects of different rates of cardiac pacing on rat myocardial energy status. Mol Cell Biochem. 102 (2), 95-100 (1991).
- Qin, F., Shite, J., Mao, W., Liang, C. S. Selegiline attenuates cardiac oxidative stress and apoptosis in heart failure: association with improvement of cardiac function. Eur J Pharmacol. 461 (2-3), 149-158 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved