A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التقاط الكمي المكانية للمخدرات في الآفات السل الرئوي بالليزر اللوني السائل ميكروديسيكشن الكتلي (LCM-LC/MS)
In This Article
Summary
هنا، يمكننا وصف بروتوكول باستخدام الليزر التقاط ميكروديسيكشن مقترنة بتحليل LC/MS مكانياً كمياً-توزيع المخدرات داخل حبيبية السل الرئوي. وقد النهج انطباق واسع لقياس تركيزات المخدرات داخل الأنسجة في التفاصيل المكانية العالية.
Abstract
السل لا يزال سببا رئيسيا للمراضة والوفيات في جميع أنحاء العالم. إدخال تحسينات على نظم المخدرات القائمة وتطوير علاجات جديدة مطلوبة على وجه الاستعجال. القدرة لأدوية السل محسوبة للوصول إلى وتعقيم البكتيريا المناطق سيئة vascularized نخرية (كاسيوم) للرئة حبيبية أمر حاسم لنجاح التدخل العلاجي. يجب أن تتضمن الأنظمة العلاجية الفعالة لذلك المخدرات مع خصائص اختراق كاسيوم مواتية. أساليب LC/MS الحالية لقياس مستويات المخدرات في الأنسجة البيولوجية حدت من قدرات التحليل المكاني، مما يجعل من الصعب على دقة تحديد تركيزات المخدرات المطلقة داخل مقصورات الأنسجة الصغيرة مثل تلك التي عثر عليها داخل نخرية حبيبية. وهنا يقدم بروتوكول الجمع بين الليزر التقاط ميكروديسيكشن (LCM) من مناطق أنسجة مرضية متميزة مع التقدير الكمي LC/MS. هذا الأسلوب يوفر الكمي المطلق للمخدرات داخل كاسيوم الحبيبي، المحيطة بالآفة الخلوية وأنسجة الرئة بعيدين، وعليه، يحدد بدقة ما إذا كان يجري تحقيق تركيزات جراثيم. بالإضافة إلى بحوث السل، قد الأسلوب العديد من التطبيقات المحتملة لحل مكانياً الكمي للمخدرات في الأنسجة المريضة.
Introduction
القدرة على حل مكانياً وقياس مستويات المخدرات شرط حاسم لتحديد ما إذا كانت الأدوية المضادة للسل التوصل إلى الفئات السكانية الفرعية الجرثومية ضمن الآفات الرئوية في تعقيم تركيزات1. أهمية خاصة هو تحديد انتشار المخدرات في صلب نخرية الآفة (تسمى كاسيوم)، التي عادة ما تحتوي على أكبر عدد من العصيات وقد يكون موجوداً سيئة للمخدرات نظراً لعدم وجود الأوعية الدموية.
الأساليب التقليدية لتقييم انتشار الآفة، التي تنطوي على تجانس الآفات الرئوية قصت متبوعاً بالاستخلاص بالمذيبات وتحليل الطيف الكتلي (LC/MS) اللوني السائل، وهي بالغة الحساسية والانتقائي للمخدرات من الفائدة. ومع ذلك، توفر هذه الأساليب سوء إدارة المعلومات المكانية، تقتصر على حجم النسيج المتجانس الأصلي. النهج التصوير الجماعي القائم على قياس الطيف الكتلي، مثل الليزر ساعد مصفوفة الامتزاز التأين (استخدام)2،3، الامتزاز اليكتروسبراي التأين (ديسي)4 أو5الاستخراج السطحي المحسن السائل، 6 توفر قدرات التصوير جداً حل مكانياً، ولكن التقدير الكمي المباشر يمكن أن تكون صعبة جداً أو مستحيلاً بسبب تأثيرات قمع أيون غير متجانسة واختلاف كفاءات استخراج أكثر من الخلية مختلف أو أنواع الأنسجة7. بالإضافة إلى ذلك، النهج التصوير الأنسجة MS الأكثر مباشرة أصلاً أقل حساسية من LC/MS بسبب عدم الفصل الكروماتوغرافي للأنواع المحلية المتنافسة للتأين وكفاءة الاستخلاص بالمذيبات أقل من المخدرات من الأنسجة.
طبق بشكل روتيني لعزل وتوصيف مناطق أنسجة متميزة لدراسات البروتين8،9 ليزر التقاط ميكروديسيكشن (LCM) جنبا إلى جنب مع تحليل LC/MS واستخدمت مؤخرا لتقدير حجم المخدرات في مداوي 10من الأنسجة الحيوانية. نقدم هنا بروتوكولا أمثل تطبيق LCM جنبا إلى جنب مع تحليل LC/MS (LCM-LC/MS) التحديد الكمي للأدوية المضادة للسل داخل مقصورات الحبيبي متميزة. يتركز في عملية ميكروديسيكشن القبض على الليزر، ليزر الأشعة فوق البنفسجية من خلال الهدف المجهر على قسم الأنسجة، الذي يقطع ويعزل منطقة الأنسجة المطلوبة باتباع مسار المعرفة من قبل المستخدم. لمساعدة الجاذبية LCM (التقنية المستخدمة لهذا البحث)، يتم تحميل المقطع الأنسجة إلى شريحة غشاء بوليمر رقيقة (الحيوانات الأليفة أو القلم) والأنسجة يتم التقاطها في غطاء أنبوب جمع يقع أسفل الشريحة. وتستخرج من الأنسجة قصت المخدرات كمياً باستخدام نهج LC/MS قياسية. ويتحدد مقدار الأنسجة المطلوبة التي سيتم جمعها في نهاية المطاف من تركيز المتوقعة من المخدرات موجودة في الأنسجة وحساسية الطريقة LC/MS. لمعظم التحليلات المتعلقة بالمخدرات مداوي على المستويات العلاجية وتحليلها باستخدام الرباعي ثلاثي روتينية مطياف كتلة، 3 مليون ميكرون2 (3 مم2) من الأنسجة مساحة كافية.
يصف هذا البروتوكول مجموعة قوية من التنميط المكاني والكمي الكامل يقدمها LCM-LC/MS، توفير تركيزات المخدرات المطلقة في جميع مقصورات حبيبية السل. قد أيضا تطبيق هذه التقنية لتحديد المخدرات التركيزات في الأنسجة المريضة مختلفة العديد من توفير معلومات اكتشاف وتطوير العقاقير الحيوية.
Protocol
أجريت جميع الدراسات الحيوانية وفقا للدليل لرعاية واستخدام الحيوانات المختبرية "معاهد الصحة الوطنية" بموافقة من "رعاية الحيوان المؤسسية" واستخدام اللجنة نييد (المعاهد الوطنية للصحة)، بيثيسدا، ماريلاند
1-الحيوانات التجارب وجمع الأنسجة
يصف هذا القسم من البروتوكول إجراءات الحيوان وجمع العينات تحت ظروف السلامة الأحيائية المستوى 3 (BSL3). ووصف بروتوكولات مفصلة متفطره الأيروسول العدوى الداخلي والمخدرات الإدارة البروتوكولات في الأرانب كانت سابقا11،12.
- يصيب الأرانب "البيضاء نيوزيلندا" (الذكور والإناث في سن 4-5 أشهر) مع السل م. HN878 باستخدام نظام أيروسول الآنف فقط، كما تم وصفه سابقا11.
- إدارة العقاقير المختارة (وإيثامبوتول في المثال المعروض هنا) عبر الطريق المفضل و euthanize الحيوانات في 2 و 6 و 24 ساعة بعد الإدارة. أولاً، تخدير الأرنب عن طريق الحقن العضلي من الكيتامين في 35 مغ/كغ وإكسيلازيني 5 مغ/كغ. الانتظار لمدة عشر دقائق وتأكيد أنيسثيتيزيشن السليم معسر الذيل ولمس العين برفق. إذا لم يكن هناك أي رد فعل، euthanize بالإدارة عن طريق الحقن الوريدي بينتوباربيتال والفينيتوئين (انظر الجدول للمواد) 1 مل/4.5 كجم في 2 مل سالين معقم.
ملاحظة: هذه تيميبوينتس الأمثل لتغطية الشخصية الحرائك الدوائية وإيثامبوتول وقد تحتاج إلى ضبط/الأمثل لدراسة العقاقير الأخرى. - استخدام الملقط، مقص أو مشرط، إزالة الرئتين من تجويف الصدر، ويرسخ خزعات الرئة تحتوي على كبيرة حبيبية نخرية جزءا لا يتجزأ من المحيطة بأنسجة الرئة بعيدين (كما تم وصفه سابقا3). تظهر نخرية حبيبية بيج في اللون، وعادة ما تبرز قليلاً من الرئة حمراء/وردي اللون المحيطة بها. لتسهيل كريوسيكتيونينج سهلة، ضمان أن خزعات لم أكبر من 2 × 1.5 × 1.5 سم.
- استخدام الملقط، ضع الخزعة على صينية كريومولد مسمى مسبقاً مع سطح القطع المطلوبة في اتصال مباشر مع القاعدة من علبة الورق. بعد تجميد، سيوفر هذا سطح مستو من التي سيتم خفض كريوسيكشنز.
- تجميد الخزعة في بخار النتروجين السائل. ملء حاوية الستايروفوم بعمق 2 بوصة مع النتروجين السائل ومكان رف أنبوب أسلاك معدنية. وينبغي أن تبرز الرف فوق سطح النتروجين السائل توفير سطح مستو التي توضع في علب الأنسجة. ضع الغطاء مرة أخرى على الحاوية الستايروفوم وترك الأنسجة لمدة 10 دقائق تجمد تماما.
- إزالة الصواني الأنسجة، لف بسرعة في فيلم الألومنيوم ومكان في فرادى المسمى resealable الأكياس البلاستيكية والختم. نقل إلى الثلاجة-80 درجة مئوية للتخزين.
ملاحظة: يتم تنفيذ الخطوات 1، 1، 1-6 في ظروف BSL3 (بما في ذلك جميع أعمال الحيوان والتعامل مع المصابين والأنسجة). غاما تشعيع خزعات الرئة في ميجارادس 3 لتمكين معالجة خارج الاحتواء BSL3. قد يتم تنفيذ ميكروديسيكشن التقاط الليزر على أنسجة معقمة داخل BLS3 مرفق إذا تمت الموافقة على بروتوكولات السلامة المعمول بها. ومع ذلك، يصف ما تبقى من هذا البروتوكول التجهيز النهائية في منشأة BSL-2.
2-الأنسجة تمزيقها
- تعيين كريوستات درجة حرارة القطع المطلوبة. نقل خزعة الرئة المشع أشعة غاما من مخزن-80 درجة مئوية إلى كريوستات وتترك لمدة 30 دقيقة حجته درجة حرارة الأنسجة. ملاحظة:-20 إلى-22 درجة مئوية الأمثل للسل الآفة خزعات.
- استخدام الملقط، إصلاح الخزعة لتشاك كريوستات باستخدام كمية صغيرة من قطع الأمثل درجة حرارة مادة لاصقة (OCT) التمسك بالقاعدة الأنسجة لتشاك. توجيه الأنسجة حيث يكون سطح مسطح (التي كانت على اتصال مع قاعدة كريومولد) على سطح مكشوف لعدة قطاعات. ضمان OCT لا تلوث على سطح النسيج، وهذا قد تتداخل مع تحليل الطيف الكتلي اللاحقة.
- قطع ثلاثة أقسام الأنسجة في 25 ميكرون سمك وجبل على الشرائح غشاء الحيوانات الأليفة. بلطف لمس الغشاء إلى قسم الأنسجة وإزالة. إذا تم تطبيق الكثير من الضغط، قد تمزق غشاء رقيق.
- تجنب المناولة المفرطة للشرائح قبل تصاعد كما سيؤدي هذا في غشاء الحيوانات الأليفة تصبح التصاق التهمة والفقراء من أقسام الأنسجة. ضمان أن تظل الشريحة الغشاء في درجة حرارة الغرفة لتمكين الالتصاق تزايد ذوبان الجليد وناجحة للأنسجة للغشاء.
- إزالة الشريحة من كريوستات والسماح إلى أيردري لمدة 3 دقائق. إذا لن يتم تنفيذ LCM-LC/MS/MS فورا، ختم الشريحة في حقيبة صغيرة يمكن إغلاقها بشرط محكم ونقلها إلى مخزن-80 درجة مئوية حتى المطلوبة للتشريح.
- قطع قسما المتاخمة لها في 10-12 ميكرومتر وذوبان الجليد-جبل على شريحة زجاج قياسية لتوضع وويوزين (H & E) تلطيخ ومرجع. ويمكن قطع مقاطع إضافية في هذا الوقت للبقع هيستوتشيميستري المرجوة الأخرى (مثل Ziehl-نيلسين لتصور بكتريا السل (MTB)).
3-ميكروديسيكشن
- إزالة حقيبة مختومة تحتوي على الشريحة من مخزن-80 درجة مئوية، والسماح للوصول إلى درجة حرارة الغرفة لمدة 5 دقائق.
ملاحظة: إذا كانت الشريحة الباردة يتعرض فورا لجو المختبرات، الأنسجة سوف تصبح مغلفة بالتكثيف، وقد تتعرض للخطر سلامة المكانية للمخدرات. - قم بتشغيل المجهر والليزر (ليزر يتطلب 5-10 دقائق الاحماء قبل البدء في قطع). تحميل أنابيب PCR مل 0.20 قبعة مسطحة في الحامل.
- إزالة الشريحة من الكيس وتأخذ صورة ضوئية لقسم الأنسجة في الحيوانات الأليفة الشريحة باستخدام ماسح ضوئي مسطح.
- ضع الشريحة في حامل الشريحة (الأنسجة الجانبية إلى الأسفل) وتعيين أنابيب جمع منفصل للمناطق ذات الاهتمام باستخدام البرمجيات مجهر الحبيبي محددة. عادة، هذه ستكون 'الرئة بعيدين،' 'الحبيبي الخلوية،' و 'كاسيوم' (مركز نخرية)، ولكن قد تختلف تبعاً لأمراض محددة للورم/الخزعة.
- التركيز على الأنسجة باستخدام 5 × الهدف المجهر. وينبغي أن توفر هذا التكبير نظرة عامة جيدة من الأنسجة التي تحتوي على كلا المجالين الحبيبي الخلوية ونخريه. في البرنامج تحديد أنبوب المعينة 'كاسيوم' لنقله إلى موضع تحت الأنسجة.
- أدخل المعلمات تشريح المطلوب. هي الإعدادات النموذجية لمقطع الرئة سميكة 25 ميكرومتر ليزر السلطة 30 وسرعة 15 الفتحة 35 (وحدات التعسفي). ومع ذلك، هذه سوف تختلف تبعاً لاستخدام مجهر واحتمال انخفاض الطاقة نظراً لسن الليزر.
- قم بتحديد أداة رسم الحرة '--'، واستخدام القلم الماوس أو لمس، مخطط المنطقة المرغوبة للتشريح. سيتم عرض المساحة السطحية للمنطقة في البرنامج. الحفاظ على مناطق مختارة تحت 500,000 ميكرومتر2 (0.5 مم2) لتسهيل تشريح أسهل. كرر التشريح حتى 3 مليون ميكرون2 (3 مم2) وقد جمعت في المجموع في غطاء الأنبوبة.
- في بعض الأحيان، قد تظل عالقة للأغشية المحيطة بها (على سبيل المثال بسبب جاذبية ثابتة) منطقة تشريح ولا تندرج ضمن سقف جمع. قم بإزالة هذه المناطق من مجموع المساحة السطحية تراكمية عن طريق تحديد وإزالة يدوياً داخل البرنامج.
- حدد الحد الأقصى ل 'الآفة الخلوية' وجمع 3 مليون ميكرون2 من الأنسجة باستخدام نفس العملية كما هو موضح في الخطوة 3، 7.
- حدد الحد الأقصى ل 'الرئة بعيدين' وجمع 3 مليون ميكرون2 من الأنسجة باستخدام نفس العملية كما هو موضح في الخطوة 3، 7. علما بأن أنسجة الرئة بعيدين يحتوي على العديد من القصيبات والمسافات السنخية. إيلاء اهتمام دقيق لاستبعاد هذه من مناطق محددة بالانسجة للتشريح.
- إزالة غطاء حامل وعناية unclip وختم وتسمية كل أنبوبة. حماية الأنسجة تشريح من المحيطة بالاضطرابات الجوية (مثل اعتبارا من انقطاع تدفق الهواء من فتح باب). تحليل الأنسجة تشريح فورا، أو تخزينها في-80 درجة مئوية وذوبان الجليد قبل تجهيز وتحليل لكمس.
4-استخراج وتحليل لكمس
- إعداد استخراج الحل من 1:1 الاسيتو الانيتريل/الميثانول الذي يتضمن المعايير الداخلية d-10 وإيثامبوتول. عند اختيار معايير داخلية، استخدام نموذج مسمى مستقرة من المخدرات أكثر (مثل التطريز المسمى الديوتريوم المستخدمة في هذه التظاهرة) مع التحول الشامل كافياً لتجنب النظائر المشعة عبر الحديث بين المخدرات أكثر ومعيار (عادة الحد ني دالتونس 4) .
ملاحظة: وضع المعايير في هوموجيناتي لكل نوع من أنواع الأنسجة الخاصة بكل منها صعب لأن هناك أنسجة سيطرة محدودة جداً لإنشاء معايير هوموجيناتي معها. كبديل لجعل المعايير من عينة هوموجيناتي ارتفعت، معياراً يمكن إنشاؤها بواسطة إضافة أنسجة فارغة ومجمع الاختبار معا واستخراج. حجم الأنسجة التحكم في هوموجيناتي الذي يتطابق مع حجم المستهدفة أقسام نسيج عينة الدراسة يقترن مباشرة بمبلغ الاختبار المجمع الذي سيكون حاضرا في تركيز معين. - حساب حجم الأنسجة المستهدفة على أساس المساحة السطحية وسمك قسم الأنسجة وتحديد عامل التخفيف اللازمة هوموجيناتي استخدام وحدة تخزين هوموجيناتي التي سوف تضاف إلى معيار وعينات مراقبة الجودة. الحسابات موضحة أدناه لمنطقة مستهدفة تشريح2 (3 مم2) ميكرومتر 3 مليون مع 25 ميكرون سمك وحجم 2 ميليلتر من هوموجيناتي.
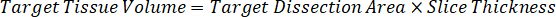
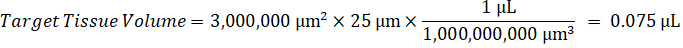
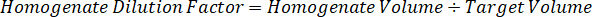

- افتراض كثافة أنسجة 1 غ/مل، إعداد المخزون هوموجيناتي التي تزن 50 مغ أنسجة التحكم وإضافة المخزن المؤقت لبرنامج تلفزيوني تمييع (باستخدام عامل إضعاف هوموجيناتي 26.67 المحسوبة في الخطوة 4، 2، مخفف مل 1.283). مجانسة بفوزه على أنسجة الرئة والمخزن المؤقت لبرنامج تلفزيوني لمدة 5 دقائق عند 1750 دورة في الدقيقة في الخالطون حبة حبة.
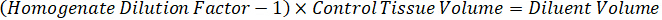
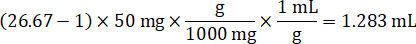
- تخفيف تركيز مخزونات المخدرات 1 ملغ/مل في المياه الاسيتو الانيتريل 1:1 لإنشاء المنحنى المعياري النتوءات الحلول. تحديد النتوءات التركيزات القياسية استناداً إلى حجم سبايك وحجم الأنسجة المستهدفة. المثال يتضح نانوغرام/مليلتر 100 قياسية باستخدام وحدة سبايك 10 ميليلتر.
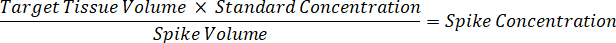
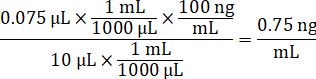
- إزالة الأنابيب التي تحتوي على الأنسجة ميكروديسيكتيد من مخزن-80 درجة مئوية، والسماح للوصول إلى درجة حرارة الغرفة لمدة 5 دقائق.
- إضافة 10 ميليلتر حل المياه الاسيتو الانيتريل 1:1 و 2 ميليلتر من المخزن المؤقت لبرنامج تلفزيوني للأنابيب التي تحتوي على الأنسجة ميكروديسيكتيد.
- للمنحنى المعياري وأنابيب مراقبة الجودة، إضافة 10 ميليلتر من التشويك حل 2 ميليلتر لعنصر التحكم هوموجيناتي الرئة.
- إضافة 50 ميليلتر من استخراج الحل لكل أنبوبة.
- دوامة كل أنبوب لمدة 5 دقائق، sonicate لمدة 5 دقائق والطرد المركزي عند 5000 دورة في الدقيقة لمدة 5 دقائق لتشكيل بيليه الفيلم والأنسجة في كل أنبوبة.
- نقل 50 ميليلتر من المادة طافية على صفيحة 96 بئر عميق وتمييع مع ميليلتر 50 إضافية من المياه في كل بئر.
- إجراء تحليل LC/MS/MS باستخدام معلمات الأداة الأمثل للمعايير الداخلية وإيثامبوتول ووايثامبوتول-d10 (كما تم وصفه سابقا بالتفصيل12).
- استخدم عامل تخفيف لتصحيح المبلغ الدقيق للأنسجة تشريح لكل عينة.
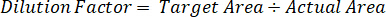
5-أسلوب التحقق من الصحة
- إنشاء هوموجيناتي في أنسجة الرئة التحكم عن طريق الجمع بين الرئة الجزء 1 و 2 أجزاء برنامج تلفزيوني الخرز الصلب 3-4. فاز أنسجة الرئة والمخزن المؤقت لبرنامج تلفزيوني لمدة 5 دقائق عند 1750 دورة في الدقيقة باستخدام الخالطون حبة.
- سبايك في هوموجيناتي بإضافة 10 ميليلتر من 1 ملغ/مل [دمس] وإيثامبوتول الأسهم إلى 990 هوموجيناتي ميليلتر لإنشاء بتركيز نهائي 10000 نانوغرام/مليلتر (10 ملغ/مل) ودوامه لمدة 1 دقيقة.
- إنشاء كتلة هوموجيناتي مجمدة التي تتدفق هوموجيناتي كريومولد والتجميد السريع على الثلج الجاف لمدة 5 دقائق.
- إعداد 25 ميكرومتر أبواب سميكة من كتلة هوموجيناتي كما هو موضح في الخطوات 2.1-2.5.
- تشريح منطقة الأنسجة المستهدفة كما هو محدد في الخطوات 3.2-3.10.
- إضافة 1:1 10 ميليلتر الاسيتو الانيتريل المياه و 2 ميليلتر من المخزن المؤقت لبرنامج تلفزيوني للأنابيب التي تحتوي على الأنسجة ميكروديسيكتيد.
- إضافة 50 ميليلتر من استخراج الحل لكل أنبوبة. اتبع الخطوات 4.9-4.12 لإنشاء منحنى قياسية وتحديد تركيز المخدرات في كتلة هوموجيناتي الأنسجة.
- حساب كفاءة الاستخراج باستخدام الصيغة التالية:
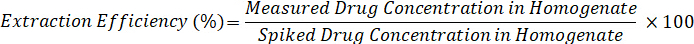
النتائج
ويرد في الشكل 1لمحة عامة عن النهج LCM-LC/MS. بعد تعقيم الأنسجة تشعيع جاما، اتخاذ جميع الخطوات اللاحقة (من الأنسجة تمزيقها فصاعدا) خارج ظروف BSL3. ويبين الشكل 2 الآفة المقاطع خزعة قبل وبعد عزل الأنسجة بواسطة LCM. يمكن تحديد مجالات السل آفات نخرية وال...
Discussion
مطلوب حلها مكانياً الكمي للمخدرات داخل الآفات السل الرئوي لتحديد ما إذا كان التعرض للمخدرات تصل إلى تركيزات تعقيم بكتيرية السكان المقيمين داخل المقصورات الآفة مختلفة. LCM-LC/MS الأسلوب الموصوفة هنا تمكن الكمي المطلق للأدوية المضادة للسل داخل جميع المقصورات الآفة، بما في ذلك كاسيوم الغنية ب?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر أوبراين بول، مني مارزيل وايزابيلا فريدمان للتجارب على الحيوانات، Jacquie غونزاليس وينر دانييل من المعاهد الوطنية للصحة/نييد للحصول على تعليمات غاما تشعيع الأنسجة الأرنب قبل الليزر التقاط ميكروديسيكشن وساراثي جانسى للمخطوطات الأفكار والمشورة. هذا العمل كانت مدعومة بتمويل من مشروع القانون، ومنح "وميليندا غيتس" (OPP1174780) والأجهزة المشتركة في المعاهد الوطنية للصحة 1S10OD018072. ونحن نشكر ايليسيو ألف يوجينين لتوفير الوصول إلى المجهر 6500 أمد إيكا وتبادل الخبرة والمشورة. شراء، والدعم المستمر، ومولت 6500 أمد منح "المعهد الوطني للصحة العقلية"، MH096625، والمعهد الوطني للاضطرابات العصبية والسكتة الدماغية، NS105584، فري التمويل (إلى E.A.E) ومساهمات GSK (إلى E.A.E).
Materials
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
References
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved