需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
激光捕获显微切割液相色谱质谱 (LCM-LC/MS) 对肺结核患者药物的空间量化
摘要
在这里, 我们描述了一个协议使用激光捕获显微切割结合 LC/MS 分析, 以空间量化的药物分布在肺结核肉芽肿。该方法具有广泛的适用性, 以量化在高空间细节组织内的药物浓度。
摘要
结核病仍然是全球发病率和死亡率的主要原因。迫切需要改进现有药物方案和开发新型疗法。在肺肉芽肿的低血管坏死区 (caseum) 中, 服用结核药物来达到和杀菌细菌的能力是治疗成功的关键。因此, 有效的治疗方案必须含有有利的 caseum 渗透特性的药物。目前用于量化生物组织中药物水平的 LC/MS 方法的空间分辨能力有限, 难以准确确定小组织内的绝对药物浓度, 如坏死性肉芽肿。在这里, 我们提出了一个协议结合激光捕获显微解剖 (LCM) 的病理不同的组织区域与 LC/MS 量化。这种技术提供绝对量化的药物在肉芽肿 caseum, 周围细胞病变和无关肺组织, 因此, 准确地确定是否有杀菌浓度正在实现。除了结核病的研究, 该技术还有许多潜在的应用, 在空间上解决的药物定量的疾病组织。
引言
空间分辨和量化药物水平的能力是确定抗结核药物是否在灭菌浓度的肺部病变中达到细菌亚群的关键要求1。特别重要的是确定药物渗入病变坏死的核心 (称为 caseum), 它通常含有最高的杆菌数量, 由于缺乏血管化, 药物可能无法进入。
传统的评估病灶穿透的方法, 包括肺切除病灶的均匀化, 其次是溶剂萃取和液相色谱质谱 (LC/MS) 分析, 是高度敏感和选择性的药物兴趣。然而, 这些方法提供的空间信息较差, 仅限于原始匀质组织的大小。基于质谱的成像方法, 如基质辅助激光解吸电离 (MALDI)2,3, 解吸电喷雾电离 (方案)4或液体增强表面萃取5, 6提供高度空间解析的成像能力, 但由于不同的细胞的异质离子抑制效应和分析方法的不同提取效率, 直接量化可能是极具挑战性或不可能的。或组织类型7。此外, 大多数直接组织 MS 成像方法本身的敏感性比 LC/MS, 由于缺乏色谱分离的内源物种竞争电离和较低的溶剂萃取效率的药物从组织。
激光捕获显微切割 (LCM) 结合 LC/MS 分析已被常规应用于分离和表征不同的组织区域的蛋白质组学研究8,9和最近用于药物量化的剂量动物组织10。在这里, 我们提出了一个优化的协议, 应用 lcm 结合 lc/ms (LCM-lc/ms) 分析, 以量化抗结核药物在不同的肉芽肿隔间。在激光捕获显微切割过程中, 紫外线激光通过显微镜目标聚焦到组织切片上, 通过遵循用户定义的路径切割和分离所需的组织区域。对于重力辅助 LCM (用于这项研究的技术), 组织部分安装在薄聚合物膜 (PET 或钢笔) 上, 组织被捕获在幻灯片下方的收集管帽中。这些药物从切除的组织中提取出来, 并使用标准的 LC/MS 方法进行量化。所需收集的组织数量最终取决于组织中药物的预期浓度和 LC/MS 方法的敏感性。对于大多数药物治疗水平的分析和分析使用常规三重四极质谱仪, 300万µm2 (3 毫米2) 的组织表面面积是足够的。
该协议描述了由 LCM-LC/MS 提供的空间轮廓和完全量化的强大组合, 在结核肉芽肿的所有隔间提供绝对药物浓度。该技术还可用于确定许多不同疾病组织的药物浓度, 提供重要的药物发现和发展信息。
研究方案
所有动物研究都是按照《国家卫生研究院动物护理和使用指南》的规定进行的, 并得到了 NIAID (NIH)、马里兰州的兽医学会和使用委员会的批准。
1. 动物实验和组织收集
《议定书》这一部分描述了生物安全等级 3 (BSL3) 条件下的动物程序和样本收集。在兔子的结核分枝杆菌气溶胶感染程序和药物管理协议的详细协议已经描述了以前的11,12。
- 使用仅鼻气溶胶系统, 如前所述的11, 感染新西兰白兔 (男性和女性在 4-5 月大) 与m. 结核HN878。
- 管理所选择的药物 (乙胺在这里提出的例子) 通过首选的路线和弄死动物在 2, 6 和 24 h 以下管理。首先, 用35毫克/千克和甲苯噻嗪的肌肉注射氯胺酮麻醉兔, 5 毫克/千克。等待十分钟, 并确认正确的麻醉通过捏尾巴和轻轻地触摸眼睛。如果没有反应, 弄死静脉注射戊巴比妥和苯妥英 (参见材料表), 在2毫升不育生理盐水1毫升/4.5 公斤。
注意: 这些 timepoints 是最佳的涵盖乙胺的药代动力学的轮廓, 可能需要调整/优化其他研究药物。 - 使用镊子、剪刀和/或手术刀, 从胸腔中取出肺部, 切除包含在周围无关肺组织内的巨大坏死肉芽肿的肺活检 (如前所述3)。坏死性肉芽肿的颜色呈米色, 通常从周围的红色/粉红色的肺部微微凸出。为了方便 cryosectioning, 确保活检不大于 2 x 1.5 x 1.5 厘米。
- 使用镊子, 将活检放置在预先标记的 cryomold 托盘上, 其所需的切割面与托盘底座直接接触。冷冻后, 这将提供一个平坦的表面, cryosections 将被削减。
- 在液氮蒸气中冷冻活检。将发泡胶容器装入2英寸深的液态氮气, 然后放置金属线管架。该机架应凸出在液氮表面上, 提供了放置组织托盘的平坦表面。将盖子放回发泡胶容器上, 并将纸巾留10分钟, 以完全冻结。
- 取出组织托盘, 快速包装铝膜, 并放置在单独标记密封塑料袋和印章。转移到-80 °c 冷藏库存放。
注意: 步骤 1.1-1.6 是在 BSL3 条件 (包括所有动物工作和处理感染的器官和组织) 执行。伽玛照射肺活检在 3 Megarads, 以使处理以外的 BSL3 遏制。如果已批准的安全协议到位, 可在 BLS3 设施内进行激光捕获显微切割生料组织。但是, 本协议的其余部分描述了 BSL-2 设施中的下游处理。
2. 组织切片
- 将恒温器设置为所需的切削温度。将伽玛辐照肺活检从-80 摄氏度贮存到恒温器, 离开30分钟平衡组织温度。注:-20 至-22 °c 是结核病病灶活检的最佳选择。
- 使用镊子, 修复活检恒温器恰克使用少量的最佳切削温度胶粘剂 (OCT) 坚持基地的组织到恰克。将组织定向, 使平面 (与 cryomold 的底部接触) 为切割的外露表面。确保 OCT 不会污染组织表面, 因为这可能会干扰随后的质谱分析。
- 切割三个组织切片在25µm 厚度和安装到 PET 膜幻灯片。轻轻地将膜接触到组织切片并取出。如果施加太多的压力, 薄膜可能会撕裂。
- 避免在安装前过度处理幻灯片, 因为这会导致 PET 膜被充电, 组织切片的粘附性较差。确保膜的滑动保持在室温下, 使组织的解冻和成功地附着在膜上。
- 从恒温器中取出幻灯片, 并允许风干3分钟。如果 LCM-LC/ms/ms 将不会立即执行, 密封在一个小密闭密封袋的幻灯片, 并转移到-80 °c 存储, 直到需要进行解剖。
- 在 10-12 µm 上切下相邻的部分, 在标准玻片上进行解冻, 用于苏木精和伊红 (H & E) 染色和参考。另外的部分可以被切开在这个时间为其他想要的组织化学污渍 (例如萋 Niellsen 为可视化结核分枝杆菌)。
3. 显微切割
- 从-80 °c 存储中取出包含该幻灯片的密封袋, 并允许达到室温5分钟。
注: 如果冷滑片立即暴露在实验室的气氛中, 组织将会被涂上凝结, 并且药物的空间完整性可能会受到损害。 - 打开显微镜和激光 (激光需要 5-10 分钟预热, 才能开始切割)。将扁帽0.20 毫升 PCR 管装入支架。
- 从袋子中取出幻灯片, 并使用平板扫描仪在 PET 滑块上的组织切片上取一个光学图像。
- 将幻灯片放到幻灯片持有者 (组织侧朝下), 并将不同的收集管分配给感兴趣的特定肉芽肿区域使用显微镜软件。通常, 这些将是 ' 无关肺, ' 细胞肉芽肿, ' 和 ' caseum ' (坏死中心), 但可能会因肉芽肿/活检的具体病理而异。
- 用5X 显微镜的目的聚焦于组织。这个放大倍数应该提供一个很好的概述, 包括细胞和坏死性肉芽肿地区的组织。在软件中选择管指定的 "caseum" 将其移动到组织下的位置。
- 输入所需的解剖参数。典型的设置为25µm 厚的肺部分是激光功率 30, 速度15和光圈 35 (任意单位)。然而, 这些将不同的视镜使用和潜在的下降功率由于激光的年龄。
- 选择 "自由绘制" 工具, 并使用鼠标或触摸屏笔, 勾勒出所需的区域进行解剖。该区域的表面积将显示在软件中。将选定区域保留在50万µm2 (0.5 毫米2) 之下, 以方便解剖。重复解剖直到300万µm2 (3 毫米2) 在管帽中总共收集到。
- 有时, 解剖区可能仍然粘在周围的膜 (例如由于静态吸引力), 而不是落入集合帽。通过在软件中手动选择和删除, 从累计曲面区域总计中移除这些区域。
- 使用步骤3.7 中概述的相同过程, 选择 "细胞病变" 的 cap 并收集300万µm2的组织。
- 选择 "无关肺" 的 cap, 并使用步骤3.7 中概述的相同过程收集300万µm2的组织。注意, 无关肺组织包含许多性细支气管和肺泡空间。仔细注意排除这些从定义的组织区域进行解剖。
- 取下瓶盖, 仔细松开, 密封并贴上每个管子的标签。保护被解剖的组织免受周围的空气干扰 (例如从打开的门的气流中断)。立即分析解剖组织, 或贮存在-80 摄氏度和解冻之前的加工和 LCMS 分析。
4. 提取和 LCMS 分析
- 制备含有乙胺 d-10 内部标准的1:1 乙腈/甲醇的萃取液。当选择一个内部标准, 使用一个稳定的标记形式的分析药物 (如在这个示范使用的氘标记的教统局) 与足够的质量转移, 以避免同位素交叉交谈的分析药物和标准 (通常至少4道尔顿).
注: 在每个组织类型的匀浆中创建标准是困难的, 因为有非常有限的控制组织, 以创建匀浆标准。作为一个替代的标准从一个尖锐的匀浆样品, 一个标准可以创造通过添加空白组织和测试化合物一起和提取。匀浆中的控制组织体积与研究样本组织切片的靶体积相匹配, 直接与一定浓度下存在的测试化合物的数量相结合。 - 根据组织切片的表面积和厚度计算靶组织体积, 并利用将添加到标准和 QC 样品中的匀浆量来确定匀浆的必要稀释因子。下面说明了300万µm2 (3 毫米2) 目标解剖区域的计算结果, 其中有25µm 厚度和2µL 匀浆量。
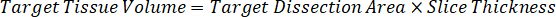
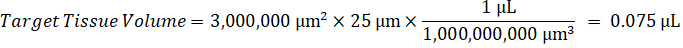
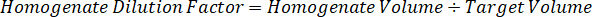

- 假设组织密度为1克/毫升, 通过称量50毫克的控制组织和添加 PBS 缓冲稀释 (使用步骤4.2 中计算的26.67 匀浆稀释因子, 稀释剂为1.283 毫升), 制备匀浆料。融汇由珠殴打肺组织和 PBS 缓冲5分钟在 1750 rpm 上的珠均质体。
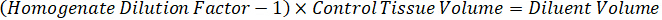
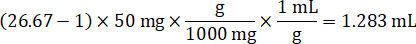
- 稀释1毫克/毫升药物储存浓度在1:1 乙腈/水, 以创建标准的曲线峰值解决方案。根据穗体积和靶组织体积确定峰值标准浓度。插图的例子是一个 100 ng/毫升标准使用10µL 穗量。
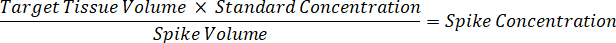
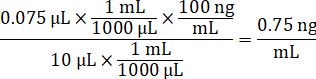
- 从-80 摄氏度的储藏中取出含有 microdissected 组织的管子, 使室温达到5分钟。
- 添加10µL 1:1 乙腈/水溶液和2µL 的 PBS 缓冲器的管含有 microdissected 组织。
- 对于标准曲线和质量控制管, 添加10µL 的峰值溶液到2µL 的控制肺匀浆。
- 在每管中添加50µL 的萃取液。
- 涡旋每管5分钟, 油脂实验5分钟, 离心机在 5000 RPM 5 分钟内形成一粒膜和组织在每管。
- 将50µL 的上清液转移到96井深井板上, 并在每个井中稀释外加50µL 的去离子水。
- 使用优化的乙胺和 Ethambutol-d10 内部标准的仪器参数执行 LC/ms/毫秒分析 (如前面详细介绍的12)。
- 使用稀释因子纠正每个样本的组织解剖的确切数量。
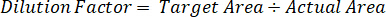
5. 方法验证
- 结合1份肺、2部 PBS 和 3-4 钢珠, 在控制肺组织中建立匀浆。用珠均质器在1750转每分钟打肺组织和 PBS 缓冲器5分。
- 将匀浆通过加入10µL 1 毫克/毫升乙胺亚砜股票成990µL 匀浆, 以创造最终浓度 1万 ng/毫升 (10 毫克/毫升) 和漩涡1分钟。
- 通过将匀浆倒入 cryomold, 并在干冰上快速冷冻5分钟, 创建一个冷冻匀浆块。
- 按照步骤 2.1-2.5 中的描述, 从匀浆块中准备25µm 厚的部分。
- 解剖在步骤 3.2-3.10 中指定的目标组织区域。
- 将10µL 1:1 乙腈/水和2µL 的 PBS 缓冲器添加到含有 microdissected 组织的管中。
- 在每管中添加50µL 的萃取液。按照步骤 4.9-4.12 创建一个标准曲线, 并确定在组织匀浆块中的药物浓度。
- 使用下面的公式计算提取效率:
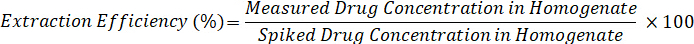
结果
LCM-LC/MS 方法的概述显示在图 1中。通过伽玛照射对组织进行消毒后, 所有后续步骤 (从组织切片开始) 都发生在 BSL3 条件之外。图 2显示了 LCM 组织隔离前后的病灶活检切片。坏死和细胞区结核病变可以很容易地识别和孤立的光学图像的视觉检查单独 (不需要提到组织学染色相邻的组织切片)。解剖过程产生一个干净的切口, 对周围?...
讨论
需要在空间上解决肺结核病变中的药物量化, 以确定药物暴露是否能达到对居住在不同病变隔间的细菌种群的杀菌浓度。这里所描述的 LCM-LC/MS 方法可以在所有病变舱室内绝对量化抗结核药物, 包括富含细菌的 caseum, 总共只使用 1-3 组织切片。传统的组织均匀化和 LC/MS 在组织中药物定量的方法往往缺乏空间特异性, 以解决特定的病变舱室, 甚至当它是可能的, 有很大的潜力交叉污染细胞和人工提取过?...
披露声明
作者没有什么可透露的。
致谢
我们感谢 Paul 奥布莱恩, Marizel 米娜和伊莎贝拉弗里德曼的动物实验, Jacquie 冈萨雷斯和丹妮尔从 NIH/NIAID 帮助与伽玛辐照兔组织之前, 激光捕获显微切割和 Jansy Sarathy 的手稿想法和建议。这项工作得到了比尔和梅琳达盖茨基金会 (OPP1174780) 和 NIH 共享仪器赠款1S10OD018072 的资助。我们感谢 Eliseo a Eugenin 提供了对莱卡 LMD 6500 显微镜的访问, 并分享了专门知识和建议。LMD 6500 的采购和持续支持由国家心理健康补助金研究所、MH096625、国家神经疾病和中风研究所、NS105584、PHRI 资助 (e.a. e) 和葛兰素 (e.a. e) 资助。
材料
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
参考文献
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。