Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пространственная количественного определения наркотиков в поражении туберкулезом легких лазером захватить Microdissection жидкость хроматографии масс-спектрометрия (LCM-LC/МС)
В этой статье
Резюме
Здесь мы описываем протокол, с помощью лазерного захвата microdissection наряду с анализом LC/MS поддается пространственно-дистрибутивов наркотиков в течение туберкулеза гранулемы. Этот подход имеет широкую применимость для количественного определения концентрации препарата в тканях при высоких пространственных деталей.
Аннотация
Туберкулез по-прежнему является основной причиной заболеваемости и смертности во всем мире. Срочно требуются усовершенствования существующих получающим и развитие Роман терапии. Способность дозированная Противотуберкулезных препаратов и стерилизовать бактерий в плохо васкуляризированной некротические регионов (caseum) легких гранулемы имеет решающее значение для успешного терапевтического вмешательства. Поэтому эффективные терапевтические схемы должны содержать наркотиков с благоприятным caseum проникновения свойствами. Текущий LC/MS методы для количественного определения уровень препарата в биологических тканях имеют ограниченные возможности пространственного разрешения, что делает его трудно точно определить абсолютное наркотиков концентрации в секциях малых ткани например, в рамках Некротические гранулемы. Здесь мы представляем протокол, сочетая лазерного захвата microdissection (LCM) регионов патологически различных тканей с квантификацией LC/MS. Этот метод обеспечивает абсолютную количественного определения наркотиков в пределах caseum гранулемы, окружающих клеточных поражений и посторонним легочной ткани и, таким образом, точно определяет, достигаются ли бактерицидные концентрации. Помимо исследования туберкулеза техника имеет множество потенциальных приложений для количественного определения пространственно решена наркотиков в пораженной ткани.
Введение
Способность пространственно решить и количественно оценить уровень препарата является важным требованием для определения, является ли противотуберкулезных препаратов достичь бактериальных субпопуляций в легких поражений в стерилизации концентрации1. Особое значение, является определение проникновение наркотиков в ядро некротические поражения (так называемый caseum), который обычно содержит наибольшее количество бацилл и могут быть плохо доступны наркотиков из-за отсутствия васкуляризации.
Традиционные методы оценки поражения проникновения, которые включают гомогенизации подакцизным легких повреждений следуют жидкостной экстракции и жидкостной хроматографии масс-спектрометрия (LC/МС) анализа, весьма чувствительны и селективного для препараты интерес. Однако эти методы предлагают бедных пространственной информации, ограничивается размер оригинального гомогенизированные ткани. Массы спектрометрии-подходы на основе изображений, например при содействии матрицы лазерной десорбции ионизации (MALDI)2,3, десорбции электроспрей ионизации (Дези)4 или жидкость повышенной поверхностной добычи5, 6 предлагают весьма пространственно решена изображений возможностей, но прямой количественной оценки может быть чрезвычайно сложным или невозможным из-за гетерогенных ионных подавления эффекты и различные эффективность извлечения аналита из различных ячейки или ткани типа7. Кроме того наиболее прямым ткани MS изображений подходы являются по своей природе менее чувствительны, чем LC/МС из-за отсутствия хроматографического разделения видов эндогенные, конкурирующих за ионизации и снижению эффективности жидкостной экстракции препарата из ткани.
Лазерная захвата microdissection (LCM) в сочетании с LC/MS анализ обычно применяется для изоляции и характеризуют собственный ткани регионов для протеомических исследований8,9 и недавно использовали для количественного определения наркотиков в дозированной 10животных тканей. Здесь мы представляем оптимизированный протокол, применяя LCM, в сочетании с анализом LC/мс (LCM-LC/МС) для количественного определения Противотуберкулезных препаратов в течение различных гранулемы отсеков. В процессе лазерной microdissection захвата УФ лазер направлена через микроскоп цель на разделе ткани, который режет и изолирует области желаемого ткани, следуя пути определяется пользователем. Для гравитации помощь LCM (техника, используемая для этого исследования), в разделе ткани монтируется на тонкой полимерной мембраны слайд (PET или пера) и ткани захватывается в коллекции трубка Крышка, расположенного ниже слайд. Препараты извлекаются из подакцизным ткани и количественно с помощью стандартных подходов LC/MS. Количество ткани, должны быть собраны в конечном итоге определяется от ожидаемой концентрации препарата в ткани и чувствительность метода LC/MS. Для большинства анализ наркотиков дозированной на терапевтических уровней и анализируются с помощью обычной тройной квадрупольным масс-спектрометром, 3 миллиона мкм2 (3 мм2) ткани площадь поверхности является достаточным.
Этот протокол описывает мощной комбинацией пространственного профилирования и полной количественной оценки предлагаемых LCM-LC/MS, обеспечивая абсолютную наркотиков концентрации в течение всех отсеков ТБ гранулемы. Техника может также применяться для определения концентрации наркотиков во многих различных больной тканях, предоставление жизненно наркотиков открытие и разработка информации.
протокол
Все исследования на животных были проведены в соответствии с руководством для ухода и использования лабораторных животных национальных институтов здравоохранения с одобрения от институциональный уход животных и использование Комитета NIAID (НИЗ), Бетесда, штат Мэриленд.
1. животных экспериментов и коллекции тканей
Этот раздел протокола описывает животных процедуры и проб в условиях биобезопасности уровня 3 (BSL3). Подробные протоколы микобактерии аэрозоля инфекции процедуры и наркотиками администрации протоколы в кролики были описаны ранее11,12.
- Заразить Новой Зеландии белый кролик (мужчин и женщин в 4-5 месяцев) с HN878 микобактерий туберкулеза с помощью носа только аэрозольные системы, как описано ранее11.
- Администрирование через предпочтительный маршрут выбранного препаратами (этамбутол в примере представлено здесь) и усыпить животных на 2, 6 и 24 ч после приема. Во-первых анестезировать кролика внутримышечно кетамина в 35 мг/кг и ксилазина на 5 мг/кг. Подождите 10 минут и подтвердить надлежащее анестезии, щипать хвост и осторожно касаясь глаза. Если нет никакой реакции, усыпить путем внутривенного введения Пентобарбитал и фенитоин (см. Таблицу материалы) в 1 мл/4,5 кг в 2 мл стерильного физиологического раствора.
Примечание: Эти timepoints являются оптимальными для покрытия фармакокинетические профиль этамбутол и могут потребовать корректировки/оптимизация для других исследование кала. - Используя щипцы, ножницы и/или скальпелем, удалить легкие из грудной полости, иссечения биопсии легких, содержащих большие некротические гранулемы, встроенных в окружающих посторонним легочной ткани (как описано ранее3). Появляться некротические гранулемы в бежевый цвет и обычно немного выступают из окружающих легких красный/розовый. Чтобы облегчить легко cryosectioning, убедитесь, что биопсия не больше, чем 2 х 1,5 х 1,5 см.
- С помощью щипцов, место биопсии на предварительно помечены cryomold поднос с желаемой режущей поверхности в непосредственном контакте с базой лотка. После замораживания, это обеспечит ровную поверхность, из которого будут сокращены cryosections.
- Заморозить биопсии в пара жидкого азота. Заполните контейнер из пенопласта на глубину 2 дюйма с жидким азотом и место металлической решетке трубки. Стойки должны выступать над поверхностью жидкого азота, обеспечивая ровную поверхность, на которой размещены лотки ткани. Установите крышку обратно на контейнере пенополистирола и оставить ткани за 10 минут, чтобы полностью заморозить.
- Удаление ткани лотки, быстро обернуть в фильме алюминия и место в отдельности помечены закрывающейся полиэтиленовых пакетов и печать. Переезд в морозильной камере-80 ° C для хранения.
Примечание: Шаги 1.1-1.6 выполняются в BSL3 условиях (включая все животные работы и обработки инфицированных органов и тканей). Гамма облучение биопсии легких на 3 Megarads, чтобы включить обработку вне BSL3 сдерживания. Лазерная захвата microdissection нестерилизованных ткани могут проводиться в течение BLS3, Фонд если утвержденных протоколов безопасности находятся в месте. Однако оставшаяся часть настоящего Протокола описывает обработке в объекте BSL-2.
2. ткань секционирование
- Установите криостата желаемого резки температуру. Передать криостата биопсии легких гамма облучению от-80 ° C для хранения и оставить на 30 минут, чтобы сбалансировать температуры тканей. Примечание: -20 до-22 ° C является оптимальным для ТБ поражения биопсии.
- С помощью пинцета, исправьте биопсии для криостата Чак, используя небольшое количество оптимального раскроя Температура клея (OCT) присоединиться база ткани для патрона. Ориент ткани, так что плоской поверхности (который был в контакте с базы cryomold) является подвергаются поверхности для резки. Убедитесь, что центр развертывания Office не загрязнять поверхность ткани, как это может помешать с анализа последующих масс-спектрометрии.
- Вырезать трех разделах ткани на 25 мкм толщина и смонтируйте на PET мембраны слайды. Нежно коснуться мембраны в разделе ткани и удалить. Если слишком много давления применяется, тонкая мембрана может порваться.
- Избегайте чрезмерной обработки слайдов до монтажа, как это приведет к PET мембраны, став заряженных и плохой адгезии разделах ткани. Убедитесь, что мембрана слайд хранится при комнатной температуре для включения оттепель монтаж и успешных адгезии ткани, мембраны.
- Удалить слайд из криостата и дать высохнуть в течение 3 минут. Если не будет немедленно выполнена LCM-LC/MS/MS, печать слайд в герметичном герметичные мешочек и передачи на хранение-80 ° C до тех пор, пока требуется для вскрытия.
- Вырежьте смежные секции на 10-12 мкм и оттепель гора на слайде стандартного стекла для гематоксилином и эозином (H & E) пятная и ссылки. Дополнительные разделы могут быть сокращены в настоящее время для других желаемых гистохимии пятна (например, Ziehl-Niellsen для визуализации микобактерии туберкулеза (MTB)).
3. Microdissection
- Удалить запечатанный пакет, содержащий слайд от-80 ° C для хранения и позволяют достичь комнатной температуры за 5 минут.
Примечание: Если холодной слайд немедленно подвергается воздействию атмосферы лаборатория, ткани будет осаждаться конденсации и пространственная целостность препарата может быть нарушена. - Включите микроскоп и лазер (лазер требует 5-10 минут разминки перед началом резки). Загрузить с плоским Кап 0.20 мл ПЦР пробирок в держатель.
- Удалить слайд из мешка и принимать оптический образ раздела ткани на PET слайд с помощью планшетного сканера.
- Поместите слайд слайд держатель (ткань лицевой стороной вниз) и назначить конкретные гранулемы регионы интереса, используя микроскоп программного обеспечения раздельного сбора трубок. Как правило, это будет «посторонним легких,» «сотовой гранулемы,» и «caseum» (Некротический центр), но может варьироваться в зависимости от конкретной патологии биопсии гранулемы.
- Сосредоточиться на ткани, используя 5 X микроскопом цели. Это увеличение должно обеспечивать хороший обзор ткани, содержащие обе области сотовой и некротические гранулемы. В программном обеспечении выберите места для «caseum» для перемещения его в положение под ткань трубки.
- Введите параметры желаемого рассечение. Типичные параметры для 25 µm толщиной легких секции являются мощность лазера 30, скорость 15 и диафрагмы 35 (условные единицы). Однако они будут отличаться, в зависимости от Микроскоп используется и потенциал снижения мощности из-за возраста лазера.
- Выберите инструмент «свободного рисования» и с помощью мыши или сенсорного пера, наметить нужного региона для рассечения. Площадь региона будет отображаться в программном обеспечении. Сохраните выбранные регионы под 500 000 мкм2 (0,5 мм2) для облегчения легче рассечение. Повторите рассечение 3 миллиона мкм2 (3 мм2) было собрано в общей сложности в крышку трубки.
- По случаю расчлененный региона могут застрять в окружающие мембраны (например, из-за статических притяжения) и не попадают в коллекции Кап. Удалите эти регионы из накопительного площадь всего, выбирая и удаление вручную в программное обеспечение.
- Установите крышку для «клеточных поражений» и собирать 3 миллиона мкм2 ткани, используя такой же процесс, как указано в шаге 3.7.
- Установите крышку для «посторонним легких» и собирать 3 миллиона мкм2 ткани, используя такой же процесс, как указано в шаге 3.7. Обратите внимание, что посторонним легочной ткани содержит много бронхиол и альвеол запрещено. Обратите особое внимание, чтобы исключить эти определенные ткани регионов для рассечения.
- Снимите колпачок держателя и тщательно unclip, уплотнение и маркировать каждую пробирку. Защитите расчлененных тканей от окружающего воздуха расстройства (например срыв потока воздуха от открытия двери). Анализировать расчлененных ткани немедленно, или хранить при температуре-80 ° C и оттепели до обработки и анализа LCMS.
4. Добыча и анализ LCMS
- Подготовьте экстракции раствор 1:1 Ацетонитрил/метанола, содержащие d-10 внутренний стандарт этамбутол. При выборе внутренний стандарт, использовать стабильную форму помечены исследуемое вещество препарата, (такие как дейтерий меченых наб используется в этой демонстрации) с достаточной массы сдвиг чтобы избежать изотоп крест говорить между аналита наркотиков и стандарт (обычно минимум 4 Дальтон) .
Примечание: Создание стандартов в огневки каждого типа соответствующих ткани трудно, потому что существует весьма ограниченный контроль ткани для создания стандартов огневки. В качестве альтернативы для принятия стандартов с шипами огневки образца стандарт могут быть созданы путем добавления пустой ткани и тест соединения вместе и экстрагирования. Объем контроля ткани в огневки, соответствующий целевой объем разделов исследования образца ткани объединяется непосредственно с количеством составные теста, которые будут присутствовать при данной концентрации. - Рассчитать объем целевых тканей, основанные на площадь и толщина ткани секции и определить необходимые разрежения фактор для огневки, используя объем огневки, которые будут добавлены к стандарту и КК образцов. Вычисления ниже для целевой расчлененный области 3 миллиона мкм2 (23 мм) с 25 мкм толщина и 2 мкл объем огневки.
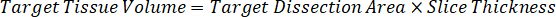
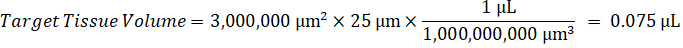
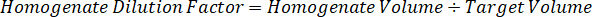

- Предполагая, плотность ткани 1 г/мл, подготовить запас огневки весом 50 мг управления ткани и добавляя PBS буфер для разбавления (с использованием коэффициента разрежения 26.67 огневки рассчитывается на шаге 4.2, растворитель – 1.283 мл). Однородный, бисера, победив легочной ткани и PBS буфер для 5 минут при 1750 об/мин на гомогенизатор шарик.
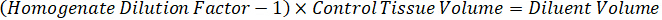
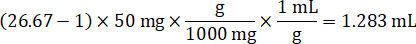
- Разбавьте 1 мг/мл концентрация наркотика запасов в 1:1 Ацетонитрил/воды для создания стандартной кривой пики решения. Определите, пики стандартной концентрации, основанные на Спайк тома и тома ткани. Иллюстрированный пример предназначен для 100 нг/мл, стандартное использование 10 мкл Спайк тома.
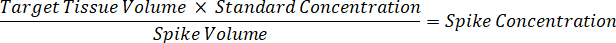
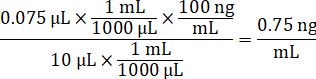
- Удаление пробирки, содержащие microdissected тканей от-80 ° C для хранения и позволяют достичь комнатной температуры за 5 минут.
- Добавьте 10 мкл раствора Ацетонитрил/водой 1:1 и 2 мкл буфера PBS в пробирки, содержащие microdissected ткани.
- Для стандартной кривой и контроля качества труб добавьте 10 мкл пики решение 2 мкл управления легких огневки.
- Добавьте 50 мкл раствора извлечения каждой трубы.
- Вихревой каждая трубка для 5 минут, sonicate на 5 минут и центрифуги при 5000 об/мин за 5 минут сформировать лепешки пленки и ткани в каждой тюбике.
- Передача 50 мкл супернатант 96-луночных штанхглубинных тарелку и разбавляют еще 50 мкл обессоленной воды в каждой скважине.
- Выполните анализ LC/MS/MS, с помощью оптимизированного инструмента параметров для этамбутола и этамбутол d10 внутренний стандарт (как описано в деталях12).
- Для исправления для точное количество ткани, расчлененный для каждого образца используйте коэффициент разрежения.
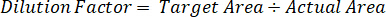
5. метод проверки
- Создайте огневки в ткани легкого управления, объединяя 1 часть легких, 2 частей PBS и 3-4 стальных шариков. Beat легочной ткани и PBS буфер для 5 минут при 1750 об/мин, с использованием гомогенизатора шарик.
- Спайк огневки, добавив 10 мкл 1 мг/мл ДМСО этамбутол складе в 990 мкл огневки для создания конечной концентрации 10000 нг/мл (10 мг/мл) и вихревые за 1 минуту.
- Создайте блок замороженные огневки, наливая огневки в cryomold и быстро замораживания на сухой лед на 5 минут.
- Подготовка 25 µm толщиной разделы из блока огневки, как описано в шагах 2.1-2.5.
- Вскрыть целевой области ткани как указано в шагах 3.2-3.10.
- Добавление 1:1 10 мкл Ацетонитрил/воды и 2 мкл буфера PBS в пробирки, содержащие microdissected ткани.
- Добавьте 50 мкл раствора извлечения каждой трубы. Выполните шаги 4.9 4.12 для создания стандартной кривой и определения концентрации препарата в блоке огневки ткани.
- Расчет эффективности извлечения с помощью формулы ниже:
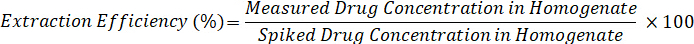
Результаты
На рисунке 1показан обзор подхода LCM-LC/MS. После стерилизации ткани по гамма облучения, все последующие шаги (от ткани секционирование начиная) занять место за пределами BSL3 условий. Рисунок 2 показывает поражения разделов биопсии до и посл...
Обсуждение
Количественная оценка пространственно решена наркотиков в легочного туберкулеза поражений требуется определить, достигает ли воздействия наркотиков для стерилизации концентрации бактериальных популяций, проживающих в различных поражения отсеков. LCM-LC/MS метод, описанный здесь позво...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим Paul O'Brien, Marizel Мина и Изабелла Фридман для экспериментов на животных, Jacquie Гонсалес и Danielle Вайнер из низ/NIAID за помощь с гамма облучение тканей кролик до лазерных захвата microdissection и Jansy Sarathy для рукописи мысли и советы. Эта работа была поддержана финансирование от Билла и Мелинды Гейтс (OPP1174780) и низ совместно инструментария Грант 1S10OD018072. Мы благодарим Eliseo а. Eugenin за предоставление доступа к микроскоп Leica ЛМД 6500 и обмен опытом и советы. Покупки и постоянной поддержки, ЛМД 6500 финансируется Национальный институт психического здоровья Грант, MH096625, Национальный институт неврологических нарушений и инсульта, NS105584, PHRI финансирования (E.A.E) и ГСК вклад (E.A.E).
Материалы
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
Ссылки
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены