É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Spatial quantificação de drogas em lesões de tuberculose pulmonar por Laser capturar Microdissection líquido cromatografia de espectrometria de massa (LCM-LC/MS)
Neste Artigo
Resumo
Aqui, descrevemos um protocolo usando laser captura microdissection juntamente com análise de LC/MS espacialmente-quantificar as distribuições de drogas dentro de granulomas de tuberculose pulmonar. A abordagem tem ampla aplicabilidade para quantificar as concentrações de droga dentro de tecidos em alto detalhe espacial.
Resumo
Tuberculose ainda é das principais causas de morbidade e mortalidade em todo o mundo. Melhorias aos regimes da droga existentes e o desenvolvimento de novas terapêuticas são urgentemente necessárias. A capacidade das drogas de TB dosadas para alcançar e esterilizar as bactérias dentro mal vascularizado necróticas regiões (caseum) de granulomas pulmonares é crucial para a intervenção terapêutica bem sucedida. Regimes terapêuticos eficazes, portanto, devem conter drogas com propriedades de penetração de caseum favorável. Métodos atuais de LC/MS para quantificação dos níveis da droga em tecidos biológicos têm limitado a capacidades de resolução espacial, tornando difícil determinar com precisão a concentrações de drogas absoluto dentro de compartimentos de tecido pequenas tais como aqueles encontrados dentro granulomas necróticos. Aqui nós apresentamos um protocolo combinando laser captura microdissection (LCM) das regiões de tecidos patologicamente distinta com quantificação de LC/MS. Esta técnica fornece quantificação absoluta de drogas dentro de granuloma caseum, envolvendo a lesão celular e tecido sem envolvimento pulmonar e, portanto, com precisão determina se as concentrações bactericidas estão a ser alcançadas. Para além da investigação da tuberculose, a técnica tem muitas aplicações potenciais para espacialmente resolvidos de quantificação de drogas em tecidos doentes.
Introdução
A capacidade de espacialmente resolver e quantificar os níveis de droga é um requisito fundamental para determinar se medicamentos anti-tuberculose alcançar subpopulações bacterianas dentro de lesões pulmonares em concentrações1de esterilização. De particular importância é determinar a penetração de drogas para o núcleo necrótico da lesão (chamado de caseum), que normalmente contém o maior número de bacilos e pode ser mal acessível às drogas devido à ausência de vascularização.
Métodos tradicionais para avaliar a penetração da lesão, que envolvem a homogeneização de lesões pulmonares extirpadas seguido por extração com solventes e análise de espectrometria de massas (LC/MS) cromatografia líquida, são altamente sensíveis e seletiva para as drogas de interesse. No entanto, estes métodos oferecem informação espacial pobre, limitada ao tamanho do original tecido homogeneizado. Espectrometria de massa-baseado imagem abordagens, tais como dessorção laser assistida por matriz (MALDI) de ionização2,3, desorção electrospray ionização (DESI)4 ou extração de superfície líquido-reforçada5, 6 oferecem recursos de imagem altamente espacialmente resolvidos, mas a quantificação directa pode ser extremamente desafiador ou impossível devido a efeitos de supressão de íon heterogêneos e diferentes eficiências de extração do analito da célula de várias ou7tipos de tecido. Além disso, abordagens de imagem mais diretas tecido MS são inerentemente menos sensíveis do que a LC/MS, devido à falta de separação cromatográfica de espécie endógena competindo por ionização e a baixa eficiência de extração com solvente da droga do tecido.
Do laser microdissection de captura (LCM) combinado com análise de LC/MS foi aplicado rotineiramente para isolar e caracterizar regiões distintas de tecido para proteômica estuda8,9 e recentemente utilizada para quantificação de drogas em uma dose tecido animal10. Aqui nós apresentamos um protocolo otimizado aplicando LCM combinado com análise de LC/MS (LCM-LC/MS) para quantificar a fármacos anti-TB dentro de compartimentos distintos granuloma. No processo do laser microdissection captura, um laser UV é focado com o objetivo de microscópio para a seção de tecido, que corta e isola a área de tecido desejado, seguindo um caminho definido pelo usuário. Para gravidade assistida LCM (a técnica utilizada para esta pesquisa), a seção de tecido é montada sobre um slide de membrana fina de polímero (PET ou caneta) e o tecido é capturado em um tampão de tubo coleção situado abaixo do slide. As drogas são extraídas do tecido excisado e quantificados utilizando abordagens padrão de LC/MS. A quantidade de tecido devem ser coletados em última análise, é determinada a concentração desejada do fármaco presente nos tecidos e a sensibilidade do método LC/MS. Para a maioria das análises de drogas dosado em níveis terapêuticos e analisados utilizando um espectrômetro de massa de rotina triplo quadrupolo, 3 milhões µm2 (3 mm2) de tecido, área de superfície é suficiente.
Este protocolo descreve a poderosa combinação de perfis espaciais e quantificação completa oferecido pela LCM-LC/MS, fornecendo a concentração absoluta de drogas dentro de todos os compartimentos de granulomas TB. A técnica também pode ser aplicada para determinar as concentrações de drogas em muitos diferentes tecidos doentes, fornecendo informações de descoberta e desenvolvimento de drogas vitais.
Protocolo
Todos os animais foram realizados estudos de acordo com o guia para o cuidado e o uso de animais de laboratório dos institutos nacionais de saúde, com aprovação do cuidado Animal institucional e Comissão de uso do NIAID (NIH), Bethesda, MD.
1. animais experimentos e coleta de tecido
Esta seção do protocolo descreve procedimentos de animais e coleta de amostra em condições de biossegurança nível 3 (BSL3). Protocolos detalhados da Mycobacterium tuberculosis aerossol infecção procedimento droga administração e protocolos em coelhos tem sido descrito anteriormente11,12.
- Infectar coelhos Nova Zelândia branco (masculinos e femininos em 4-5 meses de idade) com M. tuberculosis HN878 usando um sistema aerossol somente nariz, conforme descrito anteriormente11.
- Administrar as drogas escolhidas (etambutol no exemplo apresentado aqui) através da rota preferencial e eutanásia dos animais em 2, 6 e 24 h após a administração. Primeiro, anestesia o coelho por injeção intramuscular de cetamina em 35 mg/kg e xilazina 5 mg/kg. Espere dez minutos e confirme anesthetization adequada beliscar a cauda e tocando suavemente o olho. Se não há nenhuma reação, eutanásia por administração intravenosa de pentobarbital e fenitoína (ver Tabela de materiais) em 1 mL/4,5 kg em soro fisiológico estéril de 2 mL.
Nota: Esses momentos são ideais para cobrir o perfil farmacocinético para Ethambutol e podem exigir ajuste/otimização para outras drogas de estudo. - Usando a pinça, tesoura ou bisturi, remover os pulmões da cavidade torácica, ressecar biópsias pulmonares contendo grandes granulomas necróticos incorporados no tecido de pulmão não envolvido (conforme descrito anteriormente,3). Necróticos granulomas aparecem bege na cor e normalmente projetam-se ligeiramente do pulmão circundante cor vermelho/rosa. Para facilitar a fácil cryosectioning, certifique-se de que as biópsias são não maiores que 2 x 1,5 x 1,5 cm.
- Usando a pinça, coloque a biópsia em uma bandeja de cryomold pre-etiquetados com a superfície de corte desejado em contato direto com a base da bandeja. Após a congelação, isso proporcionará uma superfície plana do qual cryosections será cortado.
- Congele a biópsia em vapor de nitrogênio líquido. Encha um recipiente de isopor a uma profundidade de 2 polegadas com nitrogênio líquido e coloque uma cremalheira de fio do metal do tubo. O rack deve projetar-se acima da superfície do nitrogênio líquido proporcionando uma superfície plana sobre a qual são colocadas as bandejas de tecido. Coloque a tampa de volta no recipiente de isopor e deixar tecidos durante 10 minutos para congelar completamente.
- Remova as bandejas de tecido, rapidamente, embrulhe em película de alumínio e coloque em rotuladas individualmente selo e sacos plásticos resealable. Transfira para o congelador-80 ° C para armazenamento.
Nota: Etapas 1.1-1.6 são executadas em condições BSL3 (incluindo todo o trabalho animal e manipulação de tecidos e órgãos infectados). Gama irradiar as biópsias pulmonares em 3 megarad para habilitar o tratamento fora do confinamento do BSL3. Microdissection de captura do laser no tecido esterilizado pode ser realizado dentro do BLS3 facilidade se aprovados os protocolos de segurança estão em vigor. No entanto, o restante do presente protocolo descreve o processamento a jusante em uma facilidade BSL-2.
2. tecido de seccionamento
- Conjunto do criostato para a temperatura de corte desejada. Transferir a biópsia de pulmão gama irradiados de armazenamento-80 ° C para o criostato e deixar por 30 minutos para equilibrar a temperatura do tecido. Nota: -20 a-22 ° C é ideal para biópsias de lesão TB.
- Usando uma pinça, conserte a biópsia para o chuck criostato usando uma pequena quantidade de adesivo de temperatura de corte ideal (OCT) para aderir a base do tecido para o chuck. Posicione o tecido de modo que a superfície plana (que estava em contato com a base do cryomold) é a superfície exposta para o corte. Garantir a OCT não contamina a superfície do tecido, como isso pode interferir com a análise de espectrometria de massa subsequente.
- Três seções de tecido em 25 µm de espessura de corte e montagem no PET membrana slides. Suavemente, toque a membrana para a seção de tecido e remover. Se muita pressão é aplicada, a fina membrana pode rasgar.
- Evite o manuseio excessivo dos slides antes da montagem, pois isso resultará na membrana de PET, tornando-se carregada e pobre adesão das secções de tecido. Certifique-se de que o slide de membrana é mantido à temperatura ambiente para permitir a adesão de degelo-montagem e bem sucedida do tecido à membrana.
- Retirar a lâmina do criostato e deixe para secar por 3 minutos. Se LCM-LC/MS/MS não será executada imediatamente, sele o slide em um pequeno saco selável hermético e transferência para armazenamento-80 ° C até necessária para dissecação.
- Corte uma parte adjacente em 10-12 µm e degelo-mount em um slide de vidro padrão de hematoxilina e eosina (H & E) coloração e referência. Seções adicionais podem ser cortadas neste momento para outras manchas de histoquímica desejado (como o Ziehl-Niellsen para a visualização de Mycobacterium tuberculosis (MTB)).
3. Microdissection
- Retire o saco selado que contém o slide de armazenamento-80 ° C e deixe para atingir a temperatura por 5 minutos.
Nota: Se o frio slide imediatamente é exposto à atmosfera de laboratório, o tecido irá tornar-se revestido com condensação, e a integridade espacial da droga pode ser comprometida. - Ligue o microscópio e laser (laser requer 5-10 minutos de aquecimento antes de corte pode começar). Carregar tubos PCR 0,20 mL liso-cap para o titular.
- Retirar a lâmina do saco e levar uma imagem óptica da seção de tecido no slide PET usando um scanner de mesa.
- Coloque o slide no porta corrediça (lado do tecido voltada para baixo) e atribuir os tubos de coleta seletiva para regiões específicas granuloma de interesse usando o software de microscópio. Normalmente, estes serão 'sem envolvimento pulmonar,' 'granuloma celular', e 'caseum' (centro necrótico), mas pode variar dependendo da patologia específica da biópsia/granuloma.
- Focar o tecido usando o 5 X objetivo de microscópio. Essa ampliação deve fornecer uma boa visão do tecido que contém ambas as áreas de granuloma necrótico e celular. No software selecione o tubo designado 'caseum' para movê-lo para a posição sob o tecido.
- Digite os parâmetros desejados de dissecação. As configurações típicas para uma seção de pulmão grosso 25 µm são poder do laser 30, velocidade 15 e abertura 35 (unidades arbitrárias). No entanto, estas serão diferentes dependendo do microscópio usado e potencial declínio de poder devido à idade do laser.
- Selecione a ferramenta de 'desenho livre' e, usando caneta touchscreen ou um rato, contorne a região desejada para dissecação. A área de superfície da região será exibida no software. Regiões selecionadas sob 500.000 µm2 (0,5 mm2) para facilitar a dissecação mais fácil de manter. Repita a dissecação até 3 milhões µm2 (3 mm2) têm sido recolhidas no total na tampa do tubo.
- Na ocasião, a região dissecada pode permanecer presa à membrana circundante (por exemplo, devido a atração estática) e não cair a tampa de coleção. Remova estas regiões de cumulativa área de superfície total selecionando e removendo manualmente dentro do software.
- Selecione o boné para 'lesão celular' e coletar 3 milhões µm2 do tecido usando o mesmo processo, conforme descrito na etapa 3.7.
- Selecione o boné para 'sem envolvimento pulmonar' e coletar 3 milhões µm2 do tecido usando o mesmo processo, conforme descrito na etapa 3.7. Observe que o tecido pulmonar sem envolvimento contém muitos espaços alveolares e bronquíolos. Preste muita atenção para excluir estas provenientes das regiões de tecido definidos para dissecação.
- Retire o porta-tampa e cuidadosamente unclip, selar e etiquetar cada tubo. Protege os tecidos dissecados do entorno ar distúrbios (por exemplo, de interrupção de fluxo de ar de uma porta de abertura). Analisar os tecidos dissecados imediatamente, ou armazenar a-80 ° C e descongelar antes do processamento e análise LCMS.
4. extração e análise LCMS
- Prepare a solução de extração de 1:1 acetonitrilo/metanol contendo padrão interno d-10 de Etambutol. Ao selecionar um padrão interno, uso uma forma estável e rotulada da droga do analito (tais como deutério-rotulado EMB utilizado nesta demonstração) com deslocamento de massa suficiente para evitar o isótopo Cruz falar entre o analito drogas e padrão (geralmente um mínimo de 4 daltons) .
Nota: Criar padrões em homogeneizado de cada tipo de tecido respectivos é difícil porque não há tecido controle muito limitado com o qual deseja criar normas homogeneizado. Como alternativa à disponibilização de normas de uma amostra de homogenate cravado, um padrão pode ser criado pela adição de tecido em branco e composto de teste junto e extração. Um volume de tecido de controle em um homogenate que coincide com o volume de destino das secções de tecido de amostra de estudo é combinado diretamente com o aumento do teste de compostos que estaria presente em uma dada concentração. - Calcular o volume do tecido-alvo com base na área de superfície e espessura do tecido e determinar o factor de diluição necessária para o homogenate utilizando o volume de homogeneizado que será adicionado para o padrão e as amostras QC. Cálculos são ilustrados abaixo para uma área-alvo dissecado2 (3 mm2) µm 3 milhões com um 25 µm de espessura e 2 µ l volume de homogeneizado.
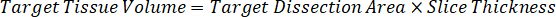
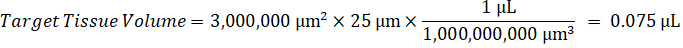
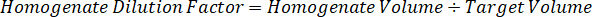

- Assumindo uma densidade de tecido de 1 g/mL, prepare o estoque de homogeneizado, 50 mg de tecido de controle de pesagem e adição de tampão PBS para diluir (usando o fator de diluição de 26,67 homogenate calculado na etapa 4.2, o diluente é 1,283 mL). Homogeneizar por grânulo batendo o tecido pulmonar e tampão PBS durante 5 minutos em 1750 rpm em um homogeneizador de grânulo.
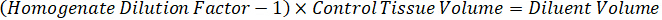
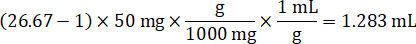
- Dilua a concentração de estoques de drogas 1 mg/mL em acetonitrila/água de 1:1 para criar a curva padrão de cravação soluções. Determine concentrações padrão baseadas sobre o volume de pico e o volume de tecido alvo de cravação. O exemplo ilustrado é para um 100 ng/mL padrão usando um volume de pico 10 µ l.
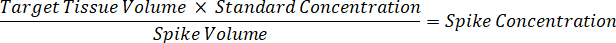
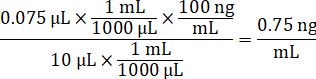
- Retirar os tubos contendo os tecidos microdissected de armazenamento-80 ° C e deixe para atingir a temperatura por 5 minutos.
- Adicione 10 µ l de solução de acetonitrila/água 1:1 e 2 µ l de tampão PBS para os tubos contendo tecido microdissected.
- Para a curva padrão e controle de qualidade de tubos, adicione 10 µ l da solução a 2 µ l de controlo pulmão homogenate de cravação.
- Adicione 50 µ l de solução de extração para cada tubo.
- Vórtice cada tubo por 5 minutos, proceda à sonicação por 5 minutos e centrifugar a 5000 RPM por 5 minutos para formar um pellet de filme e tecido em cada tubo.
- Transferir 50 µ l do sobrenadante para uma placa de 96 poços profundos poços e diluir com um adicional 50 µ l de água deionizada em cada poço.
- Realizar análise de LC/MS/MS usando parâmetros do instrumento otimizado para Ethambutol e etambutol-d10 padrão interno (conforme descrito em detalhe12).
- Use um fator de diluição para corrigir a quantidade exata de tecido dissecado para cada amostra.
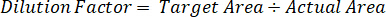
5. método validação
- Crie um homogenate no tecido pulmonar de controle através da combinação de esferas de aço de 3-4, 2 partes de PBS e 1 parte de pulmão. Bata o tecido pulmonar e tampão PBS durante 5 minutos em 1750 rpm usando um homogenizador do grânulo.
- Spike o homogenate adicionando 10 µ l de 1 mg/mL estoque Ethambutol DMSO em 990 homogenate µ l para criar uma concentração final de 10.000 ng/mL (10 mg/mL) e vortex durante 1 minuto.
- Crie um bloco congelado homogeneizado derramando o homogeneizado em um cryomold e congelando rapidamente em gelo seco por 5 minutos.
- Prepare 25 µm espessura seções do bloco homogeneizado como descrito nos passos 2.1-2.5.
- Disse a área de tecido alvo conforme especificado nas etapas 3.2-3.10.
- Adicione 10 µ l 1:1 acetonitrila/água e 2 µ l de tampão PBS para os tubos contendo tecido microdissected.
- Adicione 50 µ l de solução de extração para cada tubo. Siga os passos 4.9-4.12 para criar uma curva padrão e determinar a concentração de fármaco no bloco de homogeneizado de tecido.
- Calcule a eficiência de extração, usando a fórmula abaixo:
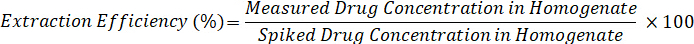
Resultados
Uma visão geral da abordagem LCM-LC/MS é mostrada na Figura 1. Após a esterilização o tecido por irradiação gama, todas as etapas subsequentes (a partir de tecido de corte em diante) ocorrem fora do BSL3 condições. A Figura 2 mostra a lesão seções biópsia antes e após o isolamento do tecido por LCM. Áreas necrosadas e celulares de lesões TB podem ser facilmente identificadas e isoladas por inspeção visual de ima...
Discussão
Espacialmente resolvidos de quantificação de drogas em lesões de TB pulmonares é necessária para determinar se a exposição da droga atinge esterilizantes concentrações de populações bacterianas que residem dentro dos compartimentos diferentes lesão. LCM-LC/MS método descrito aqui permite a quantificação absoluta de fármacos anti-TB dentro de todos os compartimentos de lesão, incluindo o caseum ricos em bactérias, usando apenas 1-3 seções de tecido no total. Homogeneização de tecidos tradicionais e a...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a Paul O'Brien, Marizel Mina e Isabella Freedman para experiências em animais, Jacquie Gonzalez e Danielle Weiner do NIH/NIAID para ajuda com irradiação gama de tecidos coelho antes do laser captura microdissection e Jansy Sarathy para manuscrito pensamentos e conselhos. Este trabalho foi financiado pelo financiamento do Bill e Melinda Gates Foundation (OPP1174780) e instrumentação de NIH compartilhado concedem 1S10OD018072. Agradecemos Eliseo A. Eugenin fornecendo acesso para microscópio Leica LMD 6500 e partilha de conhecimentos e conselhos. A compra e suporte contínuo, o LMD 6500 foi financiado por grant o Instituto Nacional de Saúde Mental, MH096625, o Instituto Nacional de Disorders Neurological e curso, NS105584, PHRI financiamento (E.A.E) e GSK contribuições (E.A.E).
Materiais
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
Referências
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados