È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Spaziali quantificazione delle droghe nelle lesioni di tubercolosi polmonare di Laser Capture Microdissection liquido cromatografia spettrometria di massa (LCM-LC/MS)
In questo articolo
Riepilogo
Qui, descriviamo un protocollo utilizzando laser capture microdissection accoppiato con analisi LC/MS spazialmente-quantificare distribuzioni di droga all'interno dei granulomi della tubercolosi polmonare. L'approccio ha ampia applicabilità a quantificare le concentrazioni di farmaco all'interno di tessuti ad alto dettaglio spaziale.
Abstract
La tubercolosi è ancora delle cause principali di morbilità e mortalità in tutto il mondo. Miglioramenti a terapie farmacologiche esistenti e lo sviluppo di approcci terapeutici sono urgentemente necessari. La capacità di dosata TB farmaci per raggiungere e sterilizzare i batteri all'interno di aree necrotiche scarsamente vascolarizzato (caseum) di granulomi polmonari è cruciale per un riuscito intervento terapeutico. I regimi terapeutici efficaci devono pertanto contenere farmaci con proprietà di penetrazione caseum favorevole. Attuali metodi di LC/MS per quantificare i livelli di farmaco nei tessuti biologici hanno limitato la capacità di risoluzione spaziale, rende difficile determinare con precisione le concentrazioni nella droga assoluta all'interno di piccoli compartimenti come quelle che si trovano all'interno granulomi necrotici. Qui presentiamo un protocollo che unisce la microdissezione laser (LCM) delle regioni di tessuto patologico distinti con quantificazione di LC/MS. Questa tecnica fornisce quantificazione assoluta di farmaci all'interno del granuloma caseum, che circonda la lesione cellulare e tessuto polmonare uninvolved e, pertanto, con precisione determina se le concentrazioni battericide sono stati raggiunti. Oltre alla ricerca di tubercolosi, la tecnica ha molte applicazioni potenziali per risolta spazialmente quantificazione delle droghe in tessuti malati.
Introduzione
La capacità di risolvere spazialmente e di quantificare i livelli della droga è un requisito essenziale per determinare se i farmaci antitubercolari raggiungono sottopopolazioni batteriche all'interno delle lesioni polmonari a sterilizzare le concentrazioni1. Di particolare importanza è determinante la penetrazione del farmaco nel nucleo necrotico della lesione (chiamato caseum), che in genere contiene il più alto numero di bacilli e può essere scarsamente accessibile ai farmaci a causa dell'assenza di vascolarizzazione.
Metodi tradizionali per valutare la penetrazione della lesione, che coinvolgono omogeneizzazione delle lesioni polmonari asportate seguita da estrazione con solvente e analisi di spettrometria di massa (LC/MS) cromatografia liquida, sono altamente sensibili e selettivi per i farmaci di interesse. Tuttavia, questi metodi offrono scarsa informazione spaziale, limitato alla dimensione del tessuto omogeneizzato originale. Approcci di imaging basati sulla spettrometria di massa, ad esempio matrix-assisted laser desorption ionization (MALDI)2,3, desorbimento electrospray ionizzazione (DESI)4 o estrazione liquido-aumentata della superficie5, 6 offrono funzionalità di imaging altamente spazialmente risolto, ma diretta quantificazione può essere estremamente difficile o impossibile a causa di effetti di soppressione di ioni eterogenee e diverse efficienze di estrazione dell'analita dalla cella vari o7tipi di tessuto. Inoltre, approcci di imaging tessuto MS più diretti sono intrinsecamente meno sensibili di LC/MS a causa della mancanza di separazione cromatografica delle specie endogene in competizione per la ionizzazione e l'efficienza di estrazione con solvente più bassa del farmaco dal tessuto.
Microdissezione laser (LCM) combinato con analisi LC/MS è stato ordinariamente applicato per isolare e caratterizzare regioni di tessuto distinti per studi di proteomica8,9 e recentemente utilizzato per la quantificazione di droga in dosato tessuto animale10. Qui presentiamo un protocollo ottimizzato l'applicazione LCM combinato con analisi LC/MS (LCM-LC/MS) per quantificare le droghe anti-TB nei raggruppamenti distinti granuloma. In lavorazione con il laser capture microdissection, un laser UV è focalizzato attraverso l'obiettivo del microscopio sulla sezione del tessuto, che taglia e che consenta di isolare l'area di tessuto desiderato seguendo un percorso definito dall'utente. Per gravità assistita LCM (la tecnica usata per questa ricerca), la sezione di tessuto è montata su un vetrino di membrana sottile polimero (PET o PEN) e il tessuto viene catturato in un cappuccio del tubo di raccolta situato sotto la diapositiva. I farmaci vengono estratti dal tessuto asportato e quantificati tramite approcci standard LC/MS. La quantità di tessuto devono essere raccolti in definitiva è determinata dalla concentrazione prevista della droga presente nel tessuto e la sensibilità del metodo LC/MS. Per la maggior parte delle analisi delle droghe dosato a livelli terapeutici e analizzati usando uno spettrometro di massa di routine triplo quadrupolo, 3 milioni µm2 (3 mm2) del tessuto superficie è sufficiente.
Questo protocollo descrive la potente combinazione di analisi spaziale e quantificazione completo offerto da LCM-LC/MS, fornendo concentrazioni nella droga assoluta all'interno di tutti i comparti dei granulomi di TB. La tecnica può essere applicata anche per determinare le concentrazioni di farmaco in molti diversi tessuti malati, fornendo informazioni di scoperta e sviluppo della droga vitale.
Protocollo
Tutti gli studi sugli animali sono stati effettuati in conformità con la guida per la cura e l'uso di animali da laboratorio del National Institutes of Health, con l'approvazione del istituzionale Animal Care e uso Comitato dei NIAID (NIH), Bethesda, MD.
1. animali esperimenti e tessuto collezione
Questa sezione del protocollo descrive procedure animale e raccolta di campioni in condizioni di biosicurezza di livello 3 (BSL3). Protocolli dettagliati della tubercolosi del micobatterio aerosol infezione procedura gestione della droga e protocolli nei conigli sono stati descritti precedentemente11,12.
- Infettare i conigli bianchi della Nuova Zelanda (maschi e femminile a 4-5 mesi di età) con M. tuberculosis HN878 utilizza un sistema di aerosol solo naso, come descritto in precedenza11.
- Amministrare le droghe selezionate (Etambutolo nell'esempio presentato qui) tramite l'itinerario preferito ed eutanasia degli animali a 2, 6 e 24 h dopo la somministrazione. In primo luogo, anestetizzare il coniglio mediante iniezione intramuscolare di ketamina a 35mg/kg e xilazina a 5 mg/kg. Attendere dieci minuti e confermare il corretto amputate pizzicando la coda e toccando delicatamente l'occhio. Se non c'è nessuna reazione, eutanasia di somministrazione endovenosa di pentobarbital e fenitoina (Vedi Tabella materiali) a 1 mL/4,5 kg in soluzione salina sterile mL 2.
Nota: Questi punti temporali sono ottimali a coprire il profilo farmacocinetico di etambutolo e possono richiedere la regolazione/ottimizzazione per altri farmaci di studio. - Utilizzando pinze, forbici o bisturi, rimuovere i polmoni dalla cavità toracica, resecare le biopsie del polmone che contiene grandi granulomi necrotici incorporati nel tessuto polmonare uninvolved (come descritto in precedenza3) circostante. Necrotici granulomi appaiono beige in colore e in genere sporgono leggermente dal polmone circostante di colore rosso/rosa. Per facilitare la facile cryosectioning, garantire che le biopsie sono non più grande di 2 x 1,5 x 1,5 cm.
- Mediante pinze, inserire la biopsia su un vassoio cryomold pre-etichettata con la superficie di taglio desiderata a diretto contatto con la base del vassoio. Dopo il congelamento, ciò fornirà una superficie piana da cui cryosections sarà tagliato.
- Congelare la biopsia in vapore di azoto liquido. Riempire un contenitore di polistirolo ad una profondità di 2 pollici con azoto liquido e una cremagliera del tubo di filo metallico. Il rack deve sporgere sopra la superficie dell'azoto liquido che fornisce una superficie piana su cui vengono posizionati i vassoi di tessuto. Riposizionare il coperchio sul contenitore di polistirolo e lasciare tessuti per 10 minuti per congelare completamente.
- Rimuovere i vassoi di tessuto, rapidamente avvolgere nella pellicola di alluminio e posizionare nel individualmente etichettati come guarnizione e sacchetti di plastica richiudibili. Trasferimento a-80 ° C congelatore per lo stoccaggio.
Nota: Passaggi 1.1-1.6 vengono eseguiti in condizioni BSL3 (comprese tutte le lavoro animale e gestione di infetti di organi e tessuti). Gamma irradiare le biopsie del polmone alle 3 megarad per attivare gestione di fuori del contenimento BSL3. Microdissezione laser sul tessuto non sterilizzato devono essere eseguiti entro il BLS3 impianto se approvato protocolli di sicurezza sono a posto. Tuttavia, la parte restante del presente protocollo viene descritta l'elaborazione a valle in una struttura di BSL-2.
2. tessuto di sezionamento
- Impostare la temperatura di taglio desiderata del criostato. Trasferire la biopsia del polmone di gamma-irradiati da-80 ° C stoccaggio per criostato e lasciare per 30 minuti per equilibrare la temperatura del tessuto. Nota: -20-22 ° C è ottimale per le biopsie lesione di TB.
- Con una pinzetta, fissare la biopsia al mandrino criostato utilizzando una piccola quantità di adesivo di taglio ottimale temperatura (OCT) per aderire alla base del tessuto al mandrino. Orientare il tessuto in modo che la superficie piana (che era in contatto con la base della cryomold) è la superficie esposta per il taglio. Garantire che l'OCT non contaminare la superficie del tessuto, come questo potrebbe interferire con l'analisi di spettrometria di massa successiva.
- Tre sezioni di tessuto a 25 µm spessore di tagliare e montare sul PET membrana diapositive. Delicatamente toccare la membrana alla sezione di tessuto e rimuovere. Se si applica troppa pressione, la sottile membrana può strappare.
- Evitare movimenti eccessivi del microfono delle diapositive prima del montaggio come questo si tradurrà nella membrana PET diventando carica e scarsa aderenza delle sezioni del tessuto. Assicurarsi che la diapositiva di membrana viene mantenuta a temperatura ambiente per consentire disgelo-montaggio e successo aderenza del tessuto alla membrana.
- Rimuovere il vetrino dal criostato e lasciare asciugare all'aria per 3 minuti. Se non viene eseguita immediatamente LCM-LC/MS/MS, sigillare il vetrino in un piccolo sacchetto sigillabile ermetico e trasferire in memoria di-80 ° C fino a quando richiesto per la dissezione.
- Tagliare una sezione adiacente al 10-12 µm e disgelo-montaggio su un vetrino standard per colorazione ematossilina ed eosina (H & E) e riferimento. Sezioni aggiuntive possono essere tagliate in questo momento per altre macchie di istochimica desiderato (ad esempio Ziehl-Niellsen per la visualizzazione del Mycobacterium tuberculosis (MTB)).
3. Microdissection
- Rimuovere il sacchetto sigillato contenente la diapositiva da-80 ° C stoccaggio e permettono di raggiungere la temperatura ambiente per 5 minuti.
Nota: Se la diapositiva fredda è esposto immediatamente nell'atmosfera del laboratorio, il tessuto sarà diventato rivestito con condensazione, e potrebbe essere compromessa l'integrità territoriale della droga. - Accendere il microscopio e il laser (laser richiede 5-10 minuti di riscaldamento prima che possa iniziare il taglio). Caricare provette PCR piatto-cap 0,20 mL nel supporto.
- Rimuovere il vetrino dal sacchetto e prendere un'immagine ottica della sezione di tessuto sulla diapositiva PET utilizzando uno scanner piano.
- Porre il vetrino nel portavetrini (lato tessuto rivolto verso il basso) e assegnare tubi di raccolta differenziata a regioni specifiche granuloma di interesse utilizzando il software di microscopio. In genere, questi saranno 'uninvolved polmone,' 'cellular granuloma,' e 'caseum' (centro necrotico), ma può variare a seconda della patologia specifica di biopsia e del granuloma.
- Concentrarsi sul tessuto utilizzando la 5x obiettivo del microscopio. Questo ingrandimento dovrebbe fornire una buona panoramica del tessuto contenente entrambe le aree granuloma cellulare e necrotico. Nel software selezionare il tubo designato 'caseum' per spostarlo nella posizione sotto il tessuto.
- Inserire i parametri desiderati dissezione. Le impostazioni tipiche per una sezione di polmone spesse 25 µm sono laser Potenza 30, velocità 15 e aperture 35 (unità arbitrarie). Tuttavia, questi sarà diverso a seconda del microscopio utilizzato e potenziale diminuzione del potere a causa dell'età del laser.
- Selezionare lo strumento di disegno libero e, utilizzando un mouse o touchscreen penna, delineare la regione desiderata per la dissezione. L'area della superficie della regione verrà visualizzato nel software. Mantenere le regioni selezionate sotto 500.000 µm2 (0,5 mm2) per facilitare la dissezione più facile. Ripetere la dissezione fino a 3 milioni µm2 (3 mm2) sono stati raccolti in totale nel cappuccio del tubo.
- In occasione della regione dissecata potrebbe rimangono bloccata alla membrana circostante (per esempio a causa di attrazione statica) e non cadere nel tappo di raccolta. Rimuovere queste regioni della superficie cumulativo totale selezionando e rimuovere manualmente all'interno del software.
- Selezionare il tappo per 'lesione cellulare' e raccogliere 3 milioni µm2 del tessuto utilizzando lo stesso processo come descritto al punto 3.7.
- Selezionare il tappo per 'uninvolved polmone' e raccogliere 3 milioni µm2 del tessuto utilizzando lo stesso processo come descritto al punto 3.7. Nota che il tessuto polmonare uninvolved contiene molti bronchioli e gli spazi alveolari. Prestare particolare attenzione a escluderle dalle regioni definite del tessuto per la dissezione.
- Rimuovere il supporto di tappo e attentamente sganciare, sigillare ed etichettare ogni provetta. Proteggere i tessuti dissecati dalle circostanti dispersioni di aria (ad esempio, da interruzione di flusso di aria da una porta di apertura). Analizzare i tessuti dissecati immediatamente, o conservare a-80 ° C e scongelare prima di elaborazione e analisi LCMS.
4. estrazione e analisi LCMS
- Preparare la soluzione di estrazione di 1:1. acetonitrile/metanolo contenente standard interno d-10 di etambutolo. Quando si seleziona uno standard interno, uso una forma stabile con etichetta della droga dell'analita (ad esempio deuterio-etichetta EMB utilizzato in questa dimostrazione) con spostamento sufficiente massa per evitare isotopo cross talk tra l'analita droga e standard (di solito un minimo di 4 Dalton) .
Nota: Creazione di omogenato di ogni tipo di tessuto rispettivi standard è difficile perché c'è un controllo molto limitato tessuto con cui creare omogeneato standard. In alternativa a rendere standard da un campione a spillo omogeneato, standard può essere creato aggiungendo tessuto vuoto e composto in esame insieme ed estrazione. Un volume di controllo tessuto in un omogeneato che corrisponde al volume dell'obiettivo delle sezioni di tessuto del campione di studio si combina direttamente con una quantità della sostanza in esame che sarà presente ad una concentrazione determinata. - Calcolare il volume di tessuto mirato basato sulla superficie e spessore della sezione di tessuto e determinare il fattore di diluizione necessario per l'omogeneizzato utilizzando il volume dell'omogeneato che verrà aggiunti al standard e campioni QC. I calcoli sono illustrati sotto per un'area di destinazione dissecato2 (3 mm2) µm 3 milioni con un 25 µm spessore e 2 µ l di omogenato.
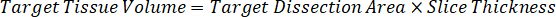
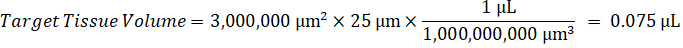
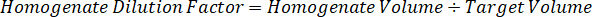

- Assumendo una densità di tessuto di 1 g/mL, preparare il brodo di omogenato di 50 mg di tessuto di controllo di pesatura e l'aggiunta di tampone PBS per diluire (utilizzando il fattore di diluizione di 26,67 omogeneato calcolato al punto 4.2, il diluente è 1,283 mL). Omogeneizzare mediante perlina battendo il tessuto polmonare e tampone PBS per 5 minuti a 1750 giri su un omogeneizzatore del tallone.
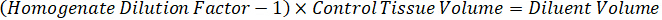
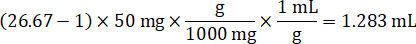
- Diluire la concentrazione del farmaco scorte di 1 mg/mL in acetonitrile/acqua di 1:1 per creare la curva standard chiodare soluzioni. Determinare chiodare concentrazioni standard basate sul volume di spike e il volume del tessuto dell'obiettivo. L'esempio illustrato è per un 100 ng/mL standard utilizzando un 10 µ l di spike.
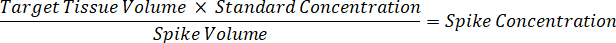
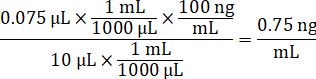
- Rimuovere le provette contenenti i tessuti microdissected da-80 ° C stoccaggio e permettono di raggiungere la temperatura ambiente per 5 minuti.
- Aggiungere 10 µ l di soluzione di acetonitrile/acqua 1:1 e 2 µ l di tampone PBS le provette contenenti tessuto microdissected.
- Per curva standard ed i tubi di controllo qualità, aggiungere 10 µ l di soluzione a 2 µ l di controllo omogeneato del polmone di chiodare.
- Aggiungere 50 µ l di soluzione di estrazione in ogni provetta.
- Vortexare ciascuna provetta per 5 minuti, trattare con ultrasuoni per 5 minuti e centrifugare a 5000 RPM per 5 minuti per formare una pallina di pellicola e tessuto in ogni provetta.
- Trasferire 50 µ l del surnatante ad una piastra a 96 pozzetti profondi pozzetti e diluire con un ulteriore 50 µ l di acqua deionizzata in ogni pozzetto.
- Eseguire l'analisi LC/MS/MS utilizzando i parametri dello strumento ottimizzato per etambutolo ed etambutolo-d10 standard interno (come precedentemente descritto in dettaglio12).
- Utilizzare un fattore di diluizione per correggere la quantità esatta di tessuto dissecato per ciascun campione.
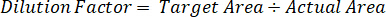
5. metodo convalida
- Creare un omogeneato nel tessuto polmonare controllo combinando 1 parte del polmone, 2 parti di PBS e perline d'acciaio 3-4. Battere il tessuto polmonare e tampone PBS per 5 minuti a 1750 giri utilizzando un omogeneizzatore del tallone.
- Spike omogeneato aggiungendo 10 µ l di 1 mg/mL di brodo di etambutolo DMSO nel 990 µ l omogeneato per creare una concentrazione finale di 10.000 ng/mL (10 mg/mL) e vortex per 1 minuto.
- Creare un blocco congelato omogeneato versando l'omogeneizzato in un cryomold e rapidamente congelamento il ghiaccio secco per 5 minuti.
- Preparare 25 µm spessore sezioni dal blocco omogeneato come descritto ai punti 2.1-2.5.
- Sezionare l'area di tessuto di destinazione come specificato nei passaggi 3.2-3.10.
- Aggiungere 10 µ l 1:1 acetonitrile/acqua e 2 µ l di tampone PBS le provette contenenti tessuto microdissected.
- Aggiungere 50 µ l di soluzione di estrazione in ogni provetta. Procedura il 4,9-4.12, per creare una curva standard e determinare la concentrazione di farmaco nel blocco di omogenato di tessuto.
- Calcolare l'efficienza di estrazione utilizzando la seguente formula:
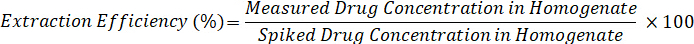
Risultati
Una panoramica dell'approccio LCM-LC/MS è illustrata nella Figura 1. Dopo la sterilizzazione il tessuto di irradiazione gamma, tutti i passaggi successivi (dal tessuto sezionamento in poi) si svolgono di fuori di condizioni BSL3. La figura 2 Mostra la lesione dalle sezioni di biopsia prima e dopo l'isolamento del tessuto di LCM. Aree necrotiche e cellulari delle lesioni TB possono essere facilmente identificate ed isolate median...
Discussione
Risolto nello spazio di quantificazione delle droghe all'interno delle lesioni di TB polmonare è necessaria per determinare se esposizione al farmaco raggiunge concentrazioni sterilizzante a popolazioni batteriche risiedono gli scompartimenti differenti della lesione. Il metodo di LCM-LC/MS qui descritto consente la quantificazione assoluta delle droghe anti-TB all'interno tutti i compartimenti di lesione, tra cui il caseum ricchi di batteri, utilizzando sezioni di tessuto di solo 1-3 in totale. Omogeneizzazione dei tes...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo Paul O'Brien, Marizel Mina e Isabella Freedman per gli esperimenti sugli animali, Jacquie Gonzalez e Danielle Weiner dal NIH/NIAID per aiuto con irradiazione gamma dei tessuti di coniglio prima del laser capture microdissection e Jansy Sarathy per manoscritto pensieri e consigli. Quest'opera è stata sostenuta da finanziamenti da Bill e Melinda Gates Foundation (OPP1174780) e strumentazione di NIH ha condiviso concedere 1S10OD018072. Ringraziamo Eliseo A. Eugenin per fornire accesso al microscopio Leica LMD 6500 e condivisione di competenze e consulenza. L'acquisto e il supporto continuo di, il 6500 LMD è stato finanziato dal grant The National Institute of Mental Health, MH096625, Istituto nazionale dei disordini neurologici e colpo, NS105584, PHRI finanziamenti (per E.A.E) e contributi di GSK (a E.A.E).
Materiali
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
Riferimenti
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon