Method Article
جراحة زرع cochlear وتسجيلات استجابة جذع الدماغ السمعية أثارت كهربائياً في الفئران C57BL/6
In This Article
Summary
نماذج حيوانية لزرع cochlear يمكن النهوض بمعرفة الأسس التكنولوجية لعلاج فقدان السمع الحسي الدائمة مع التحفيز الكهربائي. تقدم هذه الدراسة بروتوكول جراحية يصم الأذان الحادة وزرع cochlear صفيف القطب في الفئران، فضلا عن التقييم الوظيفي مع استجابة جذع الدماغ السمعية.
Abstract
عملية زرع cochlear (رابطة الدول المستقلة) هي نيوروبروسثيتيك من الأجهزة التي يمكن أن توفر حاسة السمع للصم. ومع ذلك، لا يمكن استعادة CI جميع جوانب السمع. هناك حاجة إلى تحسين تكنولوجيا زرع إذا كان المستخدمين CI إدراك الموسيقى وأداء في بيئات أكثر طبيعية، مثل جلسة الاستماع إلى صوت مع المتكلمون المتنافسة وتأملات وغيرها من الأصوات. يتطلب تحسين مثل هذه الحيوانات التجريبية فهم أفضل لآليات التحفيز الكهربائي في القوقعة وردوده في نظام السمع كلياً. الفأر نموذج جذاب متزايدة بسبب العديد من النماذج الجينية المتاحة. ومع ذلك، الاستخدام المحدود لهذه الأنواع كنموذج CI يرجع أساسا إلى صعوبة غرس صفائف قطب كهربائي صغير. المزيد من التفاصيل حول العملية الجراحية، من ثم ذات أهمية كبيرة للتوسع في استخدام الفئران في البحوث CI.
ونحن في هذا التقرير، تصف بالتفصيل البروتوكول يصم الأذان الحادة وزرع cochlear صفيف القطب في سلالة الماوس C57BL/6. ونحن تثبت فعالية هذا الإجراء مع استجابة جذع الدماغ السمعية أثارت كهربائياً (عابر) الوظيفية وإظهار أمثلة لتحفيز العصب الوجهي. وأخيراً، نحن أيضا مناقشة أهمية بما في ذلك إجراء يصم الأذان عند سماع عادة باستخدام الحيوان. ويوفر هذا الطراز الماوس فرصة قوية لدراسة الآليات الوراثية والعصبية الحيوية التي ستكون ذات أهمية بالنسبة للمستخدمين CI.
Introduction
عملية زرع cochlear (رابطة الدول المستقلة) هي الأجهزة الإلكترونية التي يمكن أن توفر شعورا بالاستماع إلى الناس مع فقدان السمع الشديد والعميق. فإنه يستخدم أقطاب مزروع جراحيا في القوقعة في الإذن الداخلية على تحفيز العصب السمعي مباشرة. وحتى الآن، كاريتاس الدولية البدلة الحسية الأكثر نجاحا وساعد أكثر من 600,000 شخص في جميع أنحاء العالم1. ومع ذلك، الجهاز يحتوي على أوجه القصور. أولاً، أن الفوائد التي يوفرها الجهاز تختلف اختلافاً كبيرا بين المتلقين. ثانيا، تعتبر الكلام في البيئات الصاخبة والموسيقى لا تزال تفتقر معظم CI المستخدمين.
لسنوات عديدة، استخدمت نماذج حيوانية فهم أفضل لهذه المسائل في البحوث CI والتحسين المستمر لسلامة وكفاءة الأجهزة. النماذج التي أعطت نظرة متعمقة في عدة ظواهر، مثل البلاستيك تغييرات في الدماغ تحدث بعد زرع CI2، أثر تطبيق العلاج الجيني للحفاظ على السمع المتبقية3، والخصائص الفيزيائية كهربائياً وحفز العصب السمعي4، من بين العديد من الأمثلة الأخرى.
الفئران كائن نموذج قوية نظراً لتوافر نماذج الصمم الوراثي الكبير. ميزات أخرى تشمل القدرة على التلاعب جينوم الفأر (مثل، عن طريق نظام كريسبر Cas)، المتقدم الفرصة لاستخدام تقنيات لدراسة آليات، وخاصة في الدماغ، ومعدل الإنجاب عالية، والتطور السريع التصوير و من السهل تربية والتعامل معها. التحديات التقنية الرئيسية في أداء العمليات الجراحية CI في الفئران هي صغر حجم القوقعة ووجود الشريان ستابيديال الكبيرة (SA). SA عادة يختفي خلال التطور الجنيني في البشر ولكن استمرت طوال الحياة في عدد من القوارض، بما في ذلك الفئران والجرذان واليرابيع. SA يعمل تحت إطار جولة المكانة، مما يزيد من تعقيد الوصول إلى القوقعة ويزيد من مخاطر العمليات الجراحية.
وقد أظهرت الدراسات السابقة جدوى زرع CI في الفئران5،،من67. ايرفينغ et al. أثبت أنه يمكن تحقيق التحفيز الكهربائي إينتراكوتشلير المزمن لمدة تصل إلى شهر واحد. التحفيز الحادة وأجرى أيضا ولكن لم تعرض التسجيلات. أنها أظهرت أن قسمها الشريان ستابيديال أي تأثير كبير على عتبة السمع أو العدد من دوامة العقدة العصبية وأن التطبيق الموضعي من النيوميسين امينوغليكوزيد، المخدرات السامة، إجراء فعال يصم الأذان في 5من الفئران. سكين وآخرون وصف نهج الظهرية معدلة للقوقعة الفأرة من خلال نافذة جولة أفضل الحفاظ على مركز الاستماع6. بعد إدراج سلك البلاتين الايريديوم، لوحظ استماع المتبقية كبيرة مع استجابة جذع الدماغ سمعية زيادة عتبة 28 dB (ABR). أوتواكوستيك الانبعاثات (عملية) فقدت في الحيوانات الكبيرة ABR عتبة تحولات6. ميستري et al. اختبار للآثار الفنية ونسيجية لغرس في غياب التحفيز الكهربائي7. على الرغم من المحافظة على السمع في كل 3 و 6 أشهر من العمر الفئران مزروع في الترددات المنخفضة، أدى زرع الأنسجة مثل التليف حول عملية الزرع وأوستيونيوجينيسيس حول بولوستومي7.
وباختصار، يوضح واحد فقط من أصل ثلاث دراسات في رابطة الدول المستقلة في الفئران، تسجيل الوظيفية لتحفيز CI. ايرفينغ والزملاء إجراء تسجيلات عابر الحاد والمزمن على حد سواء ولكن فقط أظهرت بيانات من التحفيز CI المزمنة5. نموذج المزمنة مع أحد الأجهزة القابلة للغرس تماما وضعت بها ايرفينغ et al غير تحديا من الناحية التقنية. هو لم يعرف بعد ما إذا الحادة CI التحفيز، أقل صعوبة وأسرع، ويمكن تحقيق نتائج مماثلة.
رابطة الدول المستقلة تستخدم من قبل الناس مع فقدان السمع الشديد والعميق الذي لم يعد يستفيد من المعينات السمعية. ولذلك نماذج حيوانية للمستخدمين CI وينبغي أن تشمل إجراء يصم الأذان عند سماع عادة ما تستخدم الحيوانات. وهناك سبب آخر ديافين الحيوانات استماع أن التحفيز الكهربائي للصم أو جلسة استماع القوقعة تنتج مختلف الاستجابات العصبية4،،من89،10،11، 12. التحفيز الكهربائي للقوقعة الصم مباشرة ينشط ألياف العصب السمعي ويولد استجابة اليكترونيورال (α). ويتميز بزمن قصير ومجموعة ديناميكية صغيرة في محيط8،10. من ناحية أخرى، يثير التحفيز الكهربائي من القوقعة السمع أيضا خلايا الشعر في استجابة اليكتروفونيك (β) التي تتميز بالاختفاء أطول وأكبر مجموعة ديناميكية4،11. استجابة اليكتروفونيك يعزى إلى الإثارة العادية من الألياف العصبية من خلايا الشعر الداخلية، تقلص الخارجي الشعر الخلايا المستحثة كهربائياً، وتوليد موجه السفر4. الردود اليكترونيورال واليكتروفونيك يؤدي أيضا إلى نمطين من أنماط مختلفة من النشاط في الجهاز العصبي المركزي9. وسجل ساتو et al. midbrain الخلايا العصبية من خنزير غينيا CI مزروع قبل وبعد يصم الأذان مع النيوميسين، الذي يقضي بمساهمة اليكتروفونيك. أنها أظهرت أن منحدر الدالة معدل مستوى أشد انحدارا وإطلاق معدلات أعلى في حالة ديفينيد مقارنة ب شرط استماع9. ولذلك، اعتماداً على ذكر مسألة البحث، من المهم النظر بما في ذلك يصم الأذان اليكتروفونيك منفصلة والردود اليكترونيورال على التحفيز الكهربائي للعصب السمعي.
هنا، يمكننا وصف الإجراء يصم الأذان الحادة وزرع cochlear صفيف القطب في ماوس وكذلك تسجيل الوظيفية للتحفيز الكهربائي إينتراكوتشليار مع استجابة جذع الدماغ السمعية أثارت كهربائياً (إيبر).
Protocol
وأجريت جميع الإجراءات وفقا لجامعة بازل، سويسرا، ورعاية الحيوان والمبادئ التوجيهية. كان مرخصا لها من جانب "مكتب الطب البيطري" في كانتون بازل، سويسرا.
ملاحظة: C57BL/6 الفئران الكبار، الذين تتراوح أعمارهم بين 8-12 أسبوعا (وزن ز 20 – 30)، استخدمت في هذه الدراسة.
الإذن اليسرى الإذن التجريبية. الإذن اليمنى بمثابة عنصر تحكم داخل حيوان ولا يتم تبديل جراحيا.
1-قبل الجراحة الإجراءات
-
تخدير الحيوان 30 دقيقة قبل الجراحة عن طريق الحقن داخل البريتوني (القائمة) من الكيتامين/إكسيلازيني (الكيتامين 80 ملغ/كغ، xylazine 16 مغ/كغ، والقائمة، وحجم حقنه في وزن الجسم g ميكروليتر/10).
- الملحق التخدير حسب الضرورة، كما يحكم بدواسة الإيجابية وبالبيبرال (تو-رشة) العاكسة وحركة شعيرات، مع أقل جرعة من الكيتامين (45 مغ/كغ، القائمة، حقن في وزن الجسم g ميكروليتر/10). يمكن أن يكون محل الوكلاء وأنظمة الجرعة الواحدة والمبادئ التوجيهية للمؤسسات.
ملاحظات: بشكل عام، الحيوان سوف تحتاج إلى حقنه كل 45 – 60 دقيقة مع هذا النظام عامل والجرعة. متوسط الوقت من شق الأولية للإغلاق حول الصفيف القطب مزروع عادة 1-1.5 ساعة.
- الملحق التخدير حسب الضرورة، كما يحكم بدواسة الإيجابية وبالبيبرال (تو-رشة) العاكسة وحركة شعيرات، مع أقل جرعة من الكيتامين (45 مغ/كغ، القائمة، حقن في وزن الجسم g ميكروليتر/10). يمكن أن يكون محل الوكلاء وأنظمة الجرعة الواحدة والمبادئ التوجيهية للمؤسسات.
- الاختيار للتخدير الكامل للحيوان تميزت بمعدل التنفس عادية وعدم وجود ردود الفعل تو-رشة. الحفاظ على هذا المستوى من التخدير.
- الحفاظ على درجة حرارة جسم الحيوان في 36.6 درجة مئوية مع وسادة تدفئة حلقة مغلقة. تطبيق مرهم العين لتجنب جفاف القرنية. سيكون هذا أيضا على منع الحيوان الطرفة العاكسة، الذي يمكن إضافة إلى إعادة ترميز الضوضاء.
- إدارة مسكن المحلية عن طريق الحقن تحت الجلد (الليبي) بوبيفاكايني/ليدوكائين (0.1 مغ/مل بوبيفاكايني و 0.4 ملغ/مل ليدوكائين، 0.1 مل تدار الليبي) على طول خط الشق المقصود التقليل إلى أدنى حد من أي إزعاج الجراحية. يمكن أن يكون محل الوكلاء وأنظمة الجرعة الواحدة والمبادئ التوجيهية للمؤسسات.
- إدارة الأتروبين خصم المسكارينيه (أتروبينيسولفاتي الأمينية، تدار 0.1 مغ/مل، 20 ميكروليتر الليبي، حله في برنامج تلفزيوني) في الرقبة للحد من إفراز المخاط وتسهيل التنفس. يمكن أن يكون محل الوكلاء وأنظمة الجرعة الواحدة والمبادئ التوجيهية للمؤسسات.
2-قبل يصم الأذان استجابة جذع الدماغ السمعية الصوتية (عبر)
ملاحظة: عبر يستخدم لقياس حالة جلسة استماع قبل وبعد يصم الأذان. يتم إجراء اختبار على الإذن اليسرى وفي كشك كهربائياً محمية عازلة للصوت. نوصي باختبار وزرع الإذن اليسرى لشخص استخدام اليد اليمنى في وقت لاحق. يمكن الاطلاع على مزيد من التفاصيل عن العبر في الفئران في13،14. تستخدم تكنولوجيات ديفيس تاكر (TDT) الأجهزة والبرمجيات (بيوسيج) لتسجيل العبر ولكن يمكن استخدام نظم أخرى.
- الإذن (يمين) كونترالاتيرال مع رغوة الصوتية لعزل الاستجابة العبر من الإذن (يسار) عن كتلة. وضع الرغوة في حقنه 1 مل وحقن من قناة الإذن اليمنى من الماوس لتغطية قناة الإذن كله مع الرغوة (0.1-0.2 مل رغاوي). تأكد حقنه الأختام عن كثب إلى الإذن حيث يحصل الرغوة وصولاً إلى قناة الإذن.
- مكان المتكلم 10 سم من أذنه اليسرى.
ملاحظة: تمت معايرة المتكلم لهذا الإعداد استخدام ميكروفون ثنائي الفينيل متعدد الكلور على النحو المبين في ريفيفينسي15. - تنظيف أقطاب ABR مع محلول إيثانول 70%. وضع أقطاب كهربائية تحت الجلد: النشطة (Ch1) في الذروة، الإشارة (-) أدناه بينا عن الإذن، والبرية في الساق الخلفية (الشكل 1).
- قم بتوصيل الرأس-المرحلة وما قبل مكبر للصوت إلى المعالج السمعي عبر منفذ الألياف البصرية.
-
فحص مقاومة النشطة وقطب مرجعي.
- في حالة المقاومة أكثر من 3 أوم، إعادة ترتيبها وإعادة أخذ القياس. يتم الحصول على تسجيلات أفضل عندما يكون أقطاب كهربائية مقاومة نفسه. إغلاق جناح الصوت واقية.
- انقر فوق تنشيط وتسجيل ABR في حالة الحقل مجاناً مع المعالج تعقيداً السمعية والبرمجيات. توحيد حافز فوق في البرنامج: تعرض نقرات قناة واحدة أحادية الطور 0.1 ms هرتز 21؛ انقر فوق مستوى النقصان من 90 ديسيبل SPL إلى 10 ديسيبل SPL 10 dB خطوات؛ 10 مللي ثانية تسجيل النافذة. متوسط إجمالي 512 الردود على كل مستوى من مستويات الديسيبل.
- تطبيق عامل تصفية lowpass 2,000 هرتز و 300 هرتز هيغباس تصفية دون اتصال للحد من الضوضاء في التسجيل استخدام برنامج نصي Matlab مصنوعة خصيصا.
- تحديد العتبة ABR كأدنى مستوى dB مع استجابة موجه ABR معترف بها (الشكل 2و الشكل 3).
3-الجراحة
ملاحظة: وتشمل الصكوك النموذجية المستخدمة مقص، مشرط، زوج من الملقط المعدني مع أداة نسيج ضام ونصائح مستقيمة أو منحنية والاوتاد شفط عدة نقاط ورقة قابلة للامتصاص. يتم إجراء عملية جراحية في أذنه اليسرى.
- وضع الماوس على الجانب الأيمن. تجنب الإجهاد اﻻلتوائية لا مبرر له على فقرات عنق الرحم. تأكد من الحفاظ على الجسم مباشرة إلى إبقاء الخطوط الجوية مفتوحة.
- قطع الفراء خلف أذنه اليسرى مع مقص (أو حلقها مع آلة حلاقة) تعرض الجلد. تعقيم الجلد بمحلول الإيثانول 70% وتدين (البوفيدون/اليود).
- إطار التكبير المجهري (س 16)، جعل شق إذني بعد 1 – 1.5 سم مع دون مشرط.
- قم بالتبديل إلى أعلى التكبير المجهري (25 س).
- إجراء تشريح حادة من خلال طبقة الدهون تحت الجلد، الذي يمكن أن يكون من سمك متغير، مع الملقط.
ملاحظة: كن حذراً عند تشريح كحبل الوريد الخارجي يخترق هذا المجال. يمكن أن يسبب الضرر لهذا الهيكل النزيف. - سحب العضلات الترقوية للكشف عن السمحاق tympanic الفقاعة. استخدام العصب الوجهي معلما تشريحية رئيسية للمساعدة في تحديد هوية الفقاعة السمعية. العصب الوجهي يلتف حول حافة الخلفي/الظهرية العضلات الترقوية ويعمل روسترالي على طول قناة الإذن نحو بينا. بلطف ضع أداة ضام الذاتي الاحتفاظ في شق لتسهيل الوصول إلى الفقاعة (الشكل 4).
- إزالة الأنسجة تغمر منطقة ميديو الظهرية الفقاعة للسماح للتصور الواضح ريدج بين الفقاعة، وعملية الخشاء.
- تدوير بلطف إبرة ز 30 بيرس الفقاعة وجعل ثقب (بولوستومي) على الجانب الخلفي-متفوقة ريدج (العظام أرق في هذا الجانب). بدلاً من ذلك، استخدام حفر جراحي أسنان.
ملاحظة: يمكن أن يتم ذلك والخطوات التالية مع التكبير المجهري أعلى حتى (40 س) إذا فضلت. تغيير موضع المجهر أيضا، إذا لزم الأمر. من المهم إلى أقصى حد رأي الجراحية الفضاء الإذن الوسطى. -
توسيع في بولوستومي باختلاس قطعة عظم صغيرة باستخدام الملقط مقلوب غرامة لفضح تجويف الإذن الوسطى. تمديد بولوستومي دورسالي نحو عملية الخشاء إلى مكانة نافذة جولة الواضح تغمر العظام. الشريان ستابيديال، فرع الشريان السباتي الداخلي، يدير البطني إلى مكانة نافذة جولة.
- كن حذراً لا ضرر السفينة كما النزيف قد يكون قاتلاً. يمكن إيقاف نزيف الصغيرة عن طريق الضغط على قطعة صغيرة من سبونجوستان في تجويف الإذن الداخلية.
- تمديد بولوستومي نحو الاتجاه الأمامي متفوقة لتصور stapes، عظم الإذن الوسطى متصلة بالإطار البيضاوي.
- إزالة stapes مع الملقط لفضح الإطار البيضاوي.
4-جولة نافذة تطبيق عامل السامة
- انثقب الأغشية النافذة وإطار بيضاوي جولة باستخدام إبرة ز 30 يتثلم برفق. تحقق من أن perilymph تنفد.
- نتخلل 0.05% وزن/حجم النيوميسين حله في برنامج تلفزيوني (تعديل على درجة الحموضة 7.4) من خلال الإطار البيضاوي ببطء. يجب أن تدفق السائل من النافذة جولة. كرر الإجراء نفسه في إطار جولة. احرص على عدم تلف الهياكل العظمية النافذة مع الإبرة المستخدمة نتخلل.
- ضع قطعة صغيرة (1 مم2) من سبونجوستان غارقة في النيوميسين ضمن جولة مكانة نافذة ونافذة بيضاوية.
- إزالة أداة ضام وإغلاق الشق وانتظر 30 دقيقة.
5-بعد انتهاء يصم الأذان ABR الصوتية
- تسجيل عبر بطريقة مماثلة قبل يصم الأذان (خطوات 2.2 إلى 2.8) (الشكل 2b، الشكل 3).
6-إدراج صفيف القطب CI
ملاحظة: الصفيف القطب إينتراكوتشلير يتكون من أربعة نطاقات البلاتين (Ø0.2 ملم) مع سلك البلاتين/iridum parylene معزول محمية في أنبوب سيليكون (الشكل 5).
- ضع أداة ضام في الشق إعادة الوصول إلى الفقاعة.
- إدراج الصفيف القطب في إطار جولة (حبل سكالا) في عمق حيث يقع الحلبةth البلاتين 4 فقط داخل إطار الجولة. وهذا يعطي عمق إدراج ~ 2 ملم، والمقابلة لوظيفة إينتراكوتشلير في ~ 30 كيلو هرتز16.
- لفائف أسلاك الرصاص داخل الفقاعة والصق السلك للأنسجة أعلاه الفقاعة. التفاف الأسلاك يساعد على إبقاء الصفيف في جميع أنحاء هذه التجربة.
- بعناية إزالة ضام وإغلاق الإدراج مع الغراء الأنسجة.
- إجراء شق صغير (0.5 ملم) في العنق عمودي على الخط الفاصل بين فيها النشطة، وسيتم استخدام أقطاب ABR مرجع مقص أنسجة. ضع الكرة الأرضية البلاتين في جيب تحت الجلد وإغلاق شق صغير مع الغراء الأنسجة (الشكل 6).
- توصيل لوحة الصفيف القطب إلى "منصة مشجعا الحيوان".
7-كهربائي استجابة جذع الدماغ السمعية (عابر)
ملاحظة: منصة مشجعا الحيوان (ASP) يستخدم لتحفيز الصفيف مسرى كهربائياً. ويمكن استخدام المصادر الحالية ونظم البرمجيات الأخرى.
- وضع أقطاب ABR قبل (الخطوات 2.3 إلى 2.5) (الشكل 6).
- فتح برنامج آسيا والمحيط الهادئ وتعريف نموذج تحفيز نبضة كهربائية. ونحن نستخدم الحبوب ثنائية الطور متوازنة من تهمة مع 50 ميكروثانية/المرحلة والطور البيني 10 ميكروثانية الفجوة التي عرضت في البقول 23.3 في الثانية (pps). يتم تسليم التحفيز الكهربائي في تكوين قطب أحادي القطب مع زيادة المستويات الحالية. يتم حساب متوسط إجمالي 400 الردود على كل من المستوى الحالي.
- القطارات الكهربائية النبض وتسجيل استجابة مقولة عابر باستمرار عن طريق هيدستاجي TDT، المعالج قبل مكبر للصوت والسمع.
- الأرض وتحليل البيانات عابر عبر نصي matlab مصنوعة خصيصا (الشكل 7). ترد في تكميلية البرنامج النصي ومثال على التسجيل.
8-نهاية التجربة
- في نهاية التجربة، euthanize الحيوان وفقا للمبادئ التوجيهية المؤسسية.
- فتح الشق وإزالة الزرع بعناية.
- الترا-sonicate الصفيف قطب كهربائي في الماء المقطر لمدة 10 دقائق لإزالة الحطام الأنسجة.
ملاحظة: يمكن إعادة استخدام عملية الزرع عدة مرات إذا كانت الأقطاب سليمة وإجراء بشكل صحيح. للتحقق من هذا، قياس المقاومة الأقطاب مع متعدد عند الصفيف الجافة. - تخزين الصفيف قطب كهربائي في مكان جاف.
النتائج
وكان الغرض من هذه الدراسة لوصف نموذج موثوق بها لتحفيز CI الحادة في الماوس ديافينيد. بمثابة عتبات السمع قبل وبعد الجراحة قراءات وظيفية للإجراء الذي يصم الأذان. التطبيق الموضعي من النيوميسين 0.05% في إطار بيضاوي وجولة زيادة كبيرة عتبات أثارت فوق السمع بالديسيبل 46 ± 6 (مقابل ما قبل مرحلة ما بعد النيوميسين: 30.0 dB ± 3.8 مقابل 75.7 dB ± 3.7، ف = 0.0003، إقران اختبار t, n = 7) (الشكل 3). الصفيف القطب الحجم الماوس الآخرة أدرجت في إطار جولة (الشكل 4، رقم 5). يمكن أن تولد المحاكاة الكهربائية القطب إينتراكوتشلير موثوق بها نشاط عابر. (الشكل 7). وفي بعض الحالات، تحفيز CI تنشيط العصب الوجهي وينتج موجه عالية سعة مع الكمون أما قصيرة أو طويلة (الشكل 8 أ و الرقم 8 (ب)، على التوالي). استجابة الكمون قصيرة تميزت تضخيم سريع لموجة الرابع حوالي 3 مللي، ومن المرجح أن تكون استجابة مباشرة للعصب الوجهي. بدأ حوالي 5 – 6 مللي استجابة الكمون الطويل ومن المرجح أن تكون استجابة العضلات غير سمعية (شذوذ) وآثار غير مباشرة بالعصب الوجهي. الردود العصب الوجهي نادراً ما يتم الإبلاغ عنها في الدراسات الحيوانية في الأدب ولكن هو مضاعفات معروفة جيدا في البشرية CI المستخدمين،17،،من1819. في الرقم 8، تحفيز العصب الوجهي ظهرت عند المستويات الحالية متوسطة نسبيا (μA 150-200) وفي اثنين من الحيوانات المختلفة. وفي حالات أخرى، يمكن أن تظهر كل من الاستجابات في الحيوان نفسه عند المستويات الحالية مرتفعة جداً (غير معروضة). نحن نوصي بالحد من المستوى الحالي إلى مستويات أقل من مظهر تحفيز العصب الوجهي.
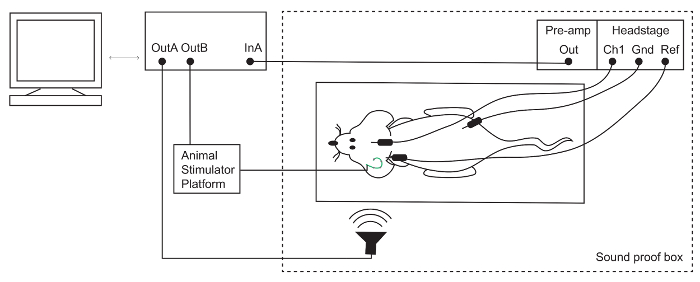
رقم 1: إعداد استجابة جذع الدماغ السمعية (ABR). يتم وضع أقطاب تحت الجلد في الذروة (/قناة نشطة 1 [Ch1])، خلف الإذن عن (المرجع [Ref]) وفي الساق الخلفية (أرض [Gnd]) الماوس أنيسثيتيزيد. تضخيم الإشارات الكهربائي وثم تسجيلها بنظام TDT. وترد التحفيز الصوتية والكهربائية عبر ميكروفون و "منصة مشجعا الحيوان"، على التوالي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
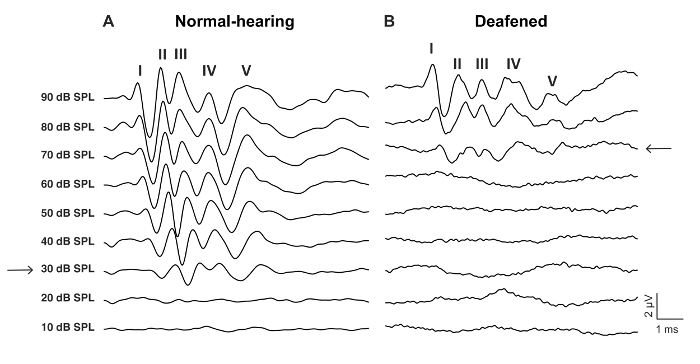
رقم 2: الممثل عبر موجات فوق التحفيز من ماوس البرية من نوع قبل وبعد يصم الأذان مع النيوميسين 0.05%- (أ) العادي-جلسة الاستماع عبر نمط يتميز بموجات المسمى-V وعتبة السمع منخفضة، هنا 30 ديسيبل SPL (السهم). ويظهر نمط (ب) عبر ديفينيد عتبة السمع زيادة، هنا 70 ديسيبل SPL (السهم). وقد الأمواج زمن أطول وأكثر غضب الزمانية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
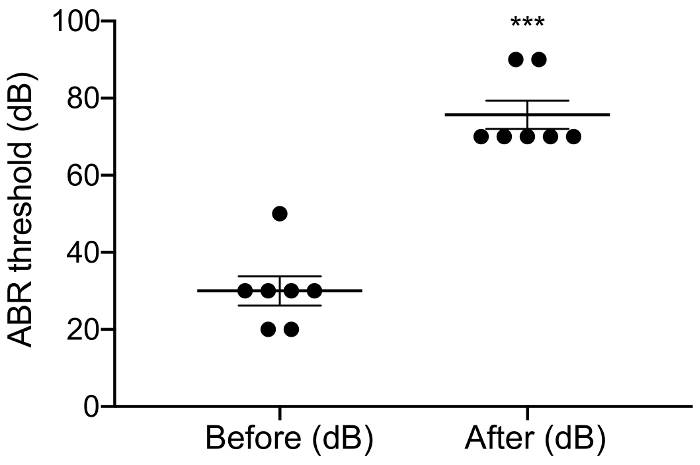
الشكل 3: عبر عتبة قبل وبعد يصم الأذان. تطبيق النيوميسين زيادة كبيرة عبر الحدود الدنيا من 46 dB ± 6. النيوميسين بعد مباراة قبل: 30.0 dB ± 3.8 مقابل 75.7 dB ± 3.7, p = 0.0003، إقران اختبار t، n = 7. الأخطاء هي الخطأ المعياري للوسائل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
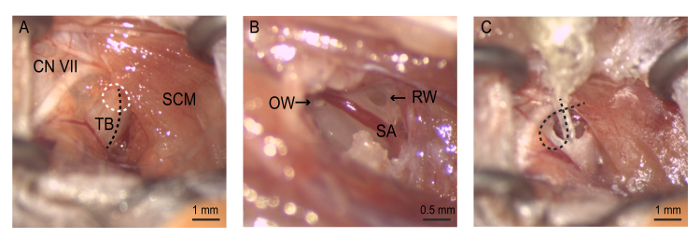
الشكل 4: الجراحة- (أ) التعرض للفقاعة السمعية. بولوستومي إجراء (دائرة بيضاء منقطة) على طول التلال في الفقاعة tympanic (خط منقط أسود). (ب) بولوستومي يسمح التصور إطار جولة والشريان ستابيديال والإطار البيضاوي. النيوميسين بلطف مسح من خلال أول الإطار البيضاوي، ثم في إطار جولة. يتم إدخال الصفيف (ج) الكهربائي حتى يقع مسرىال 4 فقط داخل مكانة نافذة جولة. السلك الكهربائي هو ملفوف داخل الفقاعة لإبقاء الصفيف في المكان قبل إغلاق الشق. سابعا CN = القحفية العصب السابع (العصب الوجهي)، آه = الإطار البيضاوي، قابل لإعادة الكتابة = جولة نافذة، SA = ستابيديال الشريان، المجلس الأعلى للقضاة = العضلات الترقوية، السل = tympanic الفقاعة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 5: زرع cochlear الماوس. (أ) الصفيف القطب إينتراكوتشليار يتكون من أربعة نطاقات البلاتين متباعدة في فاصل 0.4 مم مع قطر د: 0 [نصيحة] (د = 0.21)، 1 (د = 0.23)، 2 (د = 0.25)، 3 (د = 0.27). عرض كل قطب 0.2 مم. البلاتين/ايريديوم (90/10) أربعة parylene معزول الأسلاك يحتمي في أنبوب سيليكون. (ب) تكبير نصيحة الصفيف قطب كهربائي (مربع أحمر منقط). الصفيف القطب وكره مرجع البلاتين موصولة إلى لوحة طباعة. مقياس بار = 1 مم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
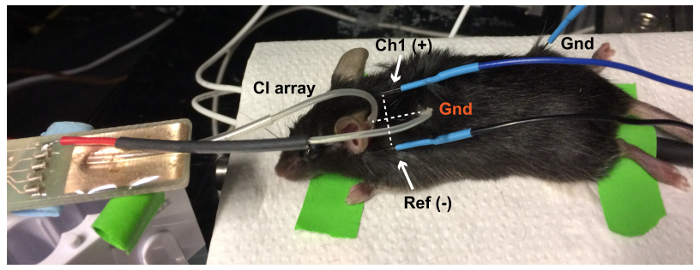
رقم 6: الإعداد ABR أثارت كهربائياً (عابر). يتم وضع الكرة الأرضية CI البلاتين (Gnd) أحمر في جيب تحت الجلد في رقبة الماوس. أن الخط الفاصل بين النشطة (Ch1(+) في الذروة) والمرجعية (Ref (-) في الإذن عن) ABR أقطاب عمودي على الخط الفاصل بين الصفيف القطب وأرض الواقع بغية الحصول على أفضل استجابة عابر. يتم وضع مسرى عابر الأرض (Gnd) أسود في الساق الخلفية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
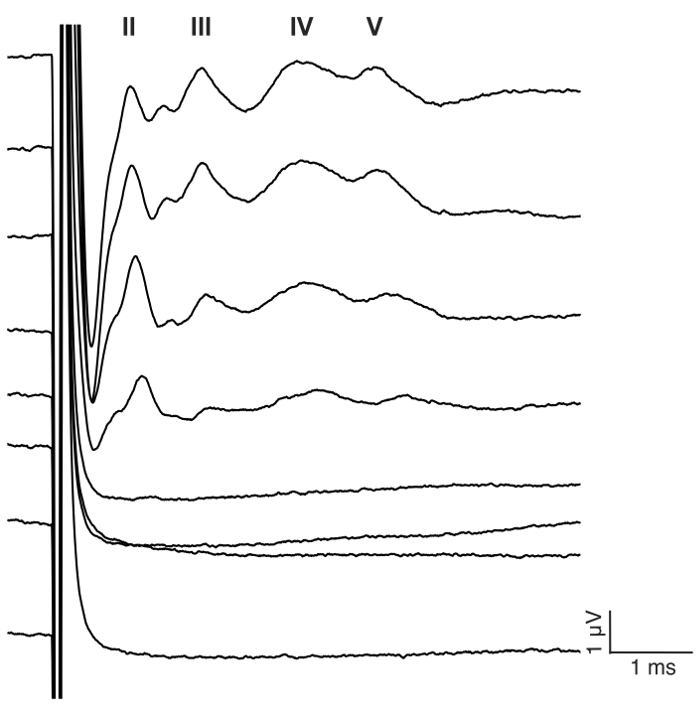
رقم 7: موجات عابر الممثل لتحفيز CI في ماوس ديفينيد. ويقدم قطار نبض ثنائية الطور إلى القطب #1 في تكوين أحادي القطب في البقول 23.3 في الثانية (pps) مع 400 من التكرار. محفزات المستوى 0-175 μA يرد في 25 الخطوات μA (انظر تفاصيل التحفيز في الخطوة 7، 2). أرقام رومانية تدل على عدد الموجه عابر. ستريك الموجه والكمون زيادة ونقصان، على التوالي، مع زيادة المستوى الحالي. في هذا المثال، ظهرت الموجه الثانية حوالي 1 مللي ثانية، الموجه الثالثة حوالي 2 مللي ثانية، رابعا موجه حول موجه ms، 3 الخامس حوالي 4 ms. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
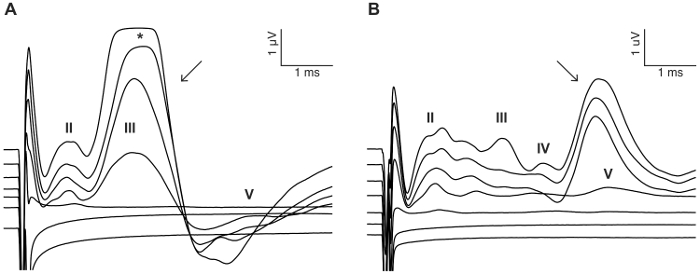
الشكل 8: مثال تحفيز العصب الوجهي. وفي بعض الحالات، يمكن تنشيط العصب الوجهي CI التحفيز وتثير استجابة مباشرة مع زمن قصير (A) (سهم) أو استجابة غير مباشرة مع زمن أطول (ب) (السهم). الأمثلة التي تظهر من الحيوانات اثنين مزروع CI حفزت بقطار نبض ثنائية الطور باستخدام 0 – 300 μA في 50 μA الخطوات (انظر تفاصيل التحفيز في الخطوة 7، 2). أرقام رومانية تدل أرقام موجه عابر. * تشير إلى القطع بالموجة عابر بسبب التشبع من مكبر للصوت. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
وتصف هذه المخطوطة النهج الجراحية يصم الأذان الحادة وزرع cochlear في الماوس، فضلا عن التقييم الوظيفي لتحفيز CI مع استجابة جذع الدماغ السمعية. على الرغم من أن القوقعة الفأرة الصغيرة والجراحة صعبة، الطراز الماوس CI عمليا ويخدم كأداة قيمة في البحوث السمعي.
الشريان ستابيديال موجود في الإذن الوسطى من الماوس. الشريان الذي يدخل الفقاعة ميديالى الخلفي، ويمتد إينفيريورلي إلى مكانة نافذة جولة ومن ثم ﻷسلحته مكانة نافذة بيضاوية. في التطوير الأولى للطراز الماوس، نحن بصدمات قاتلة داخل منطوق النزيف التالي للشريان ستابيديال، أساسا أثناء الوصول إلى الفقاعة. نتيجة لذلك، نحن تكييفها مع اتباع نهج أكثر محدودية والوصول إلى الفقاعة في خطوات تشريح أصغر حجماً وصقلها. ولوحظ بعد ذلك لا مضاعفات أخرى بسبب النزيف. وعلى الرغم من حقيقة أن الكي الشريان ستابيديال له أي تأثير كبير على عتبة السمع أو عدد من دوامة العقدة العصبية في الفئران5، في رأينا، أنها لا لزوم لها طالما أن تؤخذ قدر كبير من العناية والاهتمام أثناء الجراحة. ونقترح اتخاذ الوقت اللازم لتطوير المهارات الحركية الدقيقة، والوصول إلى الكفاءة التقنية. عادة ما يكون متوسط الوقت من شق الأولية للإغلاق حول الصفيف القطب مزروع ح 1 – 1.5.
جراحة CI الحادة الموصوفة في الفئران مشابه للإجراء "البطني" والإدراج في إطار جولة المستخدمة في القوارض الأخرى، بما في ذلك الفئران واليرابيع21،،من2022. واستخدمت دراسات أخرى القوارض "نهج الظهرية" مع كوتشليوستومي القاعدية بدوره بدلاً من إدراج إطار جولة، تجنب SA تماما وإدخال الصفيف أكثر شدة6،،من2324. غرس جمعية التحفيز المزمنة في الفئران يتبع نفس الخطوات كما هو موضح في هذا البروتوكول بالإضافة إلى شبكة دكرون لإصلاح عملية الزرع والرعاية بعد الجراحة5.
التحديات التقنية الرئيسية عند إجراء العمليات الجراحية CI في الفئران هي صغر حجم القوقعة مقارنة بالقوقعة الجرذان واليرابيع، ووجود SA كبيرة. SA موجودة أيضا في الفئران ولكن ليس في اليرابيع. وبالإضافة إلى ذلك، نظراً للفئران أصغر من الفئران واليرابيع، وهم أكثر عرضه للعمليات الجراحية.
للقضاء على الردود اليكتروفونيك في التسجيلات عابر وتقليد فقدان الشعر خلية موجودة في معظم CI المستخدمين، نحن سمعيا الحيوانات قبل الإدراج CI. الفئران ويصعب ديفين أوتوتوكسيكالي المجراة في25 لأن تركيزات الامينوجليكوزيدات المطلوبة لسبب مؤقت الجهازية نافذة ضيقة جرعة: انخفاض جرعات تعطي على مدى عدة أيام النتائج في عدم فقدان خلايا الشعر حين حقنه واحدة جرعة أعلى يمكن أن تكون فتاكة26. أيضا، هو قابلية الامينوجليكوزيدات تعتمد السلالة26. بيد أنه قد ثبت أن جرعة وحيدة من الامينوجليكوزيدات بالاقتران مع حلقة مدر للبول يمكن أن تنتج فقدان خلايا الشعر الخارجي المفرط في الفئران CBA/كي دون عواقب مهلكة27. أبلغ عن موت الخلية الشعر الداخلية تأخر في نصف جميع كوكليا درس27.
في هذه المخطوطة، قمنا باستخدام التطبيق الموضعي من النيوميسين الامينوجليكوزيدات مستوحاة من البروتوكول أنشأت مؤخرا ل الفئران C57BL/65. الطلب الحاد من النيوميسين زيادة كبيرة على عتبة السمع أثارت انقر فوق بالديسيبل 46 ± 6.1. على الرغم من أن هذه الزيادة أكبر من الزيادة 35 dB عنها ايرفينغ et al. (مقابل ما قبل ما بعد الجراحة: 41.6 dB ± 3، 3 مقابل 76.6 ديسيبل ± 4.4, p = 0.02، n = 3) 5، حققنا نفس الحد الأدنى يصم الأذان بعد (75.7 dB ± 3.7 مقابل 76.6 ديسيبل ± 4.4). النيوميسين 0.05% يعتقد أن تسبب فقدان السمع، أساسا بموت الخلية الشعر الخارجي السريع، جزئية كما الخسارة الداخلية الشعر خلية يأخذ وقتاً أطول لتحدث27. ولذلك فمن الممكن أن الاستجابة اليكتروفونيك، وإنشاء كلا من الداخلية وخلايا الشعر الخارجي4،،من89،10،،من1112، فقط القضاء جزئيا في صمت الحيوانات مع السمع المتبقية. على الرغم من أن النيوميسين 0.05% (وزن/حجم) ليس إنقاص العدد من دوامة العقدة العصبية 4 أسابيع بعد يصم الأذان5، حتى الآن مجهول إذا النيوميسين في الإعداد لدينا الحادة تؤثر على ألياف العصب السمعي أو يروج سينابتوباثي (فقدان نقاط الاشتباك العصبي بين خلايا الشعر الداخلية ونوع أنا السمعي العصب ألياف). عدم اليقين آخر أن معاملة النيوميسين الموضعية قد لا يؤدي إلى توزيع موحد لفقدان الشعر خلية على طول القوقعة. الدراسات المستقبلية المطلوبة للإجابة على هذه الأسئلة.
وخلاصة القول، جعل العدد المتزايد من النماذج الجينية للإنسان الصمم والبيوكيميائية الأدوات المتاحة الماوس نموذج حيوان جذاب للبحوث السمعية، بما في ذلك ميدان رابطة الدول المستقلة.
Disclosures
لا يوجد تضارب المصالح المالية. الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
الكتاب يود أن يشكر بيير ستال، أوتيكون الطبية، نيس، فرنسا، لتوفير "منصة التحفيز الحيوان" والمشورة على نماذج التحفيز، وجيمس باء فالون وأندرو ك. الحكمة من معهد بيونيك، ملبورن، أستراليا، للمشورة الجراحية . وأيد هذا العمل بمنحه من "مؤسسة العلوم الوطنية السويسرية" (منحة نقل منسق الإغاثة الطارئة إلى T.R.B.).
Materials
| Name | Company | Catalog Number | Comments |
| Hardware | |||
| Sound-proof booth | IAC Acoustics, Winchester, UK | Mac-2 Enclosure RF Shielded Box 2A | |
| MF1 Speaker | Tucker Davis Technologies (TDT), FL, USA | ||
| PCB microphone | PCB Piezotronics, Inc, NY, USA | Model 378C01 | |
| Low impedance headstage | TDT, FL, USA | RA4LI | |
| Medusa pre-amplifier | TDT, FL, USA | RA4PA | |
| RZ6 auditory processor | TDT, FL, USA | ||
| Animal Stimulator Platform | ASP, Oticon Medical, Nice, France | ||
| Multimeter | Fluks | #115 | |
| Surgical equipment | |||
| Closed-loop heating pad | FHC, Inc. ME, USA | ||
| Eye ointment | Alcon, CH | Lacrinorm Augengel | |
| Acoustic foam | Otoform Ak, Dreve Otoplastik GmbH | #464 | |
| Disposable subdermal needle electrodes | Horizon, Rochester Electro-Medical Inc. | S83018-R9, 27G | |
| Self-retaining retractor tool (Mini Collibri Retractor) | Fine Science Tools | #17000-01 | |
| Suction wedges | Agnthos, SE | #42-886-460 | |
| Absorbable paper point (Medium) | WPI, FL, USA | #504182 | |
| Intracochlear electrode array | Bionics Institute, Melbourne, Australia | 4 channel | |
| Spongostan Standard | Ferrosan Medical Devices | #MS0002 | |
| Tissue glue. Loctite 4161 Superbond | Henkel | Part No 19743 | |
| Animal Stimulator Platform (ASP) | Oticon Medical, Nice, France | ||
| Drugs/chemicals | |||
| Ketamine (Narketan) | Provet AG, CH | 100mg/mL, #VQ_320265 | |
| Xylazine (Rompun) | Provet AG, CH | Inj Diss 2%, # 1315 | |
| Bupivacaine | Compendium, CH | Bupivacain Sintetica inj Diss 0.5% | |
| Atropine (Atropinesulfat Amino) | Amino AG, CH | 1 mg/mL | |
| Betadine (Povidone/iodine) | Provedic, CH | ||
| Neomycin (Neomycin trisulfate salt) | Sigma | N1876-25G, Lot#WXBB7516V | |
| Software | |||
| BioSigRZ | TDT, FL, USA | ||
| Matlab | MathWorks, MA, USA | ||
| ASP software | Oticon Medical, Nice, France |
References
- The-Ear-Foundation. . Cochlear Implants Update. , (2018).
- Fallon, J. B., Irvine, D. R. F., Shepherd, R. K. Cochlear Implants and Brain Plasticity. Hearing Research. 238 (1-2), 110-111 (2008).
- Pfingst, B. E., et al. Neurotrophin Gene Therapy in Deafened Ears with Cochlear Implants: Long-term Effects on Nerve Survival and Functional Measures. Journal of the Association for Research in Otolaryngology. 18 (6), 731-750 (2017).
- Miller, C. A., et al. Electrical excitation of the acoustically sensitive auditory nerve: single-fiber responses to electric pulse trains. Journal of the Association for Research in Otolaryngology. 7 (3), 195-210 (2006).
- Irving, S., et al. Cochlear implantation for chronic electrical stimulation in the mouse. Hearing Research. 306, 37-45 (2013).
- Soken, H., et al. Mouse cochleostomy: a minimally invasive dorsal approach for modeling cochlear implantation. Laryngoscope. 123 (12), E109-E115 (2013).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hearing Research. 312, 81-90 (2014).
- Hartmann, R., Topp, G., Klinke, R. Discharge patterns of cat primary auditory fibers with electrical stimulation of the cochlea. Hearing Research. 13 (1), 47-62 (1984).
- Sato, M., Baumhoff, P., Kral, A. Cochlear Implant Stimulation of a Hearing Ear Generates Separate Electrophonic and Electroneural Responses. The Journal of Neuroscience. 36 (1), 54-64 (2016).
- Pfingst, B. E., Spelman, F. A., Sutton, D. Operating ranges for cochlear implants. Annals of Otology, Rhinology & Laryngology. 89 (2), (1980).
- Miller, C. A., Hu, N., Zhang, F., Robinson, B. K., Abbas, P. J. Changes across time in the temporal responses of auditory nerve fibers stimulated by electric pulse trains. Journal of the Association for Research in Otolaryngology. 9 (1), 122-137 (2008).
- Shepherd, R. K., Javel, E. Electrical stimulation of the auditory nerve. I. Correlation of physiological responses with cochlear status. Hearing Research. 108 (1-2), 112-144 (1997).
- Akil, O., Oursler, A. E., Fan, K., Lustig, L. R. Mouse Auditory Brainstem Response Testing. Bio Protocol. 6 (6), (2016).
- Willott, J. F. Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current Protocols in Neuroscience. Chapter 8 (Unit 8.21B. , (2006).
- TDT. . ABR User Guide: A Guide to ABR Testing with the System 3 RZ6. , (2017).
- Muller, M., von Hunerbein, K., Hoidis, S., Smolders, J. W. A physiological place-frequency map of the cochlea in the CBA/J mouse. Hearing Research. 202 (1-2), 63-73 (2005).
- Cushing, S. L., Papsin, B. C., Gordon, K. A. Incidence and characteristics of facial nerve stimulation in children with cochlear implants. Laryngoscope. 116 (10), 1787-1791 (2006).
- Berrettini, S., Vito, D. A., Bruschini, L., Passetti, S., Forli, F. Facial nerve stimulation after cochlear implantation: our experience. Acta Otorhinolaryngologica Italica. 31 (1), 11-16 (2011).
- Hu, H., Kollmeier, B., Dietz, M. Reduction of stimulation coherent artifacts in electrically evoked auditory brainstem responses. Biomedical Signal Processing and Control. 21, 74-81 (2015).
- Wiegner, A., Wright, C. G., Vollmer, M. Multichannel cochlear implant for selective neuronal activation and chronic use in the free-moving Mongolian gerbil. Journal of Neuroscience Methods. 273, 40-54 (2016).
- Hessel, H., et al. Meriones unguiculatus (Gerbil) as an animal model for the ontogenetic cochlear implant research. American Journal of Otolaryngology. 18 (S21), (1997).
- Pinilla, M., Ramirez-Camacho, R., Jorge, E., Trinidad, A., Vergara, J. Ventral approach to the rat middle ear for otologic research. Otolaryngology Head Neck Surgery. 124 (5), 515-517 (2001).
- King, J., Shehu, I., Roland, J. T., Svirsky, M. A., Froemke, R. C. A physiological and behavioral system for hearing restoration with cochlear implants. Journal of Neurophysiology. 116 (2), 844-858 (2016).
- Lu, W., Xu, J., Shepherd, R. K. Cochlear implantation in rats: a new surgical approach. Hearing Research. 205 (1-2), 115-122 (2005).
- Poirrier, A. L., et al. Ototoxic drugs: difference in sensitivity between mice and guinea pigs. Toxicology Letters. 193 (1), 41-49 (2010).
- Wu, W. J., et al. Aminoglycoside ototoxicity in adult CBA, C57BL and BALB mice and the Sprague-Dawley rat. Hearing Research. 158 (1-2), 165-178 (2001).
- Taylor, R. R., Nevill, G., Forge, A. Rapid hair cell loss: a mouse model for cochlear lesions. Journal of the Association for Research in Otolaryngology. 9 (1), 44-64 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved