Method Article
ניתוח שתל שבלולי והקלטות תגובה חשמלית עורר גזע המוח בעכברים C57BL/6
In This Article
Summary
מודלים חייתיים של שתלי שבלול יכול לקדם את הידע בסיסי טכנולוגיים לטיפול אובדן שמיעה sensorineural קבוע עם גירוי חשמלי. מחקר זה מציג פרוטוקול כירורגי מחריש אוזניים חריפה, שבלול השרשה של מערך אלקטרודה עכברים, כמו גם את הערכת תפקודי עם גזע המוח השמיעתית תגובה.
Abstract
שתלי שבלול (CIs) הם התקנים neuroprosthetic יכול לספק חוש שמיעה אנשים חרשים. עם זאת, מודיע אין אפשרות לשחזר כל ההיבטים של השמיעה. שיפור הטכנולוגיה השתל נדרש אם משתמשים CI הם תופסים את המוסיקה ולבצע בסביבות טבעי יותר, כמו לשמוע את קול עם מתחרות דברנים, השתקפויות של צלילים אחרים. שיפור כזה דורש חיות ניסוי כדי להבין טוב יותר את המנגנונים של גירוי חשמלי ב שבלול, התגובות במערכת השמיעה לגמרי. העכבר הוא מודל אטרקטיבי יותר ויותר בגלל הדגמים גנטיים רבים זמינים. עם זאת, שימוש מוגבל של מין זה כמודל CI הוא בעיקר בשל הקושי של השתלת אלקטרודה קטנה מערכים. פרטים נוספים אודות הליך כירורגי ולכן הם עניין רב להרחיב את השימוש של עכברים במחקר CI.
בדו ח זה, נתאר בפירוט את פרוטוקול מחריש אוזניים חריפה, שבלול השרשה של מערך אלקטרודה ב המתח העכבר C57BL/6. אנו מדגימים את היעילות פונקציונלי של הליך זה עם תגובה חשמלית עורר גזע המוח (eABR), להראות דוגמאות של גירוי עצב הפנים. לבסוף, נדון גם את החשיבות של לרבות הליך מחרישת אוזניים בעת שימוש שימוע בדרך כלל בעלי חיים. מודל העכבר זה מספק הזדמנות חזקה כדי לחקור מנגנונים גנטיים ולא הנוירוביולוגי שיהיו רלוונטיות למשתמשים CI.
Introduction
שתלי שבלול (CIs) הם התקנים אלקטרוניים יכול לספק חוש שמיעה לאנשים עם אובדן שמיעה חמור ועמוק. היא משתמשת אלקטרודות שהושתל בניתוח שבלול האוזן הפנימית כדי ישירות לגרות את עצב השמיעה. עד היום, המודיע הוא הפרוטזה חושית המצליחות ו עזר יותר מ 600,000 אנשים ברחבי העולם1. עם זאת, למכשיר יש חסרונות. קודם כל, היתרונות המסופקים על ידי המכשיר להשתנות במידה רבה בקרב הנמענים. שנית, דיבור סביבות רעש ומוסיקה עדיין גרוע נתפסים על ידי רוב המשתמשים CI.
במשך שנים רבות, חייתיים שימשו כדי להבין טוב יותר בעיות אלה במחקר CI וכדי לשפר את הבטיחות והיעילות של המכשירים. הדגמים נותן ערך תובנה מספר תופעות, כמו פלסטיק שינויים במוח המתרחשים בעקבות ההשתלה CI2, ההשפעה של טיפול גנטי כדי לשמר את מבחן3ולמאפיינים ביופיזיקלי של החלת עצב השמיעה מגורה חשמלית4, בין דוגמאות רבות אחרות.
עכברים הם אורגניזם מודל חזק בשל הזמינות גדול של דגמים גנטיים של חירשות. יתרונות נוספים כוללים את היכולת לתפעל את הגנום העכבר (למשל, באמצעות מערכת CRISPR-Cas), ההזדמנות להשתמש הדמיה טכניקות ללמוד מנגנונים, במיוחד באזור המוח, רבייה גבוהה קצב התפתחות מהירה מתקדמות, קל לגידול וטיפול. האתגרים הטכניים העיקריים בביצוע ניתוחים CI בעכברים הם גודלו הקטן של שבלול הנוכחות של עורק גדול stapedial (SA). ה-SA בדרך כלל נעלם במהלך התפתחות בבני אדם אך נמשכת לאורך החיים במספר של מכרסמים, לרבות עכברים, חולדות, גרבילים. ה-SA פועל מתחת הנישה החלון העגול, אשר מסבך את הגישה שבלול ומגבירה את הסיכון כירורגי.
מחקרים קודמים הראו את הכדאיות של CI השרשה ב עכברים5,6,7. אירווינג ואח הוכיח כי גירוי חשמלי intracochlear כרונית יכולה להיות מושגת עד לחודש אחד. גירוי אקוטי גם בוצעה אך ההקלטות לא הוצגו. הם הראו כי cauterizing את העורק stapedial היה אין השפעה משמעותית על סף שמיעה או מספר הנוירונים גנגליון ספירלה וכי יישום מקומי של neomycin aminoglycoside, תרופה ototoxic, היה מחריש אוזניים הליך יעיל ב עכברים5. Soken ואח תיאר גישה הגבי ששונה כדי שבלול העכבר מבעד לחלון העגול כדי כדאי לשמר את מצב השמיעה6. בעקבות החדרת מכשיר האזנה פלטינה-אירידיום, מבחן משמעותי נצפתה עם מענה גזע המוח מוגברת (ABR) סף 28 dB. פליטת Otoacoustic (OAE) אבדו בבעלי חיים עם גדול ABR הסף משמרות6. Mistry et al. נבדקו ההשפעות histopathological פונקציונלי של ההשתלה בהיעדר גירוי חשמלי7. אף-על-פי שמיעה השתמרו בעכברים 3 עד 6 חודשים מושתל בתדרים נמוכים, השרשה גרם רקמה דמוית פיברוזיס סביב השתל, osteoneogenesis סביב bullostomy7.
בקיצור, מתוך המחקרים שלוש ב- CIs בעכברים, רק אחד מדגים הקלטה פונקציונלי של גירוי CI. אירווינג ועמיתיו ביצע שתי הקלטות אקוטי וכרוני eABR אבל רק הראו נתונים גירוי כרוני של CI5. עם זאת, הדגם כרונית עם מכשיר מושתלת לחלוטין שפותחה על ידי אירווינג et al. הוא טכנית מאתגר. עדיין לא ידוע אם גירוי CI חריפה, הן פחות מאתגר ומהיר, ניתן להשיג תוצאות דומות.
CIs נמצאים בשימוש על ידי אנשים עם אובדן שמיעה חמור ועמוק, הנהנים כבר לא מכשירי שמיעה. מודלים עבור משתמשים CI ולכן צריך לכלול הליך מחרישת אוזניים בדרך כלל בדיון בעלי חיים משמשים. סיבה נוספת כדי להחריש שמיעה בעלי חיים היא כי גירוי חשמלי של חרשים או שמיעה שבלול מייצרת תגובות עצביות שונות4,8,9,10,11, 12. גירוי חשמלי של שבלול חירש מפעילה את סיבי עצב השמיעה ישירות ומייצר מענה electroneural (α). הוא מאופיין על-ידי השהיית קצר טווח דינמי קטן8,הפריפריה10. מצד שני, גירוי חשמלי של שבלול שמיעה מרגש גם תאי השיער, בתגובה electrophonic (β) המאופיינת יותר זמן השהיות ארוכות יותר, טווח דינמי גדול4,11. התגובה electrophonic מיוחסת עירור נורמלי של סיבי עצב על ידי תאים שיער הפנימי, התכווצות המושרה חשמלית של תאים שיער החיצוני, דור של גל נוסע4. תגובות Electroneural ו- electrophonic גם תוצאה של שני דפוסי פעילות שונה ב מערכת העצבים המרכזית9. סאטו ואח הקליט הניריונים המוח האמצעי של שפן CI מושתל לפני ואחרי מחריש אוזניים עם neomycin, מה שמבטל את התרומה electrophonic. הם הראו כי השיפוע של הפונקציה rate ברמת היה תלול יותר, ירי המחירים גבוהים יותר בתנאי deafened לעומת מצב השמיעה9. לפיכך, בהתאם שאלת המחקר כאמור, חשוב לקחת בחשבון כולל מחריש אוזניים electrophonic נפרדים, electroneural תגובות על גירוי חשמלי של עצב השמיעה.
כאן, אנו מתארים הליך מחריש אוזניים חריפה, ההשתלה שבלול של מערך אלקטרודה ב עכבר, כמו גם את ההקלטה פונקציונלי של גירוי חשמלי intracochlear עם תגובה חשמלית עורר גזע המוח (eABR).
Protocol
כל ההליכים בוצעו על פי הנחיות אוניברסיטת בזל, שוויץ, טיפול בבעלי חיים ו. הם היו ברשיון של המשרד הווטרינרי של קנטון באזל, שוויץ.
הערה: עכברים בוגרים C57BL/6, בגילאי 8-12 שבועות (משקל 20-30 גרם), נעשה שימוש במחקר זה.
האוזן השמאלית משמשת האוזן ניסיוני. האוזן הימנית משמש פקד אינטרה-בעלי חיים, והוא אינה משתנה בניתוח.
1. ההליכים לפני הניתוח
-
להרדים את בעלי חיים 30 דקות לפני הניתוח באמצעות הזרקה התוך הצפק (i.p.) של קטמין/חריגות השירותים הווטרינריים (80 מ"ג/ק"ג קטמין, חריגות השירותים הווטרינריים 16 מ"ג/ק"ג, i.p., נפח מוזרק ב 10 μL/גרם משקל).
- תוספת הרדמה במקרה הצורך, כפי נשפט על ידי דוושת חיובית, רפלקס (הבוהן-צביטה) palpebral תנועת נכון, עם מינון נמוך של קטאמין (45 מ"ג/ק"ג, i.p., מוזרק ב 10 μL/גרם משקל). סוכנים, משטרים במינון הרבה לכל המוסדיים הנחיות.
הערות: באופן כללי, החיה יהיה עליך לקבל זריקה כל 45 – 60 דקות עם הסוכן והמנה המשטר. הזמן הממוצע של החתך הראשוני לסגר סביב האלקטרודות מושתל היא בדרך כלל 1-1.5 שעות.
- תוספת הרדמה במקרה הצורך, כפי נשפט על ידי דוושת חיובית, רפלקס (הבוהן-צביטה) palpebral תנועת נכון, עם מינון נמוך של קטאמין (45 מ"ג/ק"ג, i.p., מוזרק ב 10 μL/גרם משקל). סוכנים, משטרים במינון הרבה לכל המוסדיים הנחיות.
- בדוק הרדמה מלאה של החיה מסומן על ידי קצב נשימה רגיל וחוסר הבוהן-קמצוץ רפלקסים. לשמור על רמה זו של הרדמה.
- לשמור על טמפרטורת גוף של החיה ב 36.6 מעלות צלזיוס עם כרית חימום לולאה סגורה. להחיל משחה העין כדי למנוע התייבשות של הקרנית. זה גם תביא להשמטת רפלקס מצמוץ של החיה, אשר יכול להוסיף רעש recoding.
- לנהל שיכוך כאב מקומי באמצעות הזרקה תת עורית (ש) של נמשך/לידוקאין (0.1 מ"ג/מ"ל נמשך, לידוקאין 0.4 מ"ג/מ"ל, 0.1 מ"ל מנוהל ספורטינג) לאורך קו החתך נועד כדי למזער את אי נוחות כירורגית כלשהי. סוכנים, משטרים במינון הרבה לכל המוסדיים הנחיות.
- להזריק אטרופין מוסקריניים אנטגוניסט (atropinesulfate אמינו, 0.1 מ"ג/מ"ל, 20 μL מנוהל ספורטינג, מומס PBS) בצוואר כדי להפחית את הפרשת ריר, כדי להקל על הנשימה. סוכנים, משטרים במינון הרבה לכל המוסדיים הנחיות.
2. קדם מחריש אוזניים אקוסטית גזע המוח השמיעתית (aABR)
הערה: aABR משמש כדי למדוד את מצב השמיעה לפני ואחרי מחריש אוזניים. הבדיקות נעשות על האוזן השמאלית, בתא חשמלית מסוככים אטומים לרעש. אנו ממליצים לבדוק, אחר כך שתל האוזן השמאלית עבור אדם ימני. ניתן למצוא פרטים נוספים על ABR בעכברים13,14. טכנולוגיות דיוויס טאקר (TDT) חומרה ותוכנה (BioSig) משמשים כדי להקליט ABR אך ניתן להשתמש במערכות אחרות.
- לחסום את האוזן (מימין) contralateral עם קצף אקוסטית כדי לבודד את התגובה ABR מהאוזן (שמאל) חולשת. מכניסים את הקצף מזרק 1 מ"ל ולהזריק אותו תעלת האוזן נכון של העכבר כדי לכסות את תעלת האוזן כל עם קצף (0.1-0.2 מ"ל של קצף). ודא החותמות מזרק צמוד לאוזן כך הקצף מקבל כל הדרך לתוך תעלת האוזן.
- מקם את הרמקול 10 ס מ מן האוזן השמאלית.
הערה: הרמקול עבור תוכנית התקנה זו היה מכויל באמצעות מיקרופון PCB כפי שמתואר refefence15. - לנקות את האלקטרודות ABR עם 70% אתנול פתרון. מקם את האלקטרודות מתחת לעור: פעיל (Ch1) על הקודקוד, הפניה (-) מתחת פינה של האוזן חולשת על הקרקע בו ברגליים האחוריות (איור 1).
- לחבר את הראש-שלב של קדם מגבר המעבד השמיעה דרך הנמל סיבים אופטיים.
-
בדוק את אימפדנס של הפעיל ואת התייחסות אלקטרודה.
- אם מעל 3 אוהם עכבה, לארגן מחדש אותם ולקחת מחדש את המדידה. ההקלטות הטובה ביותר מתקבלים כאשר האלקטרודות יש עכבה אותו. סגור בתא אטומים.
- מציגים גירוי לחץ ולהקליט ABR בתנאי שדה חינם עם מעבדים שמיעתיים מורכבים, תוכנה. לתקנן את הגירוי לחץ בתוכנה: 0.1 ms monophasic ערוץ אחד לחיצות מוצגים ב 21 הרץ; לחץ על רמת תקטן מ- 90 dB SPL כדי 10 dB SPL 10 dB שלבים; 10 ms הקלטה חלון. ממוצע בסך הכל 512 תגובות בכל רמה dB.
- להחיל מסנן lowpass 2000 הרץ ו- 300 Hz highpass מסנן במצב לא מקוון כדי להפחית את הרעש בהקלטה באמצעות סקריפט Matlab בהזמנה אישית.
- לקבוע סף ABR כרמת ה-dB הנמוך עם לזיהוי ABR גל תגובה (איור 2, איור 3).
3. ניתוח
הערה: משתמשים לכלול מספריים, אזמל, זוג מלקחיים מתכתיים עם טיפים ישרים או מעוקלים, כלי המדחק רקמות, מספר פלחי היניקה ונקודות נייר שנספג. הניתוח מתבצע על האוזן השמאלית.
- לשים את העכבר על הצד השמאלי שלו. הימנע מתח הפיתוליות מיותר על חוליות צוואר הרחם. הקפד לשמור על הגוף ישר שתפקח את דרכי הנשימה.
- לחתוך את הפרווה מאחורי האוזן השמאלית עם מספריים (או לגלח את. זה עם מכונת הגילוח) לחשוף את העור. לחטא את העור עם פתרון אתנול 70% ו- betadine (povidone יוד).
- תחת הגדלה מיקרוסקופית (16 x), עושים חתך פוסט אוריקולארית 1 – 1.5 ס"מ עם האזמל.
- לעבור הגדלה מיקרוסקופית גבוה יותר (25 x).
- לבצע עמום דרך שכבת השומן התת עורית, אשר ניתן של עובי משתנה, עם מלקחיים.
הערה: היה זהיר בעת נקרע. בזמן עורק הצוואר שחוצה את האזור הזה. נזק למבנה הזה יכול לגרום לדימום יתר. - . משכי את שריר שריר הצוואר כדי לחשוף את קרום העצם בולה tympanic. להשתמש את עצב הפנים כנקודת ציון אנטומי מפתח לסייע זיהוי של בולה השמיעה. עצב הפנים יגלוש מסביב לקצה האחורי/הגבי של שריר שריר הצוואר ופועל rostrally לאורך תעלת האוזן לכיוון פינה. בעדינות, הצב את הכלי המדחק עצמית שהגנו על החתך כדי להקל על הגישה בולה (איור 4).
- להסיר את הרקמה המכסים האזור הגבי-medio בולה כדי לאפשר הדמיה ברורה של הרכס בין בולה את התהליך הפטמתי.
- סובב בעדינות מחט 30 G לנקב את בולה ולעשות חור (bullostomy) בצד האחורי סופריור של הרכס (העצם הוא דק יותר בצד הזה). לחלופין, השתמש תרגיל ניתוח שיניים.
הערה: זה, השלבים הבאים יכול להיעשות עם הגדלה מיקרוסקופית גבוהה יותר (40 x) אם מועדף. כמו כן, לשנות את המיקום של המיקרוסקופ במידת הצורך. חשוב להגדיל את תצוגת כירורגי של המרחב באוזן התיכונה. -
הרחב את bullostomy על ידי צובט חתיכות עצם קטן באמצעות מלקחיים משופעת בסדר לחשוף את חלל האוזן התיכונה. הארך את bullostomy dorsally לקראת תהליך פטמתי הנישה החלון העגול ברור עודפי העצם. העורק stapedial, סניף של העורק, נוסע הגחון הנישה החלון העגול.
- להיזהר לא לפגוע בכלי כמו דימום יתר עלולה להיות קטלנית. ניתן לעצור דימומים קטנים על ידי לחיצה על חתיכה קטנה של spongostan בחלל האוזן הפנימית.
- להרחיב את bullostomy לעבר הכיוון הקדמי סופריור להמחיש באוזן, עצם האוזן התיכונה מחוברת אל החלון הסגלגל.
- הסר באוזן עם מלקחיים לחשוף את החלון הסגלגל.
4. חלון עגול יישום של הסוכן Ototoxic
- בעדינות לנקב בקרום חלון וחלון אליפסה עגול באמצעות מחט 30 G קהות. בדוק שאת perilymph שנגמר.
- לאט לאט perfuse neomycin משקל/נפח 0.05% מומס PBS (מותאם pH 7.4) דרך החלון הסגלגל. הנוזל צריך לשטוף החוצה מבעד לחלון העגול. חזור על הפעולות אותן בחלון עגול. להיזהר לא לפגוע המבנים עצם חלון עם מחט נהגה perfuse.
- מניחים חתיכה קטנה (1 מ מ2) spongostan טבולים neomycin בתוך הגומחה חלון וחלון אליפסה עגול.
- להסיר את הכלי המדחק, סוגרים את החתך ולהמתין 30 דקות.
5. פוסט מחרישת אוזניים ABR אקוסטי
- רשום aABR בצורה דומה כמו לפני מחריש אוזניים (שלבים 2.2 ל 2.8) (2b איור, איור 3).
6. החדרת CI האלקטרודות
הערה: האלקטרודות intracochlear מורכבת ארבע להקות פלטינה (Ø0.2 מ"מ) עם חוט parylene פלטינום/iridum מבודדים ממוגן צינור סיליקון (איור 5).
- מקם את הכלי המדחק החתך כדי לגשת מחדש את בולה.
- הכנס את האלקטרודות לחלון העגול (סקאלה טימפני) בעומק איפה הטבעתth פלטינה 4 נמצא ממש בתוך חלון עגול. זה נותן עומק של ההכנסה ~ 2 מ מ, המתאים למשרת intracochlear ~ 30 kHz16.
- סליל החוט הראשי בתוך בועה והדבק חוט הרקמה מעל בולה. סלילה החוט מסייעת לשמור את המערך במקום לאורך כל הניסוי.
- בזהירות להסיר את המדחק וסגור את הכניסה עם דבק רקמות.
- עושים חתך קטן (0.5 מ"מ) בצוואר בניצב הקו בין איפה הפעיל אלקטרודות ABR הפניה באמצעות מספריים רקמה. מניחים את הכדור הקרקע פלטינה בכיס תת עורית וסגור את חתך קטן עם רקמת דבק (איור 6).
- חבר המנהלים מערך אלקטרודה פלטפורמת ממריץ חיה.
7. חשמלי גזע המוח השמיעתית (eABR)
הערה: פלטפורמה ממריץ חיה (ASP) משמש חשמלית לגרות את האלקטרודות. ניתן להשתמש אספקה ומערכות תוכנה אחרים.
- במקום ABR האלקטרודות כמו בעבר (שלבים 2.3-2.5) (איור 6).
- פתח את תוכנת ASP ולהגדיר את הפרדיגמה גירוי חשמלי הדופק. אנו משתמשים של פולסים מאוזנת מבחינת תשלום biphasic עם μs 50/שלב, 10 μs לאטמוספרה הפער הציג ב 23.3 פולסים בשנייה (pps). גירוי חשמלי מועבר בתצורה אלקטרודה monopolar עם הגדלת רמות הנוכחי. סך של 400 תגובות חישוב הממוצע בכל רמה הנוכחי.
- להציג את הרכבות פולס חשמלי ולהקליט את eABR עורר תגובה ללא הרף דרך TDT headstage, קדם מגבר ושמיעתיים מעבד.
- מגרש ולנתח את הנתונים eABR באמצעות סקריפט matlab בהזמנה אישית (איור 7). קובץ ה-script לדוגמה של הקלטה הינם מסופקים ב Supplementary.
8. סוף הניסוי
- בסוף הניסוי, להרדימו בהתאם להנחיות מוסדיים.
- בזהירות לפתוח את החתך ולהסיר את השתל.
- אולטרה-sonicate האלקטרודות במים מזוקקים למשך 10 דקות להסיר את רקמת פסולת.
הערה: השתל ניתן להשתמש בהם מספר פעמים אם האלקטרודות ומתפקד כראוי הניצוח. כדי לבדוק זאת, למדוד את אימפדנס של האלקטרודות עם multimeter כאשר המערך הוא יבש. - אחסן את האלקטרודות במקום יבש.
תוצאות
מטרת מחקר זה היתה לתאר מודל אמין לגירוי CI חריפה העכבר deafened. ספי השמיעה מראש, לאחר ניתוח שימש הבדיקה פונקציונלי של ההליך מחריש אוזניים. יישום מקומי של 0.05% neomycin בחלון סגלגל עגולה, גדל באופן משמעותי ספי השמיעה עורר לחץ על ידי 46 dB ± 6 (neomycin שלאחר לעומת קדם: 30.0 dB ± 3.8 לעומת 75.7 dB ± 3.7, p = 0.0003, לזווג מבחן t, n = 7) (איור 3). האלקטרודות בגודל של עכבר להלן הוכנס לתוך חלון עגול (איור 4, איור 5). סימולציה חשמלי של אלקטרודה intracochlear אמין יכול לייצר פעילות eABR. (איור 7). במקרים מסוימים, גירוי CI הפעיל את עצב הפנים והפיק גל משרעת גבוהה עם השהיה קצרה או ארוכה (איור 8A איור 8 ב', בהתאמה). התגובה השהיה קצרה התאפיינה הגברה מהירה של הגל הרביעי בסביבות 3 ms, סביר להניח שתהיה תגובה ישירה של עצב הפנים. התגובה השהיה ארוכה הופיע בסביבות 5-6 ms והוא צפוי להיות תגובה (myogenic)-השמיעה שריר עורר בעקיפין על ידי עצב הפנים. עצב הפנים תגובות מדווחים לעתים נדירות במחקרים שנעשו בבעלי חיים בספרות אך הוא סיבוך ידוע האנושי CI משתמשים17,18,19. ב באיור 8, גירוי עצב הפנים הופיע ברמות הנוכחיות יחסית בינוני (150-200 μA), שתי חיות שונות. במקרים אחרים, שתי תגובות יכול להופיע אותה חיה ברמה הנוכחית גבוהה מאוד (לא מוצג). אנו ממליצים על הגבלת ברמה הנוכחית של רמות מתחת המראה של גירוי עצב הפנים.
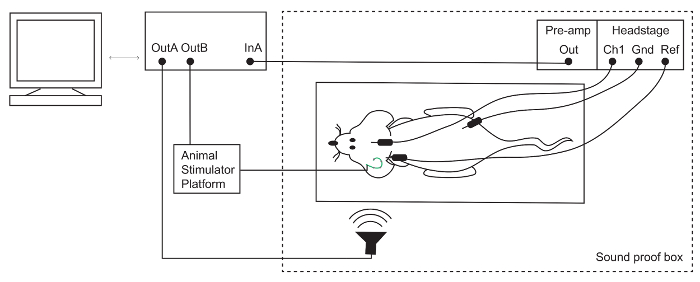
איור 1: הגדרת תגובת גזע המוח השמיעתית (ABR). אלקטרודות שבראשה ממוקמים על הקודקוד (פעיל/ערוץ 1 [Ch1]), מאחורי האוזן חולשת (הפניה [השופט]) ועל הרגל האחוריות (הקרקע [Gnd]) של העכבר anesthetized. אלקטרודה אותות מוגבר, לאחר מכן נרשם על ידי מערכת TDT. גירוי אקוסטיים וחשמליים מוצגים באמצעות מיקרופון, פלטפורמה ממריץ חיה, בהתאמה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
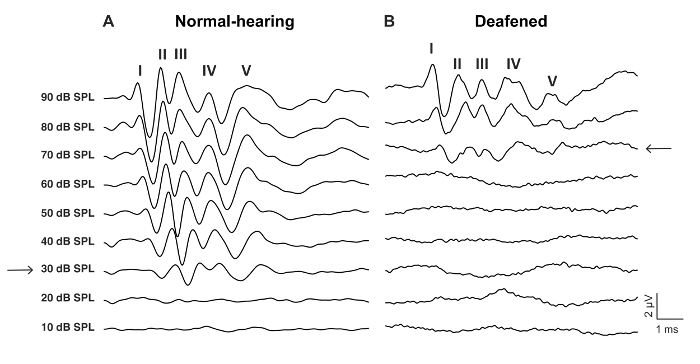
איור 2: נציג aABR גלים ללחוץ על גירוי של עכבר פראי-סוג לפני ואחרי מחריש אוזניים עם 0.05% neomycin. דפוס aABR (א) הדיון הרגיל מאופיין על ידי גלי מתויג-V וסף שמיעה נמוך, כאן 30 dB SPL (חץ). (B) aABR deafened התבנית מראה על סף שמיעה מוגברת, כאן 70 dB SPL (חץ). הגלים של השהיית זמן רב יותר ויש יותר להתעצבן טמפורלית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
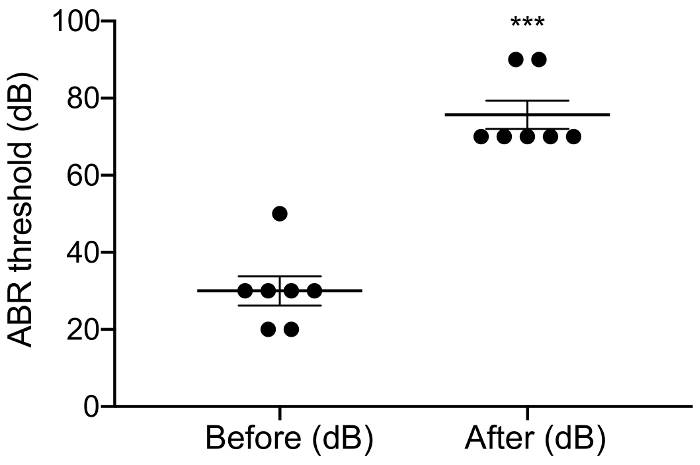
איור 3: סף aABR לפני ואחרי מחריש אוזניים. היישום של neomycin גדל באופן משמעותי aABR ספי 46 dB ± 6. פוסט-neomycin לעומת קדם: 30.0 dB ± 3.8 לעומת 75.7 dB ± 3.7, p = 0.0003, לזווג מבחן t, n = 7. נמצאו שגיאות, שגיאת תקן של האמצעים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
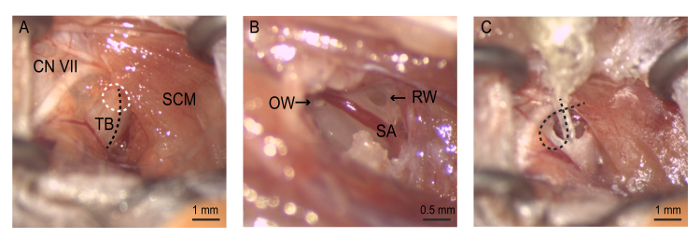
איור 4: הניתוח. (א) החשיפה בולה השמיעה. Bullostomy הוא ביצע (עיגול לבן מנוקד) לאורך הרכס על בולה tympanic (קו מנוקד שחור). (B) bullostomy מאפשר הדמיה של חלון עגול, העורק stapedial, החלון הסגלגל. Neomycin הוא בעדינות סמוקות קודם את החלון הסגלגל, ואז חלון עגול. (ג) האלקטרודה מערך נוסף עד האלקטרודהth 4 נמצא ממש בתוך הנישה החלון העגול. החוט אלקטרודה הוא מתפתל בתוך בועה כדי לשמור את המערך במקום לפני נסגר החתך. CN השביעי = עצבי השביעי (עצב הפנים), אוו = החלון הסגלגל, RW = סביב חלון, SA = עורק stapedial, SCM = שריר שריר הצוואר, TB = בולה tympanic. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5: שתל שבלול העכבר. (א) האלקטרודות intracochlear מורכב ארבע להקות פלטינה במרווחים של מרווח 0.4 מ מ עם קוטר d: 0 [טיפ] (d = 0.21), 1 (d = 0.23), 2 (d = 0.25), 3 (d = 0.27). הרוחב של כל אלקטרודה הוא 0.2 מ מ. החוטים parylene מבודדים פלטינה/אירידיום (90/10) ארבעה מוגנים צינור סיליקון. (B) הגדלה של קצה מערך אלקטרודה (ריבוע אדום מנוקד). את האלקטרודות וכדור הפניה פלטינה מחובר לוח ההדפסה. סרגל קנה מידה = 1 מ מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
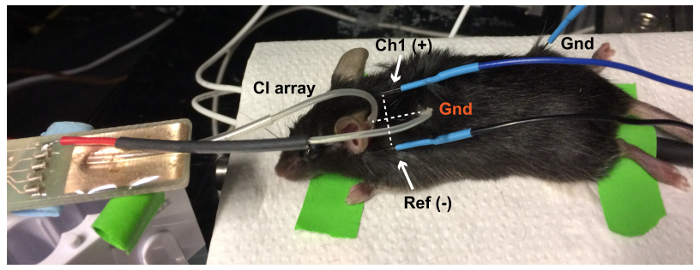
איור 6: הגדרת ABR עורר חשמלית (eABR). הכדור הקרקע CI פלטינה (Gnd, אדום) מונחת בכיס תת עורית בצוואר של העכבר. הקו בין פעיל (Ch1(+)-הקודקוד) ואלקטרודות ABR הפניה (Ref (-) על האוזן חולשת) הוא בניצב הקו בין האלקטרודות את הקרקע על מנת לקבל את התגובה eABR הטובה ביותר. האלקטרודה הקרקע eABR (Gnd, שחור) ממוקמת בו ברגליים האחוריות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
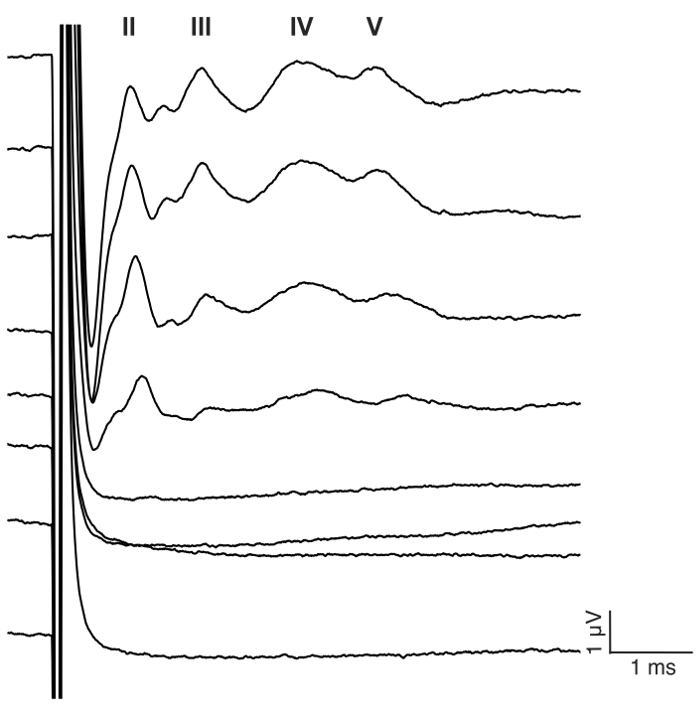
איור 7: נציג eABR גלי CI גירוי ב עכבר deafened. רכבת הדופק biphasic מוצג אלקטרודה #1 בתצורת monopolar ב 23.3 פולסים בשנייה (pps) עם 400 חזרות. ΜA רמה 0-175 גירויים מוצג ב 25 צעדים μA (ראה פרטים גירוי צעד 7.2). ספרות רומיות מציינות מספר הגל eABR. Amplitudes גל של השהיה להגדיל או להקטין, בהתאמה, עם הגדלת ברמה הנוכחית. בדוגמה זו, הגל השני הופיע סביב 1 ms, הגל השלישי בסביבות 2 ms, הגל הרביעי סביב גל ms, 3 V בסביבות 4 ms. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
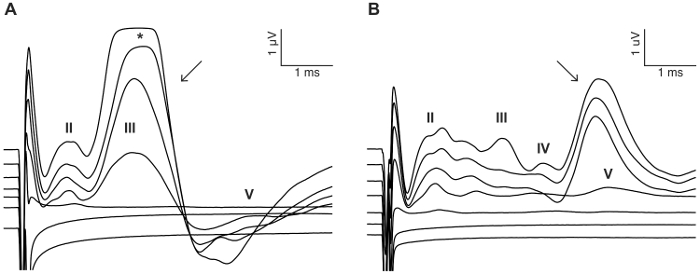
איור 8: דוגמה של גירוי עצב הפנים. במקרים מסוימים, CI גירוי ולהפעיל את עצב הפנים או לעורר תגובה ישירה עם השהיה קצרה (A) (חץ) או עקיף תגובה עם זמן השהיה (B) (חץ). הדוגמאות המוצגות הן מחיות שני מושתל-CI מגורה עם רכבת הדופק biphasic באמצעות 0 – 300 μA ב 50 μA שלבים (ראה פרטים גירוי צעד 7.2). ספרות רומיות מציינות מספרי הגל eABR. * מציין מסיכה של הגל eABR עקב הרוויה של המגבר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כתב יד זה מתאר את הגישה כירורגי מחריש אוזניים חריפה, השרשה שבלולי העכבר, כמו גם את הערכת תפקודי של CI גירוי עם גזע המוח השמיעתית תגובה. למרות שבלול העכבר הקטן ואת הניתוח מאתגר, המודל העכבר CI הוא ריאלי, והוא משמש כלי חשוב במחקר שמיעתי.
עורק stapedial נוכחת האוזן התיכונה של העכבר. העורק מזין את בולה אחוריים-medially, ונוסע נלסון אל הנישה החלון העגול ולאחר מכן עליונית הנישה החלון הסגלגל. בפיתוח ראשוני של דגם העכבר, שחווינו קטלנית טראומה הבאים אינטרה-פעיל דימום העורק stapedial, בעיקר בעת גישה של בועה. כתוצאה מכך, אנחנו הותאם גישה מוגבלת יותר ולגשת אליהם את בולה בשלבים לנתיחה קטנה, המעודנת. אין סיבוכים נוספים עקב דימום לאחר מכן נצפו. למרות העובדה שהחריצה עורק stapedial הזה יש השפעה משמעותית על סף שמיעה או מספר הנוירונים גנגליון ספירלה עכברים5, לדעתנו, זה מיותר כל עוד תשומת לב ודאגה עצומים נלקחים במהלך הניתוח. אנו ממליצים לקחת את הזמן הדרוש כדי לפתח מיומנויות psychomotor בסדר, השג מיומנות טכנית. הזמן הממוצע של החתך הראשוני לסגר סביב האלקטרודות מושתל היא בדרך כלל 1-1.5 שעות.
הניתוח מתואר CI חריפה בעכברים דומה הליך "הגחון" ואת חלון עגול ההכנסה שימוש מכרסמים אחרים, כולל עכברושים, גרבילים20,21,22. מחקרים מכרסמים אחרים ניצלו את "הגישה הגבי" עם cochleostomy התור הבזליים במקום הכניסה חלון עגול, הימנעות SA לחלוטין ולהוספה של המערך יותר עמוקות6,23,24. ההשתלה של אסיפה גירוי כרוני בעכברים עוקב אחר הפעולות כפי שמתואר פרוטוקול זה עם התוספת של רשת שדקרון לתקן את השתל ואת הטיפול לאחר הניתוח5.
האתגרים הטכניים הראשי בעת ביצוע ניתוחים CI בעכברים הם גודלו הקטן של שבלול בהשוואה שבלול של חולדות, גרבילים, ואת נוכחותם של SA גדולים. ה-SA קיים גם בחולדות אבל לא בתוך גרבילים. בנוסף, מאז עכברים קטנים יותר חולדות, גרבילים, הם פגיעים יותר ניתוחים.
כדי למנוע electrophonic תגובות ב eABR הקלטות ומחקות איבוד תאים שיער נמצאו רוב המשתמשים CI, אנחנו deafened את בעלי החיים לפני ההוספה CI. עכברים הם קשה כדי להחריש ototoxically ויוו25 כי ריכוזי aminoglycosides הנדרש כדי לגרום ototoxicity מערכתית יש חלון צר מינון: להוריד מינונים בהתחשב במשך מספר ימים תוצאות אין הפסד תא שיער ואילו זריקה אחת מינון גבוה יותר יכול להיות קטלני26. גם, הרגישות aminoglycosides הוא זן התלויים26. עם זאת, הוכח כי מנה אחת של aminoglycosides בשילוב עם חומר משתן לולאה יכול לייצר תא שיער החיצוני מוגזמת אובדן בעכברים כקבוצת/CaJ ללא השלכות קטלניות27. מוות מושהה תאי שיער הפנימי דווח לחצי cochleae בחן כל27.
כתב יד זה, השתמשנו יישום מקומי של neomycin aminoglycosides בהשראת פרוטוקול הוקמה לאחרונה עבור עכברים C57BL/65. יישום חריפה של neomycin גדל באופן משמעותי את סף השמיעה עורר לחץ 46 dB ± 6.1. למרות עלייה זו הוא גדול יותר מאשר העלייה 35 dB שדווחו על ידי אירווינג. et al. (לעומת טרום הניתוח: 41.6 dB ± 3.3 לעומת 76.6 dB ± 4.4, p = 0.02, n = 3) 5, שהשגנו הסף באותו פוסט מחרישת אוזניים (75.7 dB ± 3.7 לעומת 76.6 dB ± 4.4). neomycin 0.05% נחשב לגרום לאובדן שמיעה, בעיקר על ידי מוות תאים שיער החיצוני מהירה, חלקית כמו איבוד תאים שיער הפנימי לוקח יותר זמן להתרחש27. לכן אפשרי התגובה electrophonic, אשר הוא שנוצר הן על ידי הפנימי, החיצוני תאים שיער4,8,9,10,11,12, הוא רק חלקית חוסל ב deafened בעלי חיים עם מבחן. למרות neomycin 0.05% (משקל/נפח) לא להקטין את מספר הנוירונים גנגליון ספירלה 4 שבועות שלאחר מחריש אוזניים5, זה כבר ידוע אם neomycin בהגדרת חריפה שלנו משפיעה על סיבי עצב השמיעה או מקדם synaptopathy (אובדן הסינפסות בין תאים שיער פנימי סוג אני השמיעה עצבים סיבים). וודאות נוספת היא כי הטיפול neomycin אקטואלי לייצר התפלגות אחידה של נשירת שיער התא לאורכו של שבלול. מחקרים עתידיים נדרשים לענות על שאלות אלה.
לסיכום, המספר הגדל והולך של דגמים גנטיים חירשות האנושית ואת הכלים הביוכימי הזמינים הפוך את העכבר במודל חיה אטרקטיבי למחקר השמיעתי, לרבות בתחום של חבר העמים.
Disclosures
אין אינטרסים כלכליים מתחרים. המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להודות פייר שטל, Oticon רפואי, בניס, צרפת, למתן את החיה גירוי פלטפורמה וייעוץ על גירויים פרדיגמות, ו פאלון B. ג'יימס אנדרו ק' וייז ממוסד שטני, מלבורן, אוסטרליה, לקבלת ייעוץ כירורגי . עבודה זו נתמכה על ידי מענק של קרן המדע הלאומית השוויצרית (ERC מענק העברה T.R.B.).
Materials
| Name | Company | Catalog Number | Comments |
| Hardware | |||
| Sound-proof booth | IAC Acoustics, Winchester, UK | Mac-2 Enclosure RF Shielded Box 2A | |
| MF1 Speaker | Tucker Davis Technologies (TDT), FL, USA | ||
| PCB microphone | PCB Piezotronics, Inc, NY, USA | Model 378C01 | |
| Low impedance headstage | TDT, FL, USA | RA4LI | |
| Medusa pre-amplifier | TDT, FL, USA | RA4PA | |
| RZ6 auditory processor | TDT, FL, USA | ||
| Animal Stimulator Platform | ASP, Oticon Medical, Nice, France | ||
| Multimeter | Fluks | #115 | |
| Surgical equipment | |||
| Closed-loop heating pad | FHC, Inc. ME, USA | ||
| Eye ointment | Alcon, CH | Lacrinorm Augengel | |
| Acoustic foam | Otoform Ak, Dreve Otoplastik GmbH | #464 | |
| Disposable subdermal needle electrodes | Horizon, Rochester Electro-Medical Inc. | S83018-R9, 27G | |
| Self-retaining retractor tool (Mini Collibri Retractor) | Fine Science Tools | #17000-01 | |
| Suction wedges | Agnthos, SE | #42-886-460 | |
| Absorbable paper point (Medium) | WPI, FL, USA | #504182 | |
| Intracochlear electrode array | Bionics Institute, Melbourne, Australia | 4 channel | |
| Spongostan Standard | Ferrosan Medical Devices | #MS0002 | |
| Tissue glue. Loctite 4161 Superbond | Henkel | Part No 19743 | |
| Animal Stimulator Platform (ASP) | Oticon Medical, Nice, France | ||
| Drugs/chemicals | |||
| Ketamine (Narketan) | Provet AG, CH | 100mg/mL, #VQ_320265 | |
| Xylazine (Rompun) | Provet AG, CH | Inj Diss 2%, # 1315 | |
| Bupivacaine | Compendium, CH | Bupivacain Sintetica inj Diss 0.5% | |
| Atropine (Atropinesulfat Amino) | Amino AG, CH | 1 mg/mL | |
| Betadine (Povidone/iodine) | Provedic, CH | ||
| Neomycin (Neomycin trisulfate salt) | Sigma | N1876-25G, Lot#WXBB7516V | |
| Software | |||
| BioSigRZ | TDT, FL, USA | ||
| Matlab | MathWorks, MA, USA | ||
| ASP software | Oticon Medical, Nice, France |
References
- The-Ear-Foundation. . Cochlear Implants Update. , (2018).
- Fallon, J. B., Irvine, D. R. F., Shepherd, R. K. Cochlear Implants and Brain Plasticity. Hearing Research. 238 (1-2), 110-111 (2008).
- Pfingst, B. E., et al. Neurotrophin Gene Therapy in Deafened Ears with Cochlear Implants: Long-term Effects on Nerve Survival and Functional Measures. Journal of the Association for Research in Otolaryngology. 18 (6), 731-750 (2017).
- Miller, C. A., et al. Electrical excitation of the acoustically sensitive auditory nerve: single-fiber responses to electric pulse trains. Journal of the Association for Research in Otolaryngology. 7 (3), 195-210 (2006).
- Irving, S., et al. Cochlear implantation for chronic electrical stimulation in the mouse. Hearing Research. 306, 37-45 (2013).
- Soken, H., et al. Mouse cochleostomy: a minimally invasive dorsal approach for modeling cochlear implantation. Laryngoscope. 123 (12), E109-E115 (2013).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hearing Research. 312, 81-90 (2014).
- Hartmann, R., Topp, G., Klinke, R. Discharge patterns of cat primary auditory fibers with electrical stimulation of the cochlea. Hearing Research. 13 (1), 47-62 (1984).
- Sato, M., Baumhoff, P., Kral, A. Cochlear Implant Stimulation of a Hearing Ear Generates Separate Electrophonic and Electroneural Responses. The Journal of Neuroscience. 36 (1), 54-64 (2016).
- Pfingst, B. E., Spelman, F. A., Sutton, D. Operating ranges for cochlear implants. Annals of Otology, Rhinology & Laryngology. 89 (2), (1980).
- Miller, C. A., Hu, N., Zhang, F., Robinson, B. K., Abbas, P. J. Changes across time in the temporal responses of auditory nerve fibers stimulated by electric pulse trains. Journal of the Association for Research in Otolaryngology. 9 (1), 122-137 (2008).
- Shepherd, R. K., Javel, E. Electrical stimulation of the auditory nerve. I. Correlation of physiological responses with cochlear status. Hearing Research. 108 (1-2), 112-144 (1997).
- Akil, O., Oursler, A. E., Fan, K., Lustig, L. R. Mouse Auditory Brainstem Response Testing. Bio Protocol. 6 (6), (2016).
- Willott, J. F. Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current Protocols in Neuroscience. Chapter 8 (Unit 8.21B. , (2006).
- TDT. . ABR User Guide: A Guide to ABR Testing with the System 3 RZ6. , (2017).
- Muller, M., von Hunerbein, K., Hoidis, S., Smolders, J. W. A physiological place-frequency map of the cochlea in the CBA/J mouse. Hearing Research. 202 (1-2), 63-73 (2005).
- Cushing, S. L., Papsin, B. C., Gordon, K. A. Incidence and characteristics of facial nerve stimulation in children with cochlear implants. Laryngoscope. 116 (10), 1787-1791 (2006).
- Berrettini, S., Vito, D. A., Bruschini, L., Passetti, S., Forli, F. Facial nerve stimulation after cochlear implantation: our experience. Acta Otorhinolaryngologica Italica. 31 (1), 11-16 (2011).
- Hu, H., Kollmeier, B., Dietz, M. Reduction of stimulation coherent artifacts in electrically evoked auditory brainstem responses. Biomedical Signal Processing and Control. 21, 74-81 (2015).
- Wiegner, A., Wright, C. G., Vollmer, M. Multichannel cochlear implant for selective neuronal activation and chronic use in the free-moving Mongolian gerbil. Journal of Neuroscience Methods. 273, 40-54 (2016).
- Hessel, H., et al. Meriones unguiculatus (Gerbil) as an animal model for the ontogenetic cochlear implant research. American Journal of Otolaryngology. 18 (S21), (1997).
- Pinilla, M., Ramirez-Camacho, R., Jorge, E., Trinidad, A., Vergara, J. Ventral approach to the rat middle ear for otologic research. Otolaryngology Head Neck Surgery. 124 (5), 515-517 (2001).
- King, J., Shehu, I., Roland, J. T., Svirsky, M. A., Froemke, R. C. A physiological and behavioral system for hearing restoration with cochlear implants. Journal of Neurophysiology. 116 (2), 844-858 (2016).
- Lu, W., Xu, J., Shepherd, R. K. Cochlear implantation in rats: a new surgical approach. Hearing Research. 205 (1-2), 115-122 (2005).
- Poirrier, A. L., et al. Ototoxic drugs: difference in sensitivity between mice and guinea pigs. Toxicology Letters. 193 (1), 41-49 (2010).
- Wu, W. J., et al. Aminoglycoside ototoxicity in adult CBA, C57BL and BALB mice and the Sprague-Dawley rat. Hearing Research. 158 (1-2), 165-178 (2001).
- Taylor, R. R., Nevill, G., Forge, A. Rapid hair cell loss: a mouse model for cochlear lesions. Journal of the Association for Research in Otolaryngology. 9 (1), 44-64 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved