Method Article
Cochlea-Implantat-Chirurgie und elektrisch evozierten Auditory Brainstem Response Aufnahmen bei C57BL/6 Mäusen
In diesem Artikel
Zusammenfassung
Tiermodelle der Cochlea-Implantate können Kenntnisse über die technologischen Grundlagen für die Behandlung von permanenten Schallempfindungs-Schwerhörigkeit mit elektrischer Stimulation voraus. Diese Studie bietet eine chirurgische Protokoll für akute ohrenbetäubend und Cochlea-Implantation von Elektroden-Array in Mäusen als auch die funktionale Bewertung mit auditory Brainstem Response.
Zusammenfassung
Cochlea-Implantate (CIs) sind Neuroprosthetic Geräte, die ein Gefühl des Hörens gehörlosen Menschen zukommen lassen können. Eine CI kann jedoch nicht alle Aspekte des Hörens wiederherstellen. Verbesserung der Implantat-Technologie ist erforderlich, wenn CI-Nutzer Musik wahrnehmen und führen Sie in natürlichen Umgebungen, z. B. Anhörung eine Stimme mit konkurrierenden Talker, Reflexionen und andere Geräusche. Eine solche Verbesserung erfordert Versuchstiere, die Mechanismen der Elektrostimulation in der Cochlea und seine Reaktionen in der gesamten auditorischen System besser zu verstehen. Die Maus ist ein zunehmend attraktives Modell aufgrund der viele genetische Modelle zur Verfügung. Die begrenzte Verwendung dieser Spezies als ein CI-Modell ist jedoch vor allem aufgrund der Schwierigkeiten der kleinen Elektroden implantieren. Weitere Informationen zu den chirurgischen Eingriff sind daher von großem Interesse für die Verwendung von Mäusen in der CI-Forschung zu erweitern.
In diesem Bericht beschreiben wir ausführlich das Protokoll für akute ohrenbetäubend und Cochlea-Implantation von Elektroden-Array in der C57BL/6-Maus-Belastung. Wir zeigen die funktionelle Wirksamkeit dieses Verfahrens mit elektrisch evozierten auditory Brainstem Response (eABR) und zeigen Beispiele der Stimulation des Nervus facialis. Schließlich diskutieren wir auch die Bedeutung der Einbeziehung einer ohrenbetäubenden Verfahren bei Verwendung einer normalerweise hören Tier. Dieses Mausmodell bietet eine leistungsfähige Möglichkeit, genetische und neurobiologische Mechanismen zu studieren, die für CI-Nutzer relevant sein würde.
Einleitung
Cochlea-Implantate (CIs) sind elektronische Geräte, die ein Gefühl des Hörens Menschen mit schweren und tiefen Hörverlust zukommen lassen können. In der Cochlea des Innenohrs chirurgisch implantierte Elektroden verwendet, um den Hörnerv direkt zu stimulieren. Bisher die CI ist die erfolgreichste sensorische Prothese und hat dazu beigetragen, mehr als 600.000 Menschen weltweit1. Das Gerät hat jedoch Mängel. Zunächst unterschiedlich die Vorteile von dem Gerät unter Empfängern. Zweitens Rede in lauten Umgebungen und Musik sind immer noch schlecht von den meisten CI-Nutzer wahrgenommen.
Seit vielen Jahren nutzten Tiermodellen, diese Themen in der CI-Forschung besser zu verstehen und Sicherheit und Wirksamkeit der Geräte ständig zu verbessern. Die Modelle erhielten wertvolle Einblicke in verschiedene Phänomene wie plastischen Veränderungen im Gehirn statt nach CI-Implantation-2, die Wirkung der Gentherapie zur Erhaltung Resthörigkeit3und biophysikalischen Eigenschaften der Anwendung der elektrisch stimuliert Hörnerv4, unter vielen anderen Beispielen.
Mäuse sind ein leistungsfähiges Modellorganismus aufgrund der großen Ausdehnung des genetischen Modelle von Taubheit. Weitere Vorteile sind die Möglichkeit, die Maus Genom zu manipulieren (z.B., über das CRISPR-Cas-System), die Möglichkeit, erweiterte bildgebende Verfahren zur Untersuchung der Mechanismen, insbesondere im Gehirn, die hohe Reproduktionsrate, schnelle Entwicklung und einfache Zucht und Handhabung. Die wichtigsten technischen Herausforderungen bei der Durchführung von CI Operationen bei Mäusen sind die geringe Größe der Cochlea und das Vorhandensein einer großen stapedial Arterie (SA). Die SA in der Regel verschwindet während der Embryonalentwicklung bei Menschen aber zeitlebens in einer Reihe von Nagetieren wie Mäusen, Ratten und Rennmäuse besteht. Die SA verläuft unterhalb der runden Fensternische, die erschwert Zugang zu der Cochlea und Operationsrisiko erhöht.
Frühere Studien haben die Machbarkeit einer CI-Implantation in Mäusen5,6,7gezeigt. Irving Et Al. zeigten, dass chronische Intracochlear elektrische Stimulation für bis zu einem Monat erreicht werden kann. Akute Stimulation wurde ebenfalls durchgeführt, aber die Aufnahmen waren nicht präsentiert. Sie zeigte, dass die stapedial Arterie Kauterisieren keinen signifikanten Einfluss auf die Hörschwelle oder die Anzahl der Spirale Ganglion Neuronen hatte und topische Applikation von Aminoglykosid Neomycin, ein ototoxische Medikamente eine wirksame ohrenbetäubenden Verfahren war Mäuse-5. Soken Et Al. beschrieben einen modifizierten dorsalen Ansatz der Maus Cochlea durch das Runde Fenster, Anhörung Status6besser zu bewahren. Nach Einsetzen einer Platin-Iridium-Draht wurde erhebliche Resthörigkeit mit einer erhöhten auditory Brainstem Response (ABR) Schwelle von 28 dB beobachtet. Otoakustischen Emissionen (OAE) wurden bei Tieren mit großen ABR Schwelle Schichten6verloren. Mistry Et Al. die funktionale und histopathologischen Wirkungen der Implantation in fehlender Elektrostimulation7getestet. Obwohl Anhörung in 3 bis 6 Monate alten implantierten Mäuse bei niedrigen Frequenzen erhalten blieb, führte Implantation Fibrose-ähnliches Gewebe um das Implantat herum und Osteoneogenesis rund um die Bullostomy7.
Kurz gesagt, aus den drei Studien über CIs bei Mäusen zeigt nur eine funktionelle Aufnahme von CI-Stimulation. Irving und Kollegen durchgeführt sowohl akute und chronische eABR Aufnahmen aber nur Daten von chronischen CI Stimulation5zeigte. Die chronische Modell mit einem vollständig implantierbare Gerät von Irving Et al. ist jedoch technisch anspruchsvoll. Es ist noch nicht bekannt, ob akute CI Stimulation, weniger anspruchsvoll und schneller, ähnliche Ergebnisse erzielen kann.
GUS wird von Menschen mit schweren und tiefen Hörverlust, die nicht mehr von einem Hörgerät profitieren. Tiermodelle für CI-Nutzer sollten daher eine ohrenbetäubende Prozedur enthalten, wenn Sie normalerweise hören, dass Tiere eingesetzt werden. Ein weiterer Grund zu hören Tiere betäuben ist, dass die elektrische Stimulation eines Gehörlosen oder Anhörung Cochlea unterschiedliche Neuronale Reaktionen4,8,9,10,11, erzeugt 12. elektrischer Stimulation eine Gehörlose Cochlea direkt aktiviert die Hörnerv Fasern und erzeugt eine Electroneural Reaktion (α). Es zeichnet sich durch kurze Latenz und einen kleinen dynamischen Bereich in der Peripherie8,10. Auf der anderen Seite reizt elektrischer Stimulation eine Anhörung Cochlea auch die Haarzellen in einer Stepptänzer Antwort (β), die durch längere Wartezeiten und größeren Dynamikbereich4,11gekennzeichnet ist. Die Stepptänzer Antwort wird normale Erregung der Nervenfasern durch innere Haarzellen, elektrisch induzierten Kontraktion der äußeren Haarzellen und Generierung eines Reisenden Welle4zugeschrieben. Electroneural und Stepptänzer Antworten ergeben sich auch in zwei verschiedenen Aktivitätsmuster im Zentralnervensystem9. Sato Et Al. ermittelten Mittelhirn Nervenzellen der ein CI implantiert Meerschweinchen vor und nach der ohrenbetäubenden mit Neomycin, die Stepptänzer Beitrag beseitigt. Sie zeigten, dass die Neigung der Ratenniveau Funktion steiler wurde und feuern Preise höher in den daraus Zustand im Vergleich zu der Anhörung Zustand9. Daher je nach Fragestellung angegeben, ist es wichtig zu prüfen, einschließlich ohrenbetäubend, separate Stepptänzer und Electroneural Reaktionen auf elektrische Stimulation des Hörnervs.
Hier beschreiben wir das Verfahren für die akute ohrenbetäubend und die Cochlea-Implantation von Elektroden-Array in eine Maus sowie die funktionale Aufzeichnung des intracochlear elektrische Stimulation mit elektrisch evozierten auditory Brainstem Response (eABR).
Protokoll
Alle Verfahren wurden je nach Universität Basel, Schweiz, Tierpflege und Richtlinien durchgeführt. Sie wurden durch das Veterinäramt des Kantons Basel in der Schweiz zugelassen.
Hinweis: Erwachsene Mäusen C57BL/6, im Alter von 8 – 12 Wochen (20-30 g Gewicht), wurden in dieser Studie verwendet.
Das linke Ohr dient als experimentelle Ohr. Das rechte Ohr dient als Intra Tierkontrolle und nicht chirurgisch verändert.
1. präoperative Verfahren
-
Betäuben Sie die Tiere 30 min vor der Operation über Intra peritoneale (i.p.) Injektion von Ketamin/Xylazin (80 mg/kg Ketamin, 16 mg/kg Xylazin, i.p., Volumen injiziert 10 μl/g Körpergewicht).
- Anästhesie bei Bedarf zu ergänzen, wie eine positive Pedal und palpebrale (Zeh-Prise) Reflex und Bewegung der Schnurrhaare, mit einer niedrigeren Dosis von Ketamin (45 mg/kg, i.p., injiziert 10 μl/g Körpergewicht) beurteilt. Agenten und Dosis Regime können pro institutionellen Richtlinien ersetzt werden.
Hinweise: In der Regel das Tier einer Injektion alle 45-60 Minuten mit diesem Regime Agent und Dosis benötigen. Die durchschnittliche Zeit vom ersten Schnitt bis zur Schließung um die implantierten Elektroden-Array ist in der Regel 1-1,5 Stunden.
- Anästhesie bei Bedarf zu ergänzen, wie eine positive Pedal und palpebrale (Zeh-Prise) Reflex und Bewegung der Schnurrhaare, mit einer niedrigeren Dosis von Ketamin (45 mg/kg, i.p., injiziert 10 μl/g Körpergewicht) beurteilt. Agenten und Dosis Regime können pro institutionellen Richtlinien ersetzt werden.
- Suchen Sie nach voller Sedierung des Tieres gekennzeichnet durch eine normale Atemfrequenz und das Fehlen der Zehe-Prise Reflexe. Halten Sie dieses Niveau der Narkose.
- Halten Sie das Tier Körpertemperatur bei 36,6 ° C mit einem geschlossenen Regelkreis Heizkissen. Gelten Sie Augensalbe zur Austrocknung der Hornhaut zu vermeiden. Dadurch wird auch das Tier-Blink-Reflex, unterdrückt die Geräusche der Umkodierung hinzufügen können.
- Verwalten von lokalen Analgetikum durch subkutane Injektion (s.c.) von Bupivacain/Lidocain (0,1 mg/mL Bupivacain und Lidocain 0,4 mg/mL, 0,1 mL s.c. verabreicht) entlang der beabsichtigten Schnitt, keine chirurgische Beschwerden zu minimieren. Agenten und Dosis Regime können pro institutionellen Richtlinien ersetzt werden.
- Verwalten der Muskarin Antagonist Atropin (Atropinesulfate amino, 0,1 mg/mL, 20 μL verwaltet s.c., aufgelöst in PBS) in den Hals, Schleim-Sekretion zu reduzieren und um die Atmung zu erleichtern. Agenten und Dosis Regime können pro institutionellen Richtlinien ersetzt werden.
2. Pre-ohrenbetäubend akustische Auditory Brainstem Response (aABR)
Hinweis: aABR wird verwendet, um den Status des Gehörs vor und nach ohrenbetäubend zu messen. Auf dem linken Ohr und in einer schalldichten Kabine elektrisch abgeschirmte wird getestet. Wir empfehlen zu testen und später Implantat das linke Ohr für Rechtshänder. In13,14finden Sie weitere Details zu ABR bei Mäusen. Tucker Davis Technologien (TDT) Hardware und Software (BioSig) werden verwendet, um ABR aufzeichnen, aber andere Systeme genutzt werden.
- Blockieren der kontralateralen (rechts) Ohres mit Noppenschaum, ABR Antwort aus dem ipsilateral (linken) Ohr zu isolieren. Setzen Sie den Schaum in eine 1 mL Spritze und injizieren sie in den rechten Gehörgang der Maus, um den gesamten Gehörgang mit Schaum abdecken (0,1-0,2 mL Schaum). Stellen Sie sicher die Spritze Dichtungen eng an das Ohr so dass der Schaum bis hin in den Gehörgang gelangt.
- Platzieren Sie den Lautsprecher 10 cm aus dem linken Ohr.
Hinweis: Der Sprecher für dieses Setup wurde kalibriert mit einem PCB-Mikrofon, wie in Refefence15beschrieben. - Reinigen Sie die ABR-Elektroden mit 70 % Ethanol-Lösung. Platzieren Sie die Elektroden unter die Haut: aktiv (Ch1) auf den Scheitelpunkt (-) unterhalb der Ohrmuschel des ipsilateralen Ohres zu verweisen und Boden in das Hinterbein (Abbildung 1).
- Die Kopf-Bühne und Vorverstärker an der auditiven Prozessor über den Glasfaser-Anschluss anschließen.
-
Überprüfen Sie die Impedanz der aktiven und Referenzelektrode.
- Wenn die Impedanz über 3 Ohm ist, neu zu ordnen Sie und wieder nehmen Sie die Messung. Die besten Aufnahmen werden erzielt, wenn die Elektroden die gleiche Impedanz haben. Schließen Sie die schalldichten Kabine.
- Präsentieren Sie klicken Sie auf Anregung zu und notieren Sie ABR in einem Freifeld-Zustand mit einem komplexen auditive Prozessor und Software. Den Klick-Reiz in der Software zu standardisieren: 0,1 ms Einkanal-monophasisch Klicks präsentieren wir bei 21 Hz; Klicken Sie auf Niveau sinkt von 90 dB SPL um 10 dB SPL in 10 dB-Schritten; 10 ms Aufnahme Fenster. Im Durchschnitt insgesamt 512 Antworten auf jeder Ebene der dB.
- Anwenden einer 2.000 Hz-Tiefpass-Filter und einen 300 Hz Highpass Filter offline Rauschen in der Aufnahme mit einem maßgeschneiderten Matlab-Skript zu reduzieren.
- Bestimmen Sie die ABR-Schwelle, wie die niedrigste Ebene der dB mit einer erkennbaren ABR Welle Antwort (Abbildung 2, Abbildung 3).
(3) Chirurgie
Hinweis: Typische Instrumente sind eine Schere, Skalpell, ein paar von metallischen Pinzette mit geraden oder gebogenen Spitzen, ein Gewebe Retraktor Werkzeug, mehrere Sauger Keile und resorbierbare Papierspitzen. Die Operation erfolgt auf dem linken Ohr.
- Setzen Sie die Maus auf der rechten Seite. Vermeiden Sie unnötige Torsionsspannung auf die Halswirbel. Achten Sie darauf, halten den Körper direkt in die Atemwege offen zu halten.
- Schneiden Sie das Fell hinter dem linken Ohr mit einer Schere (oder mit einem Rasierer zu rasieren), die Haut verfügbar zu machen. Desinfizieren Sie die Haut mit 70 % Ethanol Lösung und Betadine (Povidon/Jod).
- Stellen Sie unter mikroskopischer Vergrößerung (16 X) einen 1-1,5 cm Post-auricular Schnitt mit dem Skalpell.
- Wechseln Sie zu höheren mikroskopischer Vergrößerung (25 X).
- Durchführen Sie stumpfe Dissektion durch die subkutane Fettschicht, die von verschiedener Dicke, mit der Pinzette.
Hinweis: Seien Sie vorsichtig beim sezieren wie die äußere Halsschlagader diesem Bereich durchläuft. Diese Struktur kann übermäßige Blutungen beschädigen. - Ziehen Sie den sternocleidomastoideus-Muskel um das Trommelfell Bulla Periost offenbaren. Verwenden Sie Nervus facialis als wichtige anatomische Landmarke zur Identifizierung von auditiven Pufels Unterstützung. Nervus facialis Posterior/dorsalen Rand des sternocleidomastoideus-Muskel umschlingt und Rostral verläuft entlang den Gehörgang in Richtung Ohrmuschel. Legen Sie vorsichtig die selbsthaltenden Retraktor-Tool im Schnitt um Zugang zu der Bulla (Abbildung 4) erleichtern.
- Das darüberliegende Medio-dorsalen Bereich der Bulla ermöglichen übersichtliche Visualisierung von dem Grat zwischen der Bulla und des Warzenfortsatzes Gewebe zu entfernen.
- Drehen Sie behutsam 30 G Nadel durchbohren die Bulla und machen Sie ein Loch (Bullostomy) auf der Posterior-Superior-Seite des Grates (der Knochen ist dünner auf dieser Seite). Alternativ können Sie eine chirurgische Zahnbohrer.
Hinweis: Dies und die folgenden Schritte können mit noch höheren mikroskopischer Vergrößerung (40 X) getan werden, falls gewünscht. Auch ändern Sie die Position des Mikroskops bei Bedarf. Es ist wichtig, die chirurgische Ansicht des Mittelohres Raumes zu maximieren. -
Erweitern Sie die Bullostomy durch Kneifen kleiner Knochen-Stücke mit feinen Spitzen Pinzette Mittelohr Hohlraum aussetzen. Bullostomy dorsal in Richtung des Warzenfortsatzes zu verlängern, bis die Runde Fensternische klar der darüberliegende Knochen ist. Die stapedial Arterie, ein Zweig der inneren Halsschlagader, läuft die Runde Fensternische ventralen.
- Achten Sie darauf, nicht das Schiff beschädigt, da übermäßige Blutungen kann tödlich sein. Kleine Blutungen können gestoppt werden, indem Sie ein kleines Stück von Spongostan im Innenohr Hohlraum drücken.
- Erweitern Sie die Bullostomy Richtung anterior-Superior, der Steigbügel, das Mittelohr Knochen verbunden, das ovale Fenster zu visualisieren.
- Entfernen Sie die Steigbügel mit Zange, das ovale Fenster verfügbar zu machen.
4. Runde Fenster Anwendung von ototoxischen Agent
- Perforieren Sie sanft die Runde und ovale Fenster Membranen mit einer stumpfen Nadel 30 G. Überprüfen Sie abläuft die Perilymphe.
- Perfundieren Sie langsam 0,05 % Gewicht/Volumen Neomycin in PBS (eingestellt auf pH 7,4) durch das ovale Fenster aufgelöst. Flüssigkeit sollte aus dem Rundfenster zu spülen. Wiederholen Sie den Vorgang auf das Runde Fenster. Achten Sie darauf, nicht die Fenster Knochenstrukturen mit der Nadel verwendet, um perfundieren beschädigt.
- Legen Sie ein kleines Stück (1 mm2) Spongostan getränkt in Neomycin in die Runde und ovale Fenster Nische.
- Entfernen Sie Retraktor Werkzeug, schließen Sie die Inzision und warten Sie 30 min.
5. nach dem ohrenbetäubenden akustische ABR
- Aufzeichnen von aABR in ähnlicher Weise wie vor ohrenbetäubend (Schritte 2,2 bis 2,8) (Abb. 2 b, Abbildung 3).
6. Einfügen von CI-Elektroden-Array
Hinweis: Intracochlear Elektroden-Array besteht aus vier Platin-Bändern (Ø0.2 mm) mit Platin/Iridum Parylene isoliert Kabel abgeschirmt in einem Silikonschlauch (Abbildung 5).
- Das Retraktor-Werkzeug in der Schnitt der Bulla wieder Zugang zu legen.
- Legen Sie die Elektroden-Array in das Runde Fenster (Scala Pauke) in einer Tiefe wo die 4th Platin-Ring nur innerhalb des runden Fensters befindet. Dies gibt eine Einstecktiefe von ~ 2 mm, entsprechend einer Intracochlear Position bei ~ 30 kHz16.
- Die Kabel im Inneren der Bulla Spule und kleben Sie den Draht in das Gewebe über der Bulla. Wickeln den Draht hilft, um das Array in der gesamten Experiments.
- Sorgfältig entfernen Sie die Aufrollvorrichtung und schließen Sie der Einschub mit Gewebekleber zu.
- Machen Sie einen kleinen Schnitt (0,5 mm) in den Hals senkrecht zur Linie zwischen, wo die aktive und ABR Referenzelektroden werden mit einer Gewebe-Schere. Legen Sie den Platin Boden-Ball in der subkutanen Tasche und schließen Sie den kleinen Schnitt mit Gewebekleber (Abbildung 6).
- Elektroden-Array-Board an die Tier-Stimulator-Plattform anschließen.
7. elektrische Auditory Brainstem Response (eABR)
Hinweis: Ein Tier Stimulator Plattform (ASP) wird verwendet, um die Elektrode elektrisch stimulieren. Andere Stromquellen und Software-Systemen einsetzbar.
- Platzieren Sie die ABR Elektroden als vor (Schritte 2,3 bis 2,5) (Abbildung 6).
- Öffnen Sie die ASP-Software und definieren Sie das elektrischen Impuls Stimulation Paradigma zu. Wir verwenden eine Ladung ausgeglichen biphasische Impulse mit 50 μs/Phase und 10 μs interphase Lücke auf 23,3 Impulse pro Sekunde (Pps) vorgestellt. Die elektrische Stimulation wird in monopolare Elektrode Konfiguration mit steigendem aktuelle geliefert. Insgesamt 400 Antworten werden auf jeder aktuellen Ebene gemittelt.
- Präsentieren Sie die elektrischen Impulsfolgen und notieren Sie die evozierten eABR Reaktion kontinuierlich über die TDT Headstage, Vorverstärker und auditive Prozessor.
- Plotten und analysieren der eABR Daten über ein maßgeschneidertes Matlab-Skript (Abbildung 7). Das Skript und ein Beispiel für eine Aufnahme sind in den ergänzenden vorhanden.
8. Ende des Experiments
- Am Ende des Experiments einschläfern des Tieres nach institutionellen Richtlinien.
- Vorsichtig die Inzision zu öffnen und das Implantat zu entfernen.
- Beschallen Sie Ultra-die Elektrodenanordnung in destilliertem Wasser für 10 min bis zum Gewebe Ablagerungen zu entfernen.
Hinweis: Das Implantat kann mehrmals wiederverwendet werden, wenn die Elektroden intakt und richtig führen sind. Um dies zu überprüfen, Messen Sie die Impedanz der Elektroden mit einem Multimeter, wenn das Array trocken ist. - Lagern Sie die Elektroden-Array an einem trockenen Ort.
Ergebnisse
Der Zweck dieser Studie war ein zuverlässiges Modell für akute CI-Stimulation in der blind Maus zu beschreiben. Prä- und postoperative Hörfähigkeit Schwellen diente als eine funktionale Auslesen des ohrenbetäubenden Verfahrens. Topische Anwendung von 0,05 % Neomycin im ovalen und runden Fenster Klick-evozierten Hörfähigkeit Schwellen durch 46 dB ± 6 deutlich gesteigert (Pre Vs Post-Neomycin: 30,0 dB ± 3,8 Vs 75,7 dB ± 3,7, p = 0,0003, gepaart t-Test, n = 7) (Abbildung 3). Die Maus-Größe Elektrodenanordnung wurde im folgenden in das Runde Fenster (Abb. 4, Abb. 5) eingefügt. Elektrische Simulation einer Intracochlear Elektrode konnte zuverlässig eABR Aktivität generiert werden. (Abbildung 7). In einigen Fällen CI Stimulation aktiviert den Gesichtsnerv und erzeugt eine hohe Amplitude Welle mit entweder kurze oder lange Latenzzeit (Abb. 8A und 8 b Abbildung, beziehungsweise). Die kurze Latenz Antwort zeichnete sich durch eine rasche Verstärkung der Welle IV rund 3 ms und ist wahrscheinlich eine direkte Antwort des Nervus facialis. Die lange Wartezeit Antwort erschienen ca. 5 – 6 ms und wird voraussichtlich nicht auditiven Muskel (myogen) Antwort indirekt durch den Gesichtsnerv hervorgerufen werden. Nervus facialis Reaktionen sind selten in tierexperimentellen Studien in der Literatur berichtet aber ist eine bekannte Komplikation in menschlichen CI Benutzer17,18,19. In Abbildung 8, Gesichtsbehandlung Nervenstimulation erschien auf dem relativ mittlere derzeitigen Niveau (150 – 200 μA) und bei zwei verschiedenen Tieren. In anderen Fällen könnten beide Antworten in das gleiche Tier auf dem sehr hohen derzeitigen Niveau (nicht dargestellt) werden angezeigt. Es wird empfohlen, die Stromstärke auf ein Niveau unterhalb der aussehen Gesichtsnerv Stimulation zu begrenzen.
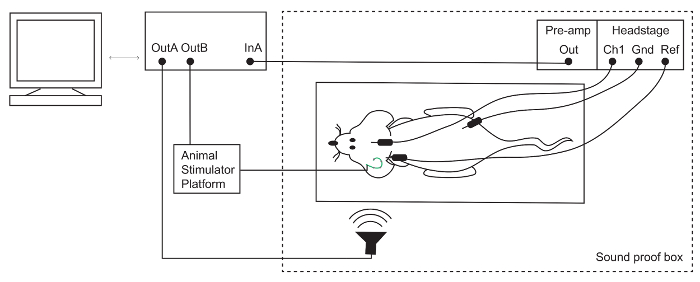
Abbildung 1: Auditory Brainstem Response (ABR) Setup. Subdermale Elektroden sind auf den Scheitelpunkt (aktiv/Kanal 1 [Ch1]), hinter dem ipsilateralen Ohr (Referenz [Ref]) und am Hinterbein (Boden [Gnd]) der narkotisierten Maus platziert. Elektrode Signale werden verstärkt und dann durch ein TDT-System aufgezeichnet. Akustische und elektrische Stimulation werden jeweils über ein Mikrofon und eine Tier-Stimulator-Plattform vorgestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
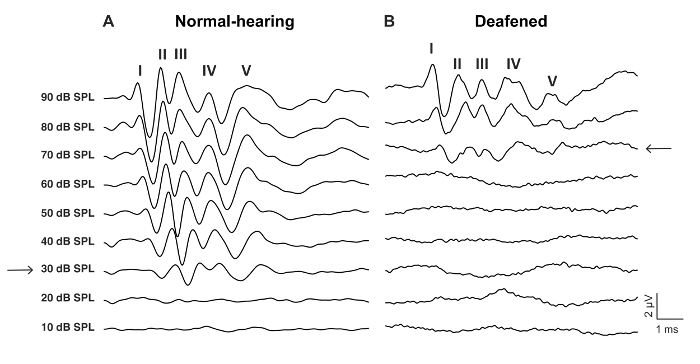
Abbildung 2: Vertreter aABR "Wellenlinien" klicken Sie auf Anregung von Wildtyp Maus vor und nach der ohrenbetäubenden mit 0,05 % Neomycin. (A) die Normal hörenden aABR Muster zeichnet sich durch Wellen gekennzeichnet-V und einem niedrigen Hörschwelle, hier 30 dB SPL (Pfeil). (B) die daraus aABR Muster zeigt eine erhöhte Hörschwelle hier 70 dB SPL (Pfeil). Die Wellen haben eine längere Wartezeit und weitere zeitliche Jitter. Bitte klicken Sie hier für eine größere Version dieser Figur.
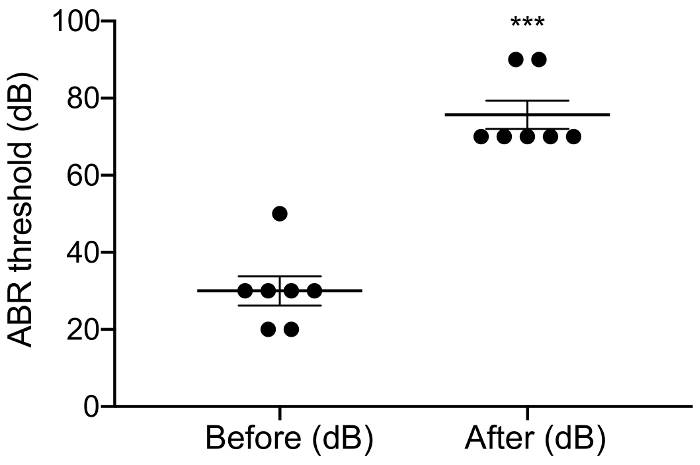
Abbildung 3: aABR Schwelle vor und nach der ohrenbetäubenden. Anwendung von Neomycin stieg deutlich um 46 dB ± 6 aABR Schwellen. Pre-Vs Post-Neomycin: 30,0 dB ± 3,8 Vs 75,7 dB ± 3,7, p = 0,0003, gepaart t-Test, n = 7. Fehler sind Standardfehler der Mittel. Bitte klicken Sie hier für eine größere Version dieser Figur.
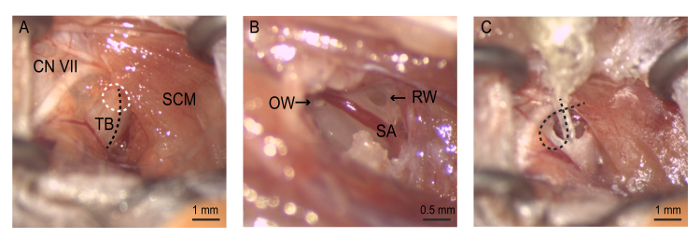
Abbildung 4: die Operation. (A) Exposition gegenüber der auditiven Bulla. Die Bullostomy ist (weiß gepunkteten Kreis) entlang des Grates auf das Trommelfell Bulla (schwarze gepunktete Linie) durchgeführt. (B) die Bullostomy ermöglicht die Visualisierung der Rundfenster, stapedial Arterie und ovale Fenster. Neomycin ist sanft gespült zuerst durch das ovale Fenster, dann das Runde Fenster. (C) der Elektroden-Array wird eingefügt, bis die 4th -Elektrode sich nur innerhalb der runden Fensternische befindet. Die Elektrode-Draht ist im Inneren der Bulla, das Array an Ort aufbewahren, bevor der Schnitt geschlossen wird aufgerollt. CN VII = Hirnnerven VII (Gesichtsnerv), OW = ovales Fenster, RW = Runde Fenster, SA = stapedial Arterie, SCM = sternocleidomastoideus Muskel, TB = Trommelfell Bulla. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: die Maus CI. (A) der Intracochlear-Elektroden-Array besteht aus vier Platin Bands in einem Intervall von 0,4 mm mit einem Durchmesser dAbstand: 0 [Tipp] (d = 0,21), 1 (d = 0,23), 2 (d = 0,25), 3 (d = 0,27). Die Breite jeder Elektrode beträgt 0,2 mm. Die vier Platin/Iridium (90/10) Parylene isolierte Drähte werden in einem Silikonschlauch abgeschirmt. (B) Vergrößerung der Elektrodenspitze Array (rote gestrichelte Quadrat). Die Elektrodenanordnung und einem Platin Referenz-Ball sind mit einem print Board verbunden. Maßstabsleiste = 1 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
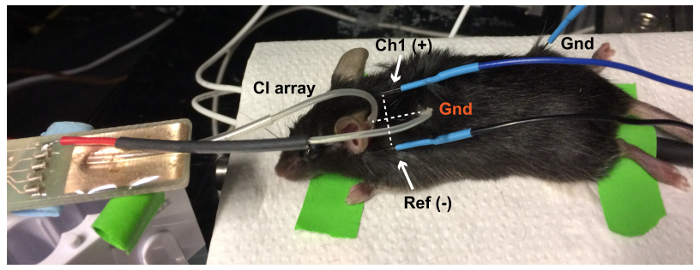
Abbildung 6: elektrisch evozierte Bera (eABR) Setup. Der CI Platin-Boden-Ball (Gnd, rot) befindet sich in einer subkutanen Tasche im Nacken der Maus. Die Linie zwischen aktiven (Ch1(+) am Scheitel) und Referenzelektroden (Ref (-) am ipsilateralen Ohr) ABR ist senkrecht zur Linie zwischen der Elektrode und der Boden um die beste eABR Antwort zu erhalten. EABR Masseelektrode (Gnd, schwarz) steht das Hinterbein. Bitte klicken Sie hier für eine größere Version dieser Figur.
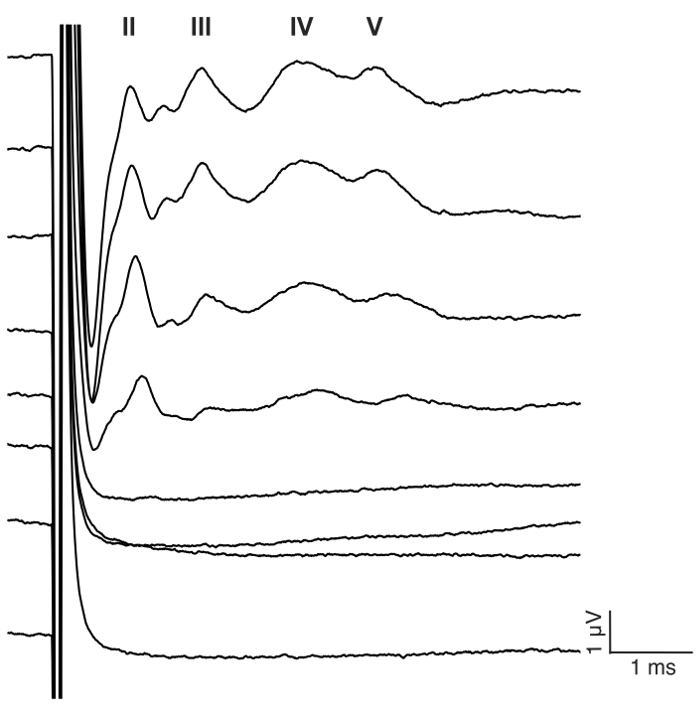
Abbildung 7: Vertreter eABR "Wellenlinien" CI-Stimulation in einer blind Maus. Eine biphasische Impulsfolge wird Elektrode #1 in monopolare Konfiguration zu 23,3 Impulse pro Sekunde (Pps) mit 400 Wiederholungen vorgestellt. Reize Ebene 0-175 μA ist in 25 μA Schritten gezeigt (siehe Stimulation Details Schritt 7.2). Römische Ziffern bezeichnen eABR Wellenzahl. Die Welle Amplitude und Latenz erhöhen und verringern, bzw. mit zunehmender Stromstärke. In diesem Beispiel Welle II erschien etwa 1 ms, Welle III ca. 2 ms Welle IV um 3 ms, Welle V ca. 4 ms. Bitte klicken Sie hier für eine größere Version dieser Figur.
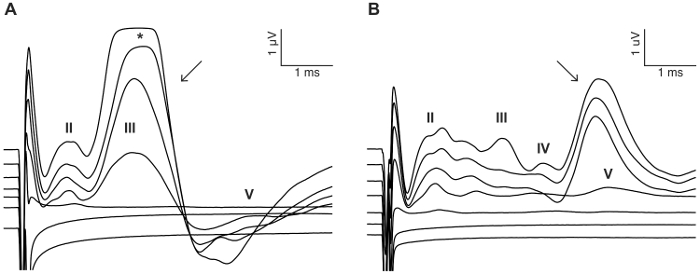
Abbildung 8: Beispiel für Gesichtsbehandlung Nervenstimulation. In einigen Fällen kann CI Stimulation aktivieren Nervus facialis und evozieren eine direkte Antwort mit kurzer Latenz (A) (Pfeil) oder indirekte Antwort mit längeren Latenz (B) (Pfeil). Die gezeigten Beispiele stammen aus zwei CI-implantierten Tiere angeregt mit einer biphasischen Impulsfolge mit 0 – 300 μA in 50 μA Schritte (siehe Stimulation Details Schritt 7.2). Römische Ziffern bezeichnen eABR Wellenzahlen. * kennzeichnet Übersteuerung der eABR Welle aufgrund der Sättigung des Verstärkers. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Manuskript beschreibt das chirurgische Vorgehen bei akuten ohrenbetäubend und Cochlea-Implantation in der Maus, als auch die funktionelle Beurteilung der CI-Stimulation mit auditory Brainstem Response. Obwohl die Maus Cochlea klein ist und der Chirurgie eine Herausforderung, die CI-Maus-Modell ist machbar und dient als ein wertvolles Instrument in der auditiven Forschung.
Die stapedial Arterie ist in das Mittelohr der Maus vorhanden. Die Arterie tritt die Bulla Posterior, medial und inferior, der runden Fensternische läuft und dann souverän die ovale Fensternische. In der Anfangsphase der Entwicklung des Mausmodells erlebten wir fatal intraoperativen Blutungen folgende Trauma an der stapedial Arterie, vor allem beim Zugriff auf die Bulla. Folglich wir einen begrenzteren Ansatz angepasst und die Bulla in kleinere, raffinierte Dissektion Schritten zugegriffen. Danach wurden keine weiteren Komplikationen durch Blutungen beobachtet. Trotz der Tatsache, dass die stapedial Arterie Kauterisation hat keinen signifikanten Einfluss auf die Hörschwelle oder Anzahl der Spirale Ganglion Neuronen in Mäusen5, unserer Meinung nach ist es nicht erforderlich, so lange, wie viel Sorgfalt und Aufmerksamkeit während der Operation getroffen werden. Wir vorschlagen, wobei den Zeitaufwand für feine psychomotorische Fähigkeiten zu entwickeln und technische Kenntnisse zu erreichen. Die durchschnittliche Zeit vom ersten Schnitt bis zur Schließung um die implantierten Elektroden-Array ist in der Regel 1-1,5 h.
Die beschriebenen akuten CI-Operation bei Mäusen ist ähnlich dem "ventralen" Verfahren und Runde Fenster einfügen in andere Nager, wie Ratten und Rennmäuse20,21,22verwendet. Andere Nager Studien haben der "dorsalen Ansatz" mit einem basalen Wende Cochleostomie statt ein Rundfenster einführen, die SA ganz zu vermeiden und einfügen dem Array mehr tief6,23,24verwendet. Die Implantation einer chronischen Stimulation Versammlung bei Mäusen folgt den gleichen Schritten wie in diesem Protokoll mit dem Zusatz aus einem Dacron Gewebe um das Implantat und postoperative Pflege5beheben beschrieben.
Die wichtigsten technischen Herausforderungen beim CI Operationen bei Mäusen sind die geringe Größe im Vergleich zu der Cochlea von Ratten und Rennmäuse, und das Vorhandensein von großen SA Cochlea. Der SA ist auch bei Ratten aber nicht in Wüstenrennmäuse. Darüber hinaus da Mäuse kleiner als Ratten und Rennmäuse sind, sind sie anfälliger für chirurgische Eingriffe.
Stepptänzer Antworten in eABR Aufnahmen zu beseitigen und Haarzelle Verlust in den meisten CI-Nutzer gefunden zu imitieren, taub wir die Tiere vor dem CI einsetzen. Mäuse sind schwer zu ototoxically in-vivo-25 zu betäuben, weil die systemische Konzentrationen der Aminoglykoside Ototoxizität führen verpflichtet hat eine schmale Dosis Fenster: niedrigere Dosen über mehrere Tage vor Anreise keine Haarzelle Verlust gegeben, während einer einzigen Injektion eine höhere Dosis kann tödliche26sein. Anfälligkeit für Aminoglykoside ist auch Belastung abhängigen26. Allerdings hat sich gezeigt, dass eine einzelne Dosis von Aminoglykoside in Kombination mit einem Diuretikum Schleife übermäßige äußeren Haarzelle Verlust bei CBA/CaJ Mäusen ohne fatale Folgen27produzieren kann. Verzögerte innere Haarzelle Tod wurde in der Hälfte aller untersuchten Cochleae27berichtet.
In diesem Manuskript verwendet wir topische Applikation von der Aminoglykoside Neomycin inspiriert durch das Protokoll vor kurzem für C57BL/6 Mäusen5gegründet. Akuten Anwendung von Neomycin deutlich erhöht die Klick-evozierten Hörschwelle von 46 dB ± 6.1. Obwohl dieser Anstieg größer als die 35 dB Erhöhung von Irving Et Al. berichtet ist (Pre Vs postoperative: 41,6 dB ± 3.3 Vs 76,6 dB ± 4,4, p = 0,02, n = 3) 5, erreichten wir die gleiche Post-ohrenbetäubende Schwelle (75,7 dB ± 3,7 Vs 76,6 dB ± 4,4). 0,05 % Neomycin ist gedacht, um ein teilweiser Verlust des Gehörs, vor allem durch schnelle äußeren Haarzellen Tod verursachen, wie innere Haarzelle Verlust auftreten,27länger dauert. Es ist daher möglich Stepptänzer Antwort, was ist generiert sowohl von inneren und äußeren Haarzellen4,8,9,10,11,12, ist nur teilweise beseitigt in Blind Tiere mit Resthörigkeit. Auch wenn 0,05 % (Gewicht/Volumen) Neomycin nicht die Anzahl der Spirale Ganglion Neuronen 4 Wochen Post-ohrenbetäubend5 verringert, es ist noch unbekannt, wenn Neomycin in unserem akute Setup wirkt sich auf die Fasern des Hörnervs oder Synaptopathy (Verlust von Synapsen fördert zwischen den inneren Haarzellen und Art nerve ich auditorischen Fasern). Eine weitere Unsicherheit ist, dass die aktuelle Neomycin-Behandlung eine gleichmäßige Verteilung der Haarzelle Verlust entlang der Länge der Cochlea nicht produzieren kann. Zukünftige Studien sind erforderlich, um diese Fragen zu beantworten.
Zusammenfassend lässt sich sagen stellen die wachsende Zahl der genetischen Modelle für menschliche Taubheit und die biochemischen Werkzeuge zur Verfügung der Maus attraktive Tiermodell für akustische Forschung, einschließlich dem Gebiet der GUS-Staaten.
Offenlegungen
Keine finanziellen Interessenkonflikte. Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten danken für die Bereitstellung der Tier-Stimulation-Plattform und Beratung auf Anregung Paradigmen und James B. Fallon und Andrew K. Wise Bionik-Instituts, Melbourne, Australien, für chirurgische Beratung Pierre Stahl, Oticon Medical, Nizza, Frankreich . Diese Arbeit wurde unterstützt durch ein Stipendium des Schweizerischen Nationalfonds (ERC Transfer Finanzhilfe für T.R.B.).
Materialien
| Name | Company | Catalog Number | Comments |
| Hardware | |||
| Sound-proof booth | IAC Acoustics, Winchester, UK | Mac-2 Enclosure RF Shielded Box 2A | |
| MF1 Speaker | Tucker Davis Technologies (TDT), FL, USA | ||
| PCB microphone | PCB Piezotronics, Inc, NY, USA | Model 378C01 | |
| Low impedance headstage | TDT, FL, USA | RA4LI | |
| Medusa pre-amplifier | TDT, FL, USA | RA4PA | |
| RZ6 auditory processor | TDT, FL, USA | ||
| Animal Stimulator Platform | ASP, Oticon Medical, Nice, France | ||
| Multimeter | Fluks | #115 | |
| Surgical equipment | |||
| Closed-loop heating pad | FHC, Inc. ME, USA | ||
| Eye ointment | Alcon, CH | Lacrinorm Augengel | |
| Acoustic foam | Otoform Ak, Dreve Otoplastik GmbH | #464 | |
| Disposable subdermal needle electrodes | Horizon, Rochester Electro-Medical Inc. | S83018-R9, 27G | |
| Self-retaining retractor tool (Mini Collibri Retractor) | Fine Science Tools | #17000-01 | |
| Suction wedges | Agnthos, SE | #42-886-460 | |
| Absorbable paper point (Medium) | WPI, FL, USA | #504182 | |
| Intracochlear electrode array | Bionics Institute, Melbourne, Australia | 4 channel | |
| Spongostan Standard | Ferrosan Medical Devices | #MS0002 | |
| Tissue glue. Loctite 4161 Superbond | Henkel | Part No 19743 | |
| Animal Stimulator Platform (ASP) | Oticon Medical, Nice, France | ||
| Drugs/chemicals | |||
| Ketamine (Narketan) | Provet AG, CH | 100mg/mL, #VQ_320265 | |
| Xylazine (Rompun) | Provet AG, CH | Inj Diss 2%, # 1315 | |
| Bupivacaine | Compendium, CH | Bupivacain Sintetica inj Diss 0.5% | |
| Atropine (Atropinesulfat Amino) | Amino AG, CH | 1 mg/mL | |
| Betadine (Povidone/iodine) | Provedic, CH | ||
| Neomycin (Neomycin trisulfate salt) | Sigma | N1876-25G, Lot#WXBB7516V | |
| Software | |||
| BioSigRZ | TDT, FL, USA | ||
| Matlab | MathWorks, MA, USA | ||
| ASP software | Oticon Medical, Nice, France |
Referenzen
- The-Ear-Foundation. . Cochlear Implants Update. , (2018).
- Fallon, J. B., Irvine, D. R. F., Shepherd, R. K. Cochlear Implants and Brain Plasticity. Hearing Research. 238 (1-2), 110-111 (2008).
- Pfingst, B. E., et al. Neurotrophin Gene Therapy in Deafened Ears with Cochlear Implants: Long-term Effects on Nerve Survival and Functional Measures. Journal of the Association for Research in Otolaryngology. 18 (6), 731-750 (2017).
- Miller, C. A., et al. Electrical excitation of the acoustically sensitive auditory nerve: single-fiber responses to electric pulse trains. Journal of the Association for Research in Otolaryngology. 7 (3), 195-210 (2006).
- Irving, S., et al. Cochlear implantation for chronic electrical stimulation in the mouse. Hearing Research. 306, 37-45 (2013).
- Soken, H., et al. Mouse cochleostomy: a minimally invasive dorsal approach for modeling cochlear implantation. Laryngoscope. 123 (12), E109-E115 (2013).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hearing Research. 312, 81-90 (2014).
- Hartmann, R., Topp, G., Klinke, R. Discharge patterns of cat primary auditory fibers with electrical stimulation of the cochlea. Hearing Research. 13 (1), 47-62 (1984).
- Sato, M., Baumhoff, P., Kral, A. Cochlear Implant Stimulation of a Hearing Ear Generates Separate Electrophonic and Electroneural Responses. The Journal of Neuroscience. 36 (1), 54-64 (2016).
- Pfingst, B. E., Spelman, F. A., Sutton, D. Operating ranges for cochlear implants. Annals of Otology, Rhinology & Laryngology. 89 (2), (1980).
- Miller, C. A., Hu, N., Zhang, F., Robinson, B. K., Abbas, P. J. Changes across time in the temporal responses of auditory nerve fibers stimulated by electric pulse trains. Journal of the Association for Research in Otolaryngology. 9 (1), 122-137 (2008).
- Shepherd, R. K., Javel, E. Electrical stimulation of the auditory nerve. I. Correlation of physiological responses with cochlear status. Hearing Research. 108 (1-2), 112-144 (1997).
- Akil, O., Oursler, A. E., Fan, K., Lustig, L. R. Mouse Auditory Brainstem Response Testing. Bio Protocol. 6 (6), (2016).
- Willott, J. F. Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current Protocols in Neuroscience. Chapter 8 (Unit 8.21B. , (2006).
- TDT. . ABR User Guide: A Guide to ABR Testing with the System 3 RZ6. , (2017).
- Muller, M., von Hunerbein, K., Hoidis, S., Smolders, J. W. A physiological place-frequency map of the cochlea in the CBA/J mouse. Hearing Research. 202 (1-2), 63-73 (2005).
- Cushing, S. L., Papsin, B. C., Gordon, K. A. Incidence and characteristics of facial nerve stimulation in children with cochlear implants. Laryngoscope. 116 (10), 1787-1791 (2006).
- Berrettini, S., Vito, D. A., Bruschini, L., Passetti, S., Forli, F. Facial nerve stimulation after cochlear implantation: our experience. Acta Otorhinolaryngologica Italica. 31 (1), 11-16 (2011).
- Hu, H., Kollmeier, B., Dietz, M. Reduction of stimulation coherent artifacts in electrically evoked auditory brainstem responses. Biomedical Signal Processing and Control. 21, 74-81 (2015).
- Wiegner, A., Wright, C. G., Vollmer, M. Multichannel cochlear implant for selective neuronal activation and chronic use in the free-moving Mongolian gerbil. Journal of Neuroscience Methods. 273, 40-54 (2016).
- Hessel, H., et al. Meriones unguiculatus (Gerbil) as an animal model for the ontogenetic cochlear implant research. American Journal of Otolaryngology. 18 (S21), (1997).
- Pinilla, M., Ramirez-Camacho, R., Jorge, E., Trinidad, A., Vergara, J. Ventral approach to the rat middle ear for otologic research. Otolaryngology Head Neck Surgery. 124 (5), 515-517 (2001).
- King, J., Shehu, I., Roland, J. T., Svirsky, M. A., Froemke, R. C. A physiological and behavioral system for hearing restoration with cochlear implants. Journal of Neurophysiology. 116 (2), 844-858 (2016).
- Lu, W., Xu, J., Shepherd, R. K. Cochlear implantation in rats: a new surgical approach. Hearing Research. 205 (1-2), 115-122 (2005).
- Poirrier, A. L., et al. Ototoxic drugs: difference in sensitivity between mice and guinea pigs. Toxicology Letters. 193 (1), 41-49 (2010).
- Wu, W. J., et al. Aminoglycoside ototoxicity in adult CBA, C57BL and BALB mice and the Sprague-Dawley rat. Hearing Research. 158 (1-2), 165-178 (2001).
- Taylor, R. R., Nevill, G., Forge, A. Rapid hair cell loss: a mouse model for cochlear lesions. Journal of the Association for Research in Otolaryngology. 9 (1), 44-64 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten