Method Article
Cirugía de implante coclear y eléctricamente evocada médula oblonga auditivo respuesta grabaciones en ratones C57BL/6
En este artículo
Resumen
Modelos animales de implantes cocleares pueden avanzar el conocimiento de los fundamentos tecnológicos de tratamiento de la pérdida permanente de audición neurosensorial con estimulación eléctrica. Este estudio presenta un protocolo quirúrgico de implantación coclear de una matriz de electrodos en ratones, así como la evaluación funcional con respuesta auditiva del médula oblonga y agudo ensordecedor.
Resumen
Implantes cocleares (IC) son dispositivos neuroprosthetic que pueden proporcionar un sentido de la audición a personas sordas. Sin embargo, el CI no puede restaurar todos los aspectos de la audición. Mejora de la tecnología del implante es necesario si los usuarios CI percibir música y realizar en ambientes más naturales, como oído una voz con competencia habladores, reflexiones y otros sonidos. Tal mejora requiere animales de experimentación para comprender mejor los mecanismos de la estimulación eléctrica de la cóclea y sus respuestas en el sistema auditivo todo. El ratón es un modelo cada vez más atractivo debido a los muchos modelos genéticos disponibles. Sin embargo, el uso limitado de esta especie como un modelo de CI es principalmente debido a la dificultad de implantar matrices de electrodos pequeños. Más detalles sobre el procedimiento quirúrgico por lo tanto son de gran interés para ampliar el uso de ratones en la investigación de CI.
En este informe, describimos en detalle el protocolo para la implantación coclear de una matriz de electrodos en la cepa de ratón C57BL/6 y agudo ensordecedor. Demostrar la eficacia funcional de este procedimiento con respuesta eléctricamente evocados auditivos del médula oblonga (eABR) y muestran ejemplos de la estimulación del nervio facial. Finalmente, también discutimos la importancia de incluir un procedimiento ensordecedor cuando se utiliza una audiencia normalmente animal. Este modelo de ratón proporciona una oportunidad potente para estudiar los mecanismos genéticos y neurobiológicos que serían de relevancia para los usuarios de CI.
Introducción
Implantes cocleares (IC) son dispositivos electrónicos que pueden proporcionar un sentido de la audición a personas con pérdida auditiva severa y profunda. Utiliza electrodos implantados quirúrgicamente en la cóclea del oído interno para estimular directamente el nervio auditivo. Hasta la fecha, el CI es la prótesis sensorial más exitosa y ha ayudado a más de 600.000 personas en todo el mundo1. Sin embargo, el dispositivo tiene defectos. En primer lugar, los beneficios proporcionados por el dispositivo varían mucho entre los recipientes. En segundo lugar, habla en ambientes ruidosos y música todavía mal son percibidas por la mayoría de los usuarios de CI.
Durante muchos años, se han utilizado modelos animales para comprender mejor estas cuestiones en la investigación del CI y para mejorar continuamente la seguridad y eficacia de los dispositivos. Los modelos han dado información valiosa sobre varios fenómenos, tales como cambios plásticos en el cerebro tienen lugar después de la implantación de CI2, el efecto de la aplicación de la terapia génica para preservar la audición residual3y propiedades biofísicas de la estimulado eléctricamente nervio auditivo4, entre muchos otros ejemplos.
Los ratones son un organismo modelo de gran alcance debido a la gran disponibilidad de modelos genéticos de la sordera. Otras ventajas incluyen la capacidad de manipular el genoma de ratón (por ejemplo,, a través del sistema CRISPR-Cas), la oportunidad de utilizar avanzadas técnicas para estudiar mecanismos, particularmente en el cerebro, la tasa de reproducción alta, rápido desarrollo de imagen y fácil reproducción y manejo. Los principales desafíos técnicos en la realización de cirugías de CI en los ratones son el pequeño tamaño de la cóclea y la presencia de una gran arteria stapedial (SA). SA generalmente desaparece durante el desarrollo embrionario en los seres humanos pero persiste durante toda la vida en un número de roedores, como ratones, ratas y jerbos. El SA funciona debajo del nicho de la ventana redonda, que complica el acceso a la cóclea y aumenta el riesgo quirúrgico.
Estudios anteriores han demostrado la viabilidad de la implantación de los CI en ratones5,6,7. Irving et al demostraron que la estimulación eléctrica crónica intracochlear puede lograrse hasta un mes. También se realizó estimulación aguda pero las grabaciones no se presentaron. Demostraron que la cauterización de la arteria stapedial no tuvo efectos significativos en el umbral de la audición o el número de las neuronas del ganglio espiral y que el uso tópico de lo aminoglucósidos neomicina, un medicamento ototóxicos, era un eficaz procedimiento ensordecedor en ratones5. Soken et al describen un acercamiento modificado dorsal a la cóclea de ratón a través de la ventana redonda para mejor preservar la audición estado6. Después de la inserción de un alambre de platino-iridio, audición residual substancial se observó una respuesta del médula oblonga auditivo mayor umbral (ABR) de 28 dB. Las emisiones otoacoustic (OAE) se perdieron en los animales con grandes ABR umbral turnos6. Mistry et al. probados los efectos histopatológicos y funcionales de la implantación en ausencia de estimulación eléctrica7. Aunque la audiencia fue preservada en 3 y 6 meses de edad ratones implantados en las frecuencias bajas, implantación resultó en tejido fibrosis alrededor del implante y osteoneogenesis en el bullostomy7.
En definitiva, de los tres estudios en CEI en ratones, única muestra grabación funcional de estimulación CI. Irving y sus colegas realizaron dos grabaciones de eABR agudas y crónicas pero sólo mostraron datos de crónica CI estimulación5. Sin embargo, es un desafío técnico el modelo crónico con un dispositivo totalmente implantable desarrollado por Irving et al. No se sabe todavía si estimulación de CI aguda, menos desafiante y más rápida, puede alcanzar resultados similares.
CIs son utilizado por personas con pérdida auditiva severa y profunda que ya no se benefician de ayudas auditivas. Modelos animales para usuarios de CI por lo tanto, deben incluir un procedimiento ensordecedor al oír normalmente se utilizan animales. Otra razón para ensordecer animales de audiencia es que la estimulación eléctrica de un sordo o cóclea del oído produce diferentes respuestas neuronales4,8,9,10,11, 12. estimulación eléctrica de una cóclea sordo directamente las fibras del nervio auditivo se activa y genera una respuesta electroneural (α). Se caracteriza por la corta latencia y un rango dinámico pequeño en la periferia de8,10. Por otro lado, la estimulación eléctrica de una cóclea de oído también excita las células de pelo en una respuesta electrophonic (β) que se caracteriza por latencias más largas y mayor rango dinámico4,11. La respuesta de electrophonic se atribuye a normal excitación de las fibras nerviosas de células de pelo internas, contracción inducida eléctricamente de externas células de pelo y la generación de un viaje de la onda4. Respuestas Electroneural y electrophonic también dar lugar a dos patrones diferentes de actividad en el sistema nervioso central9. Sato et al. había registrado las neuronas del mesencéfalo de un conejillo de Indias de CI implantado antes y después ensordecedor con neomicina, que elimina la contribución electrophonic. Demostraron que la pendiente de la función de nivel de ritmo fue más pronunciada y las tarifas de leña mayor en la condición de ciego respecto a la condición auditiva del9. Por lo tanto, dependiendo de la pregunta de investigación indicada, es importante considerar como ensordecedor electrophonic separado y electroneural respuestas a estimulación eléctrica del nervio auditivo.
Aquí, describimos el procedimiento para agudo ensordecedor y el implante coclear de una matriz de electrodos en un ratón, así como el registro funcional de estimulación eléctrica intracochlear con respuesta eléctricamente evocados auditivos del médula oblonga (eABR).
Protocolo
Todos los procedimientos fueron realizados según la Universidad de Basilea, Suiza, cuidado de los animales y las directrices. Fueron aprobadas por la Oficina veterinaria del cantón de Basilea, Suiza.
Nota: Ratones adultos C57BL/6, de 8 – 12 semanas (peso 20-30 g), se utilizaron en este estudio.
La oreja izquierda se utiliza como el oído experimental. El oído derecho sirve como un control de los animales y no es alterado quirúrgicamente.
1. preoperatorios procedimientos
-
Anestesiar los animal 30 min antes de la cirugía mediante la inyección intraperitoneal (i.p.) de ketamina/xilacina (80 mg/kg ketamina xilacina de 16 mg/kg, i.p., volumen inyectado a 10 μL/g de peso corporal).
- Suplemento de anestesia cuando sea necesario, según lo juzgado por una pedal positiva y palpebral reflejo (dedo del pie-pinch) y movimiento de los bigotes, con una dosis inferior de ketamina (45 mg/kg, i.p., inyectado en 10 μL/g de peso corporal). Agentes y regímenes de dosis pueden ser sustituidos por las directrices.
Notas: en general, el animal va a necesitar una inyección cada 45 – 60 minutos con este régimen de agente y la dosis. El tiempo medio de incisión inicial hasta el cierre alrededor de la matriz de electrodos implantados es típicamente 1-1.5 horas.
- Suplemento de anestesia cuando sea necesario, según lo juzgado por una pedal positiva y palpebral reflejo (dedo del pie-pinch) y movimiento de los bigotes, con una dosis inferior de ketamina (45 mg/kg, i.p., inyectado en 10 μL/g de peso corporal). Agentes y regímenes de dosis pueden ser sustituidos por las directrices.
- Compruebe la sedación completa del animal marcado por un ritmo respiratorio regular y la falta de reflejos del pellizco del dedo del pie. Mantener este nivel de anestesia.
- Mantener la temperatura corporal del animal en 36,6 ° C con una almohadilla de calefacción de circuito cerrado. Aplique el ungüento de ojo para evitar la deshidratación de la córnea. Esto también suprime reflejo del centelleo del animal, que puede añadir ruido a la recodificación.
- Administrar analgésico local mediante inyección subcutánea (s.c.) de lidocaína/bupivacaína (0,1 mg/mL bupivacaína y lidocaína 0,4 mg/mL, 0.1 mL administrado s.c.) a lo largo de la línea de la incisión prevista para minimizar cualquier incomodidad quirúrgica. Agentes y regímenes de dosis pueden ser sustituidos por las directrices.
- Administrar la atropina antagonista muscarínico (atropinesulfate amino, 0,1 mg/mL, 20 μL administrado s.c., disuelta en PBS) en el cuello para reducir la secreción de moco y facilitar la respiración. Agentes y regímenes de dosis pueden ser sustituidos por las directrices.
2. pre-ensordecedor acústica respuesta auditiva del médula oblonga (Aabra)
Nota: Aabra se utiliza para medir el estado de la audición antes y después de ensordecedor. La prueba se realiza en la oreja izquierda y en una cabina insonora eléctricamente blindada. Recomendamos probar y después implantar el oído izquierdo para una persona diestra. Pueden encontrar más detalles sobre ABR en ratones en13,14. Tecnologías de Davis de Tucker (TDT) hardware y software (BioSig) se utilizan para registrar ABR pero se pueden utilizar otros sistemas.
- Bloquear el oído contralateral (derecho) con espuma aislante para aislar la respuesta ABR del oído ipsilateral (izquierda). Poner la espuma en una jeringa de 1 mL e inyectar en el canal auditivo derecho del ratón para cubrir el canal de oído todo con espuma (0,1 – 0,2 mL de espuma). Asegúrese de que los sellos de la jeringa cerca al oído para que la espuma se obtiene en el canal auditivo.
- Ponga el altavoz de 10 cm de la oreja izquierda.
Nota: El orador para esta configuración se calibró usando un micrófono de PCB como se describe en el refefence15. - Limpie los electrodos ABR con solución de etanol 70%. Coloque los electrodos bajo la piel: activo (Ch1) en el vértice, referencia (-) por debajo de la oreja del oído ipsilateral y en la pata trasera (figura 1).
- Etapa y se conectan al amplificador de potencia el procesador auditivo vía el puerto de fibra óptica.
-
Compruebe la impedancia del activo y el electrodo de referencia.
- Si la impedancia es de más de 3 ohmios, volver a arreglarlos y volver a tomar la medida. Las mejores grabaciones se obtienen cuando los electrodos tienen la misma impedancia. Cerca de la cabina a prueba de sonido.
- Presentar estimulación click y grabar ABR en una condición de campo libre con un complejo procesador auditivo y software. Estandarizar el estímulo haga clic en el software: 0,1 ms monofásicos single-channel clics se presentan a 21 Hz; Haga clic en nivel disminuye de 90 dB SPL a 10 dB SPL en pasos de 10 dB; 10 ms de grabación ventana. Promedio un total de 512 respuestas en cada nivel de dB.
- Aplicar un filtro de paso bajo de 2.000 Hz y un filtro de paso alto de 300 Hz fuera de línea para reducir el ruido en la grabación mediante un script de Matlab por encargo.
- Determinar el umbral ABR como el nivel más bajo de dB con una respuesta de onda ABR reconocible (figura 2, figura 3).
3. cirugía
Nota: Instrumentos típicos usados son una tijera, un bisturí, un par de pinzas metálicas con puntas rectas o curvas, una herramienta de retractor de tejido, varias cuñas de succión y puntos absorbibles papel. La cirugía se realiza en la oreja izquierda.
- Poner el ratón sobre su lado derecho. Evitar excesiva tensión torsional en las vértebras cervicales. Asegúrese de mantener el cuerpo recto para mantener abiertas las vías respiratorias.
- Cortar la piel detrás de la oreja izquierda con una tijera (o afeitarse con una afeitadora) para exponer la piel. Esteriliza la piel con solución de etanol 70% y betadine (yodo de povidone).
- Bajo magnificación microscópica (x 16), hacer una incisión de 1 a 1,5 cm poste-auricular con el bisturí.
- Cambiar a mayor magnificación microscópica (25 x).
- Realizar disección Roma a través de la capa de grasa subcutánea, que puede ser de espesor variable, con pinzas.
Nota: Tenga cuidado al disecar como la vena yugular externa atraviesa esta zona. Daño a esta estructura puede causar sangrado excesivo. - Retraer el músculo esternocleidomastoideo para revelar el periostio de la bulla timpánica. Uso del nervio facial como una señal anatómica clave para facilitar la identificación de la bulla auditiva. El nervio facial se envuelve alrededor del borde dorsal posterior del músculo esternocleidomastoideo y recorre rostral del conducto auditivo externo hacia el pabellón de la oreja. Coloque con cuidado la herramienta retractor auto retención en la incisión para facilitar el acceso a la bulla (figura 4).
- Extirpar el tejido que cubre la zona dorsal en medio de la bulla para permitir una visualización clara de la cresta entre la bulla y la apófisis mastoides.
- Gire suavemente una aguja de 30 G para pinchar la ampolla y hacer un agujero (bullostomy) en la parte posterior superior de la cresta (el hueso es más delgado de este lado). Alternativamente, use un taladro quirúrgico dental.
Nota: Este y los siguientes pasos pueden hacerse con mayor ampliación microscópica (40 x) si se prefiere. También, cambiar la posición del microscopio si es necesario. Es importante maximizar la vista quirúrgica del espacio de oído medio. -
Ampliar la bullostomy pellizcando trozos de hueso pequeño con unas pinzas con punta finas para exponer la cavidad del oído medio. Extender la bullostomy dorsal hacia la apófisis mastoides hasta que el nicho de la ventana redonda está claro de que cubre el hueso. La arteria stapedial, una rama de la arteria carótida interna, va ventral en el nicho de la ventana redonda.
- Tenga cuidado de no dañar el buque como sangrado excesivo puede ser fatal. Pequeños sangrados pueden interrumpirse presionando un pedazo pequeño de spongostan en la cavidad del oído interno.
- Extender la bullostomy hacia la dirección anterior superior para visualizar el estribo, el hueso del oído medio conectado con la ventana oval.
- Retire el estribo con el fórceps para exponer la ventana oval.
4. redondo de la ventana aplicación de ototóxicos agente
- Suavemente le perforan las membranas de ventana y ventana oval redondeos con una aguja de 30 G blunted. Compruebe perilymph funciona hacia fuera.
- Lentamente perfusión neomicina de peso/volumen de 0.05% disuelta en PBS (ajustado a pH 7,4) a través de la ventana oval. Líquido debe lavar fuera de la ventana redonda. Repita el mismo procedimiento en la ventana redonda. Tenga cuidado de no dañar las estructuras óseas de ventana con la aguja usada para perfusión.
- Coloque un pedazo pequeño (1 mm2) de spongostan empapado de neomicina en el nicho de ventana y la ventana oval redondeado.
- Retire la herramienta del separador, cerrar la incisión y esperar 30 minutos.
5. post ensordecedor ABR acústico
- Grabar Aabra en una manera similar como antes ensordecedor (pasos 2.2 a 2.8) (figura 2b, figura 3).
6. colocación de matriz de electrodos del IC:
Nota: La matriz de electrodo intracochlear consiste en cuatro bandas platino (Ø0.2 mm) con el alambre de platino/iridum parylene aislado blindado en un tubo de silicona (figura 5).
- Asentar el retractor en la incisión para volver a acceder a la bulla.
- Introduzca la matriz de electrodos en la ventana redonda (tympani de scala) a una profundidad donde se encuentra el anillo deth platino 4 dentro de la ventana redonda. Esto le da una profundidad de inserción de ~ 2 m m, correspondiente a una posición de intracochlear en ~ 30 kHz16.
- Bobina de cable dentro de la ampolla y pegar el alambre en el tejido por encima de la bulla. Arrollar el cable ayuda a mantener la matriz en su lugar durante todo el experimento.
- Cuidadosamente retire el retractor y cerca de la inserción con el pegamento de tejido.
- Hacer una pequeña incisión (0,5 mm) en el cuello perpendicular a la línea entre donde el activo y los electrodos de referencia ABR va a utilizar una tijera de tejido. Coloque la bola de tierra de platino en el bolsillo subcutáneo y cerrar la incisión con un pegamento de tejido (figura 6).
- Conecte la Junta de arreglo de discos de electrodo a la plataforma de estimulador del Animal.
7. eléctrico respuesta auditiva del médula oblonga (eABR)
Nota: Una plataforma de estimulador de Animal (ASP) se utiliza para estimular eléctricamente la matriz de electrodos. Pueden utilizar otras fuentes de corriente y sistemas de software.
- Coloque los electrodos ABR como antes (2.3 a 2.5) (figura 6).
- Abra el software ASP y definir el paradigma de la estimulación del impulso eléctrico. Utilizamos un pulsos bifásicos de equilibrado de carga con 50 μs/fase y 10 μs interfase gap presentada en 23,3 pulsos por segundo (pps). La estimulación eléctrica es entregada en configuración de electrodo monopolar con el aumento de los niveles actuales. Un total de 400 respuestas son promediados en cada nivel actual.
- Actualmente los trenes de pulso eléctrico y registrar la respuesta de eABR evocado continuamente a través de la headstage TDT, procesador pre amplificador y auditiva.
- Trazar y analizar los datos de eABR mediante un script de matlab a medida (figura 7). La secuencia de comandos y un ejemplo de una grabación se proporcionan en el complementario.
8. final del experimento
- Al final del experimento, eutanasia animal según las directrices.
- Cuidadosamente abra la incisión y retirar el implante.
- Ultra-someter a ultrasonidos la matriz de electrodo en agua destilada durante 10 min eliminar los restos de tejido.
Nota: El implante puede ser reutilizado varias veces si los electrodos estén íntegros y correctamente llevando a cabo. Para comprobar esto, mida la impedancia de los electrodos con un multímetro cuando la matriz esté seca. - Almacenar la matriz de electrodos en un lugar seco.
Resultados
El propósito de este estudio era describir un modelo fiable para el estímulo de CI agudo en el ratón ciego. Umbrales de audiencia pre y post quirúrgica fue una lectura funcional del procedimiento ensordecedor. Aplicación tópica de neomicina 0.05% en la ventana oval y redonda aumentó significativamente los umbrales de audición chascar-evocadas por dB 46 ± 6 (neomicina después vs previo: 30,0 dB ± 3.8 vs 75,7 dB ± 3.7, p = 0.0003, emparejado prueba de t, n = 7) (figura 3). La matriz de electrodos tamaño ratón en adelante fue insertada en la ventana redonda (figura 4, figura 5). Simulación eléctrica de un electrodo intracochlear fiable podría generar actividad de eABR. (Figura 7). En algunos casos, CI estimulación activa el nervio facial y produce una onda de alta amplitud con latencia corta o larga (figura 8A y 8B figura, respectivamente). La respuesta de latencia corto se caracterizó por una rápida amplificación de la onda IV alrededor de 3 ms y es probable que sea una respuesta directa del nervio facial. La respuesta de latencia larga apareció alrededor de 5 – 6 ms y es probable que sea una respuesta muscular no auditivos (miógena) evocada indirectamente por el nervio facial. Las respuestas del nervio facial se divulgan raramente en estudios con animales en la literatura pero es una complicación bien conocida en humanos CI usuarios17,18,19. En figura 8, la estimulación del nervio facial apareció en los niveles actuales relativamente medianos (150-200 μA) y en dos animales diferentes. En otros casos, ambas respuestas pueden aparecer en el mismo animal en niveles muy altos de corriente (no mostrado). Se recomienda limitar el nivel actual a niveles por debajo de la apariencia de la estimulación del nervio facial.
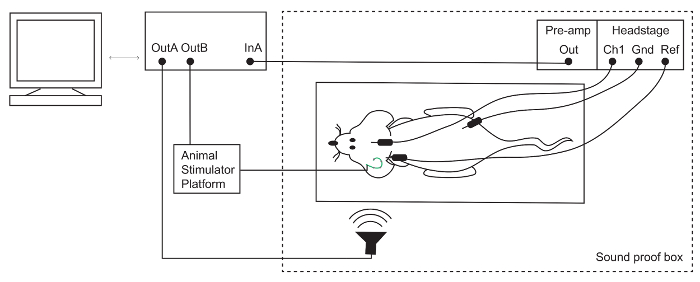
Figura 1: configuración de la respuesta de auditivos del médula oblonga (ABR). Se colocan electrodos subdérmicos en el vértice (activo/canal 1 [Ch1]), detrás de la oreja ipsilateral (referencia [Ref]) y en la pata trasera (tierra [Gnd]) del ratón anestesiado. Electrodo las señales se amplifican y luego grabadas por un sistema TDT. Estimulación acústica y eléctrica se presentan a través de un micrófono y una plataforma de estimulador de Animal, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
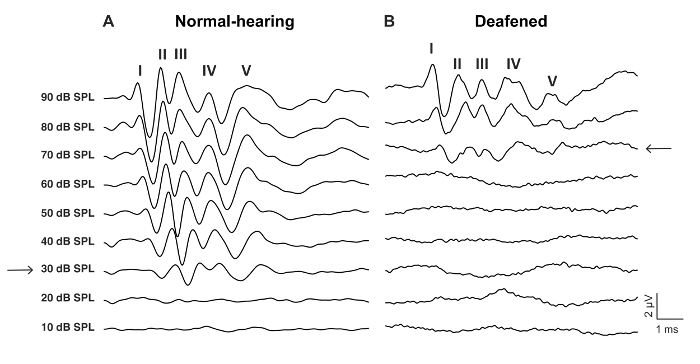
Figura 2: Representante Aabra ondas para la estimulación de un ratón de tipo antes y después de ensordecedor con neomicina 0.05%, haga clic en. (A) la audiencia normal Aabra patrón se caracteriza por ondas con-V y un umbral de baja audiencia, aquí 30 dB SPL (flecha). (B) Aabra ensordecido patrón muestra un umbral de mayor audiencia, aquí 70 dB SPL (flecha). Las olas tienen más variación temporal y un tiempo de latencia más largo. Haga clic aquí para ver una versión más grande de esta figura.
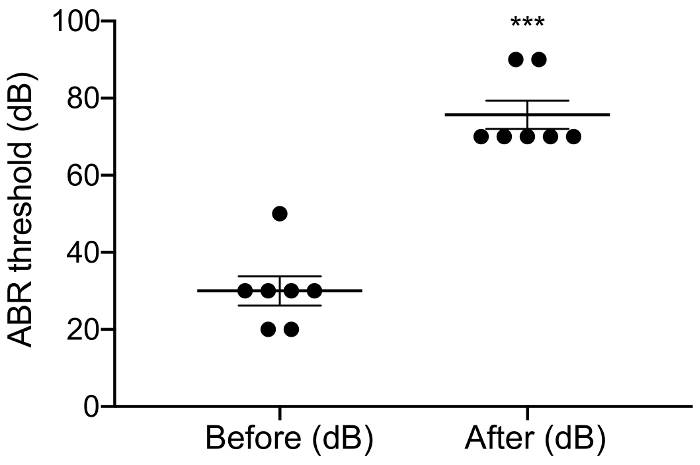
Figura 3: umbral de Aabra antes y después de ensordecedor. Aplicación de neomicina aumentó significativamente los umbrales Aabra por dB 46 ± 6. Neomicina después vs previo: 30,0 dB ± 3.8 vs 75,7 dB ± 3.7, p = 0.0003, emparejado la prueba de t, n = 7. Los errores son el error estándar de los medios. Haga clic aquí para ver una versión más grande de esta figura.
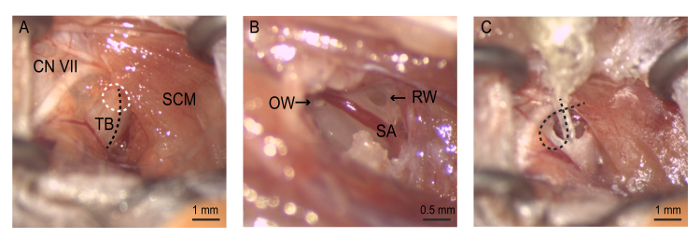
Figura 4: la cirugía. (A) la exposición a la ampolla auditiva. La bullostomy es realizada (círculo punteado blanco) a lo largo de la cresta en la bulla timpánica (línea punteada negra). (B) la bullostomy permite la visualización de la ventana oval, ventana redonda y arteria estapédica. Neomicina es suavemente limpiado a través primero de la ventana oval y la ventana redonda. Matriz (C) el electrodo se inserta hasta que el electrodo deth 4 está situado justo en el nicho de la ventana redonda. El hilo es enrollado dentro de la ampolla para mantener la matriz en su lugar antes de que se cierra la incisión. NC VII = nervio craneal VII (nervio facial), UJO = ventana oval, RW = alrededor de ventana, SA = arteria stapedial, SCM = músculo esternocleidomastoideo, TB = bulla timpánica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: el implante coclear ratón. (A) la matriz de electrodo intracochlear consiste en cuatro bandas platino espaciados a un intervalo de 0,4 mm con un diámetro d: 0 [tip] (d = 0,21), 1 (d = 0.23), 2 (d = 0,25), 3 (d = 0,27). El ancho de cada electrodo es de 0,2 mm. Los cuatro cables de parileno aislado de platino/iridio (90/10) están protegidos en un tubo de silicona. (B) la ampliación de la punta del arsenal del electrodo (cuadrado punteado rojo). La matriz de electrodos y una bola de referencia platino están conectados a una placa de impresión. Barra de escala = 1 mm. haga clic aquí para ver una versión más grande de esta figura.
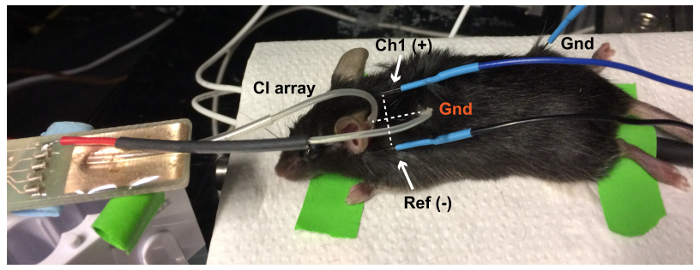
Figura 6: instalación eléctricamente evocados ABR (eABR). La bola de tierra de platino de CI (Gnd, rojo) se coloca en un bolsillo subcutáneo en el cuello del ratón. La línea entre activo (Ch1(+) en la cima) y electrodos de referencia (Ref (-) en el oído ipsilateral) ABR es perpendicular a la línea entre la matriz de electrodos y el suelo para obtener la mejor respuesta de eABR. El electrodo de tierra de eABR (tierra negra) se coloca en la pata trasera. Haga clic aquí para ver una versión más grande de esta figura.
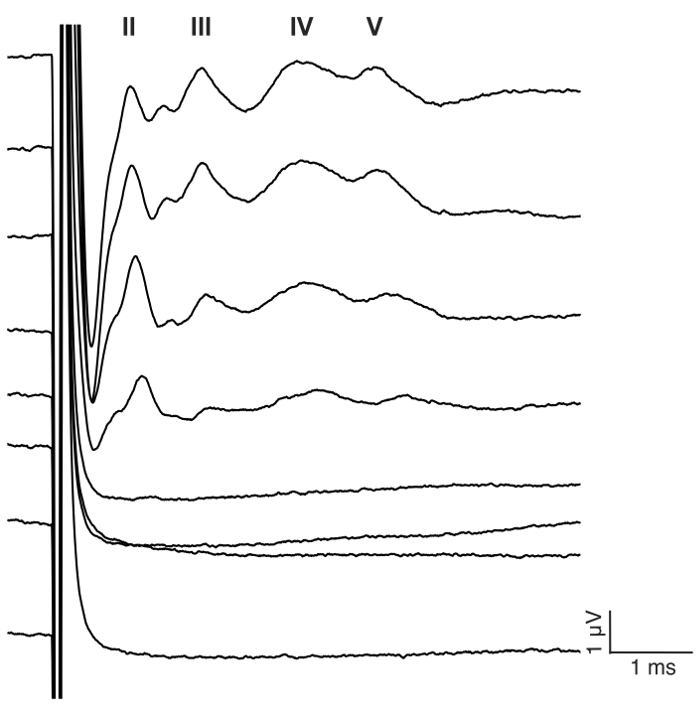
Figura 7: ondas de eABR representante al estímulo de la CI en un ratón ciego. Un tren de pulso bifásico se presenta al electrodo #1 en configuración monopolar en 23,3 pulsos por segundo (pps) con repeticiones de 400. Estímulos nivel 0-175 MA aparece en 25 pasos μA (ver detalles de estimulación en paso 7.2). Números romanos denotan el número de la onda de eABR. Las amplitudes de onda latencia aumentar y disminuir, respectivamente, con el aumento del nivel actual. En este ejemplo, wave II aparecieron alrededor de 1 ms, onda III alrededor de 2 ms, onda IV alrededor de 3 ms, de la onda V alrededor de 4 ms. Haga clic aquí para ver una versión más grande de esta figura.
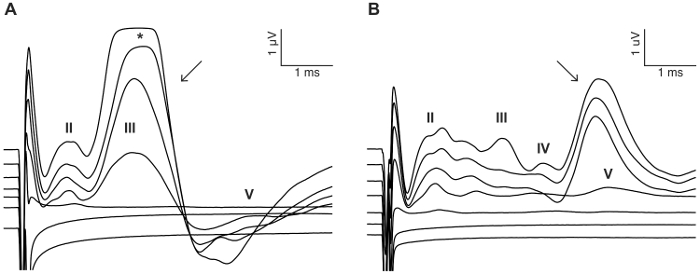
Figura 8: ejemplo de la estimulación del nervio facial. En algunos casos, CI la estimulación del nervio facial para activar y evocar una respuesta directa con latencia corta (A) (flecha) o una respuesta indirecta con latencia más largo (B) (flecha). Los ejemplos mostrados son de dos CI-implantado animales estimulados con un tren de pulso bifásico con 0 – 300 μA en μA 50 pasos (ver detalles de estimulación en paso 7.2). Números romanos denotan números de onda eABR. * denota el recorte de la onda de eABR debido a la saturación del amplificador. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este manuscrito describe el acercamiento quirúrgico agudo ensordecedor y la implantación coclear en el ratón, así como la evaluación funcional de la CI estimulación con respuesta auditiva del médula oblonga. Aunque la cóclea ratón es pequeña y la cirugía difícil, el modelo de ratón de CI es factible y sirve como una herramienta valiosa en la investigación auditiva.
La arteria stapedial está presente en el oído medio del ratón. La arteria entra en la ampolla posterior medialmente y extiende inferiorly hasta el nicho de la ventana redonda y luego superior del nicho de la ventana oval. En el desarrollo inicial del modelo de ratón, experimentamos fatal trauma siguiente hemorragia intraoperatoria a la arteria stapedial, principalmente al acceder a la bulla. Como consecuencia, hemos adaptado un enfoque más limitado y acceder la bulla en los pasos de disección menor, refinado. Se observaron después de eso sin complicaciones por sangrado. A pesar de que esa cauterización de la arteria stapedial no tiene ningún efecto significativo en el número de las neuronas del ganglio espiral o de umbral de audición en ratones5, en nuestra opinión, no es necesario siempre y cuando el gran cuidado se toman durante la cirugía. Sugerimos tomar el tiempo necesario para desarrollar la psicomotricidad fina y llegar a nivel técnico. El tiempo medio de incisión inicial cierre alrededor de la matriz de electrodos implantados es típicamente 1 a 1,5 h.
La cirugía descrita de CI aguda en ratones es similar al procedimiento "ventral" y la ventana redonda inserción en otros roedores, incluyendo ratas y jerbos20,21,22. Otros estudios del roedores han utilizado el «enfoque dorsal» con una cochleostomy de la vuelta basal en vez de una inserción de la ventana redonda, evitando totalmente el SA e insertar la matriz más profundamente6,23,24. La implantación de un conjunto de estimulación crónica en ratones sigue los mismos pasos como se describe en este protocolo con la incorporación de una malla de dacrón para fijar el implante y cuidado postoperatorio5.
Los principales retos técnicos al realizar cirugías de CI en ratones son el pequeño tamaño de la cóclea en comparación a la cóclea de ratas y jerbos y la presencia de una grande SA. El SA también está presente en ratas pero no en jerbos. Además, puesto que los ratones son más pequeños que las ratas y jerbos, son más vulnerables a procedimientos quirúrgicos.
Para eliminar las respuestas electrophonic en grabaciones de eABR y para imitar la pérdida de la célula de pelo encontrada en la mayoría de los usuarios de CI, ensordecidos los animales antes de la inserción de la CI. Los ratones son difíciles soportarla ototoxically en vivo25 porque las concentraciones sistémicas de los aminoglucósidos debe causar ototoxicidad tiene una ventana estrecha de la dosis: bajar la dosis dados sobre varios resultados de días no hay pérdida de células ciliadas, mientras que una sola inyección de una dosis más alta puede ser letal26. Susceptibilidad a los aminoglucósidos es también dependiente de la cepa26. Sin embargo, se ha demostrado que una dosis única de aminoglucósidos en combinación con un diurético de asa puede producir pérdida de la célula de pelo externa excesiva en ratones CBA/CaJ sin consecuencias fatales27. Informó de la muerte de la célula de pelo interna retrasada en la mitad de los cócleas examinadas27.
En este manuscrito, se utilizó la aplicación tópica del neomicina de aminoglucósidos inspirado en el protocolo recientemente establecido de ratones C57BL/65. Aguda aplicación de neomicina aumentó significativamente el umbral de audición chascar-evocadas por 46 dB ± 6.1. Aunque este aumento es mayor que el aumento de 35 dB por Irving et al. (después de la cirugía vs previo: 41,6 dB ± 3.3 vs 76,6 dB ± 4.4, p = 0,02, n = 3) 5, logramos el mismo umbral la ensordecedor (75,7 dB ± 3.7 vs 76,6 dB ± 4.4). neomicina 0.05% se piensa para causar una pérdida parcial de la audición, principalmente por la muerte de la célula de pelo externa rápida, como pérdida de la célula de pelo interna tarda más en producirse27. Por lo tanto es posible que electrophonic respuesta, que es generado tanto por el interior y células de pelo externas4,8,9,10,11,12, sólo es parcialmente eliminados en animales ensordecidos con audición residual. A pesar de neomicina 0.05% (peso/volumen) no disminuye el número de las neuronas del ganglio espiral 4 semanas post-ensordecedor5, es aún desconocido si neomicina en nuestra instalación aguda afecta a las fibras del nervio auditivo o promueve el synaptopathy (pérdida de sinapsis entre células de pelo internas y el tipo me auditiva del nervio las fibras). Otra incertidumbre es que el tratamiento tópico de la neomicina puede no producir una distribución uniforme de la pérdida de células ciliadas a lo largo de la longitud de la cóclea. Se requieren futuros estudios para responder a estas preguntas.
En Resumen, el creciente número de modelos genéticos para sordera humana y las herramientas bioquímicas hace el ratón un atractivo modelo animal para la investigación auditiva, incluyendo el campo de la CIs.
Divulgaciones
No hay intereses financieros que compiten. Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Pierre Stahl, Oticon Medical, Niza, Francia, para proporcionar la plataforma de estimulación Animal y asesoramiento en paradigmas de estimulación y James B. Fallon y Andrew K. Wise de biónica Institute, Melbourne, Australia, para asesoramiento quirúrgico . Este trabajo fue financiado por una subvención de la Swiss National Science Foundation (subvención de la transferencia del CEI a T.R.B.).
Materiales
| Name | Company | Catalog Number | Comments |
| Hardware | |||
| Sound-proof booth | IAC Acoustics, Winchester, UK | Mac-2 Enclosure RF Shielded Box 2A | |
| MF1 Speaker | Tucker Davis Technologies (TDT), FL, USA | ||
| PCB microphone | PCB Piezotronics, Inc, NY, USA | Model 378C01 | |
| Low impedance headstage | TDT, FL, USA | RA4LI | |
| Medusa pre-amplifier | TDT, FL, USA | RA4PA | |
| RZ6 auditory processor | TDT, FL, USA | ||
| Animal Stimulator Platform | ASP, Oticon Medical, Nice, France | ||
| Multimeter | Fluks | #115 | |
| Surgical equipment | |||
| Closed-loop heating pad | FHC, Inc. ME, USA | ||
| Eye ointment | Alcon, CH | Lacrinorm Augengel | |
| Acoustic foam | Otoform Ak, Dreve Otoplastik GmbH | #464 | |
| Disposable subdermal needle electrodes | Horizon, Rochester Electro-Medical Inc. | S83018-R9, 27G | |
| Self-retaining retractor tool (Mini Collibri Retractor) | Fine Science Tools | #17000-01 | |
| Suction wedges | Agnthos, SE | #42-886-460 | |
| Absorbable paper point (Medium) | WPI, FL, USA | #504182 | |
| Intracochlear electrode array | Bionics Institute, Melbourne, Australia | 4 channel | |
| Spongostan Standard | Ferrosan Medical Devices | #MS0002 | |
| Tissue glue. Loctite 4161 Superbond | Henkel | Part No 19743 | |
| Animal Stimulator Platform (ASP) | Oticon Medical, Nice, France | ||
| Drugs/chemicals | |||
| Ketamine (Narketan) | Provet AG, CH | 100mg/mL, #VQ_320265 | |
| Xylazine (Rompun) | Provet AG, CH | Inj Diss 2%, # 1315 | |
| Bupivacaine | Compendium, CH | Bupivacain Sintetica inj Diss 0.5% | |
| Atropine (Atropinesulfat Amino) | Amino AG, CH | 1 mg/mL | |
| Betadine (Povidone/iodine) | Provedic, CH | ||
| Neomycin (Neomycin trisulfate salt) | Sigma | N1876-25G, Lot#WXBB7516V | |
| Software | |||
| BioSigRZ | TDT, FL, USA | ||
| Matlab | MathWorks, MA, USA | ||
| ASP software | Oticon Medical, Nice, France |
Referencias
- The-Ear-Foundation. . Cochlear Implants Update. , (2018).
- Fallon, J. B., Irvine, D. R. F., Shepherd, R. K. Cochlear Implants and Brain Plasticity. Hearing Research. 238 (1-2), 110-111 (2008).
- Pfingst, B. E., et al. Neurotrophin Gene Therapy in Deafened Ears with Cochlear Implants: Long-term Effects on Nerve Survival and Functional Measures. Journal of the Association for Research in Otolaryngology. 18 (6), 731-750 (2017).
- Miller, C. A., et al. Electrical excitation of the acoustically sensitive auditory nerve: single-fiber responses to electric pulse trains. Journal of the Association for Research in Otolaryngology. 7 (3), 195-210 (2006).
- Irving, S., et al. Cochlear implantation for chronic electrical stimulation in the mouse. Hearing Research. 306, 37-45 (2013).
- Soken, H., et al. Mouse cochleostomy: a minimally invasive dorsal approach for modeling cochlear implantation. Laryngoscope. 123 (12), E109-E115 (2013).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hearing Research. 312, 81-90 (2014).
- Hartmann, R., Topp, G., Klinke, R. Discharge patterns of cat primary auditory fibers with electrical stimulation of the cochlea. Hearing Research. 13 (1), 47-62 (1984).
- Sato, M., Baumhoff, P., Kral, A. Cochlear Implant Stimulation of a Hearing Ear Generates Separate Electrophonic and Electroneural Responses. The Journal of Neuroscience. 36 (1), 54-64 (2016).
- Pfingst, B. E., Spelman, F. A., Sutton, D. Operating ranges for cochlear implants. Annals of Otology, Rhinology & Laryngology. 89 (2), (1980).
- Miller, C. A., Hu, N., Zhang, F., Robinson, B. K., Abbas, P. J. Changes across time in the temporal responses of auditory nerve fibers stimulated by electric pulse trains. Journal of the Association for Research in Otolaryngology. 9 (1), 122-137 (2008).
- Shepherd, R. K., Javel, E. Electrical stimulation of the auditory nerve. I. Correlation of physiological responses with cochlear status. Hearing Research. 108 (1-2), 112-144 (1997).
- Akil, O., Oursler, A. E., Fan, K., Lustig, L. R. Mouse Auditory Brainstem Response Testing. Bio Protocol. 6 (6), (2016).
- Willott, J. F. Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current Protocols in Neuroscience. Chapter 8 (Unit 8.21B. , (2006).
- TDT. . ABR User Guide: A Guide to ABR Testing with the System 3 RZ6. , (2017).
- Muller, M., von Hunerbein, K., Hoidis, S., Smolders, J. W. A physiological place-frequency map of the cochlea in the CBA/J mouse. Hearing Research. 202 (1-2), 63-73 (2005).
- Cushing, S. L., Papsin, B. C., Gordon, K. A. Incidence and characteristics of facial nerve stimulation in children with cochlear implants. Laryngoscope. 116 (10), 1787-1791 (2006).
- Berrettini, S., Vito, D. A., Bruschini, L., Passetti, S., Forli, F. Facial nerve stimulation after cochlear implantation: our experience. Acta Otorhinolaryngologica Italica. 31 (1), 11-16 (2011).
- Hu, H., Kollmeier, B., Dietz, M. Reduction of stimulation coherent artifacts in electrically evoked auditory brainstem responses. Biomedical Signal Processing and Control. 21, 74-81 (2015).
- Wiegner, A., Wright, C. G., Vollmer, M. Multichannel cochlear implant for selective neuronal activation and chronic use in the free-moving Mongolian gerbil. Journal of Neuroscience Methods. 273, 40-54 (2016).
- Hessel, H., et al. Meriones unguiculatus (Gerbil) as an animal model for the ontogenetic cochlear implant research. American Journal of Otolaryngology. 18 (S21), (1997).
- Pinilla, M., Ramirez-Camacho, R., Jorge, E., Trinidad, A., Vergara, J. Ventral approach to the rat middle ear for otologic research. Otolaryngology Head Neck Surgery. 124 (5), 515-517 (2001).
- King, J., Shehu, I., Roland, J. T., Svirsky, M. A., Froemke, R. C. A physiological and behavioral system for hearing restoration with cochlear implants. Journal of Neurophysiology. 116 (2), 844-858 (2016).
- Lu, W., Xu, J., Shepherd, R. K. Cochlear implantation in rats: a new surgical approach. Hearing Research. 205 (1-2), 115-122 (2005).
- Poirrier, A. L., et al. Ototoxic drugs: difference in sensitivity between mice and guinea pigs. Toxicology Letters. 193 (1), 41-49 (2010).
- Wu, W. J., et al. Aminoglycoside ototoxicity in adult CBA, C57BL and BALB mice and the Sprague-Dawley rat. Hearing Research. 158 (1-2), 165-178 (2001).
- Taylor, R. R., Nevill, G., Forge, A. Rapid hair cell loss: a mouse model for cochlear lesions. Journal of the Association for Research in Otolaryngology. 9 (1), 44-64 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados