Method Article
인공 와우 수술 및 C57BL/6 마우스에 전기 evoked 청각 Brainstem 응답 기록
요약
달팽이 관 임 플 란 트의 동물 모델 영구 난청 전기 자극 치료의 기술 기반 지식을 사전 수 있습니다. 이 연구는 급성 굉음을 쥐 청각 brainstem 응답 기능 평가 있는 전극 배열 인공 와우 이식 수술 프로토콜을 제공합니다.
초록
달팽이 관 임 플 란 트 (CIs)는 귀 머 거리 사람들에 게 청각의 감각을 제공할 수 있는 neuroprosthetic 장치. 그러나, CI는 청각의 모든 측면을 복원할 수 없습니다. 이식 기술의 개선 CI 사용자가 음악을 인식 하 고 경쟁 발음, 반사, 그리고 다른 소리는 목소리 듣고 같은 더 자연 스러운 환경에서 수행 하는 경우 필요 합니다. 이러한 개선 실험 동물을 달팽이 관에서 전기 자극 및 전체 청각 시스템에서의 응답의 메커니즘을 이해 하기를 요구 한다. 마우스 사용 가능한 많은 유전자 모델 점점 더 매력적인 모델입니다. 그러나, CI 모델이 종족의 한정 된 사용 주로 작은 전극 배열 이식의 어려움 때문입니다. 수술에 대 한 자세한 정보는 그러므로 CI 연구에서 마우스를 사용 하 여 확장을 큰 관심.
이 보고서에서 우리가 자세히 설명 급성 굉음과 인공 와우 이식 C57BL/6 마우스 스트레인에 전극 배열에 대 한 프로토콜. 우리 전기 evoked 청각 brainstem 응답 (eABR)이이 절차의 기능적 효능을 입증 하 고 안 면 신경 자극의 예를 보여. 마지막으로, 우리는 또한 일반적으로 청각을 사용 하 여 때 굉음 절차를 포함 하 여의 중요성을 논의 동물. 이 마우스 모델 CI 사용자에 대 한 관련성의 것 유전과 neurobiological 메커니즘 연구를 강력한 기회를 제공 한다.
서문
달팽이 관 임 플 란 트 (CIs)는 사람들에 게 심각 하 고 심오한 청각 상실과 청각의 감각을 제공할 수 있는 전자 장치. 내가 달팽이 관 이식 수술 전극 사용 하 여 직접 청각 신경을 자극. 날짜 하려면, CI는 가장 성공적인 감각 족 이며 60 개 이상의 사람들이 전세계1있었습니다. 그러나, 장치는 단점. 첫째, 장치에서 제공 하는 혜택 받는 사람 마다 크게 다릅니다. 둘째, 환경 및 음악에 연설 여전히 저조한 대부분 CI 사용자에 의해 감지 된다.
몇 년 동안, 동물 모델 CI 연구에 이러한 문제를 더 잘 이해 하 고 지속적으로 안전 및 소자의 효능을 개선 하기 위해 사용 되었습니다. 모델 일어나 CI 이식2, 다음 뇌에 플라스틱 변화 등 여러 현상에 대 한 값진 통찰력 준 잔여 청각3및의 생물 속성을 유지 하기 위해 유전자 치료를 적용의 효과 전기 자극된 청각 신경4, 많은 다른 보기 사이에서.
마우스는 난청의 유전자 모델의 큰 가용성으로 인해 강력한 모델 유기 체. 다른 장점 마우스 게놈을 조작 하는 기능 (예:, CRISPR-Cas 시스템을 통해), 기회를 사용 하 여 고급 이미징 기술 메커니즘, 특히 뇌, 높은 재생 속도, 신속한 개발을 공부 하 고 쉽게 번 식 하 고 처리. 쥐에 있는 CI 수술을 수행에 주요 기술 과제는 달팽이 관의 작은 크기와 큰 stapedial 동맥 (SA)의 존재 있습니다. SA는 일반적으로 인간에서 배아 개발 하는 동안 사라집니다 그러나 설치류, 쥐, 쥐, gerbils 등의 여러 생활 내내 지속. SA는 달팽이 관에 대 한 액세스를 복잡 하 고 수술 위험 증가 둥근 창 틈새 아래 실행 됩니다.
이전 연구에서 쥐5,,67CI 이식의 타당성을 나타났습니다. 어 빙 외. 만성 intracochlear 전기 자극까지 한 달 동안 달성 될 수 있다 설명 했다. 급성 자극 또한 수행 하지만 녹음 하지 발표 했다. 그들은 보여주었다 stapedial 동맥을 cauterizing 심리 임계값 또는 나선형 ganglion 신경의 수에 아무런 상당한 영향 했다는 고 aminoglycoside 네오 마이 신, ototoxic 약물의 국 소 응용 프로그램에 효과적인 굉음 절차는 마우스5. Soken 외. 더 나은 청각 상태6을 유지 하기 위해 라운드 창을 통해 마우스 달팽이 관에 대 한 수정된 등 접근을 설명 합니다. 백 금-이리듐 와이어의 삽입, 다음 상당한 잔여 청문회는 28 dB의 (ABR) 임계값 증가 청각 brainstem 응답으로 관찰 되었다. Otoacoustic 방출 (OAE) 큰 ABR 임계값 교대6동물에서 분실 되었다. Mistry 외7전기 자극 부재에서 이식의 기능과 histopathological 효과 테스트. 청각은 저주파 수에서 3와 6 개월 된 이식된 생쥐에서 보존 되었다, 비록 주입 섬유 증 같은 조직 이식 주위와 osteoneogenesis bullostomy7주위 귀착되 었 다.
즉, 쥐에 있는 CIs에 3 개의 학문에서 단 하나는 CI 자극의 기능 녹음을 보여 줍니다. 어 빙와 동료 둘 다 급성과 만성 eABR 녹음을 수행 하지만 만성 CI 자극5에서 데이터. 그러나, 어 빙 연구진이 개발 완전 이식 장치 만성 모델은 기술적으로 도전 합니다. 그것은 아직 알려져 있지 경우 급성 CI 자극, 덜 도전적이 고 빠른, 모두 비슷한 결과 얻을 수 있습니다.
CIs는 보청기의 혜택을 더 이상 심각 하 고 깊은 청력 손실 가진 사람에 의해 사용 됩니다. 따라서 CI 사용자에 대 한 동물 모델은 일반적으로 동물 사용 됩니다 청문회 때 굉음 프로시저를 포함 해야 합니다. 청각 동물 멍 하 고 또 다른 이유는 농 아 또는 청각 달팽이 관의 전기 자극 다른 신경 응답4,,89,10,11, 생산 12. 귀 달팽이 관의 전기 자극은 직접 청각 신경 섬유를 활성화 하 고 electroneural 응답 (α) 생성. 그것은 짧은 대기 시간 및 주변8,10작은 동적 범위 특징 이다. 다른 한편으로, 청각 달팽이 관의 전기 자극은 또한 더 긴 대기 시간 및 더 큰 다이나믹 레인지4,11특징 이다는 electrophonic 응답 (β) 세포 흥분. Electrophonic 응답 내부 세포, 외부 머리 세포의 전기적 유도 수축 및 여행 파4의 생성에 의해 신경 섬유의 정상적인 구동에 기인 된다. Electroneural 및 electrophonic 응답 또한 중앙 신경 조직9에서 두 개의 다른 활동 패턴 발생. 사토 외. 네오 마이 신, electrophonic 기여 제거와 굉음 전후 CI 이식 기니 피그의 midbrain 뉴런을 기록 했다. 그들은 속도 수준 함수의 기울기는 험한와 심리 상태9에 귀 상태에서 높은 비해 발사 속도 보여주었다. 따라서, 명시 된 연구 질문에 따라 별도 electrophonic 및 electroneural 청각 신경의 전기 자극에 응답을 굉음 등을 고려 하는 중요 하다.
여기, 우리는 심각한 굉음에 대 한 절차와 마우스에 전극 배열의 달팽이 관 이식 청각 brainstem 전기 evoked 응답 (eABR) intracochlear 전기 자극의 기능 녹음 설명합니다.
프로토콜
모든 절차는 바젤 대학, 스위스, 동물 보호 및 지침에 따라 실시 했다. 그들은 구획의 바젤, 스위스의 수의 사무실에 의해 허가 했다.
참고: C57BL/6 성인 쥐, 8-12 주 (무게 20-30 g), 세이 연구에 사용 되었다.
왼쪽된 귀는 실험 귀로 사용 됩니다. 오른쪽 귀는 내 동물 제어 역할 하 고 수술로 변경 되지.
1. 수술 전 절차
-
케 타 민/xylazine (80 mg/kg 케 타 민, 16 mg/kg xylazine, i.p., 볼륨 10 μ/g 몸 무게에 주입)의 복 막 내부 (i.p.) 주입을 통해 수술 전에 동물 30 분 anaesthetize
- 긍정적인 페달 및 종을 (발가락-핀치) 반사와 케 타 민 (45 mg/kg, i.p., 10 μ g/몸 무게에서 주입)의 낮은 복용량으로, 수염의 움직임에 의해 심판을, 필요에 따라 마 취를 보충. 에이전트 및 복용량 정권 기관 지침 당 교체하실 수 있습니다.
참고: 일반적으로, 동물 필요 합니다 주사가 에이전트 및 복용량 정권 마다 45-60 분. 이식된 전극 배열 주위 폐쇄 초기 절 개에서 평균 시간은 일반적으로 1-1.5 시간 이다.
- 긍정적인 페달 및 종을 (발가락-핀치) 반사와 케 타 민 (45 mg/kg, i.p., 10 μ g/몸 무게에서 주입)의 낮은 복용량으로, 수염의 움직임에 의해 심판을, 필요에 따라 마 취를 보충. 에이전트 및 복용량 정권 기관 지침 당 교체하실 수 있습니다.
- 정기적인 호흡 속도 발가락-핀치 반사의 부족에 의해 표시 된 동물의 전체 진정에 대 한 확인 하십시오. 이 정도의 마 취를 유지 합니다.
- 폐쇄 루프 난방 패드 36.6 ° C에서 동물의 체온을 유지 한다. 각 막의 탈수를 피하기 위해 눈 연 고를 적용 합니다. 이 또한 동물의 깜박임 반사는 레코딩에 소음을 추가할 수 있는 표시 되지 것입니다.
- Bupivacaine/Lidocaine의 피하 주사 (사우스 캐롤라이나) 통해 로컬 진통제 관리 (0.1 mg/mL bupivacaine 및 lidocaine 0.4 mg/mL, 0.1 mL 관리 사우스 캐롤라이나) 어떤 수술 불편을 최소화 하기 위해 의도 된 절 개 라인을 따라. 에이전트 및 복용량 정권 기관 지침 당 교체하실 수 있습니다.
- 관리 muscarinic 적 아트로핀 (atropinesulfate 아미노산, 0.1 mg/mL, 20 μ 관리 사우스 캐롤라이나, PBS에 용 해) 점액 분 비를 줄이기 위해 호흡을 촉진 하는 목에서. 에이전트 및 복용량 정권 기관 지침 당 교체하실 수 있습니다.
2. 미리 굉음 음향 청각 Brainstem 응답 (aABR)
참고: aABR 청각 굉음 전후 상태를 측정 하는 데 사용 됩니다. 테스트 하는 것은 왼쪽된 귀에와 전기적 차폐 방음 부스에서 수행 됩니다. 우리가 테스트 하 고 나중에 오른 손잡이 사람을 위해 왼쪽된 귀를 이식 하는 것이 좋습니다. 마우스에 ABR에 대 한 자세한 내용은13,14에서 찾을 수 있습니다. 터 커 데이비스 기술 (TDT) 하드웨어 및 소프트웨어 (BioSig) ABR을 기록 하는 데 사용 됩니다 하지만 다른 시스템을 사용할 수 있습니다.
- 동측 (왼쪽된) 귀에서 ABR 응답을 음향 거품 contralateral (오른쪽) 귀를 차단 합니다. 1 mL 주사기에 거품을 넣고 거품을 가진 전체 귀 운하를 마우스의 오른쪽 귀 운하에 주사 (0.1-0.2 mL의 거품). 있는지 확인 주사기 물개 밀접 하 게 귀에 거품 줄곧 외가도에 도착을 합니다.
- 스피커 왼쪽된 귀에서 10 cm를 놓습니다.
참고: 이 설정에 대 한 스피커 refefence15에 설명 된 대로 PCB 마이크를 사용 하 여 측정 했다. - 70% 에탄올 솔루션 ABR 전극을 청소 합니다. 피부 아래 전극 배치: 액티브 (Ch1)는 정점에 동측 귀의 pinna 아래 (-)를 참조 하 고 뒷 다리 (그림 1)에서.
- 광섬유 포트를 통해 청각 프로세서에 머리-무대와 프리 앰프를 연결 합니다.
-
활성의 임피던스 및 참조 전극 확인 합니다.
- 임피던스 3 옴 이상 인 경우에, 그들을 재정비 하 고 다시 측량을가지고 가십시오. 최고의 녹음 전극 동일한 임피던스를가지고 얻을 수 있습니다. 방음 부스를 닫습니다.
- 클릭 자극을 제시 하 고 복잡 한 청각 프로세서와 소프트웨어 무료 필드 조건에 ABR를 기록 합니다. 소프트웨어에서 클릭 자극 표준화: 0.1 ms 단일 채널 monophasic 클릭 21 Hz; 시 제시 클릭 10 dB 단계; 10 dB SPL에서 90 dB SPL 레벨 감소 10 ms 윈도우 기록입니다. 각 dB 수준에서 512 응답의 총 평균.
- 2000 Hz 저역 통과 필터와 300 Hz 고 역 통과 필터를 오프 라인으로 주문 품 Matlab 스크립트를 사용 하 여 기록에 소음을 줄이기 위해 적용 됩니다.
- ABR 웨이브 응답 (그림 2, 그림 3) 인식할 수 있는 가장 낮은 dB 수준으로 ABR 임계값을 결정 합니다.
3입니다. 수술
참고: 사용 되는 일반적인 계기는 시저, 메스, 직선 또는 곡선 팁, 조직 견인 도구, 여러 흡입 웨지와 흡수 종이 포인트 금속 집게의 쌍을 포함 합니다. 수술은 왼쪽된 귀에 수행 됩니다.
- 그것의 오른쪽에 마우스를 넣어. 자 궁 경부 척추에 과도 한 비틀림 스트레스를 하지 마십시오. 기도 열어 바로 시체를 유지 해야 합니다.
- 한가 위를 왼쪽된 귀 뒤에 모피 (잘라내거나는 면도기로 면도) 피부를 노출. 70% 에탄올 솔루션 및 betadine (povidone/요오드) 피부를 소독.
- 현미경 배율 (16 배속), 메스로 절 개 후 귀의 1-1.5 cm 확인.
- 더 높은 현미경 배율 (25 x)으로 전환 합니다.
- 집게와 가변 두께의 수, 피하 지방 층을 통해 둔 기 해 부를 수행 합니다.
참고: 외부 경 정 맥 통과이 지역으로 해 부 할 때 주의 해야 합니다. 이 구조에 손상을 과도 한 출혈이 발생할 수 있습니다. - 귀 물집과 공개 sternocleidomastoid 근육을 철회. 주요 해부학 적 랜드마크로 안 면 신경을 사용 하 여 청각 물집의 식별을 돕기 위해. 안 면 신경 sternocleidomastoid 근육의 후부/등 쪽 가장자리 주위를 감싸는 고 pinna 향해 귀 운하를 따라 rostrally 실행 합니다. 부드럽게 물집 (그림 4)에 대 한 액세스를 쉽게 하기 위해 절 개에 자기 고정 견인 도구를 배치 합니다.
- Overlying mastoid 과정과 물집 사이 능선의 명확한 시각화 수 있도록 물집의 평점 등 지역 조직을 제거 합니다.
- 부드럽게 회전 하는 물집 피어스 고 (뼈가이 쪽에 얇은) 능선의 후부 우수한 측에 구멍 (bullostomy) 30 G 바늘. 또는 치과 수술 드릴을 사용 합니다.
참고: 선호 하는 경우이 고 다음 단계 더 높은 현미경 확대 (40 x)와 함께 할 수 있습니다. 또한, 필요한 경우 현미경의 위치를 변경 합니다. 가운데 귀 공간 수술 보기를 최대화 하기 위해 중요 하다. -
잘 밀고 집게를 사용 하 여 중간 귀 구멍을 노출 하는 작은 뼈 조각 곤란 하 여는 bullostomy를 넓히다. 둥근 창 틈새의 뼈를 overlying 분명 하다 때까지 dorsally mastoid 과정으로 bullostomy를 확장 합니다. Stapedial 동맥의 내부 경 동맥 분기 둥근 창 틈새 복 부 실행 됩니다.
- 수 치명적일 수 있습니다 과도 한 출혈로 혈관을 손상 하지 않도록 주의 하십시오. 작은 출혈 귀 구멍에 있는 spongostan의 작은 조각을 눌러 중지 될 수 있습니다.
- 등골, 타원형 창에 연결 하는 중간 귀 뼈를 시각화 하기 위해 우수한 앞쪽 방향으로 bullostomy를 확장 합니다.
- 타원형 창 노출 집게와는 등골을 제거 합니다.
4. 둥근 창 Ototoxic 에이전트의 응용 프로그램
- 부드럽게 무딘된 30g 바늘을 사용 하 여 둥근 창과 타원형 창 막 구멍. 그 perilymph 실행 확인 하십시오.
- 천천히 0.05% 무게/볼륨 네오 마이 신 타원형 창을 통해 PBS (pH 7.4에 조정)에 용 해 perfuse. 액체는 둥근 창 밖으로 플러시 한다. 둥근 창에 동일한 절차를 반복 합니다. 수 perfuse 하는 데 사용 하는 바늘 창 뼈 구조를 손상 하지 않도록 주의 하십시오.
- Spongostan 라운드 창과 타원형 창 틈새 시장 내에서 네오 마이 신에 배어의 작은 조각 (1 m m2)를 배치 합니다.
- 견인 도구 제거 절 개 닫고 30 분을 기다립니다.
5. 후 굉음 음향 ABR
- 비슷한 방법으로 굉음 (단계 2.2 2.8) 전에 aABR을 기록 (그림 2b, 그림 3).
6입니다. CI 전극 배열 삽입
참고: 백 금/iridum 파 릴 렌 절연 와이어 실리콘 튜브 (그림 5) 차폐와 4 개의 플래티넘 밴드 (Ø0.2 m m) intracochlear 전극 배열에 의하여 이루어져 있었다.
- 다시는 물집 액세스 절 개에 견인 도구를 놓습니다.
- 둥근 창 (scala tympani) 깊이에 둥근 창 내 4번째 플래티넘 반지 위치에 전극 배열 삽입. 이 ~ 2 m m,16~ 30 kHz intracochlear 위치로 해당 삽입 깊이 제공 합니다.
- 리드 와이어는 물집 내부 코일 하 고 접착제는 물집 위의 조직에 와이어. 와이어 감기 실험 내내 자리에 배열 유지 도움이 됩니다.
- 조심 스럽게 견인 기를 제거 하 고 조직 접착제로 삽입을 닫습니다.
- 어디 사이에 수직 목에 작은 절 개 (0.5 m m) 하 게 활성 참조 ABR 전극 조직이 위를 사용 하는 것입니다. 피하 포켓에 플래티넘 땅 볼을 놓고 조직 접착제 (그림 6) 작은 절 개를 닫습니다.
- 전극 배열 보드 동물 자극 기 플랫폼에 연결 합니다.
7. 전기 청각 Brainstem 응답 (eABR)
참고: 동물 자극 플랫폼 (ASP)는 전기적 자극 전극 배열 하는 데 사용 됩니다. 다른 전류 소스 및 소프트웨어 시스템을 사용할 수 있습니다.
- ABR 전극으로 (2.3 ~ 2.5 단계) 전에 (그림 6)를 배치 합니다.
- ASP 소프트웨어 열고 전기 펄스 자극 패러다임을 정의 합니다. 충전 평형 복 형 펄스를 사용 하 여 50 μ s/단계는 우리와 10 μ interphase 간격 초 (조달 청) 당 23.3 펄스에서 발표. 전기 자극은 monopolar 전극 구성 현재 수준 증가 함께 전달 됩니다. 400 응답의 총 각 현재 수준에 평균 된다.
- 전기 펄스 트레인을 제시 하 고 TDT headstage 통해 지속적으로 evoked eABR 응답, 프리 앰프와 청각 프로세서를 기록 합니다.
- 플롯 및 맞춤 matlab 스크립트 (그림 7)를 통해 eABR 데이터 분석. 스크립트 및 녹음의 예는 보에 제공 됩니다.
8입니다. 실험의 끝
- 실험의 끝에, 기관 지침에 따라 동물을 안락사.
- 조심 스럽게 절 개를 열고는 임 플 란 트를 제거 합니다.
- 울트라-sonicate 10 분 조직 파편을 제거 하기 위해 증류수에 전극 배열.
참고: 이식 전극은 그대로 하 고 제대로 실시 하는 경우 여러 번 다시 수 있습니다. 배열이 건조 할 때이 확인 하려면 멀티 미터와 전극의 임피던스를 측정 합니다. - 건조 한 장소에 전극 배열을 저장 합니다.
결과
이 연구의 목적은 귀 마우스에서 급성 CI 자극에 대 한 신뢰할 수 있는 모델을 설명 했다. 예약 하 고 수술 후 임계값 굉음 절차의 기능 판독 역임 했습니다. 0.05% 네오 마이 신 타원형과 둥근 창에서의 국 소 응용 프로그램 크게 46 dB ± 6 클릭 갖는 심리 임계값 증가 (사전 vs 사후 네오 마이 신: 30.0 dB ± 3.8 vs 75.7 dB ± 3.7, p = 0.0003, 쌍이 t-검정, n = 7) (그림 3). 마우스 크기의 전극 배열 (그림 4, 그림 5) 둥근 창에 삽입이 되었다. Intracochlear 전극의 전기 시뮬레이션 안정적으로 eABR 활동을 생성할 수 있습니다. (그림 7)입니다. 경우에 따라 CI 자극 얼굴 신경 활성화와 짧은 또는 긴 대기 시간으로 높은 진폭의 파를 생성 (그림 8A 와 그림 8B, 각각). 짧은 대기 시간 응답 웨이브 IV 약 3 ms의 급속 한 확대에 의해 특징 이었다 고 안 면 신경의 직접적인 응답 될 것입니다. 긴 대기 시간 응답 약 5-6 ms를 등장 하 고 안 면 신경에 의해 직접 불러 일으켰다 비 청각 근육 (조직적) 응답 될 것입니다. 안 면 신경 응답 거의 문학에서 동물 연구에서 보고 된 하지만 인간의 CI 사용자17,,1819에 잘 알려진 합병증. 그림 8, 안 면 신경 자극 나타나 상대적으로 중간 전류 레벨 (150-200 µ A)와 두 개의 서로 다른 동물. 다른 경우에 둘 다 응답 매우 높은 전류 레벨 (표시 되지 않음)에 같은 동물에 나타납니다. 안 면 신경 자극의 외관 아래 수준 현재 수준을 제한 하는 것이 좋습니다.
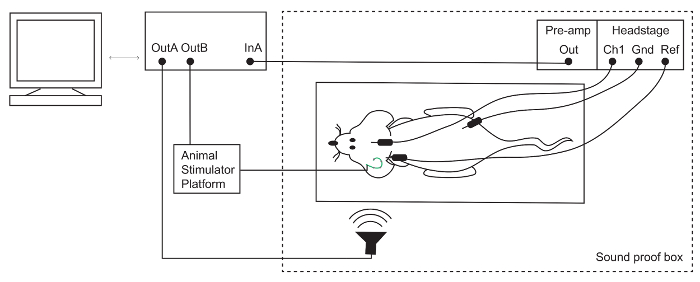
그림 1: 청각 Brainstem 응답 (ABR) 설치. 쳇 전극 (액티브/채널 1 [Ch1]), 동측 귀 ([Ref] 참조) 뒤에 정점에서 하 고 마 취 마우스의 뒷 다리 ([접지] 접지)에 배치 됩니다. 전극 신호는 증폭 하 고 TDT 시스템에 의해 기록 된. 청각과 전기 자극은 각각 마이크와 동물 자극 플랫폼을 통해 제공 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
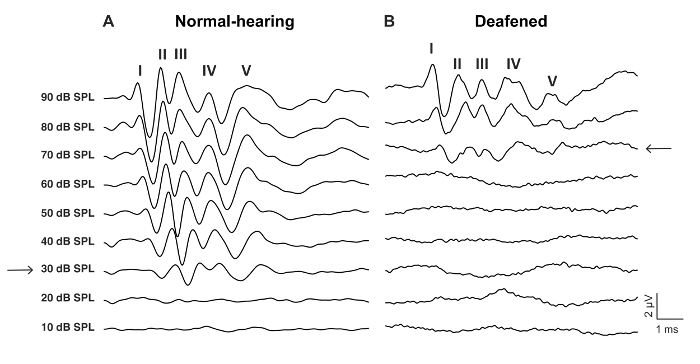
그림 2: 야생-타입 마우스에서 자극 전과 0.05% 네오 마이 신으로 굉음 후 클릭 하 여 대표 aABR 파도. (A) 정상 청력 aABR 패턴 표시-V와 낮은 심리 임계값, 여기 30 dB SPL (화살표) 파도 의해 특징입니다. (B) 귀 aABR 패턴 증가 심리 임계값을, 여기 70 dB SPL (화살표)를 보여줍니다. 파도 더 긴 대기 시간 있고 더 많은 시간적 지터. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
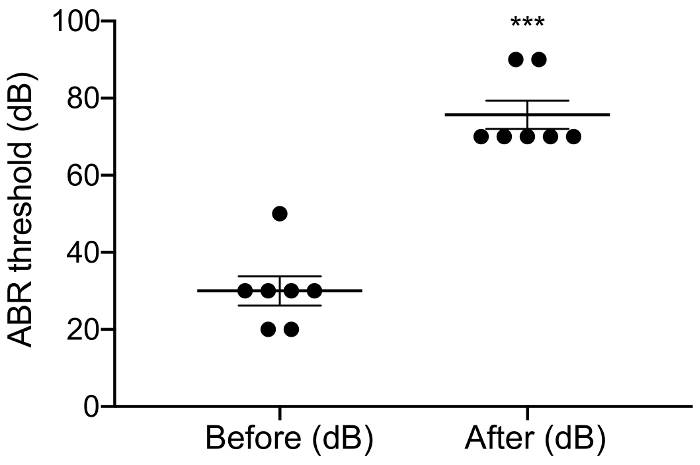
그림 3: aABR 임계값 굉음 전후. 네오 마이 신에의 응용은 46 dB ± 6 aABR 임계값을 크게 늘어납니다. 사전 vs 사후 네오 마이 신: 30.0 dB ± 3.8 vs 75.7 dB ± 3.7, p = 0.0003, 쌍이 t-검정, n = 7. 오류는 의미의 표준 오류가입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
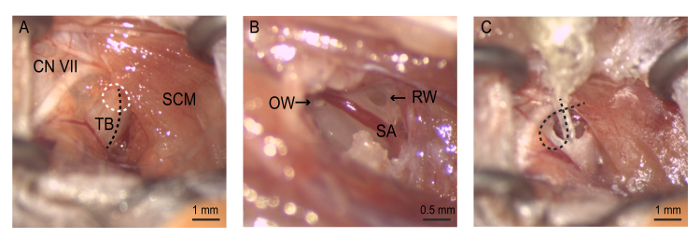
그림 4: 수술. (A) 청각 물집에 노출. bullostomy는 귀 물집 (검은 점선)에서 능선을 따라 (흰색 점선된 원)를 수행. (B)는 bullostomy의 stapedial 동맥 및 타원형 창, 둥근 창 시각화 수 있습니다. 네오 마이 신은 부드럽게 타원형 창 다음 라운드 창 처음 통해 플러시. 4번째 전극 둥근 창 틈새 내 위치 하 고 있습니다 때까지 (C)는 전극 배열 삽입 됩니다. 전극 와이어는 유지 하는 배열 절 개를 폐쇄 하기 전에 물집 내부 코일 이다. CN VII 두개골 신경 VII (안 면 신경), 유량 = 타원형 창, RW = 창, SA 라운드 = = stapedial 동맥, SCM sternocleidomastoid 근육, TB = = 귀 물집. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5: 마우스 耳. 직경 d와 0.4 m m 간격에서 간격의 플래티넘 밴드 4 개 이루어져 있다 (A) intracochlear 전극 배열: 0 [팁] (d = 0.21), 1 (d = 0.23), 2 (d = 0.25), 3 (d = 0.27). 각 전극의 폭은 0.2 m m. 4 개의 백 금/이리듐 (90/10) 파 릴 렌 절연 와이어 실리콘 튜브에 차폐 됩니다. 전극 배열 팁 (빨간색 점선된 사각형)의 (B) 확대. 전극 배열 및 백 금 기준 공 인쇄 보드에 연결 됩니다. 눈금 막대 = 1 m m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
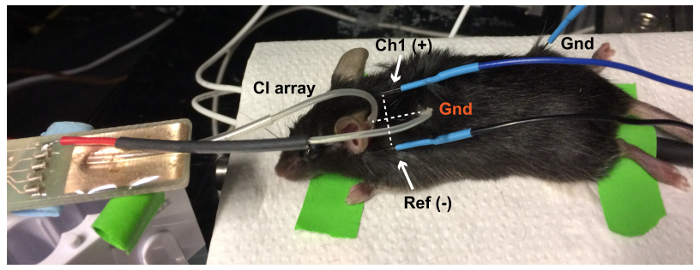
그림 6: 전기 evoked ABR (eABR) 설치. 플래티넘 CI 땅 볼 (Gnd, 빨간색) 마우스의 목에서 피하 포켓에 배치 됩니다. 활성 (꼭지점에서 Ch1(+)) 및 참조 (Ref (-) 동측 귀에) ABR 전극 사이의 최고의 eABR 응답을 얻기 위하여 전극 배열와 바닥 사이의 수직입니다. EABR 접지 전극 (Gnd, 블랙) 뒷 다리에 배치 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
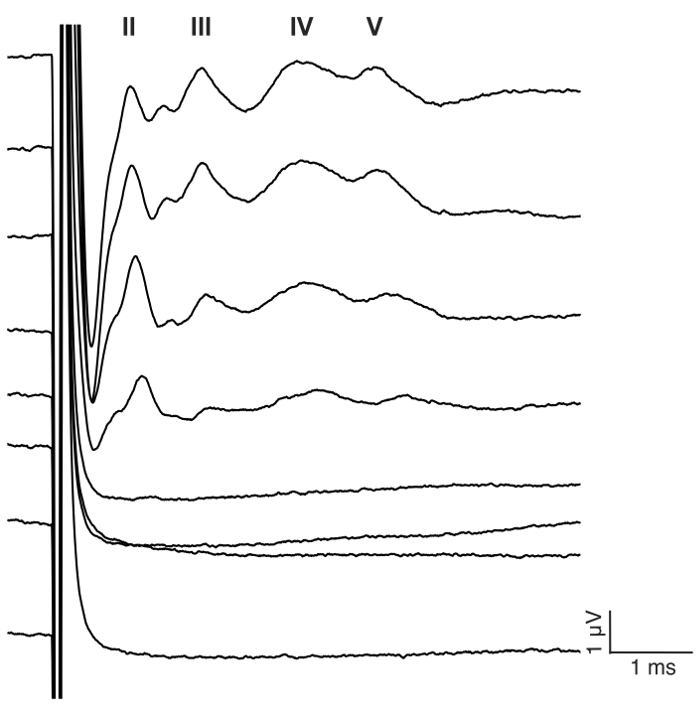
그림 7: 대표 eABR 귀 마우스에 CI 자극에 파도. 복 형 맥 박 기차 전극 #1 초당 (pps) 400 반복 23.3 펄스에서 monopolar 구성에서 제공 됩니다. 자극 수준 0-175 µ A 25 μ A 단계 (단계 7.2에서 자극 정보 참조)에 표시 됩니다. 로마 숫자는 eABR 파 수를 나타냅니다. 파 진폭 및 대기 시간 증가 하 고 감소 하는, 각각, 현재 수준 증가 함께. 이 예제에서는 웨이브 II 약 1 등장 ms, 파 III 약 2 ms, 3 ms, 파 브 약 4 ms. 주위 웨이브 IV 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
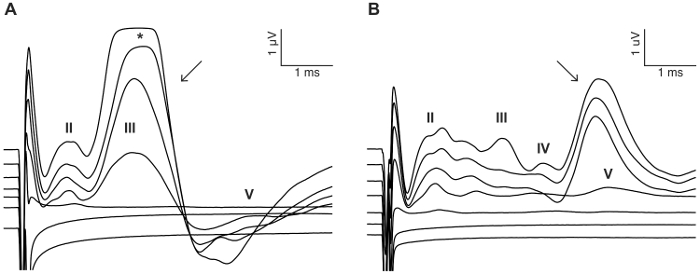
그림 8: 얼굴 신경 자극의 예. 경우에 따라 CI 자극 안 면 신경 활성화 하 고 짧은 대기 시간 (A) (화살표)와 직접 응답 또는 더 긴 대기 시간 (B) (화살표)와 간접 응답을 보여주고 수 있습니다. 표시 된 예제에서는 두 개의 CI 이식 동물 로부터 0-300를 사용 하 여 복 형 맥 박 기차 자극 50 µ A에 μ A 단계 (단계 7.2에서 자극 정보 참조). 로마 숫자는 eABR 파 숫자를 나타냅니다. * 증폭기의 포화로 인해 eABR 웨이브의 클리핑을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 원고 급성 굉음 및 마우스, 청각 brainstem 응답 CI 자극의 기능 평가에 인공 와우 이식 수술 방법을 설명합니다. 마우스 달팽이 관은 작은 도전 수술, CI 마우스 모델 가능 그리고 청각 연구에 유용한 도구 역할.
Stapedial 동맥은 마우스의 중간 귀에. 동맥은 물집 후부 medially, 들어가고 inferiorly 둥근 창 틈새에 실행 그리고 타원형 창 틈새에 머리. 마우스 모델의 초기 개발에서 우리는 물집을 액세스 하는 동안 주로 stapedial 동맥에 치명적인 내부 요원 출혈 다음 외상을 경험 했다. 결과적으로, 우리는 더 제한 된 접근 방식을 적응 하 고 작은, 세련 된 절 개 단계에서 물집을 액세스. 출혈로 인해 더 합병증 그 후 관찰 되었다. 사실 그 stapedial 동맥 열화에에서 아무런 효과가 중요 한 청각 임계값 또는 나선형 ganglion 신경의 번호에 마우스5, 우리의 의견에도 불구 하 고 그것은 필요 하지 않습니다 너무 오랫동안 큰 관심과 주의 수술 중에 찍은. 좋은 정신 운동 기술을 개발 하 고 기술 능력에 도달 하는 데 필요한 시간을 복용 하는 것이 좋습니다. 이식된 전극 배열 주위 폐쇄 초기 절 개에서 평균 시간은 일반적으로 1-1.5 h 이다.
마우스에서 설명한 급성 CI 수술 "복 부" 절차 및 다른 설치류, 쥐와 gerbils20,,2122등에서 사용 하는 둥근 창 삽입 비슷합니다. 다른 설치류 학문 둥근 창 삽입, SA 완전히 삽입 배열 더 깊이6,,2324고 대신 기저 차례 cochleostomy와 "등 접근"을 사용 했습니다. 쥐에 만성 자극 어셈블리의 이식 임 플 란 트 및 수술 후 관리5해결 하기 위해 Dacron 메시의 추가 함께이 프로토콜에서 설명 된 대로 동일한 단계를 따릅니다.
주요 기술 과제 쥐에서 CI 수술을 수행할 때 큰 SA의 존재와 쥐와 gerbils, 달팽이 관에 비해 달팽이 관의 작은 크기 이다. SA는 또한 안에 gerbils 하지만 쥐에 존재. 또한, 쥐 쥐와 gerbils 보다 작은 이기 때문에, 그들은 수술 절차에 더 취약입니다.
EABR 녹음에서 electrophonic 응답을 제거 하 고 머리 세포 손실 대부분 CI 사용자에서 발견 모방 하 우리 CI 삽입 전에 동물 모습. 마우스는 ototoxicity 발생 하는 데 필요한 aminoglycosides의 조직 농도 좁은 복용량 창 때문에 ototoxically vivo에서25 를 멍 하 고 어려운: 낮은 반면에 머리 세포 손실 없이 몇 일 결과 주어진 복용량 단일 주사 더 높은 복용량의 치명적인26일 수 있다. 또한, aminoglycosides 민감성 스트레인 종속26이다. 그러나, 그것은 루프가 뇨 제와 함께에서 aminoglycosides의 단일 복용 과도 한 외부 머리 세포 손실 없이 치명적인 결과27CBA/CaJ 생쥐에서 생산할 수 있는 표시 되었습니다. 지연된 안 머리 세포 죽음은 모든 cochleae 검사27의 절반에 보고 되었다.
이 원고에서는 우리는 aminoglycosides 네오 마이 신 최근 C57BL/6 쥐5위해 설립 하는 프로토콜에 의해 영감된의 국 소 응용 프로그램 사용. 네오 마이 신 급성 적용 클릭 갖는 심리 임계값 46 dB ± 6.1 크게 증가. 이 증가 어 빙 외. 보고 35 dB 증가 보다 더 큰 (수술 전 vs 후: 41.6 dB ± 3.3 vs 76.6 dB ± 4.4, p = 0.02, n = 3) 5, 우리 같은 후 굉음 임계값 (75.7 dB ± 3.7 vs 76.6 dB ± 4.4) 달성. 0.05% 네오 마이 신 생각 된다 급속 한 외부 머리 세포 죽음에 의해 주로 청각의 부분적인 손실 안 머리 세포 손실27발생 하는 데 시간이 오래 걸립니다. 그것은 따라서 가능한 electrophonic 응답, 즉 내부에 의해 둘 다 생성 하 고 외부 머리 세포4,,89,10,11,12만 부분적으로 잔여 청각과 귀 동물에서 탈락. 도 불구 하 고 0.05% (무게/볼륨) 네오 마이 신 나선형 ganglion 신경의 수 4 주 후5굉음을 감소 하지 않습니다, 그것은 아직 알 수 없는 경우 네오 마이 신 우리의 급성 설치에 청각 신경 섬유에 영향을 미치는 또는 synaptopathy (시 냅 스의 손실을 촉진 내부 세포 유형 사이 나 청각 신경 섬유). 또 다른 불확실성은 국 소 네오 마이 신 치료는 달팽이 관의 길이 따라 머리 세포 손실의 균일 한 분포를 생성 하지 않을 수 있습니다. 미래의 연구는 이러한 질문에 대답 해야 합니다.
요약 하자면, 인간의 청각 및 생 화 확 적인 도구를 사용할 수에 대 한 유전자 모델의 증가 CIs의 필드를 포함 하 여 청각 연구를 위한 매력적인 동물 모델 마우스에 확인 합니다.
공개
아니 경쟁 금융 관심사입니다. 저자는 공개 없다.
감사의 말
저자는 피에르 Stahl, 오티 콘 의료, 니스, 프랑스에 대 한 제공 동물 자극 플랫폼 및 조언을 자극 패러다임, 그리고 제임스 B. 펄 롱과 앤드류 공화국 현명한 공학 연구소, 멜버른, 호주에서에서 수술 조언을 감사 하 고 싶습니다. . 이 작품은 스위스 국립 과학 재단 (T.R.B. ERC 이전 부여)에서 교부 금에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Hardware | |||
| Sound-proof booth | IAC Acoustics, Winchester, UK | Mac-2 Enclosure RF Shielded Box 2A | |
| MF1 Speaker | Tucker Davis Technologies (TDT), FL, USA | ||
| PCB microphone | PCB Piezotronics, Inc, NY, USA | Model 378C01 | |
| Low impedance headstage | TDT, FL, USA | RA4LI | |
| Medusa pre-amplifier | TDT, FL, USA | RA4PA | |
| RZ6 auditory processor | TDT, FL, USA | ||
| Animal Stimulator Platform | ASP, Oticon Medical, Nice, France | ||
| Multimeter | Fluks | #115 | |
| Surgical equipment | |||
| Closed-loop heating pad | FHC, Inc. ME, USA | ||
| Eye ointment | Alcon, CH | Lacrinorm Augengel | |
| Acoustic foam | Otoform Ak, Dreve Otoplastik GmbH | #464 | |
| Disposable subdermal needle electrodes | Horizon, Rochester Electro-Medical Inc. | S83018-R9, 27G | |
| Self-retaining retractor tool (Mini Collibri Retractor) | Fine Science Tools | #17000-01 | |
| Suction wedges | Agnthos, SE | #42-886-460 | |
| Absorbable paper point (Medium) | WPI, FL, USA | #504182 | |
| Intracochlear electrode array | Bionics Institute, Melbourne, Australia | 4 channel | |
| Spongostan Standard | Ferrosan Medical Devices | #MS0002 | |
| Tissue glue. Loctite 4161 Superbond | Henkel | Part No 19743 | |
| Animal Stimulator Platform (ASP) | Oticon Medical, Nice, France | ||
| Drugs/chemicals | |||
| Ketamine (Narketan) | Provet AG, CH | 100mg/mL, #VQ_320265 | |
| Xylazine (Rompun) | Provet AG, CH | Inj Diss 2%, # 1315 | |
| Bupivacaine | Compendium, CH | Bupivacain Sintetica inj Diss 0.5% | |
| Atropine (Atropinesulfat Amino) | Amino AG, CH | 1 mg/mL | |
| Betadine (Povidone/iodine) | Provedic, CH | ||
| Neomycin (Neomycin trisulfate salt) | Sigma | N1876-25G, Lot#WXBB7516V | |
| Software | |||
| BioSigRZ | TDT, FL, USA | ||
| Matlab | MathWorks, MA, USA | ||
| ASP software | Oticon Medical, Nice, France |
참고문헌
- The-Ear-Foundation. . Cochlear Implants Update. , (2018).
- Fallon, J. B., Irvine, D. R. F., Shepherd, R. K. Cochlear Implants and Brain Plasticity. Hearing Research. 238 (1-2), 110-111 (2008).
- Pfingst, B. E., et al. Neurotrophin Gene Therapy in Deafened Ears with Cochlear Implants: Long-term Effects on Nerve Survival and Functional Measures. Journal of the Association for Research in Otolaryngology. 18 (6), 731-750 (2017).
- Miller, C. A., et al. Electrical excitation of the acoustically sensitive auditory nerve: single-fiber responses to electric pulse trains. Journal of the Association for Research in Otolaryngology. 7 (3), 195-210 (2006).
- Irving, S., et al. Cochlear implantation for chronic electrical stimulation in the mouse. Hearing Research. 306, 37-45 (2013).
- Soken, H., et al. Mouse cochleostomy: a minimally invasive dorsal approach for modeling cochlear implantation. Laryngoscope. 123 (12), E109-E115 (2013).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hearing Research. 312, 81-90 (2014).
- Hartmann, R., Topp, G., Klinke, R. Discharge patterns of cat primary auditory fibers with electrical stimulation of the cochlea. Hearing Research. 13 (1), 47-62 (1984).
- Sato, M., Baumhoff, P., Kral, A. Cochlear Implant Stimulation of a Hearing Ear Generates Separate Electrophonic and Electroneural Responses. The Journal of Neuroscience. 36 (1), 54-64 (2016).
- Pfingst, B. E., Spelman, F. A., Sutton, D. Operating ranges for cochlear implants. Annals of Otology, Rhinology & Laryngology. 89 (2), (1980).
- Miller, C. A., Hu, N., Zhang, F., Robinson, B. K., Abbas, P. J. Changes across time in the temporal responses of auditory nerve fibers stimulated by electric pulse trains. Journal of the Association for Research in Otolaryngology. 9 (1), 122-137 (2008).
- Shepherd, R. K., Javel, E. Electrical stimulation of the auditory nerve. I. Correlation of physiological responses with cochlear status. Hearing Research. 108 (1-2), 112-144 (1997).
- Akil, O., Oursler, A. E., Fan, K., Lustig, L. R. Mouse Auditory Brainstem Response Testing. Bio Protocol. 6 (6), (2016).
- Willott, J. F. Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current Protocols in Neuroscience. Chapter 8 (Unit 8.21B. , (2006).
- TDT. . ABR User Guide: A Guide to ABR Testing with the System 3 RZ6. , (2017).
- Muller, M., von Hunerbein, K., Hoidis, S., Smolders, J. W. A physiological place-frequency map of the cochlea in the CBA/J mouse. Hearing Research. 202 (1-2), 63-73 (2005).
- Cushing, S. L., Papsin, B. C., Gordon, K. A. Incidence and characteristics of facial nerve stimulation in children with cochlear implants. Laryngoscope. 116 (10), 1787-1791 (2006).
- Berrettini, S., Vito, D. A., Bruschini, L., Passetti, S., Forli, F. Facial nerve stimulation after cochlear implantation: our experience. Acta Otorhinolaryngologica Italica. 31 (1), 11-16 (2011).
- Hu, H., Kollmeier, B., Dietz, M. Reduction of stimulation coherent artifacts in electrically evoked auditory brainstem responses. Biomedical Signal Processing and Control. 21, 74-81 (2015).
- Wiegner, A., Wright, C. G., Vollmer, M. Multichannel cochlear implant for selective neuronal activation and chronic use in the free-moving Mongolian gerbil. Journal of Neuroscience Methods. 273, 40-54 (2016).
- Hessel, H., et al. Meriones unguiculatus (Gerbil) as an animal model for the ontogenetic cochlear implant research. American Journal of Otolaryngology. 18 (S21), (1997).
- Pinilla, M., Ramirez-Camacho, R., Jorge, E., Trinidad, A., Vergara, J. Ventral approach to the rat middle ear for otologic research. Otolaryngology Head Neck Surgery. 124 (5), 515-517 (2001).
- King, J., Shehu, I., Roland, J. T., Svirsky, M. A., Froemke, R. C. A physiological and behavioral system for hearing restoration with cochlear implants. Journal of Neurophysiology. 116 (2), 844-858 (2016).
- Lu, W., Xu, J., Shepherd, R. K. Cochlear implantation in rats: a new surgical approach. Hearing Research. 205 (1-2), 115-122 (2005).
- Poirrier, A. L., et al. Ototoxic drugs: difference in sensitivity between mice and guinea pigs. Toxicology Letters. 193 (1), 41-49 (2010).
- Wu, W. J., et al. Aminoglycoside ototoxicity in adult CBA, C57BL and BALB mice and the Sprague-Dawley rat. Hearing Research. 158 (1-2), 165-178 (2001).
- Taylor, R. R., Nevill, G., Forge, A. Rapid hair cell loss: a mouse model for cochlear lesions. Journal of the Association for Research in Otolaryngology. 9 (1), 44-64 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유