Method Article
Cirurgia de implante coclear e gravações de resposta eletricamente evocado auditivo do tronco encefálico em camundongos C57BL/6
Neste Artigo
Resumo
Modelos animais de implantes cocleares podem avançar o conhecimento das bases tecnológicas de tratamento de perda de audição neurossensorial permanente com estimulação elétrica. Este estudo apresenta um protocolo cirúrgico para agudo ensurdecedor e implante coclear de uma matriz de eletrodo em ratos, bem como a avaliação funcional com auditivo de tronco encefálico.
Resumo
Implantes cocleares (CIs) são dispositivos neuroprosthetic que podem fornecer um sentido da audição aos surdos. No entanto, um CI não pode restaurar todos os aspectos da audição. Melhoria da tecnologia de implante é necessário se os usuários CI de perceber a música e realizar em ambientes mais naturais, tais como ouvir uma voz com locutores concorrentes, reflexões e outros sons. Tal melhoria requer animais experimentais para melhor compreender os mecanismos de estimulação elétrica na cóclea e suas respostas no sistema auditivo toda. O mouse é um modelo cada vez mais atraente devido os genéticos muitos modelos disponíveis. No entanto, o uso limitado desta espécie como um modelo de CI é principalmente devido à dificuldade de implantação de matrizes do eletrodo pequeno. Mais detalhes sobre o procedimento cirúrgico, portanto, são de grande interesse para expandir o uso de ratos em pesquisas de CI.
Neste relatório, descrevemos em detalhe o protocolo para agudo ensurdecedor e implante coclear de uma matriz de eletrodo na cepa de rato C57BL/6. Demonstramos a eficácia funcional deste procedimento com eletricamente evocado auditivo de tronco encefálico (eABR) e mostram exemplos de estimulação do nervo facial. Finalmente, discutimos também a importância de incluir um procedimento ensurdecedor quando usando uma audiência normalmente animal. Este modelo de rato fornece uma poderosa oportunidade para estudar mecanismos genéticos e neurobiológicos que seriam relevante para os usuários do CI.
Introdução
Implantes cocleares (CIs) são dispositivos eletrônicos que podem fornecer um sentido da audição para pessoas com perda auditiva severa e profunda. Ele usa eletrodos implantados cirurgicamente na cóclea do ouvido interno para estimular diretamente o nervo auditivo. Até à data, a CI é a mais bem sucedida prótese sensorial e ajudou mais de 600.000 pessoas em todo o mundo1. No entanto, o dispositivo tem deficiências. Em primeiro lugar, os benefícios proporcionados pelo dispositivo variam muito entre os destinatários. Em segundo lugar, fala em ambientes ruidosos e música são ainda pouco percebida pela maioria dos usuários de CI.
Por muitos anos, os modelos animais têm sido utilizados para compreender melhor essas questões em investigação de CI e melhorar continuamente a segurança e a eficácia dos dispositivos. Os modelos deram insights valiosos sobre vários fenômenos, tais como plásticos mudanças no cérebro ocorrendo após implantação de CI2, o efeito de aplicar a terapia genética para preservar a audição residual3e propriedades biofísicas do estimulado eletricamente nervo auditivo4, entre muitos outros exemplos.
Os ratos são um organismo modelo poderoso devido à grande disponibilidade de modelos genéticos da surdez. Outras vantagens incluem a capacidade de manipular o genoma do rato (por exemplo,, através do sistema CRISPR-Cas), a oportunidade de utilizar avançadas técnicas para estudar mecanismos, particularmente no cérebro, a taxa elevada de reprodução, desenvolvimento rápido de imagem e fácil criação e manipulação. Os principais desafios técnicos na realização de cirurgias de CI em ratos são o pequeno tamanho da cóclea e a presença de uma grande artéria estapédica (SA). O SA geralmente desaparece durante o desenvolvimento embrionário em seres humanos, mas persiste durante toda a vida em um número de roedores, incluindo ratos, ratos e hamsters. O SA corre abaixo o nicho da janela redonda, que dificulta o acesso à cóclea e aumenta o risco cirúrgico.
Estudos anteriores mostraram a viabilidade de implantação de CI em ratos5,6,7. Irving et al. demonstraram que a estimulação elétrica crônica intracocleares pode ser alcançada por até um mês. Estimulação aguda também foi realizada, mas as gravações não foram apresentadas. Eles mostraram que cauterização da artéria estapédica não teve nenhum efeito significativo sobre o limiar auditivo ou o número de neurônios do gânglio espiral e que a aplicação tópica da aminoglicosídeos neomicina, um medicamento ototóxico, foi um procedimento eficaz ensurdecedor em ratos de5. Soken et al. descreveram uma abordagem dorsal modificada à cóclea através da janela redonda para melhor preservar a audição estatuto6rato. Após a inserção de um fio de platina-irídio, audição residual substancial observou-se com uma resposta do tronco cerebral auditivo aumento limiar (ABR) de 28 dB. Emissões otoacústicas (EOA) foram perdidas em animais com grande ABR limiar turnos6. Mistry et al testaram os efeitos funcionais e histopatológicos de implantação na ausência de estimulação elétrica7. Mesmo que a audição foi preservada em 3 e 6 meses de idade ratos implantados em baixas frequências, implantação resultou em fibrose, como tecido ao redor do implante e osteoneogenesis em torno do bullostomy7.
Em suma, fora os três estudos sobre CIs em ratos, único demonstra funcional gravação de estimulação de CI. Irving e colegas realizada ambas as gravações de eABR aguda e crônica, mas mostraram apenas dados a partir de estimulação crônica CI5. No entanto, o modelo de crônico com um dispositivo totalmente implantável desenvolvido por Irving et al. é tecnicamente desafiador. Isso ainda não é conhecido se aguda CI estimulação, menos desafiador e mais rápida, pode atingir resultados semelhantes.
CEI é utilizados por pessoas com perda auditiva severa e profunda, que já não se beneficiar de aparelhos auditivos. Modelos animais para os usuários do CI, portanto, devem incluir um procedimento ensurdecedor quando ouvir normalmente são utilizados animais. Outro motivo para ensurdecem animais audiência é que a estimulação elétrica de um surdo ou cóclea audiência produz diferentes respostas neurais4,8,9,10,11, 12. estimulação elétrica de uma cóclea surda diretamente ativa as fibras do nervo auditivo e gera uma resposta de electroneural (α). É caracterizada por curta latência e uma pequena faixa dinâmica na periferia8,10. Por outro lado, a estimulação elétrica da cóclea audiência também excita as células capilares em uma resposta de electrophonic (β) que se caracteriza por latências mais longos e maior gama dinâmica4,11. A resposta de electrophonic é atribuída à excitação normal das fibras nervosas por internas células ciliadas, contração induzida eletricamente exteriores células de cabelo e a geração de uma viagem de onda4. Respostas Electroneural e electrophonic também resultam em dois padrões diferentes de atividade do sistema nervoso central9. Sato et al gravou os neurônios do mesencéfalo de uma cobaia CI implantado antes e depois ensurdecedor com neomicina, que elimina a contribuição electrophonic. Eles mostraram que a inclinação da função taxa nível era mais íngreme e disparar taxas mais elevada na condição deafened em comparação com a condição de audição9. Portanto, dependendo da questão de investigação declarada, é importante considerar incluindo ensurdecedor electrophonic separado e respostas electroneural sobre a estimulação elétrica do nervo auditivo.
Aqui, descrevemos o procedimento para agudo ensurdecedor e o implante coclear de uma matriz de eletrodo em um rato, bem como a gravação funcional de estimulação elétrica intracochlear com eletricamente evocado auditivo de tronco encefálico (eABR).
Protocolo
Todos os procedimentos foram realizados de acordo com a Universidade de Basileia, Suíça, cuidados com animais e orientações. Eles foram licenciados pelo serviço de veterinária do Cantão de Basileia, na Suíça.
Nota: C57Bl/6 ratos adultos, com idades entre 8 a 12 semanas (20-30 g de peso), foram utilizados neste estudo.
A orelha esquerda é usada como a orelha experimental. A orelha direita serve como um controle de animais intra e cirurgicamente não é alterada.
1. pré-operatórios-procedimentos
-
Anestesiar o animal 30 min antes da cirurgia através da injeção intra-peritoneal (i.p.) de cetamina/xilazina (80 mg/kg de cetamina, xilazina 16 mg/kg, i.p., volume injetado em 10 μL/g de massa corporal).
- Complementar a anestesia, se necessário, como julgado por um pedal positivo e reflexo palpebral de (dedo do pé-pitada) e movimento dos bigodes, com uma baixa dose de cetamina (45 mg/kg, i.p., injetado em 10 μL/g de massa corporal). Agentes e regimes de dose podem ser substituídos por diretrizes institucionais.
Notas: em geral, o animal vai precisar de uma injeção cada 45-60 min com este regime de agente e dose. O tempo médio da incisão inicial de fechamento em torno da matriz de eletrodo implantado é tipicamente 1-1,5 horas.
- Complementar a anestesia, se necessário, como julgado por um pedal positivo e reflexo palpebral de (dedo do pé-pitada) e movimento dos bigodes, com uma baixa dose de cetamina (45 mg/kg, i.p., injetado em 10 μL/g de massa corporal). Agentes e regimes de dose podem ser substituídos por diretrizes institucionais.
- Verifique sedação completa do animal marcado por uma taxa de respiração regular e uma falta de dedo-pinch reflexos. Manter este nível de anestesia.
- Manter a temperatura do corpo do animal a 36,6 ° C, com uma almofada de aquecimento de circuito fechado. Aplica a pomada para evitar a desidratação da córnea. Isto também irá suprimir o reflexo de piscamento do animal, que pode adicionar ruído para a recodificação.
- Administrar analgésico local através de injeção subcutânea (s.c.) de bupivacaína/lidocaína (0,1 mg/mL de bupivacaína e 0,4 mg/mL de lidocaína, 0,1 mL administrada s.c.) ao longo da linha de incisão pretendido para minimizar qualquer desconforto cirúrgico. Agentes e regimes de dose podem ser substituídos por diretrizes institucionais.
- Administrar a atropina antagonista muscarínico (atropinesulfate amino, 0,1 mg/mL, 20 μL administrada s.c., dissolvido em PBS) no pescoço para reduzir a secreção de muco e facilitar a respiração. Agentes e regimes de dose podem ser substituídos por diretrizes institucionais.
2. pré-ensurdecedor acústico auditivo de tronco encefálico (aABR)
Nota: aABR é usado para medir o status de audiência antes e depois ensurdecedor. O teste é executado na orelha esquerda e numa cabine eletricamente blindada à prova de som. Recomendamos para testar e depois do implante da orelha esquerda para uma pessoa destra. Mais detalhes em ABR em ratos podem ser encontrados em13,14. Tecnologias de Davis Tucker (TDT) hardware e software (BioSig) são usados para gravar o ABR... mas outros sistemas podem ser usados.
- Bloquear o ouvido contralateral (à direita) com espuma acústica para isolar a resposta ABR na orelha ipsilateral (à esquerda). Coloque a espuma em uma seringa de 1 mL e injectar no canal do ouvido direito do mouse para cobrir o canal de orelha inteiro com espuma (0,1-0,2 mL de espuma). Certifique-se os selos de seringa estreitamente à orelha para que a espuma fica totalmente para dentro do canal auditivo.
- Coloque o alto-falante 10 cm da orelha esquerda.
Nota: O alto-falante para esta configuração foi calibrado usando um microfone de PCB, conforme descrito em refefence15. - Limpe os eléctrodos ABR com solução de etanol 70%. Colocar os eletrodos sob a pele: ativo (Ch1) no vértice, (-) de referência abaixo o pavilhão da orelha ipsilateral e chão na pata traseira (Figura 1).
- Conecte a cabeça-fase e pré-amplificador auditivo processador através da porta de fibra óptica.
-
Verifique a impedância de ativo e eletrodo de referência.
- Se a impedância é mais 3 Ohm, re-organizá-los e re-tomar a medida. As melhores gravações são obtidas quando os eletrodos têm a mesma impedância. Feche a cabine à prova de som.
- Clique em estimulação do presente e gravar ABR em uma condição de campo livre com um complexo auditivo processador e software. Padronizar o estímulo clique no software: 0,1 ms monocanal monofásico cliques são apresentados em 21 Hz; Clique em nível diminui de 90 dB SPL para 10 dB SPL em passos de 10 dB; 10 ms janela de gravação. Média de um total de 512 respostas em cada nível de dB.
- Aplica um filtro lowpass de 2.000 Hz e um filtro highpass de 300 Hz offline para reduzir o ruído na gravação usando um script Matlab feitos sob medido.
- Determine o limiar ABR como o nível mais baixo de dB com uma resposta de onda ABR reconhecível (Figura 2, Figura 3).
3. cirurgia
Nota: Instrumentos típicos usados incluem uma tesoura, um bisturi, um par de pinças metálicas com pontas retas ou curvas, uma ferramenta de afastador de tecido, várias cunhas de sucção e pontos de papel absorvente. A cirurgia é realizada na orelha esquerda.
- Coloque o mouse do seu lado direito. Evite o estresse de torção sobre as vértebras cervicais. Certifique-se de manter o corpo reto para manter as vias aéreas abertas.
- Cortar a pele atrás da orelha esquerda com uma tesoura (ou raspá-lo com uma máquina de barbear) para expor a pele. Esterilize a pele com solução de etanol 70% e betadine (iodopovidona/de).
- Sob magnificação microscópica (16x), fazer uma incisão de 1-1,5 cm pós-auricular com o bisturi.
- Alternar para maior ampliação microscópica (x 25).
- Realizar dissecção romba através da camada subcutânea de gordura, que pode ser de espessura variável, com fórceps.
Nota: Tenha cuidado quando dissecando como a veia jugular externa percorre nesta área. Danos a essa estrutura podem causar sangramento excessivo. - Retrai o músculo esternocleidomastoideo para revelar o periósteo timpânica. Use o nervo facial como um ponto de referência anatômico chave para auxiliar a identificação do auditório bulla. O nervo facial envolve a borda posterior/dorsal do músculo esternocleidomastoideo e dirige rostralmente ao longo do canal de orelha para o pavilhão auricular. Coloque delicadamente a ferramenta afastador auto retenção na incisão para facilitar o acesso para o bulla (Figura 4).
- Remova o tecido que cobrem a área de medio-dorsal do bulla para permitir a visualização clara da crista entre o bulla e o processo mastoide.
- Rode suavemente uma agulha 30G para perfurar o bulla e faça um buraco (bullostomy) no lado póstero-superior da crista (o osso é mais fino deste lado). Como alternativa, use uma broca dental cirúrgica.
Nota: Isto e as etapas a seguir podem ser feitas com ainda maior ampliação microscópica (40 x), se preferirem. Também, mude a posição do microscópio, se necessário. É importante maximizar a visão cirúrgica do espaço do ouvido médio. -
Alarga a bullostomy por beliscar pedaços pequeno osso usando pinça com ponta fina para expor a cavidade do ouvido médio. Estenda o bullostomy dorsalmente no sentido do processo mastoide até que o nicho da janela redonda é claro de sobrejacente osso. A artéria estapédica, um ramo da artéria carótida interna, corre ventral para o nicho da janela redonda.
- Tenha cuidado para não danificar o navio como sangramento excessivo pode ser fatal. Pequenos sangramentos podem ser interrompidos pressionando um pequeno pedaço de spongostan na cavidade do ouvido interno.
- Estenda o bullostomy direção anterior-superior para visualizar o estribo, o osso do ouvido médio ligado à janela oval.
- Remova o estribo com fórceps para expor a janela oval.
4. aplicativo de janela redonda do agente ototóxico
- Delicadamente, perfure as membranas de janela e a janela oval redondas usando uma agulha 30G embotadas. Verifique aquele perilinfa se esgote.
- Lentamente perfundir neomicina de 0.05% peso/volume dissolvida em PBS (ajustado ao pH 7,4) através da janela oval. Líquido deve descarregar a janela redonda. Repita o mesmo procedimento na janela redonda. Tenha cuidado para não danificar as estruturas ósseas de janela com a agulha usada para perfundir.
- Coloque um pedaço pequeno (1 mm2) de spongostan embebido em neomicina dentro do nicho redondo de janela e a janela oval.
- Remover a ferramenta retractor, fechar a incisão e esperar 30 min.
5. pós-ensurdecedor ABR acústico
- Gravar aABR em uma maneira similar como antes ensurdecedor (passos 2.2 a 2.8) (Figura 2b, Figura 3).
6. inserção de matriz de eletrodo de CI
Nota: A matriz de eletrodos intracocleares consiste de quatro bandas de platina (Ø0.2 mm) com fio de platina/iridum parylene isolado protegido em um tubo de silicone (Figura 5).
- Coloque a ferramenta afastador na incisão para re-acessar o bulla.
- Inserir a matriz de eletrodo a janela redonda (scala tympani) a uma profundidade onde o anel de platina deth 4 situa-se no interior da janela redonda. Isso dá uma profundidade de inserção de ~ 2 mm, correspondente a uma posição de intracocleares na ~ 30 kHz16.
- Enrole o fio de ligação dentro da bolha e cole o fio no tecido acima o bulla. Bobinar o fio ajuda a manter a matriz no lugar durante todo o experimento.
- Remova o retractor com cuidado e feche a inserção com cola de tecido.
- Faça uma pequena incisão (0,5 mm) no pescoço perpendicular à linha entre onde o ativo e eletrodos de referência ABR estará usando uma tesoura de tecido. Coloque a bola do chão platina no bolso subcutâneo e fechar a pequena incisão com cola de tecido (Figura 6).
- Conecte a placa de matriz de eletrodo para a plataforma de estimulador do Animal.
7. elétrica auditivo de tronco encefálico (eABR)
Nota: Uma plataforma de estimulador de Animal (ASP) é utilizado para estimular eletricamente a matriz de eletrodo. Outras fontes de corrente e sistemas de software podem ser usados.
- Coloque os ABR eletrodos como antes (etapas 2.3 a 2.5) (Figura 6).
- Abra o software ASP e definir o paradigma de estimulação do impulso eléctrico. Nós usamos um pulsos de balanceamento de carga bifásica com 50 μs/fase e 10 μs interphase lacuna apresentada na 23,3 pulsações por segundo (pps). A estimulação elétrica é entregue na configuração de eletrodo monopolar com aumento dos níveis atuais. Um total de 400 respostas são em média a cada nível atual.
- Apresentar os trens de pulso elétrico e gravar a resposta evocada eABR continuamente através da TDT headstage, processador pré-amplificador e auditivo.
- Traçar e analisar os dados de eABR através de um script feito por matlab (Figura 7). O script e um exemplo de uma gravação são fornecidos na complementar.
8. final do experimento
- No final do experimento, abater o animal, de acordo com as normas institucionais.
- Cuidadosamente Abra a incisão e remover o implante.
- Ultraproceda à sonicação a matriz de eletrodo em água destilada por 10 min remover os restos de tecido.
Nota: O implante pode ser reutilizado várias vezes se os eléctrodos estão intactos e realizando corretamente. Para verificar isso, medir a impedância dos eletrodos com um multímetro quando a matriz é seca. - Armazene a matriz de eletrodo em lugar seco.
Resultados
O objetivo deste estudo foi descrever um modelo fiável para estimulação aguda de CI no mouse deafened. Limiares auditivos pré e pós-cirúrgicos serviram como uma leitura funcional do processo ensurdecedor. A aplicação tópica de neomicina 0,05% na janela oval e redonda aumentou significativamente limiares auditivos clique-evocada por 46 dB ± 6 (pós-neomicina pré-vs: 30,0 dB ± 3,8 vs 75,7 dB ± 3,7, p = 0.0003, emparelhado t-teste, n = 7) (Figura 3). A matriz de tamanho do mouse eletrodo doravante foi inserida a janela redonda (Figura 4, Figura 5). Simulação elétrica de um eletrodo intracocleares confiável poderia gerar atividade eABR. (Figura 7). Em alguns casos, CI estimulação ativado o nervo facial e produziu uma onda de alta amplitude com latência curta ou longa (Figura 8A e 8B figura, respectivamente). A resposta curta latência foi caracterizada por uma rápida amplificação da onda IV cerca de 3 ms e é provável que seja uma resposta direta do nervo facial. A resposta de longa latência apareceu por volta de 5 – 6 ms e é provável que seja uma resposta muscular não-auditivas (miogênico) evocada indirectamente pelo nervo facial. Respostas do nervo facial são raramente relatadas em estudos com animais na literatura, mas é uma complicação conhecida em humanos CI usuários17,18,19. Em Figura 8, estimulação do nervo facial apareceu nos níveis atuais relativamente médios (150-200 μA) e em dois animais diferentes. Em outros casos, ambas as respostas poderiam aparecer no mesmo animal níveis muito elevados de corrente (não mostrado). É recomendável limitar o nível atual para níveis inferiores a aparência da estimulação do nervo facial.
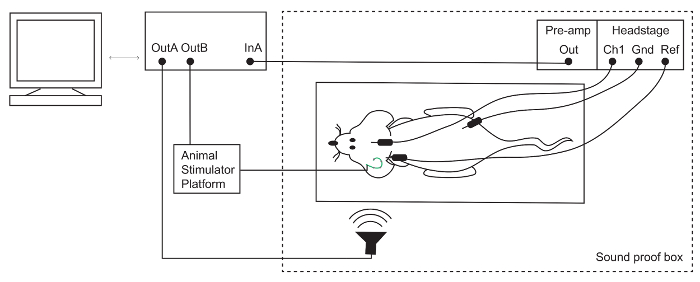
Figura 1: configuração de resposta de auditivo do tronco encefálico (ABR). Os eléctrodos subcutâneos são colocados no vértice (ativo/canal 1 [Ch1]), atrás da orelha ipsilateral (referência [Ref]) e com a pata traseira (terra [Gnd]) do mouse anestesiado. Sinais de eletrodo são amplificados e então gravados por um sistema TDT. Estimulação elétrica e acústica são apresentados através de um microfone e uma plataforma de estimulador do Animal, respectivamente. Clique aqui para ver uma versão maior desta figura.
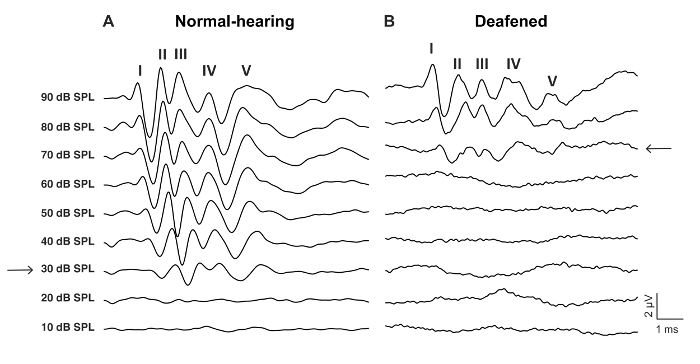
Figura 2: representante aABR acena para clique a estimulação de um rato selvagem-tipo antes e depois ensurdecedor com 0,05% neomicina. (A), a audição normal aABR padrão é caracterizado por ondas rotuladas-V e um limite de baixa audiência, aqui 30 dB SPL (seta). (B) a aABR deafened padrão mostra um limiar de maior audiência, aqui 70 dB SPL (seta). As ondas têm uma latência mais longa e mais variação temporal. Clique aqui para ver uma versão maior desta figura.
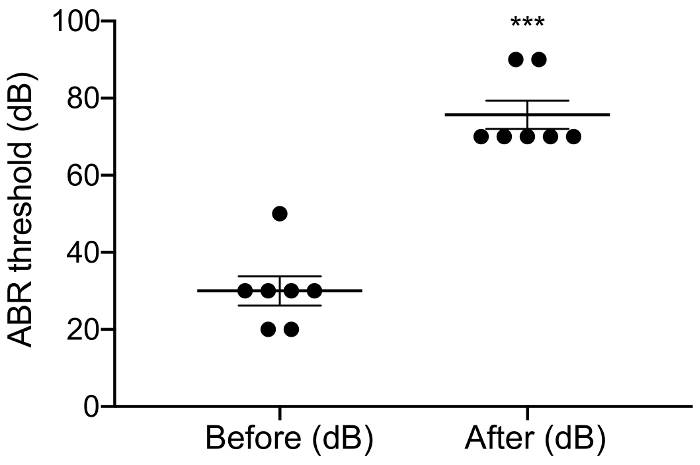
Figura 3: aABR limiar antes e depois ensurdecedor. Aplicação de neomicina aumentou significativamente aABR limiares de 46 dB ± 6. Pós-neomicina Pre-vs: 30,0 dB ± 3,8 vs 75,7 dB ± 3,7, p = 0.0003, emparelhado t-teste, n = 7. Erros são erro padrão dos meios. Clique aqui para ver uma versão maior desta figura.
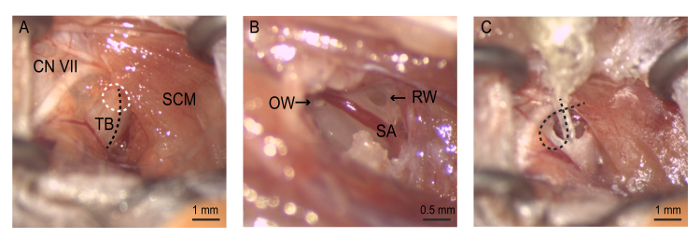
Figura 4: A cirurgia. (A) exposição para o auditório bulla. A bullostomy é realizada (círculo pontilhado branco) ao longo da crista sobre a timpânica (tracejado preto). (B), o bullostomy permite a visualização da janela redonda, estapédica artéria e janela oval. Neomicina é gentilmente liberadas em primeiro lugar, a janela oval e, em seguida, a janela redonda. Matriz (C), o eletrodo é inserido até 4th eléctrodo é localizado no interior do nicho da janela redonda. O fio eléctrodo estiver enrolado dentro da bolha para manter a matriz no lugar antes que a incisão é fechada. VII CN = nervo craniano VII (nervo facial), OW = janela oval, RW = janela redonda, SA = artéria estapédica, SCM = músculo esternocleidomastoideo, TB = timpânica. Clique aqui para ver uma versão maior desta figura.

Figura 5: O implante coclear rato. (A), a matriz de eletrodos intracocleares consiste de quatro bandas platina espaçadas em um intervalo de 0,4 mm, com um diâmetro d: 0 [dica] (d = 0,21), 1 (d = 0,23), 2 (d = 0,25), 3 (d = 0,27). A largura de cada eletrodo é de 0,2 mm. Os quatro fios de parylene isolado de platina/irídio (90/10) estão protegidos em um tubo de silicone. (B) ampliação da ponta de matriz de eletrodo (quadrado pontilhado vermelho). A matriz de eletrodo e uma esfera de platina de referência estão conectados a uma placa de impressão. Barra de escala = 1 mm. clique aqui para ver uma versão maior desta figura.
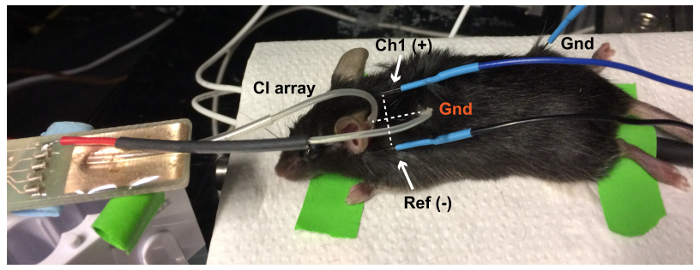
Figura 6: configuração evocada eletricamente ABR (eABR). A bola rasteira CI platina (Gnd, vermelho) é colocada em uma bolsa subcutânea no pescoço do mouse. A linha entre ativo (Ch1(+) no vértice) e eletrodos de referência (Ref. (-) no ouvido ipsilateral) ABR é perpendicular à linha entre a matriz de eletrodo e o solo, a fim de obter a melhor resposta eABR. O eléctrodo de terra de eABR (Gnd, negro) é colocado na pata traseira. Clique aqui para ver uma versão maior desta figura.
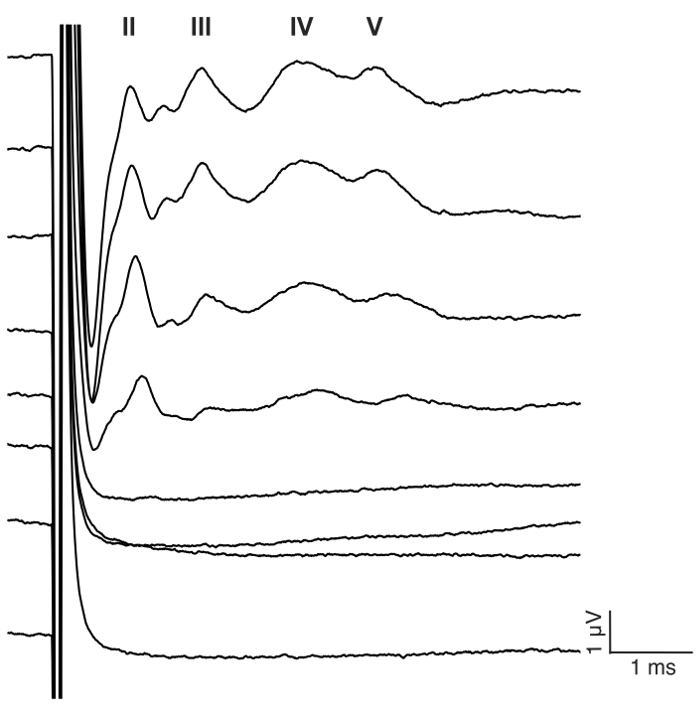
Figura 7: eABR representante acena à estimulação de CI em um mouse deafened. Um trem de pulso bifásico é apresentado ao eletrodo #1 na configuração monopolar em 23,3 pulsos por segundo (pps) com 400 repetições. Estímulos nível 0-175 μA é mostrado em 25 passos μA (ver detalhes de estimulação em passo 7.2). Numerais romanos denotam o número de onda de eABR. As amplitudes de onda e a latência aumentam e diminuem, respectivamente, com o aumento do nível atual. Neste exemplo, a onda II apareceu por volta de 1 ms, onda III por volta de 2 ms, IV de onda em torno de 3 ms,, onda V cerca de 4 ms.. Clique aqui para ver uma versão maior desta figura.
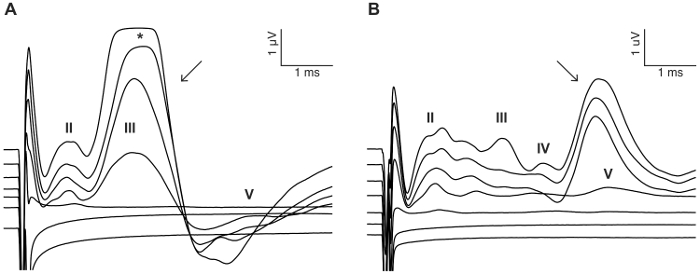
Figura 8: exemplo de estimulação do nervo facial. Em alguns casos, CI estimulação pode ativar o nervo facial e evocam uma resposta direta com latência curta (A) (seta) ou indiretos com latência mais (B) (seta). Os exemplos mostrados são de dois CI-implantado animais estimulados com um trem de pulso bifásico usando 0 – 300 μA em 50 μA passos (ver detalhes de estimulação em passo 7.2). Algarismos romanos indicam números de onda de eABR. * denota recorte da onda eABR devido à saturação do amplificador. Clique aqui para ver uma versão maior desta figura.
Discussão
Este manuscrito descreve a abordagem cirúrgica para agudo ensurdecedor e implante coclear no mouse, bem como a avaliação funcional do CI estimulação com auditivo de tronco encefálico. Embora a cóclea de rato é pequena e a cirurgia desafiador, o modelo do rato do CI é viável e serve como uma ferramenta valiosa na investigação auditiva.
A artéria estapédica está presente no ouvido médio do mouse. A artéria entra o bulla póstero-medial e corre inferiormente para o nicho da janela redonda e depois superiormente para o nicho da janela oval. No desenvolvimento inicial do modelo do rato, experimentamos trauma seguinte sangramento intra-operatório fatal à artéria estapédica, principalmente ao acessar o bulla. Como consequência, estamos adaptados a uma abordagem mais limitada e acessado o bulla em passos menores, refinado dissecação. Não há outras complicações devido a sangramento depois disso foram observadas. Apesar do fato que cauterização da artéria estapédica não tem nenhum efeito significativo no número de neurônios do gânglio espiral ou limiar de audição em ratos5, em nossa opinião, é desnecessário enquanto grande cuidado e atenção são tomadas durante a cirurgia. Sugerimos levar o tempo necessário para desenvolver habilidades psicomotoras bem e alcançar proficiência técnica. O tempo médio da incisão inicial de fechamento em torno da matriz de eletrodo implantado é tipicamente 1-1,5 h.
A cirurgia de CI aguda descrita em camundongos é semelhante ao procedimento "ventral" e inserção de janela redonda, usado em outros roedores, incluindo ratos e gerbils de21,20,22. Outros roedores estudos utilizaram a "abordagem dorsal" com um cochleostomy basal de vez em vez de uma inserção da janela redonda, evitando o SA inteiramente e inserindo a matriz mais profundamente6,23,24. A implantação de um conjunto de estimulação crônica em ratos segue as mesmas etapas, conforme descrito no presente protocolo, com a adição de uma malha de Dacron para fixar o implante e os cuidados pós-operatórios5.
Os principais desafios técnicos ao realizar cirurgias de CI em ratos são o pequeno tamanho da cóclea em comparação com a cóclea de ratos e ratos e a presença de uma grande SA. A SA também está presente em ratos, mas não em hamsters. Além disso, uma vez que os ratos são menores que ratos e ratos, são mais vulneráveis aos procedimentos cirúrgicos.
Para eliminar respostas electrophonic em gravações de eABR e de imitar a perda de cabelo célula encontrada na maioria dos usuários de CI, nós surdos os animais antes da inserção do CI. Os ratos são difíceis de ensurdecem ototoxically in vivo25 porque as concentrações sistêmicas de aminoglicosídeos necessárias para causar ototoxicidade tem uma janela estreita dose: reduzir doses entregadas vários resultados de dias sem perda de cabelo célula, Considerando que uma única injeção de uma dose mais elevada pode ser letal26. Também, susceptibilidade aos aminoglicosídeos é dependente de tensão26. No entanto, ficou demonstrado que uma dose única de aminoglicosídeos em combinação com um diurético laço pode produzir perda excessiva exterior cabelo célula no CBA/CaJ ratos sem consequências fatais27. Morte celular atrasada de cabelo interna foi relatado em metade de todos os cochleae examinou27.
Neste manuscrito, usamos a aplicação tópica da aminoglicosídeos neomicina inspirada pelo protocolo estabelecido recentemente para de camundongos C57BL/65. Aplicação aguda de neomicina aumentou significativamente o limiar de audição clique-evocada por 46 dB ± 6.1. Embora este aumento é maior do que o aumento de 35 dB relatado por Irving et al (pós-cirurgia pré-vs: 41,6 dB ± 3,3 vs 76,6 dB ± 4,4, p = 0,02, n = 3) 5, obtivemos o mesmo limiar pós ensurdecedor (75,7 dB ± 3,7 vs 76,6 dB ± 4,4). 0,05% neomicina é pensada para causar uma perda parcial da audição, principalmente pela morte celular exterior rápida do cabelo, como perda de celular interna do cabelo leva mais tempo para ocorrer a27. É portanto possível que electrophonic a resposta, que é gerado pelo interior e exterior de células ciliadas4,8,9,10,11,12, é apenas parcialmente eliminada em animais surdos com audição residual. Apesar de 0,05% (peso/volume) neomicina não diminui o número de neurônios do gânglio espiral 4 semanas pós ensurdecedor5, é ainda desconhecido se neomicina em nossa instalação aguda afeta as fibras do nervo auditivo ou promove synaptopathy (perda de sinapses entre células internas do cabelo e tipo eu auditivo nervo fibras). Outra incerteza é que o tratamento de neomicina tópica não pode produzir uma distribuição uniforme de perda de cabelo célula ao longo do comprimento da cóclea. Futuros estudos são necessários para responder a estas perguntas.
Em resumo, o número crescente de modelos genéticos para surdez humana e as ferramentas bioquímicas disponíveis fazer o rato atraente modelo animal para a investigação auditiva, incluindo o campo de CIs.
Divulgações
Sem interesses financeiros concorrentes. Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de agradecer a Pierre Stahl, médico Oticon, Nice, França, fornecendo a plataforma de estimulação do Animal e conselhos sobre paradigmas de estimulação e James B. Fallon e Andrew K. Wise do Instituto biônica, Melbourne, Austrália, para conselhos cirúrgico . Este trabalho foi financiado por um subsídio da Swiss National Science Foundation (concessão de transferência ERC para T.R.B.).
Materiais
| Name | Company | Catalog Number | Comments |
| Hardware | |||
| Sound-proof booth | IAC Acoustics, Winchester, UK | Mac-2 Enclosure RF Shielded Box 2A | |
| MF1 Speaker | Tucker Davis Technologies (TDT), FL, USA | ||
| PCB microphone | PCB Piezotronics, Inc, NY, USA | Model 378C01 | |
| Low impedance headstage | TDT, FL, USA | RA4LI | |
| Medusa pre-amplifier | TDT, FL, USA | RA4PA | |
| RZ6 auditory processor | TDT, FL, USA | ||
| Animal Stimulator Platform | ASP, Oticon Medical, Nice, France | ||
| Multimeter | Fluks | #115 | |
| Surgical equipment | |||
| Closed-loop heating pad | FHC, Inc. ME, USA | ||
| Eye ointment | Alcon, CH | Lacrinorm Augengel | |
| Acoustic foam | Otoform Ak, Dreve Otoplastik GmbH | #464 | |
| Disposable subdermal needle electrodes | Horizon, Rochester Electro-Medical Inc. | S83018-R9, 27G | |
| Self-retaining retractor tool (Mini Collibri Retractor) | Fine Science Tools | #17000-01 | |
| Suction wedges | Agnthos, SE | #42-886-460 | |
| Absorbable paper point (Medium) | WPI, FL, USA | #504182 | |
| Intracochlear electrode array | Bionics Institute, Melbourne, Australia | 4 channel | |
| Spongostan Standard | Ferrosan Medical Devices | #MS0002 | |
| Tissue glue. Loctite 4161 Superbond | Henkel | Part No 19743 | |
| Animal Stimulator Platform (ASP) | Oticon Medical, Nice, France | ||
| Drugs/chemicals | |||
| Ketamine (Narketan) | Provet AG, CH | 100mg/mL, #VQ_320265 | |
| Xylazine (Rompun) | Provet AG, CH | Inj Diss 2%, # 1315 | |
| Bupivacaine | Compendium, CH | Bupivacain Sintetica inj Diss 0.5% | |
| Atropine (Atropinesulfat Amino) | Amino AG, CH | 1 mg/mL | |
| Betadine (Povidone/iodine) | Provedic, CH | ||
| Neomycin (Neomycin trisulfate salt) | Sigma | N1876-25G, Lot#WXBB7516V | |
| Software | |||
| BioSigRZ | TDT, FL, USA | ||
| Matlab | MathWorks, MA, USA | ||
| ASP software | Oticon Medical, Nice, France |
Referências
- The-Ear-Foundation. . Cochlear Implants Update. , (2018).
- Fallon, J. B., Irvine, D. R. F., Shepherd, R. K. Cochlear Implants and Brain Plasticity. Hearing Research. 238 (1-2), 110-111 (2008).
- Pfingst, B. E., et al. Neurotrophin Gene Therapy in Deafened Ears with Cochlear Implants: Long-term Effects on Nerve Survival and Functional Measures. Journal of the Association for Research in Otolaryngology. 18 (6), 731-750 (2017).
- Miller, C. A., et al. Electrical excitation of the acoustically sensitive auditory nerve: single-fiber responses to electric pulse trains. Journal of the Association for Research in Otolaryngology. 7 (3), 195-210 (2006).
- Irving, S., et al. Cochlear implantation for chronic electrical stimulation in the mouse. Hearing Research. 306, 37-45 (2013).
- Soken, H., et al. Mouse cochleostomy: a minimally invasive dorsal approach for modeling cochlear implantation. Laryngoscope. 123 (12), E109-E115 (2013).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hearing Research. 312, 81-90 (2014).
- Hartmann, R., Topp, G., Klinke, R. Discharge patterns of cat primary auditory fibers with electrical stimulation of the cochlea. Hearing Research. 13 (1), 47-62 (1984).
- Sato, M., Baumhoff, P., Kral, A. Cochlear Implant Stimulation of a Hearing Ear Generates Separate Electrophonic and Electroneural Responses. The Journal of Neuroscience. 36 (1), 54-64 (2016).
- Pfingst, B. E., Spelman, F. A., Sutton, D. Operating ranges for cochlear implants. Annals of Otology, Rhinology & Laryngology. 89 (2), (1980).
- Miller, C. A., Hu, N., Zhang, F., Robinson, B. K., Abbas, P. J. Changes across time in the temporal responses of auditory nerve fibers stimulated by electric pulse trains. Journal of the Association for Research in Otolaryngology. 9 (1), 122-137 (2008).
- Shepherd, R. K., Javel, E. Electrical stimulation of the auditory nerve. I. Correlation of physiological responses with cochlear status. Hearing Research. 108 (1-2), 112-144 (1997).
- Akil, O., Oursler, A. E., Fan, K., Lustig, L. R. Mouse Auditory Brainstem Response Testing. Bio Protocol. 6 (6), (2016).
- Willott, J. F. Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current Protocols in Neuroscience. Chapter 8 (Unit 8.21B. , (2006).
- TDT. . ABR User Guide: A Guide to ABR Testing with the System 3 RZ6. , (2017).
- Muller, M., von Hunerbein, K., Hoidis, S., Smolders, J. W. A physiological place-frequency map of the cochlea in the CBA/J mouse. Hearing Research. 202 (1-2), 63-73 (2005).
- Cushing, S. L., Papsin, B. C., Gordon, K. A. Incidence and characteristics of facial nerve stimulation in children with cochlear implants. Laryngoscope. 116 (10), 1787-1791 (2006).
- Berrettini, S., Vito, D. A., Bruschini, L., Passetti, S., Forli, F. Facial nerve stimulation after cochlear implantation: our experience. Acta Otorhinolaryngologica Italica. 31 (1), 11-16 (2011).
- Hu, H., Kollmeier, B., Dietz, M. Reduction of stimulation coherent artifacts in electrically evoked auditory brainstem responses. Biomedical Signal Processing and Control. 21, 74-81 (2015).
- Wiegner, A., Wright, C. G., Vollmer, M. Multichannel cochlear implant for selective neuronal activation and chronic use in the free-moving Mongolian gerbil. Journal of Neuroscience Methods. 273, 40-54 (2016).
- Hessel, H., et al. Meriones unguiculatus (Gerbil) as an animal model for the ontogenetic cochlear implant research. American Journal of Otolaryngology. 18 (S21), (1997).
- Pinilla, M., Ramirez-Camacho, R., Jorge, E., Trinidad, A., Vergara, J. Ventral approach to the rat middle ear for otologic research. Otolaryngology Head Neck Surgery. 124 (5), 515-517 (2001).
- King, J., Shehu, I., Roland, J. T., Svirsky, M. A., Froemke, R. C. A physiological and behavioral system for hearing restoration with cochlear implants. Journal of Neurophysiology. 116 (2), 844-858 (2016).
- Lu, W., Xu, J., Shepherd, R. K. Cochlear implantation in rats: a new surgical approach. Hearing Research. 205 (1-2), 115-122 (2005).
- Poirrier, A. L., et al. Ototoxic drugs: difference in sensitivity between mice and guinea pigs. Toxicology Letters. 193 (1), 41-49 (2010).
- Wu, W. J., et al. Aminoglycoside ototoxicity in adult CBA, C57BL and BALB mice and the Sprague-Dawley rat. Hearing Research. 158 (1-2), 165-178 (2001).
- Taylor, R. R., Nevill, G., Forge, A. Rapid hair cell loss: a mouse model for cochlear lesions. Journal of the Association for Research in Otolaryngology. 9 (1), 44-64 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados