A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل الطيفي تقلب Fluorescence من تفاعلات البروتين البروتين في الخلية جهات الاتصال
In This Article
Summary
ويصف هذا البروتوكول اتباع نهج قائم على التحليل الطيفي تقلب الأسفار للتحقيق في التفاعلات بين البروتينات بوساطة التفاعلات خلية خلية، أي البروتينات المترجمة في تقاطعات الخلية، مباشرة في الخلايا الحية. نحن توفير مبادئ توجيهية مفصلة على صك المعايرة والحصول على البيانات وتحليلها، بما في ذلك تصحيحات لمصادر الحرفية الممكنة.
Abstract
مجموعة متنوعة من العمليات البيولوجية ينطوي على التفاعل خلية خلية، عادة بوساطة من البروتينات التي تتفاعل في التفاعل بين الخلايا المجاورة. للفائدة، قادرون فقط بضعة فحوصات على وجه التحديد سبر هذه التفاعلات مباشرة في الخلايا الحية. نقدم هنا، فحص لقياس ربط البروتينات التي أعربت في سطوح الخلايا المجاورة، وفي الاتصالات خلية خلية. هذا الإنزيم يتكون من خطوتين: خلط الخلايا معربا عن البروتينات التي تهم تنصهر فيها مختلف البروتينات الفلورية، تليها fluorescence تقلب التحليل الطيفي القياسات في خلية خلية جهات الاتصال باستخدام ليزر [كنفوكل] المسح مجهر. نحن إثبات جدوى هذا التحليل في سياق بيولوجيا ذات صلة بقياس تفاعلات البروتين اميلويد السلائف مثل 1 (APLP1) عبر تقاطعات خلية خلية. نحن توفير بروتوكولات مفصلة في الحصول على البيانات باستخدام التقنيات المستندة إلى الأسفار (المسح الأسفار عبر ارتباط التحليل الطيفي، وعدد عبر الارتباط وتحليل السطوع) ومعايرات الصك المطلوب. علاوة على ذلك، فإننا نناقش الخطوات الحاسمة في تحليل البيانات، وكيفية تحديد وتصحيح التباينات الإشارات الخارجية، زائفة، مثل تلك التي تعزى إلى حركة فوتوبليتشينج أو الخلية.
وبصفة عامة، المقايسة المقدمة تنطبق على أي إنسان-أو التفاعل الغيروية البروتين-بروتين في خلية خلية الاتصالات، بين الخلايا بأنواع مختلفة أو نفسها ويمكن تنفيذها على ليزر [كنفوكل] تجارية المسح مجهر. هو شرط هام استقرار النظام، الذي ينبغي أن يكون كافياً للتحقيق ديناميات انتشارية البروتينات ذات الاهتمام خلال عدة دقائق.
Introduction
العديد من العمليات البيولوجية التي تحدث في مواقع التفاعلات خلية خلية، مثل خلية خلية التصاق1،2،3، خلية خلية الانصهار4 والاعتراف الخلوية5. هذه الأحداث تمثل أهمية خاصة أثناء تطوير الكائنات الحية متعددة الخلايا، وخلية خلية الاتصالات، مثلاً، أثناء الاستجابات المناعية. وساطة هذه العمليات عادة من البروتينات التي تكون مترجمة على السطح، أي في غشاء البلازما (م) من الخلايا المجاورة وتخضع لتفاعلات معينة في خلية خلية الاتصال التي هي على وجه التحديد الخاضعة للتنظيم في المكان والزمان. في كثير من الحالات، هذه التفاعلات المباشرة هومو-أو التفاعلات عبر الغيروية البروتين-بروتين، ولكن قد ينطوي أيضا على أيونات أو يغاندس بوصفها linkers خارج الخلية1. على الرغم من أهمية أساسية، وهناك نقص في فحوصات سبر هذه تفاعلات البروتين البروتين محددة مباشرة في البيئة الأصلية للخلايا الحية. تتطلب العديد من الأساليب أما تعطيل الخلية (مثل فحوصات الكيمياء الحيوية مثل شركة إيمونوبريسيبيتيشن6)، التثبيت (مثلاً، بعض تقنيات بصرية مجهرية فائقة القرار والمجهر الإلكتروني لخلية خلية اتصالات7)، أو هي غير محددة، مثل التجميع/التصاق فحوصات8،9. للتغلب على هذه المشكلة، تم تنفيذ fluorescence تقنيات استناداً إلى الأسفار الرنين الطاقة نقل (الحنق)10 أو الأسفار التكامل11. ومع ذلك، تتطلب هذه الطرق تحقيقا لمسافات صغيرة بما فيه الكفاية بين فلوروفوريس، تسميات الفلورسنت على الجانب خارج الخلية البروتينات10، يحتمل أن تتداخل مع التفاعلات عبر .
نقدم هنا، تحليل القائم على الأسفار بديلة لتفاعلات البروتين البروتين في الخلية جهات الاتصال. هذا النهج يجمع بين النهج عبر الارتباط الأسفار (الأسفار المسح الضوئي عبر ارتباط مطيافية (سفككس)، وعدد عبر الارتباط والسطوع (ccN & ب)) وخلط الخلايا معربا عن بناء انصهار من البروتين من الفائدة، مثلاً، مستقبلات التصاق. تتم تسمية مستقبلات التحقيق في الخليتين التفاعل مع البروتينات الفلورية طيفيا فصل اثنين (FPs)، من داخل الخلايا الجانب (انظر الشكل 1A).
أساليب العاملين تقوم على التحليل الإحصائي للأسفار التقلبات الناجمة عن الحركة انتشارية البروتينات الفلورية الانصهار من خلال حجم ليزر [كنفوكل] مجهر مسح التنسيق. أكثر في التفاصيل، ويَسْبِر المقايسة نشر المشارك من البروتينات ذات الاهتمام في كلا PMs المجاورة في خلية خلية الاتصالات. إذا البروتينات الخضوع عبر التفاعلات، سيحمل هذه المجمعات عبر البروتينات الفلورية التي تنبعث منها في كل القنوات الطيفية، تسبب تقلبات fluorescence مرتبطة من بواعث كلا. من ناحية أخرى، في حالة حدوث لا ملزمة، تقلبات عدد من البروتينات التي تواجه الدورة الشهرية ستكون مستقلة، مما تسبب في لا تقلبات مرتبطة. اكتساب يمكن أن يؤديها بطريقتين: 1) سفككس يستند على شكل خط المسح الضوئي عبر الاتصال خلية خلية ويَسْبِر فعالية التفاعلات في بقعة تقع في منطقة الاتصال. من خلال تحليل الزمانية لتقلبات الأسفار، سفككس يوفر أيضا معلومات حيوية، أي معاملات نشر مجمعات البروتين؛ 2) ccN & ب يستند إلى إجراء تحليل بيكسيلويسي لسلسلة من الصور التي حصلت في مناطق الاتصال خلية خلية. قد القدرة على التحقيق وخريطة التفاعلات على طول كامل الاتصال بالمنطقة (في المستوى البؤري واحد)، ولكن لا يقدم معلومات عن ديناميات. يمكن الجمع بين كلا الأسلوبين مع تحليل للسطوع الجزيئية، أي إشارة fluorescence متوسط المنبعثة في الوحدة الزمنية من مجمعات البروتين نشرها مفردة، وهكذا، تقديم تقديرات ل stoichiometry مجمعات البروتين في خلية الاتصالات.
في هذه المقالة، نحن نقدم بروتوكولات مفصلة لإعداد عينة وأداة المعايرة، الحصول على البيانات وتحليلها لإجراء التحليل المقدم على ليزر [كنفوكل] تجارية المسح مجهر. يمكن إجراء هذه التجارب على أي صك مجهزة بالعد فوتون أو كاشفات التناظرية وموضوعي مع ارتفاع الفتحة العددية. علينا مواصلة مناقشة الخطوات الحاسمة للبروتوكول وتقديم مخططات تصحيح للعديد من العمليات التي تسبب تقلبات إشارة أرتيفاكتوال، مثلاً، للكشف عن الضوضاء، وحركة فوتوبليتشينج أو الخلية. وضعت أصلاً للتحقيق في التفاعلات بين الخلايا ملتصقة، التحليل يمكن تعديلها لتعليق الخلايا، أو تكييفها لنظم الغشاء النموذجي، مثلاً، أونيلاميلار العملاقة حويصلات (جوفس) أو البلازما العملاقة غشاء الحويصلات (جبمفس)، مما يسمح التحديد الكمي للتفاعل في البيئات المختلفة الدهن، أو في حالة عدم12،سيتوسكيليتون المنظمة13.
المسح الضوئي الطيفي الارتباط عبر الأسفار هو نسخة معدلة من الأسفار عبر ارتباط مطيافية14 وتم تصميمه خصيصا للتحقيق في ديناميات انتشارية بطيئة في الأغشية الدهنية15. أنه يستند إلى عملية شراء مسح خط عمودي إلى الساعة التي تحتوي على بروتينات الفلورسنت للفائدة. للتحقيق في التفاعلات بين نوعين من أنواع البروتين المسمى بشكل مختلف، يتم اكتساب في قناتين طيفية استخدام اثنين من خطوط الليزر وهما كشف windows ل fluorophores طيفيا المنفصلين عن ذويهم. سبب ديناميات نشر بطيئة من البروتينات في الساعة (D≤ ~ 1/ق2ميكرومتر)، يمكن أن يؤديها قياس خالية من الحديث عبر مخطط الإثارة من سطر إلى سطر15بالتناوب. يبدأ التحليل: 1) محاذاة خوارزمية تصحيح لحركة الخلية الجانبية استناداً إلى بلوكويسي في المتوسط من خطوط ~ 1000، 2) تحديد الموقف مع الموقف، أي الساعة fluorescence أقصى إشارة، في كل كتلة و 3) تحويل جميع القطع لمشترك منشأ12،15، كل على حدة في كل قناة. ثم، يتم تحديد تلقائي لتناظر الساعة بكسل بتحديد المنطقة الوسطى من نوبة ضبابي من مجموع كافة الأسطر الانحياز (أي، مركز ± 2.5σ). تكامل الإشارة في كل سطر غلة السلسلة الزمنية fluorescence غشاء F(t) في كل قناة (ز = الأخضر قناة، r = القناة الحمراء). علما بأن حجم بكسل يجب أن تكون صغيرة بما يكفي، مثلاً، < 200 نانومتر، إعادة بناء شكل النقطة نشر وظيفة والعثور على مركزها، المقابلة لموقف رئيس الوزراء. حضور فوتوبليتشينج كبيرة، قد يكون على غرار مع دالة آسيه مزدوجة السلسلة الزمنية الأسفار في كل قناة وثم تم تصحيحها بالصيغة التالية:16
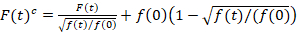 . (1)
. (1)
من المهم ملاحظة أن هذه الصيغة بفعالية تصحيح كلا من الاتساع ونشر الأوقات التي تم الحصول عليها من تحليل الارتباط F(t)ج، مقارنة بتقديرات المعلمة التي يمكن الحصول على من غير المصححة F(t). ثم، مهام الارتباط التلقائي والصليب (أكفس/أطر التعاون القطري) وتحسب للأسفار إشارات:
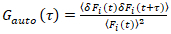 ، (2).
، (2).
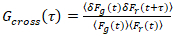 ، (3).
، (3).
حيث δوأنا = وأنا(t)- 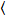 وأنا(t)
وأنا(t)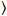 و أنا = ز، والبحث والتطوير.
و أنا = ز، والبحث والتطوير.
نموذج نشر ثنائي الأبعاد ثم مزودة بجميع مهام الارتباط (لجنة الأمن الغذائي العالمي):
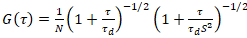 . (4)
. (4)
هنا، تشير N إلى عدد البروتينات الفلورية في حجم المراقبة و τد وقت نشرها لكل قناة. هذا النموذج يأخذ في الاعتبار أن في وصف الإعداد التجريبية، يحدث انتشار البروتينات في الساعة في الطائرة x-z، خلافا لتكوين علاقة الفلورية استخداماً التحليل الطيفي (FCS) تجارب على الأغشية السبر نشر في الطائرة x-y من حجم [كنفوكل]17. الخصر ث0 وعامل البنية S، واصفاً الإطالة wض حجم التنسيق في z, S = ثضث0، يتم الحصول عليها من قياس معايرة FCS نقطة أدوا بالأصباغ طيفيا مماثلة ونفس إعدادات البصرية استخدام القيم الموجودة بالفعل لأن معامل نشر دصبغ:
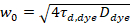 ، (5).
، (5).
حيث τد، وصبغ هو وقت نشر متوسط قياس جزيئات الصبغة، التي تم الحصول عليها من تركيب نموذج لنشر ثلاثية الأبعاد للبيانات، ومراعاة التحولات حساب الكسر ر كل ن الجزيئات إلى الدولة الثلاثي مع ثابت وقت ττ:
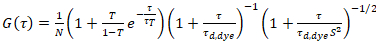 . (6)
. (6)
وأخيراً، نشر معاملات (د) وقيم السطوع الجزيئية (اليورو) والصليب-الارتباط النسبي للبيانات سفككس (rel.cc.) يتم حساب كما يلي:
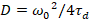 ، (7).
، (7).
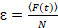 ، (8).
، (8).
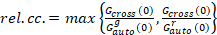 ، (9).
، (9).
زالصليب(0) من حيث السعة للدالة عبر الارتباط و 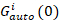 هو السعة للدالة ترابط تلقائي في القناة-ال أنا.
هو السعة للدالة ترابط تلقائي في القناة-ال أنا.
هذا التعريف نسبي الصليب-العلاقة المتبادلة، أي استخدام كحد أقصى بدلاً من يعني في المعادلة 9، يأخذ في الاعتبار أن يقتصر الحد الأقصى لعدد من المجمعات من نوعين من أنواع البروتين الحالية بتركيزات مختلفة الأنواع الموجودة في عدد أقل.
عدد عبر الارتباط وسطوع يستند إلى تحليل هذه لحظة لشدة الأسفار لكل بكسل من رصة صور اكتسبت على مر الزمن في موقع ثابت في العينة، تتألف عادة من ~ 100-200 الإطارات، مع اثنين الطيفية القنوات ( g = أخضر القناة، r = القناة الحمراء). من الوسط الزماني 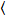 أنا
أنا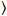 أنا والفرق
أنا والفرق 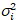 ، وتحسب سطوع الجزيئية اليوروi وعدد نأنا في كل بكسل وقناة الأطياف (أنا = g, r)18:
، وتحسب سطوع الجزيئية اليوروi وعدد نأنا في كل بكسل وقناة الأطياف (أنا = g, r)18:
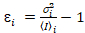 ، (10).
، (10).
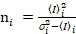 . (11)
. (11)
من المهم ملاحظة أن معادلات معينة تنطبق على الحالة المثالية لكاشف فوتون العد الحقيقي. لأنظمة الكشف التناظرية، تطبيق المعادلات التالية19،20:
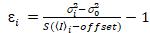 ، (12).
، (12).
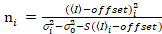 . (13)
. (13)
هنا، هو S معامل التحويل بين الفوتونات المكتشفة والتهم الرقمية المسجلة، 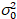 ضجيج قراءات و إزاحة يشير إلى الكشف عن كثافة الإزاحة. عموما، يجب معايرة هذه الكميات، لأي نوع الكاشف، استناداً إلى قياس الفرق كاشف كدالة كثافة لإنارة مطرد19، مثلاً، سطح معدني عاكس أو حل صبغ المجففة. يمكن تحديد الإزاحة عن طريق قياس معدل العد في عينة دون ضوء الإثارة. عن طريق إجراء انحدار خطي للفرق المرتبطة بالكشف عن
ضجيج قراءات و إزاحة يشير إلى الكشف عن كثافة الإزاحة. عموما، يجب معايرة هذه الكميات، لأي نوع الكاشف، استناداً إلى قياس الفرق كاشف كدالة كثافة لإنارة مطرد19، مثلاً، سطح معدني عاكس أو حل صبغ المجففة. يمكن تحديد الإزاحة عن طريق قياس معدل العد في عينة دون ضوء الإثارة. عن طريق إجراء انحدار خطي للفرق المرتبطة بالكشف عن 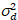 مقابل الأرض كثافة (أنا), S و
مقابل الأرض كثافة (أنا), S و 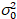 يمكن أن تكون حازمة19:
يمكن أن تكون حازمة19:
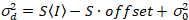 . (14)
. (14)
وأخيراً، يحسب في كل بكسل سطوع عبر الارتباط ويتم تعريفها بشكل عام21
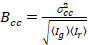 ، (15).
، (15).
حيث 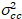 هو الصليب-الفرق
هو الصليب-الفرق 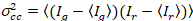 .
.
من أجل تصفية تقلبات المعمرة، تتم جميع ccN & حسابات ب بعد النقل التصفية، بشكل مستقل لكل بكسل22. بإيجاز، ni, اليوروأنا (أنا = g, r) وتحسب بcc في انزلاق قطاعات مثل إطارات 8-15. يمكن أن متوسط القيم التي تم الحصول عليها ومن ثم ثم الحصول على بكسل النهائي القيم عدد والسطوع.
تحليل ستويتشيوميتري
بغية تقدير stoichiometry مجمعات البروتين في الخلية جهات الاتصال، يمكن تحليل سطوع الجزيئية بشكل منفصل في كل قناة طيفية سفككس أو ccN & ب البيانات. في سفككس، يتم الحصول على قيمة سطوع واحدة كل قياس في كل قناة. في ccN & B، يتم الحصول على الرسم بياني سطوع لكل بكسل المقابلة لجهة الاتصال خلية خلية وقيمة متوسط (أو الوسيط) يمكن استخدامها سطوع الممثل للقياس. عن طريق إجراء نفس التحليل على مرجع أحادي، يمكن تطبيع جميع قيم السطوع مباشرة الحصول على الدولة oligomeric متوسط مجمعات البروتين تم الكشف عنها. في هذه المرحلة، من المهم تصحيح لوجود FPs غير الفلورية قد يؤدي التقليل من الدولة أوليجوميريك. وهذا عادة ما يقوم بقياس سطوع23،البروتين مرجع هومو dimeric24 استخدام سفكس لون واحد أو عدد والسطوع (ن وب).
Protocol
1-نموذج إعداد: خلية خلية خلط الإنزيم
ملاحظة: بروتوكول التالية وصف الإجراء خلط للخلايا ملتصقة. فإنه يمكن تعديله للخلايا المزروعة في التعليق.
- عدد مناسب من الخلايا على لوحة 6، حسنا، مثلاً، 800,000 الخلايا HEK 293T (عد مع نويباور العد الدائرة)، يوميا قبل تعداء البذور. العدد يمكن تعديلها تبعاً للوقت بين البذر وتعداء وتعديلها لأنواع الخلايا الأخرى. لإجراء تجربة أساسية (أي، البروتينات ذات الاهتمام والمراقبة السلبية)، إعداد على الأقل 4 آبار. خلايا الثقافة في 37 درجة مئوية، 5% CO2 في المتوسطة المتوسطة ايجل تعديل (دميم) في دولبيكو، تستكمل بالمصل البقري الجنين (10 في المائة) ولام الجلوتامين (1%).
- ترانسفيكت الخلايا وفقا لإرشادات الشركة المصنعة (انظر الجدول للمواد).
- لإجراء تجربة أساسية، ترانسفيكت، في آبار منفصلة، والبلازميدات لبروتين الفائدة التي تنصهر فيها إلى 'الأخضر' (مثلاً، أحادي المحسن أخضر نيون البروتين (ميجفب)، أو بروتين فلوري الصفراء (مييفب)) أو 'الأحمر' (مثلاً، مشري، أو مكاردينال) البروتين الفلورسنت.
ملاحظة: في هذا البروتوكول، ونركز على APLP1-مييفب و APLP1-مكاردينال12، والمراقبة السلبية المقابلة، مثلاً، ميريستويلاتيد-بالميتويلاتيد-مييفب (myr-النخيل-مييفب) ومكاردينال (myr-النخيل-مكاردينال)12. وبصفة عامة، 200 نانوغرام-1 ميكروغرام من بلازميد الحمض النووي تكفي. تعداء عالية الكفاءة يزيد من فرصة للبحث عن الخلايا 'الأحمر' و 'الأخضر' في جهة الاتصال. قم بتعديل مقدار كاشف بلازميد وتعداء لتحسين كفاءة تعداء. الحاسمة: خلية كونفلوينسي ينبغي أن يكون حوالي 70% عند ترانسفيكتينج الخلايا. إذا كانت الخلايا روافد الإفراط، سيتم تقليل كفاءة تعداء. إذا كانت الخلايا غير المتلاقية كافية، قد حمل الإجهاد تعداء والاختلاط ومنع العديد من الخلايا من مرفق مناسب بعد خلط.
- لإجراء تجربة أساسية، ترانسفيكت، في آبار منفصلة، والبلازميدات لبروتين الفائدة التي تنصهر فيها إلى 'الأخضر' (مثلاً، أحادي المحسن أخضر نيون البروتين (ميجفب)، أو بروتين فلوري الصفراء (مييفب)) أو 'الأحمر' (مثلاً، مشري، أو مكاردينال) البروتين الفلورسنت.
- أداء الخلية خلط ~4 ± 2 ح بعد تعداء.
- إزالة النمو المتوسطة وتغسل جيدا برفق مع برنامج تلفزيوني تستكمل بملغ2 + و Ca2 +1 مل كل. ثم، قم بإزالة برنامج تلفزيوني. (الحرجة) إسقاط برنامج تلفزيوني على الحافة جيدا لمنع انفصال الخلايا أثناء الغسيل.
- إضافة ~ 50 ميليلتر التربسين الإيثيلين حمض (يدتا) حل دروبويسي لكل بئر لتسهيل المفرزة من الخلايا. احتضان في 37 درجة مئوية للحد الأدنى 2 بعد ذلك، يهز لوحة 6-جيدا جانبياً لفصل الخلايا ببطء.
ملاحظة: قد تكون أوقات الاحتضان الموسعة المطلوبة لبعض أنواع الخلايا. - إضافة 950 ميليلتر من متوسط النمو لكل بئر وريسوسبيند الخلايا من بيبيتينج عدة مرات صعودا وهبوطاً، وبالتالي فصل كافة الخلايا من أسفل جيدا. (الحرجة) التأكد من أن الخلايا حراكه بشكل صحيح ومنفصلة عن بعضها البعض عن طريق التحقق بصريا لغياب المجاميع خلية كبيرة بعد استثارة. وإلا سوف يتم الحصول على العديد من الاتصالات 'الأخضر'-'الأحمر' أو 'الأخضر'-'الأحمر' بعد الاختلاط.
- نقل الحل خلية من بئر واحدة (البروتين الفائدة أو المراقبة السلبية) للمقابلة أيضا، أي 'الأحمر' (مثلاً، APLP1-مكاردينال ترانسفيكتيد) إلى 'الأخضر' (مثلاً، APLP1-مييفب ترانسفيكتيد) الخلايا. مزيج من بيبيتينج بلطف عدة مرات صعودا وهبوطاً. ثم، بذور الخلايا المختلطة على الأطباق أسفل الزجاج 35 ملم (1 مل من محلول الخلايا المختلطة للطبق الواحد)، بالإضافة إلى 1 مل من متوسط النمو والثقافة المصنف الخلايا ليوم آخر على 37 درجة مئوية، وأول أكسيد الكربون 5%2.

الشكل 1 . سير العمل التجريبي والتمثيل التخطيطي للمسح الطيفي الارتباط عبر الأسفار والارتباط عبر تحليل عدد والسطوع في خلية خلية الاتصالات- (أ) نظام لإعداد نموذج: اختلاط الشعبين الخلية transfected مع البروتين للفائدة (مثلاً، APLP1) تنصهر فيها هما البروتينات الفلورية طيفيا متميزة (مثل مييفب ومكاردينال) بعد تعداء. يتم تحديد جهات اتصال خلايا ترانسفيكتيد بشكل مختلف في تجارب الفحص المجهري. لتجنب التداخل مع المجالات ملزم خارج الخلية، يجب أن تنصهر بروتين فلوري إلى المحطة داخل الخلايا من بروتين الفائدة. (ب) قياسات "المسح فككس" (سفككس) عمودي المنجز لجهة الاتصال خلية في قناتين الطيفية (القناة 1، الأخضر والقناة 2، أحمر). يتم محاذاة خطوط المسح (ممثلة كيموجرافس) وقد لخص الغشاء بكسل. ثم، يتم حساب أكفس وأطر التعاون القطري من آثار كثافة وأنا(t). يتم تمثيل أكفس بلون أحمر وأخضر. إطار التعاون القطري يمثل باللون الأزرق. (ج) ن عبر ارتباط & ب (ccN & ب) اكتساب النتائج في تكديس ثلاثي الأبعاد (x-y-الوقت) صورة. يتم تحديد عائد حول جهة الاتصال خلية خلية. ثم سطوع القناة وعبر الارتباط (اليورو1واليورو2بcc) يتم حساب القيم في كل خلية-خلية الاتصال وحدة بكسل. ثم يتم تصور النتائج كرسوم بيانية، تجمع كل بكسل المحدد. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
2-نموذج إعداد: السيطرة الإيجابية للتجارب عبر الارتباط وبناء هومو-ديمر لتحليل السطوع
- البذور 600,000 HEK 293T الخلايا، عد مع خلية العد الدائرة، على الزجاج 35 ملم أسفل الأطباق قبل تعداء بيوم واحد. الثقافة الخلايا عند 37 درجة مئوية، 5% CO2 في إكمال دميم المتوسطة (راجع الخطوة 1، 1) ليوم آخر.
- ترانسفيكت الخلايا مع ~ 250 نانوغرام بلازميد الحمض النووي وفقا لإرشادات الشركة المصنعة. للمراقبة عبر الارتباط الإيجابي، استخدام بلازميد ترميز ترتكز على غشاء بروتين فلوري هترو-ديمر، مثلاً، myr-النخيل-مشري-ميجفب أو myr-النخيل--مكاردينال--مييفب12 المقابلة لقوة حماية المنشآت بروتين الفائدة. لمعايرة سطوع، استخدام البلازميدات ترميز ترتكز على غشاء مونومر FP ومعا هومو-ديمر المقابلة لل FPs تنصهر للبروتين الفائدة، مثلاً، myr-النخيل-مييفب و myr-النخيل-مييفب-مييفب لمعايرة تحليل السطوع APLP1-مييفب12.
- الثقافة الخلايا عند 37 درجة مئوية، 5% CO2 في إكمال دميم المتوسطة (راجع الخطوة 1، 1) ليوم آخر.
3-[كنفوكل] ليزر المسح المجهري: إعداد ومعايرة تركيز وحدة التخزين
ملاحظة: يتم كتابة البروتوكول التالي للتجارب التي يؤديها مع ميجفب/مييفب ومتشيري/مكاردينال في ليزر المسح مجهر [كنفوكل] المستخدمة في هذه الدراسة. قد يتم تعديل الإعداد الضوئية وإعدادات البرامج (خطوط الليزر، مرايا مزدوج اللون، والمرشحات) واختيار الأصباغ المعايرة للأجهزة الأخرى في الثانية والمجهر.
- بدوره على المجهر وأشعة الليزر على الأقل ساعة قبل التجربة لضمان الاستقرار الليزر والموازنة لدرجة الحرارة.
- إعداد 100-200 ميليلتر من الحلول المناسبة صبغة الفلورسنت للذوبان في الماء (انظر الجدول للمواد للحصول على أمثلة) في الماء أو في برنامج تلفزيوني لمعايرة حجم التنسيق، مع تركيزات في مدى 10-50 نانومتر.
- ضع الحلول صبغ على زجاج نظيف 35 ملم أسفل طبق #1.5، أي وجود سماكة 0.16-0.19 ملم.
ملاحظة: من الناحية المثالية، استخدام الأطباق مع الزجاج غطاء عالية الأداء بعد تسامح سمك منخفضة، مثلاً، 0.170 ± 0.005 مم، مما يسمح بتصويب الطوق طوق أمثل (الخطوة 3، 6). من المهم أن تستخدم نفس النوع من الطبق كما هو مستخدم في وقت لاحق للتجارب التالية. - ضع الطبق يتضمن الحل الصبغ مباشرة على الهدف (ويفضل الماء الغمر، مع 1.2 غ) لضمان التركيز في الحل. بدلاً من ذلك، ضع الطبق على صاحب العينة والتركيز في العينة (مثلاً، 10-20 ميكرون فوق الجزء السفلي من الطبق).
ملاحظة: لا ننصح باستخدام أهداف النفط بسبب ضعف الإشارة التي تم الحصول عليها عند التركيز العميق في العينات المائية. - قم بإعداد مسار الإثارة والانبعاثات، مثلاً، اختر 488 نانومتر الليزر، ومرآة مزدوج اللون نانومتر 488/561، الكشف عن الإطار 499-552 نانومتر وحجم ثقب 1 وحدة مهواة (الاتحاد الأفريقي). تأكد من أن حجم الثقب هو نفسه كتلك التي سيتم استخدامها في القياسات عبر الارتباط.
- ضبط موضع الثقب (التكيف الثقب) والطوق طوق موضوعية لتعظيم معدل العد. لتحقيق هذا الهدف، بدوره حلقة ذوي الياقات البيضاء حتى يتم الكشف عن معدل الحد الأقصى للعدد.
ملاحظة: تصحيح الطوق طوق تستأثر بسماكة محددة من الزجاج غطاء المستخدمة. تحقيق الحد الأقصى من معدل العد، أي.، جمع الفوتونات العديد من كل جزيء قدر الإمكان، من المهم إلى أقصى حد نسبة الإشارة إلى الضوضاء (الاستخبارات) القياسات. - تنفيذ سلسلة من القياسات FCS نقطة (مثلاً 6 قياسات في مواقع مختلفة، كل منها يتألف من 15 من التكرار من 10 s، أي 2.5 دقيقة مجموع الوقت، أخذ عينات مع الوقت يسكن المايكروثانيه 1 أو أقل) في نفس السلطة الليزر المستخدمة في العلاقة عبر القياسات (عادة ~ 1%، µW أي ~ 1-2).
- تناسب نموذج نشر ثلاثية الأبعاد بما في ذلك مساهمة الثلاثي (6 المعادلة) للبيانات.
ملاحظة: عادة، هي الأوقات التي تم الحصول عليها من نشر المايكروثانيه حوالي 30 وعامل الهيكل حول 4-8. - حساب الخصر ث0 من وقت نشر متوسط قياس ونشر قيم معامل نشر الصبغة المستخدمة في درجة حرارة الغرفة25 طبقاً للمعادلة 5. القيم النموذجية 200-250 نيوتن متر.
- كرر روتين المعايرة (خطوات 3.4-3.9) مع صبغة فلورسنت مختلفة للكشف عن قناة ثانية إذا لزم الأمر (مثلاً، 561 نانومتر الإثارة والكشف بين 570 نانومتر و 695 nm). تبقى موضع الثقب وحجم كما تم تعيينها للكشف عن القناة الأولى.
- حساب سطوع الجزيئية (المعادلة 8) من القياسات المعايرة، وتخزين القيم التي تم الحصول عليها.
ملاحظة: القيم النموذجية للإعداد المستخدمة هي ~8-10 كيلو هرتز/جزيء (MOL) 1.8 µW 488 نانومتر الإثارة السلطة. أقل من القيم المعتاد قد تشير إلى التراب على الهدف، واختلال الإعداد أو ليزر انخفاض ناتج. التحقق من وتخزين الليزر الناتج القوى في الهدف بشكل منتظم باستخدام مقياس طاقة. للمقارنة بين الأجهزة المختلفة، هو سطوع الجزيئية التي طبعت بقوة الليزر الإثارة المعلمة الأكثر وضوحاً لتقييم الأداء المجهر.
4-المسح الطيفي عبر الارتباط Fluorescence: اقتناء
ملاحظة: بروتوكول التالية مكتوبة للتجارب التي يؤديها مع ميجفب/مييفب (الأخضر) ومشري/مكاردينال ('الأحمر') في المجهر [كنفوكل] المسح الضوئي الليزر المستخدمة في هذه الدراسة. الإعداد الضوئية وإعدادات البرامج (خطوط الليزر، ومرايا مزدوج اللون، مرشحات) قد تكون مختلفة بالنسبة للأجهزة الأخرى في الثانية أو المجهر.
- إعداد المسار البصري، مثلاً، 488 نانومتر و 561 نانومتر الإثارة ومرآة مزدوج اللون نانومتر 488/561، والثقب في 1 الاتحاد الأفريقي ل 488 نانومتر الإثارة. تجنب التحدث عبر الطيفية، حدد مسارين منفصلين لإثارة والكشف عن ميجفب/مييفب (488 نانومتر الإثارة، قناة الأخضر) ومشري/مكاردينال (561 الإثارة نانومتر، القناة الحمراء) تسلسلياً وتحديد المسارات تبديل كل سطر. للكشف عن، استخدام عوامل التصفية المناسبة للقنوات، مثلاً، 499-552 نانومتر في قناة الأخضر و 570 695 نانومتر في القناة الحمراء.
- إذا لم يكن ممكناً الإثارة مختلفة، استخدم إعدادات عامل التصفية المناسب للقناة الحمراء لتقليل الطيفية عبر الحديث (أي الكشف عن الأسفار مشري/مكاردينال لا تقل 600 nm). هذا قد تقلل من كمية الفوتونات التي اكتشفت في القناة الحمراء وتخفض بالتالي من دائرة الاستخبارات الوطنية.
- ضع الطبق الذي يحتوي على الخلايا المختلطة على صاحب العينة. انتظر 10 دقائق على الأقل لضمان درجة حرارة الموازنة والحد من الانجراف التركيز.
- وتركز على الخلايا باستخدام نقل الضوء في القائمة تحديد موقع .
- البحث عن زوج من 'أحمر' وخلية 'أخضر' على اتصال ببعضهم البعض. عبر وجود ارتباط إيجابي أو ديمر هومو التحكم بالسطوع (انظر القسم 2)، البحث عن خلية معزولة التي تنبعث منها الأسفار في القنوات أو إشارة كل إنسان-ديمر في الساعة.
ملاحظة: (حرجة) تصغير عينة التعرض أثناء البحث عن الخلايا لتجنب ما قبل التبييض، مما قد يقلل من الارتباط عبر26. لذلك، تفحص في أسرع سرعة المسح الضوئي والليزر المنخفض القوى. لتجنب التشبع الكاشف أثناء التصوير بقوة الإعراب عن الخلايا، البحث في وضع التكامل. لتقليل التعرض، المسح الضوئي بانخفاض الليزر القوى غير ممكن في وضع فوتون العد . - حدد خط عمودي مسار المسح الضوئي إلى خلية خلية الاتصال (أو بعد الظهر من خلية واحدة لمراقبة السطوع إيجابية عبر الارتباط أو هومو-ديمر) باستخدام الزر المحاصيل كما هو مبين في الأرقام 1 باء و 2 ألف.
ملاحظة: لا تسمح بعض المجاهر أقدم الاتجاهات تفحص التعسفي. في هذه الحالة، خلية خلية الاتصالات مع اتجاه عمودي على اتجاه المسح يجب أن تكون موجودة. -
تكبير/تصغير إلى تحقيق حجم بكسل من 50-200 نانومتر وتحديد خط في وضع المسح الضوئي. تعيين حجم الإطار إلى 128 × 1 بكسل.
ملاحظة: حجم بكسل نموذجي هو 160 نانومتر، المقابلة لمدة المسح الضوئي من حوالي 20 ميكرومتر. - تعيين سرعة المسح الضوئي إلى قيمة الحد الأقصى المسموح به، و مثلاً المايكروثانيه 472.73 كل سطر.
ملاحظة: لمخطط بديل إثارة، وهذا يناظر المايكروثانيه 954.45 المسح الضوئي الوقت، أي ~ 1000 فحص/s على الإعداد المستخدمة. ويمكن تعديل سرعة المسح الضوئي تبعاً لمعامل نشر من بروتين الفائدة. للبروتينات الغشاء الرأسية، أوقات نشر نموذجية حول السيدة 10-20 ينبغي أن يكون المسح الضوئي الوقت أصغر عشر مرات على الأقل من مرات نشرها. السفلي بسرعة المسح الضوئي قد حمل فوتوبليتشينج أقوى وتتطلب أقل الإضاءة القوى. بدلاً من ذلك، واحد يمكن أن تفرض وقفه، مثلاً، يبلغ 5 مللي ثانية، الفترات الفاصلة بين كل عملية مسح للمجمعات نشرها ببطء شديد باستخدام الفاصل الزمني في القائمة الفرعية السلسلة الزمنية . - اختر صلاحيات الليزر المناسبة، مثلاً، ~ 1-2 µW ل 488 نانومتر و ~ 5-10 µW ل 561 نانومتر الإثارة.
ملاحظة: ارتفاع الليزر القوى تحسين دائرة الاستخبارات الوطنية، ولكن زيادة فوتوبليتشينج. ولذلك، ينبغي أن تختار القوى الليزر يكون فوتوبليتشينج أقل من 50% معدل العد الأولى. - تعيين دورات 100,000-500، 000.
ملاحظة: عدد من عمليات المسح، أي مدة القياس، وقد تختلف: أوقات أطول في قياس سيحسن دائرة الاستخبارات الوطنية وقد يكون من الأنسب لنشرها الجزيئات ببطء، غير أن تحد من حركة الخلايا وفوتوبليتشينج قياس القصوى الوقت. البيانات المقدمة هنا تم الحصول عليها بشكل روتيني ل ~ 3-6 دقيقة، أي فحص خط 200,000-400,000. - تعيين للكشف عن وضع فوتون العد . اضغط على بدء التجربة لبدء اكتساب. كرر الخطوات من 4.5-4.11 لقياس خلية أخرى.
ملاحظة: من المستحسن لقياس الخلايا 10-15 كل عينة على مستويات مختلفة من التعبير. (الحرجة) تجنب التشبع للكشف عن مستويات عالية من التعبير. معدل الحد الأقصى للعدد ينبغي أن لا تتجاوز ~ 1 ميغاهرتز. - إذا كان يجري تحليل سطوع لتحديد الدول أوليجوميريك، إجراء القياسات معايرة سطوع هومو-ديمر وفقا لتعديل الخطوات 4.1-4.11: قياس كل بروتين فلوري هومو ديمر كل على حدة (في الخلايا المعزولة، أعدت باستخدام بروتوكول القسم 2) وإجراء القياسات فقط في إحدى القنوات الطيفية.
5-المسح الطيفي عبر الارتباط Fluorescence: تحليل البيانات
ملاحظة: يتبع البروتوكول التالية تنفيذ إجراء تحليل ووصف بالتفصيل في المقالات السابقة12،15. رمز البرنامج متاح عند الطلب للكتاب.
- تصدير ملفات البيانات الخام (مثلاً، الاتحاد) إلى صورة RGB TIFF بتنسيق البيانات الخام. سوف يحتوي هذا الملف على كيموجراف مع الأخضر وبيانات القناة الحمراء، في القناة تسمى G و R للصورة، على التوالي.
- استيراد ملف TIFF مع برمجيات التحليل المناسب والمضي قدما لإجراء التحليل.
ملاحظة: يتم تطبيق الخطوات التالية (خطوات 5.3-5.7) بشكل منفصل لكل قناة: - محاذاة الأسطر عن طريق إجراء يكون متوسط وقت سيجمينتويسي أو تتحرك مع كتل من خطوط 500-1000. تحديد موضع غشاء، أي موضع بكسل مع معدل الحد الأقصى للعدد، في كل كتلة. تحول جميع الكتل إلى نفس الموضع الأفقي. بتصحيح هذا الإجراء للتشريد الأفقي للاتصال خلية خلية، مثلاً، بسبب حركة الخلية.
- تلخيص جميع خطوط متحاذية على طول محور الوقت وتناسب الشخصية متوسط كثافة استخدام دالة ضبابي. حضور كبير الخلفية داخل الخلايا، استخدم ضبابي بالإضافة إلى دالة سينية. تعريف بكسل المقابلة للغشاء ككل بكسل داخل ±2.5σ موقف الغشاء ونلخص الكثافة هذه بكسل في كل سطر، الحصول على قيمة إشارة صف واحد لكل نقطة مرة (أي، لكل خط المسح الضوئي).
- إذا لزم الأمر (مثلاً خلفية > 10% إشارة غشاء)، تطبيق تصحيح خلفية عن طريق طرح كثافة بكسل المتوسط في السيتوبلازم مضروباً في 2.5σ (في وحدات بكسل) من الأسفار غشاء، في كتل من خطوط 1000. تجنب مشرق حويصلات داخل الخلايا عند اختيار خلفية بكسل.
- إذا كان يتم ملاحظة فوتوبليتشينج، تطبيق تصحيح تبيض. ولذلك، تناسب السلسلة الزمنية fluorescence الغشاء مع دالة آسيه مزدوجة وتطبيق التصحيح المناسب 1 معادلة الصيغة،16.
ملاحظة: بدلاً من ذلك، فورييه الطيف على أساس مخططات تصحيح قد يكون تطبيق27. (الحرجة) إذا كان هناك فوتوبليتشينج لكن لا المصوبة ل، قد تكون مشوهة لجنة الأمن الغذائي العالمي شدة وتقديرات المعلمة قد تكون متحيزة بشدة (مثلاً، انظر الشكل 5ه). - حساب أكفس وأطر التعاون القطري وفقا للمعادلات 2 و 3 باستخدام، مثلاً، خوارزمية متعددة-تاو28. لتحسين موثوقية التحليل وتجنب المصنوعات اليدوية، وإجراء العمليات الحسابية لشرائح قياس إجمالي تساوي 10-20. فحص سلسلة زمنية الأسفار ولجنة الأمن الغذائي العالمي في كل قطعة وإزالة شرائح مشوهة وضوح (انظر الأمثلة في الشكل 4A-4 د). متوسط جميع قطاعات غير مشوهة.
ملاحظة: هذا الإجراء يمكن أن يكون آليا لتجنب تحيز ذاتي ل البيانات29. لقياسات غير مستقرة جداً وجود العديد من مقاطع قصيرة قد تكون مفيدة. غير أن طول الجزء ينبغي أن يظل على الأقل ثلاثة أوامر من حجم أعلاه وقت نشرها لتجنب الإحصائية أونديرسامبلينج أخطاء29،30،17. - تناسب نموذج نشر ثنائي الأبعاد، 4 المعادلة، إلى لجنة الأمن الغذائي التي تم الحصول عليها. ولذلك، إصلاح هيكل عامل إلى القيمة التي تم الحصول عليها في قياس المعايرة (القسم 3 من البروتوكول). يمكن تحسين دقة تناسب بأداء نوبة مرجح استخدام الأوزان الإحصائية لكل نقطة بيانات تم الحصول عليها من خوارزمية تاو متعددة.
- حساب معامل نشر استخدام الخصر محسوبة وفقا للمعادلة 7.
- حساب سطوع الجزيئية بتقسيم الأسفار متوسط الكثافة في كل قناة بالمقابل عدد الجسيمات، 8 المعادلة. تطبيع قيمة سطوع العزم في كل قناة بسطوع متوسط مرجع أحادي مقابل الحصول على الدولة أوليجوميريك، وأخذا في الاعتبار غير الفلورية في الثانية23. لتحقيق هذا الهدف، تحديد قيم السطوع ديمر هومو متوسط من تحليل لون واحد لحساب الكسر من غير الفلورية في الثانية23.
- حساب الصليب-الارتباط النسبي وفقا للمعادلة 9.
6-عدد عبر الارتباط والسطوع: معايرة الكاشف
ملاحظة: يوفر البروتوكول التالية إرشادات عامة بشأن كيفية معايرة نظام الكشف. هذا الإجراء إلزامي لنظم الكشف التناظرية، ولكن غير مطلوب تماما عندما تستخدم فوتون الحقيقي للكشف عن العد.
- الجاف للحلول المناسبة صبغ للذوبان في الماء (انظر الجدول للمواد للحصول على أمثلة) على طبق أسفل زجاج 35 ملم. تعيين مسار بصري تبعاً لذلك، أي 488 أو 561 الإثارة نانومتر والكشف في شمال البحر الأبيض المتوسط 499-552 أو 570 695 نانومتر، على التوالي.
ملاحظة: بدلاً من ذلك، سطح معدني عاكس يمكن استخدام بدلاً من الحلول صبغ المجففة عن طريق وضع قطعة معدنية مباشرة فوق الهدف. - إجراء قياسات N & ب لون واحد في المناطق ذات التركيزات صبغة مختلفة أو ليزر مختلف القوى. ولذلك، استخدام التكبير/التصغير لتحقيق حجم بكسل من 300 نانومتر، سرعة المسح الضوئي الوقت يسكن بكسل المناسبة، مثلاً، المايكروثانيه 25 وتحديد دورات لإطارات 100-200.
- تعيين كاشفات عد فوتون (أو الوضع التمثيلي إذا هي القيام بقياسات مع التناظرية الكشف) واضغط على بدء التجربة لبدء اكتساب. إجراء القياس في صفر طاقة الإثارة لتحديد كثافة الإزاحة.
- مؤامرة الفرق بكسل كدالة كثافة بكسل لكل بكسل المقاسة وأداء نوبة خطي لهذه البيانات. تحديد S كمنحدر احتواء الخطي. حساب ضجيج قراءات من التقاطع y، استخدام S والإزاحة كثافة مصممة وفقا لمعادلة 14.
7-رقم عبر الارتباط والسطوع: اقتناء
- اتبع الخطوات 4.1-4.4 بروتوكول اكتساب سفككس.
- استخدام المحاصيل لتحديد إطار 512 × 128 بكسل حول خلية خلية الاتصال (أو الساعة معزولة للتحكم بالسطوع هومو-ديمر)، و التكبير لتحقيق حجم بكسل من 50-100 نانومتر.
- استخدام سرعة المسح الضوئي لتعيين الوقت المناسب بكسل يسكن، مثلاً، المايكروثانيه 6.3.
ملاحظة: في ن & ب، ينبغي أن يكون الوقت يسكن بكسل أصغر بكثير من وقت نشر بروتين الفائدة. إذا تم اختيار مخطط بديل إثارة، على سبيل المثال، التبديل بين المسارات كل سطر، ينبغي أن يكون الوقت بين المسارين أصغر من وقت نشر بروتين الفائدة. وإلا يتم تقليل عبر كشفها-العلاقة المتبادلة. - مجموعة دورات لإطارات 100-200.
ملاحظة: سيؤدي إلى تحسين عدد إطار أعلى دائرة الاستخبارات الوطنية، ومع ذلك، قد تحد من حركة الخلية قياس مجموع الوقت. المسح الضوئي الوقت لكل إطار ينبغي أن يكون أعلى بكثير من وقت نشر بروتين الفائدة. خلاف ذلك هو تقليل سطوع واضح، يبدو أن أي من الجزيئات غير متحرك. للمجمعات نشرها ببطء شديد، وفرض وقفه، مثلاً، 2 ق، في ما بين الإطارات باستخدام الفاصل الزمني في القائمة الفرعية السلسلة الزمنية . - تعيين سلطات الليزر إلى القيم المناسبة (القيم النموذجية هي ~ 1-2 µW ل 488 نانومتر و ~ 5-10 µW للإثارة نانومتر 561).
ملاحظة: العالي للطاقة الليزر يؤدي إلى سطوع أعلى وتحسين دائرة الاستخبارات الوطنية، ولكن أيضا فوتوبليتشينج المحسن. الليزر القوى يجب أن تكون مرتفعة بما يكفي لتحقيق سطوع تم الكشف عنها على الأقل ~ 1 كيلو هرتز/MOL لكن تظل منخفضة بما يكفي لتجنب أكثر من 10-20% فوتوبليتشينج. عادة ما يتم الحصول على فوتوبليتشينج ميجفب/مييفب أو مكاردينال/مشري، أقل من 10%. - تعيين كاشفات عد فوتون (أو الوضع التمثيلي إذا هي القيام بقياسات مع التناظرية الكشف). اضغط على بدء التجربة لبدء اكتساب.
- تقييم معدل العد فوتون. إذا تجاوزت معدلات العد بكسل خلية الاتصال 1 ميغاهرتز، تقليل قوة الليزر أو حدد الخلايا التي تنخفض فيها مستويات التعبير. كرر الخطوات من 7، 2-7.7. لقياس هذا الزوج القادم من الخلايا. من المستحسن لقياس الخلايا 10-15 كل تجربة على مستويات مختلفة من التعبير.
- إذا كان يتم إجراء تحليل سطوع لقياس أوليجوميريزيشن، إجراء القياسات معايرة سطوع هومو-ديمر وفقا للخطوات معدلة 7.1 7.7: قياس كل بروتين فلوري هومو ديمر كل على حدة (في الخلايا المعزولة، أعدت باستخدام بروتوكول القسم 2) وإجراء القياسات فقط في إحدى القنوات الطيفية.
8-رقم عبر الارتباط والسطوع: تحليل البيانات
ملاحظة: ويتبع البروتوكول التالي إجراء تحليل هو موضح سابقا12،31. تتوفر التعليمات البرمجية البرمجيات من المؤلفين عند الطلب.
- استيراد البيانات الخام (مثل الاتحاد ملفات يمكن استيرادها باستخدام الحزمة32 بيوفورماتس). متوسط كافة الإطارات وتحديد منطقة للفائدة (ROI) حول جهة الاتصال خلية خلية.
- القيام صورة محاذاة خوارزمية33، مثلاً، بتعظيم العلاقة المكانية بين رويس في الإطارات التالية لترجمة الأفقي التعسفي، بلغ في المتوسط عبر كل القنوات. سيتم تصحيح هذا الإجراء للتنقل الأفقي للخلايا.
- تنطبق تصفية boxcar22 للحد من تقلبات المعمرة دخيلة، منشؤها، مثلاً، حركة الخلايا المتبقية أو تبييض الخلفية. وبدلاً من ذلك، قد يتم تطبيق أسلوب ديتريندينج لتصحيح فوتوبليتشينج34.
ملاحظة: إذا كان لا يوجد تحليل سيجمينتويسي أو ديتريندينج يتم تطبيقها، وقد يكون السطوع الظاهر يبالغ إلى حد كبير.- تعريف القطع المنزلقة من، مثلاً، 8 إلى 15 الإطارات (مثلاً، إطارات 1 إلى 8، 2 إلى 9، وهلم جرا) وحساب قيم السطوع القناة وعبر الارتباط وفقا لمعادلات 10، 11 و 15 بيكسيلويسي في كل مقطع. إذا لم تكن كاشفات فوتون الحقيقي العد، للكشف عن تأخذ المعلمات كاشف معايرة في الاعتبار عند حساب السطوع، أي استخدام المعادلات 12 و 13 بدلاً من ذلك.
ملاحظة: حساب قيم السطوع في قطاعات معينة من 8 إلى 15 الإطارات يؤدي إلى تقدير 10-20 ٪ من السطوع المطلق والمبالغة في تقدير 10-20% من إعداد الجسيمات. ومع ذلك، نسب السطوع (مثلاً، ديمر للسطوع مونومر) لا تتأثر، طالما أن طول الجزء تظل ثابتة طوال التحليل (البيانات لا تظهر). يمكن تحديدها عن طريق المحاكاة أن الخطأ الإحصائي لطول قطاع معين وتصحيحها وبالتالي ل. - متوسط قيم الإضاءة التي يتم الحصول عليها بيكسيلويسي عبر جميع القطاعات. في هذه الخطوة، قد إزالة 5% أعلى وأدنى قيم السطوع الجزء من المتوسط أو استبعاد الأجزاء التي تظهر تشويها واضحا في الكثافة، بسبب، مثلاً، حويصلة داخل الخلايا أو تجميع عابر موجودة في هذه بكسل.
- تعريف القطع المنزلقة من، مثلاً، 8 إلى 15 الإطارات (مثلاً، إطارات 1 إلى 8، 2 إلى 9، وهلم جرا) وحساب قيم السطوع القناة وعبر الارتباط وفقا لمعادلات 10، 11 و 15 بيكسيلويسي في كل مقطع. إذا لم تكن كاشفات فوتون الحقيقي العد، للكشف عن تأخذ المعلمات كاشف معايرة في الاعتبار عند حساب السطوع، أي استخدام المعادلات 12 و 13 بدلاً من ذلك.
- رسم قيم السطوع بكسل كدالة كثافة بكسل وحدد السكان بكسل يتوافق مع جهة الاتصال خلية خلية. وسيكون بكسل خلفية قيم كثافة منخفضة جداً. عند هذه النقطة، إعادة تقييم معدل الحد الأقصى للعدد. استبعاد بكسل مع معدلات العد أعلاه 1 ميغاهرتز الحيلولة دون حدوث تصادم بين آثار.
- إنشاء رسوم بيانية سطوع القناة وعبر ارتباط الخلية الخلية المحددة بكسل الاتصال والحصول على قيم السطوع بلغ متوسط العائد على الاستثمار. تطبيع قيمة سطوع القناة متوسط بمتوسط سطوع مرجع أحادي مقابل الحصول على الدولة أوليجوميريك، وأخذا في الاعتبار غير الفلورية في الثانية23. ولذلك، تحديد قيم السطوع ديمر هومو متوسط من تحليل لون واحد لحساب الكسر من غير الفلورية في الثانية23.
- للتوضيح، رسم خرائط سطوع القناة وعبر الارتباط.
النتائج
أول اختبار لتحليل التفاعل البروتين البروتين، أي خلط الخلايا معربا عن البروتينات الفلورية طيفيا متميزة متبوعاً سفككس/ccN & ب القياسات (الشكل 1)، ينبغي أن يقوم على البروتينات التي لا يتوقع أن التفاعل في الخلية جهة الاتصال (أي، عنصر تحكم سلبية). ولذلك...
Discussion
الإجراء التجريبي الموضح هنا يسمح التحقيق في البروتين-بروتين التفاعلات عبر جهات الاتصال خلية خلية، تستخدم تقنيات التحليل الطيفي تقلب الأسفار، إلا وهي سفككس و ccN & b تشمل هذه الأساليب تحليل إحصائي لتقلبات fluorescence المنبعثة من اثنين FPs طيفيا المنفصلين تنصهر فيها protein(s) للفائدة في جهة اتصال...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
بتأييد هذا العمل جزئيا الأوقيانوغرافية الألمانية (DFG) منح 254850309. يشكر المؤلفون لوكنر مادلين لقراءة نقدية من المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM growth medium | PAN-Biotech | P04-01548 | |
| DPBS w/o: Ca2+ and Mg2+ | PAN-Biotech | P04-36500 | |
| DPBS w: Ca2+ and Mg2+ | PAN-Biotech | P04-35500 | |
| Trypsin EDTA | PAN-Biotech | P10-023100 | |
| TurboFect Transfection Reagent | Thermo Fisher Scientific | R0531 | |
| HEK 293T cells | DSMZ | ACC 635 | |
| Alexa Fluor 488 NHS Ester | Thermo Fisher Scientific | A20000 | |
| Rhodamine B | Sigma-Alderich | 83689-1G | |
| Plasmid DNA | Addgene | NA | See reference 12 (Dunsing et. al., MBoC 2017),for a detailed description of all plasmids |
| 6-well plate | Starlab | CC7672-7506 | |
| 35-mm glass bottom dishes | CellVis | D35-14-1.5-N | |
| Zeiss LSM780 confocal | Carl Zeiss | NA | |
| MATLAB software package | MathWorks | 2015b | |
| Neubauer cell counting chamber | Marienfeld | 640110 |
References
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. . Molecular biology of the cell. , (2002).
- Tepass, U., Truong, K., Godt, D., Ikura, M., Peifer, M. Cadherins in embryonic and neural morphogenesis. Nature Reviews Molecular Cell Biology. 1 (2), 91-100 (2000).
- Harris, T. J. C., Tepass, U. Adherens junctions: from molecules to morphogenesis. Nature Reviews Molecular Cell Biology. 11 (7), 502-514 (2010).
- Hernández, J. M., Podbilewicz, B. The hallmarks of cell-cell fusion. Development. 144 (24), 4481-4495 (2017).
- Huppa, J. B., Davis, M. M. T-cell-antigen recognition and the immunological synapse. Nature Reviews Immunology. 3 (12), 973-983 (2003).
- Kaden, D., Voigt, P., Munter, L. -. M., Bobowski, K. D., Schaefer, M., Multhaup, G. Subcellular localization and dimerization of APLP1 are strikingly different from APP and APLP2. Journal of cell science. 122, 368-377 (2009).
- Yap, A. S., Michael, M., Parton, R. G. Seeing and believing: recent advances in imaging cell-cell interactions. F1000Research. 4, 273 (2015).
- Kashef, J., Franz, C. M. Quantitative methods for analyzing cell-cell adhesion in development. Developmental Biology. 401 (1), 165-174 (2015).
- Soba, P., et al. Homo- and heterodimerization of APP family members promotes intercellular adhesion. The EMBO Journal. 24 (20), 3624-3634 (2005).
- Kim, S. A., Tai, C. -. Y., Mok, L. -. P., Mosser, E. A., Schuman, E. M. Calcium-dependent dynamics of cadherin interactions at cell-cell junctions. Proceedings of the National Academy of Sciences of the United States of America. 108 (24), 9857-9862 (2011).
- Feinberg, E. H., et al. GFP Reconstitution Across Synaptic Partners (GRASP) Defines Cell Contacts and Synapses in Living Nervous Systems. Neuron. 57 (3), 353-363 (2008).
- Dunsing, V., Mayer, M., Liebsch, F., Multhaup, G., Chiantia, S. Direct evidence of amyloid precursor-like protein 1 trans interactions in cell-cell adhesion platforms investigated via fluorescence fluctuation spectroscopy. Molecular biology of the cell. 28 (25), 3609-3620 (2017).
- Schneider, F., et al. Diffusion of lipids and GPI-anchored proteins in actin-free plasma membrane vesicles measured by STED-FCS. Molecular Biology of the Cell. 28 (11), 1507-1518 (2017).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature methods. 3 (2), 83-89 (2006).
- Ries, J., Schwille, P. Studying Slow Membrane Dynamics with Continuous Wave Scanning Fluorescence Correlation Spectroscopy. Biophysical Journal. 91 (5), 1915-1924 (2006).
- Ries, J., Chiantia, S., Schwille, P. Accurate Determination of Membrane Dynamics with Line-Scan FCS. Biophysical Journal. 96 (5), 1999-2008 (2009).
- Chiantia, S., Ries, J., Schwille, P. Fluorescence correlation spectroscopy in membrane structure elucidation. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1788 (1), 225-233 (2009).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical journal. 94 (6), 2320-2332 (2008).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy research and technique. 71 (1), 69-81 (2008).
- Unruh, J. R., Gratton, E. Analysis of Molecular Concentration and Brightness from Fluorescence Fluctuation Data with an Electron Multiplied CCD Camera. Biophysical Journal. 95 (11), 5385-5398 (2008).
- Digman, M. A., Wiseman, P. W., Choi, C., Horwitz, A. R., Gratton, E. Stoichiometry of molecular complexes at adhesions in living cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2170-2175 (2009).
- Hellriegel, C., Caiolfa, V. R., Corti, V., Sidenius, N., Zamai, M. Number and brightness image analysis reveals ATF-induced dimerization kinetics of uPAR in the cell membrane. The FASEB journal official publication of the Federation of American Societies for Experimental Biology. 25 (9), 2883-2897 (2011).
- Dunsing, V., Luckner, M., Zühlke, B., Petazzi, R. A., Herrmann, A., Chiantia, S. Optimal fluorescent protein tags for quantifying protein oligomerization in living cells. Scientific Reports. 8 (1), 10634 (2018).
- Chen, Y., Johnson, J., Macdonald, P., Wu, B., Mueller, J. D. Observing Protein Interactions and Their Stoichiometry in Living Cells by Brightness Analysis of Fluorescence Fluctuation Experiments. Methods in enzymology. 472, 345-363 (2010).
- . Absolute Diffusion Coefficients: Compilation of Reference Data for FCS Calibration Available from: https://www.picoquant.com/images/uploads/page/files/7353/appnote_diffusioncoeffients.pdf (2010)
- Foo, Y. H., Naredi-Rainer, N., Lamb, D. C., Ahmed, S., Wohland, T. Factors affecting the quantification of biomolecular interactions by fluorescence cross-correlation spectroscopy. Biophysical journal. 102 (5), 1174-1183 (2012).
- Baum, M., Erdel, F., Wachsmuth, M., Rippe, K. Retrieving the intracellular topology from multi-scale protein mobility mapping in living cells. Nature Communications. 5, 4494 (2014).
- Wohland, T., Rigler, R., Vogel, H. The standard deviation in fluorescence correlation spectroscopy. Biophysical journal. 80 (6), 2987-2999 (2001).
- Ries, J., et al. Automated suppression of sample-related artifacts in Fluorescence Correlation Spectroscopy. Optics Express. 18 (11), 11073 (2010).
- Ries, J., Schwille, P. New concepts for fluorescence correlation spectroscopy on membranes. Physical Chemistry Chemical Physics. 10 (24), 3487 (2008).
- Mayer, M. C., et al. Amyloid precursor-like protein 1 (APLP1) exhibits stronger zinc-dependent neuronal adhesion than amyloid precursor protein and APLP2. Journal of Neurochemistry. 137 (2), 266-276 (2016).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Trullo, A., Corti, V., Arza, E., Caiolfa, V. R., Zamai, M. Application limits and data correction in number of molecules and brightness analysis. Microscopy Research and Technique. 76 (11), 1135-1146 (2013).
- Nolan, R., et al. nandb-number and brightness in R with a novel automatic detrending algorithm. Bioinformatics. 33 (21), 3508-3510 (2017).
- Hammond, G. R. V., Sim, Y., Lagnado, L., Irvine, R. F. Reversible binding and rapid diffusion of proteins in complex with inositol lipids serves to coordinate free movement with spatial information. The Journal of cell biology. 184 (2), 297-308 (2009).
- Hendrix, J., Dekens, T., Schrimpf, W., Lamb, D. C. Arbitrary-Region Raster Image Correlation Spectroscopy. Biophysical journal. 111 (8), 1785-1796 (2016).
- Hendrix, J., et al. Live-cell observation of cytosolic HIV-1 assembly onset reveals RNA-interacting Gag oligomers. The Journal of cell biology. 210 (4), 629-646 (2015).
- Hendrix, J., Schrimpf, W., Höller, M., Lamb, D. C. Pulsed Interleaved Excitation Fluctuation Imaging. Biophysical Journal. 105 (4), 848-861 (2013).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5 (1), 5412 (2014).
- Chojnacki, J., et al. Envelope glycoprotein mobility on HIV-1 particles depends on the virus maturation state. Nature Communications. 8 (1), 545 (2017).
- Godin, A. G., et al. Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis. Proceedings of the National Academy of Sciences of the United States of America. 108 (17), 7010-7015 (2011).
- Müller, J. D., Chen, Y., Gratton, E. Resolving Heterogeneity on the Single Molecular Level with the Photon-Counting Histogram. Biophysical Journal. 78 (1), 474-486 (2000).
- Kim, S. A., Heinze, K. G., Bacia, K., Waxham, M. N., Schwille, P. Two-Photon Cross-Correlation Analysis of Intracellular Reactions with Variable Stoichiometry. Biophysical Journal. 88 (6), 4319-4336 (2005).
- Jenkins, E., et al. Reconstitution of immune cell interactions in free-standing membranes. Journal of cell science. 132 (4), (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved