A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس المباشر للمشاركة المستهدفة KDM1A باستخدام الاختبارات المناعية المستندة إلى العلاج الكيميائي
In This Article
Summary
هنا، نقدم بروتوكوللقياس المشاركة المستهدفة KDM1A في خلية بشرية أو حيوانية، أو أنسجة أو عينات دم عولجت بمثبطات KDM1A. يستخدم البروتوكول وضع علامات المسبار الكيميائي لإنزيم KDM1A المجاني والتحديد الكمي المباشر للمهنة المستهدفة باستخدام الاختبارات المناعية المستندة إلى العلاج الكيميائي ويمكن استخدامها في الدراسات ما قبل السريرية والسريرية.
Abstract
وتقييم المشاركة المستهدفة، التي تعرف بأنها تفاعل دواء مع البروتين الذي صمم له، هو شرط أساسي لتفسير النشاط البيولوجي لأي مركب في تطوير المخدرات أو في مشاريع البحوث الأساسية. في علم الوراثة، يتم تقييم المشاركة المستهدفة في معظم الأحيان عن طريق تحليل علامات الوكيل بدلاً من قياس اتحاد المركب إلى الهدف. تتضمن التبيّات البيولوجية في المصب التي تم تحليلها تعديل علامة الهيستون أو تغييرات التعبير الجيني. KDM1A هو demethylase يسين الذي يزيل مجموعات الميثيل من H3K4 أحادية وثنائية الميثيل، وهو تعديل يرتبط بإسكات التعبير الجيني. تعديل علامات الوكيل يعتمد على نوع الخلية ووظيفة التركيبة الوراثية للخلايا التي تم التحقيق فيها، والتي يمكن أن تجعل التفسير والمقارنة بين الحالات صعبة للغاية. وللتحايل على هذه المشاكل، يتم تقديم بروتوكول متعدد الاستخدامات لتقييم آثار الجرعة وديناميات المشاركة المستهدفة المباشرة في KDM1A. الفحص الموصوف يجعل استخدام مسبار كيميائي KDM1A لالتقاط وقياس الإنزيم غير المثبط، ويمكن تطبيقه على نطاق واسع على الخلايا أو عينات الأنسجة دون الحاجة إلى التعديل الوراثي، لديه نافذة ممتازة للكشف، ويمكن استخدامها على حد سواء للبحوث الأساسية وتحليل العينات السريرية.
Introduction
ليسين demethylase محددة 1 (KDM1A)1 هو demethylase تشارك في السيطرة على النسخ الجيني. وقد برز هذا البروتين كهدف الدوائية المرشح2 في علم الأورام; بما في ذلك سرطان الدم النقوي الحاد3 (AML), متلازمة خلل التنسج النقوي (MDS)4, التليف النقوي (MF)5,6, سرطان الرئة الخلية الصغيرة (SCLC)7; في مرض الخلايا المنجلية (SCD)8،9، وفي أمراض الجهاز العصبي المركزي بما في ذلك مرض الزهايمر (AD)، التصلب المتعدد (MS)؛ وفي العدوان10.
معظم المركبات المثبطة KDM1A في التنمية السريرية هي مشتقات السيكلوبروبيلان وتمنع البروتين عن طريق ربط covalent إلى الفلافين الدينوكليوتيد (FAD) عامل مساعد11. تثبيط KDM1A يحفز تغييرات التعبير الجيني، ولكن هذه التغييرات تختلف اختلافا كبيرا عبر الأنسجة، وأنواع الخلايا، أو حالات المرض. تثبيط KDM1A أيضا يغير علامات الهيستون12،ولكن يتم إنتاج هذه التغييرات عموما محليا في موقع معين في الجينوم، ومرة أخرى، والأنسجة العالية والخلية محددة.
وقد تم تطوير البروتوكول لقياس المشاركة المستهدفة KDM1A مباشرة في العينات البيولوجية، وقد تم تحسينه للاستخدام مع مثبطات سيكلوبروبيلامين المشتقة. ويستند هذا التقييم على تكنولوجيا ELISA ويحلل، في موازاة ذلك، توتال وفري (أي غير مقيدة بمثبط) KDM1A في استخراج البروتين الأصلي من عينة بيولوجية في اختبار مرحلة صلبة. وكخطوة أولى، يتم تحليل العينة البيولوجية في وجود البكيويند KDM1A الانتقائي ة العلاج الكيميائي OG-88113،14،المستمدة من مثبطات KDM1A الانتقائية ORY-1001 (iadademstat)، وهو مثبط قوي من KDM1A في السريرية تطوير لعلاج أمراض الأورام. يحتوي المسبار الكيميائي على50 IC لKDM1A من 120 nM ويشمل moiety ملزمة FAD مرتبطة بالبولي ايثيلين غليكول biotinylated (PEG) الذيل. يرتبط المسبار الكيميائي حصريًا بـ KDM1A المجاني، ولكن ليس بـ KDM1A المثبط في العينة. بعد ربط المسبار الكيميائي، يتم التقاط المجمعات التي تحتوي على KDM1A في العينة على لوحات ميكروتيدر مع سطح مطلي streptavidin لتحديد KDM1A مجانا، أو على لوحات مغلفة مع الأجسام المضادة أحادية النسيلة المضادة لKDM1A التقاط لتحديد مجموع KDM1A. بعد الغسيل، يتم احتضان كلا اللوحتين بجسم مضاد للكشف المضاد لـ KDM1A، وغسلهما مرة أخرى، واحتضنهما بجسم مضاد للأرنب مضاد للأرانب من نوع HRP-conju،( HRP-conju/ لكشفه باستخدام الركيزة المضيئة والقياس الكمي عن طريق قياس النسبية وحدات الضوء (RLU) في مقياسالإنارة (الشكل 1).
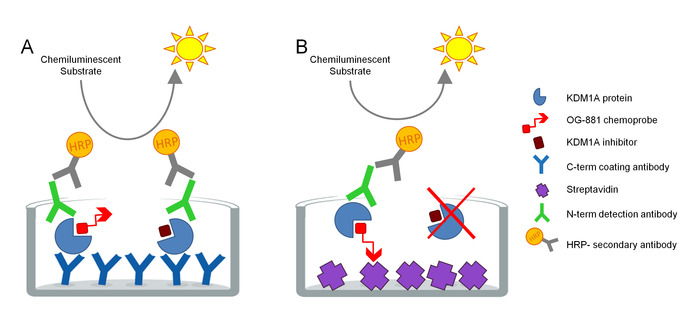
الشكل 1 مخطط إنزيم إليسا مرتبط بالفحص المناعي الكيموبي للمشاركة المستهدفة KDM1A: أ) تحديد إجمالي KDM1A باستخدام ساندويتش ELISA و B) تحديد KDM1A مجانا باستخدام العلاج الكيميائي ELISA. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتم تضمين منحنى قياسي في كل من لوحات ELISA للتحقق من خطية كل مستوى. ثم يتم حساب تحديد المشاركة المستهدفة KDM1A في كل عينة كقيمة نسبية للعينة قبل الجرعة أو السيارة المعالجة.
Access restricted. Please log in or start a trial to view this content.
Protocol
وتم الحصول على عينات من الدم من معهد البحوث الحيوية في سانت باو وفقا للتشريعات الإسبانية (Real Decreto de Biobancos 1716/2011) وموافقة لجان الأخلاقيات المحلية. أُجريت دراسات مع الأنسجة الحيوانية وفقاً للمبادئ التوجيهية المؤسسية لرعاية واستخدام الحيوانات المختبرية (توجيه مجلس الجماعات الأوروبية 86/609/EEC) الذي أنشأته اللجنة الأخلاقية لتجارب الحيوانات في PRAAL-PCB.
1. إعداد العينات البيولوجية للفحص.
تحذير: ينطوي هذا البروتوكول على التلاعب بالعينات البيولوجية التي قد تخضع لمعيار مسببات الأمراض المنقولة بالدم التابع لإدارة السلامة والصحة المهنيتين (29 CFR 1910.1030)، والتوجيه 2000/54/EC الصادر عن البرلمان الأوروبي وللمحكمة الأوروبية بشأن المؤرخ 18 أيلول/سبتمبر 2000 أو ما يعادله من لوائح. وبالإضافة إلى ذلك، قد تحتوي العينات البيولوجية على آثار للمركبات الكيميائية التحقيقية النشطة بيولوجيا، وقد ينطوي البروتوكول على مزيد من التلاعب بهذه المركبات. مراجعة صحيفة بيانات السلامة (SDS) للمركبات المستخدمة قبل بدء التجربة والتقيد الصارم بجميع تدابير السلامة المعمول بها في مركز البحوث، بما في ذلك استخدام معدات الحماية الشخصية الكافية(PPE). ارتداء الملابس الواقية المناسبة واستخدام التدريع السليم خلال التجربة. التخلص من المخلفات في حاويات النفايات المناسبة (النفايات البيولوجية/السامة للخلايا).
ملاحظة: يبدأ هذا البروتوكول بخلايا أو عينات من الأشخاص الذين عولجوا بمثبطKDM1A وضوابطهم غير المعالجة أو المركبات/الغفل المعالجة 3.
- الخلايا المعالجة بسيارة أو مثبطات KDM1A في المختبر
- للخلايا نمت في تعليق, كما 10 مل الثقافات, نقل تعليق إلى أنابيب مخروطية نظيفة 15 مل والمضي قدما إلى 1.1.3.
- للخلايا الملتصقة (نمت في 75 سم2 قوارير)، وإزالة المتوسطة من قارورة وغسل لفترة وجيزة باستخدام 4 مل PBS. فصل الخلايا من سفنهم باستخدام 1.5 مل من 0.5٪ تريبسين-EDTA خلال 2-5 دقيقة (قد تختلف ظروف التريبسيني، اتبع توصيات مزود خط الخلية)، إضافة 4 مل PBS ونقل الخلايا إلى أنابيب مخروطية نظيفة 15 مل.
- إدراج الأنابيب في مقاعد البدلاء أعلى الطرد المركزي وجمع الخلايا عن طريق الطرد المركزي لمدة 5 دقائق في 400 × ز في 4 درجة مئوية. إزالة supernatant، وإعادة تعليق بيليه في 1 مل من PBS الاستغناء عنها باستخدام micropipette ونقل التعليق إلى أنبوب الطرد المركزي الصغير 1.5 مل.
- إدراج العينات في جهاز طرد مركزي ميكروأنبوب والطرد المركزي لهم لمدة 5 دقائق في 400 × ز في 4 درجة مئوية. إزالة PBS عن طريق الطموح مع micropipette وإما الحفاظ على الكريات على الجليد والمضي قدما إلى الخطوة 2. أو تجميد الكريات على الجليد الجاف وتخزينها في -80 درجة مئوية حتى الخطوة 3.
- عينات من الأشخاص أو الحيوانات المعالجة بمركبة/وهمي أو مثبطات KDM1A
- الأنسجة: قطع الأنسجة في صغيرة، 1 سم3 قطع باستخدام مشرط. تجميد قطع الأنسجة في السائل N2 في حاوية ديوار وتخزينها في -80 درجة مئوية حتى الخطوة 3.
- خلايا الدم أحادية اللانووي متعددة الأشكال (PBMCs): تمييع 10 مل من الدم الطازج (عملية الحد الأقصى 2 ساعة بعد سحب الدم) التي تم جمعها في K2-EDTA أنابيب مع 2 مجلدات من PBS في أنبوب مخروطي 50 مل. عزل PBMCs من الدم باستخدام أنابيب فصل PBMC التي يتم الحصول عليها تجاريا وفقا لتعليمات الشركة المصنعة. الحفاظ على الكريات على الجليد والمضي قدما إلى الخطوة 3.2؛ أو تجميد الكريات على الجليد الجاف وتخزينها في -80 درجة مئوية حتى الخطوة 3.
ملاحظة: تحتوي بيليه الخلية الرطبة من 20 إلى 50 ميكرولتر على 1 × 107 خلايا، اعتماداً على حجم الخلية. بيليه PBMC الرطب التي تم الحصول عليها من 10 مل من الدم البشري السليم لديها حجم 20 ميكرولتر ويحتوي على 1 × 107 PBMCs ويمكن تخزين الأنسجة أو الكريات الخلية في -80 درجة مئوية لمدة تصل إلى 6 أشهر.
2. إعداد الحلول
- إعداد 2 μM OG-881 حل العمل: اتخاذ 10 μL aliquot استخدام واحد من 20 مل biotinylated التحقيق OG-881 حل الأسهم من الثلاجة 4 درجة مئوية وتركها في درجة حرارة الغرفة (RT) لمدة 10 دقيقة. أيون في PBS، وذلك باستخدام micropipette مع نصائح مرشح وتغيير غيض بين خطوات التخفيف المختلفة.
- إعداد 10X مثبطات البروتياز: حل 1 قرص في 1 مل PBS في أنبوب الطرد المركزي الجزئي.
- إعداد المجلد المطلوب من 1X خلية lysis العازلة مع 25 nM OG-881 العلاج الكيميائي. لكل مل، مزيج 100 درجة مئوية التي تم الحصول عليها تجاريا 10X خلية lysis العازلة، 150 ميكرولتر من 10X مثبطات البروتياز، 12.5 ميكرولتر من 2 μM OG-881، و 737.5 ميكرولتر من نوع 1 الماء المقطر مزدوجة.
- بشكل اختياري إعداد وحدة التخزين المطلوبة من المخزن المؤقت 1x خلية lysis ولكن مع 25 nM ORY-1001 بدلاً من OG-881 كما في الخطوة 2.3. ويمكن استخدام مثبطات أقل قوة ولكن قد تتطلب تركيزات أعلى، لاستخدامها في السيطرة الإيجابية مع تثبيط 100٪ (انظر الخطوة 3.5).
ملاحظة: اتخاذ التدابير المناسبة لتجنب أي تلوث غير مقصود للحلول أو العينات مع حلول المخزون المانع OG-881 أو KDM1A. لحساب الحجم المطلوب من 1X خلية lysis العازلة مع 25 nM OG-881، نفترض أن 400 ميكرولتر مطلوب لكل 40 ملغ من الأنسجة المسحوقة، أو 200 درجة مئوية لكل بيليه الرطب من 107 خلايا.
3. استخراج البروتين الأصلي
- من الأنسجة:
- سحق وتجانس مكعب 1 سم3 من الأنسجة المجمدة مع هاون والآفات المبردة على الجليد الجاف. Aliquot العينات في قارورة استخدام واحد تحتوي على 40 ملغ من مسحوق الأنسجة، وتجنب ذوبان في جميع الأوقات. انتقل إلى الخطوة 3-1-2. للمعالجة الفورية أو تخزين في -80 درجة مئوية.
- إعادة تعليق 40 ملغ من الأنسجة المسحوقة في 400 درجة مئوية من 1X خلية الليسيس العازلة مع 25 nM OG-881، دوامة لمدة 10 ثانية، وإجبار العينة خمس مرات على الأقل من خلال إبرة حقنة حادة قياس 18 مقياس حتى يتم تحقيق تحليل الأنسجة والأصفر الفاتح عكر إلى تعليق البرتقال هو تعليق تم الحصول عليها. تجنب تشكيل فقاعة.
- تابع إلى الخطوة 3.3
- من كريات الخلايا (PBMCs وخطوط الخلايا):
- إعادة تعليق بيليه من 1 × 107 خلايا في 200 μL من 1X خلية lysis العازلة التي تحتوي على 25 nM OG-881. دوامة العينات لفترة وجيزة وإبقائها على الجليد لمدة 5 دقائق.
- سونيكات العينات في سونيكاتور باستخدام 3 نبضات من 20 ثانية كل في 45 كيلو هرتز; وضعها على الجليد لمدة 20 ثانية بين البقول.
ملاحظة: بمجرد إعادة تعليق العينات البيولوجية في المخزن المؤقت لـ 1x من اللباقة الخلوية، احتفظ بها على الجليد أثناء بقية العملية.
- الاحتفاظ بالعينات على الجليد لمدة 5 دقائق إضافية، دوامة لفترة وجيزة والطرد المركزي العينات لمدة 10 دقيقة في 14 000 × ز في جهاز طرد مركزي المبردة مسبقا في 4 درجة مئوية.
- باستخدام ميكرومازيت 1 مل، نقل supernatants إلى أنابيب الطرد المركزي الصغيرة الطازجة 1.5 مل وتركها على الجليد خلال 2 ح. مواصلة إلى الخطوة 4.
- واختياريًا، يمكن إعداد عنصر تحكم إيجابي لمحاكاة المشاركة المستهدفة بنسبة 100% على النحو التالي:
- إعادة تعليق بيليه الخلية أو الأنسجة المسحوقة من مركبة أو عينة غير المعالجة (الجرعة المسبقة) في الحجم المطلوب من 1X الخلية الاسطا العازلة مع 25 nM ORY-1001 وعملية على النحو المبين في الخطوة 3.1 إلى 3.3.
- نقل supernatants من السيطرة الإيجابية في أنابيب الطرد المركزي الصغيرة 1.5 مل الطازجة وتركها على الجليد لمدة 1 ساعة.
- إضافة 5 ميكرولتر من 2 μM OG-881 حل العمل إلى supernatant التحكم الإيجابي (حجم للتحكم الإيجابي ولدت من عينة الأنسجة 40 ملغ) أو 2.5 ميكرولتر من 2 μM OG-881 حل العمل (حجم للتحكم الإيجابي ولدت من عينة 107خلية) للحصول على نفس تركيز OG-881 مثل العينات الأخرى وترك على الجليد خلال 2 ح. مواصلة إلى الخطوة 4.
4. القياس الكمي للبروتين الأصلي باستخدام برادفورد &
- تمييع مصدر تجاري برادفورد بروتين تحليل كاشف 5 مرات مع H2O نوع 1 الماء المقطر مزدوجة. حساب حجم الكاشف المطلوب للكمية الإجمالية من العينات والمعايير (1 مل لكل عينة أو معيار + 5 مل حجم الزائدة).
- لشكل الزلال المصل البقري (BSA) القياسي، قم بإعداد أنبوب طرد مركزي واحد مع حل فحص بروتين برادفورد المخفف بـ 1 مل (فارغ) وسبعة أنابيب طرد مركزي دقيق مع 995 درجة مئوية من محلول فحص بروتين برادفورد المخفف. إضافة 5 ميكرولتر من كل معيار من معايير BSA (تركيز يتراوح بين 125 و2000 ميكروغرام/مل) لكل من أنابيب الطرد المركزي الدقيقة السبعة ومزجها عن طريق عكس الأنابيب بلطف عدة مرات. حضانة لمدة 5 دقائق في RT.
- نقل المعايير المخففة إلى cuvettes وقراءة OD من عينات فارغة والبقري المصل الزلال القياسية في مقياس الطيف في 280 نانومتر.
- بالنسبة للعينات البيولوجية، قم بإعداد أنبوب واحد للطاردة الدقيقة مع 1 مل مخفف برادفورد البروتين فحص الحل (فارغة) والعديد من أنابيب الطرد المركزي الدقيقة مع 999 درجة مئوية من الكاشف برادفورد البروتين المخفف كعينات التي تحتاج إلى تحديد كمية. باستخدام ميكرومازيت P2 التلقائي، إضافة 1 ميكرولتر من استخراج البروتين الأصلي أعدت في الخطوة 3 إلى كل أنبوب الطرد المركزي الجزئي ومزيج عن طريق عكس بلطف الأنابيب عدة مرات. احتضان العينات 5 دقيقة في RT.
- نقل وحدات التخزين إلى cuvettes وقراءة OD من العينات في مقياس الطيف الضوئي في 280 نانومتر.
- بشكل تفضيلي، انتقل على الفور إلى الخطوة 5. بدلا من ذلك، تخزين مقتطفات البروتين الأصلي في -80 درجة مئوية حتى الخطوة 5. تجنب تجميد دورات ذوبان.
5. ELISAs الإنارة لتحديد KDM1A الكلي والحر
ملاحظة: الحفاظ على درجة حرارة المختبر ثابتة عند 23-24 درجة مئوية (RT).
- طلاء لوحات ميكروتيدر مع القبض على الجسم المضاد KDM1A أو Streptavidin
- مجموع KDM1A ELISA: لكل لوحة، وإعداد 10 مل من KDM1A التقاط الأجسام المضادة إلى تركيز نهائي من 2 ميكروغرام / مل في PBS. نقل 100 درجة مئوية في كل بئر من لوحة.
- مجانا KDM1A ELISA: لكل لوحة، وإعداد 10 مل من streptavidin في 10 ميكروغرام / مل في PBS. نقل 100 درجة مئوية في كل بئر من لوحة.
- أعلى ختم مجموع ومجانا KDM1A إليسا لوحات مع فيلم لاصق واحتضان لوحات بين عشية وضحاها في 4 درجة مئوية في الثلاجة.
- غسل وحجب لوحات
- أخرج الأطباق من الثلاجة واتركها متساوية لمدة 45 دقيقة في RT قبل الاستخدام.
- إعداد 1000 مل تخزين العازلة (0.1٪ توين في PBS) و 50 مل حظر العازلة (1٪ BSA في PBS) لكل لوحة.
- غسل لوحات 3 مرات مع العازلة غسل. في هذه الخطوات والخطوات اللاحقة، اضغط على لوحة على المناشف الورقية بعد كل خطوة غسل لإزالة الحل المتبقي.
- إضافة 200 درجة مئوية من حظر العازلة لكل بئر إلى كل من لوحات، أعلى ختم كلا لوحات مع فيلم لاصق وحضانة 2 ساعة في RT.
- إعداد العينات البيولوجية
- تخفيف مستخلصات البروتين المحلية التي تم الحصول عليها في نهاية الخطوة 3 إلى التركيز المناسب باستخدام PBS. التركيز الموصى به سوف تختلف في وظيفة مستوى التعبير KDM1A في العينة البيولوجية. أمثلة على النطاقات المناسبة هي (1) الكريات الخلية: 0.5 - 10 ميكروغرام لكل بئر. (2) مركبات ثنائي الفينيل متعدد البروم: 5 - 30 ميكروغرام لكل بئر. (3) الأنسجة المسحوقة (الدماغ والرئة والجلد): 20 - 100 ميكروغرام لكل بئر. الاحتفاظ بالعينات على الجليد أثناء التحضير. عند الإمكان، قم بتشغيل تحليلات العينات ثلاثية التقنية.
- إعداد منحنى قياسي باستخدام rKDM1A الإنسان:
- لإعداد حل العمل القياسي KDM1A، pipet الحجم المناسب من rKDM1A لتركيز نهائي من 25 pg/μL، إضافة 75 ميكرولتر من 2 μM OG-881، وكاملة مع 1 × PBS إلى حجم إجمالي قدره 6 مل في أنبوب الصقر 15 مل. حافظ على حل العمل القياسي KDM1A على الجليد خلال 1 ساعة واخلط الحل بلطف عن طريق عكس أنبوب الصقر 15 مل عدة مرات كل 20 دقيقة.
- إعداد سلسلة التخفيف القياسية KDM1A في أنابيب الطرد المركزي الصغيرة 1.5 مل وفقا للجدول 1 (إعداد قياسي)، في حجم كاف لتحليل ثلاثة أضعاف اثنين من 96 لوحات microtiter جيدا.
| سلسلة قياسية | [ككم1ا] معياريّة عمل حل ([كدم1ل]) | |
| (pg KDM1A/well) | PBS (μL) | |
| 2500 لC-* | 800 | - |
| 2500 | 800 | - |
| 1750 | 560 | 240 |
| 1250 | 400 | 400 |
| 750 | 240 | 560 |
| 250 | 80 | 720 |
| 25 | 8 | 792 |
| صفر | صفر | 800 |
| ملاحظه: | ||
| (1) حجم أعدت من كل تخفيف يكفي لتشغيل في 3licate 2 لوحات من التصاق. | ||
| (2) النطاق الموصى به هو بين 2.5 و 5000 pg / well | ||
| * للسيطرة السلبية C-، دون KDM1A كشف الأجسام المضادة | ||
الجدول 1: إعداد المعايير. لإعداد السلسلة القياسية من البروتين KDM1A، ماصة الكميات المشار إليها من كدف1A القياسية حل العمل وPBS في ثمانية أنابيب الطرد المركزي الصغيرة 1.5 مل المسمى بشكل صحيح.
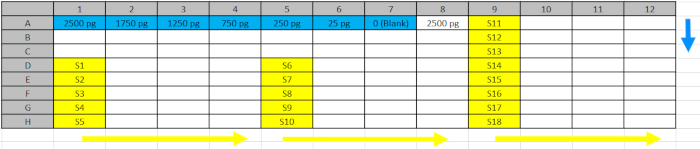
الجدول 2: تصميم لوحة بئر عميق. المعايير (الأزرق) والعينات (الصفراء) من الخطوة 5.4.2. تم الأنابيب في المواقف المنعكسة من لوحة بئر عميقة لتسهيل التحميل في لوحات ELISA بعد اتجاه الأسهم الزرقاء (القياسية) والأصفر (عينات). الرجاء النقر هنا لتحميل هذا الملف.
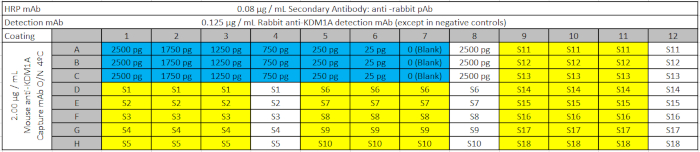
الجدول 3: تصميم لوحة إليسا. وتشمل لوحة الاختبار المنحنى القياسي مع انخفاض كميات من الهدف KDM1A المؤتلف (باللون الأزرق)؛ العينات البيولوجية (S) باللون الأصفر؛ والضوابط السلبية المقابلة (تحتوي على عينات ولكن ليس الأجسام المضادة الكشف الأولية) باللون الأبيض، ليتم تحميلها على لوحات ELISA من لوحة بئر عميق. تحتوي الفارغة (0 في المنحنى القياسي) على كافة كواشف الالتقاط والكشف ولكن لا توجد عينة. الرجاء النقر هنا لتحميل هذا الملف.
- اليسا
- (تابع من الخطوة 5.2.4.) بعد 2 ساعة من الحضانة، تجاهل المخزن المؤقت حظر وغسل لوحات مع العازلة غسل.
- نقل العينات المخففة بشكل مناسب (مستخلصات البروتين المحلية والمنحنى القياسي من الخطوة 5.3.) إلى كتلة تخزين بئر عميقة مبردة 96 بعد توزيع اللوحة المبينة في الجدول 2 (تصميم لوحة بئر عميق).
- الحفاظ على هذه الكتلة على الجليد حتى pipetting 100 عينة ميكرولتر / جيدا في لوحات ELISA المجموع والحرة بعد توزيع لوحة المبينة في الجدول 3 (تصميم لوحة ELISA).
- حضانة لمدة 1 ساعة في RT، وتجاهل العينات وغسل لوحات 5 مرات مع العازلة غسل.
- إعداد 20 مل من الأجسام المضادة للكشف عن الأرانب KDM1A في 0.125 ميكروغرام / مل في حظر العازلة، إضافة 100 درجة مئوية لكل بئر في كل لوحة من التبيّاع، باستثناء في الآبار المقابلة للضوابط السلبية C-. أعلى ختم لوحة وحضانة 1 ساعة في RT.
- تجاهل حل الأجسام المضادة للكشف وغسل لوحات 6 مرات مع العازلة غسل.
- إعداد 25 مل من الماعز الثانوي المضادة للأرنب الأجسام المضادة للأرانب HRP لتخفيف 1:5,000 في حظر العازلة, إضافة 100 € L لكل بئر إلى لوحات microtiter; واحتضان 1 ساعة في RT.
-
الكشف عن اللولومية الكيميائية
- 30 دقيقة قبل نهاية الخطوة 5.4.7. وفي ظل ظروف الإضاءة الناعمة، مزيج أجزاء متساوية من Luminol محسن ومحلول بيروكسيد (10.5 مل: 10.5 مل، ل2 لوحات) في زجاجة العنبر وتركها في RT.
ملاحظة: الحفاظ على حل العمل Luminol في زجاجة العنبر وتجنب التعرض لفترات طويلة إلى أي ضوء مكثف. التعرض على المدى القصير للإضاءة المختبرية النموذجية لن يضر بالحل العملية. - ما لا يقل عن 20 دقيقة قبل قياس الإنارة، والتبديل على قارئ ميكروبليت في 25 درجة مئوية وإعداد التلاوة إلى 1000 مللي ثانية وقت التكامل و 150 مللي ثانية تسوية الوقت. قد تتطلب إعدادات المعلمة التحسين في وظيفة الأداة.
- بعد 1 ساعة من الحضانة في الخطوة 5.4.7.، تجاهل محلول الأجسام المضادة الثانوية وغسل لوحات 6 مرات مع العازلة غسل.
- ماصة 100 ميكرولتر لكل بئر من محلول العمل Luminol (الركيزة Chemiluminescent) أعدت في الخطوة 5.5.1. ماصة ببطء شديد وتجنب تشكيل فقاعة. استخدام جهاز ضبط الوقت للسيطرة على الوقت بين إضافة الحل وقياس الإنارة من لوحات والحفاظ على هذا الوقت ثابت لتحقيق جيدة بين اختبار استنساخ.
- أعلى ختم لوحات والطرد المركزي إلى 500 × ز في RT لمدة 45 ثانية في لوحة الطرد المركزي للقضاء على أي فقاعات المتبقية. احتضان لوحات لمدة 1 دقيقة على لوحة شاكر في 100 دورة في الدقيقة.
- إدراج لوحة داخل القارئ وتركها لمدة 3 دقائق لتثبيت درجة الحرارة في 25 درجة مئوية (دون فيلم لاصق). ابدأ دائمًا بطبق ELISA المجاني.
- قراءة وحدات الإنارة النسبية (RLU) من كل فحص لوحة ELISA (مجانا وإجمالي KDM1A).
- حفظ ونسخ قيم RLU الخام من ملفات Excel "البيانات الخام" لمزيد من التحليل للنتائج.
- 30 دقيقة قبل نهاية الخطوة 5.4.7. وفي ظل ظروف الإضاءة الناعمة، مزيج أجزاء متساوية من Luminol محسن ومحلول بيروكسيد (10.5 مل: 10.5 مل، ل2 لوحات) في زجاجة العنبر وتركها في RT.
6 - حساب المشاركة المستهدفة
- في برنامج جدول بيانات، حساب RLU الحرة وRLU القيم الإجمالية للعينات SX والعينات المرجعية REF (غير المعالجة، مركبة أو عينة ما قبل الجرعة) من البيانات الخام المكررة التقنية على النحو المفصل أدناه:
- أدخل البيانات الفردية RAW RLUi Total وRAW RLUi Free من الفراغات والمنحنى القياسي والضوابط السلبية C- والعينات البيولوجية (SX وREF) في ورقة بيانات التحليل (على سبيل المثال، Excel). أيضا، أدخل المبالغ (بالغرام) من KDM1A من المنحنى القياسي في ورقة البيانات.
- حساب RLU متوسط الخام، الانحرافات المعيارية،ومعامل التباين السيرة الذاتيةRLU من إجمالي الخام الفردية وبيانات RLUi الحرة الخام لكل نقطة بيانات تكرار التقنية.
- تطبيق القضاء خارج (على سبيل المثال لtriplicates): لكل فرد الخام RLU المجموع والخام RLU نقطة البيانات الحرة RLUi من نقطة بيانات ثلاثية التقنية، وتطبيق معايير Grubbs عندما السيرة الذاتية للثلاثية > 0.15، ورفض واحد المشتبه به قيمة RLU الخام عندما
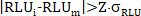 ,
,
[وهربي] [ز] = 1.148 ل [ن] = 3 و90% ثقة فاصلة ([س]). - إذا تم تطبيق القضاء خارج، إعادة حساب RLU متوسط Raw، الانحراف المعياري وRLU السيرة الذاتية من القيم غير المرفوضة (nr) RLUi الخام وRAW RLUi Free لكل نقطة بيانات.
- تطبيق تصحيح الخلفية: حساب متوسط RLU الحرة وRLU القيم الإجمالية لكل نموذج قياسي، وكل عينة SX ونموذج المرجع المرجعي كما يلي:


- تمثل البيانات بيانياً كما يلي:
- رسم القيمالإجمالية لـ RLUFree وRLU (محور Y) نسبة إلى تعريف العينة (المحور س) في رسم بياني شريطي.
- أيضا رسم قيم RLU (Y-محور) من المعايير في مؤامرة مبعثر ة نسبة إلى كمية من pg من البروتين rKDM1A (X-محور) للقياسات الحرة والإجمالية، فضلا عن خطوط الاتجاه الخطية المقابلة وحساب ص2 (مربع الخطية معامل الارتباط) القيم.
- حساب المشاركة المستهدفة (TE)؛ أي النسبة المئوية لـ KDM1A المقيدة بمثبط KDM1A في كل عينة SX بالنسبة إلى عينة مرجعية REF (عينة غير المعالجة أو مركبة أو عينة ما قبل الجرعة) على النحو التالي:
- حساب نسبة R من متوسط RLU الحرة إلى القيم الإجمالية لعينات SX وREF كما يلي:

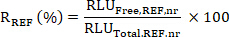
- ثم حساب المشاركة الهدف (TE) من نموذج SX كما يلي:
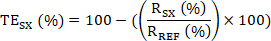
اختياري: (1) إذا أجريت تجارب تكرار بيولوجية N، كل مع تكرار التقنية ن؛ أولاً حسابSX TE لمجموعات النسخ المتماثل التقنية. في وقت لاحق، حساب متوسط TE، SD وقيم السيرة الذاتية لمجموعة النسخ المتماثل البيولوجية.
- حساب نسبة R من متوسط RLU الحرة إلى القيم الإجمالية لعينات SX وREF كما يلي:
- مراجعة ما إذا كانت معايير قبول التقييم قد استوفيت: تحقق من أن (1) خلفية التقييم مقبولة ومتوسط فارغ < 0.05 x 107 RLU; (2) عينة الإنارة التلقائي ة غائبة وRLUs من الضوابط السلبية C- هي أقل من الحد الأدنى من القياس الكمي (LLOQ = متوسط فارغ + 10X SD)؛ (3) منحنى معيار rKDM1A هو خطي وr2 ≥ 0.98؛ (4) للعينات البيولوجية قيم RLU التي تقع في النطاق الديناميكي والخطي للفحص أي بين LLOQ و 2500 pg/well.
ملاحظة: الخطوات 6-1. إلى 6.4. يمكن أن تكون آلية بسهولة في ورقة بيانات حساب التفاضل والتكامل. - تصدير بيانات TE إلى مصدر مفتوح أو برنامج إحصائي يتم الحصول عليه تجاريًا من اختيار التمثيل الرسومي لقيم TE والتقييمات الإحصائية الإضافية.
Access restricted. Please log in or start a trial to view this content.
النتائج
خطية التحديد الكلي والحر KDM1A.
تم إعداد سلسلة قياسية كما هو موضح في الخطوة 5.3.2.، وذلك باستخدام 0 إلى 2500 pg من إنزيم KDM1A المؤتلف البشري كامل الطول. تم تقييم قيم RLU من المجموع وRKDM1A الحرة للتحقق من الخطية (الشكل2A و 2B).
Access restricted. Please log in or start a trial to view this content.
Discussion
تم تطوير البروتوكول المعروض هنا لقياس المشاركة المستهدفة KDM1A مباشرة باستخدام رواية القبض على المسبار الكيميائي KDM1A مقرها ELISA. وقد تم التحقق من صحة هذه الطريقة على خطوط الخلايا البشرية المستزرعة وعينات الجسم الحي السابق من الإنسان والفئران والفأر والبابون (بما في ذلك PBMCs والرئة والدماغ وال...
Access restricted. Please log in or start a trial to view this content.
Disclosures
المؤلف تمارا مايس هو المدير التنفيذي والمساهم، والمؤلفين كريستينا Mascaró وراكيل رويز رودريغيز هي موظفة في Oryzon Genomics S.A. Oryzon Genomics S.A. تطور مثبطات KDM1A ويحمل براءات الاختراع التي تغطي المركبات والأساليب المستخدمة في هذه المادة.
Acknowledgements
تم تمويل هذه الدراسة من قبل أورزون جينوميكس. S.A., هوفمان لاروش, وبدعم جزئي من CIIP-20152001 وRETOS برنامج التعاون RTC-2015-3332-1.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0,05% Trypsin-EDTA (1X) | Thermo Scientific | #25300-062 | |
| 10 X Protease Inhibitor Tablets | Roche | #11836153001 | |
| 96 deep well storage block | VWR | #734-1679 | |
| 96 well ELISA plates | Nunc | #436110 | |
| Adhesive black Film | Perkin Elmer | #6050173 | |
| Adhesive transparent Film | VWR | #60941-062 | |
| Biotinylated KDM1A probe OG-881 | Oryzon Genomics S.A. | NA | |
| Bovine Serum Albumin | Sigma | # 3117057001 | |
| Bovine Serum Albumin Standard | Thermo Scientific | #23208) | |
| Bradford Protein Assay | BioRad | #500-0001 | |
| Cell lysis buffer 10X | Cell Signaling | #9803 | |
| Centrifuge for 96- well plates | Hettich | Rotina 420R | |
| Flask | Thermo Scientific | #156499 | |
| Full length, enzymatically active human Recombinant LSD1 / KDM1A | Active Motif | #31426 | |
| Graphpad Prism 5 Project | GraphPad Software | NA | |
| Luminol-Enhacer and Peroxide Solution (Chemiluminescent Substrate) | Thermo Scientific | #37074 | |
| Micro Centrifuge | Eppendorf | 5415 R | |
| Microplate reader Infinite 200-Tecan | Tecan | Infinite 200 | |
| Mouse monoclonal capture antibody Anti-KDM1A (N-terminal epitope) | Abcam | #ab53269 | |
| Needle G18 gauge blunt | BD | #303129 | |
| ORY-1001 (iadademstat) | Oryzon Genomics S.A. | NA | |
| PBMC separation tubes 10 ml | Greiner bio-one | #163288 | |
| PBMC separation tubes 50 ml | Greiner bio-one | #227288 | |
| PBS 1x | Sigma | #D8537 | |
| Plate shaker | Heidolph Instruments | Rotamax 120 | |
| Polysorbate 20 | Sigma | #P7949 | |
| Rabbit monoclonal detection antibody Anti-KDM1A (C-terminal epitope) | Cell Signaling | #672184BF-100 | |
| Secondary antibody Peroxidase-conjugated Donkey Anti-rabbit IgG | Thermo Scientific | #31458 | |
| Spectrophotometer cuvette 1.5 | Deltalab | #302100 | |
| Spectrophotometer for cuvette | GE Healthcare | GeneQuant 1300 | |
| Streptavidin | Promega | #Z704A | |
| Syringe | BD | #303172 | |
| Type 1 ultrapure water | Millipore | Milli-Q Advantage A10 | |
| Ultrasonic cleaner | VWR | USC200T |
References
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119 (7), 941-953 (2004).
- Maiques-Diaz, A., Somervaille, T. C. LSD1: biologic roles and therapeutic targeting. Epigenomics. 8 (8), 1103-1116 (2016).
- Maes, T. ORY-1001, a Potent and Selective Covalent KDM1A Inhibitor, for the Treatment of Acute Leukemia. Cancer Cell. 33 (3), 495-511 (2018).
- Sugino, N. A novel LSD1 inhibitor NCD38 ameliorates MDS-related leukemia with complex karyotype by attenuating leukemia programs via activating super-enhancers. Leukemia. 31 (11), 2303-2314 (2017).
- Kleppe, M., Shank, K., Efthymia, P., Riehnhoff, H., Levine, R. L. Lysine-Specific Histone Demethylase, LSD1, (KDM1A) As a Novel Therapeutic Target in Myeloproliferative Neoplasms. Blood. 126, 601(2015).
- Jutzi, J. S., et al. LSD1 Inhibition Prolongs Survival in Mouse Models of MPN by Selectively Targeting the Disease Clone. HemaSphere. 2 (3), 54(2018).
- Mohammad, H. P. DNA Hypomethylation Signature Predicts Antitumor Activity of LSD1 Inhibitors in SCLC. Cancer Cell. 28 (1), 57-69 (2015).
- Rivers, A., et al. RN-1, a potent and selective lysine-specific demethylase 1 inhibitor, increases γ-globin expression, F reticulocytes, and F cells in a sickle cell disease mouse model. Experimental Hematology. 43 (7), 546-553 (2015).
- Rivers, A. Oral administration of the LSD1 inhibitor ORY-3001 increases fetal hemoglobin in sickle cell mice and baboons. Experimental Hematology. 67, 60-64 (2018).
- Buesa, C., et al. The dual LSD1/MAO-B inhibitor ORY-2001 prevents the development of the memory deficit in samp8 mice through induction of neuronal plasticity and reduction of neuroinflammation. Alzheimer’s & Dementia. 11 (7), P905(2015).
- Schmidt, D. M., McCafferty, D. G. Trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1. Biochemistry. 46 (14), 4408-4416 (2007).
- Forneris, F., Binda, C., Vanoni, M. A., Battaglioli, E., Mattevi, A. Human histone demethylase LSD1 reads the histone code. Journal of Biological Chemistry. 280 (50), 41360-41365 (2005).
- Oryzon Genomics, Methods to determine kdm1a target engagement and chemoprobes useful therefor. , WO2017158136 (2016).
- Mascaró, C., Ortega, A., Carceller, E., Rruiz Rodriguez, R., Cicero, F., Lunardi, S., Yu, L., Hilbert, M., Maes, T. Chemoprobe-based assays of histone lysine demethylase 1A target occupation enable in vivo pharmacokinetics and -dynamics studies of KDM1A inhibitors. Journal of Biological Chemistry. , In Press (2019).
- Rodriguez-Suarez, R. Development of Homogeneous Nonradioactive Methyltransferase and Demethylase Assays Targeting Histone H3 Lysine 4. Journal of Biomolecular Screening. 17 (1), 49-58 (2011).
- Lynch, J. T., Cockerill, M. J., Hitchin, J. R., Wiseman, D. H., Somervaille, T. C. CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1. Analytical Biochemistry. 442 (1), 104-106 (2013).
- Schulz-Fincke, J. Structure-activity studies on N-Substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation. European Journal of Medicinal Chemistry. 144, 52-67 (2018).
- Ishii, T., et al. CETSA quantitatively verifies in vivo target engagement of novel RIPK1 inhibitors in various biospecimens. Scientific Report. 7, 13000(2017).
- Maes, T. ORY-2001: An Epigenetic drug for the treatment of cognition defects in Alzheimer’s disease and other neurodegenerative disorders. Alzheimer’s & Dementia. 12 (7), P1192(2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved