Method Article
الدراسات المستهدفة باستخدام الوجه كتلة المسلسل ومركزة أيون شعاع المسح المجهري الإلكترون
In This Article
Summary
هنا، نقدم بروتوكول اجمع بكفاءة بين وجه كتلة تسلسلية ومركزة شعاع الأيون المسح المجهري الإلكترون لاستهداف منطقة ذات أهمية. يسمح هذا للبحث الفعال، في ثلاثة أبعاد، وتحديد موقع الأحداث النادرة في مجال عرض كبير.
Abstract
يسمح هذا البروتوكول بالتصوير الفعال والفعال لعينات الخلايا أو الأنسجة في ثلاثة أبعاد على مستوى القرار من الفحص المجهري الإلكتروني. لسنوات عديدة ظلت المجهر الإلكتروني (EM) تقنية ثنائية الأبعاد بطبيعتها. مع ظهور تقنيات التصوير بالمجهر الإلكتروني المسح التسلسلي (حجم EM)، باستخدام إما ميكروتومي متكامل أو شعاع أيون مركز لشريحة ثم عرض الأنسجة المضمنة، يصبح البعد الثالث يمكن الوصول إليها بسهولة. يستخدم الفحص المجهري للإلكترون (SBF-SEM) المسح المجهري للوجه من البلوك التسلسلي ميكروميكروتومي مغلق ًا في غرفة SEM. لديها القدرة على التعامل مع عينات كبيرة (1000 ميكرومتر × 1000 درجة مئوية) وحقول كبيرة للصورة في حجم صغير X، Y بكسل، ولكن محدودة في البعد Z بواسطة سكين الماس. لا يقتصر التركيز على شعاع أيون SEM (FIB-SEM) في القرار 3D، (voxels متساوي المدار من ≤ 5 نانومتر قابلة للتحقيق)، ولكن مجال الرؤية هو أكثر محدودية بكثير. يوضح هذا البروتوكول سير عمل للجمع بين التقنيتين للسماح بالعثور على مناطق فردية ذات أهمية (ROIs) في حقل كبير ثم تصوير المجلد المستهدف اللاحق بدقة فوكسل عالية النظائر. إعداد الخلايا الثابتة أو الأنسجة هو أكثر تطلبا لتقنيات EM حجم بسبب المتناقضة اضافية اللازمة لتوليد إشارة فعالة في التصوير SEM. وتستغرق هذه البروتوكولات وقتا طويلا وكثيفة العمالة. ويتضمن هذا البروتوكول أيضا معالجة الأنسجة بمساعدة الموجات الدقيقة التي تيسر اختراق الكواشف، مما يقلل من الوقت اللازم لبروتوكول المعالجة من أيام إلى ساعات.
Introduction
يصف هذا البروتوكول سير عمل للاستهداف الفعال للميكروسكوب الإلكتروني ثلاثي الأبعاد عالي الدقة (EM) إلى منطقة معينة ذات أهمية (ROI). منذ بداياتها في الثلاثينات من القرن الماضي، كانت EM تقنية ثنائية الأبعاد في الأساس. كانت الصور المنشورة الأولى من أنسجة أو خلايا كاملة ولكن سرعان ما أفسحت المجال للأقسام التي تم قطعها باليد باستخدام ultramicrotome وصورة باستخدام المجهر الإلكتروني الإرسال (TEM). TEM تنتج ميكروغرافات عالية الدقة جدا حيث حتى أصغر من الهياكل الخلوية يمكن تمييزها بوضوح. ومع ذلك، فإن نحافة القسم اللازم لتصوير الأنسجة بواسطة شعاع الإلكترون جعلت المعلومات في البعد Z الحد الأدنى. وبما أن الخلايا هي هياكل ثلاثية الأبعاد، كان لا بد من الاستدلال على التفاعلات بين هياكل الخلايا وأسطح الخلايا من بيانات محدودة. وقد أثار ذلك احتمال سوء التفسير، لا سيما في الهياكل المعقدة. تمكن بعض microscopists للحصول على هياكل أكثر دقة 3D عن طريق الخلايا التسلسلية والأنسجة ومن ثم إعادة بنائها بشق الأنفس من الصور TEM الفردية1. وكانت هذه عملية كثيفة العمالة جدا وقبل ظهور التصوير الرقمي والكمبيوتر تقديم النتائج كان من الصعب أيضا تصور. في السنوات الأخيرة تم إدخال تقنيتين أصبحتا تعرفان بشكل جماعي باسم مجهري الإلكترون الحجم (حجم EM)2 التي جعلت EM في ثلاثة أبعاد في متناول المزيد من المختبرات.
فكرة الحصول على كومة من الصور من كتلة جزءا لا يتجزأ من داخل المجهر الإلكتروني يمكن إرجاعها إلى عام 1981 عندما ستيف ليتون وألان Kuzirian بنيت ميكروتومي مصغرة ووضعها في غرفة المجهر الإلكتروني المسح3 (SBF-SEM) . تم نسخ هذا النموذج الأولي في نهاية المطاف وتحسينه بعد 23 عاما من قبل دينك وهورستمان4 وتسويقها في وقت لاحق. في نفس الوقت تقريبا أصبح العلماء البيولوجيون على بينة من تكنولوجيا أخرى تستخدم في المقام الأول في علوم المواد، وشعاع أيون مركزة. تستخدم هذه التقنية شعاع أيون من نوع ما (الغاليوم، البلازما) لإزالة كمية صغيرة جدا من المواد السطحية من عينة (FIB-SEM)5. كلا الأسلوبين تستخدم المقاطع تليها التصوير توفير سلسلة من الصور التي يمكن دمجها في X، Y، Z، كومة. توفر كلتا التقنيات معلومات ثلاثية الدقة ولكن بمقاييس دقة مختلفة. SBF-SEM محدودة بالخصائص الفيزيائية للسكين الماس إلى شرائح لا أرق من 50 نانومتر لأشواط التصوير التسلسلي الطويل; ومع ذلك فإن حجم كتلة العينة التي يمكن تقسيمها كبير، ويصل إلى 1 مم × 1 مم × 1 مم. ، يمكن أن تكون أحجام بكسل الصورة صغيرة مثل 1 نانومتر. وهذا يؤدي إلى voxels غير متساوي المدار حيث البعد X,Y غالباً ما يكون أصغر من Z. بسبب دقة شعاع أيون، FIB-SEM لديه القدرة على جمع الصور مع voxels متساوي المدار ≤ 5 نانومتر. ومع ذلك، فإن المساحة الإجمالية التي يمكن تصويرها صغيرة جداً. وقد تم نشر جدول موجز لمختلف العينات والمجلدات المصورة مع التقنيات اثنين سابقا3.
إعداد الأنسجة لحجم EM هو أكثر صعوبة من TEM القياسية أو SEM لأن العينات يجب أن تكون ملطخة لتوفير توليد إشارة كافية في SEM. في كثير من الأحيان، البقع تحتاج إلى تحسين ليس فقط لنوع الأنسجة معينة ولكن أيضا لإضافة على النقيض من بعض الهياكل الخلوية لجعل تحديد وإعادة الإعمار أسهل. ويستند البروتوكول المستخدم هنا على معيار NCMIR6. تلطيخ إضافية عادة ما يعني خطوات بروتوكول إضافية. وبالتالي بالنسبة لحجم EM، يلزم تمديد البروتوكولات القياسية لضمان الوقت الكافي للكواشف لاختراق العينة. يمكن للمعالجة بمساعدة الميكروويف تقليل الوقت اللازم للتلطيخ من ساعاتإلى دقائق ويجعل حجم EM إعداد عينة أكثر كفاءة 7. هذه الطريقة تنطبق على جميع أنواع الخلايا والأنسجة8 وعلى أسئلة البحث حيث عدم تجانس الأنسجة يجعل أخذ العينات من منطقة محددة ضرورية9.
بمجرد الحصول على مكدس بيانات يمكن محاذاته وتجزئة بنيات الاهتمام من بقية البيانات ونمذجتها في 3D. على الرغم من أن أتمتة التصوير العديد من شرائح الأنسجة جعلت الحصول على صورة مباشرة نسبيا، فإن عملية إعادة بناء البيانات وتصورها رقميا ً مهمة تستغرق وقتاً طويلاً. ولم تُدمج بعد البرمجيات لهذا الغرض ولا تكون آلية بالكامل. منذ الكثير من العمل في وقت مبكر باستخدام حجم EM كان موجها نحو علم الأعصاب، وتقنيات تلطيخ والرقمية هياكل التجزئة مثل المحاور متقدمة إلى حد ما بالمقارنة مع الخلايا الأخرى والعضيات. في حين أن الأدب على الأنسجة الأخرى غير العصبية ينمو بسرعة, هياكل غير خطية أو غير منتظمة تتطلب المزيد من المدخلات اليدوية.
استخدام كل من SBF-SEM و FIB-SEM هو نهج مفيد لاستهداف وتصوير هياكل الأنسجة محددة وغير متجانسة في دقة عالية في 3D. الجمع بين ذلك مع معالجة الأنسجة بالموجات الدقيقة بمساعدة أن يقلل إلى حد كبير من الوقت اللازم لإعداد العينة. معا هذا سير العمل سيجعل توليد عالية الدقة isotropic voxel مجموعات البيانات صورة من الهياكل الدقيقة عملية فعالة وأكثر سرعة.
Protocol
1. تثبيت العينة ومعالجة لميكروسكوب الإلكترون
- إصلاح شتلات التلايا العربي الذي يزرع على لوحات أجار في 0.5٪ بارافورمالدهايد، 2.5٪ الجلوتالدهايد في 0.1 م الفوسفات العازلة (PB) درجة الحموضة 6.8 لمدة 2 ساعة في درجة حرارة الغرفة (RT).
تحذير: الألدهيدات هي المهيجات وتآكل ولها إمكانات مسرطنة، مطفرة ومسخية. يجب التعامل مع جميع الحلول مع معدات الحماية المناسبة وفي غطاء محرك الدخان. - قطع نصائح الجذر من النبات نمت في الخطوة 1.1 ووضع 2-3 نصائح في أنابيب 0.5 مل تحتوي على نفس المثبت بين عشية وضحاها في 4 درجة مئوية.
ملاحظة: يتم تحديد حجم هذا وأية حلول في الخطوات المتبقية بواسطة وحدة تخزين العينة; الحد الأدنى لنسبة العينة إلى الحل هو 10:1. عينات أكبر من 1 ملم في أي بعد سيكون من الصعب وصمة عار، لذلك العمل مع كتل الأنسجة أكبر هو أكثر صعوبة. ليس كل الأنسجة لها نفس الخصائص; على سبيل المثال، أوراق النبات وينبع يمكن أن يكون من الصعب وصمة عار. إذا كانت العينات الأكبر أو أنواع الأنسجة الصعبة مرغوبة، يجب إجراء تحسين معالجة العينات قبل الانتقال إلى جمع البيانات. - إعداد حل ثيوكاربوهيدرازيد (TCH)، اللازمة الطازجة والمتاحة قبل الخطوة 1.7. إضافة 0.1 غرام من ثيوكاربوهيدرازيد إلى 10 مل من الماء المقطر المزدوج (ddH2O) وتذوب عن طريق التدفئة إلى 60 درجة مئوية في الفرن لمدة 1 ساعة. قبل الاستخدام، قم بتصفية حل TCH باستخدام فلتر حقنة 0.22 م.
- إزالة المثبت من الأنابيب واستبدالها ب0.1 M PB p h 6.8. وضع الأنابيب على طاولة الهز المداري في 100 دورة في الدقيقة وغسل لمدة 10 دقيقة.
- آخر إصلاح نصائح الجذر عن طريق استبدال PB مع 2٪أوستروكسيد أوزميوم (OsO 4) و 0.2٪ الروثينيوم الأحمر في 0.1 M PB الحموضة 6.8. وضع الأنابيب في الميكروويف مع الأغطية مفتوحة وبدءالبرنامج 9 (الجدول 1).
تحذير: الأوساميوم خطر للغاية في حالة الابتلاع، وخطر جداً في حالة الاستنشاق، وخطر في حالة ملامسة الجلد. التعامل دائما باستخدام معدات الحماية المناسبة وفي غطاء محرك السيارة الدخان.
ملاحظة: في جميع أنحاء البروتوكول، يتم فتح أغطية الأنابيب دائمًا أثناء خطوات الميكروويف. - اغسل أطراف الجذر مرتين مع ddH2O لمدة 5 دقائق لكل منهما على سطح المقعد. لبرنامج استخدام الغسيل الثالث والرابع DdH2O 15 على الميكروويف (الجدول1). بعد أول 40 ثانية ddH2O غسل، واتخاذ عينات من الميكروويف واستبدال العازلة مع ddH2O. الطازجة وضع العينات مرة أخرى في الميكروويف ومواصلة البرنامج.
ملاحظة: سيقوم الميكروويف بتنبيه عندما يحتاج المخزن المؤقت إلى تحديث. تأكد من استبدال غطاء للغرفة فراغ بشكل صحيح في كل مرة. - احتضان عينات في حل TCH أعدت سابقا في RT لمدة 2 دقيقة على مقاعدالبدلاء ولمزيد من الحضانة استخدام برنامج الميكروويف 8 (الجدول 1). لا تغير الحل بين مقاعد البدلاء والميكروويف.
- غسل العينات كما هو موضح في الخطوة 1.6.
- وضع عينات في 1٪ OsO4 في ddH2O لبرنامج الميكروويف 9 (الجدول1).
- غسل العينات كما هو موضح في الخطوة 1.6.
- احتضان عينات في 1٪ خلات أورانيل في ddH2O باستخدام برنامج الميكروويف 16 (الجدول1).
تحذير: خلات أورانيل سامة، مهيجة ولها إمكانات مسرطنة ومطفرة ومسخية. التعامل دائما باستخدام معدات الحماية المناسبة. - غسل العينات كما هو موضح في الخطوة 1.6.
- إعداد الحل الرئيسي والتون للاستخدام في الخطوة 1.14. أولا جعل حل الأسهم من حمض الأسبارتاك L عن طريق إضافة 0.998 غرام من حمض الأسبارتاك L إلى 250 مل من DdH2O وضبط درجة الحموضة إلى 3.8 مع 1 م كوه. بعد ذلك، حل 0.066 غرام من نترات الرصاص في 10 مل من محلول مخزون حمض الاسبارتيك وعدل درجة الحموضة إلى 5.5. يترك الحل في الفرن عند 60 درجة مئوية لمدة 30 دقيقة.
ملاحظة: لا يجب أن تشكل أي يعجل. - احتضان عينات في حل الرصاص والتون لمدة 30 دقيقة في الفرن في 60 درجة مئوية.
- غسل العينات كما هو موضح في الخطوة 1.6.
- عينات الجفاف في EtOH في خطوات متدرجة من 50٪، 70٪، 90٪ في ddH2O، ثم 2X في 100٪ EtOH. استخدام برنامج الميكروويف10 (الجدول 1) والميكروويف سوف يطالب المستخدمين كل 40 ق لاستبدال الحل مع الخطوة EtOH التالية. هذه هي الخطوة الأخيرة التي تم القيام بها في الميكروويف.
- مزيد من الجفاف في 100٪ أكسيد البروبيلين 2X لمدة 10 دقيقة لكل منهما في RT على مقاعد البدلاء، واستبدال الحل بين الخطوات.
ملاحظة: أكسيد البروبيلين يمكن أن يذوب بعض البلاستيك مثل البوليسترين. إما استخدام قارورة زجاجية لهذه الخطوة أو البلاستيك قبل الاختبار للمقاومة.
تحذير: أكسيد البروبيلين قابل للاشتعال للغاية. التعامل دائما باستخدام معدات الحماية المناسبة وفي غطاء محرك السيارة الدخان. - بدء التسلل من نصائح الجذر عن طريق احتضان في الراتنج 50٪ تحفيز في أكسيد البروبيلين (دقيقة 2 ساعة).
تحذير: مكونات الراتنج تحفيز هي المهيجات. التعامل دائما باستخدام معدات الحماية المناسبة وفي غطاء محرك السيارة الدخان. - استبدال الحل مع 100٪ تحفيز ومغادرة بين عشية وضحاها في RT.
- تغيير إلى الراتنج الطازجة 100٪ تحفيز 2 مرات (دقيقة 2 ح الحضانة).
- ضع العينات في قالب التضمين، الذي يحتوي مرة أخرى على راتنج 100% طازج وبلمرة في فرن عند 65 درجة مئوية لمدة 36-48 ساعة.
ملاحظة: يعتمد قالب التضمين المستخدم على نوع الأنسجة والنهج المستخدم في التصوير. هنا، تم استخدام قالب السيليكون المسطحة التضمين (الشكل1A).
2. إعداد عينات جزءا لا يتجزأ من التصوير
- إزالة عينات من الفرن، وإزالة الراتنج من القالب تضمين (الشكل1B).
- باستخدام شفرة الحلاقة، قم بتقليم العينة تقريبًا إلى كتلة تصل إلى 0.5 مم × 0.5 مم × 0.5 مم (الشكل1C).
ملاحظة: لمنع الشحن في SBF-SEM، من المهم تقليم بعيدا أكبر قدر ممكن من الراتنج العارية وجعل العينة مسطحة / رقيقة قدر الإمكان. من الناحية المثالية جميع جوانب الكتلة تحتوي على الأنسجة بالفعل، ولكن الأهم من ذلك الجانب الذي سيتم إرفاقه إلى دبوس معدني (انظر الخطوة 2.3) يجب أن تحتوي على الأنسجة المكشوفة بحيث الأنسجة على اتصال مباشر مع المعدن موصل. - إزالة العينة من الراتنج الدخيل وإرفاقه إلى دبوس معدني (الشكل1D)مع الراتنج الايبوكسي موصل، والتأكد من أن جزءا من الأنسجة هو لمس دبوس معدني. اسمحوا علاج الايبوكسي بين عشية وضحاها في الفرن في 65 درجة مئوية.
ملاحظة: تأكد من وضع العينة في وسط الدبوس لأن حركة المرحلة في SB-SEM محدودة. إزالة عينة راتنج صغيرة جدا مغلفة من الراتنج اضافية يمكن أن يكون من الصعب كما عينة صغيرة سيكون لها ميل إلى الطيران بعيدا عندما منفصلة. حل بسيط وفعال لهذا هو لتغطية العينة مع ورقة من فيلم البارافين كما هو مبين في الفيلم التكميلي للمرجع1. - ربط الناقل في حامل لultramicrotome. استخدام شفرة الحلاقة لإزالة أي الايبوكسي الزائد واستخدام ultramicrotome وسكين الماس لتنعيم الوجه والجانبين من كتلة، وتشكيل الهرم. تأكد من أن بعض الأنسجة على الأقل تتعرض بالفعل على وجه كتلة.
ملاحظة: الخطوة الإضافية لاستخدام سكين الماس اختيارية ولكنها تجعل كتلة الناتجة أسهل للاقتراب في SBF-SEM لأن ظل السكين على وجه كتلة أكثر وضوحا مما يجعل تقدير المسافة بين سكين وكتلة الوجه أسهل لتحديد. - ضع كتلة العينة المشذبة في المكتاب وغطي العينة بطبقة رقيقة (2−5 نانومتر) من البلاتين (Pt).
ملاحظة: سيتم قطع البلاتين على وجه كتلة بعيدا خلال النهج في SBF-SEM (انظر أدناه)، ولكن البلاتين على جانبي الهرم سوف توفر الموصلية إضافية. في هذا المثال، كانت العينة مغلفة بالبلاتين، ولكن الذهب، أو الذهب / البلاديوم هو أيضا فعالة. ومع ذلك، أدى طلاء مع الذهب في زيادة الحطام على كتلة الوجه أثناء تشغيل التصوير.
3. التصوير في SBF-SEM
- إدراج الناقل في المجهر SBF-SEM وجلب السكين على مقربة من سطح العينة. باستخدام سكين الماس تقليم قبالة الجزء العلوي من العينة بحيث تم بالفعل إزالة طبقة Pt ويتعرض على الأقل جزء من الأنسجة.
ملاحظة: بما أن هذه العملية مختلفة لكل مجهر SBF-SEM، يتم تحديد كل خطوة هنا. طالما أن سطح العينة خال ٍ من Pt وجاهز للتصوير، فإن الخطوات التالية ستكون ممكنة. - بدء التصوير في دقة منخفضة وأوقات قصيرة يسكن للحصول على نظرة عامة على العينة وتحديد موقع منطقة ذات أهمية (الشكل1E).
ملاحظة: هنا، تم استخدام 512 × 512 بكسل و1 ميكروس وقت للمسح السريع وتحديد المواقع من المرحلة و 2000 × 2000 بكسل مع 1 μs وقت التسوية تم استخدامها لتحسين نافذة التصوير وضبط التركيز. - باستخدام جهد متسارع من 1.5-2.0 كيلوفولت في تيار 80-100 pA، التقاط صورة للأنسجة.
ملاحظة: تم تصوير المثال الموضح هنا على نظام فراغ عالي حيث يحتاج تيار الحزمة إلى ضبط لتقليل الشحن، وهو يعتمد على العينة. عادةً، يتم تعيين شعاع الإلكترون إلى 1.5−2.0 كيلوفولت ولكن هذا سيكون يعتمد على العينة. في التكبير اتّصال أعلى (عادة > 10,000x) يتأثر الراتنج كثيراً بالشعاع لضمان التصاق سلس، لذلك عادة ما يتم تعيين حجم البكسل إلى 8−20 نانومتر بحجم صورة 8,000-10,000 × 8,000−10,000 بكسل مع تكبيرات مقابلة تبلغ 430 – 1400x وأحجام الحقول من 64 × 64 ملم و 200 × 200 مم على التوالي. - تحديد منطقة ذات أهمية وتحديد عدد الأقسام اللازمة لتغطية حجم الاهتمام وبدء تشغيل التصوير، وذلك باستخدام كاشف الإلكترون المتناثر مرة أخرى.
ملاحظة: في المثال المعروض هنا، تم تصوير 500 قسم من 80 نانومتر في 10 نانومتر بكسل و 10000 × 10000 صورة بكسل (يسكن الوقت 1 μs). تم تعيين المجهر إلى 1.6 كيلوفولت و 100 pA. بشكل عام، يعتمد عدد الأقسام على عينة وحجم عائد الاستثمار ويمكن أن يختلف من 100 s إلى 1000 s من الأقسام المتتالية. تتكون مجموعة البيانات الناتجة من صور مفردة لكل مقطع. يجب تحويل هذه الصور إلى مكدس ثلاثي الأبعاد.
4. SBF-SEM معالجة البيانات
- باستخدام Fiji، حدد تسلسل صورة استيراد الملفات وحدد موقع مكدس الصور لتحميل الصور. اعتماداً على حجم مجموعة البيانات، تحقق من المربع 'استخدام المكدس الظاهري'.
ملاحظة: إذا كانت مجموعة البيانات كبيرة حقاً أولاً تحويله إلى 8 بت (إذا تم تجميعها في 16 بت) وإذا لزم الأمر بن البيانات حتى يكون حجم قابل للتطبيق. - باستخدام زر التشغيل في أسفل الصورة قم بالتمرير خلال مجموعة البيانات لمعرفة ما إذا كان تشغيل التصوير ناجحاً. تحقق من القطع الأثرية التصوير نموذجية لSBF-SEM، مثل أقسام تسقط من السكين على كتلة الوجه، وشحن في مناطق الراتنج العارية، وقطع القطع الأثرية من السكين (خطوط أفقية على الصورة).
- يقوم استخدام خصائص صورة الأمر بضبط حجم البكسل وعمق voxel (أي سمك المقطع) المستخدم أثناء التشغيل. إذا كانت البيانات معلبة بالفعل، خذ هذا في الاعتبار.
- باستخدام الإضافات الأوامر تسجيل الخطي محاذاة المكدس مع SIFT لتسجيل البيانات.
ملاحظة: هناك حاجة إلى تسجيل بيانات SBF-SEM لأنه قد يكون هناك حركة عينة طفيفة أثناء التصوير بسبب شحن أو الانجراف من العينة. وبما أن هذه ليست سوى حركة الحد الأدنى في XY، هناك حاجة فقط إلى الترجمة. - تحقق من المحاذاة عن طريق التمرير خلال مجموعة البيانات وإذا موافق استخدام الأمر حفظ ضمن قائمة الملفات لحفظ مجموعة البيانات محاذاة كملف 3D-tif.
- قم بتحليل مجموعة البيانات بعناية لمعرفة ما إذا كان عائد الاستثمار مضمنًا ويحتوي على المعلومات المطلوبة للسؤال البيولوجي. في الصورة الأخيرة للمكدس (= وجه الكتلة الحالي)، حدد عائد استثمار جديد لتصوير FIB-SEM.
ملاحظة: إذا لم يكن هناك منطقة جيدة لتصوير FIB-SEM موجودة على وجه كتلة الحالي، يمكن قطع المزيد من المقاطع من الكتلة (التي لا تزال في SBF-SEM) حتى يظهر عائد استثمار. هناك حد لوحدة التخزين التي يمكن تصويرها مع FIB. يمكن أن يكون عائد الاستثمار على صورة SBF-SEM الحد الأقصى في X،Y من 30-40 درجة مئوية × 15-20 درجة مئوية.
5. التصوير في FIB-SEM
- التقاط صور نظرة عامة على العينة في SBF-SEM، بما في ذلك مثالي واحد أو أكثر من حواف العينة التي يمكن التعرف عليها بعد ذلك في FIB-SEM (الشكل2A،C).
ملاحظة: في هذا المثال تم التقاط الصور نظرة عامة SBF-SEM في حجم بكسل 10 نانومتر، 8000 × 8000 بكسل في 1 μs وقت الإقامة. وكان المجهر لا يزال تعيين في 1.6 كيلوفولت و 100 pA. - إزالة العينة من SBF-SEM ومكان في المغطي التأتأة. معطف العينة مع ≥ 20 نانومتر البلاتين لتصوير FIB-SEM.
- تحميل عينة في FIB-SEM واستخدام كاشف الإلكترون الثانوي في 15 كيلوفولت، 1 nA تحديد موقع العائد على الاستثمار المحدد في SBF-SEM على كتلة الوجه (الشكل2B،D).
ملاحظة: التصوير في 15 كيلو فولت ضروري لرؤية من خلال طلاء البلاتين. - جلب العائد على العينة في نقطة الصدفة من FIB وSEM الحزم، عن طريق تحريك وإمالة المرحلة (الشكل3A).
ملاحظة: عادةً ما يتم تحميل العمود FIB تحت زاوية (الشكل3A). وهذا يعني أن أي عينة تحتاج إلى إمالة بطريقة أن يتم وضع السطح ليتم تصويرها وتقسيمها بالتوازي مع شعاع FIB. يتم الآن إمالة السطح الذي سيتم تصويره فيما يتعلق بشعاع SEM ويجب إزالة خندق من الأنسجة قبل أن تتمكن SEM من صورة عائد الاستثمار (الشكل3E) - باستخدام شعاع FIB ونظام حقن الغاز، إيداع طبقة واقية 1 ملم من البلاتين على السطح فوق عائد الاستثمار (الشكل3C). بعد ذلك، باستخدام تيار طحن منخفضة (50-100 درجة في الثانية)، مطحنة الخطوط الدقيقة في ترسب البلاتين للتركيز التلقائي وتتبع 3D أثناء تشغيل التصوير (الشكل3D). وباستخدام عمود FIB وحاقن غاز الكربون، قم بتغطية هذه الخطوط بترسب الكربون.
ملاحظة: يتوافق حجم عائد الاستثمار هنا مع حجم عائد الاستثمار على صورة SBF-SEM وبالتالي يمكن أن يكون الحد الأقصى للحجم 30-40 درجة مئوية × 15-20 ميكرومتر. في هذا المثال تم تصوير عائد استثمار قدره 17 ميكرومتر × 8 ميكرومتر. هناك حاجة إلى ترسب الكربون لحماية الخطوط وخلق تباين أبيض وأسود بين الكربون والبلاتين الذي هو مثالي للتركيز التلقائي. يمكن العثور على تيارات الطحن المستخدمة لكل خطوة في الجدول2. - باستخدام تيار طحن عالية، مطحنة خندق من 30 ميكرومتر أمام عائد الاستثمار، وخلق سطح التصوير لشعاع SEM (الشكل3E).
ملاحظة: شعاع FIB مدمر بطبيعته، حتى أكثر من ذلك في التيارات العالية. تأكد من الحفاظ على التصوير في التيارات العالية إلى الحد الأدنى والصورة في التكبير منخفضة وسرعات المسح السريع لتجنب ذوبان الراتنج في عائد الاستثمار. - قم بتمهيد سطح التصوير باستخدام تيار طحن أقرب إلى التيار المستخدم أثناء تشغيل التصوير. توقف عن التلميع عندما تكون جميع علامات التركيز التلقائي والتتبع ثلاثي الأبعاد مرئية بوضوح على سطح التصوير (الشكل3F). ويمكن متابعة تقدم FIB عن طريق تصوير السطح مع EM (باستخدام كاشف الإلكترون المتناثرة مرة أخرى) أثناء تلميع.
- تحديد المنطقة التي سيتم تصويرها على السطح الذي تم إنشاؤه حديثًا وتعيين معلمات التصوير. تأكد من تركيز شعاع الإلكترون على السطح، وتعيين السطوع والتباين وتعيين حجم البكسل وسمك المقطع. حافظ على وقت التصوير أقل من دقيقة واحدة عن طريق ضبط متوسط الوقت والخط.
ملاحظة: من المهم استخدام الجهد المنخفض للتصوير مع شعاع الإلكترون للتأكد من أن يتم تصوير سطح الكتلة فقط (أي أنه لا يتم تصوير أي إلكترونات من أعمق في العينة). ويتم ذلك عن طريق الحفاظ على الجهد أقل من 2 كيلو فولت واستخدام كاشف الإلكترون المتناثرة مرة أخرى مع الجهد الشبكة، مما يسمح فقط الإلكترونات عالية الطاقة ليتم تصويرها. في هذا المثال، تم تعيين شعاع الإلكترون في 1.5 كيلوفولت و 1 nA مع الجهد الشبكة من 1.2 كيلوفولت على كاشف الإلكترون المتناثرة مرة أخرى. هنا أيضا، تم استخدام حجم بكسل من 5 نانومتر مع أقسام 5nm ليؤدي إلى مجموعة بيانات مع voxels متساوي المدار. تم تصوير مساحة 17 ميكرومتر × 10 ميكرومتر عند 6.5 ميكروثانية ومتوسط خط قدره 1.0. - قم بتعيين الإطارات للضبط التلقائي والتتبع ثلاثي الأبعاد، باستخدام نفس حجم البكسل والوقت ومتوسط الخط المستخدم في التصوير.
ملاحظة: تختلف هذه العملية لأنظمة مختلفة، وبالتالي يتم ذكر الخطوة فقط دون تحديد الإجراءات المختلفة. - بدء تشغيل التصوير ومراقبة استقرار العملية خلال أول 50-100 قسم. بمجرد تشغيل النظام بسلاسة، غادر الغرفة وتأكد من أن هناك أقل قدر ممكن من الإزعاج إلى الغرفة.
ملاحظة: تعتمد مدة التشغيل وعدد المقاطع على حجم عائد الاستثمار وسمك المقطع. في FIB-SEM المحور Z هو في الواقع ارتفاع مربع عائد الاستثمار على صورة SBF-SEM (ماكس 15-20 درجة مئوية; الشكل 3هاء). - تسجيل بيانات FIB-SEM بنفس الطريقة الموضحة أعلاه لبيانات SBF-SEM.
النتائج
الصور من SBF-SEM تقدم لمحة عامة عن الأنسجة، وإعطاء نظرة ثاقبة في التوجه المكاني للخلايا والاتصالات بين الخلايا (الشكل4A). يضيف التصوير اللاحق FIB-SEM على منطقة جديدة، والتي عادة ما تكون منطقة ذات أهمية يتم تحديدها بعد فحص تشغيل SBF-SEM، تفاصيل عالية الدقة لخلايا و/أو هياكل محددة (الشكل4B).
الشكل 4 جيم D تظهر الفرق في تقديم voxels غير متساوي المدار من البيانات SBF-SEM (الشكل4C)وبيانات VOXel FIB-SEM متساوي المدار (الشكل4D). سمك z المستخدمة في SBF-SEM يعني أن تقديم يظهر بوضوح المقاطع، مما أدى إلى تأثير 'الدرج' في على السطح. في البيانات FIB-SEM المقاطع 5 نانومتر ضمان أن التقديم يظهر أكثر سلاسة بكثير والمقاطع الفردية مزيج في السطح تماما.
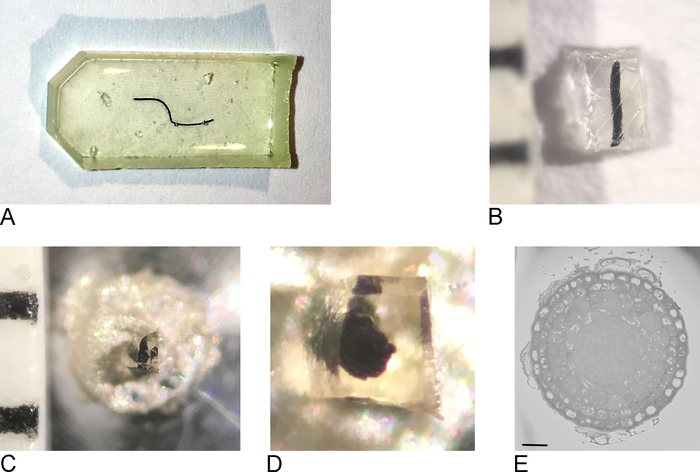
الشكل 1: إنشاء وجه كتلة من عينة الراتنج جزءا لا يتجزأ. (أ) طرف الجذر جزءا لا يتجزأ من الراتنج. (B) باستخدام شفرة الحلاقة يتم اقتطاع الراتنج الزائد بعيدا حتى كتلة من 0.5 مم2 لا يزال. (C,D) يتم لصقها كتلة قلص على دبوس معدني وبعد ليلة في الفرن، يتم اقتطاع جانبي الكتلة وسطح ممهدة بسكين الماس باستخدام ultramicrotome. (E) داخل SBF-SEM، يتم توجيه العينة بحيث يمكن التعرف على blockface وعائد الاستثمار، شريط مقياس = 20 درجة.
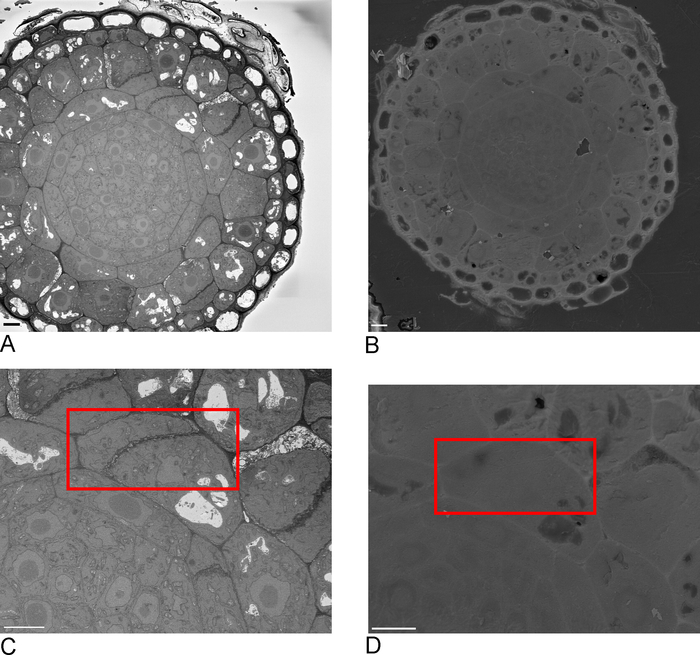
الشكل 2: الارتباط بين SBF-SEM وFIB-SEM. نظرة عامة على الصور من كتلة الوجه باستخدام SBF-SEM (A) وFIB-SEM (B)، شريط مقياس = 5 ميكرومتر. مربع أحمر يحدد المنطقة التي سيتم تصويرها مع FIB-SEM، شريط مقياس = 5 ميكرومتر.
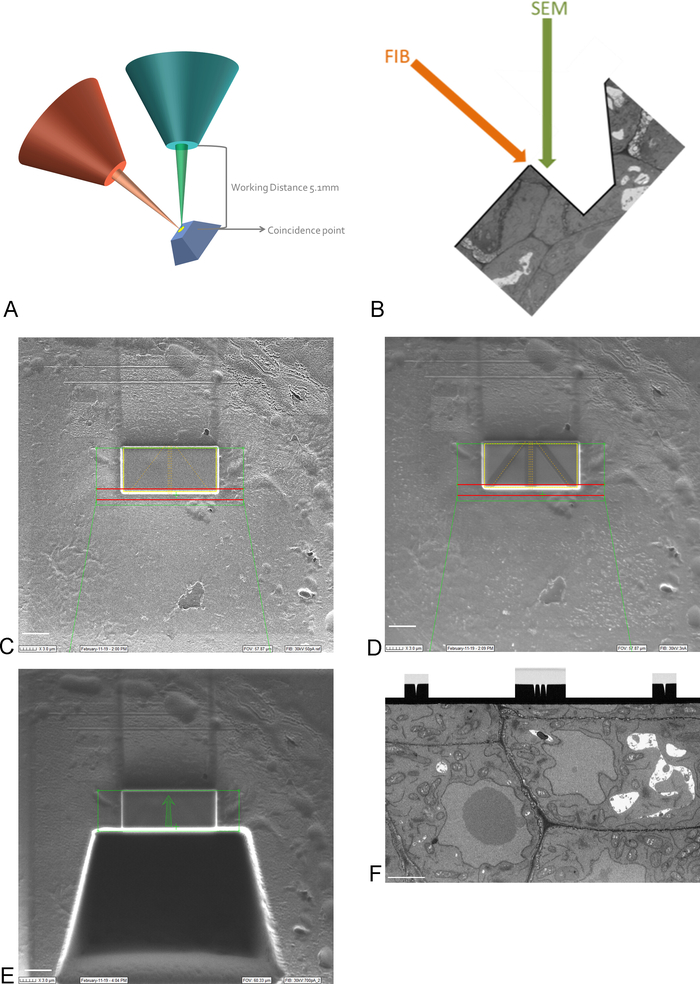
الشكل 3: مخطط FIB-SEM وخطوات الإعداد. (أ) مخطط يبين اتجاه شعاع FIB، شعاع SEM وعينة. يجب وضع العينة إلى نقطة الصدفة في FIB وSEM الحزم لتكون قادرة على مطحنة وصورة على نفس المنطقة. (ب) الرسم التخطيطي للخندق اللازم لتصوير SEM للأقسام التي أزالها FIB. (C) صورة التقطت مع شعاع FIB تظهر ترسب البلاتين على عائد الاستثمار، شريط مقياس 5 μm. (D) صورة مأخوذة مع شعاع FIB تظهر الخطوط المستخدمة للتركيز التلقائي وتتبع 3D. يتم استخدام الخطوط في الوسط للتركيز التلقائي وتوفر الخطوط الخارجية تتبع 3D. ترسب الكربون على رأس خطوط يوفر التباين اللازم (البلاتين مقابل الكربون) لأداء هذهالمهام، مقياس 5 م. (E) صورة مأخوذة مع شعاع FIB بعد طحن الخندق، مقياس 5 م. (F) صورة مأخوذة مع شعاع SEM تظهر منطقة الاهتمام التي تم تصويرها أثناء تشغيل FIB-SEM، شريط مقياس 2 μm. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
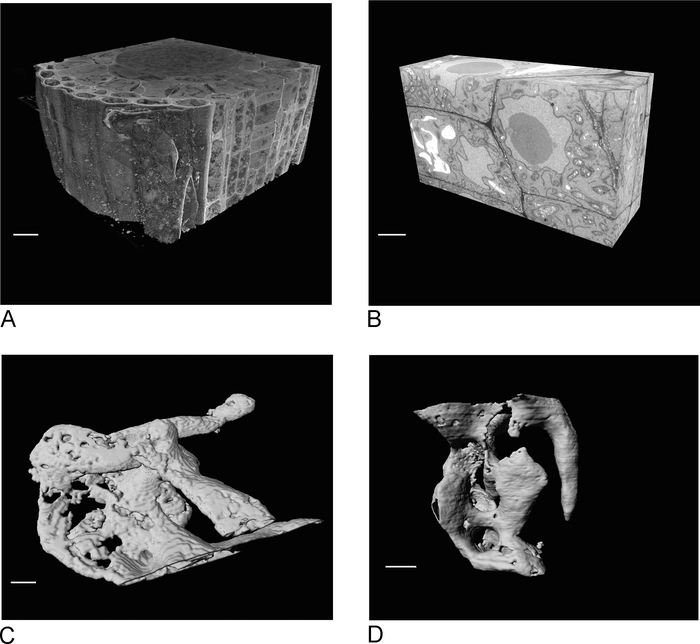
الشكل 4: نتائج SBF-SEM وFIB-SEM قبل وبعد التجزئة. (أ) عرض ثلاثي الجوانب لمجموعة بيانات SBF-SEM (100 × 100 × 40 ميكرومتر، شريط مقياس = 10 ميكرومتر)، (B) عرض ثلاثي الجوانب لمجموعة بيانات FIB-SEM (17 × 10 × 5.4 ميكرومتر، شريط مقياس = 2 ميكرو متر)، (C) الفراغات المقدمة مقسمة من بيانات SBF-SEM حسب العتبة، شريط المقياس = 2 ميكرومتر D. من البيانات FIB-SEM عن طريق العتبات، شريط مقياس = 2 م. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| بروتوكول لمعالجة الموجات الدقيقة | |||||||||
| برنامج # | وصف | موجه المستخدم (تشغيل/إيقاف تشغيل) | الوقت (ساعة: دقيقة: ثانية) | الطاقة (واط) | درجة الحرارة (درجة مئوية) | تحميل برودة (إيقاف / السيارات / على) | فراغ / مضخة Bubbler (قبالة / بوب / VAC دورة / VAC على / فاب) | ثابت درجة الحرارة | |
| مضخة (تشغيل / إيقاف) | درجة الحرارة (درجة مئوية) | ||||||||
| 8 | TCH | قباله | 0:01:00 | 150 | 50 | قباله | فراغ دورة | في | 30 |
| قباله | 0:01:00 | 0 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:01:00 | 150 | 50 | قباله | فراغ دورة | في | 30 | ||
| 9 | الاوزميوم | قباله | 0:02:00 | 100 | 50 | قباله | فراغ دورة | في | 30 |
| قباله | 0:02:00 | 0 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:02:00 | 100 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:02:00 | 0 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:02:00 | 100 | 50 | قباله | فراغ دورة | في | 30 | ||
| 10 | 50% EtOH | في | 0:00:40 | 150 | 50 | قباله | قباله | في | 30 |
| 70% EtOH | في | 0:00:40 | 150 | 50 | قباله | قباله | في | 30 | |
| 90% EtOH | في | 0:00:40 | 150 | 50 | قباله | قباله | في | 30 | |
| 100٪ EtOH | في | 0:00:40 | 150 | 50 | قباله | قباله | في | 30 | |
| 100٪ EtOH | في | 0:00:40 | 150 | 50 | قباله | قباله | في | 30 | |
| 15 | 0.1M كاكوديلات | في | 0:00:40 | 250 | 50 | قباله | فراغ دورة | في | 30 |
| 0.1M كاكوديلات | في | 0:00:40 | 250 | 50 | قباله | فراغ دورة | في | 30 | |
| 15 | ddH2O | في | 0:00:40 | 250 | 50 | قباله | فراغ دورة | في | 30 |
| ddH2O | في | 0:00:40 | 250 | 50 | قباله | فراغ دورة | في | 30 | |
| 16 | خلات أورانيل | قباله | 0:01:00 | 150 | 50 | قباله | فراغ دورة | في | 30 |
| قباله | 0:01:00 | 0 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:01:00 | 150 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:01:00 | 0 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:01:00 | 150 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:01:00 | 0 | 50 | قباله | فراغ دورة | في | 30 | ||
| قباله | 0:01:00 | 150 | 50 | قباله | فراغ دورة | في | 30 | ||
الجدول 1 بروتوكول مفصل لمعالجة الموجات الدقيقة.
| خطوه | الحاليه | الوقت المقدر |
| البلاتين الترسيب | 3n A | 10-15 دقيقة |
| طحن Autotune وتتبع علامات | 50-100 نقطة في اليوم | 4-6 دقائق |
| الكربون الترسيب | 3 ن م | 5-10 دقائق |
| طحن الخندق الخشن | 15-30 درجة غير المائة | 30-50 دقيقة |
| تلميع السطح | 1.5-3 ن.م | 15-20 دقيقة |
| تشغيل التصوير | 700 pA-1.5 nA | ساعات العمل والأيام |
الجدول 2 FIB الطحن التيارات المستخدمة لإعداد العينة وتشغيل التصوير
Discussion
حجم الإلكترون المجهري هو أكثر تحديا وتستغرق وقتا طويلا من SEM التقليدية أو TEM. بسبب الحاجة إلى وصمة عار الأنسجة أو الخلايا في كتلة، يجب أن تكون خطوات المعالجة طويلة بما فيه الكفاية لضمان اختراق الكواشف في جميع أنحاء العينة. استخدام طاقة الميكروويف لتسهيل الاختراق يجعل معالجة أقصر وأكثر كفاءة ويحسن تلطيخ. لأن التحضير لEM هو أكثر صرامة بكثير من للميكروسكوب الخفيفة يجب أن تكون جميع الحلول والكواشف رقابة الجودة بدقة. يمكن أن يكون للتغيرات في الحموضة، والتوتر، واستخدام الكواشف غير النقية، وإدخال الملوثات بسبب ضعف التقنية، جميعها آثار ضارة على الصورة النهائية.
يتطلب حجم EM أيضابروتوكولات مصممة بشكل فردي لكل نوع عينة مختلفة. الأنسجة الثدييات من أنواع مختلفة: النباتات، والخلايا واحدة مثل الخميرة، trypanosomes، C. elegans،وما إلى ذلك، كل حاجة الاختلافات الخاصة بهم لتحقيق النتائج المثلى. يجب تصميم التثبيت وتلطيخ من أجل الحفاظ على السلامة الهيكلية والحفاظ على العينة أقرب إلى مورفولوجيا في الجسم الحي قدر الإمكان. تثبيت الأنسجة في درجة الحرارة الفسيولوجية، ودرجة الحموضة وتونية أمر بالغ الأهمية لجعل العينة مثل الحياة كما يمكن أن يكون. تجميد الضغط العالي (HPF) من العينات قد يساعد على الحفاظ على حالة أكثر تشبه الحياة، (أو ربما مجرد إنتاج قطع أثرية مختلفة)، ولكن بالنسبة لغير الخلايا والأنسجة رقيقة جدا سوف تفشل HPF كما الجليد الزجاجي لا يمكن أن تولد إلا في كميات صغيرة. لذلك لكثير من الأسئلة التثبيت الكيميائي هو الخيار الوحيد. بغض النظر عما إذا كان التثبيت هو HPF أو الكيميائية، في أي تجربة EM النتائج الهيكلية تحتاج إلى أن تكون مقارنة بعناية إلى نتائج مماثلة من الخلايا الحية أو تصوير الأنسجة لمعرفة ما إذا كانت متسقة. يجب أيضا أن يكون الأمثل تلطيخ مع النظر في السؤال المحدد الذي يحتاج إلى الإجابة والبروتوكول الذي سيتم استخدامه لتصور الصور الرقمية.
وجود كل من SBF-SEM ونظام FIB على مقربة من ذلك هو ميزة كبيرة في العديد من التجارب. مجال الرؤية الكبير وارتفاع X،Y القرار من SBF-SEM يجعل العثور على الهياكل الفردية / الخلايا / الأحداث مباشرة ويوفر التوجه المكاني العام للخلايا في الأنسجة. وبالإضافة إلى ذلك، قدرتهعلى السماح التصوير من خلال عينة في Z قوية جدا. ومع ذلك، يمكن أن تفشل عمليات إعادة الإعمار التي تتطلب تفاصيل هندسية دقيقة أو تنتج قطع أثرية باستخدام هذه التقنية بسبب voxels غير متساوي المدار الذي يولده. يقتصر FIB من قبل الفيزياء من العملية إلى مجال التصوير أصغر ولكن قرارها 3D كافية لإعادة الإعمار دقيقة جدا. الجمع بين التقنيات اثنين هو واضح كما يمكن أن تنتقل العينات من SBF-SEM إلى FIB دون مزيد من المعالجة أو التحضير. ونحن نعترف بأن استخدام SBF-SEM للبحث من خلال عينة للعثور على منطقة معينة هو استخدام مكلفة جدا من أداة أكثر قدرة. ومع ذلك، فإن القدرة على رؤية الوجه الجديد على الفور وتحديد ما إذا كان قد تم الوصول إلى عائد الاستثمار هو ميزة كبيرة. بالإضافة إلى ذلك، قد تؤدي بدائل استخدام المقاطع المتوسطة الحجم نصف الرقيقة التسلسلية (0.5 م) إلى إزالة الهياكل الصغيرة قبل اكتشافها، وفحص كتلة باستخدام مقاطع TEM واحدة يجب قطعها، ووضعها على شبكة ثم عرضها في TEM مكلفة بنفس القدر ليس كما هو الحال في كفاءة الطريقة المعروضة.
نظرًا لوجود العديد من البرامج لتجزئة البيانات وتقديمها، وقد لا يتم تقديم احتياجات بنية معينة بشكل أفضل بواسطة تطبيق واحد، لا يمكن اقتراح سير عمل قياسي. قد يتم تقسيم بعض الهياكل البسيطة مع خوارزمية عتبة إذا كانت تقع ضمن قيم مقياس رمادي ضيق جداً. يمكن تقسيم الهياكل العصبية شبه تلقائيا باستخدام برنامج مثل Ilastik11 ولكن سيكون أقل فائدة على العضيات على شكل أكثر عشوائية أو معقدة مثل ER. مصفحات متصفح الصور هو برنامج مرن جدا التي يمكن محاذاة، قطعة، وتقديم حجم البيانات EM، ولكن يتطلب تفاعل كبير من قبل المستخدم12. وكقاعدة عامة، فإن مقدار الوقت اللازم لتصور النتائج رقمياً سيتجاوز إلى حد كبير الوقت المخصص لإعداد العينة والتصوير.
وقد فتحت تقنيات حجم EM البعد الثالث للتحليل الهيكلي الفائق. طرق أخرى للحصول على EM 3D لها قيود في حجمها (التصوير المقطعي TEM)، أو كفاءتها (القسم التسلسلي TEM). وعلى الرغم من أن معظم التقنيات في مجال الاستجابة للعينات الحجم معقدة للغاية ومكلفة بحيث لا يمكن تنفيذها في فرادى المختبرات، فإن عدد المرافق الأساسية المشتركة التي تقدمها آخذ في الازدياد، كما أن عدد أنواع العينات التي تم تصويرها بنجاح قد ازداد بسرعة. بالنسبة لأولئك الذين لديهم سؤال معين ونسيج معين فمن المرجح أن يكون شخص ما قادرا على تقديم المشورة والتعليمات بشأن إعداده والتصوير. يمكن تحسين حجم معدات EM لتشمل القدرة على التعامل مع عينات أكبر في SBF-SEM والقدرة على طحن أكبر ROIs مع FIB. والبرمجيات القادرة على تقسيم الهياكل ذات الأهمية بطريقة أكثر آلية ستبسط إلى حد كبير عملية تحليل البيانات والتحسينات في سرعة الحوسبة، وتقلل من الوقت اللازم للقيام بذلك. على الرغم من القيود الحالية، حجم EM لا يزال أداة مفيدة والجمع بين SBF-SEM وFIB-SEM يوفر سير عمل فعال لتحديد الأحداث النادرة وتصويرها بدقة عالية.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم توفير معدات الحجم EM بمنحة سخية من حكومة فلاندرز.
Materials
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
References
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved