Method Article
직렬 블록 얼굴 및 집중된 이온 빔 검사 전자 현미경 검사법을 사용하여 표적으로 한 연구 결과
요약
여기서, 우리는 관심 있는 지역을 표적으로 하기 위하여 직렬 블록 면 및 집중된 이온 광선 주사 전자 현미경 을 능등하게 결합하기 위한 프로토콜을 제시합니다. 이를 통해 3차원으로 효율적으로 검색하고 넓은 시야에서 드문 이벤트를 찾을 수 있습니다.
초록
이 프로토콜은 전자 현미경 검사법의 해결책 수준에서 3 차원으로 세포 또는 조직 견본의 능률적이고 효과적인 화상 진찰을 허용합니다. 수년 동안 전자 현미경 검사법 (EM)은 본질적으로 2 차원 기술로 남아 있습니다. 직렬 스캐닝 전자 현미경 이미징 기술 (볼륨 EM)의 출현으로, 통합 된 마이크로 톤 또는 집중 된 이온 빔을 사용하여 슬라이스 한 다음 내장 된 조직을 볼 수 있게되면서 제 3 차원은 쉽게 접근 할 수 있습니다. 직렬 블록 얼굴 스캐닝 전자 현미경 검사법 (SBF-SEM)은 SEM 챔버에 동봉된 초미세토메를 사용합니다. 그것은 큰 표본 (1,000 μm x 1,000 μm)과 작은 X, Y 픽셀 크기에서 이미지 큰 시야를 처리 할 수있는 기능을 가지고 있지만 다이아몬드 칼에 의해 Z 치수에 제한됩니다. 집중 이온 빔 SEM(FIB-SEM)은 3D 분해능에 한정되지 않고(≤5 nm의 등방성 복셀은 달성 가능함) 시야가 훨씬 더 제한적이다. 이 프로토콜은 두 가지 기술을 결합하여 넓은 필드에서 개별 ROI(관심 영역)를 찾은 다음 높은 등방성 복셀 해상도로 후속 표적 볼륨을 이미징하는 워크플로우를 보여 줍니다. 고정 된 세포 또는 조직을 준비하는 것은 SEM 이미징의 효율적인 신호 생성에 필요한 추가 대비로 인해 볼륨 EM 기술에 더 까다롭습니다. 이러한 프로토콜은 시간이 많이 걸리고 노동이 많이 소요됩니다. 이 프로토콜은 또한 마이크로파 보조 조직 처리를 통합하여 시약의 침투를 용이하게 하여 처리 프로토콜에 필요한 시간을 며칠에서 몇 시간으로 줄입니다.
서문
이 프로토콜은 특정 관심 영역(ROI)에 대한 고해상도 3차원 전자 현미경 검사법(EM)의 효율적인 타겟팅을 위한 워크플로우를 설명합니다. EM은 1930년대에 시작된 이래 본질적으로 2차원 기술이었습니다. 첫번째 간행된 심상은 전체 조직 또는 세포의 것이었지만 곧 초음파를 사용하여 손으로 절단되고 투과 전자 현미경 (TEM)를 사용하여 심상한 단면도에 방법을 주었습니다. TEM은 아주 작은 세포 구조조차도 명확하게 식별할 수 있는 매우 고해상도 현미경 을 생성합니다. 그러나, 전자빔에 의해 영상화되는 조직에 필요한 단면의 얇음은 Z 치수에서 최소한의 정보를 만들었다. 세포는 3차원 구조이기 때문에 세포 구조와 세포 표면 간의 상호 작용은 제한된 데이터에서 유추되어야 했습니다. 이것은 특히 복잡한 구조에서 오해의 가능성을 제기했습니다. 몇몇 현미경 은 세포와 조직을 직렬로 하 여 더 정확한 3D 구조물을 얻기 위하여 관리하고 그때 개별적인 TEM 심상 1에서 그(것)들을 근면하게 재구성했습니다. 이것은 매우 노동 집약적인 과정이었고 디지털 이미징과 컴퓨터 렌더링의 출현 이전에도 결과를 시각화하기가 어려웠습니다. 최근에는 더 많은 실험실에 접근 할 수있는 3 차원의 EM을 만든 볼륨 전자 현미경 검사법 (volume EM) 2로 통칭되는 두 가지 기술이 도입되었습니다.
전자 현미경 내부에 내장 된 블록에서 이미지 스택을 얻는 아이디어는 스티브 레이튼과 앨런 Kuzirian이 소형 마이크로 토메를 구축하고 주사 전자 현미경3 (SBF-SEM)의 챔버에 배치 할 때 1981 년으로 거슬러 올라갈 수 있습니다 . 이 프로토타입은 결국 23년 후 Denk와 Horstmann4에 의해 복사되고 개선되었고 그 후 상용화되었습니다. 거의 같은 시간에 생물 과학자들은 재료 과학에 주로 사용되는 또 다른 기술을 인식하게되었다, 집중 이온 빔. 이 기술은 일종의 이온 빔(Gallium, plasma)을 사용하여 샘플(FIB-SEM) 5로부터 매우적은 양의 표면 물질을 제거한다. 두 기술 모두 X, Y, Z, 스택으로 결합 될 수있는 일련의 이미지를 제공하는 이미징 다음에 단면을 사용합니다. 두 기술 모두 3D 정보를 제공하지만 해상도 척도가 다릅니다. SBF-SEM은 다이아몬드 나이프의 물리적 특성에 의해 50 nm 이하의 슬라이스로 제한되며, 긴 직렬 이미징 실행을 위해; 그러나 단면화할 수 있는 샘플 블록 크기는 최대 1mm x 1mm x 1mm크기로 인해 블록 면에서 신호를 수신하는 백 산란 전자 검출기(32k x 32k 픽셀)의 대형 디지털 수집 형식으로 인해 이미지 픽셀 크기는 1nm만큼 작을 수 있습니다. 이로 인해 X,Y 치수가 Z보다 작은 비 등방성 복셀이 생성됩니다. 이온 빔의 정밀도 때문에 FIB-SEM은 등방성 복셀 ≤5 nm로 이미지를 수집할 수 있습니다. 그러나 이미지화할 수 있는 전체 영역은 매우 작습니다. 두 가지 기술로 이미지된 다양한 샘플 및 볼륨에 대한요약 표가 이전에 3.
부피 EM에 대한 조직 준비는 SEM에서 적절한 신호 생성을 제공하기 위해 샘플을 염색해야하기 때문에 표준 TEM 또는 SEM보다 더 어렵습니다. 식별 및 재건을 쉽게 하기 위해 특정 세포 구조와 대조. 여기서 사용되는 프로토콜은 NCMIR 표준6을 기반으로 합니다. 추가 염색은 일반적으로 추가 프로토콜 단계를 의미합니다. 따라서 볼륨 EM의 경우 시약이 시료에 침투할 수 있는 충분한 시간을 확보하기 위해 표준 프로토콜을 확장해야 합니다. 마이크로웨이브 보조 처리는 염색에 필요한 시간을 몇 시간에서 몇 분으로단축할 수 있으며 볼륨 EM 샘플 준비를 보다 효율적으로 7. 이 방법은 모든 세포 및 조직 유형 8에 적용 가능하고 조직의 불균일성이 특정 영역의샘플링을필수적인 9.
데이터 스택을 가져오면 나머지 데이터에서 분할되고 3D로 모델링된 관심 구조와 정렬할 수 있습니다. 많은 조직 조각을 이미징하는 자동화로 이미지 수집이 비교적 간단해졌지만 데이터를 디지털 방식으로 재구성하고 시각화하는 과정은 시간이 많이 소요되는 작업입니다. 이 목적을 위한 소프트웨어는 아직 통합되거나 완전히 자동화되지 않았습니다. 부피 EM을 사용하는 초기 작업의 대부분은 신경 과학을 지향했기 때문에 축축과 같은 구조를 염색하고 디지털로 분할하는 기술은 다른 세포 및 세포기관에 비해 상당히 진보되었습니다. 다른 비 신경 조직에 대한 문헌이 빠르게 성장하는 동안 비선형 또는 불규칙한 구조는 더 많은 수동 입력이 필요합니다.
SBF-SEM 및 FIB-SEM을 모두 사용하는 것은 3D로 고해상도로 특정, 비균질, 조직 구조를 표적화 및 이미징하는 데 유용한 접근법입니다. 이를 마이크로파 보조 조직 처리와 결합하여 시료 준비에 필요한 시간을 크게 줄입니다. 이 워크플로우를 통해 미세 구조의 고해상도 등방성 복셀 이미지 데이터 세트를 효율적이고 신속한 프로세스로 생성할 수 있습니다.
프로토콜
1. 전자 현미경 검사법에 대한 샘플 고정 및 처리
- 상온에서 2시간 동안 0.5% 파라포름알데히드, 0.1M 인산완충제(PB) pH 6.8에서 2.5% 글루타랄데히드에 한천 판에서 자란 애기장대탈리아나의 모종을 고치자.
주의: 알데히드는 자극제이며 부식성이며 발암성, 돌연변이성 및 기형생성 잠재력을 가지고 있습니다. 모든 용액은 적절한 보호 장비와 연기 후드로 처리해야 합니다. - 1.1단계에서 자란 식물의 뿌리 끝을 잘라내고 4°C에서 하룻밤 동안 동일한 고정제를 함유하는 0.5 mL 튜브에 2-3개의 팁을 넣습니다.
참고: 이 볼륨과 나머지 단계의 모든 솔루션은 샘플 볼륨에 의해 결정됩니다. 용액에 대한 샘플의 최소 비율은 10:1입니다. 어떤 차원에서 1mm보다 큰 샘플은 얼룩이 나기 어렵기 때문에 더 큰 조직 블록으로 작업하는 것이 더 어렵습니다. 모든 조직이 동일한 특성을 가지고 있는 것은 아닙니다. 예를 들어, 식물 잎과 줄기는 얼룩이 어려울 수 있습니다. 더 큰 샘플 또는 어려운 조직 유형이 필요한 경우 데이터 수집으로 이동하기 전에 샘플 처리의 최적화를 수행해야 합니다. - 1.7단계 전에 신선하고 사용 가능한 티오카르보하이드라지드(TCH) 용액을 준비한다. 티오카르보하이드라지드 0.1 g을 이중 증류수(ddH 2O)의10 mL에 넣고 오븐에서 60°C로 가열하여 1시간 동안 용해합니다. 사용하기 전에 0.22 μm 주사기 필터를 사용하여 TCH 용액을 필터링하십시오.
- 튜브에서 고정제를 제거하고 0.1 M PB pH 6.8로 교체하십시오. 튜브를 100rpm의 궤도 흔들림 테이블에 놓고 10 분 동안 씻으십시오. 신선한 PBS를 사용하여 5 번 세탁을 반복하십시오.
- 포스트는 0.1 M PB pH 6.8에서 2% 오스뮴 테트 옥사이드 (OsO 4) 및 0.2 % 루테늄 레드로 PB를 대체하여 루트 팁을 수정합니다. 뚜껑을 열고 전자 레인지에 튜브를 넣고 프로그램9 (표 1)를 시작합니다.
주의: 오스뮴은 섭취 시 매우 위험하며, 흡입 시 매우 위험하며, 피부 접촉 시 위험합니다. 항상 적절한 보호 장비와 연기 후드를 사용하여 취급하십시오.
참고: 프로토콜 전반에 걸쳐, 튜브의 뚜껑은 전자레인지 단계에서 항상 열려 있습니다. - 벤치탑에서 각각 5분동안 ddH 2O로 루트 팁을 두 번 씻습니다. 제3 및 제4 ddH2O 워시 용 프로그램(15)을 전자레인지에 사용한다(표 1). 처음 40초 ddH2O 세척 후, 샘플을 전자레인지에서 꺼내신선한 ddH2O로 교체하고 샘플을 전자레인지에 다시 넣고 프로그램을 계속합니다.
참고: 버퍼를 새로 고쳐야 할 때 전자레인지에 알람이 울립니다. 진공 챔버의 뚜껑이 매번 올바르게 교체되었는지 확인하십시오. - 이전에 제조된 TCH 용액을 RT에서 2분간 벤치에서 인큐베이팅하고 추가 인큐베이션을 위해 마이크로파 프로그램 8(표 1)을 사용한다. 벤치와 전자레인지 사이에 용액을 변경하지 마십시오.
- 1.6단계에서 설명한 대로 샘플을 세척한다.
- 전자레인지 프로그램 9(표 1)의 경우 ddH2O에 1% OsO4에 샘플을 놓습니다.
- 1.6단계에서 설명한 대로 샘플을 세척한다.
- 마이크로파 프로그램 16(표 1)을 사용하여 ddH2O에서1% 우라틸 아세테이트로 샘플을 인큐베이팅한다.
주의: 우라얄 아세테이트는 독성, 자극성이며 발암성, 돌연변이 성 및 기형 생성 잠재력을 가지고 있습니다. 항상 적절한 보호 장비를 사용하여 취급하십시오. - 1.6단계에서 설명한 대로 샘플을 세척한다.
- 1.14단계에서 사용할 월튼의 리드 솔루션을 준비합니다. 먼저 DdH 2O의 250 mL에 L-아스파르산 0.998 g을 추가하고 pH를 1 M KOH로 3.8로 조정하여 L-아스파르산의 재고 용액을 만듭니다. 다음으로, L-aspartic acid 스톡 용액 의 10 mL에 납 질산염 0.066 g을 용해하고 pH를 5.5로 조정합니다. 용액을 60°C에서 30분 동안 오븐에 둡니다.
참고: 침전물은 형성되지 않습니다. - 60 °C에서 오븐에서 30 분 동안 월튼의 리드 솔루션에 샘플을 인큐베이션.
- 1.6단계에서 설명한 대로 샘플을 세척한다.
- EtOH에서 샘플을 50%, 70%, ddH2O에서 90%, 100% EtOH에서 2배의 등급화 단계로 탈수합니다. 전자 레인지 프로그램10 (표 1)을 사용하면 전자 레인지마다 40 s마다 다음 EtOH 단계로 솔루션을 교체하라는 메시지가 표시됩니다. 이것은 전자 레인지에서 수행 된 마지막 단계입니다.
- 100% 프로필렌 옥사이드 2x를 벤치의 RT에서 각각 10분 동안 탈수하여 단계 간 용액을 대체합니다.
참고 : 프로필렌 산화폴리스티렌과 같은 일부 플라스틱을 용해 시킬 수 있습니다. 이 단계에 유리 바이알을 사용하거나 저항을 위해 플라스틱을 사전 테스트하십시오.
주의: 프로필렌 옥사이드는 인화성이 높습니다. 항상 적절한 보호 장비와 연기 후드를 사용하여 취급하십시오. - 프로필렌 옥사이드 (min 2 h)에서 50 % Spurr의 수지에서 배양하여 뿌리 팁의 침투를 시작합니다.
주의: 스퍼의 수지 성분은 자극제입니다. 항상 적절한 보호 장비와 연기 후드를 사용하여 취급하십시오. - 용액을 100% Spurr로 교체하고 RT에서 하룻밤 동안 둡니다.
- 신선한 100% 스퍼의 수지 2회(분 2시간 배양)로 변경합니다.
- 신선한 100% Spurr의 수지가 다시 포함된 샘플을 임베딩 몰드에 넣고 36-48h동안 65°C의 오븐에서 중합합니다.
참고 : 사용되는 포함 금형은 조직의 유형과 이미징에 사용되는 접근 방식에 따라 달라집니다. 여기서, 플랫 실리콘 임베딩 몰드를 사용하였다(도1A).
2. 이미징을 위해 임베디드 샘플 준비
- 오븐에서 샘플을 제거하고 임베딩 몰드에서 수지(그림1B)를제거합니다.
- 면도날을 사용하여 샘플을 최대 0.5mm x 0.5mm x 0.5mm(그림1C)의 블록으로 대략 다듬습니다.
참고: SBF-SEM에서 충전되지 않도록 하려면 가능한 한 많은 베어 수지에서 잘라내고 샘플을 가능한 한 평평하고 얇게 만드는 것이 중요합니다. 이상적으로 블록의 모든 면은 이미 조직을 포함하지만, 가장 중요한 것은 금속 핀에 부착될 측면(단계 2.3 참조)은 조직이 전도성 금속과 직접 접촉하도록 노출된 조직을 함유해야 한다. - 외부 수지에서 샘플을 제거하고 전도성 에폭시 수지로 금속 핀 (그림1D)에부착하여 조직의 일부가 금속 핀에 닿는지 확인합니다. 에폭시를 65°C에서 오븐에서 하룻밤 경화시켰다.
참고: SB-SEM의 스테이지 이동이 제한되어 있으므로 샘플이 핀 중앙에 위치해야 합니다. 작은 샘플은 분리 될 때 멀리 비행하는 경향이있을 것이다 때문에 여분의 수지에서 매우 작은 수지를 감싸는 샘플을 제거하는 것은 어려울 수 있습니다. 이에 대한 간단하고 효과적인 해결책은 참조 1의 보충 영화에 도시된 바와 같이파라핀 필름 시트로 샘플을 덮는 것이다. - 울트라 마이크로토메를 위해 홀더에 캐리어를 고정하십시오. 면도날을 사용하여 여분의 에폭시를 제거하고 울트라 마이크로톤과 다이아몬드 나이프를 사용하여 블록의 얼굴과 측면을 부드럽게 하여 피라미드를 형성합니다. 적어도 일부 조직이 블록 페이스에 이미 노출되어 있는지 확인하십시오.
참고: 다이아몬드 나이프를 사용하는 추가 단계는 선택 사항이지만 블록 면에 있는 칼의 그림자가 선명하여 칼과 블록 면 사이의 거리를 쉽게 판단할 수 있기 때문에 SBF-SEM에서 결과 블록을 더 쉽게 접근할 수 있습니다. - 트리밍된 샘플 블록을 스퍼터 코터에 넣고 백금(Pt)의 얇은 층(2−5 nm)으로 샘플을 코팅합니다.
참고: 블록 페이스의 백금은 SBF-SEM(아래 참조)에서 접근하는 동안 절단되지만 피라미드 측면의 백금은 추가적인 전도성을 제공합니다. 이 예에서, 샘플은 백금으로 코팅되었지만, 금, 또는 금/팔라듐도 효과적이다; 그러나, 금으로 코팅하는 것은 화상 진찰 실행 도중 블록 면에 증가한 파편 귀착되었습니다.
3. SBF-SEM의 이미징
- SBF-SEM 현미경에 담체를 삽입하고 칼을 시료 표면에 가까이 가져옵니다. Pt 층이 이미 제거되고 조직의 적어도 일부가 노출되도록 샘플의 상부를 트림 다이아몬드 나이프를 사용하여.
참고: 이 과정은 각 SBF-SEM 현미경에 대해 다르기 때문에 모든 단계가 여기에 지정된 것은 아닙니다. 샘플 표면이 Pt에서 자유롭고 이미징준비가 되어 있는 한 다음 단계가 가능합니다. - 낮은 해상도와 짧은 거주 시간에서 이미징을 시작하여 샘플의 개요를 얻고관심 영역을 찾습니다(그림 1E).
참고: 여기서 는 512 x 512 픽셀과 1 μs 의 거주 시간을 스테이지의 빠른 스캐닝 및 위치 지정에 사용했으며, 이미징 창을 최적화하고 초점을 조정하는 데 1 μs 의 2,000 픽셀과 1 μs 의 거주 시간을 사용했습니다. - 80-100 pA의 전류에서 1.5-2.0 kV의 가속 전압을 사용하여 조직의 이미지를 캡처합니다.
참고: 여기에 표시된 예는 충전을 최소화하기 위해 빔 전류를 조정해야 하는 고진공 시스템에서 이미지화되었으며, 이는 매우 샘플에 따라 달라집니다. 전형적으로, 전자 빔은 1.5−2.0 kV로 설정되지만 이것은 샘플에 의존적일 것이다. 더 높은 배율(일반적으로 > 10,000x)에서 수지는 빔의 영향을 너무 많이 받아 매끄러운 단면을 보장하기 때문에 일반적으로 픽셀 크기는 8,000-10,000 x 8,000-10,000 픽셀의 이미지 크기에서 8-20nm로 설정되어 있으며 해당 배율은 430 – 각각 64 X 64mm 및 200 x 200mm의 1,400x 및 필드 크기. - 관심 영역을 결정하고 관심 볼륨을 커버하고 다시 흩어진 전자 검출기를 사용하여 이미징 실행을 시작하는 데 필요한 섹션 수를 결정합니다.
참고: 여기에 제시된 예제에서는 80nm의 500개 섹션이 10nm 픽셀과 10,000 x 10,000 픽셀 이미지(거주 시간 1 μs)로 이미지화되었습니다. 현미경은 1.6 kV 및 100 pA로 설정되었다. 일반적으로 섹션 수는 ROI의 샘플 및 크기에 따라 달라지며 연속적인 섹션의 100초에서 1,000초까지 다양할 수 있습니다. 결과 데이터 집합은 모든 섹션의 단일 이미지로 구성됩니다. 이러한 이미지는 3D 스택으로 변환해야 합니다.
4. SBF-SEM 데이터 처리
- 피지를 사용하여 파일 가져오기 이미지 시퀀스를 선택하고 이미지 스택을 찾아 이미지를 로드합니다. 데이터 집합의 크기에 따라 '가상 스택 사용' 상자를 선택합니다.
참고: 데이터 집합이 정말 큰 경우 먼저 8비트(16비트에서 수집된 경우)로 변환하고 필요한 경우 실행 가능한 크기가 될 때까지 데이터를 bin합니다. - 이미지 하단의 재생 버튼을 사용하여 데이터 집합을 스크롤하여 이미징 실행이 성공했는지 확인합니다. SBF-SEM의 일반적인 이미징 아티팩트(예: 블록 페이스의 칼에서 떨어지는 부분, 맨수지 부위에서 충전, 칼의 아티팩트 절단(이미지의 수평선)를 확인합니다.
- 명령 이미지 속성을 사용하여 실행 중에 사용되는 픽셀 크기와 복셀 깊이(즉, 단면 두께)를 조정합니다. 데이터가 이미 비닝된 경우 이 것을 고려하십시오.
- SIFT와 명령 플러그인 등록 선형 스택 정렬을 사용하여 데이터를 등록합니다.
참고: SBF-SEM 데이터의 등록은 시료의 충전 또는 드리프트로 인해 이미징 중에 약간의 샘플 이동이 있을 수 있으므로 필요합니다. XY에서는 최소한의 이동일 뿐이기 때문에 번역만 필요합니다. - 데이터 집합을 스크롤하여 정렬을 확인하고 확인하면 파일 메뉴 아래에 저장 명령을 사용하여 정렬된 데이터 집합을 3D tif 파일로 저장합니다.
- 데이터 집합을 신중하게 분석하여 ROI가 포함되어 있는지, 생물학적 질문에 필요한 정보가 포함되어 있는지 확인합니다. 스택의 마지막 이미지(= 현재 블록 면)에서 FIB-SEM 이미징을 위한 새 ROI를 선택합니다.
참고: 현재 블록 면에 FIB-SEM 이미징에 적합한 영역이 없는 경우 ROI가 나타날 때까지 블록(SBF-SEM에 남아 있음)에서 더 많은 섹션을 절단할 수 있습니다. FIB로 이미지화할 수 있는 볼륨에는 제한이 있습니다. SBF-SEM 이미지의 ROI는 X, Y 30-40 μm x 15-20 μm에서 최대값일 수 있습니다.
5. FIB-SEM의 이미징
- SBF-SEM에서 샘플의 개요 이미지를 가져 가서, 이상적으로 FIB-SEM (그림2A,C)에서 인식 할 수있는 샘플의 하나 이상의 가장자리를 포함.
참고: 이 예제에서는 SBF-SEM 개요 이미지가 1μs 의 거주 시간에 10nm 픽셀 크기, 8,000 x 8,000픽셀로 촬영되었습니다. 현미경은 여전히 1.6 kV 및 100 pA로 설정되었습니다. - SBF-SEM에서 샘플을 제거하고 스퍼터 코터에 넣습니다. FIB-SEM 이미징을 위해 ≥20 nm 백금으로 샘플을 코팅합니다.
- 샘플을 FIB-SEM으로 로드하고 15 kV에서 이차 전자 검출기를 사용하여, 1 nA는 블록 면에서 SBF-SEM에서 확인된 ROI를 찾아낸다(도2B,D).
참고: 백금 코팅을 통해 15kV의 이미징이 필요합니다. - 스테이지를 이동하고 기울여 샘플의 ROI를 FIB 및 SEM 빔의 우연의 일치지점으로 가져옵니다(그림 3A).
참고: FIB 컬럼은 일반적으로 각도(그림3A)에따라 장착됩니다. 즉, 표면을 이미지화하고 단면화하는 방식으로 모든 샘플을 기울여야 합니다. 이미지화할 표면은 이제 SEM 빔에 대하여 기울어져 있으며, SEM이 ROI를 이미지화하기 전에 조직의 트렌치를 제거해야 합니다(그림3E). - FIB 빔 및 가스 분사 시스템을 사용하여 ROI 위의 표면에 백금의1mm 보호 층을 증착합니다(그림 3C). 다음으로, 낮은 밀링 전류(50-100 pA)를 사용하여 이미징 실행 중에 자동 초점 조정 및 3D 추적을 위해 백금 증착에 미세 라인을 밀링합니다(그림3D). FIB 컬럼과 탄소 가스 인젝터를 사용하여 탄소 증착로 이러한 라인을 덮습니다.
참고: 여기서 ROI의 크기는 SBF-SEM 이미지의 ROI 크기에 해당하며 최대 크기는 30-40 μm x 15-20 μm일 수 있습니다. 이 예에서는 17 μm x 8 μm의 ROI를 이미지화했습니다. 카본 증착은 라인을 보호하고 자동 초점에 이상적인 카본과 플래티넘 사이의 흑백 대비를 만드는 데 필요합니다. 각 단계에 사용되는 밀링 전류는 표2에서 찾을 수 있습니다. - 높은 밀링 전류를 사용하여 ROI 앞에서 30 μm의 트렌치를 밀링하여 SEM 빔의 이미징 표면을 만듭니다(그림3E).
참고: FIB 빔은 본질적으로 파괴적이며, 높은 전류에서는 더욱 파괴적입니다. ROI에서 수지가 녹지 않도록 낮은 배율과 빠른 스캔 속도로 영상을 최소로 유지하십시오. - 이미징 실행 중에 사용되는 전류에 더 가까운 밀링 전류로 이미징 표면을 부드럽게 합니다. 모든 자동 초점 및 3D 추적 표시가 이미징 표면에 선명히 표시되면 연마를 중지합니다(그림3F). FIB의 진행은 연마하는 동안 EM(백 산란 된 전자 검출기를 사용하여)으로 표면을 이미징함으로써 뒤따를 수 있다.
- 새로 생성된 표면에서 이미지할 영역을 결정하고 이미징 매개변수를 설정합니다. 전자 빔이 표면에 초점을 맞추고 밝기와 대비를 설정하고 픽셀 크기 및 단면 두께를 설정해야 합니다. 대기 시간과 라인 평균을 조정하여 이미징 시간을 1분 미만으로 유지합니다.
참고: 블록의 표면만 이미지화되도록 전자 빔을 이미징하기 위해 저전압을 사용하는 것이 중요합니다(즉, 샘플 깊숙이 들어온 전자가 이미지화되지 않음). 이는 전압을 2kV 이하로 유지하고 그리드 전압이 있는 백 산란 전자 검출기를 사용하여 고에너지 전자만 이미지화할 수 있도록 합니다. 이 예에서, 전자 빔은 백 산란 전자 검출기상 1.2 kV의 그리드 전압을 가진 1.5 kV 및 1 nA로 설정되었다. 또한 여기에서는 5nm 섹션과 함께 픽셀 크기 5nm를 사용하여 등방성 복셀이 있는 데이터 집합을 생성했습니다. 17 μm x 10 μm의 면적은 6.5 μs 거주 시간 및 1.0의 선 평균에서 이미지화되었다. - 이미징에 사용된 것과 동일한 픽셀 크기, 거주 시간 및 줄 평균을 사용하여 자동 튜닝 및 3D 추적을 위한 창을 설정합니다.
참고: 이 프로세스는 시스템에 따라 다르므로 다른 작업을 지정하지 않고 단계만 언급됩니다. - 이미징 실행을 시작하고 처음 50-100 섹션 동안 프로세스의 안정성을 모니터링합니다. 시스템이 원활하게 실행되면, 방을 떠나 가능한 한 방에 약간의 방해가 있는지 확인합니다.
참고: 실행 기간과 단면 수는 ROI의 크기와 단면 두께에 따라 달라집니다. FIB-SEM에서 Z축은 실제로 SBF-SEM 이미지의 ROI 박스 높이입니다(최대 15−20 μm; 그림3E)를 참조하십시오. - SBF-SEM 데이터에 대해 위에서 설명한 것과 동일한 방식으로 FIB-SEM 데이터를 등록합니다.
결과
SBF-SEM의 이미지는 조직의 개요를 제공하여 세포 및 세포 간 연결의 공간적 배향에 대한 통찰력을 제공합니다 (그림 4A). SBF-SEM 실행의 검사 후에 결정되는 관심 영역인 새로운 영역에 대한 후속 FIB-SEM 이미징은 특정 세포 및/또는구조의 고해상도 세부 사항을 추가합니다(그림 4B).
그림 4C ,D는 SBF-SEM 데이터(도4C)와등방성 복셀 FIB-SEM 데이터(도4D)의비등온성 복셀의 렌더링의 차이를 보여준다. SBF-SEM에 사용되는 z 두께는 렌더링이 단면을 명확하게 표시하여 표면에 '계단' 효과를 낸다는 것을 의미합니다. FIB-SEM 데이터에서 5nm 섹션은 렌더링이 훨씬 더 매끄럽게 나타나고 개별 섹션이 표면에 완전히 혼합되도록 합니다.
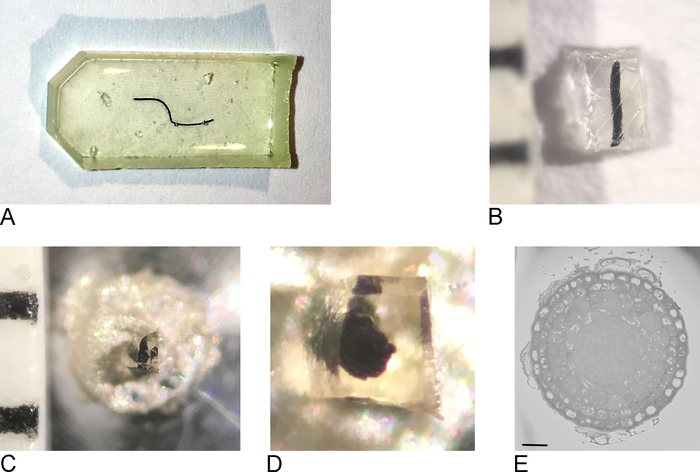
그림 1: 수지 내장 샘플에서 블록 면 생성. (A) 수지에 내장 된 루트 팁. (B) 면도날을 사용하여 0.5 mm2의 블록이 남을 때까지 여분의 수지는 멀리 다듬어지다. (C,D) 트리밍 된 블록은 금속 핀에 붙어 있으며 오븐에서 밤을 보낸 후 블록의 측면을 다듬고 표면은 울트라 마이크로 톤으로 다이아몬드 나이프로 매끄럽게 합니다. (E) SBF-SEM 내부에서 샘플은 블록페이스와 ROI를 인식할 수 있도록 방향이 정위되어, 스케일 바 = 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
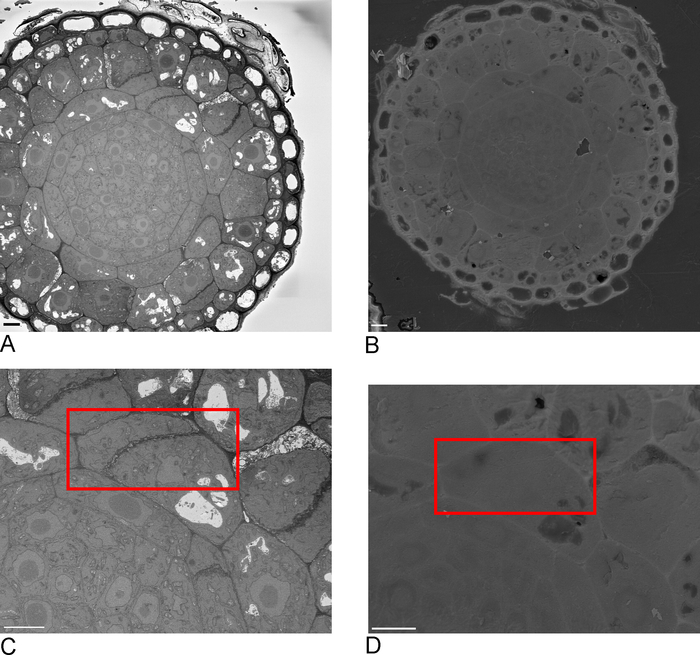
그림 2: SBF-SEM과 FIB-SEM 간의 상관관계입니다. SBF-SEM(A) 및 FIB-SEM(B) 및 스케일 막대= 5 μm.(C,D) ROI를 확대/축소를 사용하여 블록 페이스의 이미지 개요. 빨간색 상자는 FIB-SEM, 배율 표시줄 = 5 μm로 이미지될 영역을 묘사합니다.
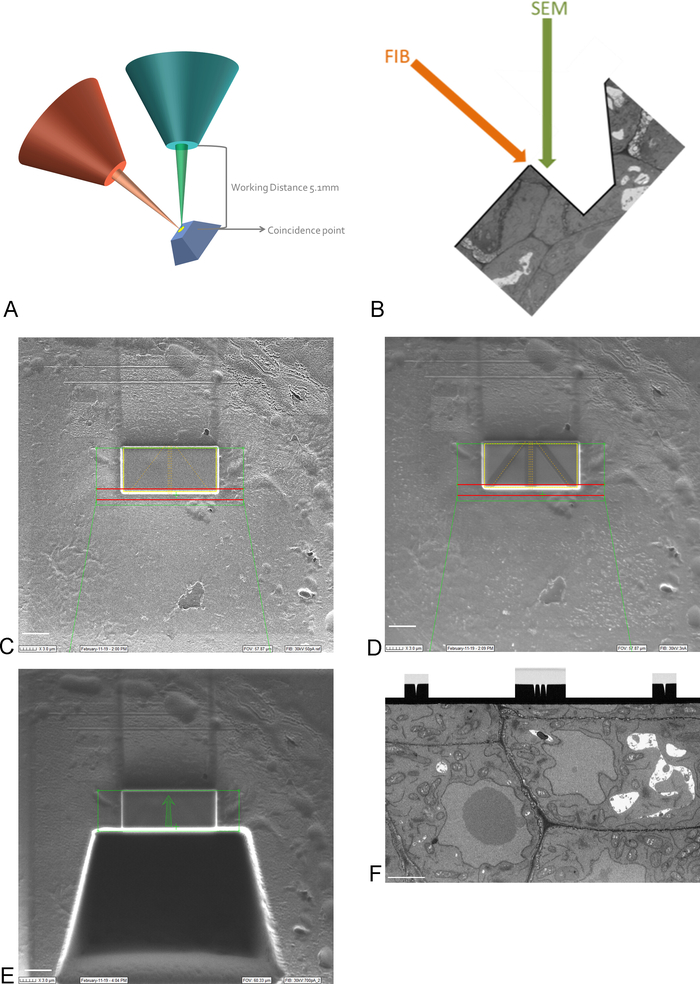
그림 3: FIB-SEM 체계 및 준비 단계. (A) FIB 빔, SEM 빔 및 샘플의 방향을 나타내는 구성표. 샘플은 FIB 및 SEM 빔의 우연한 지점에 배치되어야 동일한 영역에서 밀링 및 이미지를 할 수 있습니다. (B) FIB에 의해 제거된 섹션의 SEM 이미징에 필요한 트렌치의 개략도면. (C) ROI에 백금 증착을 보여주는 FIB 빔으로 촬영한 이미지, 스케일 바 5 μm. (D) 자동 초점 및 3D 추적에 사용되는 라인을 보여주는 FIB 빔으로 촬영한 이미지. 가운데의 선은 자동 초점에 사용되며 외부 선은 3D 추적을 제공합니다. 라인 상부에 탄소 증착은 이러한 작업을 수행하는 데 필요한 콘트라스트(백금 대탄소)를 제공하며, 스케일바 5 μm. (E) 트렌치의 밀링 후 FIB 빔으로 촬영한 이미지, 스케일바 5 μm(F) SEM 빔으로 촬영한 이미지 FIB-SEM 실행 중에 이미지된 관심 영역, 배율 막대 2 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
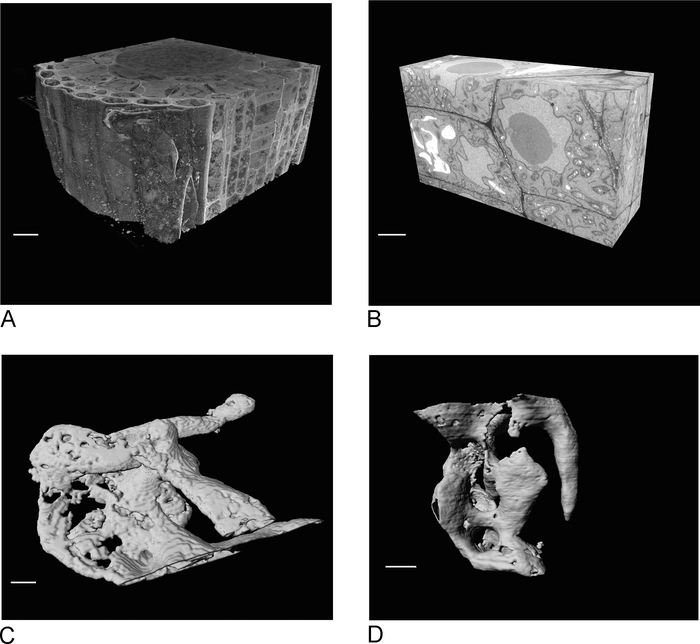
그림 4: 세분화 전후의 SBF-SEM 및 FIB-SEM 결과. (A) SBF-SEM 데이터 세트의 3D 뷰 (100 x 100 x 40 μm, 스케일 바 = 10 μm), (B) FIB-SEM 데이터 세트의 3D 뷰 (17 x 10 x 5.4 μm, 스케일 바 = 2 μm), (C) SBF-SEM 데이터로부터 분할된 렌더링 된 진공 청소기 = 임계값, 2 μm. 임계값, 스케일 바 = 2 μm에 의해 FIB-SEM 데이터에서 멘싱.
| 마이크로파 처리를 위한 프로토콜 | |||||||||
| 프로그램 # | 설명 | 사용자 프롬프트(켜기/끄기) | 시간(시간:최소:초) | 전원(와트) | 온도(°C) | 로드 쿨러(꺼짐/자동/켜짐) | 진공/버블러 펌프(오프/버브/진공 주기/진공/vap) | 정상 온도 | |
| 펌프(켜기/끄기) | 온도(°C) | ||||||||
| 8 | TCH (주) | 꺼져 있습니다. | 0:01:00 | 150 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 |
| 꺼져 있습니다. | 0:01:00 | 0 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:01:00 | 150 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 9 | 오스뮴 | 꺼져 있습니다. | 0:02:00 | 100 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 |
| 꺼져 있습니다. | 0:02:00 | 0 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:02:00 | 100 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:02:00 | 0 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:02:00 | 100 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 10 | 50% EtOH | 에 | 0:00:40 | 150 | 50 | 꺼져 있습니다. | 꺼져 있습니다. | 에 | 30 |
| 70% EtOH | 에 | 0:00:40 | 150 | 50 | 꺼져 있습니다. | 꺼져 있습니다. | 에 | 30 | |
| 90% EtOH | 에 | 0:00:40 | 150 | 50 | 꺼져 있습니다. | 꺼져 있습니다. | 에 | 30 | |
| 100% EtOH | 에 | 0:00:40 | 150 | 50 | 꺼져 있습니다. | 꺼져 있습니다. | 에 | 30 | |
| 100% EtOH | 에 | 0:00:40 | 150 | 50 | 꺼져 있습니다. | 꺼져 있습니다. | 에 | 30 | |
| 15 | 0.1M 카코디슬레이트 | 에 | 0:00:40 | 250 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 |
| 0.1M 카코디슬레이트 | 에 | 0:00:40 | 250 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | |
| 15 | ddH2O | 에 | 0:00:40 | 250 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 |
| ddH2O | 에 | 0:00:40 | 250 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | |
| 16 | 우라벨 아세테이트 | 꺼져 있습니다. | 0:01:00 | 150 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 |
| 꺼져 있습니다. | 0:01:00 | 0 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:01:00 | 150 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:01:00 | 0 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:01:00 | 150 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:01:00 | 0 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
| 꺼져 있습니다. | 0:01:00 | 150 | 50 | 꺼져 있습니다. | 진공 사이클 | 에 | 30 | ||
표 1. 마이크로파 처리를 위한 자세한 프로토콜.
| 단계 | 현재 | 예상 시간 |
| 증착 플래티넘 | 3n A | 10-15분 |
| 밀링 자동 조정 및 추적 마크 | 50-100 pA | 4-6분 |
| 증착 탄소 | 3 nA | 5-10분 |
| 밀링 거친 트렌치 | 15-30 nA | 30-50분 |
| 표면 연마 | 1.5-3 nA | 15-20분 |
| 이미징 실행 | 700 pA-1.5 nA | 시간-일 |
표 2. 시료 준비 및 이미징 실행에 사용되는 FIB 밀링 전류
토론
부피 전자 현미경 검사법은 기존의 SEM 또는 TEM보다 더 까다롭고 시간이 많이 걸립니다. 조직 이나 세포 enbloc를 염색 할 필요가 있기 때문에, 처리 단계는 샘플 전체에 걸쳐 시약의 침투를 보장하기에 충분히 길어야한다. 침투를 용이하게 하기 위해 마이크로파 에너지를 사용하면 더 짧고 효율적인 처리가 가능하게 되며 얼룩이 개선됩니다. EM에 대한 준비는 광 현미경 검사법보다 훨씬 더 엄격하기 때문에 모든 솔루션과 시약은 엄격하게 품질을 제어해야합니다. pH의 변화, 토니시티, 불순한 시약의 사용, 열악한 기술로 인한 오염 물질의 도입은 모두 최종 이미지에 해로운 영향을 미칠 수 있습니다.
또한 볼륨 EM에는 각 기종유형에 대해 개별적으로 맞춤화된 프로토콜이 필요합니다. 식물, 효모, 트리파노솜, C. 예쁜 꼬마등과 같은 단일 세포는 모두 최적의 결과를 얻기 위해 자신의 변형이 필요합니다. 구조적 무결성을 보존하고 샘플을 생체 내 형태에 최대한 가깝게 유지하도록 고정 및 염색을 설계해야 합니다. 생리적 온도, pH 및 토니시티에서 조직을 고정하는 것은 시료를 실물처럼 만드는 데 매우 중요합니다. 시료의 고압 동결(HPF)은 실제와 같은 상황을 보존하는 데 도움이 될 수 있지만(또는 다른 아티팩트를 산출할 수도 있음) 세포와 매우 얇은 조직 이외에는 유리체 얼음이 소량으로만 생성될 수 있기 때문에 HPF가 실패합니다. 따라서 많은 질문에 대한 화학 고정은 유일한 옵션입니다. 고정이 HPF 또는 화학적인 경우에, 어떤 EM 실험든지에서 구조적인 결과는 살아있는 세포 또는 조직 화상 진찰에서 유사한 결과와 신중하게 비교될 필요가 있는지 일관되는지 보기 위하여. 또한 답변해야 하는 특정 질문과 디지털 이미지 시각화에 사용할 프로토콜을 고려하면서 염색을 최적화해야 합니다.
SBF-SEM 및 FIB 시스템을 모두 근접에 두는 것은 많은 실험에서 큰 이점입니다. 넓은 시야와 높은 X, SBF-SEM의 Y 해상도는 개별 구조 /세포 / 이벤트를 간단하게 찾고 조직에서 세포의 전반적인 공간 방향을 제공합니다. 또한 Z의 샘플을 통해 이미징을 허용하는 기능은 매우 강력합니다. 그러나 미세한 기하학적 세부 사항이 필요한 재구성은 발생하는 비 등방성 복셀로 인해 이 기술을 사용하여 아티팩트를 생성하거나 실패할 수 있습니다. FIB는 프로세스의 물리학에 의해 더 작은 이미징 필드로 제한되지만 3D 해상도는 매우 정확한 재구성에 충분합니다. 샘플이 추가 처리 또는 준비 없이 SBF-SEM에서 FIB로 이동할 수 있기 때문에 두 기술을 결합하는 것은 간단합니다. SBF-SEM을 사용하여 샘플을 검색하여 특정 영역을 찾는 것은 훨씬 더 유능한 도구를 사용하는 데 매우 비용이 많이 듭니다. 그러나 새로운 블록페이스를 즉시 보고 ROI에 도달했는지 여부를 확인하는 기능은 큰 장점입니다. 또한 직렬 반박(0.5 μm) LM 섹션을 사용하는 대안은 감지되기 전에 작은 구조물을 제거할 수 있으며, 절단해야 하는 단일 TEM 섹션을 사용하여 블록을 검사하고 그리드에 배치한 다음 동등하게 비싼 TEM으로 볼 수 있는 것은 제시된 방법으로 효율적입니다.
데이터를 분할하고 렌더링하는 프로그램이 많고 지정된 구조의 요구 사항이 단일 응용 프로그램에서 가장 잘 제공되지 않을 수 있으므로 표준 워크플로를 제안할 수 없습니다. 일부 간단한 구조는 매우 좁은 회색 축척 값에 속하는 경우 임계값 알고리즘으로 분할될 수 있습니다. 신경 구조는 Ilastik11과 같은 프로그램을 사용하여 반자동 분할될 수 있지만 ER과 같은 더 무작위적이거나 복잡한 모양의 소기관에는 덜 유용할 것입니다. 현미경 이미지 브라우저는 볼륨 EM 데이터를 정렬, 세그먼트 및 렌더링할 수 있는 매우 유연한 프로그램이지만 상당한 사용자 상호 작용이 필요합니다12. 일반적으로 결과를 디지털 방식으로 시각화하는 데 필요한 시간은 샘플 및 이미징 을 준비하는 데 걸리는 시간을 크게 초과합니다.
볼륨 EM 기술은 초구조 분석에 대한 3차원을 열었습니다. 3D EM을 얻는 다른 방법은 그들의 부피 (TEM 단층 촬영) 또는 그들의 효율성 (직렬 섹션 TEM)에 있는 제한이 있습니다. 대부분의 경우 볼륨 EM 기술은 개별 실험실에서 구현하기에는 너무 복잡하고 비용이 많이 들지만 이를 제공하는 공유 핵심 시설의 수는 증가하고 있으며 성공적으로 이미지화된 샘플 유형의 수가 급격히 증가하고 있습니다. 특정 질문과 특정 조직을 가진 사람들을 위해 누군가가 그것의 준비 및 화상 진찰에 조언 그리고 지시를 제안할 수 있을 것입니다 가능성이 높습니다. 볼륨 EM 장비는 SBF-SEM에서 더 큰 샘플을 처리할 수 있는 용량과 FIB를 사용하여 더 큰 ROI를 밀링하는 기능을 포함하도록 개선할 수 있습니다. 관심 있는 구조를 보다 자동화된 방식으로 분할할 수 있는 소프트웨어는 데이터를 분석하는 프로세스를 크게 단순화하고 컴퓨팅 속도의 향상을 통해 필요한 시간을 단축할 수 있습니다. 현재의 한계에도 불구하고 볼륨 EM은 여전히 유용한 도구이며 SBF-SEM과 FIB-SEM을 결합하면 희귀 이벤트를 식별하고 고해상도로 이미징할 수 있는 효율적인 워크플로우를 제공합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
볼륨 EM장비는 플랑드르 정부의 관대한 보조금으로 제공되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
참고문헌
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유