Method Article
Seri Blok Yüz ve Odaklanmış Iyon ışını Scan Elektron Mikroskobu Kullanılarak Yapılan Hedefli Çalışmalar
Bu Makalede
Özet
Burada, seri blok yüz ve odaklanmış iyon ışını tarama elektron mikroskobu ile ilgi alanını hedefleyen bir protokolü etkin bir şekilde birleştirmek için bir protokol sıyoruz. Bu, üç boyutlu olarak verimli arama yapılmasına ve geniş bir görüş alanında nadir olayları bulmanızı sağlar.
Özet
Bu protokol, hücre veya doku örneklerinin elektron mikroskobu çözünürlüğü düzeyinde üç boyutlu olarak etkin ve verimli bir şekilde görüntülenmesine olanak sağlar. Uzun yıllar elektron mikroskobu (EM) doğal olarak iki boyutlu bir teknik olarak kalmıştır. Seri tarama elektron mikroskobu görüntüleme teknikleri (hacim EM) gelişiyle, ya entegre bir mikrotom veya odaklanmış iyon ışını kullanarak sonra gömülü dokuları görüntülemek için, üçüncü boyut kolayca erişilebilir hale gelir. Seri blok yüz taramalı elektron mikroskobu (SBF-SEM) SEM haznesinde bir ultramikrotom kullanır. Büyük numuneleri (1.000 μm x 1.000 m) ve küçük X,Y piksel boyutunda görüntü büyük görüş alanlarını işleyebilme yeteneğine sahiptir, ancak z boyutunda elmas bıçak ile sınırlıdır. Odaklanmış iyon demeti SEM (FIB-SEM) 3D çözünürlükte sınırlı değildir, (≤5 nm izotropik voxels ulaşılabilir), ancak görüş alanı çok daha sınırlıdır. Bu protokol, büyük bir alanda tek tek ilgi bölgeleri (ROI) bulmak ve daha sonra yüksek isotropik voksel çözünürlükte sonraki hedeflenen hacmi görüntüleme sağlamak için iki teknik birleştirmek için bir iş akışı göstermektedir. SEM görüntülemede verimli sinyal üretimi için gerekli ekstra kontrast nedeniyle sabit hücre veya dokuların hazırlanması hacim EM teknikleri için daha zahmetlidir. Bu tür protokoller zaman alıcı ve emek yoğun. Bu protokol aynı zamanda reaktiflerin penetrasyonunu kolaylaştıran mikrodalga destekli doku işlemeyi de içerir ve bu da işlem protokolü için gereken süreyi gün lerden saatlere indirir.
Giriş
Bu protokol, yüksek çözünürlüklü, üç boyutlu elektron mikroskobu (EM) ile belirli bir ilgi bölgesine (YG) verimli hedefleme için bir iş akışını açıklar. 1930'larda başlangıcından bu yana, EM aslında iki boyutlu bir teknik olmuştur. İlk yayınlanan görüntüler tüm dokulara veya hücrelere aitti, ancak kısa sürede ultramikrotom kullanılarak elle kesilen ve iletim elektron mikroskobu (TEM) kullanılarak çekilen bölümlere yol açtı. TEM, hücresel yapıların en küçüğünün bile açıkça ayırt edilebildiği çok yüksek çözünürlüklü mikrograflar üretmektedir. Ancak, elektron ışını ile görüntülenecek dokunun gerekli olan kesitin incelikzliği Z boyutunda bilgi minimal yaptı. Hücreler üç boyutlu yapılar olduğundan, hücre yapıları ve hücre yüzeyleri arasındaki etkileşimler sınırlı verilerden çıkarılmalıdır. Bu durum, özellikle karmaşık yapılarda yanlış yorumlama potansiyelini ortaya çıkardı. Bazı mikroskopistler seri kesitli hücre ve dokular ile daha doğru 3Boyutlu yapılar elde etmeyi başarmış ve bunları tek tek TEMgörüntülerindenözenle yeniden yapılandırmayı başarmış 1. Bu çok emek yoğun bir süreçti ve dijital görüntüleme ve bilgisayar oluşturma sonuçları nın ortaya çıkmasından önce de görselleştirmek zordu. Son yıllarda, EM'i üç boyutlu olarak daha fazla laboratuvara erişilebilir hale getiren hacim elektron mikroskobu (hacim EM)2 olarak bilinen iki teknik ortaya çıkmıştır.
Bir elektron mikroskobu içinde gömülü bir bloktan bir görüntü yığını elde etme fikri, Steve Leighton ve Alan Kuzirian'ın minyatür bir mikrotom yapıp taramalı elektron mikroskobu3 (SBF-SEM) odasına yerleştirerek 1981'e kadar uzanabilir. . Bu prototip 23 yıl sonra Denk ve Horstmann4 tarafından kopyalandı ve geliştirildi ve daha sonra ticarileştirildi. Kabaca aynı zamanda biyolojik bilim adamları öncelikle malzeme biliminde kullanılan başka bir teknoloji nin farkına vardılar, odaklanmış iyon ışını. Bu teknik, bir numuneden çok az miktarda yüzey materyalini çıkarmak için bir çeşit iyon ışını(Galyum, plazma) kullanır (FIB-SEM) 5. Her iki teknik de x, y, z, yığın içine kombine edilebilir görüntüleri bir dizi sağlayan görüntüleme ardından kesit kullanır. Her iki teknik de 3B bilgi sağlar, ancak farklı çözünürlük ölçeklerinde. SBF-SEM, elmas bıçağın fiziksel özellikleri ile uzun seri görüntüleme koşuları için 50 nm'den daha ince olmayan dilimlerle sınırlıdır; ancak kesilebilen örnek blok boyutu büyüktür, blok yüzeyinden sinyal alan arka dağınık elektron dedektörünün (32k x 32k piksel) büyük dijital kazanım formatı nedeniyle 1 mm x 1 mm x 1 mm x 1 mm.'ye kadar , görüntü piksel boyutları 1 nm kadar küçük olabilir. Bu x,Y boyutunun sıklıkla Z'den daha küçük olduğu non-isotropic voksellerle sonuçlanır. İyon ışınının hassasiyeti nedeniyle, FIB-SEM izotropik voxels ≤5 nm ile görüntü toplama yeteneğine sahiptir. Ancak, görüntülenebilir toplam alan oldukça küçüktür. Çeşitli örnekler ve iki teknik ile görüntülenmiş hacimleri bir özet tablo daha önce3yayınlanmıştır .
Doku hazırlama hacmi EM için standart TEM veya SEM için daha zordur çünkü örnekler SEM yeterli sinyal üretimi sağlamak için lekeli olmalıdır. Sık sık, lekeler sadece belirli doku tipi için değil, aynı zamanda eklemek için optimize edilmelidir tanımlama ve yeniden yapılandırmayı kolaylaştırmak için bazı hücresel yapılara zıt. Burada kullanılan protokol NCMIR standardı6'ya dayanmaktadır. Ek boyama genellikle ek protokol adımları anlamına gelir. Bu nedenle, cilt EM için, reaktiflerin numuneye nüfuz etmesi için yeterli zaman sağlamak için standart protokollerin genişletilmesi gerekir. Mikrodalga destekli işleme, boyama için gereken süreyi saatler dakikaya kadar azaltabilir ve hacim EM numune hazırlamayı daha verimli hale getirir7. Bu yöntem tüm hücre ve doku tipleri için geçerlidir8 ve doku homojenliği belirli bir alanın örnekleme yapar sorular araştırma için9.
Bir veri yığını elde edildikten sonra hizalanabilir ve ilgi yapıları verilerin geri kalanından bölümlere ayrılabilir ve 3D olarak modellenebilir. Birçok doku diliminin görüntülenmesinin otomasyonu görüntü edinimi nispeten basit hale getirse de, verileri dijital olarak yeniden yapılandırma ve görselleştirme süreci zaman alan bir görevdir. Bu amaçla yazılım henüz entegre veya tam otomatik değildir. Hacim EM kullanarak erken çalışma çok nöroloji yönelik olduğundan, aksonlar gibi yapıları boyama ve dijital olarak segmente etme teknikleri diğer hücre ve organellere göre oldukça gelişmiştir. Diğer nöronal olmayan dokular üzerinde literatür hızla büyürken, doğrusal olmayan veya düzensiz yapılar daha manuel giriş gerektirir.
Hem SBF-SEM hem de FIB-SEM'nin kullanılması, 3 Boyutlu olarak yüksek çözünürlükte spesifik, homojen olmayan doku yapılarını hedeflemek ve görüntülemek için yararlı bir yaklaşımdır. Büyük ölçüde örnek hazırlanması için gerekli süreyi azaltır mikrodalga destekli doku işleme ile birleştirerek. Birlikte bu iş akışı ince yapıların yüksek çözünürlüklü izotropik voxel görüntü veri setleri verimli ve daha hızlı bir süreç üretecek.
Protokol
1. Elektron mikroskobu için numune fiksasyonu ve işlenmesi
- Agar tabaklarında %0,5 paraformaldehit, 0,1 M fosfat tamponunda (PB) pH 6.8'de %2.5 glutaraldehit olarak yetiştirilen Arabidopsis thaliana fidelerini oda sıcaklığında 2 saat (RT) sabitle.
DİkKAT: Aldehitler tahriş edici ve aşındırıcıdır ve kanserojen, mutajenik ve teratojenik potansiyele sahiptir. Tüm çözümler uygun koruyucu ekipmanla ve duman kaputunda kullanılmalıdır. - Adım 1.1'de yetiştirilen bitkinin kök uçlarını kesin ve 4 °C'de aynı fiksatifi içeren 0,5 mL tüplere 2-3 uç koyun.
NOT: Bu ve kalan adımlardaki çözümlerin hacmi örnek hacmi ile belirlenir; çözeltiye numunenin minimum oranı 10:1'dir. Herhangi bir boyutta 1 mm'den büyük örneklerleke zor olacak, bu nedenle daha büyük doku blokları ile çalışmak daha zordur. Tüm dokular aynı özelliklere sahip değildir; örneğin, bitki yaprakları ve sapları leke zor olabilir. Daha büyük numuneler veya zor doku tipleri isteniyorsa, veri toplamaya geçmeden önce numune işlemenin optimizasyonu yapılmalıdır. - Thiocarbohydrazide (TCH) çözeltisini hazırlayın, gerekli taze ve adım 1.7 önce kullanılabilir. 10 mL çift distile suya 0,1 g thiocarbohydrazide ekleyin (ddH2O) ve fırında 60 °C'ye 1 saat ısıtılarak eritin. Kullanmadan önce, 0,22 μm şırınga filtresi kullanarak TCH çözeltisi filtreleyin.
- Tüplerden fiksatif çıkarın ve 0.1 M PB pH 6.8 ile değiştirin. Tüpleri 100 rpm'de orbital sallayarak masaya koyun ve 10 dk. Taze PBS kullanarak yıkamayı 5 kez tekrarlayın.
- PB'yi %2 osmiyum tetroksit (OsO 4)ve 0,1 M PB pH 6,8'de %0,2 rutenyum kırmızısı ile değiştirerek kök uçlarını düzeltin. Tüpleri kapakları açık mikrodalgaya koyun ve program 9'u başlatın (Tablo1).
DİkKAT: Osmiyum yutma durumunda son derece tehlikeli, inhalasyon durumunda çok tehlikeli ve cilt teması durumunda tehlikelidir. Her zaman uygun koruyucu ekipman kullanarak ve bir duman başlık içinde kolu.
NOT: Protokol boyunca, tüplerin kapakları mikrodalga adımları sırasında her zaman açıktır. - Kök uçlarını tezgahın üzerinde 5 dk ddH2O ile iki kez yıkayın. Üçüncü ve dördüncü ddH2O yıkama programı için 15 mikrodalga (Tablo1). İlk 40 saniyedddH2O yıkadıktan sonra, mikrodalgadan numune leri alın ve arabelleği taze ddH2O.
NOT: Arabellek yenilenmesi gerektiğinde mikrodalga bir alarm sesi çıkar. Vakum odası için kapağın her seferinde doğru şekilde değiştirildiğinden emin olun. - Daha önce hazırlanmış TCH çözeltisinde inkübasyon örnekleri tezgahta 2 dakika ve daha fazla kuluçka için mikrodalga programı 8 'i kullanabilmiştir (Tablo1). Tezgah ve mikrodalga arasında çözelti değiştirmeyin.
- 1.6 adımda açıklandığı gibi örnekleri yıkayın.
- Mikrodalga programı 9 (Tablo1)için ddH2O'da %1 OsO 4'e numune yerleştirin.
- 1.6 adımda açıklandığı gibi örnekleri yıkayın.
- Mikrodalga programı 16 kullanarak ddH2O'da %1 üranyal asetat (Tablo1)inkübat örnekleri.
DİkKAT: Uranyal asetat toksiktir, tahriş edicidir ve kanserojen, mutajenik ve teratojenik potansiyele sahiptir. Her zaman uygun koruyucu ekipman kullanarak kolu. - 1.6 adımda açıklandığı gibi örnekleri yıkayın.
- Walton'ın lider çözümlerini adım 1.14'te kullanıma hazırlayın. Önce 250 mL ddH2O'ya 0,998 g L-aspartik asit ekleyerek ve pH'ı 1 M KOH ile 3,8'e ayarlayarak L-aspartik asit in stoğu çözeltisi yapın. Daha sonra, 10 mL L-aspartik asit stok çözeltisinde 0,066 g kurşun nitratı çözün ve pH'ı 5,5'e ayarlayın. Çözeltiyi 60 °C'de 30 dk bekletin.
NOT: Hiçbir çökelti oluşmamalıdır. - Walton kurşun çözeltisi içinde kuluçka örnekleri 30 dakika fırında 60 °C.
- 1.6 adımda açıklandığı gibi örnekleri yıkayın.
- EtOH'daki dehidrat örnekleri %50, %70, ddH2O'da %90 ve %100 EtOH'da %2x dereceli adımlarla. Mikrodalga programı 10 (Tablo1) kullanın ve mikrodalga kullanıcılara her 40 s sonraki EtOH adımı ile çözüm yerine istenir. Bu mikrodalgada yapılan son adım.
- Tezgahtaki RT'de her biri 10 dakika boyunca %100 propilen oksit 2x daha fazla susuzluk, adımlar arasındaki çözeltinin yerini aşar.
NOT: Propilen oksit polistirenler gibi bazı plastikleri eritebilir; ya bu adım için cam şişeler veya direnç için ön test plastik kullanın.
DİkKAT: Propilen oksit son derece yanıcıdır. Her zaman uygun koruyucu ekipman kullanarak ve bir duman başlık içinde kolu. - % 50 Spurr'un reçinesini propilen oksitte (min 2 saat) kuluçkaya yatırarak kök uçlarının infiltrasyonuna başlayın.
DİkKAT: Mahmuz'un rezorne bileşenleri tahriş edicidir. Her zaman uygun koruyucu ekipman kullanarak ve bir duman başlık içinde kolu. - Çözeltiyi %100 Spurr's ile değiştirin ve bir gece boyunca RT'de bırakın.
- Taze 100% Spurr's rezorin 2 kez (min 2 saat kuluçka) değiştirin.
- Numuneleri yine taze %100 Spurr reçine içeren bir katıştırma kalıbına yerleştirin ve 65 °C'de 36−48 saat boyunca polimerize edin.
NOT: Kullanılan katıştırma kalıbı doku tipine ve görüntülemede kullanılan yaklaşıma bağlıdır. Burada düz silikon gömme kalıbı kullanılmıştır (Şekil 1A).
2. Gömülü örnekleri görüntüleme için hazırlama
- Fırından numuneleri çıkarın, katıştırma kalıbından reçiyiyi çıkarın (Şekil 1B).
- Jilet kullanarak, numuneyi kabaca maksimum 0,5 mm x 0,5 mm x 0,5 mm (Şekil1C)bloğuna kırpın.
NOT: SBF-SEM'de şarj olmayı önlemek için, mümkün olduğunca çok çıplak rezorni kesmek ve numuneyi mümkün olduğunca düz/ince yapmak önemlidir. İdeal olarak bloğun her tarafında zaten doku içerir, ama en önemlisi metal pin bağlı olacak yan (adım 2.3 bakınız) doku iletken metal ile doğrudan temas böylece maruz doku içermelidir. - Yabancı reçineden numuneyi çıkarın ve iletken epoksi reçine ile metal bir iğneye (Şekil1D)takın, dokunun bir kısmının metal iğneye değdiğinden emin olun. Epoksi kürü bir gecede fırında 65 °C'de bırakın.
NOT: SB-SEM'deki sahnenin hareketi sınırlı olduğundan, numunenin pimin ortasına yerleştirdiğinden emin olun. Çok küçük rezorin kaplı numunesini ekstra rezorinden çıkarmak zor olabilir, çünkü küçük numune ayrılırken uçup gitmek zorunda kalacaktır. Bunun için basit ve etkili bir çözüm referans1ek film gösterildiği gibi parafin film bir levha ile örnek kapsayacak. - Ultramikrotom için taşıyıcıyı tutucuya sabitle. Herhangi bir aşırı epoksi kaldırmak için bir jilet kullanın ve bir piramit oluşturan, bloğun yüz ve yan pürüzsüz ultramicrotome ve elmas bıçak kullanın. En azından bazı dokuzaten blok yüz maruz olduğundan emin olun.
NOT: Elmas bıçak kullanmanın ekstra adımı isteğe bağlıdır ancak sbf-SEM'de elde edilen bloğun yaklaşmasını kolaylaştırır, çünkü bloğun yüzündeki bıçağın gölgesi daha net olur ve böylece bıçak ve blok yüz arasındaki mesafeyi tahmin etmeyi daha kolay belirler. - Kesilmiş numune bloğunu sputter kaplamaya yerleştirin ve numuneyi ince bir tabaka (2−5 nm) platin (Pt) ile kaplayın.
NOT: Blok yüzündeki platin, SBF-SEM'deki yaklaşım sırasında kesilecektir (aşağıya bakınız), ancak piramidin yan tarafındaki platin ek iletkenlik sağlayacaktır. Bu örnekte platin ile kaplanmış, ancak altın veya altın/ paladyum da etkilidir; ancak, altın ile kaplama bir görüntüleme çalışması sırasında blok yüzünde artan enkaz sonuçlandı.
3. SBF-SEM'de Görüntüleme
- Taşıyıcıyı SBF-SEM mikroskobuna yerleştirin ve bıçağı numune yüzeyine yaklaştırın. Pt tabakası zaten kaldırılmış ve doku en azından bir parçası maruz böylece örneğin üst kısmı kapalı elmas bıçak döşeme kullanarak.
NOT: Bu işlem her SBF-SEM mikroskobu için farklı olduğundan, burada her adım belirtilmemiştir. Numune yüzeyi Pt'den arınmadı ve görüntülemeye hazır olduğu sürece, sonraki adımlar mümkün olacaktır. - Düşük çözünürlükte ve kısa çalışma zamanlarında görüntülemeye başlayın ve numunenin genel görünümünü elde edin ve ilgi çekici bir bölge bulun (Şekil 1E).
NOT: Burada, sahne nin hızlı taranması ve konumlandırılması için 512 x 512 piksel ve 1 μs çalışma süresi, görüntüleme penceresinin optimizasyonu ve odağın ayarlanması için 2.000 x 2.000 piksel kullanılmıştır. - 80−100 pA'lık bir akımda 1.5-2.0 kV hızlanan voltaj kullanarak, dokunun bir görüntüsünü yakalayın.
NOT: Burada gösterilen örnek, çok örneke bağlı olan şarjı en aza indirmek için ışın akımının ayarlanması gereken yüksek bir vakum sisteminde görüntülenmiştir. Tipik olarak, elektron ışını 1,5−2.0 kV olarak ayarlanır, ancak bu örneke bağımlı olacaktır. Daha yüksek büyütmelerde (genellikle > 10.000x) rezorin düzgün kesiti garanti etmek için ışından çok fazla etkilenir, bu nedenle piksel boyutu 8.000−10.000 x 8.000−10.000 piksel lik bir görüntü boyutunda 8−20 nm olarak ayarlanır ve 430' a karşılık gelen büyütmeler ile – Sırasıyla 64 x 64 mm ve 200 x 200 mm'lik 1.400 x ve alan boyutları. - İlgi çekici bir bölge belirleyin ve arka daki dağınık elektron dedektörünü kullanarak ilgi hacmini karşılamak ve görüntüleme koşusunu başlatmak için kaç bölüme ihtiyaç duyulduğuna karar verin.
NOT: Burada sunulan örnekte, 80 nm'nin 500 bölümü 10 nm piksel ve 10.000 x 10.000 piksel görüntü (1 μs) olarak görüntülenmiştir. Mikroskop 1.6 kV ve 100 pA olarak ayarlandı. Genel olarak, kesit sayısı yg'nin numune ve boyutuna bağlıdır ve 100 s ile 1.000 s arasında art arda bölümler arasında değişebilir. Ortaya çıkan veri kümesi her bölümün tek görüntülerinden oluşur. Bu görüntülerin 3B yığına dönüştürülmesi gerekir.
4. SBF-SEM veri işleme
- Fiji'yi kullanarak, dosya alma-görüntü dizisini seçin ve görüntüleri yüklemek için görüntü yığınını bulun. Veri kümesinin boyutuna bağlı olarak, 'sanal yığını kullan' kutusunu işaretleyin.
NOT: Veri kümesi gerçekten büyükse, önce 8 bit (16 bit olarak toplanırsa) ve gerekirse uygulanabilir bir boyuta sahip olana kadar verileri depolayın. - Görüntünün altındaki yürüt düğmesini kullanarak görüntüleme çalışmasının başarılı olup olmadığını görmek için veri setinde ilerleyin. SBF-SEM için, blok yüzünde ki bıçaktan düşen, çıplak rekarne alanlarında şarj olan, bıçağın artefaktlarını (görüntüdeki yatay çizgiler) kesen bölümler gibi tipik görüntüleme eserlerini kontrol edin.
- Komut görüntü özelliklerini kullanarak çalışma sırasında kullanılan piksel boyutunu ve voxel derinliğini (yani, kesit kalınlığı) ayarlayın. Veriler zaten binned ise, bunu dikkate alın.
- Verileri kaydetmek için SIFT ile komut eklentileri-kayıt-doğrusal yığın hizalama kullanma.
NOT: SBF-SEM verilerinin kaydedilmesi gereklidir, çünkü görüntüleme sırasında numunenin şarj edilmesi veya sürüklenmesi nedeniyle hafif bir örnek hareketi olabilir. Bu XY sadece minimal bir hareket olduğundan, sadece çeviri gereklidir. - Veri kümesinde kaydırarak hizalamayı kontrol edin ve Tamam ise hizalanmış veri kümesini 3D-tif dosyası olarak kaydetmek için dosya menüsünün altındaki kaydet komutunu kullanın.
- Yatırım getirisi nin dahil olup olmadığını ve biyolojik soru için gerekli bilgileri içerip içermediğini görmek için veri kümesini dikkatle analiz edin. Yığının son görüntüsünde (= geçerli blok yüzü), FIB-SEM görüntüleme için yeni bir ygiçin seçin.
NOT: Geçerli blok yüzünde FIB-SEM görüntüleme için iyi bir bölge yoksa, yG görünene kadar bloktan (hala SBF-SEM'de olan) daha fazla kesit kesilebilir. FIB ile görüntülenebilen ses düzeyinin bir sınırı vardır. SBF-SEM görüntüsündeki yg 30-40 μm x 15-20 m X,Y maksimum olabilir.
5. FIB-SEM'de Görüntüleme
- SBF-SEM'deki numunenin genel görüntülerini alın, ideal olarak fib-SEM'de tanınabilir olan numunenin bir veya daha fazla kenarı da dahil olmak üzere (Şekil2A,C).
NOT: Bu örnekte SBF-SEM genel bakış görüntüleri 10 nm piksel boyutunda, 8.000 x 8.000 piksel 1 μs çalışma süresi nde alınmıştır. Mikroskop hala 1.6 kV ve 100 pA olarak belirlenmiştir. - Örneği SBF-SEM'den çıkarın ve püskürtücü kaplamaya yerleştirin. FIB-SEM görüntüleme için numuneyi ≥20 nm platinle kaplar.
- FiB-SEM'e numune yükleyin ve 15 kV'da ikincil elektron dedektörü kullanarak, 1 nA blok yüzünde SBF-SEM'de tanımlanan YG'yi bulur (Şekil 2B,D).
NOT: Platin kaplamayı görmek için 15 kV'da görüntüleme gereklidir. - Örnekteki Yatırım Getirisini, sahneyi hareket ettirerek ve yatırarak FIB ve SEM ışınlarının tesadüf noktasına getirin (Şekil3A).
NOT: FIB sütunu genellikle bir açının altına monte edilir (Şekil 3A). Bu, herhangi bir numunenin görüntülenecek ve kesilecek yüzeyin FIB ışınına paralel olarak konumlandırılacak şekilde eğilmesi gerektiği anlamına gelir. Görüntülenecek yüzey artık SEM ışınına göre eğimlidir ve SEM Yatırım Getirisi'ni görüntüleyemeden önce bir doku siperinin kaldırılması gerekir (Şekil3E) - FIB ışını ve gaz enjeksiyon sistemini kullanarak, yatırım getirisinin üzerinde yüzeye 1 mm'lik koruyucu platin tabakası koyun (Şekil3C). Daha sonra, düşük frezeleme akımı (50-100 pA) kullanarak, görüntüleme çalışması sırasında otomatik odaklama ve 3D izleme için platin birikimine ince çizgiler imal edin (Şekil3D). FIB kolon ve karbon gaz enjektörü kullanarak, karbon birikimi ile bu hatları kaplayın.
NOT: Buradaki Yatırım Getirisi'nin boyutu SBF-SEM görüntüsündeki Yatırım Getirisi boyutuna karşılık gelir ve maksimum boyut 30-40 μm x 15-20 m olabilir. Bu örnekte 17 μm x 8 m'lik bir Yatırım Getirisi görüntülendi. Hatların korunması ve otomatik odaklama için ideal olan karbon ve platin arasında siyah-beyaz bir kontrast oluşturmak için karbon birikimi gereklidir. Her adım için kullanılan frezeleme akımları Tablo2'de bulunabilir. - Yüksek frezeleme akımı kullanarak, Yatırım Getirisi'nin önünde 30 μm'lik bir açma zonklayarak SEM ışını için görüntüleme yüzeyi oluşturur (Şekil3E).
NOT: FIB ışını doğal olarak yıkıcıdır, yüksek akımlarda daha da fazladır. YG'deki rezorin erimesini önlemek için görüntülemeyi en az yüksek akımlarda ve düşük büyütme ve hızlı tazyik hızlarında görüntülemeye devam edin. - Görüntüleme çalışması sırasında kullanılan akıma daha yakın bir frezeleme akımı ile görüntüleme yüzeyini düzleştirin. Tüm otomatik odaklama ve 3B izleme işaretleri görüntüleme yüzeyinde açıkça görünürolduğunda parlatma yı durdurun (Şekil3F). FIB'nin ilerlemesini, parlatma sırasında yüzeyin EM (arka da dağınık elektron dedektörü kullanılarak) görüntülenmesi ile izlenebilir.
- Yeni oluşturulan yüzeyde görüntülenecek alanı belirleyin ve görüntüleme parametrelerini ayarlayın. Elektron ışınının yüzeye odaklandığından emin olun, parlaklık ve kontrast ayarlayın ve piksel boyutunu ve kesit kalınlığını ayarlayın. Çalışma süresini ve çizgi ortalamasını ayarlayarak görüntüleme süresini 1 dakikanın altında tutun.
NOT: Elektron ışını ile görüntüleme için düşük voltaj kullanmak önemlidir ve bu da sadece blok yüzeyinin görüntülenmesini sağlar (örn. numunenin derinliklerinden hiçbir elektron görüntülenmez). Bu, gerilimin 2 kV'un altında tutulması ve ızgara gerilimi olan arka dağınık elektron dedektörü kullanılarak yapılır ve sadece yüksek enerjili elektronların görüntülenebilmelidir. Bu örnekte, elektron ışını 1.5 kV ve 1 nA olarak ayarlanmış, arka daki dağınık elektron dedektörü üzerinde 1.2 kV'luk bir ızgara gerilimi ile ayarlanmıştır. Ayrıca burada, 5 nm piksel boyutunda bir piksel boyutu nda 5nm bölümleri ile iotropik voxels ile bir dataset neden kullanılmıştır. 17 μm x 10 μm'lik bir alan 6,5 μs çalışma süresi ve 1,0 çizgi ortalaması ile görüntülendi. - Görüntüleme için kullanılan aynı piksel boyutunu, çalışma süresini ve çizgi ortalamasını kullanarak otomatik ayarlama ve 3B izleme için pencereleri ayarlayın.
NOT: Bu işlem farklı sistemler için farklı olacaktır, bu nedenle farklı eylemler belirtilmeden yalnızca adım belirtilir. - Görüntüleme çalışmasını başlatın ve ilk 50−100 kesitte sürecin stabilitesini izleyin. Sistem sorunsuz bir şekilde çalışmaya başladığında, odadan ayrılın ve odada mümkün olduğunca az rahatsızlık olduğundan emin olun.
NOT: Çalıştırma süresi ve bölüm sayısı YG'nin boyutuna ve kesit kalınlığına bağlıdır. FIB-SEM'de Z ekseni aslında SBF-SEM görüntüsündeki yatırım getirisi kutusunun yüksekliğidir (maksimum 15−20 μm; Şekil 3E). - FIB-SEM verilerini, SBF-SEM verileri için yukarıda açıklandığı şekilde kaydedin.
Sonuçlar
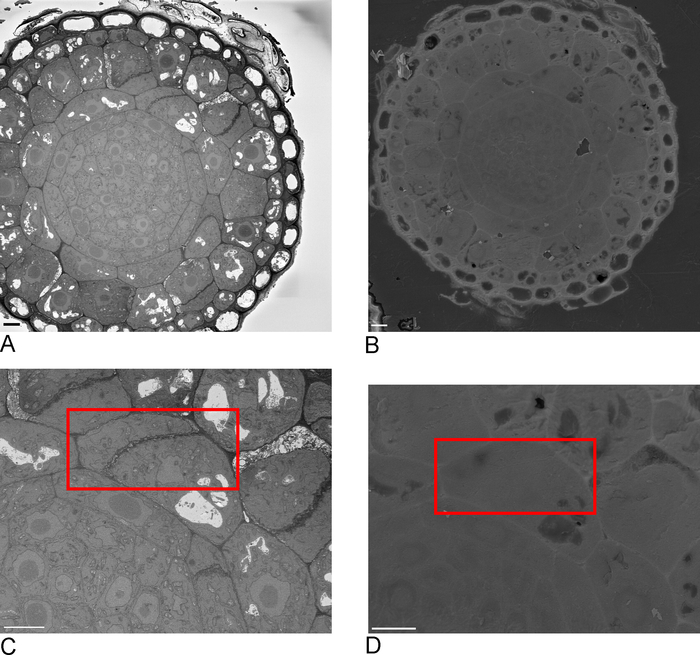
SBF-SEM'den alınan görüntüler, hücrelerin ve hücreler arası bağlantıların uzamsal yönelimine ışık tarak dokuya genel bir bakış sağlar (Şekil4A). SBF-SEM çalışmasının incelenmesinden sonra genellikle belirlenen bir ilgi bölgesi olan yeni bir bölgede sonraki FIB-SEM görüntüleme, belirli hücrelerin ve/veya yapıların yüksek çözünürlüklü ayrıntılarını ekler (Şekil4B).
Şekil 4C ,D, SBF-SEM verilerinin (Şekil4C)ve izotropik voksel FIB-SEM verilerinin izotropik olmayan voksellerinin işlenmesindeki farkı göstermektedir (Şekil 4D). SBF-SEM'de kullanılan z kalınlığı, işlemenin bölümleri açıkça gösterdiği ve yüzeyde 'merdiven' etkisi ne kadar etkili olduğu anlamına gelir. FIB-SEM verilerinde 5 nm'lik kesit, işlemenin çok daha düzgün görünmesini ve tek tek bölümlerin yüzeye tamamen karışmasını sağlar.
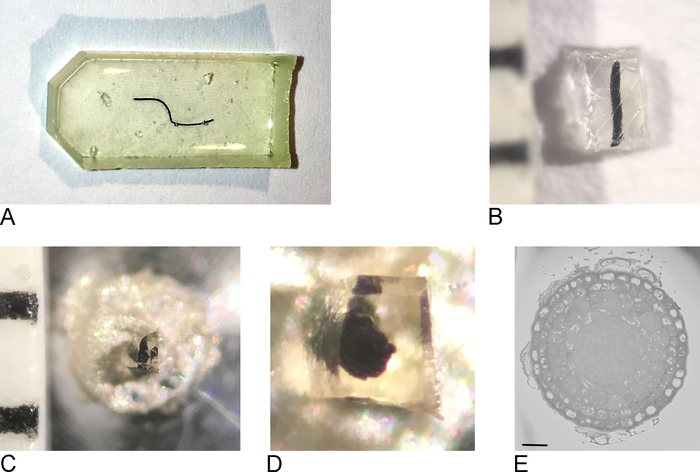
Şekil 1: Rezorin gömülü bir örnekten blok yüzünün oluşturulması. (A) Rezorne gömülü bir kök ucu. (B) Jilet kullanılarak fazla resenin 0,5 mm 2'lik bir blok kalana kadar kesilir. (C,D) Kesilmiş blok metal bir iğne üzerine yapıştırılmış ve fırında bir gece sonra, blok kenarları kesilmiş ve yüzey bir ultramicrotome kullanarak bir elmas bıçak ile düzeltilir. (E) SBF-SEM içinde, örnek blokyüz ve YG tanınabilir, ölçek çubuğu = 20 μm yönlendirilir.
Şekil 2: SBF-SEM ve FIB-SEM arasındaki korelasyon. SBF-SEM(A) ve FIB-SEM (B), ölçekçubuğu = 5 μm.(C,D) Yatırım Getirisini yakınlaştırarak blok yüzün genel görüntüleri. Kırmızı kutu FIB-SEM, ölçek çubuğu = 5 μm ile görüntülenecek bölgeyi besler.
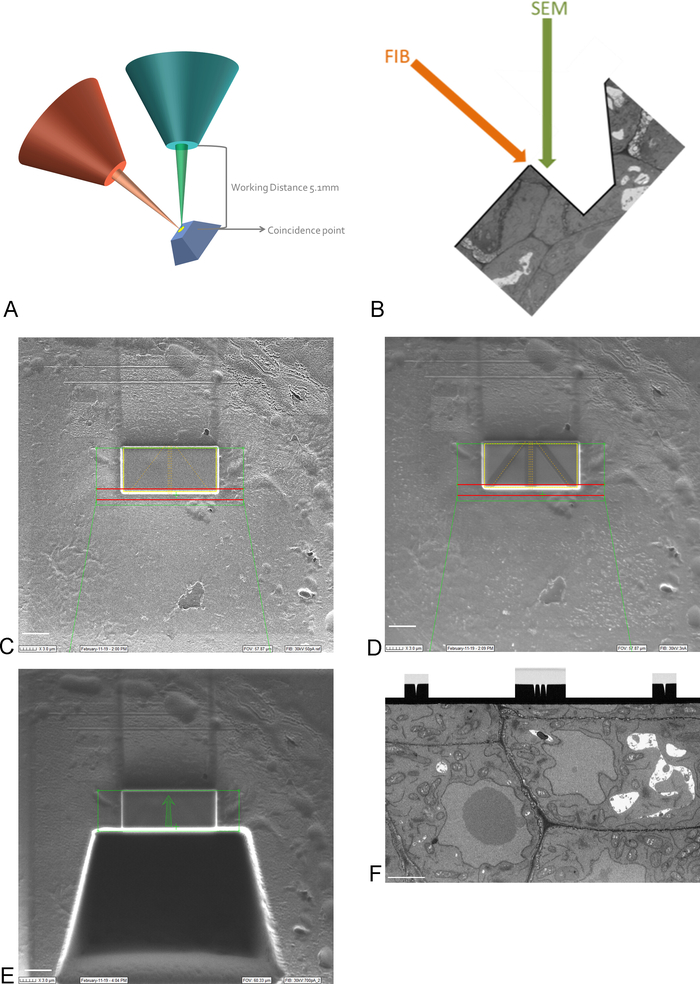
Şekil 3: FIB-SEM şeması ve hazırlama adımları. (A) FIB ışınının yönünü, SEM ışınını ve numunesini gösteren şema. Numunenin, aynı bölgede değirmen ve görüntü görebilmesi için FIB ve SEM ışınlarının tesadüf noktasına yerleştirilmesi gerekir. (B) FIB tarafından çıkarılan bölümlerin SEM görüntülemesi için gerekli siperin şematik çizimi. (C) Yatırım getirisiüzerinde Platin birikimi gösteren FIB ışını ile çekilen görüntü, ölçek çubuğu 5 μm. (D) Otomatik odaklama ve 3D izleme için kullanılan çizgileri gösteren FIB ışını ile çekilen görüntü. Ortadaki çizgiler otomatik odaklama için kullanılır ve dış hatlar 3B izleme sağlar. Çizgilerin üzerine karbon birikimi bu görevleri gerçekleştirmek için gerekli kontrastı (platin vs karbon) sağlar, scalebar 5 μm. (E) Siperfret frezeleme sonra FIB Kiriş ile çekilen görüntü, scalebar 5 μm. (F) Görüntü gösteren SEM Kiriş ile alınan FIB-SEM çalışması sırasında görüntülenen ilgi bölgesi, ölçek çubuğu 2 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
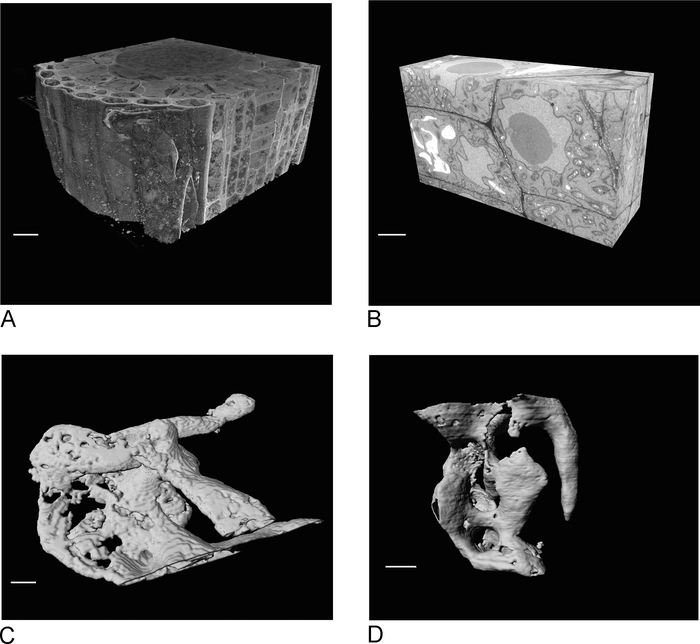
Şekil 4: SBF-SEM ve FIB-SEM segmentasyon öncesi ve sonrası sonuçları. (A) SBF-SEM veri setinin 3B görünümü (100 x 100 x 40 μm, ölçek çubuğu = 10 μm), (B) FIB-SEM veri setinin 3B görünümü (17 x 10 x 5,4 μm, ölçek çubuğu = 2 μm), (C ) Eşik, ölçek çubuğu = 2 μm D parçalı granüller tarafından SBF-SEM verilerinden segmente edilmiş render vacuoles. eşik, ölçek çubuğu = 2 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Mikrodalga İşleme Protokolü | |||||||||
| Program # | Açıklama | Kullanıcı İstemi (a/kapalı) | Zaman (hr:min:sn) | Güç (Watt) | Sıcaklık (°C) | Yük Soğutucusu (kapalı/otomatik/açma) | Vakum/Kabarcık Pompası (kapalı/bubb/vac döngüsü/vac açık/vap) | Sabit Sıcaklık | |
| Pompa (a/kapalı) | Sıcaklık (°C) | ||||||||
| 8 | Tch | KAPALI | 0:01:00 | 150 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 |
| KAPALI | 0:01:00 | 0 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:01:00 | 150 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| 9 | Osmiyum | KAPALI | 0:02:00 | 100 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 |
| KAPALI | 0:02:00 | 0 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:02:00 | 100 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:02:00 | 0 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:02:00 | 100 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| 10 | %50 EtOH | -ını | 0:00:40 | 150 | 50 | KAPALI | KAPALI | -ını | 30 |
| %70 EtOH | -ını | 0:00:40 | 150 | 50 | KAPALI | KAPALI | -ını | 30 | |
| %90 EtOH | -ını | 0:00:40 | 150 | 50 | KAPALI | KAPALI | -ını | 30 | |
| %100 EtOH | -ını | 0:00:40 | 150 | 50 | KAPALI | KAPALI | -ını | 30 | |
| %100 EtOH | -ını | 0:00:40 | 150 | 50 | KAPALI | KAPALI | -ını | 30 | |
| 15 | 0.1M CACODYLATE | -ını | 0:00:40 | 250 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 |
| 0.1M CACODYLATE | -ını | 0:00:40 | 250 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | |
| 15 | ddH2O | -ını | 0:00:40 | 250 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 |
| ddH2O | -ını | 0:00:40 | 250 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | |
| 16 | Uranyl Asetat | KAPALI | 0:01:00 | 150 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 |
| KAPALI | 0:01:00 | 0 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:01:00 | 150 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:01:00 | 0 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:01:00 | 150 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:01:00 | 0 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
| KAPALI | 0:01:00 | 150 | 50 | KAPALI | VAKUM DÖNGÜSÜ | -ını | 30 | ||
Tablo 1. Mikrodalga işleme için ayrıntılı protokol.
| Adım | Şu anki | Tahmini Süre |
| İfade Platin | 3n A | 10-15 dakika |
| Frezeleme Autotune ve İzleme İşaretleri | 50-100 pA | 4-6 dakika |
| Biriktirme Karbon | 3 nA | 5-10 dakika |
| Frezeleme Kaba Açması | 15-30 nA | 30-50 dakika |
| Parlatma Yüzeyi | 1.5-3 nA | 15-20 dakika |
| Görüntüleme Çalıştır | 700 pA-1.5 nA | Saatler-gün |
Tablo 2. Numune hazırlama ve görüntüleme çalışması için kullanılan FIB frezeleme akımları
Tartışmalar
Hacim elektron mikroskobu geleneksel SEM veya TEM'den daha zorlu ve zaman alıcıdır. Dokuların veya hücrelerin bloğa boyanması gerektiğinden, işleme adımları reaktiflerin numune boyunca penetrasyonunu sağlayacak kadar uzun olmalıdır. Penetrasyonu kolaylaştırmak için mikrodalga enerjisinin kullanılması daha kısa ve daha verimli bir işleme sağlar ve boyamayı iyileştirir. EM'e hazırlık ışık mikroskobundan çok daha sıkı olduğundan tüm çözümler ve reaktifler kalite kontrollü olmalıdır. pH değişiklikleri, tonicity, kirli reaktiflerin kullanımı, ve kötü teknik nedeniyle kirleticilerin giriş tüm son görüntü üzerinde zararlı etkileri olabilir.
Birim EM ayrıca her farklı örnek türü için ayrı ayrı uyarlanmış protokoller gerektirir. Farklı türde Memeli dokuları: bitkiler, maya gibi tek hücreler, tripanozos, C. elegans,vb, tüm optimal sonuçlar elde etmek için kendi varyasyonları gerekir. Fiksasyon ve boyama, yapısal bütünlüğü koruyacak ve numuneyi in vivo morfolojisine mümkün olduğunca yakın tutacak şekilde tasarlanmalıdır. Fizyolojik sıcaklık, pH ve tonitlik dokuların fiksasyonu, numunenin olabildiğince yaşam benzeri olması için çok önemlidir. Örneklerin yüksek basınçlı donma (HPF) daha yaşam sallayıcı bir durum korumak için yardımcı olabilir, (ya da belki de sadece farklı eserler verim), ama hücreler ve çok ince dokular dışında HPF vitreus buz sadece küçük hacimlerde oluşturulabilir gibi başarısız olacaktır. Bu nedenle birçok soru için kimyasal fiksasyon tek seçenektir. Fiksasyon HPF veya kimyasal olursa olsun, herhangi bir EM deneyinde yapısal sonuçların canlı hücre veya doku görüntülemesinden elde edilen benzer sonuçlarla karşılaştırılmak gerekir. Yanıtlanması gereken özel soru ve dijital görüntülerin görselleştirilmesi için kullanılacak protokol göz önünde bulundurularak boyama da optimize edilmelidir.
Hem SBF-SEM hem de FIB sistemine yakın olması birçok deneyde büyük bir avantajdır. Geniş görüş alanı ve SBF-SEM'in yüksek X,Y çözünürlüğü, tek tek yapıları/hücreleri/olayları bulmayı kolaylaştırır ve dokudaki hücrelerin genel mekansal yönünü sağlar. Buna ek olarak, Z'deki bir örneklem aracılığıyla görüntülemeye izin verebilme yeteneği çok güçlüdür; ancak, ince geometrik detay gerektiren rekonstrüksiyonlar başarısız olabilir veya ürettiği non-izotropik voxels nedeniyle bu tekniği kullanarak eserler üretmek. FIB daha küçük bir görüntüleme alanı için sürecin fizik ile sınırlıdır ama 3D çözünürlük çok doğru rekonstrüksiyonlar için yeterlidir. Örnekler daha fazla işleme veya hazırlık olmadan SBF-SEM'den FIB'e geçebildiği için, iki tekniği birleştirmek kolaydır. Belirli bir alanı bulmak için bir örnek üzerinde arama yapmak için SBF-SEM'i kullanmanın çok daha yetenekli bir aracın çok pahalı bir kullanımı olduğunu kabul ediyoruz. Ancak, yeni blockface'i hemen görebilme ve Yatırım Getirisi'ne ulaşılıp ulaşılmadığını belirleme becerisi büyük bir avantajdır. Ayrıca, seri yarı ince (0,5 μm) LM kesitlerin algılanmadan önce kaldırılması ve kesilmesi, ızgaraya konması ve daha sonra eşit derecede pahalı TEM'de görüntülenmesi gereken tek TEM kesitleri kullanılarak bir bloğun incelenmesi alternatifleri, sunulan yöntem olarak verimlidir.
Verileri segmente etmek ve işlemek için birçok program bulunduğundan ve belirli bir yapının gereksinimleri tek bir uygulama tarafından en iyi şekilde sunulmayabileceğinden, standart iş akışı önerilemeyebilir. Bazı basit yapılar, çok dar gri ölçek değerlerine denk kalıyorsa, bir eşik algoritması ile bölümlere ayrılabilir. Nöronal yapılar Ilastik11 gibi bir program kullanılarak yarı otomatik olarak segmente edilebilir ancak ER gibi daha rastgele veya karmaşık şekilli organellerde daha az yararlı olacaktır. Mikroskopi Görüntü Tarayıcı, hizalamak, segment ve hacim EM verileri işlemek çok esnek bir programdır, ancak önemli kullanıcı etkileşimi gerektirir12. Genel bir kural olarak, sonuçları dijital olarak görselleştirmek için gereken süre, numune ve görüntülemenin hazırlanması için gereken süreyi büyük ölçüde alacaktır.
Hacim EM teknikleri ultrastrüktise analizin üçüncü boyutunu açmıştır. 3D EM elde diğer yöntemler hacmi (TEM tomografi) veya bunların verimliliği (seri bölümü TEM) sınırlamaları vardır. Çoğunlukla hacimli EM teknikleri bireysel laboratuvarlarda uygulanamayacak kadar karmaşık ve maliyetli olsa da, bunları sunan ortak çekirdek tesislerin sayısı artmakta ve başarılı bir şekilde görüntülenen numune türlerinin sayısı hızla artmıştır. Belirli bir soru ve belirli bir doku olanlar için birisi hazırlık ve görüntüleme konusunda tavsiye ve talimatlar sunmak mümkün olacak muhtemeldir. Hacim EM donanımı, SBF-SEM'deki daha büyük numuneleri işleme kapasitesini ve FIB ile daha büyük ROI'ları frezeleme kapasitesini içerecek şekilde geliştirilebilir. İlgi yapılarını daha otomatik bir şekilde bölümlere ayırabilen yazılım, verileri analiz etme sürecini büyük ölçüde basitleştirecek ve bilgi işlem hızındaki iyileştirmeler bunu yapmak için gereken süreyi azaltacaktır. Mevcut sınırlamalarına rağmen, hacim EM hala yararlı bir araçtır ve SBF-SEM ve FIB-SEM'i birleştirmek, nadir olayları tanımlamak ve bunları yüksek çözünürlükte görüntülemek için verimli bir iş akışı sağlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Cilt EM için ekipman Flanders Hükümeti cömert bir hibe ile sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
Referanslar
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır