Method Article
إثراء جزيئات البروتين الدهني الأصلي مع ميكرورنا والتحديد اللاحق لمحتوياتها المطلقة/النسبية ميكرورنا ومعدل نقلها الخلوي
In This Article
Summary
هنا ، يتم تقديم الكمية في الوقت الحقيقي البلمره سلسله البروتوكول القائم علي رد الفعل لتحديد محتوي الحمض الريبي الصغير الأصلي (المطلق/النسبي) من جزيئات البروتين الدهني. الاضافه إلى ذلك ، يتم إثبات طريقه لزيادة مستوي الحمض الريبي الصغير ، فضلا عن طريقه لتحديد معدل امتصاص جزيئات الخلايا الدهنية.
Abstract
جزيئات البروتين الدهني هي في الغالب ناقلات الدهون والكوليسترول في مجري الدم. وعلاوة علي ذلك ، فانها تحتوي علي كميات صغيره من خيوط الميكرورنا غير الترميز (ميرنا). بشكل عام ، ميرنا يغير الملف الشخصي التعبير عن البروتين بسبب التفاعلات مع رسول الحمض الريبي النيبالي (mRNA). التالي ، فان معرفه محتوي ميرنا النسبي والمطلق لجزيئات البروتين الدهني ضرورية لتقدير التاثير البيولوجي لامتصاص الجسيمات الخلوية. وهنا ، يتم تقديم البروتوكول القائم علي تفاعل البلمره المتسلسل في الوقت الحقيقي (qPCR) لتحديد محتوي ميرنا المطلق لجزيئات البروتين الدهني — الذي يظهر لجزيئات البروتين الدهني الاصليه والمخصبة من ميرنا. يتم قياس محتوي ميرنا النسبي باستخدام بطاقات صفيف ميكروفلويدريك متعددة الآبار. وعلاوة علي ذلك ، يسمح هذا البروتوكول العلماء لتقدير ميرنا الخلوية ، التالي ، معدل امتصاص جزيئات البروتين الدهني. وهناك زيادة كبيره في مستوي ميرنا الخلوية يمكن ملاحظتها عند استخدام البروتينات الدهنية عاليه الكثافة (HDL) جزيئات محمله بشكل مصطنع مع ميرنا ، في حين ان الحضانة مع جزيئات HDL الاصليه لا تعطي تاثيرا كبيرا بسبب محتواها منخفضه نسبيا ميرنا. وعلي النقيض من ذلك ، فان الامتصاص الخلوي لجزيئات البروتين الدهني منخفض الكثافة (LDL)-لا مع ميرنا الاصليه ولا محمله بشكل مصطنع معها-لم يغير مستوي ميرنا الخلوي.
Introduction
تتكون جزيئات البروتين الدهني من طبقه أحاديه من الدهون البرمائية والكوليسترول الذي يضم نواه من استرات الكوليستيرول ودهون الدهون الثلاثية. يتم تثبيت الجسيمات بأكملها بواسطة شحمي الاغشيه المضمنة ، والتي تحدد الوظائف البيولوجية للجسيمات. يمكن تمييز جزيئات البروتين الدهني وفقا لكثافتها المتزايدة ، التالي ، إنقاص الحجم ، وهي بروتين دهني منخفض الكثافة جدا (VLDL) ، وبروتين دهني متوسط الكثافة (IDL) ، و LDL ، وجسيمات HDL. علي الرغم من نقل مكونات المياه غير القابلة للذوبان في مجري الدم ، فقد ثبت ان الجسيمات HDL تحمل خيوط غير الترميز من ميرنا1،2. [ميكرو-رناس] صنف من قصيرة (عاده اثنان اثنا عشر [نوبوتيدس]) [رنا] فروع, اي يتحلل اينتراسيلولارلي متممه [مرنا] خيوط و, بذلك, يغير التعبير تشكيل من بعض بروتينات3,4,5, 6- وعلاوة علي ذلك ، تم العثور علي تعديلات الملف الشخصي ميرنا في مجموعه متنوعة من الامراض ، التالي ، يتم تطبيق الشخصية كمؤشر حيوي للتشخيص والتشخيص. النقل خارج الخلية من miRNAs بين الخلايا عن طريق جزيئات البروتين الدهني قد تكون بمثابه اليه اضافيه لتحوير مستوي mRNA البينية. للتقدير الكمي للتاثير البيولوجي ، هناك حاجه إلى المعرفة فيما يتعلق بمحتوي ميرنا المطلق والنسبي لجزيئات البروتين الدهني.
الكمية PCR في الوقت الحقيقي هو وسيله مناسبه وسريعة نسبيا للحصول علي هذه المعلومات. التالي ، يمكن حساب قيمه القياس الكمي النسبي (RQ) ، والاختلافات النسبية بين العينات المختلفة وكسور البروتين الدهني التي تقدر بثمن. بطاقات صفيف ميكروفلويدريك المتعددة هي طريقه سريعة وسهله الاستخدام لتحديد الوجود النسبي (يعادل قيمه RQ) miRNAs في عينه. Multiwell بطاقات صفيف ميكروفلويديك تتكون من 96 أو 384 غرف التفاعل الفردية لردود الفعل الفردية qpcr جزءا لا يتجزا من جهاز ميكروفلويديك. تحتوي كل غرفه علي مسبار التحلل المائي المطلوب والإشعال الخاصة qPCR لواحد ميرنا الفردية. المزايا هي وقت المناولة القصيرة بسبب التوحيد القياسي ، وسير العمل بسيطه ، وانخفاض عدد الخطوات الأنابيب. وعلاوة علي ذلك ، يتم تصغير حجم العينة المطلوبة. وعلي النقيض من القياس الكمي النسبي ، فان محتوي ميرنا المطلق يتطلب مقارنه لنتائج عينه qPCR مع المنحنيات القياسية للأرقام المطلقة المعروفة لخيوط ميرنا. وتجدر الاشاره إلى انه نظرا لمحتوي ميرنا منخفض نسبيا ، ومعيار ، وعلاوة علي ذلك ، حتى واحده جزيء تقنيات التصوير الحساسة ليست ممكنة-الإثراء الاصطناعي لجزيئات البروتين الدهني مع ميرنا أمر حتمي لدراسة الخلوية تفاعل جسيمات البروتين الدهني ونقل ميرنا. وفيما يتعلق بهذا الأمر ، فان الفصل بين الجسيمات الحميدة يتبع مع البعد اللاحق7 يسمح بإدماج و ، التالي ، إثراء مع خيوط ميرنا. إثراء مماثله للجسيمات LDL مع ميرنا غير ممكن بسبب هيدروفوبيسيتي من البروتين apoB-100 ، وهو المكون الرئيسي للجسيمات LDL. ومع ذلك ، بالاضافه إلى القطب المذيب ثنائي ميثيل سولفوكسيد (DMSO) ، والتي هي قادره علي اختراق اغشيه الدهون ، يمكن تحميل جزيئات LDL بشكل مصطنع مع خيوط ميرنا كذلك.
عاليه السرعة المجهرية القوه الذرية (HS-فؤاد) هو أداه قويه لتوصيف العينات البيولوجية التي تقدم subnanometer المكانية والقرار الزمانيه subsecond8. التالي ، فانه هو تقنيه مناسبه تماما لمراقبه الجودة من جزيئات البروتين الدهني المعدلة كما الأصلي/المعاد تشكيلها/المسمية جزيئات البروتين الدهني يمكن ان تكون ناقصه تحت بيئة شبه فسيولوجية.
هنا ، يتم تقديم بروتوكول المستندة إلى qPCR خطوه بخطوه لتحديد محتوي ميرنا المطلق/النسبي من جزيئات البروتين الدهني وعينات الخلية ، والذي يسمح بتقدير معدل امتصاص جزيئات البروتين الدهني الخلوي. وعلاوة علي ذلك ، يتم إظهار طريقه لإثراء جزيئات البروتين الدهني مع ميرنا. قد يتم تكييف هذه الطريقة للتلاعب العام لمحتوي البروتين الدهني ، التالي ، ويوضح انطباق جزيئات البروتين الدهني كاهداف لتسليم المخدرات.
Protocol
وقد وافقت لجنه الأخلاقيات في جامعه فيينا الطبية علي التبرع بالدم (511/2007 ، الرقم ال1414/2016). التسمية وفقا للحد الأدنى من المعلومات لنشر التجارب الكمية في الوقت الحقيقي PCR (MIQE)9 المبادئ التوجيهية.
1. البروتين الدهني عزل الجسيمات من الدم البشري
- [بريكول] [اولترتنتريمن] إلى 4 [ك.]. سحب الدم من المتطوعين الأصحاء بعد الصيام بين عشيه وضحيها.
ملاحظه: عاده ما تكون مطلوبه ثلاثه مانحين ، والتبرع ب80 مل لكل منهما ، وأنابيب جمع الدم التي تحتوي علي حمض ايثيلنديدياتيتاياستيك (أدتا) كمضاد للتخثر. - أجهزه الطرد المركزي في 2,000 x g لمده 20 دقيقه في 4 °c والبلازما الحصاد (المرحلة العليا) ؛ تجنب قوي القص. تحديد إجمالي حجم V وضبط ، إذا لزم الأمر ، إلى مضاعف من حجم أنبوب طرد باستخدام الفوسفات-مخزنه المالحة (تلفزيوني). قياس كتله 1 مل 3x وحساب متوسط كثافة ρ.
- حساب الكمية المطلوبة من بروميد البوتاسيوم (KBr) لضبط الكثافة مع المعادلة التالية10 (لكثافة المطلوب في غرام/ملليلتر ، استخدم A = 1.019 ، ولحجم
 معين من KBr ، استخدم = 0.364 mL/g). يضاف KBr إلى البلازما ويحرك برفق لتجنب قوي القص حتى يذوب KBr تماما.
معين من KBr ، استخدم = 0.364 mL/g). يضاف KBr إلى البلازما ويحرك برفق لتجنب قوي القص حتى يذوب KBr تماما.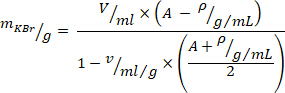
- قياس الكثافة كما هو موضح في الخطوة 1.2 وضبط مره أخرى ، إذا لزم الأمر ، عن طريق أضافه المزيد من KBr وختم أنابيب الطرد المركزي مناسبه ل نبذ حلول مع البلازما. تجنب اي فقاعات الهواء. خلاف ذلك ، قد ينهار الأنبوب. وضع أنابيب في الدوار وفقا لتعليمات الشركة المصنعة وأجهزه الطرد المركزي في 214,000 x g ل 20 ح في 4 ° c.
- فتح أنابيب وفقا لتعليمات الشركة المصنعة وتجاهل المرحلة العليا التي تحتوي علي VLDL و IDL. تحديد إجمالي حجم V وضبط ، إذا لزم الأمر ، إلى مضاعف من حجم أنبوب طرد باستخدام تلفزيوني.
- تحديد كثافة ρ من الجزء السفلي. حساب المبلغ المطلوب من KBr لضبط الكثافة (استخدام A = 1.063). يحرك الخليط برفق لتجنب قوي القص حتى يذوب KBr. كرر الخطوة 1.4.
- أزاله وجمع المرحلة العليا التي تحتوي علي جزيئات LDL. تخزين محلول الجسيمات LDL تحت جو غاز خامل في 4 درجه مئوية. تحديد إجمالي حجم V وضبط ، إذا لزم الأمر ، إلى مضاعف من حجم أنبوب طرد باستخدام تلفزيوني. تحديد كثافة ρ من الجزء السفلي كما هو موضح في الخطوة 1.2.
- احسب المبلغ المطلوب من KBr لضبط الكثافة (استخدم A = 1.220) وأضفه. يحرك الخليط برفق لتجنب قوي القص حتى يذوب KBr. كرر الخطوة 1.4.
- أزاله وجمع المرحلة العليا التي تحتوي علي جزيئات HDL. تحديد حجمها الإجمالي الخامس وضبط ، إذا لزم الأمر ، إلى مضاعف من حجم أنبوب طرد باستخدام تلفزيوني. تحديد كثافة ρ. خطوه طرد الثانية من المرحلة العليا في 214,000 x g ل 20 ح عند 4 °c ينصح لأزاله الزلال. إذا لزم الأمر ، كرر الخطوة 1.8. أزاله وجمع المرحلة العليا التي تحتوي علي جزيئات HDL.
- اعداد وprecool علي الأقل 20 لتر من العازلة غسيل الكلي (0.9 ٪ كلوريد الصوديوم ، 0.1 ٪ أدتا [pH 7.4]) إلى 4 درجه مئوية. أنابيب غسيل الكلي قبل الرطب (قطع الوزن الجزيئي: 12 – 14 ده) وأضافه محلول الجسيمات LDL و HDL وفقا لتعليمات الشركة المصنعة. الديزه ضد 5 لتر من غسيل الكلي العازلة في 4 درجه مئوية وتغيير المخزن المؤقت بعد 1, 2, و 4 ح.
- بعد 24 ساعة ، واستعاده الحلول الجسيمات البروتين الدهني من أنابيب غسيل الكلي وتحديد تركيز البروتين باستخدام الفحص برادفورد11 أو آخر المناسبة. تخزين الحلول الجسيمات HDL و LDL تحت جو الغاز الخامل في 4 ° c.
2. الاصطناعية ميرنا الaliots
ملاحظه: عند التعامل مع الحمض الريبي النيبالي قله الكريات ، والعمل RNase خاليه. العمل فقط مع المواد الاستهلاكية الطازجة والبلاستيك القابل للتصرف ودائما ارتداء القفازات ، والتي ينبغي تغييرها في كثير من الأحيان. استخدم فقط الحلول الخالية من النواز. اعمل دائما علي الجليد.
- تدور أسفل القارورة التي تم الحصول عليها من الشركة المصنعة في اقصي قوه لتشكيل بيليه من ميرنا الاصطناعية بالتجميد. أضافه حجم مناسب من 10 ملم تريس (هيدروكسيميثيل) أمينوميثاني (تريس) العازلة ، pH 7.5 ، للتركيز النهائي من 10 μM (تركيز المخزون) ميرنا.
- ماصه بلطف صعودا وهبوطا بضع مرات لأعاده التعليق. اعداد قسامات من 100 μl كل في أنابيب معقمه. تخزينها في-20 درجه مئوية إذا لم تستخدم علي الفور. تجنب الذوبان المتكرر والتجمد.
3-أعاده تشكيل جزيئات الكوليسترول الحميد
-
ديلبيديشن
- اعداد المخزن المؤقت A (150 mM NaCl ، 0.01 ٪ أدتا ، 10 مم تريس/HCl [pH 8.0]). Precool الطرد المركزي إلى-10 درجه مئوية. Precool 100 mL من خليط من الايثانول: ثنائي ايثيل الأثير (3:2) في-20 درجه مئوية.
تحذير: ارتداء معدات الحماية الشخصية المناسبة والعمل في غطاء الدخان اثناء التعامل مع ثنائي ايثيل الأثير كما انها قابله للاشتعال للغاية وضاره علي الجلد. - مزيج حجم المقابلة 5 ملغ من الجسيمات HDL مع 50 mL من الايثانول precooled: ثنائي ايثيل الأثير (3:2) خليط واحتضان لمده 2 ح في-20 درجه مئوية. أجهزه الطرد المركزي في 2,500 x g لمده 10 دقيقه عند-10 درجه مئوية.
- تجاهل supernatant ، أعاده تعليق بيليه في 50 mL من الايثانول precooled: ثنائي ايثيل الأثير الخليط بواسطة vortexing ، واحتضان للمرة الثانية ل 2 ح في-20 درجه مئوية. الطرد المركزي مره أخرى في 2,500 x g لمده 10 دقيقه في-10 درجه مئوية.
ملاحظه: إذا رغبت في ذلك ، بالتجميد الفائق لتحليل محتوي ميرنا في جزء الدهون من جزيئات HDL. - تجفيف بيليه تحت N2 تدفق الغاز وأعاده التعليق عليه في 250 μl من المخزن المؤقت A (انظر الخطوة 3-1-1). تحديد تركيز البروتين باستخدام فحص البروتين برادفورد أو آخر المناسبة وتمييع إلى تركيز النهائي من 1 ملغ من البروتين/250 μL من العازلة A.
ملاحظه: يمكن إيقاف البروتوكول مؤقتا هنا. تخزين الحل بين عشيه وضحيها في 4 درجه مئوية تحت جو الغاز الخامل.
- اعداد المخزن المؤقت A (150 mM NaCl ، 0.01 ٪ أدتا ، 10 مم تريس/HCl [pH 8.0]). Precool الطرد المركزي إلى-10 درجه مئوية. Precool 100 mL من خليط من الايثانول: ثنائي ايثيل الأثير (3:2) في-20 درجه مئوية.
-
اعاده تشكيل
- اعداد فوسفاتيديلكولين (PC) حل الأسهم باستخدام خليط من كلوروفورم: الميثانول (2:1) بتركيز 5.6 ملغ من جهاز الكمبيوتر/مل. المثل ، اعداد حلول الأوراق المالية من الكوليستيرول (5 ملغ من CO/مل) والكوليسترول (5 ملغ من C/مل). تخزين جميع الحلول في-20 درجه مئوية.
- في أنبوب زجاجي نظيف ، مزيج 500 μL من جهاز الكمبيوتر ، 100 μL من CO ، و 13.5 μL من C. هذه المجلدات تتوافق مع نسبه المولي التقريبية من 100 PC: 22 CO: 4.8 c. تجفيف الخليط تحت N2 تدفق الغاز اثناء تدوير الأنبوب لإنتاج طبقه سطح متجانسة.
ملاحظه: يمكن إيقاف البروتوكول مؤقتا هنا. تخزين القارورة الزجاجية (إذا رغبت في ذلك ، يمكن تخزينها) تحت جو الغاز الخامل عند-20 درجه مئوية. - اعداد محلول ألغام المنوية 30 ملم الطازجة في العازلة ا. مزيج واحد قسامه (100 μl ، 10 μM) من ميرنا الاصطناعية (انظر الخطوة 2.2) مع 100 μl من محلول spermine واحتضان لمده 30 دقيقه في 30 درجه مئوية.
ملاحظه: لتجارب التحكم السلبية ، استبدل الحل ميرنا و/أو الspermine بنفس حجم المخزن المؤقت A. - حل PC/CO/C المزيج الرئيسي قسامه في الخليط من الخطوة 3-2-3.
- اعداد حل من 30 ملغ/مل من وديوكسيتشولاتي الصوديوم في المخزن المؤقت a وأضافه 50 μl إلى الحل من الخطوة 3-2. يحرك عند 4 درجه مئوية لمده 2 ساعة.
- أضافه 250 μL من الحل HDL ديليبيداتيد من الخطوة 3-1-4. هذا الحجم يتوافق مع نسبه المولي تقريبي من 100 PC: 22 CO: 4.8 C:1 ديليبيداتيد البروتينات HDL. يحرك الخليط عند 4 درجات مئوية بين عشيه وضحيها.
-
غسيل الكلي
- Precool علي الأقل 15 L من تلفزيوني في 4 ° c. أضف 50 غرام من الخرز الممتزه إلى 800 مل من الماء المقطر المزدوج (ddh2O) ويحرك الخليط لمده دقيقه واحده. انتظر 15 دقيقه ، وصب في supernatant ، وتكرار الاجراء مع تلفزيوني.
- شرائط غسيل الكلي قبل الرطب (قطع الوزن الجزيئي: 20 ده) أو أنابيب غسيل الكلي المناسبة وأضافه المحلول من الخطوة 3.2.6 ، وذلك باستخدام حقنه وفقا لتعليمات الشركة المصنعة.
- أضافه الخرز الممتزه من الخطوة 3-3-1 إلى 3 لتر من التلفزيونية والديزه في 4 درجه مئوية. تغيير العازلة والخرز بعد 1 h و 2 ح.
- بعد 24 ساعة ، واستعاده الحل الجسيمات HDL (rHDL) المعاد تشكيلها وتحديد تركيز البروتين باستخدام المقايسة برادفورد. تخزين محلول الجسيمات rHDL تحت جو الغاز الخامل في 4 درجه مئوية.
4. وضع العلامات علي جزيئات LDL
- اعداد 10x العازلة LDL (1.5 M كلوريد الصوديوم ، 3 مم أدتا ، 1 مم الاثيلين جلايكول-bis (β-امينوايثيل الأثير)-N ، N ، N ' ، N'--حمض تتراكسي [EGTA ، pH 7.4]) وتخزينها في درجه حرارة الغرفة.
- اعداد حل جديد للألغام المنوية 30 ملم في المياه الخالية من RNase. اخلطي (100 μL ، 10 μM) من ميرنا الاصطناعية (انظر الخطوة 2.2) مع 100 μL من محلول النطاف واحتضان لمده 30 دقيقه في 30 درجه مئوية.
ملاحظه: للتجارب السيطرة السلبية ، واستبدال ميرنا و/أو محلول spermine مع نفس الحجم من 1x العازلة LDL. - أضافه 100 μL من DMSO إلى الحل ميرنا/spermine من الخطوة 4.2 وتمييع أكثر مع 1.2 mL من 1x العازلة LDL.
- تمييع محلول الجسيمات LDL إلى تركيز نهائي من حوالي 4 مغ/مل مع تلفزيوني ومزيج 450 μL مع 50 μL من 10x العازلة LDL. احتضان لمده 10 دقيقه علي الجليد.
- الجمع بين محلول الجسيمات LDL من الخطوة السابقة والحل ميرنا/spermine/DMSO (من الخطوة 4.3) واحتضانه ل 2 ح في 40 درجه مئوية.
- اجراء غسيل الكلي مماثله كما هو موضح في القسم 3.3 وتخزين الحل الجسيمات LDL المسمي وفقا لذلك.
5. مراقبه الجودة من الجزيئات الدهنية المعاد تشكيلها/المسمي
ملاحظه: لمراقبه الجودة ، يمكن تحديد القطر والشكل العام لجزيئات البروتين الدهني باستخدام ، علي سبيل المثال ، فؤاد أو المجهر الكتروني (EM). هنا ، يستخدم HS-فؤاد لقياس توزيع حجم جزيئات البروتين الدهني الأصلي/المعاد تشكيله/المسمي.
- تمييع محلول الجسيمات HDL/LDL في الاذاعه التلفزيونية (1:100 – 1:1000) واحتضانه علي ميكا المشقوق الطازج لمده 5 دقائق. ليلتصق الميكا12، اضغط شريط لاصق ضد الركيزة وأزاله طبقات ميكا العليا عن طريق سحب الشريط قباله.
ملاحظه: اعتمادا علي أداه فؤاد معينه ، ومنطقه المراقبة ، والتركيز الاولي للجسيمات ، يجب تعديل عامل التخفيف لمراقبه الجزيئات الفردية. - بعد الحضانة ، شطف العينة مع تلفزيوني وأداء التصوير HS-فؤاد في تلفزيوني وفي وضع التنصت مع الكابولي وجود ثوابت الربيع k غيرقادر علي < 0.2 N/m. فمن المستحسن استخدام احجام المسح الضوئي < 1 μm2 والحفاظ علي قوات التصوير منخفضه قدر الإمكان.
- تحديد ارتفاع الجسيمات التي لا تعرف العمر فيما يتعلق سطح الميكا مع البرامج المناسبة.
- تحميل البيانات في غويندديون (مجانية) ، والكشف عن الجزيئات عن طريق تحليل الحبوب (علامة الحبوب حسب العتبة) وتعيين عتبه فوق خلفيه الركيزة. تسطيح الصورة (أزالهالخلفية متعددة الحدود) اختيار الخيار استبعاد منطقه مقنعه .
- تصدير قيم الارتفاع للجسيمات المكتشفة (توزيع خصائص الحبوبالمختلفة) وكرر هذه الخطوات لجميع الصور المسجلة. اجراء تحليل إحصائي اما بإنشاء الرسوم البيانية أو حساب وظائف الكثافة الاحتمالية لمرتفعات الجسيمات التي تم الحصول عليها.
- كرر الخطوات 5.1 – 5.3 مع جزيئات البروتين الدهني الاصليه وكذلك المعاد تشكيلها/المسمية وقارن النتائج التي تم الحصول عليها للتحقق من جوده الجسيمات. في حاله مراقبه الحطام و/أو التكتلات ، تخلص من العينة.
6-ثقافة الخلية
- تنمو الخلايا الملتصقة وفقا للبروتوكول المعمول به (علي سبيل المثال ، ldlA7-SRBI13) حتى تصل إلى كونفلوينسي.
ملاحظه: العديد من الغرف المستقلة اعتمادا علي عدد من التجارب (الموصي بها غرفتين في الاعداد التجريبي) والتجارب السيطرة السلبية (الموصي بها غرفتين دون أضافه جزيئات البروتين الدهني) مطلوبه. بالاضافه إلى ذلك ، مطلوب غرفتين لتحديد رقم الخلية. - اغسل الخلايا برفق 3x مع محلول الملح المتوازن من هانك (HBSS) لأزاله الحطام الخلوي وتغطيه طبقه الخلايا بكميه مناسبه من متوسط النمو الخالي من المصل. أضافه كميه مناسبه من محلول الجزيئات الدهنية للوصول إلى تركيز نهائي من جزيئات البروتين الدهني 50 ميكروغرام/مل. احتضان في 37 درجه مئوية و 5 ٪ CO2 لمده 16 ساعة.
ملاحظه: اعتمادا علي التصميم التجريبي وخط الخلية ، يجب تكييف وقت الحضانة لتحقيق زيادة كافيه (اي قابله للقياس) في مستوي ميرنا الخلوي. - يغسل برفق الخلايا 3x مع الحرارة المسبقة (37 درجه مئوية) HBSS لأزاله الحطام الخلية/جزيئات البروتين الدهني وتغطي طبقه الخلية مع حجم مناسب من الوسط الخالي من المصل.
- تحديد كثافة الخلية باستخدام الأسلوب المناسب (علي سبيل المثال ، مقياس الشكل النصفي ، عداد الخلايا المؤتمت) في غرفتين مستقلتين علي الأقل لحساب عدد الخلايا في وحده تخزين العينة من الخطوة 6.3. يتم استخدام هذا الرقم للتسوية.
7. استخراج ميرنا من الخلايا والبروتين الدهني عينات الجسيمات
ملاحظه: يتم تنفيذ استخراج ميرنا من الخلايا باستخدام مجموعه استخراج ميرنا مع التعديلات التالية.
-
عينات الخلية
- Precool الطرد المركزي إلى 4 درجه مئوية. أضافه 350 μL من كاشف تحلل كل إلى غرفتين تحتوي علي الخلايا. كتجربة مراقبه سلبيه ، استخدم غرفه بدون خلايا.
تحذير: ارتداء معدات الحماية الشخصية المناسبة والعمل في غطاء الدخان اثناء التعامل مع كاشف تحلل كما انه يحتوي علي الفينول و ثيوسيانات. - انتظر لمده 3 – 5 دقائق (اعتمادا علي خط الخلية) لمفرزه الخلية. إذا لزم الأمر ، والتحقق من انفصال الخلية مع المجهر برايت. تجمع محتويات غرفتين في أنبوب 1.5 mL.
- باستخدام ابره 20 ز وحقنه 5 مل ، تجانس/تعطيل عينه 5x-10x من قبل الطموح واحتضان لمده 5 دقائق. أضافه 140 μL من كلوروفورم (CHCl3) ، يهز بقوة ل 15 ثانيه ، واحتضان لمده 3 دقائق.
- جهاز الطرد المركزي في 12,000 x g لمده 15 دقيقه في 4 °c. بعد ذلك ، توقف عن تبريد جهاز الطرد المركزي.
- نقل المرحلة المائية العليا إلى أنبوب جديد 1.5 mL; تجنب خلط الطور/التلوث حيث تحتوي المرحلة البينية علي الحمض النووي والمرحلة السفلي تحتوي علي البروتينات. أضافه 1.5 x حجم 100 ٪ الايثانول وتخلط جيدا عن طريق التنضيد.
- وضع عمود تدور في أنبوب جمع 2 مل وأضافه 700 μL من الخليط من 7.1.5 الخطوة. أجهزه الطرد المركزي في 8,000 x g ل 15 s في درجه حرارة الغرفة. تجاهل التدفق وكرر هذه الخطوة مع وحده تخزين العينة المتبقية.
- تجاهل التدفق من خلال وأضافه 700 μL من المخزن المؤقت للغسيل الأول إلى عمود الدوران. الطرد المركزي في 8,000 x g لمده 15 ثانيه في درجه حرارة الغرفة.
- تجاهل التدفق من خلال وأضافه 500 μL من المخزن المؤقت للغسيل الثاني إلى عمود الدوران. الطرد المركزي في 8,000 x g لمده 15 ثانيه في درجه حرارة الغرفة. كرر هذه الخطوة بأكملها مره ثانيه مع 2 دقيقه من طرد time.
- وضع العمود تدور في أنبوب جمع 2 مل جديده والطرد المركزي بسرعة كامله لمده 1 دقيقه لتجفيف الغشاء.
- وضع العمود تدور في أنبوب جمع 1.5 mL. أضف 30 μL من المياه الخالية من RNase في وسط الغشاء للحصول علي الشطف والطرد المركزي في 8,000 x g لمده 1 دقيقه. كرر هذه الخطوة بأكملها مره ثانيه مع التدفق الأول من خلال حل التملص. تتم خطوه النسخ العكسي مباشره بعد الاستخراج; خلاف ذلك ، تخزين عينات ميرنا المستخرجة في-20 درجه مئوية.
- Precool الطرد المركزي إلى 4 درجه مئوية. أضافه 350 μL من كاشف تحلل كل إلى غرفتين تحتوي علي الخلايا. كتجربة مراقبه سلبيه ، استخدم غرفه بدون خلايا.
-
جزيئات البروتين الدهني
- تعيين حجم العينة مع تركيز البروتين ادني إلى 100 μL (= الحد الأقصى لحجم العينة). حساب وحدات التخزين عينه من العينات الأخرى وفقا لهذا التطبيع ، عكسيا لتركيزها. لتجارب التحكم السلبية ، استخدم 100 μL من المياه الخالية من RNase.
ملاحظه: التطبيع غير مطلوب ولكن يبسط المقارنة المباشرة للنتائج اثناء خطوه qPCR والتحليل. - Precool الطرد المركزي إلى 4 درجه مئوية. أضافه 700 μL من كاشف تحلل إلى حجم العينة من 7.2.1 الخطوة.
- اجراء استخراج ميرنا وفقا للخطوات 7.1.3 – 7.1.10.
- تعيين حجم العينة مع تركيز البروتين ادني إلى 100 μL (= الحد الأقصى لحجم العينة). حساب وحدات التخزين عينه من العينات الأخرى وفقا لهذا التطبيع ، عكسيا لتركيزها. لتجارب التحكم السلبية ، استخدم 100 μL من المياه الخالية من RNase.
8. عكس النسخ
ملاحظه: يتم تنفيذ النسخ العكسي من ميرنا باستخدام عده النسخ العكسي مع التعديلات التالية.
- ذوبان الكواشف عده والإشعال النسخ العكسي علي الجليد. اعداد المزيج الرئيسي التالي في أنبوب رد فعل علي الجليد: 45.7 μL من RNase خاليه H2س ، 16.5 μl من 10x العازلة النسخ الاحتياطي ، 11 μl من انزيم النسخ العكسي ، 2.1 μl من مثبط RNase ، و 1.7 Μl من dntp مزيج. تخلط برفق ، لا دوامه.
ملاحظه: المقياس يعتمد علي كميه العينة; هنا ، يتم حسابه لمده 10 ردود الفعل. - تسميه أنابيب 0.2 mL وفقا لذلك ومزيج 7 μL من المزيج الرئيسي من الخطوة 8.1 مع 5 μL من العينة المستخرجة من الخطوة 7.1.10 و 3 μL من التمهيدي النسخ العكسي. تخلط برفق ، والطرد المركزي قريبا ، وتخزين الخليط علي الجليد.
- من أجل استخدام نفس رقم الخلية لكل خط الخلية ، تقليل حجم العينة من خط الخلية مع رقم الخلية العامة اعلي; استخدام هذا كحجم المتبقية للوصول إلى حجم العينة الإجمالي من 5 μL من المياه RNase خاليه.
ملاحظه: يتم تطبيع عينات الجسيمات البروتين الدهني بالفعل في الخطوة 7.2.1. لاعداد منحني القياسية ، تمييع قسامه من ميرنا بالتتابع في المياه rnase خاليه وحساب عدد خيوط لكل حجم العينة. والمطلوب هو خمس نقاط بيانات علي الأقل ضمن نطاق القيم الناتجة عن دوره التحديد الكمي للعينه (جس). وعاده ما تكون عوامل التخفيف الاجماليه التي تتراوح بين 102 إلى 106 مناسبه. - وضع أنابيب في اله ثيرموسيكلير والبدء في البرنامج التالي: 30 دقيقه في 16 درجه مئوية (الصلبة الخطوة) ، 30 دقيقه في 42 درجه مئوية (عكس النسخ) ، 5 دقائق في 85 درجه مئوية (ذوبان الخطوة) ، ووقفه في 4 درجه مئوية (التخزين). تنفيذ خطوه qPCR مباشره بعد النسخ العكسي; خلاف ذلك ، تخزين الحمض النووي التكميلي (cDNA) توليفها من عينات ميرنا في-20 درجه مئوية.
9. الشركة القطرية
- تنفيذ qPCR من cDNA (عكس المنقولة من ميرنا) باستخدام المقايسة المتاحة تجاريا (انظر جدول المواد) مع التعديلات التالية.
- ذوبان جميع الكواشف (supermix ، RNase خاليه H2س) ، عينات cdna (من الخطوة 8.4) ، والإشعال علي الجليد. اعداد المزيج الرئيسي التالي في أنبوب رد فعل علي الجليد: 75 μL من supermix ، 47.5 μL من RNase خاليه H2O ، 7.56 μl من التمهيدي. تخلط برفق ، لا دوامه.
ملاحظه: المقياس يعتمد علي كميه العينة; هنا ، يتم حسابه لمده 10 ردود الفعل. - تسميه أنابيب 0.2 mL وفقا لذلك وأضافه 2 μL من عينه cDNA إلى 13 μL من المزيج الرئيسي وتخلط بلطف. بشكل عام ، وقياس كل عينه 2x.
ملاحظه: مطلوب اثنين علي الأقل عينات التحكم السلبية بالاضافه إلى ذلك — استخدام المياه RNase خاليه كعينه. إذا لم يتم تحديد منحني المعايرة في نفس تشغيل العينة ، فان عينه واحده من قياس منحني المعايرة مطلوبه أيضا. هو استعملت ان معايره كل فرده يركض إلى ال نفسه رد فعل فعاليه. - وضع أنابيب في الجهاز PCR وبدء البرنامج التالي: 2 دقيقه في 50 درجه مئوية ، 10 دقيقه في 95 درجه مئوية ، 15 ق في 95 درجه مئوية ، و 60 s في 60 درجه مئوية. كرر الخطوتين الأخيرتين من البرنامج حتى 50x.
- لتحليل القيم جس مع حزمه البرمجيات الجهاز PCR ، تنشيط ديناميكتيوب التطبيع (للتعويض عن مستويات الخلفية المختلفة باستخدام المشتقة الثانية من كل تتبع عينه) والضوضاء المنحدر تصحيح (التطبيع إلى مستوي الضجيج).
ملاحظه: يجب ان تكون القيمة cq عنصر التحكم السالب عده دورات اعلي من القيمة cq العينة الأعلى.- لتحليل منحني المعايرة ، تحديد عتبه لحساب cq لكل ميرنا من المنحنيات القياسية لكل ميرنا بشكل فردي ، وذلك باستخدام وظيفة عتبه البحث التلقائي من حزمه البرامج ، ويبقيه ثابتا لكل ميرنا محدده.
- لتحليل العينات ، إذا لزم الأمر ، تعويض عن كفاءه التفاعل المختلفة للعينه تشغيل مع نقطه البيانات من عينه منحني المعايرة. يحسب البرنامج قيم cq من العينات من مستوي عتبه قياس منحني المعايرة ذات الصلة.
10. حساب المحتوي ميرنا
-
معايره منحني
- حساب ، من العدد الاولي من خيوط ميرنا لكل قسامه (100 μl من 10 μM ميرنا ، الوزن الجزيئي من ورقه البيانات) والخطوات التالية التخفيف التسلسلي ، وعدد خيوط ميرنا في حجم العينة (حجم عينه 5 μl من الخطوة 8.3).
ملاحظه: بافتراض كفاءه النسخ العكسي من 1 ، هذا الرقم يساوي عدد خيوط cDNA. - حساب عدد خيوط cDNA في حجم العينة من 2 μL من الخطوة 9.3. اعتبرت بذلك الاضافيه تخفيف عامل من 7.5 (ال 2 [ميكرول] عينه حجم من خطوه 9.4 من ال 15 μL عينه حجم من خطوه 8.4).
- ارسم قيمه cq من الخطوة 9.5.1 مقابل عدد خيوط n الخيوط المحسوبة في الخطوة 10.1.2 في قطعه الأساس-10 المخطط الحسابي ، وتناسب نقاط البيانات مع منحني الانحدار التالي (M = ميل الخطي منحني الانحدار ، B = أزاحه).
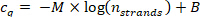
تاكد من ان معامل الارتباط (R2) للخط هو > 0.99.
- حساب ، من العدد الاولي من خيوط ميرنا لكل قسامه (100 μl من 10 μM ميرنا ، الوزن الجزيئي من ورقه البيانات) والخطوات التالية التخفيف التسلسلي ، وعدد خيوط ميرنا في حجم العينة (حجم عينه 5 μl من الخطوة 8.3).
-
جزيئات البروتين الدهني
- حساب عدد خيوط ميرنا لكل وحده تخزين عينه باستخدام عينه قياس cq القيمة (الخطوة 9.5.2) والمعادلة التالية (M و B هي معلمات منحني المعايرة من ميرنا محدده).
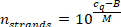
- حساب العدد المطابق من جزيئات البروتين الدهني في حجم العينة ، بدءا من وحده التخزين في الخطوة 7.2.1 (100 μL) ، تركيزه المعروف ، وخطوات التخفيف اللاحقة (100 μL-> حجم عينه μL في الخطوة 7.1.10-> 5 μL [تخفيف 1:6] عينه في الحجم الكلي 15 μL في الخطوة 8.4-> 2 μL [تخفيف 1:7.5] في الخطوة 9.4). تفترض الوزن الجزيئي 250 كده للجسيمات HDL و 3 MDa للجسيمات LDL واسترداد 100 ٪ من ميرنا خلال خطوه استخراج ميرنا (تجاهل اي مساهمه الدهون إلى الوزن الجزيئي غله مبالغه طفيفه من عدد خيوط ميرنا في جسيمات البروتين الدهني).
- قسم عدد خيوط ميرنا من الخطوة 10.2.1 بعدد الجزيئات المحسوبة في الخطوة السابقة لإنتاج عدد خيوط ميرنا لكل جزيء بروتين دهني.
- حساب عدد خيوط ميرنا لكل وحده تخزين عينه باستخدام عينه قياس cq القيمة (الخطوة 9.5.2) والمعادلة التالية (M و B هي معلمات منحني المعايرة من ميرنا محدده).
-
الخلايا
- حساب عدد خيوط ميرنا في حجم العينة وفقا ل10.2.1 الخطوة.
- حساب العدد المطابق من الخلايا في وحده التخزين العينة وفقا ل10.2.2 الخطوة ، بدءا من تركيز رقم الخلية الاولي يقاس في الخطوة 6.4.
- تقسيم عدد خيوط ميرنا من 10.3.1 عدد الخلايا المحسوبة في الخطوة السابقة لإنتاج عدد خيوط ميرنا لكل خليه.
- حساب معدل امتصاص جزيئات البروتين الدهني عن طريق تقسيم المبلغ الإجمالي لخيوط ميرنا من الخطوة السابقة بعد تصحيح لمستوي ميرنا الخلفية من الخلايا التي تم الحصول عليها من تجربه التحكم السلبية بنسبه ميرنا/الجسيمات (الخطوة 10.2.3 ) ووقت الحضانة (16 ساعة ، انظر الخطوة 6.2).
11. صفائف ميكروفلويدريك متعددة الآبار
-
ميرنا استخراج
- تنفيذ استخراج ميرنا كما هو موضح في الخطوة 7.
-
عكس النسخ
- تذويب الإشعال النسخ العكسي ، ومكونات عده النسخ العكسي ، و MgCl2 (25 ملم) علي الجليد. لثمانيه عينات ، مزيج 8 μL من الإشعال النسخ العكسي (10x) ، 2.25 μL من dNTPs مع دتب (100 mM) ، 16.88 μL من النسخ العكسي (50 U/μL) ، 9.00 μL من 10x النسخ الاحتياطي العكسي الاستنساخ ، 10.12 μL من MgCl2، 1.12 μl من مثبط RNase ، و 1 μL من المياه الخالية من النيوداز.
- تخلط برفق والطرد المركزي لفتره وجيزة. أضافه 4.3 μL من مزيج رد فعل النسخ العكسي إلى 3.5 μL من ميرنا المستخرجة في أنبوب ومزيج ، وتدور ، واحتضان علي الجليد لمده 5 دقائق. وضع الأنابيب في اله ثيرموسيكلير وبدء البرنامج التالي: 16 درجه مئوية لمده 2 دقيقه ، 42 درجه مئوية لمده 1 دقيقه ، و 50 درجه مئوية ل 1 ثانيه المتكررة 40x في المجموع ، وبعد ذلك ، كرد فعل التوقف ، 85 درجه مئوية لمده 5 دقائق وعقد في 4 درجه مئوية حتى توقفت.
-
تضخيم
- ذوبان الإشعال علي الجليد وعكس والطرد المركزي لفتره وجيزة. اخلط مزيج التضخيم الرئيسي (2x) بواسطة الزجاجة. اعداد مزيج رد فعل التضخيم المسبق وفقا للتعليمات التالية لثمانيه عينات: 112.5 μL من مزيج التضخيم الرئيسي (2x) ، 22.5 μL من الإشعال التضخيم المسبق ، و 67.5 μL من المياه الخالية من النيوداز. عكس والطرد المركزي لفتره وجيزة.
- مزيج 2.5 μL من الناتج رد فعل النسخ العكسي من الخطوة 11.2.2 مع 22.5 μL من مزيج رد فعل التضخيم المسبق من الخطوة السابقة وعكس والطرد المركزي لفتره وجيزة. احتضان العينات علي الجليد لمده 5 دقائق.
- وضع الأنابيب في اله ثيرموسيكلير واحتضان في الإعدادات التالية: تنشيط انزيم في 95 درجه مئوية لمده 10 دقيقه ، الصلب في 55 درجه مئوية لمده 2 دقيقه ، وتمتد في 72 درجه مئوية لمده 2 دقيقه ، وكرر 12x: النحت في 95 درجه مئوية ل 15 ثانيه والصلب/تمتد في 60 درجه مئوية ل 4 دقيقه ، انزيم تعطيل في 99.9 درجه مئوية لمده 10 دقيقه ، و 4 درجه مئوية علي الانتظار.
- تدور أسفل ، أضافه 7.5 μL من 1x TE (pH 8.0) و 67.5 μL من المياه الخالية من النيوداز ، عكس ، والطرد المركزي لفتره وجيزة. يمكن تخزين العينات في-20 درجه مئوية لمده تصل إلى 1 أسبوع.
-
qPCR
- خلط المزيج الرئيسي بواسطة يحوم الزجاجة. اعداد مزيج التفاعل PCR لبطاقة واحده: 450 μL من المزيج الرئيسي ، 441 μL من المياه الخالية من النيوداز ، و 9 μL من عينه التضخيم المسبق من الخطوة 11.3.4. عكس والطرد المركزي لفتره وجيزة.
- تحميل كل خزان التعبئة من بطاقة صفيف multifluidic متعددة الآبار مع 100 μL من مزيج تفاعل PCR المعدة وفقا لتعليمات الشركة المصنعة والطرد المركزي 2x لمده 1 دقيقه في 3,000 x g. التسارع اثناء الخطوتين طرد المتتالية مهم لتعبئة البطاقة بشكل صحيح. ختم البطاقة وفقا لتعليمات الشركة المصنعة.
- استخدام نظام PCR مع البرنامج التالي: تنشيط انزيم في 95 درجه مئوية لمده 10 دقيقه وبعد ذلك ، وكرر 40x: النحت في 95 درجه مئوية ل 15 ثانيه والصلب/تمتد في 60 درجه مئوية لمده 1 دقيقه.
- استيراد ملف النتائج من نظام PCR وحساب قيم RQ باستخدام حزمه البرامج الخاصة بالنظام مع إعدادات التحليل التالية: الحد الأقصى المسموح به من القيمة cq 40.0 ، الحد الأقصى للقيم cq في الحسابات المضمنة ، والقيم المتطرفة بين نسخ متماثلة مستبعده. تنشيط معدل الاكتشاف الزائف بينجاميني-Hochberg كخيار لضبط القيمة p(تصحيح حدوث الإيجابيات الزائفة14) والتطبيع العالمي كاسلوب التسوية (باستخدام قيمه عتبه وسيطه لكافة العينات 15).
النتائج
مخطط عام لعزل جزيئات البروتين الدهني
يظهر الشكل 1 المخطط العام لعزل جزيئات البروتين الدهني بدءا من الدم الكامل ، وذلك باستخدام التعويم المتسلسل للعوم16. إذا رغبت في ذلك, كسور الجسيمات الدهنية الأخرى مثل الجسيمات VLDL و IDL يمكن حصادها خلال هذا البروتوكول. الدوار التيتانيوم ثابت الزاوية في تركيبه مع أنابيب البولي بروبيلين ختم سريعة مناسبه لتحمل القوات الطردة. لتجنب انهيار الأنبوب ، من المهم تجنب فقاعات الهواء في الأنبوب. ويتم طرد في 4 درجه مئوية للتقليل من تدهور البروتين. وعاده ما تبدا من البلازما (60-80 مل لكل متبرع) من التبرعات الدم المجمعة من ثلاثه متطوعين ، وهو العائد من الجسيمات LDL و HDL حجم الحل من 3 مل كل مع تركيزات في نطاق 1-3 مغ/مل يمكن توقعه. استغرق الاجراء برمته ، بدءا من التبرع بالدم ، حوالي 7 أيام.
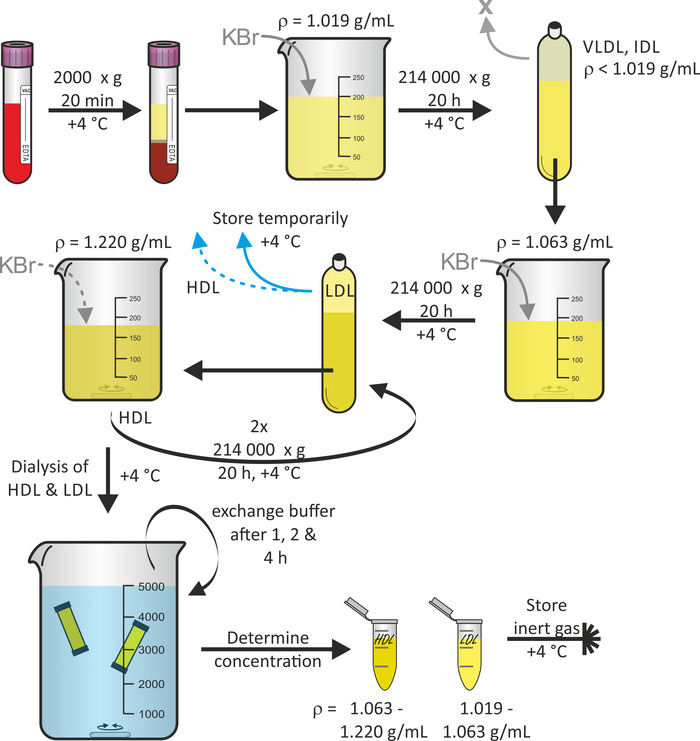
الشكل 1: مخطط انسيابي لعزل البروتين الدهني. الطرد المركزي الدم من المتطوعين الأصحاء في أنابيب الحاويات فراغ وجمع البلازما (المرحلة العليا). بعد تعديل كثافته إلى ρ = 1.019 g/mL باستخدام KBr ، الطرد المركزي الحل في 214,000 x g ل 20 ح في 4 ° c. بعد تعديل كثافة الجزء السفلي إلى ρ = 1.063 g/mL باستخدام KBr ، الطرد المركزي الحل مره أخرى في 214,000 x g ل 20 ح في 4 ° c. تخزين الجزء العلوي الذي يحتوي علي جزيئات LDL مؤقته عند 4 درجه مئوية. بعد تعديل كثافة الجزء السفلي إلى ρ = 1.220 g/mL باستخدام KBr ، الطرد المركزي الحل مرتين في 214,000 x g ل 20 ح في 4 ° c. جمع الجزء العلوي الذي يحتوي علي جزيئات الكوليسترول الحميد ، الديديزه علي حد سواء الحميد والجسيمات LDL الحلول وتبادل العازلة بعد 1 ، 2 ، و 4 ح. بعد 24 ساعة ، تحديد تركيز البروتين وتخزين العينات تحت غاز خامل في 4 درجه مئوية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
أعاده تشكيل جزيئات الكوليسترول الحميد
تم اجراء أعاده تشكيل جزيئات HDL وفقا لبروتوكول نشرت سابقا من قبل جوناس7. وكانت الخطوة الاولي هي الخلط بين جزيئات الكوليسترول الحميد كما هو مبين في الشكل 2A، تليها الخطوة الثانية لأعاده التشكيل (اي أعاده التكوين) كما هو مبين في الشكل 2 ب، باستخدام الدهون PC ، CO ، و C بالاضافه إلى خليط من ميرنا والنطاف. اخترنا الإنسان الناضجة مير-223 و مير-155 لان مير-223 يظهر وفره عاليه و مير-155 نادره في جزيئات البروتين الدهني17. عاده ، يتم تنفيذ كلا الخطوتين في يومين متتابعين. وخلال أعاده التشكيل ، يمكن أضافه مكونات أخرى من الليبوفيليا و/أو البرمائيات حسب الرغبة. وكان التبخر الكامل من الايثانول/ثنائي ايثيل الأثير والمذيبات الميثانول/كلوروفورم من PC, CO, و C الحرجة. وكانت الخطوة الاخيره-كما هو مبين في الشكل 2C-اجراء غسيل الكلي لفصل الجسيمات الحميدة المعاد تشكيلها (rhdl) من الدهون الحرة/ميرنا/المنظفات. استغرق هذا 1-2 اضافيه أيام. الاضافه من الخرز ماصه لمحلول غسيل الكلي ابقي التدرج كثافة علي طول غشاء غسيل الكلي ثابت. ويمكن توقع الغلة من 50 ٪ من جزيئات rHDL.
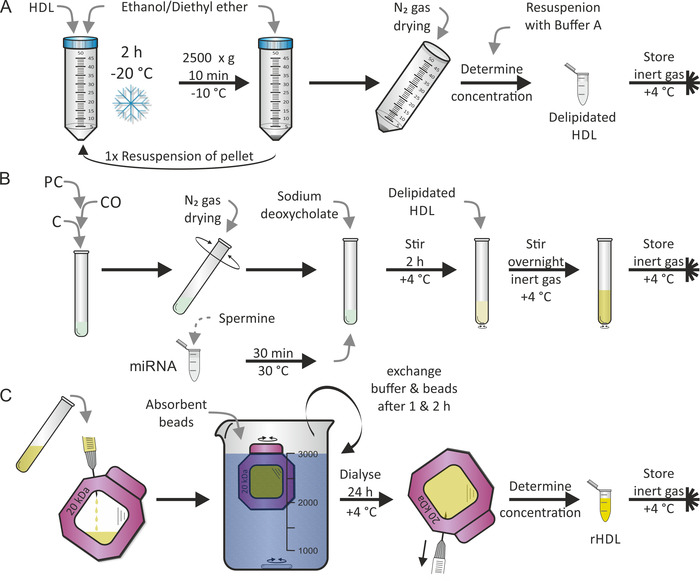
الشكل 2: مخطط انسيابي لأعاده تشكيل الجسيمات HDL. (ا) ديلبيديشن: خلط محلول الجسيمات HDL مع الايثانول الذي سبق الإفراج عنه/ثنائي ايثيل الأثير واحتضان في-20 درجه مئوية لمده 2 ساعة. بعد التخلص من supernatant ، وأعاده تعليق بيليه وتكرار الاجراء. تجفيف بيليه مع N2 الغاز وأعاده التعليق عليه في المخزن المؤقت A. بعد التحديد من التركيز, خزنت ال ديليبيداتيد HDL تحت خاملة غاز جو في 4 [ك.]. (ب) أعاده التشكيل: بعد خلط الفوسفاتيديل-الكولين (PC) ، الكوليستيرول اولاتي (CO) ، والكوليسترول (C) ، تتبخر المذيب باستخدام N2 الغاز في حين تناوب الأنبوب. احتضان ميرنا قسامه مع محلول spermine لمده 30 دقيقه في 30 درجه مئوية ، أضافه وديوكسيتشولاتي الصوديوم وأعاده تعليق فيلم الدهون المجففة. يحرك العينة لمده 2 ح في 4 درجه مئوية ، أضافه محلول HDL ديليبيداتيد ، ويحرك العينة مره أخرى ، وهذه المرة بين عشيه وضحيها في 4 درجه مئوية تحت جو الغاز الخامل. (ج) غسيل الكلي: نقل المحلول من اللوحة B التي تحتوي علي جزيئات الحميد (rhdl) المعاد تشكيلها إلى غرفه غشاء غسيل الكلي (الوزن الجزيئي المقطوع: 20 ده) والديزه ضد الخدمات التلفزيونية والخرز الماصة عند درجه حرارة 4 درجات مئوية. تبادل العازلة والخرز بعد 1 ح و 2 ح. استرداد الحل الجسيمات rHDL بعد 24 ساعة ، وتحديد التركيز ، وتخزين العينة تحت جو الغاز الخامل في 4 درجه مئوية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
وضع العلامات علي جزيئات LDL
وضع العلامات علي جزيئات LDL مع ميرنا (الشكل 3) كما هو موضح للجسيمات HDL لم يكن ممكنا بسبب هيدروفوبيسيتي البروتين apob-100 ، وهو المكون الرئيسي للجسيمات ldl. وقد استخدمت DMSO لاختراق أحاديه الدهن من الجسيمات LDL ، التالي ، توسطت جمعيه ميرنا. استغرق الاجراء برمته 1-2 أيام مع عائد قريب من 100%.
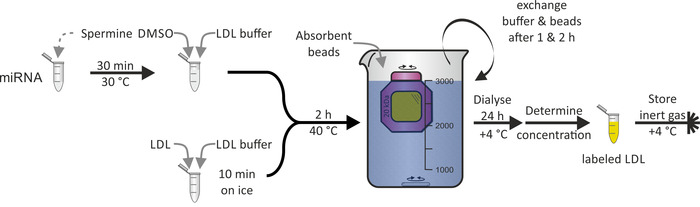
الشكل 3: مخطط انسيابي لوسم الجسيمات LDL. احتضان ميرنا قسامه مع محلول spermine لمده 30 دقيقه في 30 درجه مئوية وأضافه dmso و LDL العازلة. احتضان عينه LDL الطرافة العازلة LDL لمده 10 دقيقه علي الجليد وأضافه ميرنا/spermine/الخليط DMSO. بعد الحضانة في 40 درجه مئوية ل 2 ح ، نقل الحل إلى غرفه غشاء الغسيل الكلوي (الوزن الجزيئي قطع: 20 كده) والديزه ضد تلفزيوني والخرز ماصه في + 4 ° c. تبادل المخزن المؤقت والخرز بعد 1 & 2 ح. استرداد المسمية الجسيمات LDL حل بعد 24 ساعة ، وتحديد التركيز وتخزين تحت جو الغاز الخامل في + 4 درجه مئوية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
مراقبه جوده جزيئات البروتين الدهني
HS-فؤاد يمكن استخدامها لفحص حجم وشكل جزيئات البروتين الدهني الاصليه والمعاد تشكيلها/المسمي علي الميكا. فقط قبل الاستخدام ، ميكا يجب ان تكون طازجه المشقوق (استخدام شريط لاصق لأزاله الطبقة العليا [s]) من أجل توفير سطح نظيفه ومسطحه. عند احتضان جزيئات HDL/LDL علي الميكا ، فان عامل التخفيف (و/أو وقت الحضانة) يحتاج إلى تعديل لمراقبه الجزيئات الفردية. ولا تسمح التكتلات بتحديد ابعاد الجسيمات. الجسيمات HDL هي المحمولة علي الميكا. عند استخدام التقليدية فؤاد بدلا من النظام المنسق-فؤاد ، يحتاج بروتوكول التجميد ليتم تكييفها وفقا لذلك (العازلة ، طلاء السطح) للحد من التنقل الجسيمات الجانبية. اثناء مسح العينة ، يجب ان تبقي قوه التصوير منخفضه (وضع التنصت) لتجنب اي تشوه في الجزيئات ، والذي سيؤثر بالتالي علي القيم المقاسه. لتحليل البيانات ، تم الكشف عن الجسيمات عن طريق خوارزميه عتبه (علي سبيل المثال ، في غويندديون: الحبوب > علامة بواسطة عتبه) وتم تحديد ارتفاعها فيما يتعلق سطح الميكا. قياس ارتفاع الجزيئات هو الطريقة الأكثر دقه لتحديد احجام الجسيمات ، حيث ان الابعاد الجانبية الظاهرة يتم توسيعها بواسطة شكل الطرف (انظر الصور المثالية في الشكل 4). وقد تم حساب وظائف الكثافة الاحتمالية (pdfs) لمرتفعات الجسيمات للتقييم الإحصائي ومقارنه توزيعات الحجم لجزيئات البروتين الدهني المختلفة. مقارنه بين جزيئات LDL الاصليه والمسمية ميرنا كما هو مبين في الشكل 4 يجعل من الممكن التحقق من التشابه الرئيسي بين المسمية وغير المسمية (اي الاصليه) جزيئات البروتين الدهني (المسمي جزيئات ldl دون أضافه ميرنا/ وتظهر مخاليط النطاف كعنصر تحكم لاجراء وضع العلامات نفسها). استغرق الاجراء برمته حوالي 1 يوم.
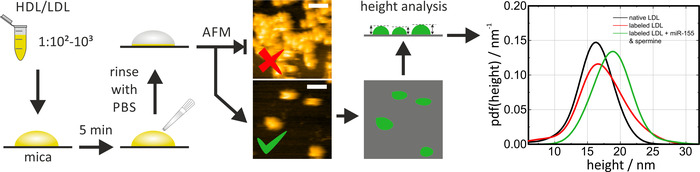
الشكل 4: المخطط الانسيابي والنتائج التمثيلية لقياسات النظام المنسق-فؤاد. تمييع الجسيمات HDL/LDL عينه في الخدمات التلفزيونية العامة (1:102-1:103) واحتضانها علي ميكا المشقوق الطازجة لمده 5 دقائق ، تليها شطف دقيق مع تلفزيوني لأزاله الجزيئات الحرة (وليس كثفت بالكهرباء). أداء التصوير HS-فؤاد والتحقق من كثافة الجسيمات علي السطح. تنفيذ القياسات في الخدمات التلفزيونية في درجه حرارة الغرفة. الصورة العليا لهذا الرقم يظهر كثافة الجسيمات عاليه جدا; الصورة السفلية هي مناسبه للتحليل. تم تحليل ارتفاع جزيئات واحده بعد الدرس والأصلي (منحني اسود) والمعاد تشكيلها/المسمي (منحني الأحمر والأخضر) تمت مقارنه الجسيمات في التقييم الإحصائي. شريط مقياس = 100 نانومتر. وقد تم تعديل هذا الرقم من Axmann وآخرون19. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
ميرنا استخراج ، عكس النسخ ، و qPCR
وقد اجري استخراج ميرنا من البروتين الدهني الأصلي/المخصب بشكل مصطنع أو عينات الخلايا باستخدام مجموعه استخراج ميرنا كما هو مبين في 5 ا. ببموجب هذا ، كانت بيئة خاليه من RNase حرجه. استغرقت هذه الخطوة حوالي 1 ح. تم اجراء النسخ العكسي لعينه ميرنا المستخرجة (الشكل 5 ب) باستخدام الإجراءات الكيميائية الحيوية القياسية كما هو موصوف من قبل الشركة المصنعة. استغرقت هذه الخطوة حوالي 1.5 ساعة. وأخيرا ، تم تحديد كميه cDNA التي تم الحصول عليها خلال الخطوة الاخيره باستخدام qPCR (الشكل 5 ج). والمنحني القياسي ، الذي يربط القيم التي تم الحصول عليها من الدرجة c إلى الرقم المطلق لحبل ميرنا ، أسفر عن محتوي ميرنا المطلق للعينه الاوليه. استغرق هذا حوالي 2.5 h.
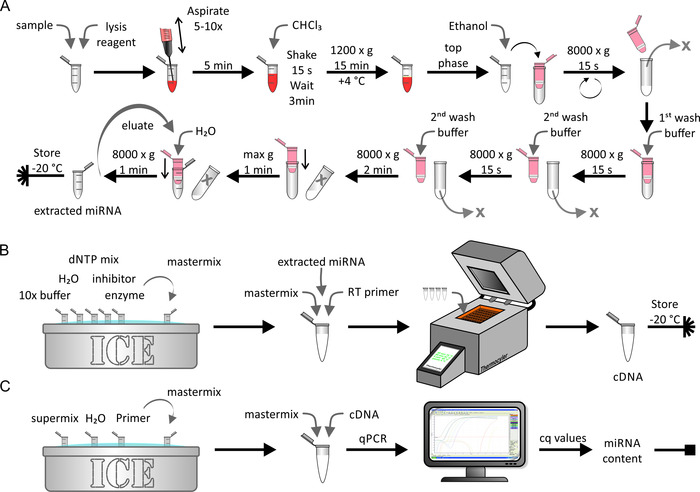
الشكل 5: مخطط استخراج ميرنا ، النسخ العكسي ، و qPCR. (ا) استخراج ميرنا: خلط العينة مع كاشف تحلل و lyse ذلك عن طريق الطموح باستخدام حقنه. احتضان لمده 5 دقائق وأضافه CHCl3. يهز بقوة لمده 15 ثانيه واحتضان لمده 3 دقائق. بعد طرد في 1,200 x g لمده 15 دقيقه في 4 °c ، وجمع المرحلة العليا ومزجها مع الايثانول. نقل الحل إلى عمود تدور (الحد الأقصى لحجم < 700 μL) والطرد المركزي عليه في 8,000 x g ل 15 س. تجاهل التملص وكرر الخطوة الاخيره مع بقية الحل. أضافه المخزن المؤقت الغسيل الأول وأجهزه الطرد المركزي في 8,000 x g ل 15 s. تجاهل والتملص ، أضافه المخزن المؤقت الغسيل الثاني ، وأجهزه الطرد المركزي في 8,000 x g ل 15 ثانيه. كرر الخطوة الاخيره مع طرد time 2 دقيقه. مزيد من تجفيف الغشاء عن طريق طرد باقصي سرعه لمده 1 دقيقه. Elute ميرنا مع H2س وأجهزه الطرد المركزي في 80,000 x g لمده 1 دقيقه. تخزين عينه ميرنا المستخرجة في-20 درجه مئوية. (ب) النسخ العكسي: ذوبان العازلة 10X ، H2س ، dntp ميكس ، المثبط ، والانزيم علي الجليد واعداد المزيج الرئيسي. أضافه ميرنا المستخرجة من لوحه A إلى المزيج الرئيسي والتمهيدي النسخ العكسي وأداء النسخ العكسي باستخدام اله ثيرموسيكلير. تخزين عينه cDNA عند-20 درجه مئوية. (ج) qpcr: ذوبان المزيج الفائق ، H2O ، والتمهيدي علي الجليد واعداد المزيج الرئيسي. أضافه cDNA من لوحه B إلى المزيج الرئيسي وتنفيذ qpcr. تحليل البيانات للحصول علي قيم جس وحساب المحتوي ميرنا المطلق للعينه (انظر الشكل 6 والنتائج التمثيلية للتفاصيل). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
المحتوي ميرنا المطلق ومعدل نقل
وقد تم حساب المحتوي المطلق لهذه الجزيئات من الجسيمات الاصليه والمخصبة بشكل مصطنع ومن جزيئات ال LDL من القيم c للعينات والمنحني المعياري لكل منها علي النحو المبين في الصورة 6. يظهر الشكل 6A البيانات كما تم حسابها بواسطة برنامج التحليل (مع تطبيع ديناميكتيوب المنشط [للتعويض عن مستويات الخلفية المختلفة باستخدام المشتقة الثانية لكل تتبع عينه] وتصحيح انحدار الضوضاء [التطبيع إلى مستوي الضجيج]). تم تحديد القيم جس من المنحنيات القياسية باستخدام وظيفة عتبه البحث التلقائي لحزمه البرامج علي اشاره الفلورية تطبيع تقاس بواسطة اله qpcr. ببموجب هذا ، البرنامج إلى اقصي درجه R-القيمة من نوبة من منحني القياسية. وابقي علي مستوي العتبة ثابتا لكل تحليل عينه ميرنا محدده. وفي وقت لاحق ، تم رسم قيم جس كداله لعدد خيوط ميرنا ، وتم حساب خط الانحدار. وحددت قيم العينة جس بنفس مستوي العتبة كما هو مبين في الشكل 6 باء؛ تم تعويض الاختلافات في كفاءه التفاعل بين تشغيلات qPCR المختلفة تلقائيا بواسطة البرنامج باستخدام عينه منحني معايره اضافيه واحده مضمنه في كل شوط. باستخدام معادله خط الانحدار ، يمكن حساب مقدار غير معروف من ميرنا في العينة. وقد قدر عدد جزيئات البروتين الدهني من تركيز بروتيني الاوليه ومتوسط الوزن الجزيئي (MWHDL ~ 250 كده). التالي, لم يتم افتراض اي مساهمه الدهون في الوزن الجزيئي — التالي, عدد خيوط ميرنا لكل الجسيمات البروتين الدهني كانت مبالغه قليلا. وعلاوة علي ذلك ، تم افتراض معدل الاسترداد 100 ٪ من ميرنا خلال خطوه استخراج ميرنا. وعلاوة علي ذلك ، تم تحديد محتوي ميرنا من الخلايا قبل وبعد الحضانة مع جزيئات HDL وتم حساب معدل نقل ميرنا كما هو مبين في الشكل 6C.
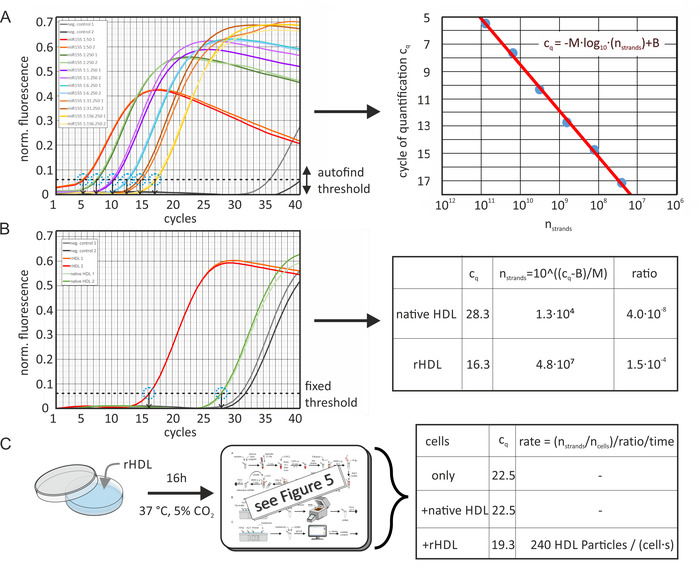
الشكل 6: مخطط بياني لحساب المحتوي المطلق لميرنا ومعدل النقل. (ا) المنحني القياسي ل mir-155: تم التخفيف بشكل متسلسل 155 من المياه الخالية من الحمض الريبي النيبالي (100 μl ، 10 μM) بالماء الذي لم يتم الاشاره اليه. وقد أثمرت qPCR القيم جس لكل عينه التخفيف التسلسلي (تقاس مرتين) باستخدام وظيفة عتبه البحث التلقائي لحزمه البرامج. وأسفرت تجارب التحكم السلبية (بدون أضافه ميرنا) عن قيم جس من > 35. وقد تم تركيب نقاط البيانات الخاصة بقيم cq كداله لعدد خيوط ميرنا في حجم العينة (محسوبة من التركيز الاولي والمخففات التسلسلية) مع المعادلة المعروضة (الخط الأحمر ، الصورة الصحيحة) ، الغلة M =-3.36 و B = 42.12. ال يقرر [بكر] كفاءه كان 0.98. تم حساب أشرطه الخطا من نتائج التكرار التجريبية وكانت أصغر من قطر دائره نقطه البيانات. (ب) تم تحديد القيم cq لجزيئات HDL الاصليه/المخصبة بشكل مصطنع بنفس مستوي العتبة المحدد في اللوحة A وتم تحويلها إلى عدد خيوط ميرنا في حجم عينه qpcr. تم حساب النسبة المطلقة من ميرنا من العينة الاصليه من عدد (تركيز) جزيئات HDL في حجم العينة (3.2 × 1011 جزيئات). (ج) عينات الخلية (خط الخلية ldlA7) تم احتضانها لمده 16 ساعة مع جزيئات HDL المخصب بشكل مصطنع (50 ميكروغرام/مل) وتحليلها بالمثل. كانت القيم cq المحددة 22.5 ، 22.5 ، و 19.3 للخلايا فقط ، للخلايا المحتضنة مع HDL الأصلي ، أو للخلايا المحتضنة مع محلول الجسيمات rhdl (كل من 50 ميكروغرام/مل) ، علي التوالي. تم تحويل هذه القيم إلى عدد خيوط ميرنا كما تم في اللوحة B. تم تصحيح عدد خيوط ميرنا بعد الحضانة (7.3 x 106) عن طريق الطرح من عدد خيوط ميرنا قبل الحضانة (8.6 x 105). وكانت النتيجة مقسومه علي عدد الخلايا في وحده التخزين العينة (3,100) ، ونسبه الجسيمات ميرنا-الجزيئات (1.5 x 10-4) ، وفتره الحضانة (16 ساعة). وهذا أسفر عن معدل نقل جزيئات البروتين الدهني عن طريق امتصاص ميرنا (240 الجسيمات HDL امتصاص الاحداث لكل خليه والثانية). وقد تم تعديل هذا الرقم من Axmann وآخرون19. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
مجموعه ميكروفلويدريك متعددة الآبار
بسبب الغلات الصغيرة من استخراج ميرنا ، وأعقب النسخ العكسي من ميرنا المستخرجة خطوه التضخيم المسبق. وأخيرا ، وكما هو مبين في الشكل 6، اجري التقييم القطري. لجميع الخطوات ، تم استخدام الإجراءات البيوكيميائية القياسية كما هو موضح من قبل الشركة المصنعة. هنا ، ويظهر جزء من الملف الشخصي ميرنا العالمية علي الجسيمات HDL من المرضي اليوريميه لدراسة حول تاثير نموذج الإبلاغ الموحد علي افلوكس الكوليسترول من الضامة18 . في هذه الدراسة, قدره متقبل الكولسترول HDL أو المصل في — إلى جانب الآخرين — 17 الشباب المرضي الحالب البالغين (كد مراحل 3-5) و 14 الشباب البالغين غسيل الكلي المرضي دون الامراض المرتبطة بها وتم قياس الضوابط المتطابقة. لتحليل البيانات ، تم استخدام الإعدادات الافتراضية (الحد الأقصى لقيمه CT المسموح به: 40.0 ، بما في ذلك الحد الأقصى لقيم التصوير المقطعي في الحسابات واستبعاد المتطرفين بين النسخ المتماثلة). تم تعديل قيم Pباستخدام بينجاميني-hochberg معدل اكتشاف كاذبه (تصحيح حدوث إيجابيات كاذبه) ، وكطريقه التطبيع ، تم تحديد التطبيع العالمي ، الذي يجد المقايسات المشتركة بين جميع عينات لاستخدام متوسط لها CT لتطبيع. في النتائج التمثيلية ، يتم تصوير بعض rqs من mirnas معزولة من hdls من المرضي اليوريميه (rqs من الضوابط هي 1). ومن الواضح ان مير-122 و مير-224 يتم التعبير عنها بشكل كبير في HDLs من المرضي الحالب. استغرقت هذه الخطوة بأكملها حوالي 1 يوم.
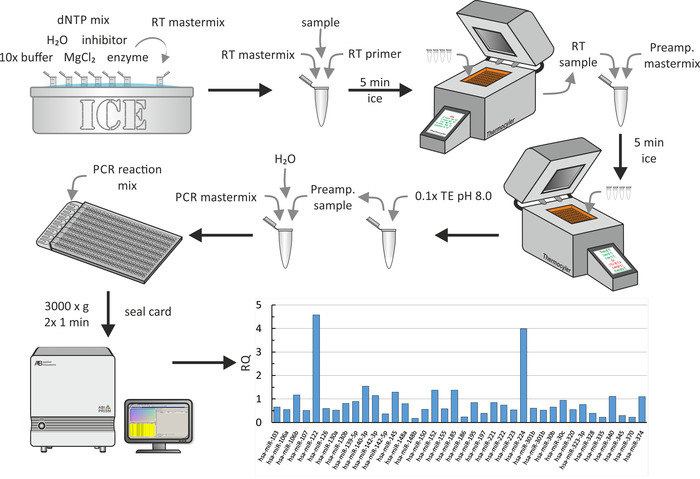
الشكل 7: المخطط الانسيابي والنتائج التمثيلية لمجموعه ميكروفلويدريك متعددة الآبار. بعد استخراج ميرنا كما هو مبين في الشكل 5A، ومزج عينه ميرنا مع التمهيدي النسخ العكسي ومزيج رئيسي يحتوي علي 10x العازلة ، H2س ، dntp ميكس ، المثبط ، mgcl2، والانزيم. بعد الحضانة علي الجليد لمده 5 دقائق ، وأداء النسخ العكسي باستخدام اله ثيرموسيكلير. أضف مزيج التضخيم الرئيسي ، واحتضنه لمده 5 دقائق علي الجليد ، وقم باجراء التضخيم المسبق باستخدام اله ثيرموسيكلير. أضافه 0.1 x TE (pH 8.0) ومزج قسامه مع المزيج الرئيسي pcr و H2س. ماصه مزيج رد فعل pcr في ميناء التعبئة من صفيف ميكروفلويديك متعددة وتدور مرتين في 3,000 x ز لمده دقيقه واحده كل. اجراء qpcr باستخدام نظام PCR وتحليل البيانات لإنتاج القيم rq (هنا ، يظهر الشكل rq قيم الجسيمات HDL من المرضي يوريميه بالمقارنة مع مجموعه السيطرة الصحية18). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
هنا ، يتم وصف العزلة من الجزيئات البروتين الدهني من الدم البشري وتحديد محتواها ميرنا الفردية خطوه بخطوه. من المهم للعمل في بيئة خاليه من RNase في حين التعامل مع معزولة وتوليفها ميرنا-الجسيمات المضمنة ميرنا من الواضح محمية من تدهور الانزيميه. كما نسبه ميرنا/الجسيمات من جزيئات البروتين الدهني الأصلي منخفضه نوعا ما ، والإثراء الاصطناعي مع ميرنا مطلوب لدراسة امتصاص الجسيمات هولو من الخلايا. التالي ، فان أعاده تشكيل جزيئات HDL كما هو موضح سابقا7 يتم تعديلها لدمج خيوط ميرنا. بالاضافه إلى ذلك ، فان فصل الدهون وكسر البروتين خلال هذا الاجراء يسمح للعلماء بفحص المكونات المرتبطة بالدهن والبروتين في جسيمات البروتين الدهني19. بطريقه مماثله ، يتم تكييف الاجراء الوسم من جزيئات LDL. ومن المثير للاهتمام ، ان أضافه النطاف-المثبت الطبيعي للالنيوبوتيدات-لم يؤثر علي نسبه ميرنا/الجسيمات. وتجدر الاشاره إلى ان الطريقة ، من حيث المبدا ، تسمح بعدم الطي من المواد الأخرى من ميرنا داخل جسيمات البروتين الدهني. وبطبيعة الحال ، هناك حد فيما يتعلق بالحجم المادي للمادة استنادا إلى الحجم الكلي لل HDL (القطر: 5-12 نانومتر) وجزيئات LDL (القطر: 18-25 نانومتر).
وفيما يتعلق بمراقبه الجودة من الجزيئات الدهنية المعاد تشكيلها/المسمي, HS-فؤاد هو طريقه قابله للتطبيق لتوصيف الجسيمات HDL/LDL علي مستوي الجسيمات واحد. بالمقارنة مع EM ، فانه يسمح لأوقات التحضير أقصر والظروف شبه الفسيولوجية (الرطب ، درجه حرارة الغرفة).
نظرا لحساسيته المتاصله والتضخيم ، qPCR هو الأسلوب المفضل للكشف عن تركيزات ميرنا منخفضه. بدلا من ذلك ، واحد جزيء المجهر المجهري الحساسة ، والتي هي قادره علي الكشف عن جزيئات الفردية حتى ، لن تكون مناسبه بسبب تركيزات منخفضه ، علي سبيل المثال ، فلوريسسينتلي المسمي ميرنا خيوط لكل الجسيمات. وهكذا ، تم العثور علي نسبه خيوط ميرنا لكل الجسيمات الدهنية الاصليه لتكون 10-8. الإثراء الاصطناعي يزيد من نسبه بمعامل 10,000 ، مما يسهل تقدير معدل امتصاص البروتين الدهني الخلوي (لم يتم الكشف عن اي فرق كبير باستخدام جزيئات البروتين الدهني الأصلي 19). الحساسية العالية من qPCR يجعل من الممكن تحديد معدل الامتصاص هذا عن طريق قياس عدد خيوط ميرنا بعد وقت الحضانة ونسبه ميرنا/الجسيمات. وتجدر الاشاره إلى ان القيمة المحسوبة تتجاهل تدهور الخلوية والإفراج عن ميرنا ، التالي ، يمثل علي الأقل حدا ادني لنسبه امتصاص جزيئات البروتين الدهني.
في المستقبل ، يمكن تكييف هذه الطريقة لنقل المواد الصيدلانية (ولا سيما أيضا محبه للدهون منها) في الخلايا وربط تاثيرها البيولوجي علي تركيز داخل الخلية (تحديد من خلال معدل امتصاص جزيئات البروتين الدهني).
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
وقد حظي هذا العمل بدعم مشروع صندوق العلوم النمساوي P29110-B21 ، وهو مشروع "هوخشوليومبوسستيفتونغ دير شتات فيينا تسور فورستر دير ويسنشافت" 3065/2011 ، الصندوق الأوروبي للتنمية الاقليميه (EFRE, IWB2020) ، الدولة الاتحادية لأعالي النمسا ، و "الأرض OÖ Basisfinanzierung".
Materials
| Name | Company | Catalog Number | Comments |
| Ultracentrifuge | Beckman | Optima L-100 XP | Lipoprotein isolation |
| Ultracentrifuge rotor | Beckman | TI 55.2 | Lipoprotein isolation |
| Vacutainer (EDTA) | Becton Dickinson | 366643 | Lipoprotein isolation |
| Kaliumbromid | Sigma Aldrich | 2110 | Lipoprotein isolation |
| Ultracentrifuge tubes | Beckman | 342414 | Lipoprotein isolation |
| Ultracentrifuge tube sealer | Beckman | 342428 | Lipoprotein isolation |
| Sodiumchlorid | Carl Roth GmbH | P029.2 | Lipoprotein isolation |
| EDTA | Fisher Scientific | D/0650/50 | Lipoprotein isolation |
| Dialysis tubes, MWCO 12 - 14k | Spectra | 132700 | Lipoprotein isolation |
| synthetic miRNA | microSynth | - | synthetic miRNA |
| TRIS buffer pH 7 | Ambion | AM9850G | synthetic miRNA |
| TRIS buffer pH 8 | Ambion | AM9855G | synthetic miRNA |
| sterile tubes | Carl Roth GmbH | ENE8.1 | synthetic miRNA |
| Photometer | Eppendorf | Eppendorf Biophotometer | Bradford assay |
| Cuvette | Carl Roth GmbH | XK20 | Bradford assay |
| Coomassie G-250 Stain | BioRad GmbH | 161-0786 | Bradford assay |
| Sodiumchlorid | Carl Roth GmbH | 3957.1 | Delipitation |
| EDTA | Fluka Analytical | 03690-100ML | Delipitation |
| TRIS buffer pH 8.0 | Ambion | AM9855G | Delipitation |
| Ethanol 100% | AustrAlco | Ethanol Absolut 99.9% | Delipitation |
| Diethyl ether | Carl Roth GmbH | 3942.1 | Delipitation |
| Centrifuge | Thermo Scientific | Multifuge X3R | Delipitation |
| Chloroform | Carl Roth GmbH | 3313.1 | Reconstitution |
| Methanol | Carl Roth GmbH | 4627.1 | Reconstitution |
| Phosphatidylcholine | Sigma Aldrich GmbH | P3556-25mg | Reconstitution |
| Cholesterol oleate | Sigma Aldrich GmbH | C-9253-250mg | Reconstitution |
| cholesterol | Sigma Aldrich GmbH | C8667-500mg | Reconstitution |
| glass tubes | Carl Roth GmbH | K226.1 | Reconstitution |
| spermine | Sigma Aldrich GmbH | S3256-1G | Reconstitution |
| Thermomixer | Eppendorf | Thermomixer comfort | Reconstitution |
| Sodium deoxycholate | Sigma Aldrich GmbH | 3097-25G | Reconstitution |
| Magnetic stir bar | Carl Roth GmbH | 0955.2 | Reconstitution |
| 100µL micropipettes | Carl Roth GmbH | A762.1 | Reconstitution |
| PBS | Carl Roth GmbH | 9143.2 | Dialysis |
| Amberlite XAD-2 beads | Sigma Aldrich GmbH | 10357 | Dialysis |
| Slide-A-Lyzer casette (cut-off 20 kDa) | Thermo Scientific | 66003 | Dialysis |
| Syringe | Braun | 9161406V | Dialysis |
| Syringe needle | Braun | 465 76 83 | Dialysis |
| EGTA | Carl Roth GmbH | 3054.2 | Labeling of LDL particles |
| DMSO | life technologies | D12345 | Labeling of LDL particles |
| Atomic Force Microscope | RIBM | SS-NEX | Quality control of reconstituted/labeled lipoprotein particles |
| Muscovite Mica (V-1 Grade) | Christine Gröpl | G250-1/V1 | Quality control of reconstituted/labeled lipoprotein particles |
| AFM Cantilever | Nanoworld | USC-F1.2-k0.15 | Quality control of reconstituted/labeled lipoprotein particles |
| Gwyddion 2.49 | Czech Metrology Institute | http://gwyddion.net | Quality control of reconstituted/labeled lipoprotein particles |
| Chamber slides, Nunc Lab-Tek | VWR | 734-2122 | Cell culture |
| HBSS | Carl Roth GmbH | 9117.1 | Cell culture |
| Cell counter | Omni Life Science GmbH | Casy | Cell culture |
| miRNeasy Mini Kit | QIAGEN | 217004 | miRNA extraction |
| Centrifuge | Eppendorf | 5415R | miRNA extraction |
| 20G needle | Braun | Sterican 465 75 19 | miRNA extraction |
| 5ml syringe | Becton Dickinson | 309050 | miRNA extraction |
| PCR cabinet | Esco | PCR-3A1 | Reverse Transcription |
| TaqMan Reverse Transcription Kit | Thermo Scientific | 4366596 | Reverse Transcription |
| Rnase-free water | Carl Roth GmbH | T143 | Reverse Transcription |
| 0.2 ml tubes | Brand | 781305 | Reverse Transcription |
| Centrifuge | Carl Roth GmbH | Microcentrifuge AL | Reverse Transcription |
| Thermocycler | Sensoquest | Labcycler | Reverse Transcription |
| TaqMan Primer | Thermo Scientific | - | qPCR |
| iTaq Universal probe supermix | BioRad GmbH | 1725131 | qPCR |
| PCR machine | Corbett | Rotor-Gene RG-6000 | qPCR |
| TaqMan MicroRNA Reverse Transcription Kit | Applied Biosystems | 4366596 | TaqMan Array |
| Megaplex RT Primers, Human Pool A v2.1 | Applied Biosystems | 4399966 | TaqMan Array |
| TaqMan PreAmp Master Mix | Applied Biosystems | 4391128 | TaqMan Array |
| Megaplex PreAmp Primers, Human Pool A v2.1 | Applied Biosystems | 4399933 | TaqMan Array |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | TaqMan Array |
| TaqMan Advanced miRNA Human A Cards | Applied Biosystems | A31805 | TaqMan Array |
| Nuclease-free water | Thermo Scientific | R0581 | TaqMan Array |
| MgCl2 (25mM) | Thermo Scientific | R0971 | TaqMan Array |
| TE, pH 8.0 | Invitrogen | AM9849 | TaqMan Array |
| 7900HT Fast Real-Time PCR System | Applied Biosystems | 4351405 | TaqMan Array |
| TaqMan Array Card Sealer | Applied Biosystems | - | TaqMan Array |
References
- Vickers, K. C., Palmisano, B. T., Shoucri, B. M., Shamburek, R. D., Remaley, A. T. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nature Cell Biology. 13 (4), 423-435 (2011).
- Tabet, F., et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nature Communications. 5, (2014).
- Wahid, F., Shehzad, A., Khan, T., Kim, Y. Y. MicroRNAs: Synthesis, mechanism, function, and recent clinical trials. Biochimica et Biophysica Acta - Molecular Cell Research. 1803 (11), 1231-1243 (2010).
- Carthew, R. W., Sontheimer, E. J. Origins and Mechanisms of miRNAs and siRNAs. Cell. 136 (4), 642-655 (2009).
- Fabian, M. R., Sonenberg, N., Filipowicz, W. Regulation of mRNA Translation and Stability by microRNAs. Annual Review of Biochemistry. 79 (1), 351-379 (2010).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: Are the answers in sight?. Nature Reviews Genetics. 9 (2), 102-114 (2008).
- Jonas, A. Reconstitution of High-Density Lipoproteins. Methods in Enzymology. , 553-582 (1986).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Bustin, S. A., et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Patsch, J. R., Patsch, W. Zonal ultracentrifugation. Methods in Enzymology. 129 (1966), 3-26 (1986).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Yamamoto, D., et al. High-Speed Atomic Force Microscopy Techniques for Observing Dynamic Biomolecular Processes. Methods in Enzymology. 475, 541-564 (2010).
- Stangl, H., Cao, G., Wyne, K. L., Hobbs, H. H. Scavenger receptor, class B, type I-dependent stimulation of cholesterol esterification by high density lipoproteins, low density lipoproteins, and nonlipoprotein cholesterol. Journal of Biological Chemistry. 273 (47), 31002-31008 (1998).
- Hochberg, B. Controlling the False Discovery Rate: a Practical and Powerful Approach to Multiple Testing. Journal of the Royal Statistical Society. 57 (1), 289-300 (1995).
- Mestdagh, P., et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biology. 10 (6), (2009).
- Schumaker, V. N., Puppione, D. L. 6] Sequential Flotation Ultracentrifugation. Methods in Enzymology. 128 (C), 155-170 (1986).
- Wagner, J., et al. Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1392-1400 (2013).
- Meier, S. M., et al. Effect of chronic kidney disease on macrophage cholesterol efflux. Life Sciences. 136, 1-6 (2015).
- Axmann, M., et al. Serum and Lipoprotein Particle miRNA Profile in Uremia Patients. Genes. 9 (11), 533 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved