Method Article
MicroRNA ile yerli lipoprotein parçacıkları zenginleştirme ve onların mutlak/bağıl microRNA Içerik ve onların hücresel transfer hızı sonraki belirlenmesi
Bu Makalede
Özet
Burada, lipoprotein parçacıklarının yerel Micro-RNA içeriğinin (mutlak/göreceli) belirlenmesi için nicel gerçek zamanlı polimeraz zincir reaksiyon tabanlı protokol sunulur. Buna ek olarak, Mikro-RNA seviyesini artırmak için bir yöntem, hem de lipoprotein parçacıkları hücresel alımını oranını belirlemek için bir yöntem gösterilmiştir.
Özet
Lipoprotein parçacıklar kan dolaşımında lipid ve kolesterol ağırlıklı taşıyıcılar vardır. Ayrıca, küçük miktarlarda kodlaması olmayan microRNA (miRNA) ipleri içerir. Genel olarak, miRNA, Messenger-RNA (mRNA) ile etkileşimleri nedeniyle protein ifadesi profilini değiştirir. Böylece, lipoprotein parçacıklarının göreceli ve mutlak miRNA içeriğinin bilgisi, hücresel parçacık alımı biyolojik etkisini tahmin etmek için esastır. Burada, lipoprotein parçacıklarının mutlak miRNA içeriğini belirlemek için, yerli ve miRNA zenginleştirilmiş lipoprotein parçacıkları için gösterilen örneklenmiş bir nicel gerçek zamanlı polimeraz zincir reaksiyonu (qPCR) tabanlı protokol sunulmaktadır. Göreceli Mirna içeriği multiwell mikroakışkan dizi kartları kullanılarak niceleyilmiş. Ayrıca, bu protokol bilim adamlarının hücresel Mirna ve böylece, lipoprotein parçacık alımını oranı tahmin sağlar. Hücre miRNA seviyesinin önemli bir artışı, miRNA ile yapay olarak yüklenmiş yüksek yoğunluklu lipoprotein (HDL) parçacıkları kullanıldığında gözlemlenebilir, ancak yerel HDL partikülleri ile inkübasyon oldukça düşük miRNA içeriği nedeniyle önemli bir etki vermez. Buna karşılık, düşük yoğunluklu lipoprotein hücresel alımı (LDL) parçacıklar-ne yerli miRNA ile ne de yapay ile yüklü-hücresel miRNA seviyesini değiştirmez.
Giriş
Lipoprotein parçacıkları, kolesteril esterleri ve trigliserid yağların bir çekirdeğini kapsayan, amphiphilik lipidler ve kolesterol bir tek tabakalı oluşur. Tüm parçacık, parçacık biyolojik işlevselliğini tanımlayan membran gömülü Apolipoproteinler tarafından stabilize edilir. Lipoprotein parçacıklar kendi artan yoğunluğa göre ayırt edilebilir ve böylece, azalan boyutu, yani çok-düşük yoğunluklu lipoprotein (VLDL), orta yoğunluklu lipoprotein (IDL), LDL, ve HDL parçacıkları. Kan dolaşımında su çözünmez bileşenlerin taşınması rağmen, bu HDL parçacıkları Mirna1,2kodlama olmayan ipler taşımak göstermiştir. Mikro-Rnas kısa bir sınıf (genellikle iki düzine nükleotis) RNA ipleri, hangi hücre dışı tamamlayıcı mRNA iplerini düşür ve böylece, belirli proteinler ifade profilini değiştirmek3,4,5, 6' ya kadar. Ayrıca, miRNA profilinin değişimleri çeşitli hastalıklarda bulunmuştur ve böylece profil tanı ve prognoz için bir biyomarker olarak uygulanabilir. MiRNAs 'ın lipoprotein parçacıkları aracılığıyla hücreler arasında harici olarak taşınması, hücre içi mRNA seviye modülasyonu için ek bir mekanizma olarak hizmet verebilir. Biyolojik etkiyi niceciksel olarak tahmin etmek için lipoprotein parçacıklarının mutlak ve göreceli miRNA içeriğine ilişkin bilgi gereklidir.
Nicel gerçek zamanlı PCR bu bilgileri elde etmek için uygun ve nispeten hızlı bir yöntemdir. Bu nedenle, göreli kantifikasyon (RQ) değeri hesaplanabilir ve farklı örnekler ile lipoprotein fraksiyonları arasındaki göreceli farklar tahmin edilebilir. Multiwell mikrofluidik dizi kartları, bir örnekteki miRNAs 'ın göreli varlığını (RQ değerine eşittir) belirlemek için hızlı ve kolay kullanımlı bir yöntemdir. Multiwell mikrofluidik dizi kartları mikrofluidik bir cihaza gömülü bireysel qPCR reaksiyonlar için 96 veya 384 bireysel reaksiyon odaları oluşur. Her oda, tek bir miRNA için gerekli hidroliz prob ve belirli qPCR astar içerir. Avantajlar, standardizasyon, basit bir iş akışı ve daha az sayıda pipetleme adımından dolayı kısa bir kullanım zamanıdır. Dahası, gerekli numune hacmi minimize edilir. Göreli quantification aksine, mutlak miRNA içeriği miRNA iplerin bilinen mutlak sayılar standart eğrileri ile qPCR örnek sonuçları bir karşılaştırma gerektirir. Bu unutulmamalıdır ki, nispeten düşük miRNA içeriği nedeniyle, standart ve, dahası, hatta tek molekül duyarlı görüntüleme teknikleri mümkün değildir-miRNA ile lipoprotein partiküllerinin yapay zenginleştirme hücresel çalışma kaçınılmaz lipoprotein parçacık etkileşimi ve miRNA transferi. Bununla ilgili olarak, HDL parçacığın delipidation sonraki relipidation7 ile birleştirilmesi ve böylece, Mirna ipleri ile zenginleştirme sağlar izledi. MiRNA ile LDL partiküllerinin benzerliği, LDL parçacıklarının ana bileşeni olan apoB-100 proteinin hidrofobiği nedeniyle uygulanabilir değildir. Ancak, lipid membranlarına nüfuz eden Polar solvent dimetil sülfoxid (DMSO) ek olarak, LDL parçacıkları yapay olarak miRNA ipleri ile de yüklenebilir.
Yüksek hızlı atomik kuvvet mikroskobu (HS-AFM) subnanometer uzamsal ve subsecond temporal çözünürlük8sunan biyolojik numunelerin karakterizasyonu için güçlü bir araçtır. Bu nedenle, yerel/reconstituted/etiketli lipoprotein parçacıkları gibi değiştirilmiş lipoprotein parçacıklarının kalite kontrolü için iyi uygun bir tekniktir, yakın fizyolojik bir çevre altında görüntülenmiş olabilir.
Burada, qPCR tabanlı bir protokol, lipoprotein parçacıklarının ve hücre örneklerinin mutlak/göreceli miRNA içeriğini belirlemek için adım adım sunulur ve bu da hücresel lipoprotein parçacık alımı oranının tahmin edilmesini sağlar. Dahası, miRNA ile lipoprotein parçacıklarının zenginleşmesi için bir yöntem gösterilmiştir. Bu yöntem lipoprotein içeriğinin genel manipülasyon için adapte olabilir ve bu nedenle, ilaç teslimi için hedefler olarak lipoprotein parçacıklarının uygulanabilirliğini gösterir.
Protokol
Kan bağışları, Viyana Tıp Üniversitesi Etik Komitesi (EK-Nr. 511/2007, EK-Nr. 1414/2016) tarafından onaylanmıştır. Nomenclature, nicel gerçek zamanlı PCR denemeleri (MıQE)9 yönergelerin yayınlanması Için minimum bilgilere göre kullanılır.
1. insan kanından lipoprotein parçacık yalıtımı
- Bir ultracent Gece oruç sonra sağlıklı gönüllülerden kan çizin.
Not: genellikle gerekli üç bağış, bağışlayan 80 mL her, ve kan toplama tüpleri içeren ethylenediaminetetraasetic asit (EDTA) antikoagülan olarak. - 2.000 x g 'de 4 °c ' de 20 dakika Santrifüjü ve hasat plazması (üst faz); kesme kuvvetlerinden kaçının. Toplam hacmi V belirleyin ve gerekirse, fosfat-tamponlu tuz (PBS) kullanarak santrifüjleme tüp hacminin birden fazla ayarlayın. 1 mL 3x kütlesini ölçün ve ortalama yoğunluk ı. $ hesaplamak.
- Aşağıdaki denklem10 ile yoğunluk ayarlaması için gerekli Potasyum bromür (KBR) miktarını hesaplayın (gram/mililitre istenilen yoğunluk Için, A = 1,019 kullanın ve belirli bir kbr hacmi için = 0,364 ml/g kullanın
 ). KBr 'i plazmaya ekleyin ve KBr tamamen çözünene kadar kesme kuvvetlerini önlemek için yavaşça karıştırın.
). KBr 'i plazmaya ekleyin ve KBr tamamen çözünene kadar kesme kuvvetlerini önlemek için yavaşça karıştırın.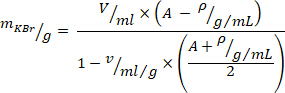
- 1,2 adımda açıklandığı gibi yoğunluğu ölçün ve gerekirse, daha fazla KBR ekleyerek yeniden ayarlayın. plazma ile ultracent Herhangi bir hava kabarcıkları kaçının; Aksi takdirde, tüp çökebilir. Rotora tüpleri üreticinin talimatlarına göre yerleştirin ve 214.000 x g 'de santrifüjün 4 °c ' de 20 saat boyunca santrifüj yapın.
- Tüpleri üreticinin talimatlarına göre açın ve VLDL ve IDL içeren üst aşaması atın. Toplam hacim V belirleyin ve gerekirse, PBS kullanarak santrifüjleme tüp hacmi birden fazla ayarlayın.
- Alt kesinin ağırlığı ı. $. Yoğunluk ayarı için gerekli KBr miktarını hesaplayın ( A = 1,063 kullanın). KBr çözülene kadar kesme kuvvetlerini önlemek için yavaşça karıştırın. 1,4 adımı yineleyin.
- LDL parçacıkları içeren üst aşaması çıkarın ve toplayın. LDL parçacık çözümünü 4 °C ' de inert gaz atmosferi altında saklayın. Toplam hacim V belirleyin ve gerekirse, PBS kullanarak santrifüjleme tüp hacmi birden fazla ayarlayın. 1,2 adımda açıklandığı gibi alt kesir yoğunluğu $
- Yoğunluk ayarı için gerekli KBr miktarını hesaplayın ( A = 1,220 kullanın) ve ekleyin. KBr çözülene kadar kesme kuvvetlerini önlemek için yavaşça karıştırın. 1,4 adımı yineleyin.
- HDL parçacıklarını içeren üst aşaması çıkarın ve toplayın. Toplam hacmi V belirleyin ve gerekirse, PBS kullanarak santrifüjleme tüp hacminin birden fazla ayarlayın. Yoğunluğunu belirlemek $. 4 °C ' de 20 h için 214.000 x g 'de üst fazda ikinci bir santrifüjleme adımı albumin kaldırılması tavsiye edilir. Gerekirse, 1,8 adımı yineleyin. HDL parçacıklarını içeren üst aşaması çıkarın ve toplayın.
- En az 20 L diyaliz tamponunu (0,9% NaCl, 0,1% EDTA [pH 7,4]) 4 °C ' ye hazırlayın ve ön soğutur. Prewet Dializ tüpler (moleküler ağırlık kesme: 12 – 14 kDa) ve üreticinin talimatlarına göre LDL ve HDL parçacık solüsyonu ekleyin. 4 °C ' de 5 L diyaliz tamponunun karşı Dialyze ve 1, 2 ve 4 h sonra tampon değiştirin.
- 24 saat sonra, diyaliz tüplerinden lipoprotein parçacık çözümlerini kurtarın ve Bradford tahlil11 veya başka bir uygun bir kullanarak protein konsantrasyonu belirleyin. HDL ve LDL parçacık çözümlerini 4 °C ' de inert gaz atmosferinde saklayın.
2. sentetik Mirna plakaya
Not: RNA oligonucleotides işleme, RNase-Free çalışır. Sadece taze, tek kullanımlık plastik sarf malzemeleri ile çalışın ve her zaman sıklıkla değiştirilmesi gereken eldiven giyin. Sadece nuclease içermeyen çözümleri kullanın. Her zaman buz üzerinde çalışın.
- En yüksek kuvvet liyofilize sentetik Mirna bir Pelet oluşturmak için üreticiden elde edilen şişe aşağı spin. 10 μM (stok konsantrasyonu) miRNA son konsantrasyon için 10 mM Tris (hidrokmetil) aminomethane (TRIS) tampon, pH 7,5, uygun bir hacim ekleyin.
- Resuspension için birkaç kez hafifçe yukarı ve aşağı pipet. Her biri steril tüplerde 100 μL 'nin plakaya hazırlayın. Hemen kullanılsa-20 °C ' de saklayın. Tekrarlanan çözme ve dondurmayı kaçının.
3. HDL parçacıklarının yeniden oluşturulması
-
Delipidation
- A arabelleği hazırlayın (150 mM NaCl, 0,01% EDTA, 10 mM Tris/HCl [pH 8,0]). Santrifüjü-10 °C ' ye precool. Precool 100 etanol karışımı mL: dietil eter (3:2) at-20 °C.
DIKKAT: son derece yanıcı ve cilde zararlı olduğu için dietil eter kullanırken uygun kişisel koruyucu ekipman giyin ve duman kaputu içinde çalışın. - 5 mg HDL parçacıklarına karşılık gelen bir hacmi, 50 mL 'Lik ön soğutmalı etanol ile karıştırın: dietil eter (3:2) karışımı ve 2 saat-20 °C ' de inkük. 2.500 x g 'de-10 °c ' de 10 dakika Santrifüjü.
- Supernatant atın, 50 ml presoğutmalı etanol içinde Pelet pelletini: diyetil eter karışımı, ve 2 h-20 °c için ikinci kez inkük. 2.500 x g 'de 10 dk at-10 °c ' de Santrifüjü tekrar yapın.
Not: istenirse, HDL parçacıklarının lipid fraksiyonu Mirna içeriğinin bir analizi için süpernatant lyophilize. - N2 gaz akışı altında Pelet kurutun ve 250 μL tampon A olarak pelletini (bkz. Adım 3.1.1). Bradford protein tahlil veya başka uygun bir kullanarak protein konsantrasyonu belirlemek ve 1 mg protein/250 μL tampon A son konsantrasyon seyreltilme.
Not: protokol burada duraklatılmış olabilir. Solüsyonu gece 4 °C ' de inert gaz atmosferinde saklayın.
- A arabelleği hazırlayın (150 mM NaCl, 0,01% EDTA, 10 mM Tris/HCl [pH 8,0]). Santrifüjü-10 °C ' ye precool. Precool 100 etanol karışımı mL: dietil eter (3:2) at-20 °C.
-
Sulandırma
- Bir Fosfatidilkolin hazırlamak (PC) kloroform karışımı kullanarak stok çözüm: metanol (2:1) bir konsantrasyonda 5,6 mg PC/mL. Benzer şekilde, kolesteril oleat (5 mg CO/mL) ve kolesterol (5 mg C/mL) stok çözümlerini hazırlayın. Tüm çözümleri-20 °C ' de saklayın.
- Temiz cam tüpte Mix 500 μL PC, 100 μL CO ve 13,5 μL C. Bu birimler 100 PC yaklaşık molar oranı karşılık gelir: 22 CO: 4.8 C. homojen bir yüzey tabakası verim için tüp döndürürken N2 gaz akışı altında karışımı kuru.
Not: protokol burada duraklatılmış olabilir. -20 °C ' de inert gaz atmosferi altında cam şişesini (istenirse stoklama mümkündür) saklayın. - Yeni bir 30 mm spermin solüsyonu hazırlamak buffer a. Mix One kısım (100 μL, 10 μM) sentetik Mirna (bkz. Adım 2,2) ile 100 μL spermin solüsyonu ve 30 °c ' de otuz dak.
Not: negatif kontrol denemeleri için Mirna ve/veya spermin çözümünü aynı hacim arabellek A ile değiştirin. - Adım 3.2.3 karışımı bir PC/Co/C Master Mix kısım çözülür.
- A arabelleğinde 30 mg/ml sodyum deoksikolatın çözeltisi hazırlayın ve adım 3.2.4 çözüm için μL 50 ekleyin. 2 h için 4 °C ' de karıştırın.
- Adım 3.1.4 delipidated HDL çözüm 250 μL ekleyin. Bu hacim 100 PC: 22 CO: 4.8 C:1 delipidated HDL proteinleri yaklaşık molar oranına karşılık gelir. Gece 4 °C ' de karıştırın.
-
Diyaliz
- 4 °C ' de en az 15 L PBS precool. 800 ml çift distile su (DDH2O) için adsorban boncuk 50 g ekleyin ve 1 dakika boyunca karıştırın. 15 dakika bekleyin, supernatant ve PBS ile prosedürü tekrarlayın.
- Prewet diyaliz kasetleri (moleküler ağırlık Cut-off: 20 kDa) veya uygun Dializ tüpleri ve çözüm adım 3.2.6 eklemek, üreticinin talimatlarına göre bir şırınga kullanarak.
- Adım 3.3.1 dan 3 L PBS için adsorban boncuk ekleyin ve 4 °c ' de Dialyze. Tampon ve boncuk 1 saat ve 2 saat sonra değiştirin.
- 24 saat sonra, reconstituted HDL (rHDL) parçacık çözeltisi kurtarmak ve Bradford tahlil kullanarak protein konsantrasyonu belirlemek. RHDL parçacık çözümünü 4 °C ' de inert gaz atmosferi altında saklayın.
4. LDL parçacıklarının etiketlenmesi
- Hazırlamak 10X LDL tampon (1,5 M NaCl, 3 mM EDTA, 1 mM etilen glikol-bis (β-aminoetil eter)-N, N, N ', n'-Tetraacetic asit [EGTA, pH 7,4]) ve oda sıcaklığında saklayın.
- RNase-Free suda taze 30 mm spermin solüsyonu hazırlayın. 100 μL spermin çözeltisi ile bir kısım (100 μL, 10 μM) sentetik Mirna (bkz. Adım 2,2) karıştırın ve 30 °c ' de 30 dakika boyunca inküye yapın.
Not: negatif kontrol denemeleri için, Mirna ve/veya spermin çözümünü 1x LDL tampon ile aynı hacimle değiştirin. - 100 μL DMSO 'ya adım 4,2 ' den miRNA/spermine solüsyonunu ekleyin ve 1,2 mL 1x LDL tampon ile daha fazla seyreltin.
- LDL parçacık çözümünü PBS ile yaklaşık 4 mg/mL 'Lik son bir konsantrasyona seyreltin ve 50 μL 10X LDL tampon ile mix 450 μL. Buzun üzerinde 10 dakika boyunca kulyın.
- LDL parçacık çözümünü bir önceki adımda ve miRNA/spermine/DMSO çözeltisi (adım 4,3) ile birleştirin ve 40 °C ' de 2 saat boyunca inküye yapın.
- 3,3 bölümünde açıklandığı gibi diyaliz yapın ve etiketli LDL parçacık çözümünü buna göre saklayın.
5. reconstituted/etiketli lipoprotein parçacıklarının kalite kontrolü
Not: kalite kontrol Için lipoprotein parçacıklarının çapı ve genel şekli, örneğin AFM veya elektron mikroskobu (EM) kullanılarak belirlenebilir. Burada, HS-AFM yerel/reconstituted/etiketli lipoprotein parçacıklarının boyutunu dağılımı ölçmek için kullanılır.
- PBS 'de HDL/LDL parçacık çözeltisi seyreltilmiş (1:100 – 1:1000) ve 5 dakika boyunca taze parçalanabilen Mika üzerinde kulbin. Mika12için, substrat karşı yapışkan bant basın ve teyp çekerek üst Mika katmanları kaldırmak için yarma için.
Not: belirli AFM enstrüman, gözlem alanı ve partiküllerin ilk konsantrasyon bağlı olarak, seyreltme faktörü bireysel parçacıklar gözlemlemek için ayarlanması gerekir. - İnkübasyon sonrasında, numuneyi PBS ile durulayın ve PBS 'de HS-AFM görüntülemeyi gerçekleştirin ve kcant ≪ 0,2 N/m yay sabitleri olan konsol ile dokunma modunda. < 1 μm2 tarama boyutlarını kullanmak ve görüntüleme kuvvetlerini mümkün olduğunca düşük tutmak önerilir.
- Uygun yazılım ile Mika yüzeyine göre görüntülenmiş partiküllerin yüksekliğini belirleyin.
- Veri yükleme Gwyddion (Freeware), tahıl Analizi (eşik tarafından işareti taneleri) ve substrat arka plan üzerinde eşik ayarlamak yoluyla parçacıklar tespit. Maskelenmiş bölgeyi hariç tut seçeneğini belirleyerek görüntüyü yassılaştırın (polinomial arka planı kaldırın).
- Algılanan partiküllerin yükseklik değerlerini (çeşitli tahıl özelliklerinin dağılımı) dışa aktarın ve kaydedilen tüm görüntüler için bu adımları yineleyin. Histogramları oluşturarak veya elde edilen parçacık yüksekliklerinin olasılık yoğunluğu işlevlerini hesaplamak suretiyle istatistiksel analiz gerçekleştirin.
- Doğal yanı sıra reconstituted/etiketli lipoprotein parçacıkları ile 5.1 – 5.3 adımlarını yineleyin ve parçacık kalitesini doğrulamak için elde edilen sonuçları karşılaştırın. Enkaz ve/veya konglomeratlar gözlemleyerek, örnek atın.
6. hücre kültürü
- Uyumlu hücreleri kurulan bir protokole göre büyütün (örn. ldlA7-SRBı13).
Not: deneylerin sayısına bağlı olarak birkaç bağımsız Odalar (önerilen iki oda deneysel ayar başına) ve negatif kontrol denemeleri (önerilen iki Odalar lipoprotein parçacıkları ilavesi olmadan) gereklidir. Ayrıca, hücre numarasının belirlenmesi için iki odası gereklidir. - Hücre enkaz kaldırmak ve serum-ücretsiz büyüme orta uygun bir hacim ile hücre tabakasını kapsayacak şekilde prewarmed Hank dengeli tuz solüsyonu (HBSS) ile 3x hücreleri yavaşça yıkayın. 50 μg/mL lipoprotein parçacıklarının son konsantrasyonuna ulaşmak için uygun hacimli lipoprotein parçacık çözeltisi ekleyin. 37 °C ' de ve% 5 CO2 ' de 16 saat boyunca kulbe
Not: deneysel tasarım ve hücre çizgisine bağlı olarak, kuluçta süresi hücresel miRNA düzeyinde yeterli (yani, ölçülebilir) artış elde etmek için adapte edilmelidir. - Hücre enkaz/lipoprotein parçacıkları kaldırmak ve serum-ücretsiz orta uygun bir hacim ile hücre tabakası kapsayacak şekilde prewarmed (37 °C) HBSS ile 3x hücreleri yavaşça yıkayın.
- 6,3 adımda örnek hacimde hücre sayısını hesaplamak için en az iki bağımsız odada uygun bir Yöntem (örneğin, hemokytometer, otomatik hücre sayacı) kullanarak hücre yoğunluğunu belirleyin. Bu sayı normalleştirme için kullanılır.
7. hücre ve lipoprotein parçacık örneklerinden miRNA ekstraksiyon
Not: miRNA 'nın hücrelerden çıkarılması, aşağıdaki değişikliklerle miRNA ekstraksiyon kiti kullanılarak gerçekleştirilir.
-
Hücre örnekleri
- Santrifüjü 4 °C ' ye precool. 350 μL lizis reakajının her birini hücreler içeren iki odana ekleyin. Negatif kontrol deneyi olarak hücre içermeyen bir oda kullanın.
DIKKAT: uygun kişisel koruyucu ekipman giyin ve fenol ve Thiocyanate içeren liziz reaktif kullanırken bir duman kaputu içinde çalışın. - Hücre dekolmanı için 3 – 5 dakika (hücre hattına bağlı olarak) bekleyin. Gerekirse, aydınlık alan mikroskopisi ile hücre dekolmanı kontrol edin. Havuz bir 1,5 mL tüp iki odası içeriğini.
- 20 G iğne ve 5 mL şırıngayı kullanarak, numuneyi 5x – 10X aspirasyon ile homojenize/bozar ve 5 dakika boyunca inküye yapın. 140 μL kloroform (CHCl3) ekleyin, 15 s için güçlü bir şekilde sallayın ve 3 dakika boyunca inküye yapın.
- 12.000 x g 'de 4 °c ' de 15 dakika Santrifüjü. Daha sonra Santrifüjü soğutmayı bırak.
- Üst sulu faz yeni bir 1,5 mL tüp transfer; faz karıştırma önlemek/interfaz DNA içerir ve alt faz proteinleri içerir gibi kontaminasyon. 1,5 x 100% etanol hacmi ekleyin ve pipetleme ile iyice karıştırın.
- 2 mL toplama tüpünde bir döndürme sütunu yerleştirin ve adım 7.1.5 karışımı μL 700 ekleyin. Oda sıcaklığında 15 s için 8.000 x g 'de santrifüjler. Akış yoluyla atın ve bu adımı, kalan numune hacmi ile yineleyin.
- Akışı atın ve 700 ekleme μL ilk yıkama arabelleği döndürme sütuna. Oda sıcaklığında 15 s için 8.000 x g 'de Santrifüjü.
- Akışı atın ve 500 ekleme μL ikinci yıkama arabelleği döndürme sütuna. Oda sıcaklığında 15 s için 8.000 x g 'de Santrifüjü. Santrifüjleme süresi 2 dk ile ikinci kez bu tüm adımı tekrarlayın.
- Spin sütununu yeni 2 mL 'Lik bir toplama tüpüne yerleştirin ve membranı kurutmak için 1 dakika boyunca tam hızda santrifüjün.
- Spin sütununu 1,5 mL toplama tüpüne yerleştirin. Elüsyon için membranın ortasına 30 μL RNase-Free su ekleyin ve 1 dakika için 8.000 x g 'de santrifüjün. bu tüm adımı ilk akışla Ikinci kez tekrar edin. Ters transkripsiyon adım hemen ayıkladıktan sonra yapılır; Aksi takdirde, çıkarılan miRNA örneklerini-20 °C ' de saklayın.
- Santrifüjü 4 °C ' ye precool. 350 μL lizis reakajının her birini hücreler içeren iki odana ekleyin. Negatif kontrol deneyi olarak hücre içermeyen bir oda kullanın.
-
Lipoprotein parçacıkları
- En düşük protein konsantrasyonu ile numunenin hacmini 100 μL (= maksimum numune hacmi) olarak ayarlayın. Diğer numunelerin örnek hacimlerini, bu normalleşme göre, kendi konsantrasyonlarına tersine hesaplayın. Negatif kontrol denemeleri için 100 μL RNase-Free su kullanın.
Not: normalleştirme gerekli değildir, ancak qPCR adım ve çözümleme sırasında sonuçların doğrudan karşılaştırmasını basitleştirir. - Santrifüjü 4 °C ' ye precool. 700 adım 7.2.1 μL liziz reakajının örnek hacmine ekleyin.
- 7.1.3 adımlarına göre miRNA ekstraksiyonu gerçekleştirin – 7.1.10.
- En düşük protein konsantrasyonu ile numunenin hacmini 100 μL (= maksimum numune hacmi) olarak ayarlayın. Diğer numunelerin örnek hacimlerini, bu normalleşme göre, kendi konsantrasyonlarına tersine hesaplayın. Negatif kontrol denemeleri için 100 μL RNase-Free su kullanın.
8. Ters transkripsiyon
Not: miRNA 'nın ters transkripsiyonu, aşağıdaki değişikliklerle Ters transkripsiyon kiti kullanılarak gerçekleştirilir.
- Kit reaktifler ve Ters transkripsiyon astar buz üzerinde çözüler. Buz üzerinde bir reaksiyon tüpü aşağıdaki ana karışımı hazırlayın: 45,7 μL RNase-Free H2O, 16,5 μL 10X Ters transkripsiyon tampon, 11 μL Ters transkripsiyon enzim, 2,1 μL RNase inhibitörü, ve 1,7 μl dntp karışımı. Hafifçe karıştırın, girdap yapmayın.
Not: ölçek örnek miktarına bağlıdır; burada, 10 reaksiyon için hesaplanır. - Etiket 0,2 mL tüpler buna göre ve mix 7 μL ana karışımı adım 8,1 ile 5 μL adım 7.1.10 ve 3 μL Ters transkripsiyon astar dan ayıklanan örnek. Hafifçe karıştırın, kısa sürede santrifüj yapın ve karışımı buzun üzerine saklayın.
- Her hücre satırının aynı hücre numarasını kullanmak için, hücre satırının örnek hacmini daha yüksek bir genel hücre numarasına sahip olarak azaltın; 5 μL RNase içermeyen suyun toplam numune hacmine ulaşmak için bunu kalan hacim olarak kullanın.
Not: lipoprotein Parçacık örnekleri zaten adım 7.2.1 normalleştirilmiş. Standart eğrisi hazırlama için, RNase-Free suda sıralı olarak Mirna bir kısım seyreltici ve numune hacmi başına iplerin sayısını hesaplayın. Gerekli olan örnek miktarın döngüsü (cq) değerlerinin aralığı içinde en az beş veri noktası gereklidir. Genellikle 102 ila 106 arasında değişen toplam seyreltme faktörleri uygundur. - Tüpleri termocycler makinesine yerleştirin ve aşağıdaki programa başlayın: 16 °C ' de 30 dk (tavlama adım), 42 °C ' de 30 dakika (Ters transkripsiyon), 85 °C ' de 5 dakika (erime adım) ve 4 °C ' de (depolama) duraklatın. Ters transkripsiyon hemen sonra qPCR adımını gerçekleştirin; Aksi takdirde,-20 °C ' de miRNA örneklerinden sentezlenen tamamlayıcı DNA 'Yı (cDNA) saklayın.
9. qPCR 'ler
- Aşağıdaki değişiklikler ile ( malzeme tablosunabakın) ticari olarak kullanılabilir bir tahlil kullanarak cDNA bir qPCR (geri Mirna gelen transkripsiyonu) gerçekleştirin.
- Tüm reaktifler (supermix, RNase-Free H2O), cDNA örnekleri (adım 8,4) ve buzdaki astar çözme. Buz üzerinde bir reaksiyon tüpü aşağıdaki ana karışımı hazırlayın: 75 μL supermix, 47,5 μL RNase-Free H2O, 7,56 μL astar. Hafifçe karıştırın, girdap yapmayın.
Not: ölçek örnek miktarına bağlıdır; burada, 10 reaksiyon için hesaplanır. - Etiket 0,2 mL tüpler buna göre ve 2 μL cDNA örnek 13 μL ana karışımı ekleyin ve hafifçe karıştırın. Genel olarak, her örnek 2x ölçmek.
Not: en az iki negatif kontrol örneği ek olarak gereklidir — örnek olarak RNase-Free su kullanın. Kalibrasyon eğrisi örnek olarak aynı çalışma sırasında belirlenmemiş ise, kalibrasyon eğrisi ölçümünde bir örnek de gereklidir. Her bir çalışma için aynı reaksiyon verimliliği kalibre etmek için kullanılır. - Tüpleri PCR makinesine yerleştirin ve aşağıdaki programı başlatın: 50 °C ' de 2 dk, 95 °C ' de 10 dk, 95 °C ' de 15 s ve 60 °C ' de 60 s. Programın son iki adımını 50 kata kadar yineleyin.
- PCR makinenin yazılım paketi ile cq değerlerinin Analizi Için, Dynamictube normalleştirme (her örnek izinin ikinci türevi kullanarak farklı arka plan düzeylerinin telafisi) ve gürültü eğim etkinleştirin Düzeltme (gürültü seviyesine normalleştirme).
Not: negatif denetimin cq değeri, en yüksek örnek cq değerinden daha yüksek birkaç döngü olmalıdır.- Bir kalibrasyon eğrisi analizi için, yazılım paketinin Otomatik bul eşik fonksiyonunu kullanarak her Mirna 'nın standart eğrilerinden her bir Mirna için cq hesaplamasının eşiğini belirleyin ve sabit tutun Her özel miRNA için.
- Örnek analiz için, gerekirse, kalibrasyon eğrisi örneğinden veri noktası ile çalışan numunenin farklı reaksiyon verimliliklerini telafi etmek için. Yazılım, numunelerin cq değerlerini, ilgili kalibrasyon eğrisi ölçümünün eşik düzeyinden hesaplar.
10. miRNA içeriğinin hesaplanması
-
Kalibrasyon eğrisi
- Hesapla, kısım başına Mirna ipliklerin ilk sayısı (100 μL 10 μM Mirna, veri sayfasından moleküler ağırlık) ve sonraki seri seyreltme adımları, örnek hacminde Mirna İplikçilerin sayısı (adım 8,3 5 μL örnek hacim).
Not: 1 Ters transkripsiyon verimliliği varsayarsak, bu sayı cDNA ipliğinin sayısına eşittir. - 9,3 adımda 2 μL örnek hacminde cDNA iplerin sayısını hesaplayın. Böylece 7,5 ek seyreltme faktörü (adım 9,4 2 μL numune hacmi, adım 8,4 ' dan 15 μL örnek birimden) göz önünde bulundurun.
- Cq değeri adım 9.5.1, bir Base-10 semilogarithmic arsa içinde adım 10.1.2 hesaplanan ipler niplerin sayısına karşı Plot ve veri noktalarını aşağıdaki regresyon eğrisi ile sığdırmak (M = doğrusal bir eğim regresyon eğrisi, B = uzaklık).
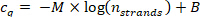
Satır için korelasyon katsayısı (R2) > 0,99 olduğunu onaylayın.
- Hesapla, kısım başına Mirna ipliklerin ilk sayısı (100 μL 10 μM Mirna, veri sayfasından moleküler ağırlık) ve sonraki seri seyreltme adımları, örnek hacminde Mirna İplikçilerin sayısı (adım 8,3 5 μL örnek hacim).
-
Lipoprotein parçacıkları
- Ölçülen örnek cq değeri (adım 9.5.2) ve aşağıdaki denklem (M ve B , belirli Mirna 'nın kalibrasyon eğrisi parametreleridir) kullanılarak örnek hacim başına Mirna iplikleri sayısını hesaplayın.
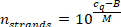
- Numune hacmine karşılık gelen lipoprotein parçacıklarının sayısını, Step 7.2.1 (100 μL), bilinen konsantrasyonunu ve sonraki seyreltme adımlarını (100 μL-> 30 μL örnek hacim 7.1.10-> 5 μL [seyreltme 1:6] Adım 8,4-> 2 μL [seyreltme 1:7.5] adımda 9,4) 15 μL toplam hacminde örnek. HDL parçacıkları için 250 kDa molekül ağırlığı ve LDL partikülleri için 3 MDa ve miRNA ekstraksiyon adımı sırasında miRNA 'nın% 100 ' lik geri kazanımı (moleküler ağırlıkta herhangi bir lipid katkısı göz ardı edilmesi, miRNA iplerinin sayısının hafif bir aşırı öngörü verir lipoprotein parçacık).
- Bir önceki adımda hesaplanan partiküllerin sayısı tarafından adım 10.2.1 miRNA iplerin sayısını Böl lipoprotein Parçacık başına miRNA iplerin sayısını verim.
- Ölçülen örnek cq değeri (adım 9.5.2) ve aşağıdaki denklem (M ve B , belirli Mirna 'nın kalibrasyon eğrisi parametreleridir) kullanılarak örnek hacim başına Mirna iplikleri sayısını hesaplayın.
-
Hücre
- Adım 10.2.1 göre numune hacmi başına miRNA iplerin sayısını hesaplayın.
- 6,4 adımda ölçülen ilk hücre numarası konsantrasyonu ile başlayarak, adım 10.2.2 göre örnek birimdeki hücrelerin karşılık gelen sayısını hesaplayın.
- 10.3.1 gelen miRNA iplerin sayısını bölme hücre başına miRNA iplerin sayısını verim için önceki adımda hesaplanan hücre sayısı.
- Mirna/partikül oranı tarafından negatif kontrol deneyinden elde edilen hücrelerin arka plan Mirna seviyesi için Düzeltme sonrasında önceki adımda Mirna iplerinin toplam miktarını bölerek lipoprotein parçacıklarının alımını oranını hesaplayın (adım 10.2.3 ) ve kuluçk süresi (16 saat, bkz. Adım 6,2).
11. multiwell mikrofluidik diziler
-
miRNA çıkarma
- 7. adımda açıklandığı gibi miRNA ekstraksiyon gerçekleştirin.
-
Ters transkripsiyon
- Ters transkripsiyon astarları, Ters transkripsiyon kiti bileşenlerini ve buzun üzerinde MgCl2 (25 mm) çözün. Sekiz numune için, 8 μL Ters transkripsiyon astar (10X) Mix, 2,25 μL dTTP (100 mm) ile dntps, 16,88 μL ters transkriptaz (50 U/μL), 9,00 μL 10X Ters transkripsiyon tampon, 10,12 μL MgCl2, 1,12 μL RNase inhibitörü (20 U/μL) ve 1 μL çekirdeksiz su.
- Hafifçe karıştırın ve kısaca santrifüjün. 4,3 μL Ters transkripsiyon reaksiyonu karışımı ekleyin 3,5 μL ayıklanan miRNA bir tüp ve mix, aşağı spin ve 5 dakika boyunca buzun üzerinde inküye. tüpleri bir termocycler makinesine yerleştirin ve aşağıdaki programa başlayın: 2 dakika için 16 °C, 42 °C 1 dakika ve 50 °C 1 s tekrarlanan 40X için, ve sonra, stop reaksiyonu olarak, 85 °C 5 dak ve 4 °C ' de duruncaya kadar tutun.
-
Katörün
- Astarları buzun üzerinde çözün ve kısa bir süre Santrifüjü çevirin. Şişe dönen tarafından ön amplifikasyon Master Mix (2x) karıştırın. Ön amplifikasyon reaksiyonu karışımı sekiz numune için aşağıdaki talimatlara göre hazırlayın: 112,5 μL ön amplifikasyon ana karışımı (2x), 22,5 μL ön amplifikasyon astar ve 67,5 μL çekirdeksiz su. Tersine çevir ve Santrifüjü kısaca yapın.
- Önceki adımdan 22,5 μL ön amplifikasyon reaksiyonu karışımı ile adım 11.2.2 Ters transkripsiyon reaksiyonu ürününün μL 'i Mix 2,5 ve kısa bir süre içinde santrifüjün. Numuneleri 5 dakika boyunca buzun üzerine koyun.
- Tüpleri bir termocycler makinesine yerleştirin ve aşağıdaki ayarlarında Inküye: 10 dakika için 95 °C ' de enzim aktivasyonu, 2 dakika için 55 °C ' de tavlama, 2 dakika için 72 °C ' de uzanan, tekrarlanmış 12x: 15 s için 95 °C ' de ve 4 dk için 60 °C ' de tavlama/genişletme , 99,9 ° c 'de enzim inaktivasyonu 10 dakika ve 4 °C ' de beklemede.
- Aşağı Döndür, 7,5 μL 1x TE (pH 8,0) ve 67,5 μL 'yi çekirdeksiz su, ters çevirme ve Santrifüjden kısaca ekleyin. Örnekler 1 haftaya kadar-20 °C ' de depolanabilir.
-
qPCR
- Şişe dönen tarafından ana karışımı karıştırın. Bir kart için PCR reaksiyon karışımını hazırlayın: 450 μL Master Mix, 441 μL çekirdeksiz su ve 9 μL ön amplifikasyon örneği adım 11.3.4. Tersine çevir ve Santrifüjü kısaca yapın.
- Üretici talimatlarına göre hazırlanan PCR reaksiyon karışımı 100 μL ile multiwell mikrofluidik dizi kartının her dolgu rezervuarı yükleyin ve 3.000 x g'de 1 dak. Ardışık iki santrifüjleme adımında ivme, kartın düzgün doldurulması için önemlidir. Kartı üreticinin talimatlarına göre mühürleyin.
- Aşağıdaki program ile bir PCR sistemi kullanın: 10 dakika için 95 °c ' de enzim aktivasyonu ve sonra, tekrarlanan 40X: 95 °c ' de 15 s ve tavlama/60 °c ' de 1 dakika boyunca genişletme için denatüre.
- PCR sisteminden sonuçlar dosyasını içe aktarın ve aşağıdaki çözümleme ayarlarıyla sistemin yazılım paketini kullanarak RQ değerlerini hesaplayın: 40,0 en fazla izin verilen cq değeri, hesaplamalarda maksimum cq değerleri ve aykırı değerler çoğaltır arasında hariç. Benjamini – Hochberg yanlış keşif oranını, p-değer ayarlaması (yanlış pozitif sonuçlar14' ün oluşumunu düzeltme) ve normalleştirme yöntemi olarak küresel normalleştirme (tüm örnekler için bir medyan eşik değeri kullanarak) seçeneği olarak etkinleştirin 15).
Sonuçlar
Lipoprotein parçacık yalıtımı genel bir şeması
Şekil 1 , sıralı flotasyon ultracent,16kullanarak tüm kandan başlayarak lipoprotein parçacık yalıtım genel düzenini gösterir. İstenirse, bu protokol sırasında VLDL ve IDL parçacıkları gibi diğer lipoprotein parçacık fraksiyonları hasat edilebilir. Polipropilen hızlı mühür tüpleri ile birlikte sabit açılı titanyum rotor santrifüjleme kuvvetlerine dayanmak için uygundur. Tüp çöküşü önlemek için, tüp hava kabarcıkları önlemek için önemlidir. Santrifüjleme, protein bozulmasını en aza indirmek için 4 °C ' de gerçekleştirilir. Genellikle plazma başlayarak (60-80 mL donör başına) üç gönüllülerin havuza kan bağışları, LDL ve HDL parçacık çözeltisi hacimleri bir verim 3 mL aralığında konsantrasyonları ile 1-3 mg/mL beklenebilir. Tüm prosedür, kan bağından başlayarak, yaklaşık 7 gün sürdü.
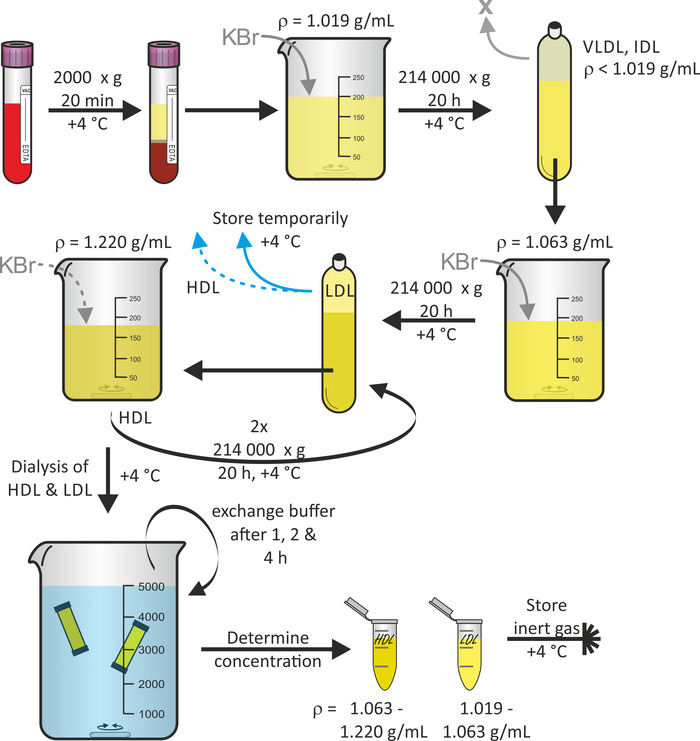
Şekil 1: Lipoprotein yalıtım akış şeması. Vakum konteyner tüpleri sağlıklı gönüllülerden santrifüj kan ve plazma toplamak (üst faz). KBr kullanarak m = 1,019 g /ml 'ye yoğunluğunu ayarlamanın ardından, 4 °c ' de 20 saat için 214.000 x g 'de çözeltinin Santrifüjüne gidin. KBr kullanarak m = 1,063 g/mL için alt fraksiyonunun yoğunluğunun ayarlanması sonrasında, 4 °c ' de 20 saat için 214.000 x g 'de yeniden santrifüj yapın. LDL partikülleri içeren üst fraksiyonu 4 °C ' de geçici olarak saklayın. KBr kullanarak m = 1,220 g/mL için alt fraksiyonunun yoğunluğunun ayarlanması sonrasında, 4 °c ' de 20 saat için 214.000 x g 'de iki kez santrifüj yapın. HDL parçacıkları içeren üst kesir toplamak, hem HDL ve LDL parçacık çözümleri Dialyze ve 1, 2 ve 4 saat sonra tampon değişimi. 24 saat sonra protein konsantrasyonunu belirleyin ve numuneleri 4 °C ' de inert gaz altında saklayın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
HDL parçacıklarının yeniden oluşturulması
HDL parçacıklarının yeniden oluşturulması, daha önce Jonas7tarafından yayınlanan bir protokole göre yapılmıştır. İlk adım, Şekil 2a'da gösterildiği gibi HDL partiküllerinin delipidasyon oldu, sonra ikinci adım relipidation (yani, Reconstitution) Şekil 2BGÖSTERILDIĞI gibi, LIPID PC kullanarak, Co, ve C Mirna ve spermine karışımı ek olarak. Biz insan olgun miR-223 ve mir-155 çünkü miR-223 yüksek bir bolluk ve miR-155 lipoprotein parçacıkları17nadirdir gösterir seçti. Genellikle, her iki adımda ardışık 2 gün gerçekleştirilir. Reanayasa sırasında, diğer lipophilik ve/veya amphiphilik bileşenler istenilen şekilde eklenebilir. Etanol/dietil eter ve PC, CO ve C metanol/kloroform solvent tam buharlaşma kritik oldu. Son adım — Şekil 2C'de gösterildiği gibi-reconstituted HDL parçacıklarını (rhdl) serbest lipidler/Mirna/deterjan ile ayırmak için diyaliz prosedürdür. Bu ek bir 1-2 gün sürdü. Dializ çözeltisi için emici boncuk ilavesi diyaliz membranı sabit boyunca yoğunluk gradyan tuttu. RHDL parçacıklarının% 50 oranında bir verim beklenebilir.
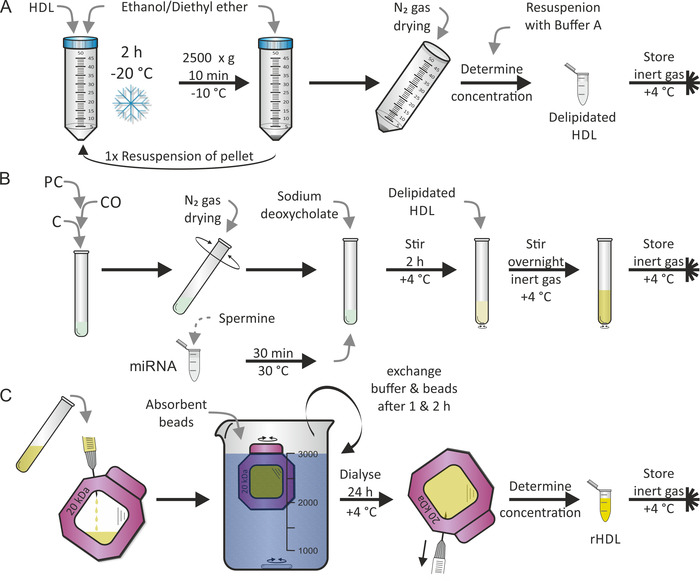
Şekil 2: HDL parçacık reanayasasının akış çizelgesi. (A) delipidation: HDL parçacık çözümünü ön soğutmalı etanol/dietil eter ile karıştırın ve-20 °c ' de 2 saat boyunca kuluçkaya atın. Süpernatant atarken, Pelet pelletini ve prosedürü tekrarlayın. N2 gaz ile Pelet kuru ve tampon A içinde pelletini. Konsantrasyonun belirlendikten sonra, delipidated HDL 'yi 4 °C ' de inert gaz atmosferinde saklayın. (B) reanayasası: fosfatidill-kolın (PC), kolesteril OLEAT (Co) ve kolesterol (C) karıştırma sonra, tüp döndürürken N2 gaz kullanarak solvent Buharlık. 30 °c ' de 30 dakika boyunca spermin çözeltisi ile Mirna kısım 'u kulbatın, sodyum deoksikolatın ekleyin ve kurutulmuş lipid filmi pelletini. Numuneyi 4 °C ' de 2 saat karıştırın, delipidated HDL çözümünü ekleyin ve numuneyi tekrar karıştırın, bu kez gece 4 °C ' de inert gaz atmosferi altında. (C) diyaliz: reconstituted HDL (rhdl) parçacıkları içeren panelden çözümü Dializ membran odasına (moleküler ağırlık kesme: 20 kDa) aktarın ve 4 °c ' de PBS ve emici boncuklar karşı Dialyze et. Tampon ve boncuklar 1 saat ve 2 saat sonra değişimi. 24 saat sonra rHDL parçacık çözümünü kurtarın, konsantrasyonu belirleyin ve numuneyi 4 °C ' de inert gaz atmosferi altında saklayın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
LDL parçacıklarının etiketlenmesi
LDL parçacıklarının miRNA ile etiketlenmesi (Şekil 3), HDL parçacıkları için gösterildiği gıbı, LDL parçacıklarının ana bileşeni olan apoB-100 proteinin hidrofobiği nedeniyle uygulanabilir değildi. Dmso, LDL parçacığını lipid Tek tabakalı penetrasyonunu için kullanıldı ve bu nedenle, Mirna Derneği aracılı. Tüm prosedür% 100 bir verim yakın ile 1-2 gün sürdü.
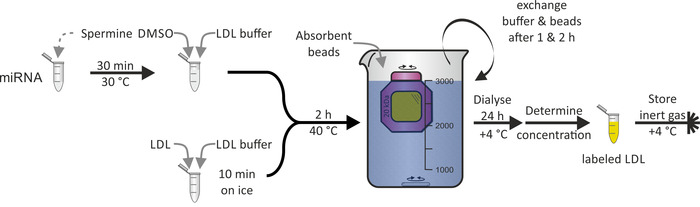
Şekil 3: LDL parçacık etiketleme akış çizelgesi. 30 °c ' de 30 dakika boyunca spermin çözeltisi ile Mirna kısım 'u inküle ve DMSO ve LDL tampon ekleyin. LDL örnek zekâ LDL tamponunu buzun üzerinde 10 dakika boyunca inküat ve miRNA/spermine/DMSO karışımı ekleyin. 40 °C ' de 2 h 'de kuluçtan sonra, solüsyonu diyaliz membranı odasına (moleküler ağırlık kesme: 20 kDa) aktarın ve + 4 °C ' de PBS ve emici boncuklar karşı Dialyze et. Exchange buffer ve boncuk 1 & 2 saat sonra. 24 saat sonra etiketlenmiş LDL parçacık çözümünü kurtarın, konsantrasyon ve mağaza altında inert gaz atmosferi + 4 °C ' de belirleyin. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Lipoprotein parçacıklarının kalite kontrolü
HS-AFM Mika üzerinde yerli ve reconstituted/etiketli lipoprotein parçacıklarının boyutunu ve şeklini incelemek için kullanılabilir. Kullanmadan hemen önce, Mika taze ve düz bir yüzey sağlamak için (üst katman [s] kaldırmak için yapışkan bant kullanın) temiz olması gerekir. Mika üzerinde HDL/LDL parçacıklarının inkübasyon yaparken, seyreltme faktörü (ve/veya kuluçken süresi) bireysel parçacıklar gözlemlemek için ayarlanması gerekir. Kümeler parçacık boyutlarını belirlemesine izin vermez. HDL parçacıkları Mika üzerinde mobil. HS-AFM yerine konvansiyonel AFM kullanıldığında, immobilizasyon protokolünün lateral parçacık mobilitesini azaltmak için buna göre (tampon, yüzey kaplama) adapte edilmesi gerekir. Numuneyi tararken, parçacıkların herhangi bir deformasyonunu önlemek için görüntüleme kuvveti düşük tutulmalıdır (Dokunma modu), böylece ölçülen değerleri etkileyecektir. Veri analizi için parçacıklar bir eşik algoritması ile tespit edildi (örn., Gwyddion: tanecik > işareti) ve yüksekliği Mika yüzeyine göre belirlendi. Belirgin lateral boyutlar ucu şekli ile genişleyerek ( Şekil 4' te örnek görüntülere bakın) partiküllerin yüksekliğini ölçmek partikül boyutlarını belirlemek için en hassas yoldur. Partikül yükseklikleri olasılık yoğunluğu fonksiyonları (PDF) istatistiksel değerlendirme ve çeşitli lipoprotein partiküllerinin boyutu dağılımları karşılaştırılması için hesaplanır. Şekil 4 ' te gösterildiği gibi yerel ve MIRNA etiketli LDL partiküllerinin karşılaştırılması, etiketli ve etiketsiz (örneğin, yerli) lipoprotein parçacıkları (Mirna ilavesi olmadan LDL parçacıkları etiketli) arasındaki asıl benzerlik doğrulamak mümkün kılar/ spermin karışımları etiketleme prosedürü kendisi için bir kontrol olarak gösterilir). Tüm prosedür yaklaşık 1 gün sürdü.
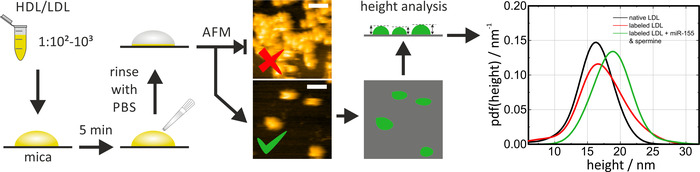
Şekil 4: HS-AFM ölçümlerinin akış çizelgesi ve temsili sonuçları. PBS 'de HDL/LDL parçacık örneğini seyreltir (1:102-1:103) ve 5 dk için taze parçalanabilen Mika üzerinde kuluçyat, sonra da serbest (elektrostatik olarak adsorbed değil) parçacıklar kaldırmak için PBS ile dikkatli bir durulama. HS-AFM görüntüleme gerçekleştirin ve yüzeyde parçacık yoğunluğunu kontrol edin. PBS 'deki ölçümleri oda sıcaklığında gerçekleştirin. Bu rakam üst görüntü çok yüksek parçacık yoğunluğu gösterir; alt görüntü analiz için uygundur. Tek partiküllerin yüksekliği, eşik ve yerli (siyah eğri) sonra analiz edildi ve reconstituted/etiketli (kırmızı ve yeşil eğrisi) parçacıklar istatistiksel bir değerlendirmede karşılaştırıldı. Ölçek çubuğu = 100 Nm. Bu rakam Axmann ve al.19' dan değiştirildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
miRNA ekstraksiyon, Ters transkripsiyon ve qPCR
MiRNA 'nın yerli/yapay olarak zenginleştirilmiş lipoprotein veya hücre örneklerinden çıkarılması, Figure 5A'da gösterildiği gibi bir Mirna ekstraksiyon kiti kullanılarak yapılmıştır. Bu nedenle, bir RNase-Free çevre kritik oldu. Bu adım yaklaşık 1 saat sürdü. çıkarılan miRNA örneğinin ters transkripsiyonu (Şekil 5B) üretici tarafından açıklandığı gibi standart biyokimyasal prosedürler kullanılarak yapılmıştır. Bu adım yaklaşık 1,5 h aldı. Son adımda elde edilen cDNA miktarı qPCR (Şekil 5c) kullanılarak belirlendi. Elde edilen cq değerlerini mutlak Mirna Strand numarasına ilişkilendiren standart eğri, ilk numunenin mutlak Mirna içeriğini sağladı. Bu yaklaşık 2,5 h aldı.
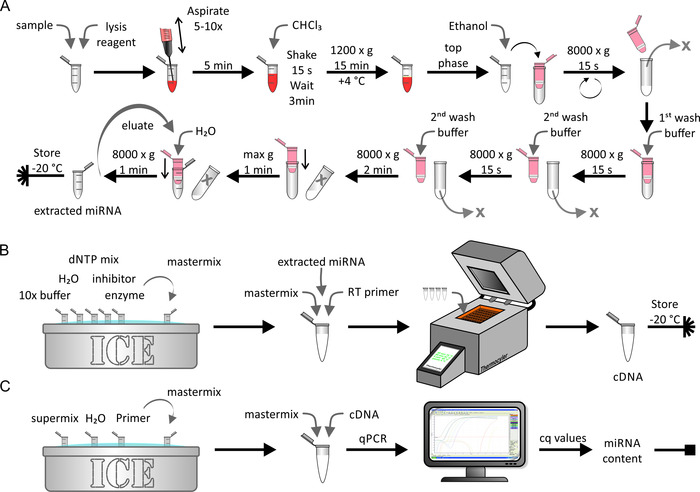
Şekil 5: miRNA ekstraksiyon, Ters transkripsiyon ve qPCR akış çizelgesi. (A) Mirna ekstraksiyon: örnek lizis reaktif ile karıştırın ve bir şırınga kullanarak aspirasyon ile Lyse. 5 dakika boyunca inkübe ve CHCl3ekleyin. 15 s için güçlü bir şekilde sallayın ve 3 dakika boyunca inküye yapın. 4 °C ' de 15 dakika 1.200 x g 'de santrifüjleme yapıldıktan sonra, üst fazı toplayın ve etanol ile karıştırın. Çözümü bir döndürme sütununa aktarın (maksimum hacim < 700 μL) ve 15 s için 8.000 x g 'de santrifüjle çıkarın. akıtıcı atın ve çözümün geri kalanı ile son adımı tekrarlayın. İlk yıkama tamponunu ekleyin ve 15 s için 8.000 x g 'de Santrifüjü atın, ikinci yıkama tamponunu ekleyin ve 15 s için 8.000 x g 'de santrifüj yapın. 2 dakika santrifügleme süresi ile son adımı tekrarlayın. Daha fazla 1 dakika boyunca maksimum hızda santrifüjleme ile membran kurutun. 1 dakika için 80.000 x g 'de H2O ve santrifüj Ile Mirna elute-20 °C ' de çıkarılan Mirna örneğini saklayın. (B) Ters transkripsiyon: 10X tampon çözme, H2O, dntp Mix, inhibitör, ve buz üzerinde enzim ve ana karışımı hazırlayın. A panelinden çıkarılan Mirna 'yı ana karışım ve Ters transkripsiyon astar için ekleyin ve bir termocycler makinesini kullanarak Ters transkripsiyon gerçekleştirin. CDNA örneğini-20 °C ' de saklayın. (C) qPCR: süper karışımı çözün, H2O, ve buz üzerinde astar ve ana karışımı hazırlayın. CDNA panelini B ana karışımı ekleyin ve qPCR gerçekleştirin. Cq değerleri elde etmek ve numunenin mutlak Mirna içeriğini hesaplamak için verileri analiz edin (bkz. Şekil 6 ve Ayrıntılar için temsili sonuçlar). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Mutlak miRNA içeriği ve aktarım hızı
Doğal ve yapay olarak zenginleştirilmiş HDL ve LDL parçacıklarının mutlak miRNA içeriği, numunelerin cq değerlerinden ve Şekil 6' da gösterildiği gibi ilgili Mirna 'nın standart eğrisinden hesaplanmıştır. Şekil 6a analiz yazılımı tarafından hesaplanan verileri gösterir (etkin dynamictube normalleştirme ile [her örnek izleme ikinci türevi kullanarak farklı arka plan seviyeleri telafisi] ve gürültü eğim Düzeltme [gürültü seviyesine normalleştirme]). Standart eğrilerin cq değerleri, qPCR makinesi tarafından ölçülen normalleştirilmiş floresan sinyalinde yazılım paketinin Otomatik bul eşik işlevi kullanılarak belirlendi. Burada, yazılım standart eğrisi uygun R-değerini maksimize. Eşik düzeyi her belirli miRNA örnek analizi için sabit tutuldu. Daha sonra cq değerleri Mirna iplerin sayısının bir işlevi olarak çizilen ve regresyon satırı hesaplanmıştır. Örnek cq değerleri Şekil 6B'de gösterildiği gibi aynı eşik düzeyiyle belirlendi; farklı qPCR çalışmaları arasındaki reaksiyon verimliliği farklılıkları, her koşunun içerdiği bir ek kalibrasyon eğrisi örneği kullanılarak yazılım tarafından otomatik olarak telafi edilmiştir. Regresyon satırı denklemini kullanarak, örnekteki miRNA 'nın bilinmeyen miktarı hesaplanabilir. Lipoprotein parçacık sayısı ilk protein konsantrasyonu ve ortalama moleküler ağırlığı tahmin edildi (MWHDL ~ 250 kDa). Böylece, moleküler ağırlığa lipid katkısı kabul edilmiyordu-bu nedenle lipoprotein parçacığın başına miRNA iplerin sayısı biraz abartıldı. Dahası, miRNA ekstraksiyon aşamasında% 100 ' lık bir kurtarma oranı kabul edildi. Ayrıca, HDL partikülleri ile kuluçlmadan önce ve sonra hücrelerin miRNA içeriği belirlendikten sonra miRNA transfer hızı Şekil 6C'de gösterildiği gibi hesaplanır.
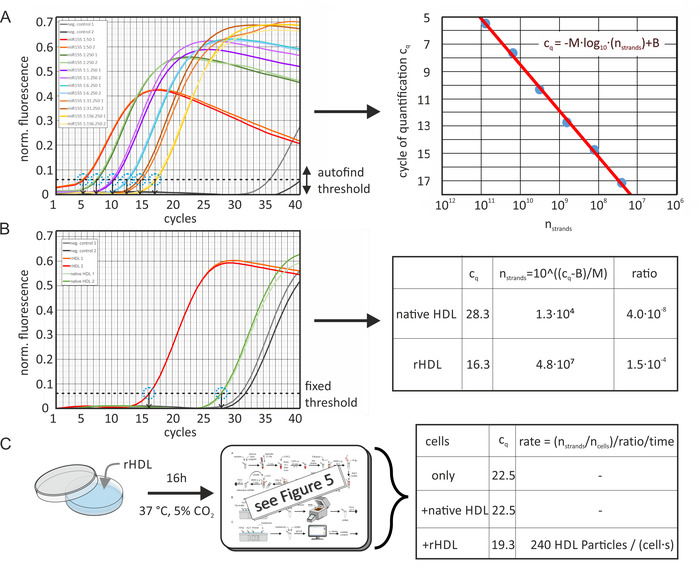
Şekil 6: mutlak miRNA içeriğinin ve transfer oranının hesaplanmasında akış çizelgesi. (A) mir-155 için standart eğrisi: bir mir-155 kısım (100 μL, 10 μM) belirtildiği gibi RNA içermeyen su ile seri olarak seyreltilmiş. qPCR, yazılım paketinin Otomatik bul eşik işlevini kullanarak her seri seyreltme örneği için cq değerlerini (iki kez ölçülür) sağladı. Negatif kontrol denemeleri (miRNA eklenmesi olmadan) > 35 cq değerleri sağladı. Numune hacmi başına miRNA iplikleri sayısı işlevi olarak cq değerlerinin veri noktaları (ilk konsantrasyon ve seri dilüsyonlar hesaplanır) sunulan denklem ile donatılmış (kırmızı çizgi, sağ görüntü), M =-3,36 ve B = 42,12. Belirlenen PCR verimliliği 0,98 idi. Hata çubukları deneysel tekrarların sonuçlarından hesaplandı ve veri noktası dairesini çapından daha küçüktü. (B) yerel/yapay olarak ZENGINLEŞTIRILMIŞ HDL parçacıklarının cq değerleri, A panelinde belirlendiği gibi aynı eşik düzeyine göre belirlendi ve qPCR örnek hacminde Mirna iplerinin sayısına dönüştürülür. Orijinal numunenin miRNA 'nın mutlak oranı, numune hacminin (3,2 x 1011 parçacık) HDL parçacıklarının sayısına (konsantrasyonu) karşı hesaplanır. (C) hücre örnekleri (hücre hattı LDLA7-srbı), yapay olarak ZENGINLEŞTIRILMIŞ HDL parçacıkları (50 μg/ml) ile 16 h için inkübe edilmiş ve benzer şekilde analiz edilmiştir. Belirlenen cq değerleri, yalnızca hücreler için 22,5, 22,5 ve 19,3, yerel HDL ile birlikte gelen hücreler veya rhdl parçacık çözeltisi (hem 50 μg/ml) ile birlikte gelen hücreler için sırasıyla bulunuyordu. Bu değerler, Bpanelinde yapılan Mirna iplerin sayısına dönüştürülmüştür. İnkübasyon sonrası miRNA iplerin sayısı (7,3 x 106) inkübasyon öncesinde Mirna iplerin sayısının çekilmesi ile düzeltilmiştir (8,6 x 105). Sonuç, numune birimindeki hücre sayısına (3.100), miRNA-parçacık-oranı (1,5 x 10-4) ve inkübasyon süresi (16 saat) bölünmüştür. Bu, miRNA alımı ile lipoprotein parçacıklarının aktarım hızını sağladı (240, hücre ve ikincisi başına HDL parçacık alımı olayları). Bu rakam Axmann ve al.19' dan değiştirildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Multiwell mikrofluidik dizi
MiRNA ekstraksiyon küçük verimleri nedeniyle, çıkarılan miRNA Ters transkripsiyon bir ön amplifikasyon adım izledi. Son olarak, qPCR, Şekil 6' da gösterildiği gibi gerçekleştirildi. Tüm adımlar için, üretici tarafından açıklandığı gibi standart biyokimyasal prosedürler kullanılmıştır. Burada, CRF 'nin makrofajlar18 ' den gelen kolesterol "effluks" üzerindeki etkisi üzerine bir çalışma için istihdam edilen üremik hastaların HDL parçacıklarının küresel Mirna profilinin bir parçası gösterilir. Bu çalışmada, HDL veya serum kolesterol alıcı kapasitesi-diğerlerinin yanı sıra-17 Genç Yetişkin üremik hastalar (CKD aşamaları 3-5) ve 14 Genç Yetişkin hemodiyaliz hastalar ile ilişkili hastalıklar ve eşleşen kontroller ölçülmüştür. Verileri çözümlemek için varsayılan ayarlar kullanıldı (maksimum izin verilen CT değeri: 40,0, hesaplamalarda maksimum CT değerleri ve çoğaltır arasında aykırı değerler dahil). P-değerleri Benjamini-Hochberg yanlış keşif oranı (yanlış pozitifinlerin oluşumunu düzeltme) kullanılarak ayarlandı ve normalleştirme yöntemi olarak, genel normalleştirme seçildi, tüm arasında ortak deneyleri bulur numuneleri orta CT normalleştirme için kullanmak için. Temsili sonuçlarda, üremik hastaların HDLs 'den izole edilen bazı RQs 'ler (RQs kontrolleri 1). Açıkçası, miR-122 ve miR-224 oldukça üremik hastaların HDLs ifade edilir. Tüm bu adım yaklaşık 1 gün sürdü.
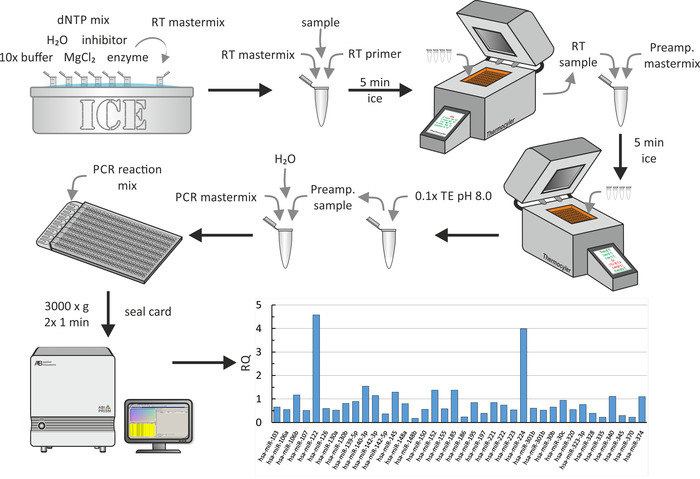
Şekil 7: multiwell mikrofluidik dizinin akış çizelgesi ve temsili sonuçları. Şekil 5Agösterildiği gibi Mirna ekstraksiyon sonra, Ters transkripsiyon primer ve 10X tampon içeren bir ana Mix Ile Mirna örnek Mix, H2O, dntp Mix, Inhibitör, MgCl2, ve enzim. 5 dakika boyunca buzun üzerinde kuluçdan sonra, bir termocycler makinesi kullanarak Ters transkripsiyon gerçekleştirin. Ön amplifikasyon ana karışımını ekleyin, buzda 5 dakika boyunca inküye yapın ve bir termocycler makinesini kullanarak ön amplifikasyon gerçekleştirin. 0.1 x te (pH 8,0) ekleyin ve PCR Master Mix ve H2O ile bir kısım karıştırın. PCR reaksiyon karışımını multiwell mikrofluidik dizinin dolgu portuna pipet yapın ve her biri 1 dk için 3.000 x g 'de iki kez döndürün. QPCR 'yi bir PCR sistemi kullanarak gerçekleştirin ve RQ değerlerini elde etmek için verileri analiz edin (burada, şekil18' de sağlıklı bir kontrol grubuna kıyasla üremi HASTALARıN HDL PARÇACıKLARıNıN RQ değerlerini gösterir). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
Burada, lipoprotein parçacık fraksiyonları insan kanı ve kendi bireysel miRNA içeriğinin belirlenmesi yalıtım adım-adım açıklanmıştır. Yalıtılmış ve sentezlenmiş miRNA işleme sırasında bir RNase-Free ortamda çalışmak için önemlidir-parçacık gömülü miRNA belli ki enzimatik bozulması korunaklı. Yerli lipoprotein parçacıklarının miRNA/parçacık oranı oldukça düşüktür, miRNA ile yapay zenginleştirme hücrelerin Holo parçacık alımı incelemek için gereklidir. Böylece, daha önce açıklandığı gibi HDL partiküllerinin yeniden oluşturulması7 Mirna iplerini birleştirmek için değiştirilir. Ayrıca, bu prosedür sırasında lipid ve protein fraksiyonu ayrılması bilim adamlarının lipoprotein parçacık19lipid ve protein ilişkili bileşenlerini incelemek için izin verir. Benzer şekilde, LDL parçacıklarının etiketleme prosedürü adapte edilir. İlginçtir, spermine ilavesi-nükleotidler doğal bir stabilizatörü-miRNA/parçacık oranını etkilemez. Bu, prensip olarak, yöntem bir lipoprotein parçacık içinde miRNA daha diğer maddelerin infolding sağlar unutulmamalıdır. Tabii ki, HDL genel boyutuna göre maddenin fiziksel boyutu ile ilgili bir sınır vardır (çap: 5-12 NM) ve LDL parçacıklar (çap: 18-25 Nm).
Reconstituted/etiketli lipoprotein parçacıklarının kalite kontrolü ile ilgili olarak HS-AFM, tek parçacık seviyesinde HDL/LDL parçacıklarını karakterize etmek için uygulanabilir bir yöntemdir. EM ile karşılaştırıldığında, daha kısa hazırlık süreleri ve yakın fizyolojik koşullar (ıslak, oda sıcaklığı) sağlar.
Doğal duyarlılığı ve amplifikasyonu nedeniyle qPCR, düşük miRNA konsantrasyonlarını algılamak için tercih edilen yöntemdir. Alternatif olarak, tek molekül duyarlı Floresan Mikroskobu, hatta bireysel molekülleri algılamak mümkün, düşük konsantrasyonları nedeniyle uygun olmayacaktır, örneğin, Parçacık başına floresan etiketli miRNA ipleri. Böylece, yerli lipoprotein parçacığın başına miRNA iplerin oranı 10-8olarak bulunmuştur. Yapay zenginleştirme, hücresel lipoprotein alımını oranının (doğal lipoprotein parçacıkları 19kullanılarak algılanmayan) tahmin edilmesini kolaylaştıran 10.000 faktörüyle oranı artar. QPCR 'nin yüksek duyarlılığı, kuluçka süresi ve miRNA/parçacık oranı sonrasında miRNA iplerin sayısını ölçerek bu alımı hızını belirlemenize olanak sağlar. Hesaplanan değerin hücresel bozulması ve Mirna 'nın serbest bırakılması yok sayar ve bu nedenle, lipoprotein parçacık alımını oranı için en az bir alt sınırı temsil ettiği belirtilmelidir.
Gelecekte, yöntem hücrelerde ilaç maddeleri (özellikle de lipophilik olanlar) aktarmak için adapte edilebilir ve hücre içi konsantrasyon (lipoprotein parçacıkları alımını oranı ile belirlenir) biyolojik etkisini ilişkilendirir.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu çalışma Avusturya Bilim Fonu Projesi P29110-B21, "Hochschuljubiläumsstiftung der Stadt Wien Zur Förderung der Wissenschaft" projesi H-3065/2011, Avrupa Bölgesel Kalkınma Fonu (EFRE, IWB2020), üst federal devlet tarafından destekleniyordu. Avusturya ve "Land OÖ Basisfinanzierung".
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ultracentrifuge | Beckman | Optima L-100 XP | Lipoprotein isolation |
| Ultracentrifuge rotor | Beckman | TI 55.2 | Lipoprotein isolation |
| Vacutainer (EDTA) | Becton Dickinson | 366643 | Lipoprotein isolation |
| Kaliumbromid | Sigma Aldrich | 2110 | Lipoprotein isolation |
| Ultracentrifuge tubes | Beckman | 342414 | Lipoprotein isolation |
| Ultracentrifuge tube sealer | Beckman | 342428 | Lipoprotein isolation |
| Sodiumchlorid | Carl Roth GmbH | P029.2 | Lipoprotein isolation |
| EDTA | Fisher Scientific | D/0650/50 | Lipoprotein isolation |
| Dialysis tubes, MWCO 12 - 14k | Spectra | 132700 | Lipoprotein isolation |
| synthetic miRNA | microSynth | - | synthetic miRNA |
| TRIS buffer pH 7 | Ambion | AM9850G | synthetic miRNA |
| TRIS buffer pH 8 | Ambion | AM9855G | synthetic miRNA |
| sterile tubes | Carl Roth GmbH | ENE8.1 | synthetic miRNA |
| Photometer | Eppendorf | Eppendorf Biophotometer | Bradford assay |
| Cuvette | Carl Roth GmbH | XK20 | Bradford assay |
| Coomassie G-250 Stain | BioRad GmbH | 161-0786 | Bradford assay |
| Sodiumchlorid | Carl Roth GmbH | 3957.1 | Delipitation |
| EDTA | Fluka Analytical | 03690-100ML | Delipitation |
| TRIS buffer pH 8.0 | Ambion | AM9855G | Delipitation |
| Ethanol 100% | AustrAlco | Ethanol Absolut 99.9% | Delipitation |
| Diethyl ether | Carl Roth GmbH | 3942.1 | Delipitation |
| Centrifuge | Thermo Scientific | Multifuge X3R | Delipitation |
| Chloroform | Carl Roth GmbH | 3313.1 | Reconstitution |
| Methanol | Carl Roth GmbH | 4627.1 | Reconstitution |
| Phosphatidylcholine | Sigma Aldrich GmbH | P3556-25mg | Reconstitution |
| Cholesterol oleate | Sigma Aldrich GmbH | C-9253-250mg | Reconstitution |
| cholesterol | Sigma Aldrich GmbH | C8667-500mg | Reconstitution |
| glass tubes | Carl Roth GmbH | K226.1 | Reconstitution |
| spermine | Sigma Aldrich GmbH | S3256-1G | Reconstitution |
| Thermomixer | Eppendorf | Thermomixer comfort | Reconstitution |
| Sodium deoxycholate | Sigma Aldrich GmbH | 3097-25G | Reconstitution |
| Magnetic stir bar | Carl Roth GmbH | 0955.2 | Reconstitution |
| 100µL micropipettes | Carl Roth GmbH | A762.1 | Reconstitution |
| PBS | Carl Roth GmbH | 9143.2 | Dialysis |
| Amberlite XAD-2 beads | Sigma Aldrich GmbH | 10357 | Dialysis |
| Slide-A-Lyzer casette (cut-off 20 kDa) | Thermo Scientific | 66003 | Dialysis |
| Syringe | Braun | 9161406V | Dialysis |
| Syringe needle | Braun | 465 76 83 | Dialysis |
| EGTA | Carl Roth GmbH | 3054.2 | Labeling of LDL particles |
| DMSO | life technologies | D12345 | Labeling of LDL particles |
| Atomic Force Microscope | RIBM | SS-NEX | Quality control of reconstituted/labeled lipoprotein particles |
| Muscovite Mica (V-1 Grade) | Christine Gröpl | G250-1/V1 | Quality control of reconstituted/labeled lipoprotein particles |
| AFM Cantilever | Nanoworld | USC-F1.2-k0.15 | Quality control of reconstituted/labeled lipoprotein particles |
| Gwyddion 2.49 | Czech Metrology Institute | http://gwyddion.net | Quality control of reconstituted/labeled lipoprotein particles |
| Chamber slides, Nunc Lab-Tek | VWR | 734-2122 | Cell culture |
| HBSS | Carl Roth GmbH | 9117.1 | Cell culture |
| Cell counter | Omni Life Science GmbH | Casy | Cell culture |
| miRNeasy Mini Kit | QIAGEN | 217004 | miRNA extraction |
| Centrifuge | Eppendorf | 5415R | miRNA extraction |
| 20G needle | Braun | Sterican 465 75 19 | miRNA extraction |
| 5ml syringe | Becton Dickinson | 309050 | miRNA extraction |
| PCR cabinet | Esco | PCR-3A1 | Reverse Transcription |
| TaqMan Reverse Transcription Kit | Thermo Scientific | 4366596 | Reverse Transcription |
| Rnase-free water | Carl Roth GmbH | T143 | Reverse Transcription |
| 0.2 ml tubes | Brand | 781305 | Reverse Transcription |
| Centrifuge | Carl Roth GmbH | Microcentrifuge AL | Reverse Transcription |
| Thermocycler | Sensoquest | Labcycler | Reverse Transcription |
| TaqMan Primer | Thermo Scientific | - | qPCR |
| iTaq Universal probe supermix | BioRad GmbH | 1725131 | qPCR |
| PCR machine | Corbett | Rotor-Gene RG-6000 | qPCR |
| TaqMan MicroRNA Reverse Transcription Kit | Applied Biosystems | 4366596 | TaqMan Array |
| Megaplex RT Primers, Human Pool A v2.1 | Applied Biosystems | 4399966 | TaqMan Array |
| TaqMan PreAmp Master Mix | Applied Biosystems | 4391128 | TaqMan Array |
| Megaplex PreAmp Primers, Human Pool A v2.1 | Applied Biosystems | 4399933 | TaqMan Array |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | TaqMan Array |
| TaqMan Advanced miRNA Human A Cards | Applied Biosystems | A31805 | TaqMan Array |
| Nuclease-free water | Thermo Scientific | R0581 | TaqMan Array |
| MgCl2 (25mM) | Thermo Scientific | R0971 | TaqMan Array |
| TE, pH 8.0 | Invitrogen | AM9849 | TaqMan Array |
| 7900HT Fast Real-Time PCR System | Applied Biosystems | 4351405 | TaqMan Array |
| TaqMan Array Card Sealer | Applied Biosystems | - | TaqMan Array |
Referanslar
- Vickers, K. C., Palmisano, B. T., Shoucri, B. M., Shamburek, R. D., Remaley, A. T. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nature Cell Biology. 13 (4), 423-435 (2011).
- Tabet, F., et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nature Communications. 5, (2014).
- Wahid, F., Shehzad, A., Khan, T., Kim, Y. Y. MicroRNAs: Synthesis, mechanism, function, and recent clinical trials. Biochimica et Biophysica Acta - Molecular Cell Research. 1803 (11), 1231-1243 (2010).
- Carthew, R. W., Sontheimer, E. J. Origins and Mechanisms of miRNAs and siRNAs. Cell. 136 (4), 642-655 (2009).
- Fabian, M. R., Sonenberg, N., Filipowicz, W. Regulation of mRNA Translation and Stability by microRNAs. Annual Review of Biochemistry. 79 (1), 351-379 (2010).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: Are the answers in sight?. Nature Reviews Genetics. 9 (2), 102-114 (2008).
- Jonas, A. Reconstitution of High-Density Lipoproteins. Methods in Enzymology. , 553-582 (1986).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Bustin, S. A., et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Patsch, J. R., Patsch, W. Zonal ultracentrifugation. Methods in Enzymology. 129 (1966), 3-26 (1986).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Yamamoto, D., et al. High-Speed Atomic Force Microscopy Techniques for Observing Dynamic Biomolecular Processes. Methods in Enzymology. 475, 541-564 (2010).
- Stangl, H., Cao, G., Wyne, K. L., Hobbs, H. H. Scavenger receptor, class B, type I-dependent stimulation of cholesterol esterification by high density lipoproteins, low density lipoproteins, and nonlipoprotein cholesterol. Journal of Biological Chemistry. 273 (47), 31002-31008 (1998).
- Hochberg, B. Controlling the False Discovery Rate: a Practical and Powerful Approach to Multiple Testing. Journal of the Royal Statistical Society. 57 (1), 289-300 (1995).
- Mestdagh, P., et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biology. 10 (6), (2009).
- Schumaker, V. N., Puppione, D. L. 6] Sequential Flotation Ultracentrifugation. Methods in Enzymology. 128 (C), 155-170 (1986).
- Wagner, J., et al. Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1392-1400 (2013).
- Meier, S. M., et al. Effect of chronic kidney disease on macrophage cholesterol efflux. Life Sciences. 136, 1-6 (2015).
- Axmann, M., et al. Serum and Lipoprotein Particle miRNA Profile in Uremia Patients. Genes. 9 (11), 533 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır