Method Article
マイクロ Rna による天然リポタンパク質粒子の濃縮とその絶対/相対マイクロ Rna 含量とその細胞移動速度の決定
要約
ここでは、定量的なリアルタイムポリメラーゼ連鎖反応ベースのプロトコルが、リポタンパク質粒子の天然マイクロ RNA 含量 (絶対/相対) の決定のために提示される。加えて、マイクロ RNA レベルを増加させるための方法、ならびにリポ蛋白質粒子の細胞取り込み速度を決定するための方法が、実証される。
要約
リポタンパク質粒子は、主に血流中の脂質およびコレステロールのトランスポーターである。さらに、少量のノンコーディングマイクロ Rna (miRNA) を含有しています。一般に、miRNA は、メッセンジャー RNA (mRNA) との相互作用によりタンパク質発現プロファイルを変化させる。したがって、リポタンパク質粒子の相対および絶対 miRNA 含量の知識は、細胞粒子取り込みの生物学的効果を推定するために不可欠である。ここでは、定量的なリアルタイムポリメラーゼ連鎖反応 (qPCR) ベースのプロトコルを用いて、天然および miRNA 濃縮リポタンパク質粒子について例示されたリポタンパク質粒子の絶対 miRNA 含有量を決定します。相対 miRNA 含有量は、マルチウェルマイクロ流体アレイ・カードを使用して定量化されます。さらに、このプロトコルは、科学者が細胞 miRNA を推定することを可能にし、したがって、リポタンパク質粒子取込み速度である。人為的に miRNA を装填した高密度リポタンパク質 (HDL) 粒子を使用する場合、細胞 miRNA レベルの有意な増加が観察されますが、天然の HDL 粒子とのインキュベーションは、それらのむしろ低い miRNA 含量のために有意な効果をもたらしません。対照的に、低密度リポタンパク質 (LDL) 粒子の細胞の取り込みは、ネイティブ miRNA と人工的にロードされていません-細胞 miRNA レベルを変化させませんでした。
概要
リポタンパク質粒子は、コレステリルエステルエステルおよびトリグリセリド脂肪のコアを内包する両親媒性脂質およびコレステロールの単層から構成される。粒子全体は、粒子の生物学的機能を定義する膜埋め込まれた apolipoproteins によって安定化される。リポ蛋白粒子は、それぞれの増加密度に応じて区別することができ、したがって、サイズを減少させる、すなわち超低密度リポタンパク質 (VLDL)、中間密度リポタンパク質 (IDL)、LDL、および HDL 粒子として。血流中の水不溶性成分の輸送にもかかわらず、HDL 粒子が miRNA1,2の非コーディング鎖を運ぶことが実証されています。マイクロ rna は短い (通常2ダースヌクレオチドの) RNA 鎖のクラスであり、これは細胞内相補的 mRNA 鎖を分解し、それにより、ある種のタンパク質の発現プロファイルを変化させる3、4、5、 6さらに、miRNA プロファイルの改変が種々の疾患において見出され、従って、プロファイルは、診断および予後のためのバイオマーカーとして適用可能である。リポ蛋白粒子を介した細胞間の Mirna の細胞外輸送は、細胞間 mRNA レベル変調のための追加機構として機能し得る。生体効果を定量的に推定するためには、リポタンパク質粒子の絶対的および相対 miRNA 含量に関する知識が必要である。
定量的リアルタイム PCR は、この情報を取得するための適切で比較的迅速な方法です。したがって、相対定量化 (RQ) 値を計算することができ、異なるサンプルとリポ蛋白画分の間の相対差は推定可能である。マルチウェルマイクロ流体アレイカードは、サンプル中の Mirna の相対存在 (RQ 値に相当) を決定するための高速で使いやすい方法です。マルチウェルマイクロ流体アレイカードは、マイクロ流体デバイスに埋め込まれた個々の qPCR 反応のための96または384の個々の反応チャンバから成ります。各チャンバには、1つの個々の miRNA に必要な加水分解プローブおよび特異的 qPCR プライマーが含まれています。その利点は、標準化による短い処理時間、簡単なワークフロー、ピペット操作の回数の減少です。さらに、必要なサンプル容積は最小になる。相対定量とは対照的に、絶対 miRNA 含有量には、miRNA ストランドの既知の絶対数の標準曲線との qPCR サンプル結果の比較が必要です。そのため、miRNA 含量が比較的低く、標準であること、さらに、単一分子感受性イメージング技術でさえも実現可能でないということは、miRNA を用いたリポタンパク質粒子の人工的な濃縮は、細胞学を研究するために不可避であることに留意すべきであるリポタンパク質粒子相互作用および miRNA 転送。これに関して、HDL 粒子の delipidation はその後に続く relipidation7を用いて、miRNA ストランドを用いて濃縮することを可能にする。MiRNA を用いた LDL 粒子の同様の濃縮は、LDL 粒子の主な構成成分である apoB-100 タンパク質の疎水性のために実現可能ではない。しかしながら、極性溶媒を添加することによりジメチルスルホキシド (DMSO)、これは脂質膜を貫通することができ、LDL 粒子は同様に miRNA 鎖を人工的に装填することができる。
高速原子間力顕微鏡 (HS-AFM) は、subnanometer 空間的および subsecond 時間的分解能8を提供する生物学的標本の特徴付けのための強力なツールです。それ故に、それは、ネイティブ/再構成/標識リポタンパク質粒子が近生理的環境下で画像化することができるように変性リポタンパク質粒子の品質管理のための十分に適した技術である。
ここでは、qPCR ベースのプロトコルを段階的に提示して、リポタンパク質粒子および細胞サンプルの絶対/相対 miRNA 含有量を決定し、これにより細胞リポタンパク質粒子の取込み速度を推定することができます。さらに、miRNA を用いたリポ蛋白質粒子の濃縮のための方法が実証されている。この方法は、リポタンパク質含量の一般的な操作のために適合され得る、したがって、薬物送達のための標的としてのリポタンパク質粒子の適用性を実証する。
プロトコル
献血はウィーン医科大学 (EK-Nr. 511/2007, EK-Nr. 1414/2016) によって承認されています。命名法は、定量的リアルタイム PCR 実験 (MIQE)9ガイドラインの公開に関する最低限の情報に基づいています。
1. 人間の血液からのリポタンパク質粒子の分離
- Precool を4° c に ultracentrifuge。一晩絶食後に健康なボランティアから血液を引きます。
注: 通常必要なドナーは3名で、それぞれ 80 mL を供与し、ethylenediaminetetraacetic 酸 (EDTA) を含む採血チューブを抗凝固剤として提供する。 - 4° c で20分間 2000 x gで遠心分離し、血漿 (上層相) を収穫します。せん断力を避けてください。合計容積Vを決定し、必要に応じて、リン酸緩衝生理食塩水 (PBS) を使用して遠心チューブ体積の倍数に調整する。1 mL 3x の質量を測定し、平均密度ρを計算します。
- 次の式10で密度調整のために必要な量の臭化カリウム (KBr) を計算します (グラム/ミリリットルの所望の密度のために、 A = 1.019 を使用
 し、KBr の特定の体積については、= 0.364 mL/g) を使用します。プラズマに KBr を加え、KBr が完全に溶けるまでせん断力を避けるためにやさしくかき混ぜます。
し、KBr の特定の体積については、= 0.364 mL/g) を使用します。プラズマに KBr を加え、KBr が完全に溶けるまでせん断力を避けるためにやさしくかき混ぜます。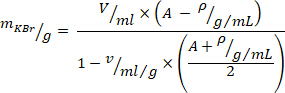
- ステップ1.2 で説明されているように密度を測定し、さらに KBr を追加することにより、必要に応じて再度調整します。充填とシールプラズマと超遠心よるに適した遠心管を密封します。任意の気泡を避けます。さもなければ、チューブが潰れてしまうことがある。メーカーの指示に従ってローターにチューブを置き、214000 x gで 20 h で4° c で遠心分離します。
- メーカーの指示に従ってチューブを開き、VLDL と IDL を含む上の段階を破棄します。合計容積Vを決定し、必要に応じて、PBS を使用して遠心管体積の倍数に調整します。
- ボトム画分の密度ρを求める。密度調整に必要な KBr の量を計算します ( A = 1.063 を使用)。KBr が溶けるまでせん断力を避けるためにやさしくかき混ぜる。ステップ1.4 を繰り返します。
- LDL 粒子を含む上層相を除去して回収する。LDL 粒子溶液を4° c の不活性ガス雰囲気下に保管してください。合計容積Vを決定し、必要に応じて、PBS を使用して遠心管体積の倍数に調整します。ステップ1.2 で説明したようにボトム画分の密度ρを求める。
- 密度調整のために必要な量の KBr を計算し ( A = 1.220 を使用)、それを追加します。KBr が溶けるまでせん断力を避けるためにやさしくかき混ぜる。ステップ1.4 を繰り返します。
- HDL 粒子を含む上部相を除去し、回収する。その合計容積Vを決定し、必要に応じて、PBS を使用して遠心管体積の倍数に調整する。密度ρを決定する。4° c で20の h のための 214000 x gの上の段階の第2遠心分離ステップはアルブミンを取除くために推薦される。必要に応じて、ステップ1.8 を繰り返します。HDL 粒子を含む上部相を除去し、回収する。
- 調製し、少なくとも 20 L の透析緩衝液 (0.9% NaCl、0.1% EDTA [pH 7.4]) を4° c に precool。Prewet 透析チューブ (分子量カットオフ:12 ~ 14 kDa) を加え、製造元の指示に従って LDL および HDL 粒子溶液を追加します。透析は、4° c で 5 L の透析バッファーに対して、1、2、4時間後にバッファーを変更します。
- 24時間後、透析チューブからリポタンパク質粒子溶液を回収し、ブラッドフォードアッセイ11または別の適切なものを使用してタンパク質濃度を決定する。HDL と LDL の粒子溶液を4° c の不活性ガス雰囲気下に保管してください。
2. 合成 miRNA アリコート
注: RNA オリゴヌクレオチドを扱う場合は、RNase フリーで作業してください。新鮮な使い捨てのプラスチック消耗品でのみ作業し、常に手袋を着用し、頻繁に変更する必要があります。ヌクレアーゼフリーのソリューションのみを使用してください。常に氷上で作業する。
- 最大の力でメーカーから取得したバイアルをスピンダウンして、凍結乾燥合成 miRNA のペレットを形成します。10μ m (ストック濃度) miRNA の最終濃度について、10 mM トリス (ヒドロキシメチル) aminomethane (トリス) バッファー、pH 7.5 の適切なボリュームを追加します。
- 再懸濁のために数回、ゆっくりと上下にピペットで拭きます。滅菌チューブ中にそれぞれ100μ l のアリコートを調製する。すぐに使用しない場合は-20 ° c でそれらを保存します。解凍と凍結を繰り返すことは避けてください。
3. HDL 粒子の再構成
-
Delipidation
- バッファー A (150 mM NaCl、0.01% EDTA、10 mM トリス/HCl [pH 8.0]) をご用意ください。遠心分離機を-10 ° c に Precool ます。エタノールの混合物の Precool 100 mL: ジエチルエーテル (3:2) で-20 ° c。
注意: 適切な個人用保護具を着用し、ジエチルエーテルを取り扱いながら、それは非常に可燃性と皮膚に有害であるとして、ヒュームフードで動作します。 - 脱エタノールの 50 mL の HDL 粒子 5 mg に対応するボリュームを混合: ジエチルエーテル (3:2) 混合物および-20 ° c で2時間インキュベートします。2500 x gで10分間-10 ° c で遠心分離します。
- 上清を廃棄し、脱エタノールの 50 mL でペレットを再懸濁し、ボルテックスによってジエチルエーテル混合物を、2回目の時間を-20 ° c でインキュベートします。2500 x gで10分間-10 ° c で再び遠心分離します。
注: 必要であれば、lyophilize は、HDL 粒子の脂質分率における miRNA 含量の分析のために上清を測定する。 - N2ガス流の下でペレットを乾燥させ、250μ l のバッファ A に再懸濁します (ステップ3.1.1 を参照)。ブラッドフォードタンパク質アッセイまたは別の適切なものを使用してタンパク質濃度を決定し、バッファ A の 1 mg のタンパク質/250 μ l の最終濃度に希釈します。
注: プロトコルはここで一時停止することができます。溶液は、不活性ガス雰囲気下で4° c で一晩保管してください。
- バッファー A (150 mM NaCl、0.01% EDTA、10 mM トリス/HCl [pH 8.0]) をご用意ください。遠心分離機を-10 ° c に Precool ます。エタノールの混合物の Precool 100 mL: ジエチルエーテル (3:2) で-20 ° c。
-
再構成
- クロロホルム: メタノール (2:1) を5.6 の濃度の PC/mL で混合して、ホスファチジルコリン (PC) ストック溶液を調製します。同様に、コレステリルエステルオレイン酸 (5 mg の CO/mL) およびコレステロール (5 mg の C/mL) の原液を調製します。-20 ° c ですべてのソリューションを保存します。
- きれいなガラス管では、500μ l の PC、100μ l の CO、13.5 μ l の C を混合します。これらの容積は、100 PC のおおよそのモル比に対応する:22 CO: 4.8 c. チューブを回転させながら N2のガス流の下で混合物を乾燥し、均質な表面層を生成する。
注: プロトコルはここで一時停止することができます。-20 ° c の不活性ガス雰囲気下でガラスバイアル (必要に応じて、備蓄が可能) を保管してください。 - 新しい 30 mM のスペルミンソリューションをバッファー A に準備します。合成 miRNA (100 μ l、10μ m) 1 アリコート (ステップ2.2 参照) と100μ l のスペルミン溶液を混合し、30° c で30分間インキュベートします。
注: 陰性対照実験のために、miRNA および/またはスペルミン溶液を同じ量のバッファー A と取り替えてください。 - ステップ3.2.3 からの混合物のアリコートの PC/CO/C のマスターミックスを溶かしなさい。
- バッファ A のデオキシコール酸ナトリウムの 30 mg/mL の溶液を調製し、ステップ3.2.4 から溶液に50μ l を加えます。4° c で2時間攪拌します。
- ステップ3.1.4 から delipidated HDL 溶液の250μ l を加えてください。この容積は、100 PC のおおよそのモル比に対応する:22 CO: 4.8 C:1 delipidated HDL タンパク質。4° c で一晩攪拌します。
-
透析
- 4° c で少なくとも 15 L の PBS を Precool。50 g の吸着性ビーズを 800 mL の二重蒸留水 (ddH2O) に添加し、1分間攪拌してから15分待って、上清をデカントし、PBS で手順を繰り返す。
- Prewet 透析カセット (分子量カットオフ:20 kDa) または適切な透析チューブを使用して、ステップ3.2.6 から溶液を添加し、製造者の指示に従ってシリンジを用いてください。
- ステップ3.3.1 から 3 L の PBS および透析に吸着性ビーズを加え、4° c で添加する。1時間後と2時間後にバッファーとビーズを交換します。
- 24時間後、再構成された HDL (rHDL) 粒子溶液を回収し、ブラッドフォードアッセイを使用してタンパク質濃度を決定します。RHDL 粒子溶液を4° c で不活性ガス雰囲気下に保管してください。
4. LDL 粒子の標識
- 10x LDL 緩衝液 (1.5 M NaCl、3 mM EDTA、1 mM エチレングリコール-ビス (β-アミノエチルシステインエーテル)-N、N、N '、N'-tetraacetic 酸 [EGTA、pH 7.4]) を調製し、室温で保存します。
- 新しい 30 mM スペルミン溶液を RNase フリーの水で調製します。アリコート (100 μ l、10μ m) の合成 miRNA (ステップ2.2 を参照) を100μ l のスペルミン溶液で混合し、30° c で30分間インキュベートします。
注: 陰性対照の実験のために、miRNA および/またはスペルミン溶液を 1x LDL バッファーの同じボリュームで取り替えてください。 - ステップ4.2 からの miRNA/スペルミン溶液に DMSO の100μ l を加え、1x LDL バッファーの 1.2 mL でさらに希釈します。
- PBS で約 4 mg/mL の最終濃度に LDL 粒子溶液を希釈し、10倍の LDL バッファー50μ l の450μ l を混合します。氷上で10分間インキュベートします。
- 前のステップと miRNA/スペルミン/DMSO 溶液 (ステップ4.3 から) の LDL 粒子溶液を結合し、40° c で2時間インキュベートします。
- セクション3.3 で説明したような透析を行い、それに応じて標識された LDL 粒子溶液を保存する。
5. 再構成/標識リポタンパク質粒子の品質管理
注: 品質管理のために、リポタンパク質粒子の直径および一般的な形状は、例えば、AFM または電子顕微鏡 (EM) を使用して決定することができる。ここで、HS − AFM は、ネイティブ/再構成/標識リポタンパク質粒子のサイズ分布を測定するために使用される。
- PBS (1: 100-1: 1000) で HDL/LDL 微粒子溶液を希釈し、切断されたばかりの雲母で5分間インキュベートします。マイカ12を切断するためには、基材に対して粘着テープを押し付け、テープを抜いて上マイカ層を除去する。
注: 特定の AFM 器具に応じて、観察領域、および粒子の初期濃度を、希釈倍率が個々の粒子を観察するように調整しなければならない。 - インキュベート後、サンプルを PBS ですすぎ、PBS での HS-AFM イメージングを行い、kカント≪ 0.2 N/m のバネ定数を持つカンチレバーのタッピングモードで行います。1μ m2 < スキャンサイズを使用し、イメージング力をできるだけ低く保つことをお勧めします。
- 適切なソフトウェアを用いてマイカ面に対して撮像粒子の高さを求める。
- Gwyddion (フリーウェア) にデータをロードし、穀物分析を介して粒子を検出し (閾値によって穀物をマーク)、基板の背景の上にしきい値を設定します。[マスクされた領域を除外] オプションを選択して、イメージを平らにします (多項式の背景を削除します)。
- 検出された粒子の高さの値 (様々な粒子特性の分布) をエクスポートし、すべての記録画像に対してこれらのステップを繰り返します。ヒストグラムを作成するか、得られた粒子の高さの確率密度関数を計算することにより、統計分析を実行します。
- ネイティブだけでなく、再構成/標識リポタンパク質粒子とステップ 5.1-5.3 を繰り返し、粒子の品質を検証するために得られた結果を比較します。破片やコングロマリットを観察する場合は、サンプルを破棄します。
6. 細胞培養
- 確立されたプロトコル (例えば、ldlA7-SRBI13) に従って付着細胞をコンフルエントに達するまで増殖する。
注: 実験の数に応じていくつかの独立したチャンバ (推奨される実験設定ごとに2つのチャンバ) と陰性対照実験 (推奨される2つのチャンバは、リポ蛋白質の粒子を添加せず) が必要です。さらに、2つの部屋は細胞数の決定のために必要とされる。 - Prewarmed ハンクのバランスのとれた塩溶液 (HBSS) で細胞を優しく洗って、細胞破片を取り除き、適切な量の無血清成長培地で細胞層を覆います。50μ g/mL リポタンパク質粒子の最終濃度に到達するために、リポ蛋白質粒子溶液の適切な量を追加します。37° c で、5% の CO2を16時間インキュベートします。
注: 実験計画および細胞株に依存して、インキュベーション時間は、細胞 miRNA レベルの十分な (すなわち測定可能な) 増加を達成するために適合されなければならない。 - Prewarmed (37 ° c) HBSS の細胞を優しく洗浄して細胞破片/リポタンパク質粒子を除去し、細胞層を適切な量の無血清培地で覆う。
- ステップ6.3 からの試料体積中の細胞数を計算するために、適切な方法 (例えば、血球計数器、自動セルカウンタ) を用いて細胞密度を測定する。この数値は正規化に使用されます。
7. 細胞およびリポタンパク質粒子サンプルからの miRNA の抽出
注: 細胞からの miRNA の抽出は、以下の修飾を用いて miRNA 抽出キットを使用して行われます。
-
細胞サンプル
- 遠心分離機を4° c に Precool。細胞を含む2つのチャンバにそれぞれ350μ l の溶解試薬を添加する。陰性対照実験として、細胞を含まないチャンバを使用する。
注意: 適切な個人保護具を着用し、フェノールとチオシアン酸が含まれているので溶解試薬を取り扱いながら、ヒュームフードで作業します。 - 細胞の離脱には 3 ~ 5 分待ってください (細胞株によって異なります)。必要に応じて、明視野顕微鏡による細胞剥離を確認してください。1.5 mL チューブに2つのチャンバの内容をプールします。
- 20の G の針および5つの mL のスポイトを使用して、抱負によってサンプル 5-10 を均質にし、5分間インキュベートしなさい140μ l のクロロホルム (CHCl3) を加え、15秒間激しく振り、3分間インキュベートします。
- 12000 x gで4° c で15分間遠心します。その後、遠心分離機の冷却を停止します。
- 新しい 1.5 mL チューブに上部水性相を移します。interphase には DNA が含まれ、下の段階にはタンパク質が含まれているため、相混合/汚染を避けてください。100% のエタノールの体積を1.5 倍にし、ピペッティングによって十分に混合します。
- 2 mL のコレクションの管のスピンコラムを置き、ステップ7.1.5 からの混合物の700μ l を加えなさい。室温で 15 s の 8000 x gで遠心分離します。フロースルーを破棄し、残りのサンプルボリュームでこのステップを繰り返します。
- フローを破棄し、最初の洗浄バッファの700μ l をスピンカラムに加えます。室温で15秒間 8000 x gで遠心分離します。
- フローを破棄し、2番目のウォッシュバッファの500μ l をスピンカラムに加えます。室温で15秒間 8000 x gで遠心分離します。遠心分離時間の2分でこの全体のステップをもう一度繰り返してください。
- スピンカラムを新しい 2 mL コレクションチューブに入れ、1分間フルスピードで遠心分離して膜を乾燥させます。
- 1.5 mL のコレクションチューブにスピンカラムを配置します。溶出のために膜の中心にある RNase フリーの水30μ l を加え、それを1分間 8000 x gで遠心分離します。溶出液としての最初の流れで、このステップ全体をもう一度繰り返します。逆転写ステップは、抽出直後に行われます。それ以外の場合は、抽出した miRNA サンプルを-20 ° c に保存します。
- 遠心分離機を4° c に Precool。細胞を含む2つのチャンバにそれぞれ350μ l の溶解試薬を添加する。陰性対照実験として、細胞を含まないチャンバを使用する。
-
リポタンパク質粒子
- タンパク質濃度が最も低いサンプルの体積を100μ l (= 最大サンプル体積) に設定します。その濃度に反比例して、この正規化に従って他のサンプルのサンプル量を計算します。陰性対照実験のために、RNase フリー水の100μ l を使用してください。
注: 正規化は必須ではありませんが、qPCR ステップおよび分析中の結果の直接比較を簡単にします。 - 遠心分離機を4° c に Precool。ステップ7.2.1 のサンプル容量に700μ l の溶解試薬を加えます。
- ステップ7.1.3 –7.1.10 に従って miRNA 抽出を行います。
- タンパク質濃度が最も低いサンプルの体積を100μ l (= 最大サンプル体積) に設定します。その濃度に反比例して、この正規化に従って他のサンプルのサンプル量を計算します。陰性対照実験のために、RNase フリー水の100μ l を使用してください。
8. 逆転写
注: miRNA の逆転写は、以下の変更を伴う逆転写キットを使用して行われます。
- キット試薬および逆転写用プライマーを氷上で解凍します。氷の上の反作用の管の次のマスターの組合せを準備しなさい: 45.7μ l の rnase フリーの h2o、16.5 のμ l の10x 逆転転写バッファー、11μ l の逆転写酵素、2.1 μ l の RNase 阻害剤、及び1.7 μ l の dNTP ミックス。優しく混ぜる、渦をしないでください。
注: スケールは、サンプル量によって異なります。ここでは、10個の反応について計算する。 - ラベル 0.2 mL チューブに従って、ステップ7.1.10 および3μ l の逆転写プライマーから抽出されたサンプルの5μ l を用いてステップ8.1 からマスターミックスの7μ l を混合する。ゆっくりと混合し、すぐに遠心分離し、氷の上に混合物を保存します。
- 各細胞株に同じセル番号を使用するために、より高い全体の細胞数で細胞株のサンプル量を減らしてください。これを残量として、5μ l の RNase フリー水の総サンプル量に到達させる。
注: リポタンパク質粒子サンプルはステップ7.2.1 ですでに正規化されています。標準的な曲線の準備のために、RNase フリーの水でアリコートの miRNA を順次希釈し、サンプル体積あたりのストランド数を計算します。必要なのは、得られたサンプル定量サイクル (cq) 値の範囲内にある少なくとも5つのデータポイントです。通常、10〜106の範囲の総希釈因子が適している。 - Thermocycler 機にチューブを配置し、次のプログラムを開始:16 ° c で30分 (アニーリングステップ)、42° c で30分 (逆転写)、85° c (溶融工程) で5分、4° c (貯蔵) で一時停止します。逆転写の直後に qPCR ステップを実行します。それ以外の場合は、miRNA サンプルから合成された相補 DNA (cDNA) を-20 ° c で保管してください。
9. qPCR
- 市販のアッセイを用いて cDNA の qPCR (miRNA からの逆転転写) を行い、以下の変形を有する (資料表参照)。
- すべての試薬 (スーパーミックス、RNase フリーの H2o)、cDNA サンプル (ステップ8.4 から)、および氷上のプライマーを解凍します。氷の上の反作用の管の次のマスターの組合せを準備しなさい: スーパーミックスの75μ l、RNase 自由な H2O の47.5 μ l、プライマーの7.56 μ l。優しく混ぜる、渦をしないでください。
注: スケールは、サンプル量によって異なります。ここでは、10個の反応について計算する。 - ラベル 0.2 mL チューブをそれに応じて、2μ l の cDNA サンプルをマスターミックスの13μ l に追加し、やさしく混合します。一般に、各サンプル2倍を測定します。
注: 2 つ以上のネガティブコントロールサンプルがさらに必要です—サンプルとして RNase フリーの水を使用してください。較正曲線がサンプルと同じ実行で決定されない場合、較正曲線測定からの1つのサンプルも必要である。これは、同じ反応効率に個々の実行を較正するために使用されます。 - PCR マシンにチューブを置き、50° c で2分、95° c で10分、95° c で15秒、60° c で 60 s を開始します。プログラムの最後の2つのステップを最大50倍まで繰り返します。
- PCR マシンのソフトウェアパッケージで cq値を分析するには、 DynamicTube 正規化(各サンプルトレースの2番目の導関数を使用して異なるバックグラウンドレベルの補正) とノイズ勾配を有効化します。補正(ノイズレベルへの正規化)。
注: ネガティブコントロールの cq値は、最高サンプル cq値よりも数サイクル高くなければなりません。- 較正曲線解析のために、各 miRNA の標準曲線から個別に各 mirna の cqを計算するための閾値を決定し、ソフトウェアパッケージの自動検出閾値機能を使用して、それを一定に保つ各特定の miRNA について。
- サンプル分析では、必要に応じて、キャリブレーション曲線サンプルからのデータ点を使用して、サンプル実行のさまざまな反応効率を補正します。ソフトウェアは、それぞれの較正曲線測定の閾値レベルからサンプルの cq値を計算する。
10. miRNA 含有量の計算
-
較正曲線
- 計算は、アリコート当たりの miRNA 鎖の初期数 (100 μ l の10μ m miRNA、データシートからの分子量) およびその後のシリアル希釈ステップ、サンプル体積中の miRNA 鎖の数 (ステップ8.3 からの5μ l のサンプル体積) から算出する。
注: 逆転写効率を1と仮定すると、この数値は cDNA ストランドの数と同じになります。 - ステップ9.3 から2μ l のサンプル量で cDNA 鎖の数を計算します。それによって7.5 の付加的な希釈係数 (ステップ8.4 からの15μ l のサンプル容積からのステップ9.4 からの2μ l のサンプル容積) を考慮する。
- ステップ9.5.1 からの cq値をベース-10 semilogarithmic プロットのステップ10.1.2 で計算されたストランドnストランドの数に対してプロットし、データポイントを次の回帰曲線で当てはめます (M = 線形の傾き回帰曲線、 B = オフセット)。
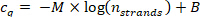
線の相関係数 (R2) が0.99 で > ことを確認します。
- 計算は、アリコート当たりの miRNA 鎖の初期数 (100 μ l の10μ m miRNA、データシートからの分子量) およびその後のシリアル希釈ステップ、サンプル体積中の miRNA 鎖の数 (ステップ8.3 からの5μ l のサンプル体積) から算出する。
-
リポタンパク質粒子
- 測定されたサンプル cq値 (ステップ 9.5.2) を使用してサンプル容積あたりの miRNA ストランドの数を計算し、次の式 (MおよびBは特定の miRNA の較正曲線パラメータです)。
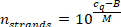
- サンプル容積におけるリポ蛋白質粒子の対応する数を計算し、ステップ 7.2.1 (100 μ l)、その既知の濃度、およびその後の希釈ステップでの体積から始めて (100 μ l-> ステップ 7.1.10-> 5 μ l) [希釈 1:6]ステップ 8.4-> 2 μ l 中 [希釈 1: 7.5] ステップ9.4 における総体積が15μ l のサンプル。過大評価の HDL 粒子については分子量が 250 kDa、LDL 粒子には 3 MDa、miRNA 抽出工程では miRNA の 100% 回復 (分子量に対する脂質の寄与を無視すると、miRNA ストランド数のわずかなが得られます。リポタンパク質粒子)。
- ステップ10.2.1 からの miRNA ストランドの数を前のステップで計算された粒子の数で除算し、リポ蛋白質粒子あたりの miRNA ストランドの数を生成する。
- 測定されたサンプル cq値 (ステップ 9.5.2) を使用してサンプル容積あたりの miRNA ストランドの数を計算し、次の式 (MおよびBは特定の miRNA の較正曲線パラメータです)。
-
細胞
- ステップ10.2.1 に従ってサンプル容積ごとの miRNA ストランドの数を計算します。
- ステップ10.2.2 に従ってサンプル容積中の対応するセル数を計算し、ステップ6.4 で測定した初期セル数濃度から開始する。
- 10.3.1 からの miRNA ストランドの数を前のステップで計算したセルの数で除算して、セルあたりの miRNA ストランドの数を算出します。
- MiRNA/粒子比による陰性対照実験から得られた細胞のバックグラウンド miRNA レベルについて補正後の前工程から miRNA ストランドの総量を除してリポ蛋白質粒子の取込み速度を計算する (ステップ10.2.3) およびインキュベーション時間 (16 h、ステップ6.2 を参照)。
11. マルチウェルマイクロ流体アレイ
-
miRNA 抽出
- 手順7で説明したように miRNA 抽出を行う。
-
逆転写
- 逆転写プライマー、逆転写キット成分、MgCl2 (25 mM) を氷上で解凍します。8つのサンプルのために、8μ l の逆転写プライマー (10x)、2.25 μ l の dTTP (100 mM)、16.88 μ l の逆転写酵素 (50 U/μ l)、9.00 μ l の dNTPs の MgCl2、10.12 μ l の RNase 阻害剤 (20 U/μ l) を混ぜてください。、ヌクレアーゼフリー水の1μ l を有する。
- 軽く混合して簡単に遠心分離します。チューブ内の抽出された miRNA の3.5 μ l に4.3 μ l の逆転写反応混合液を加え、5分間氷の上で混ぜ合わせ、スピンダウンしてインキュベートします。チューブを thermocycler マシンに置き、次のプログラムを開始してください:16 ° c 2 分間、42° c 1 分間、50° c を1秒間、合計40倍に繰り返し、その後、ストップ反応として、85° c で5分間、停止するまで4° c でホールドした。
-
Preamplification
- 氷の上でプライマーを解凍し、一時的に反転し、遠心分離します。ボトルを旋回させることで、preamplification マスターミックス (2x) を混ぜます。8つのサンプルのための次の指示に従って preamplification の反作用の組合せを準備しなさい: preamplification のマスターの混合物 (2x) の112.5 μ l、preamplification のプライマーの22.5 μ l、およびヌクレアーゼ自由な水の67.5 μ l。一時的に反転して遠心分離します。
- ステップ11.2.2 からの逆転写反応生成物の2.5 μ l を前工程からの preamplification 反応混合物の22.5 μ l で混合し、一時的に遠心分離する。氷の上でサンプルを5分間インキュベートします。
- チューブを thermocycler マシンに置き、以下の設定でインキュベートします:10 分間の95° c での酵素の活性化、55° c での2分間のアニーリング、72° c での2分間の延長、繰り返し 12x:95 ° c の 15 s での変性、60° c での4分間のアニール/延長、10分間の99.9 ° c での酵素の不活性化、および4° c のホールド。
- スピンダウン、7.5 μ l の 1x TE (pH 8.0) と67.5 μ l のヌクレアーゼフリーの水を加え、転化し、簡単に遠心分離します。サンプルは1週間まで-20 ° c で貯えることができる。
-
qPCR
- ボトルを旋回させることでマスターミックスを混ぜます。1つのカードのための PCR の反作用の組合せを準備しなさい: 450 μ l のマスターの組合せ、441μ l のヌクレアーゼ自由な水、およびステップ11.3.4 からの preamplification のサンプルの9μ l。一時的に反転して遠心分離します。
- マルチウェルマイクロ流体アレイカードの各充填貯留部に、製造者の指示に従って調製した PCR 反応混合物の100μ l をロードし、3000 x gで1分2x 遠心分離する。2つの連続した遠心分離ステップの間の加速度は、カードを適切に充填するために重要である。製造元の指示に従って、カードを封印します。
- 以下のプログラムで PCR システムを使用してください:95 ° c で10分間酵素活性化し、その後、2倍に95° c で15秒間変性し、60° c で1分間アニーリング/延長します。
- PCR システムから結果ファイルをインポートし、システムのソフトウェアパッケージを使用して、次の分析設定で RQ 値を計算します: 最大許容 cq値40.0、計算に含まれる最大 cq値、および外れ値を除外した反復のうち。P値調整 (誤検出14の発生の修正) およびグローバル正規化 (すべてのサンプルの中央しきい値を使用) のオプションとして Benjamini –ホシュベルグ偽発見率を有効にします15)。
結果
リポタンパク質粒子分離の一般的なスキーム
図 1は、全血から始まるリポタンパク質粒子分離の一般的なスキームを示しており、逐次浮選超遠心よる16を使用する。所望であれば、VLDL および IDL 粒子のような他のリポタンパク質粒子画分は、このプロトコルの間に収穫することができる。ポリプロピレンのクイックシールの管を伴って固定角度のチタニウムの回転子は遠心分離の力に抗するために適している。チューブの崩壊を避けるために、チューブ内の気泡を避けることが重要です。遠心分離は4° c で行われ、タンパク質の分解を最小限に抑えます。3人の志願者のプールされた献血の血漿 (ドナーあたり 60-80 mL) から始まる通常、1-3 mg/mL の範囲の濃度を有する 3 mL の LDL および HDL 粒子溶液体積の収率が期待できる。献血から始まった全体の手順は、7日ほどかかりました。
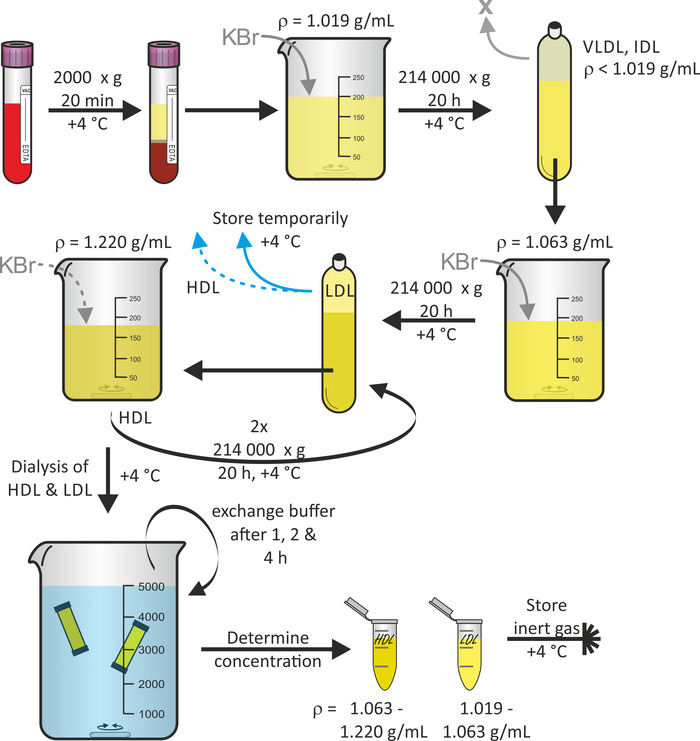
図 1:リポタンパク質単離のフローチャート。真空容器チューブ内の健康なボランティアから血液を遠心分離し、血漿 (上相) を収集します。Ρ = 1.019 g/ML の KBr を使用してその密度を調整した後、溶液を、4° c で20時間 214000 x gで遠心分離する。Ρ = 1.063 g/ML の KBr を使用して下フラクションの密度を調整した後、4° c で 20 h で 214000 x gで再度溶液を遠心分離する。LDL 粒子を含む上画分を4° c で一時保存する。KBr を用いてρ = 1.220 g/mL の下画分の密度を調整した後、4° c で20時間 214000 x gで溶液を2回遠心分離する。HDL 粒子を含有する上部分画を収集し、HDL および LDL 粒子溶液の両方を透析し、1、2、および4時間後に緩衝液を交換する。24時間後、タンパク質濃度を測定し、不活性ガスの下でサンプルを4° c で保存します。この図の大規模なバージョンを表示するには、ここをクリックしてください。
HDL 粒子の再構成
HDL 粒子の再構成は、以前にジョナス7によって公開されたプロトコルに従って実行しました。最初のステップは図 2aに示すように HDL 粒子の delipidation であり、続いて、図 2bに示されるように relipidation (すなわち再構成) の第2ステップが、miRNA とスペルミンの混合物に加えて脂質 PC、CO、および C を使用した。我々は、miR-223 が高含量を示し、miR-155 がリポタンパク質粒子17において稀であるため、ヒトの成熟 miR-223 および mir-155 を選択した。通常、両方のステップは2つの連続した日に実行されます。再構成中に、必要に応じて他の親油性および/または両親媒性の成分を加えることができる。PC、CO および C のエタノール/ジエチルエーテルおよびメタノール/クロロホルム溶媒の完全な蒸発が重要であった。最後のステップ-図 2cに示すように、遊離脂質/miRNA/洗剤から再構成された HDL 粒子 (rHDL) を分離する透析手順でした。これは、さらに1-2 日を要した。透析液に吸収性ビーズを添加すると、透析膜に沿った密度勾配が一定に保たれた。RHDL 粒子の収率は 50% であることが期待できる。
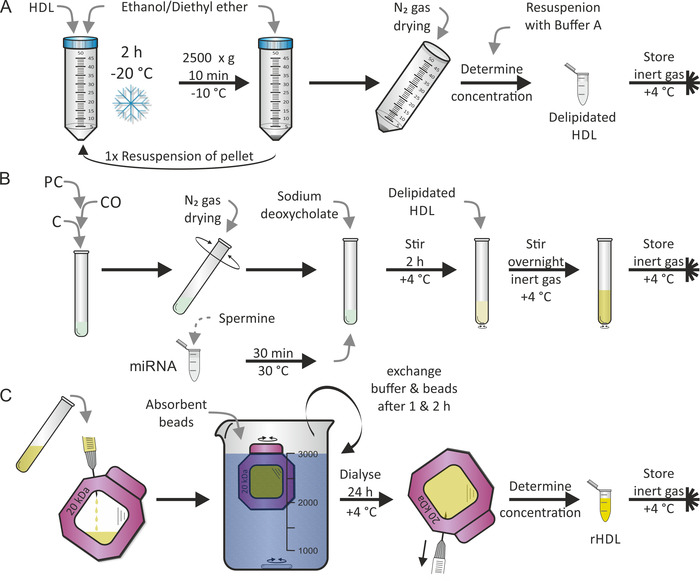
図 2:HDL 粒子再構成のフローチャート(A) DELIPIDATION: HDL 粒子溶液を脱エタノール/ジエチルエーテルと混合し、-20 ° c で2時間インキュベートします。上清を廃棄した後、ペレットを再懸濁し、手順を繰り返します。ペレットを N2 ガスで乾燥させ、バッファ A に再懸濁ます。濃度の判定後、delipidated HDL を4° c で不活性ガス雰囲気下に保存する。(B) 再構成: ホスファチジルコリン-コリン (PC)、コレステリルエステルオレイン酸 (CO)、およびコレステロール (C) を混合した後、チューブを回転させながら n2 ガスを用いて溶媒を蒸発させる。スペルミン溶液を用いて miRNA アリコートを30° c で30分間インキュベートし、デオキシコール酸ナトリウムと再懸濁の乾燥した脂質膜を加えます。サンプルを4° c で2時間撹拌し、delipidated HDL 溶液を加え、このサンプルを再度撹拌し、この時間を不活性ガス雰囲気下で4° c で一晩します。(C) 透析: 再構成された HDL (rHDL) 粒子を含むパネルBから透析膜チャンバー (分子量カットオフ:20 kDa) に溶液を移し、4° c で PBS および吸収性ビーズに対して透析する。1時間後および2時間後に緩衝液とビーズを交換する。24時間後に rHDL 粒子溶液を回収し、濃度を求め、4° c で不活性ガス雰囲気下で試料を保存する。この図の大規模なバージョンを表示するには、ここをクリックしてください。
LDL 粒子の標識
HDL 粒子について実証されたように miRNA を用いた LDL 粒子の標識 (図 3) は、ldl 粒子の主成分である apoB-100 タンパク質の疎水性のために実現可能ではなかった。DMSO は、LDL 粒子の脂質単層の浸透のために使用され、したがって、miRNA 会合を媒介した。全体の手順は 100% に近い収率で1-2 日を要した。
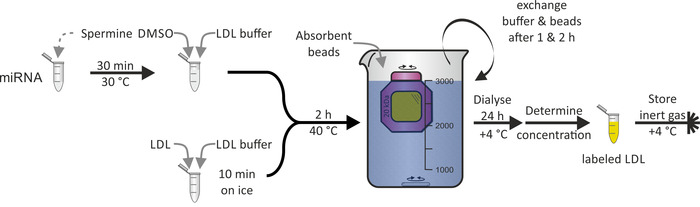
図 3:LDL 粒子標識のフローチャート。30° c で30分間スペルミン溶液で miRNA アリコートをインキュベートし、DMSO および LDL バッファーを追加します。氷の上の10分のための LDL のサンプルのウィットの LDL のバッファをインキュベートし、miRNA/スペルミン/DMSO 混合物を加える。40° c で2時間インキュベートした後、溶液を透析膜チャンバー (分子量カットオフ:20 kDa) に移し、PBS と透析を + 4 ° c で吸収します。交換バッファーおよびビーズ 1 & 2 時間後に標識された LDL 粒子溶液を24時間後に回収し、濃度を決定し、+ 4 ° c の不活性ガス雰囲気下で保存する。この図の大規模なバージョンを表示するには、ここをクリックしてください。
リポタンパク質粒子の品質管理
HS-AFM は、マイカ上のネイティブおよび再構成/標識されたリポタンパク質粒子のサイズおよび形状を調べるために使用することができる。使用する直前に、マイカは、清潔で平坦な表面を提供するために、(上部の層を除去するために粘着テープを使用して) 開裂しなければなりません。マイカ上の HDL/LDL 粒子をインキュベートする場合、希釈倍率 (および/またはインキュベーション時間) を調整して個々の粒子を観察する必要があります。クラスターでは、パーティクルの寸法を決定することはできません。HDL 粒子は、mica 上でモバイルです。HS-AFM の代わりに従来の AFM を使用する場合、その固定化プロトコルは、それに応じて (バッファー、表面コーティング)、側面の粒子移動性を低減するように適合させる必要があります。サンプルをスキャンしながら、撮像力は、粒子の任意の変形を避けるために、低 (タッピングモード) に保たれなければならない、これは測定値に影響を与えます。データ解析のために、粒子は、閾値アルゴリズムを介して検出された (例えば、Gwyddion:閾値による粒子 >) およびそれらの高さをマイカ表面に関して決定した。粒子の高さを測定することは、見かけの側面寸法が先端形状によって広げられるので、粒子サイズを決定する最も正確な方法です (図 4の例示的なイメージを参照)。粒子高さの確率密度関数 (pdf) は、様々なリポタンパク質粒子のサイズ分布の統計的評価および比較のために計算された。図 4に示すような天然および miRNA 標識の LDL 粒子の比較により、標識と nonlabeled (すなわち、天然) リポタンパク質粒子 (miRNA を添加せずに標識された LDL 粒子) の間の主な類似性を確認することが可能になりますスペルミン混合物は、標識法自体のコントロールとして示されている)。全体の手順は、約1日かかりました。
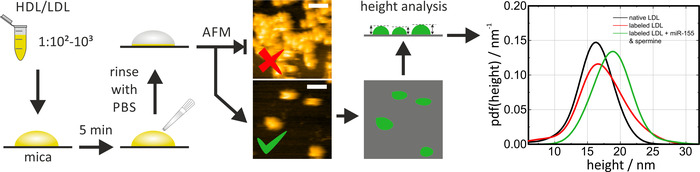
図 4: HS-AFM 測定のフローチャートと代表的な結果PBS (1:102-1:103) で HDL/LDL 粒子サンプルを希釈し、静電的で切断した後に5分間インキュベートし、PBS で慎重にすすぎ、遊離 (非吸着) 粒子を除去します。HS-AFM イメージングを実行し、表面の粒子密度を確認します。室温で PBS で測定を行う。この図の上の画像は、粒子密度が高すぎることを示しています。下の画像は解析に適しています。単一粒子の高さを、閾値化及びネイティブ (黒色曲線) および再構成/標識 (赤色及び緑色曲線) 粒子の後に分析し、統計的評価で比較した。スケールバー = 100 nm。この図は、Axmann et al.19から修正されている。この図の大規模なバージョンを表示するには、ここをクリックしてください。
miRNA 抽出、逆転写、および qPCR
ネイティブ/人工的に濃縮されたリポタンパク質または細胞サンプルからの miRNA の抽出は、図 5aに示すように miRNA 抽出キットを用いて行った。ここで、RNase フリーの環境が不可欠でした。このステップは、約1時間かかりました。抽出された miRNA サンプルの逆転写 (図 5b) は、製造業者によって記述される標準的な生化学的手順を用いて行った。この手順には約1.5 時間かかりました。最後に、最後のステップの間に得られた cDNA の量を、qPCR を用いて測定した (図 5c)。得られた cq値を絶対 mirna 鎖数に関連付けた標準曲線は、初期サンプルの絶対 mirna 含量を生じた。これは約2.5 時間かかりました。
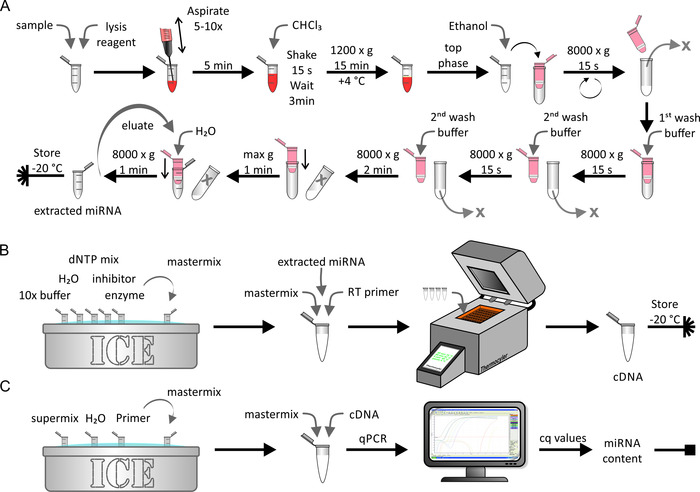
図 5: miRNA 抽出、逆転写、および qPCR のフローチャート。(A) miRNA 抽出: サンプルを溶解試薬で混合し、シリンジを使用して吸引で溶解します。5分間インキュベートし、CHCl3を追加します。15秒間激しく振り、3分間インキュベートします。4° c で15分間 1200 x gで遠心分離した後、トップ相を回収し、エタノールと混合する。溶液をスピンカラム (最大容量 < 700 μ l) に移し、15秒間 8000 x gに遠心分離します。溶離液を廃棄し、残りの溶液とともに最後のステップを繰り返します。最初の洗浄バッファを追加し、8000 x gで15秒間遠心分離を行います。溶離液を廃棄し、2回目の洗浄緩衝液を加え、15秒間に 8000 x gで遠心分離する。2分の遠心分離時間で最後のステップを繰り返します。さらに、最大速度で遠心分離で膜を1分間乾燥させます。 MiRNA を H2o で溶出し、8万 x gで1分間遠心分離します。抽出した miRNA サンプルを-20 ° c で保存します。(B) 逆転写:10 倍バッファー、H2o、dNTP ミックス、インヒビター、酵素を氷上で解凍し、マスターミックスを調製します。抽出された miRNA をパネルaからマスターミックスおよび逆転写プライマーに加え、thermocycler マシンを使用して逆転写を行います。CDNA サンプルは-20 ° c で保管してください。(C) qPCR: スーパーミックス、h2o、および氷上のプライマーを解凍し、マスターミックスを調製します。パネルBからの cDNA をマスターミックスに追加し、qPCR を実行します。データを分析して cq値を取得し、サンプルの絶対 miRNA 含有量を計算します (詳細については、図 6および代表的な結果を参照してください)。この図の大規模なバージョンを表示するには、ここをクリックしてください。
絶対 miRNA 含有量と転送速度
ネイティブおよび人工的に濃縮された HDL および LDL 粒子の絶対 miRNA 含有量を、図 6に示すようにサンプルの cq値およびそれぞれの miRNA の標準曲線から計算しました。図 6aは、解析ソフトウェアによって計算されたデータを示しています (アクティブ化DynamicTube 正規化(各サンプルトレースの2番目の導関数を使用した異なるバックグラウンドレベルの補正用) とノイズ勾配補正[ノイズレベルへの正規化])。標準曲線の cq値は、qPCR 装置で測定した規格化された蛍光信号に対するソフトウェアパッケージの自動検出閾値関数を用いて決定した。ここに、ソフトウェアは、標準曲線の適合度の R 値を最大化した。閾値レベルは、特定の miRNA サンプル分析ごとに一定に保たれた。続いて、miRNA ストランド数の関数として cq値をプロットし、回帰直線を算出した。サンプル cq値は、図 6bに示されたのと同じ閾値レベルで決定された。異なる qPCR 実行間の反応効率差は、各ランに含まれる1つの追加較正曲線サンプルを使用して、ソフトウェアによって自動的に補償されました。回帰直線の方程式を使用すると、サンプル中の miRNA の未知の量が計算される可能性があります。リポ蛋白質粒子数は初期タンパク質濃度とその平均分子量 (MWHDL 〜 250 kDa) から推定した。これにより、分子量に対する脂質寄与が仮定されなかった—したがって、リポ蛋白質粒子あたりの miRNA 鎖の数は、わずかに過大評価された。さらに、miRNA 抽出工程での miRNA の 100% の回収率を想定した。また、HDL 粒子とのインキュベーション前後の細胞の miRNA 含有量を測定し、miRNA 転写速度を図 6cに示すように算出した。
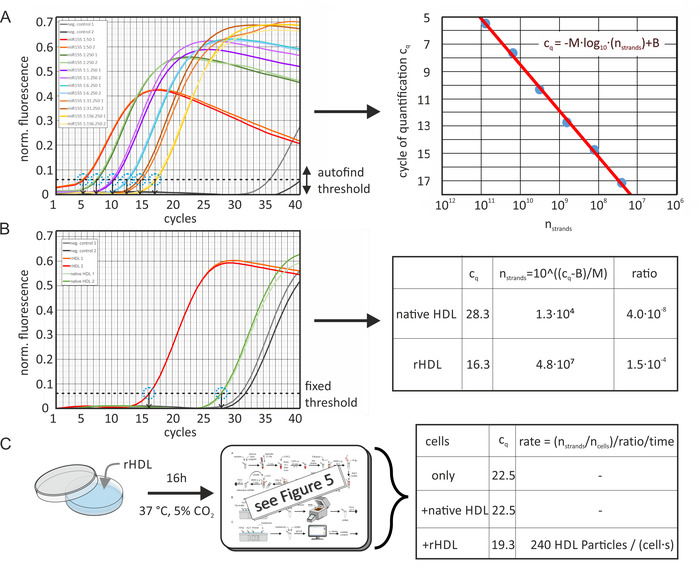
図 6: 絶対 miRNA 含有量と転写速度の計算のフローチャート(A) 155 のための標準曲線: アリコート (100 μ l、10μ m) を155、示されているように RNA フリー水で連続的に希釈した。qPCR は、ソフトウェアパッケージの自動検出閾値機能を使用して、各シリアル希釈サンプル (2 回測定) について cq値を得ました。陰性対照実験 (miRNA の添加なし) は、> 35 の cq値をもたらした。Cq値のデータ点は、サンプル体積当たりの miRNA ストランドの数 (初期濃度および連続希釈から計算される) の関数として、提示された式 (赤線、右画像) を装着し、 M =-3.36 とB = 42.12。測定された PCR 効率は0.98 であった。誤差バーは、実験の繰り返しの結果から計算され、データ点の円の直径よりも小さくなっています。(B) cqのネイティブ/人工的に濃縮された HDL 粒子の値を、パネルAで決定したのと同じ閾値レベルで測定し、qPCR サンプル量中の miRNA 鎖の数に換算した。元のサンプルの miRNA の絶対比は、サンプル体積中の HDL 粒子の数 (濃度) から計算した (3.2 x 1011粒子)。(C) 細胞試料 (細胞株 LDLA7 − SRBI) を、人工的に濃縮された HDL 粒子 (50 μ g/mL) で16時間インキュベートし、同様に分析した。決定された cq値は、細胞についてのみ22.5、22.5、および19.3、天然 HDL と共にインキュベートした細胞について、または rHDL 粒子溶液 (両方とも50μ g/mL) でインキュベートした細胞について、それぞれ示した。これらの値は、パネルBで行われるように miRNA ストランドの数に変換された。インキュベーション後の miRNA 鎖の数 (7.3 x 106) を、インキュベーション前の mirna 鎖の数の減算によって補正した (8.6 x 105)。結果を、サンプル体積の細胞数 (3100)、miRNA-粒子比 (1.5 x 10-4)、およびインキュベーション期間 (16 時間) で割った。これは、miRNA の取り込みを介してリポ蛋白粒子の伝達速度を生じさせる (240 HDL 粒子取り込みイベント/細胞と秒)。この図は、Axmann et al.19から修正されている。この図の大規模なバージョンを表示するには、ここをクリックしてください。
マルチウェルマイクロ流体アレイ
MiRNA 抽出のわずかな収率のために、抽出された miRNA の逆転写が続いて、preamplification 工程を経た。最後に、qPCR は、図 6に示すように、実施した。すべてのステップについて、製造業者によって説明されるように標準的な生化学的手順が用いられた。ここでは、マクロファージ18からのコレステロール流出に対する CRF の影響に関する研究のために募集された尿毒症患者の HDL 粒子に関するグローバル miRNA プロファイルの一部を示す。本研究では、HDL または血清中のコレステロール受容能力-他のものに加え、17人の若年成人尿毒症患者 (CKD ステージ 3-5) および関連疾患のない14人の若年成人透析患者と、一致対照を測定した。データを解析するために、デフォルト設定が使用されました (最大許容 CT 値: 40.0、計算での最大 CT 値を含む、反復間の外れ値の除外)。P値はBenjamini-ホシュベルグ偽発見率(誤検出の発生の補正) を使用して調整され、正規化方法として、全体の中で共通のアッセイを検出するグローバル正規化が正規化のためにそのメディアン CTを使用するサンプル。代表的な結果として、尿毒症患者の HDLs から分離した RQs のいくつかの Mirna が示されている (対照の RQs が 1)。明らかに、miR-122 および miR-224 は、尿毒症患者の HDLs において高度に発現している。この全体のステップは、約1日かかりました。
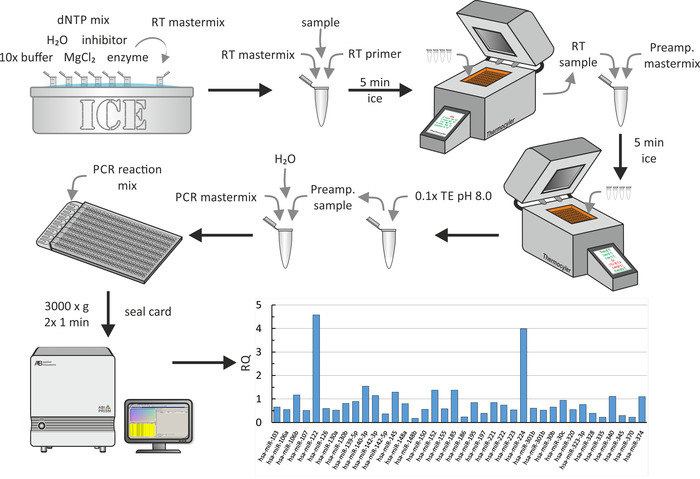
図 7: マルチウェルマイクロ流体アレイのフローチャートと代表的な結果図 5aに示すように mirna を抽出した後、mirna サンプルを逆転写プライマーおよび10倍バッファー、H2o、dNTPミックス、インヒビター、MgCl2、および酵素を含むマスターミックスと混合します。氷上で5分間インキュベートした後、thermocycler 機を用いて逆転写を行う。Preamplification マスターミックスを追加し、氷上で5分間インキュベートし、thermocycler 機を使用して preamplification を行います。0.1 x TE (pH 8.0) を追加し、アリコートと PCR マスターミックスと H2oを混合して、pcr 反応ミックスをマルチウェルマイクロ流体アレイの充填ポートに挿入し、3000 x gで1分間2回回転させる。PCR システムを用いて qPCR を実行し、RQ 値を得るためにデータを分析した (ここで、この図は、健常対照群18と比較して尿毒症患者の RQ 粒子についてこの値を示す)。 この図の大規模なバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、ヒト血液からのリポ蛋白質粒子画分の単離とそれらの個々の miRNA 含量の決定について、段階的に説明する。単離および合成された miRNA を処理しながら、RNase フリーの環境で作業することが重要であり、粒子組込み miRNA は、酵素分解から明らかに守られる。天然リポタンパク質粒子の miRNA/粒子比がかなり低くなるにつれ、細胞のホロ粒子取り込みを研究するために miRNA による人工的な濃縮が必要となる。これにより、前述の7のような HDL 粒子の再構成が、miRNA ストランドを組み込むように修飾される。さらに、この手順の間の脂質およびタンパク質フラクションの分離は、科学者がリポ蛋白質粒子19の脂質およびタンパク質関連成分を調べることを可能にする。同様の方法で、LDL 粒子の標識手順が適合される。興味深いことに、スペルミンの添加 (ヌクレオチドの自然な安定剤) は、miRNA/粒子比に影響を与えませんでした。原理的には、この方法は、リポタンパク質粒子内の miRNA 以外の他の物質の infolding を可能にすることに留意すべきである。もちろん、HDL (直径: 5-12 nm) と LDL 粒子 (直径: 18-25 nm) の全体的なサイズに基づいて物質の物理的サイズに関して制限がある。
再構成/標識リポタンパク質粒子の品質管理に関して、HS − AFM は、単一の粒子レベルで HDL/LDL 粒子を特徴付けるのに適用可能な方法である。EM と比較して、それはより短い準備時間および近い生理学的な条件 (ぬれた、室温) を可能にする。
固有の感度と増幅により、qPCR は低 miRNA 濃度を検出するための選択方法です。あるいは、単一分子感受性蛍光顕微鏡は、個々の分子をも検出することができ、例えば、粒子当たりの蛍光標識された miRNA ストランドの低濃度のためには適さないであろう。したがって、天然リポタンパク質粒子当たりの miRNA 鎖の比は、10− 8であることが見出された。人工的な濃縮は、1万の係数によって比を増加させ、これは細胞リポタンパク質取り込み速度の推定を容易にする (天然のリポタンパク質粒子19を使用して有意な差は検出されない)。QPCR の高感度により、インキュベーション時間と miRNA/粒子比の後の miRNA 鎖の数を測定することでこの取込み速度を決定することができます。計算された値は、細胞の劣化および miRNA の放出を無視し、従って、リポタンパク質粒子取り込み比について少なくとも下限を表すことに留意すべきである。
将来的には、この方法は、医薬物質 (特に親油性のもの) を細胞内に移し、それらの生物学的効果と細胞内濃度を相関させることができる (リポ蛋白質粒子の取り込み速度によって決まる)。
開示事項
作者は何も開示することはありません。
謝辞
この作品は、オーストリア科学基金プロジェクト P29110 ・ B21、「Hochschuljubiläumsstiftung ・デア・シュタット・ウィーン zur Förderung ・デア・ Wissenschaft」プロジェクト H-3065/2011、欧州地域開発基金 (EFRE、IWB2020)、連邦国家オーストリア、そして「陸 OÖ Basisfinanzierung」。
資料
| Name | Company | Catalog Number | Comments |
| Ultracentrifuge | Beckman | Optima L-100 XP | Lipoprotein isolation |
| Ultracentrifuge rotor | Beckman | TI 55.2 | Lipoprotein isolation |
| Vacutainer (EDTA) | Becton Dickinson | 366643 | Lipoprotein isolation |
| Kaliumbromid | Sigma Aldrich | 2110 | Lipoprotein isolation |
| Ultracentrifuge tubes | Beckman | 342414 | Lipoprotein isolation |
| Ultracentrifuge tube sealer | Beckman | 342428 | Lipoprotein isolation |
| Sodiumchlorid | Carl Roth GmbH | P029.2 | Lipoprotein isolation |
| EDTA | Fisher Scientific | D/0650/50 | Lipoprotein isolation |
| Dialysis tubes, MWCO 12 - 14k | Spectra | 132700 | Lipoprotein isolation |
| synthetic miRNA | microSynth | - | synthetic miRNA |
| TRIS buffer pH 7 | Ambion | AM9850G | synthetic miRNA |
| TRIS buffer pH 8 | Ambion | AM9855G | synthetic miRNA |
| sterile tubes | Carl Roth GmbH | ENE8.1 | synthetic miRNA |
| Photometer | Eppendorf | Eppendorf Biophotometer | Bradford assay |
| Cuvette | Carl Roth GmbH | XK20 | Bradford assay |
| Coomassie G-250 Stain | BioRad GmbH | 161-0786 | Bradford assay |
| Sodiumchlorid | Carl Roth GmbH | 3957.1 | Delipitation |
| EDTA | Fluka Analytical | 03690-100ML | Delipitation |
| TRIS buffer pH 8.0 | Ambion | AM9855G | Delipitation |
| Ethanol 100% | AustrAlco | Ethanol Absolut 99.9% | Delipitation |
| Diethyl ether | Carl Roth GmbH | 3942.1 | Delipitation |
| Centrifuge | Thermo Scientific | Multifuge X3R | Delipitation |
| Chloroform | Carl Roth GmbH | 3313.1 | Reconstitution |
| Methanol | Carl Roth GmbH | 4627.1 | Reconstitution |
| Phosphatidylcholine | Sigma Aldrich GmbH | P3556-25mg | Reconstitution |
| Cholesterol oleate | Sigma Aldrich GmbH | C-9253-250mg | Reconstitution |
| cholesterol | Sigma Aldrich GmbH | C8667-500mg | Reconstitution |
| glass tubes | Carl Roth GmbH | K226.1 | Reconstitution |
| spermine | Sigma Aldrich GmbH | S3256-1G | Reconstitution |
| Thermomixer | Eppendorf | Thermomixer comfort | Reconstitution |
| Sodium deoxycholate | Sigma Aldrich GmbH | 3097-25G | Reconstitution |
| Magnetic stir bar | Carl Roth GmbH | 0955.2 | Reconstitution |
| 100µL micropipettes | Carl Roth GmbH | A762.1 | Reconstitution |
| PBS | Carl Roth GmbH | 9143.2 | Dialysis |
| Amberlite XAD-2 beads | Sigma Aldrich GmbH | 10357 | Dialysis |
| Slide-A-Lyzer casette (cut-off 20 kDa) | Thermo Scientific | 66003 | Dialysis |
| Syringe | Braun | 9161406V | Dialysis |
| Syringe needle | Braun | 465 76 83 | Dialysis |
| EGTA | Carl Roth GmbH | 3054.2 | Labeling of LDL particles |
| DMSO | life technologies | D12345 | Labeling of LDL particles |
| Atomic Force Microscope | RIBM | SS-NEX | Quality control of reconstituted/labeled lipoprotein particles |
| Muscovite Mica (V-1 Grade) | Christine Gröpl | G250-1/V1 | Quality control of reconstituted/labeled lipoprotein particles |
| AFM Cantilever | Nanoworld | USC-F1.2-k0.15 | Quality control of reconstituted/labeled lipoprotein particles |
| Gwyddion 2.49 | Czech Metrology Institute | http://gwyddion.net | Quality control of reconstituted/labeled lipoprotein particles |
| Chamber slides, Nunc Lab-Tek | VWR | 734-2122 | Cell culture |
| HBSS | Carl Roth GmbH | 9117.1 | Cell culture |
| Cell counter | Omni Life Science GmbH | Casy | Cell culture |
| miRNeasy Mini Kit | QIAGEN | 217004 | miRNA extraction |
| Centrifuge | Eppendorf | 5415R | miRNA extraction |
| 20G needle | Braun | Sterican 465 75 19 | miRNA extraction |
| 5ml syringe | Becton Dickinson | 309050 | miRNA extraction |
| PCR cabinet | Esco | PCR-3A1 | Reverse Transcription |
| TaqMan Reverse Transcription Kit | Thermo Scientific | 4366596 | Reverse Transcription |
| Rnase-free water | Carl Roth GmbH | T143 | Reverse Transcription |
| 0.2 ml tubes | Brand | 781305 | Reverse Transcription |
| Centrifuge | Carl Roth GmbH | Microcentrifuge AL | Reverse Transcription |
| Thermocycler | Sensoquest | Labcycler | Reverse Transcription |
| TaqMan Primer | Thermo Scientific | - | qPCR |
| iTaq Universal probe supermix | BioRad GmbH | 1725131 | qPCR |
| PCR machine | Corbett | Rotor-Gene RG-6000 | qPCR |
| TaqMan MicroRNA Reverse Transcription Kit | Applied Biosystems | 4366596 | TaqMan Array |
| Megaplex RT Primers, Human Pool A v2.1 | Applied Biosystems | 4399966 | TaqMan Array |
| TaqMan PreAmp Master Mix | Applied Biosystems | 4391128 | TaqMan Array |
| Megaplex PreAmp Primers, Human Pool A v2.1 | Applied Biosystems | 4399933 | TaqMan Array |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | TaqMan Array |
| TaqMan Advanced miRNA Human A Cards | Applied Biosystems | A31805 | TaqMan Array |
| Nuclease-free water | Thermo Scientific | R0581 | TaqMan Array |
| MgCl2 (25mM) | Thermo Scientific | R0971 | TaqMan Array |
| TE, pH 8.0 | Invitrogen | AM9849 | TaqMan Array |
| 7900HT Fast Real-Time PCR System | Applied Biosystems | 4351405 | TaqMan Array |
| TaqMan Array Card Sealer | Applied Biosystems | - | TaqMan Array |
参考文献
- Vickers, K. C., Palmisano, B. T., Shoucri, B. M., Shamburek, R. D., Remaley, A. T. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nature Cell Biology. 13 (4), 423-435 (2011).
- Tabet, F., et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nature Communications. 5, (2014).
- Wahid, F., Shehzad, A., Khan, T., Kim, Y. Y. MicroRNAs: Synthesis, mechanism, function, and recent clinical trials. Biochimica et Biophysica Acta - Molecular Cell Research. 1803 (11), 1231-1243 (2010).
- Carthew, R. W., Sontheimer, E. J. Origins and Mechanisms of miRNAs and siRNAs. Cell. 136 (4), 642-655 (2009).
- Fabian, M. R., Sonenberg, N., Filipowicz, W. Regulation of mRNA Translation and Stability by microRNAs. Annual Review of Biochemistry. 79 (1), 351-379 (2010).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: Are the answers in sight?. Nature Reviews Genetics. 9 (2), 102-114 (2008).
- Jonas, A. Reconstitution of High-Density Lipoproteins. Methods in Enzymology. , 553-582 (1986).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Bustin, S. A., et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Patsch, J. R., Patsch, W. Zonal ultracentrifugation. Methods in Enzymology. 129 (1966), 3-26 (1986).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Yamamoto, D., et al. High-Speed Atomic Force Microscopy Techniques for Observing Dynamic Biomolecular Processes. Methods in Enzymology. 475, 541-564 (2010).
- Stangl, H., Cao, G., Wyne, K. L., Hobbs, H. H. Scavenger receptor, class B, type I-dependent stimulation of cholesterol esterification by high density lipoproteins, low density lipoproteins, and nonlipoprotein cholesterol. Journal of Biological Chemistry. 273 (47), 31002-31008 (1998).
- Hochberg, B. Controlling the False Discovery Rate: a Practical and Powerful Approach to Multiple Testing. Journal of the Royal Statistical Society. 57 (1), 289-300 (1995).
- Mestdagh, P., et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biology. 10 (6), (2009).
- Schumaker, V. N., Puppione, D. L. 6] Sequential Flotation Ultracentrifugation. Methods in Enzymology. 128 (C), 155-170 (1986).
- Wagner, J., et al. Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1392-1400 (2013).
- Meier, S. M., et al. Effect of chronic kidney disease on macrophage cholesterol efflux. Life Sciences. 136, 1-6 (2015).
- Axmann, M., et al. Serum and Lipoprotein Particle miRNA Profile in Uremia Patients. Genes. 9 (11), 533 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved