Method Article
העשרה של ליפופרוטאין חלקיקים מקומיים עם מיקרואורנה והקביעה הבאה של התוכן המוחלט שלהם/מיקרוליאורנה וקצב העברת הסלולר שלהם
In This Article
Summary
כאן, פרוטוקול כמותי בזמן אמת מבוסס על תגובת שרשרת פולימראז מוצגת לצורך קביעת התוכן המקורי מיקרו-RNA (מוחלט/יחסי) של חלקיקים ליפופרוטאין. בנוסף, שיטה להגברת רמת מיקרו RNA, כמו גם שיטה לקביעת שיעור ספיגת הסלולר של חלקיקים ליפופרוטאין, מומחש.
Abstract
חלקיקי ליפופרוטאין הם מובילים ברובם של שומנים וכולסטרול במחזור הדם. יתר על כן, הם מכילים כמויות קטנות של קווצות שאינן מצפינה מיקרוקוד (miRNA). באופן כללי, miRNA משנה את פרופיל ביטוי החלבון עקב אינטראקציות עם messenger-RNA (mRNA). כך, הידע של התוכן הקרוב והמוחלט miRNA של חלקיקים ליפופרוטאין הוא חיוני כדי להעריך את ההשפעה הביולוגית של ספיגת חלקיקים סלולריים. כאן, תגובת שרשרת פולימראז כמותיים בזמן אמת (qPCR) הפרוטוקול מוצג כדי לקבוע את התוכן המוחלט miRNA של ליפופרוטאין חלקיקים — לדוגמה הראו מקורי ו-miRNA-מועשר ליפופרוטאין חלקיקים. התוכן היחסי של miRNA מכמת באמצעות כרטיסי מערך מיקרופלואידיג multiflu, יתר על כן, פרוטוקול זה מאפשר למדענים להעריך את miRNA הסלולר, ולכן, ליפופרוטאין שיעור ספיגת חלקיקים. גידול משמעותי של רמת miRNA הסלולר הוא הנצפה בעת שימוש ליפופרוטאין בצפיפות גבוהה (HDL) חלקיקים טעון באופן מלאכותי עם miRNA, בעוד דגירה עם חלקיקי HDL מקורי התשואות אין השפעה משמעותית בשל התוכן הנמוך שלהם miRNA נמוכה. לעומת זאת, הקליטה התאית של חלקיקי ה-LDL בעלי צפיפות נמוכה, לא משנה את רמת miRNA הסלולרית.
Introduction
חלקיקי ליפופרוטאין מורכבים ממונאולייר של שומנים וכולסטרול אמפיפילי מתוחם ליבה של cholesteryl אסטרים ושומנים טריגליצרידים. החלקיק כולו מיוצב על ידי ממברנה מוטבע, המגדיר את הפונקציונליות הביולוגית של החלקיקים. ליפופרוטאין חלקיקים יכול להיות מכובד על פי הצפיפות ההולכת וגוברת שלהם, ולכן, גודל יורדת, כלומר כמו ליפופרוטאין בצפיפות נמוכה מאוד (VLDL), ליפופרוטאין בצפיפות בינונית (IDL), LDL, ו-HDL. למרות התחבורה של מרכיבים מבוססי מים במחזור הדם, זה הוכיח כי חלקיקי HDL לשאת קווצות שאינן קידוד של mirna1,2. מיקרו rnas הם מחלקה של קצר (בדרך כלל שני תריסרים של נוקלאוטידים) גדילי רנ א, אשר לבזות intracellularly משלימים סיבי mrna, ובכך, לשנות את פרופיל הביטוי של חלבונים מסוימים3,4,5, . שישה מטרים יתר על כן, שינויים של פרופיל miRNA נמצאו במגוון של מחלות, ולכן, הפרופיל הוא ישים כסמנים ביונקר לאבחון ופרוגנוזה. התחבורה החילוץ של miRNAs בין תאים באמצעות ליפופרוטאין חלקיקים עשוי לשמש מנגנון נוסף עבור אפנון רמת mRNA ברמה הבין-תאית. כדי לאמוד את ההשפעה הביולוגית, הידע לגבי התוכן המוחלט והיחסי של מירופרוטאין הינו צורך.
PCR כמותי בזמן אמת היא שיטה מתאימה ומהירה יחסית להשגת מידע זה. לפיכך, ערך הקוונפיקציה היחסי (RQ) ניתן לחישוב, והבדלים יחסיים בין דגימות שונות ליפופרוטאין שברים מעריכים. כרטיסי מערך מיקרופלואידיג multiflu, הם שיטה מהירה וקלה לשימוש כדי לקבוע את הנוכחות היחסית (משווה לערך ה-RQ) של miRNAs במדגם. כרטיסי מערך multifluאידיג מורכבים של 96 או 384 חדרי התגובה הבודדים של התגובות qPCR בודדים מוטבע במכשיר microfluidic. כל תא מכיל את המחקר ההידרוליזה הנדרש ומדויק qPCR התחל עבור מירנה יחיד. היתרונות הם זמן הטיפול הקצר עקב סטנדרטיזציה, זרימת עבודה פשוטה, ומספר מופחת של שלבי פיליטוף. יתר על כן, נפח המדגם הנדרש הוא ממוזער. בניגוד לקוונפיקציה יחסית, התוכן miRNA המוחלט דורש השוואה של תוצאות לדוגמה qPCR עם עקומות סטנדרטיות של מספרים מוחלטים הידוע של קווצות miRNA. יש לציין כי, בשל התוכן הנמוך יחסית miRNA שלהם, סטנדרטי, יתר על כן, אפילו מולקולה אחת ושיטות הדמיה רגיש לא ריאלי – העשרה מלאכותית של חלקיקים ליפופרוטאין עם miRNA הוא בלתי נמנע ללמוד סלולרי ליפופרוטאין אינטראקציה חלקיקים ו miRNA העברה. לגבי זה, מדליזציה של חלקיק ה-HDL ואחריו עם משוב הבאים7 מאפשר התאגדות של, ובכך, העשרה עם קווצות mirna. העשרה דומים של חלקיקי LDL עם miRNA לא ניתן בשל הידרופוטביניטי של חלבון apoB-100, שהוא המרכיבים העיקריים של החלקיקים LDL. עם זאת, על ידי תוספת של הממס diמתיל סולפוקסיד (DMSO), אשר מסוגל לחדור ממברנות השומנים, חלקיקי LDL ניתן לטעון באופן מלאכותי עם קווצות miRNA גם.
מיקרוסקופ כוח אטומי במהירות גבוהה (HS-AFM) הוא כלי רב עוצמה לאפיון של דגימות ביולוגיות המציעות מרחבית תת-שנייה וברזולוציה של הזמן השני8. מכאן, היא טכניקה מתאים היטב עבור בקרת איכות של חלקיקים שונה ליפופרוטאין כמו יליד/reconstituted/התווית חלקיקים ליפופרוטאין ניתן לדימות תחת סביבה כמעט פיסיולוגיים.
כאן, פרוטוקול qPCR מוצג צעד אחר צעד כדי לקבוע את התוכן המוחלט/יחסי miRNA של ליפופרוטאין חלקיקים ודגימות תאים, אשר מאפשר הערכה של שיעור ספיגת חלקיקים ליפופרוטאין הסלולר. יתר על כן, שיטה להעשרה של חלקיקים ליפופרוטאין עם miRNA מומחש. שיטה זו עשויה להיות מותאמת עבור מניפולציה כללית של תוכן ליפופרוטאין, ומכאן, מדגים את תחולתן של חלקיקים ליפופרוטאין כמטרות לאספקת סמים.
Protocol
תרומות דם אושרו על ידי ועדת האתיקה, האוניברסיטה הרפואית של וינה (EK-Nr. 511/2007, EK-Nr. 1414/2016). המינוח הוא על פי המידע המינימלי לפרסום כמותי (מקווע)9 הנחיות בזמן אמת.
1. ליפופרוטאין בידוד חלקיקים מהדם האנושי
- הultracentrifuge מראש עד 4 ° c. למשוך דם ממתנדבים בריאים לאחר לילה צום.
הערה: נדרש בדרך כלל שלושה תורמים, תרומת 80 mL כל אחד, ו צינורות איסוף דם המכיל את חומצת החומץ (EDTA) כנוגד קרישה. - צנטריפוגה ב 2,000 x g עבור 20 דקות ב 4 ° c והקציר פלזמה (השלב העליון); למנוע הטיית כוחות. קבע את העוצמה הכוללת V והתאם, במידת הצורך, לכפולה של אמצעי האחסון הצנטריפוגה באמצעות תמיסת מלח מוזרמת פוספט (PBS). למדוד את המסה של 1 mL 3x ולחשב את הצפיפות הממוצעת ρ.
- לחשב את הכמות הנדרשת של אשלגן ברומיד (KBr) עבור התאמת צפיפות עם המשוואה הבאה10 (עבור הצפיפות הרצויה של גרם/מיליליטר, להשתמש = 1.019, ועבור הנפח הספציפי של kbr, השתמש
 = 0.364 mL/g). הוסף KBr לפלזמה ומערבבים בעדינות כדי למנוע הטיית כוחות עד KBr הוא התפרקה לחלוטין.
= 0.364 mL/g). הוסף KBr לפלזמה ומערבבים בעדינות כדי למנוע הטיית כוחות עד KBr הוא התפרקה לחלוטין.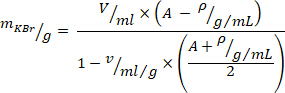
- למדוד את הצפיפות כפי שמתואר בשלב 1.2 ולהתאים שוב, במידת הצורך, על ידי הוספת KBr נוספים. מילוי ואטימה של צינורות צנטריפוגה מתאים לחיבור פלזמה. להימנע בועות אוויר; אחרת, הצינורית עלולה להתמוטט. מניחים את הצינורות ברוטור על פי הוראות היצרן ואת צנטריפוגה ב 214,000 x g עבור 20 h ב 4 ° c.
- פתח את הצינורות לפי הוראות היצרן ולמחוק את השלב העליון המכיל את VLDL ו-IDL. קבע את העוצמה הכוללת V והתאם, במידת הצורך, לכפולה של אמצעי האחסון צנטריפוגה tube באמצעות PBS.
- קבע את הצפיפות ρ של השבר התחתון. חישוב הכמות הנדרשת של KBr להתאמת צפיפות ( השתמש ב = 1.063). מערבבים בעדינות כדי למנוע הטיית כוחות עד KBr מומס. חזור על שלב 1.4.
- הסר ואסוף את השלב העליון המכיל חלקיקי LDL. אחסן את התמיסה של ה-LDL באווירת גז אינרטי ב -4 ° c. קבע את העוצמה הכוללת V והתאם, במידת הצורך, לכפולה של אמצעי האחסון צנטריפוגה tube באמצעות PBS. לקבוע את צפיפות ρ של השבר התחתון כפי שמתואר בשלב 1.2.
- חישוב הכמות הנדרשת של KBr להתאמת צפיפות ( השתמש ב-= 1.220) והוסף אותו. מערבבים בעדינות כדי למנוע הטיית כוחות עד KBr מומס. חזור על שלב 1.4.
- הסר ואסוף את השלב העליון המכיל חלקיקי HDL. קבע את הנפח הכולל שלו V והתאם, במידת הצורך, לכפולה של אמצעי האחסון צנטריפוגה tube באמצעות PBS. קבע את הצפיפות ρ. צעד צנטריפוגה שני של השלב העליון ב 214,000 x g עבור 20 h ב 4 ° c מומלץ להסיר אלבומין. במקרה הצורך, חזור על שלב 1.8. הסר ואסוף את השלב העליון המכיל חלקיקי HDL.
- היכונו ומצננים לפחות 20 L של מאגר דיאליזה (0.9% הנאל, 0.1% EDTA [pH 7.4]) עד 4 ° c. צינורות דיאליזה מפרתיים (משקל מולקולרי לגזור: 12 – 14 kDa) ולהוסיף את הפתרון LDL ו-HDL על פי הוראות היצרן. Dialyze נגד 5 L של מאגר דיאליזה ב 4 ° c ולשנות את המאגר אחרי 1, 2, ו 4 h.
- לאחר 24 שעות, לשחזר את הפתרונות ליפופרוטאין חלקיקים מצינורות דיאליזה ולקבוע את ריכוז החלבון באמצעות שיטת ברדפורד11 או אחרת אחד המתאים. אחסן את ה-HDL ואת פתרונות החלקיקים LDL תחת אווירת גז אינרטי ב -4 ° c.
2. מרקם סינתטי
הערה: כאשר מטפלים ברנ א oligonucleotides, לעבוד RNase-חינם. לעבוד רק עם טרי, מתכלים פלסטיק חד פעמי תמיד ללבוש כפפות, אשר יש לשנות לעתים קרובות. השתמש רק בפתרונות ללא חכירה. . תמיד לעבוד על קרח
- לסובב את המבחנה רכשה מן היצרן בכוח מירבי כדי ליצור גלולה של הלינוהסינתטי miRNA. הוסף נפח מתאים של הידרוקסימתיל (TRIS) מאגר, pH 7.5, עבור ריכוז סופי של 10 μM (ריכוז במלאי) miRNA.
- בעדינות למעלה ולמטה. כמה פעמים להשעיה הכינו את הליבטים של 100 μL כל אחד בצינורות סטריליים. אחסן אותם ב-20 ° c אם לא נעשה בהם שימוש מיידי. . הימנע מלהפשיר ולקפוא
3. החוקה של חלקיקי ה-HDL
-
מדליזציה
- הכן מאגר A (150 מ"מ היאl, 0.01% EDTA, 10 מ"מ מ טריס/HCl [pH 8.0]). לצנן את הצנטריפוגה ל -10 ° c. Precool 100 mL של תערובת של אתנול: diethyl אתר (3:2) ב-20 ° c.
התראה: ללבוש ציוד הגנה אישי מתאים ולעבוד בתוך מכסה המנוע בזמן טיפול דיאתיל האתר כפי שהוא דליק מאוד ומזיק לעור. - מערבבים אמצעי אחסון המתאים ל 5 מ ג חלקיקי HDL עם 50 mL של אתנול טרום מקורר: diethyl אתר (3:2) תערובת ו דגירה עבור 2 h ב-20 ° c. צנטריפוגה ב 2,500 x g עבור 10 דקות ב-10 ° c.
- להיפטר supernatant, להשעות מחדש את הגלולה ב 50 mL של אתנול טרום מקורר: diethyl אתר תערובת ידי vortexing, ו דגירה פעם שנייה עבור 2 h ב-20 ° c. צנטריפוגה שוב ב 2,500 x g עבור 10 דקות ב-10 ° c.
הערה: במקרה הצורך, ליאופנט את סופרנטאנט לניתוח של תוכן miRNA בחלק השומנים של חלקיקי ה-HDL. - יבש את הגלולה מתחת לזרימת גז2 N והשהה אותו מחדש ב-250 μl של מאגר A (ראה שלב 3.1.1). לקבוע את ריכוז החלבון באמצעות שיטת ברדפורד חלבון או אחר אחד מתאים ולדלל את הריכוז הסופי של 1 מ"ג חלבון/250 μL של מאגר A.
הערה: ניתן להשהות את הפרוטוקול כאן. אחסן את הפתרון בין לילה ב -4 ° c תחת אווירת גז אינרטי.
- הכן מאגר A (150 מ"מ היאl, 0.01% EDTA, 10 מ"מ מ טריס/HCl [pH 8.0]). לצנן את הצנטריפוגה ל -10 ° c. Precool 100 mL של תערובת של אתנול: diethyl אתר (3:2) ב-20 ° c.
-
צטנפות
- הכינו פתרון מניות של זרחן (PC) באמצעות תערובת של כלורופורם: מתנול (2:1) בריכוז של 5.6 מ"ג מ-PC/mL. באופן דומה, להכין פתרונות מניות של cholesteryl אולאט (5 מ"ג של CO/ml) וכולסטרול (5 מ ג של C/ml). אחסן את כל הפתרונות ב-20 ° c.
- בצינור זכוכית נקייה, לערבב 500 μL של PC, 100 μL של CO, ו 13.5 μL של C. אמצעי אחסון אלה מקבילים ליחס טוחנת משוער של 100 PC: 22 שיתוף: 4.8 C. יבש את התערובת מתחת לזרימת הגז N2 תוך כדי סיבוב הצינור כדי להניב שכבת משטח הומוגנית.
הערה: ניתן להשהות את הפרוטוקול כאן. לאחסן את בקבוקון זכוכית (אם תרצה, לאגור אפשרי) תחת אווירת גז אינרטי ב-20 ° c. - הכינו פתרון טרי 30 מ"מ משלי במאגר a. מערבבים אחד סדרת מחלקים (100 μl, 10 μm) של mirna סינתטי (ראה שלב 2.2) עם 100 μl של פתרון ספרמינה ו דגירה עבור 30 דקות ב 30 ° c.
הערה: עבור ניסויים בשליטה שלילית, החלף את הפתרון miRNA ו/או מוקש באותו נפח של מאגר A. - לפזר מחשב/CO/C מערבבים מאסטר בתערובת משלב 3.2.3.
- הכינו פתרון של 30 מ"ג/mL של נתרן deoxycholate במאגר A ולהוסיף 50 μL אל הפתרון משלב 3.2.4. מערבבים ב -4 ° c עבור 2 h.
- הוסף 250 μL של פתרון HDL מדליק משלב 3.1.4. אמצעי אחסון זה מקביל ליחס טוחנת משוער של 100 PC: 22 ושות: 4.8 C:1 החלבונים HDL. מערבבים ב -4 ° c בלילה.
-
דיאליזה
- מגניב לפחות 15 L של PBS ב 4 ° c. הוסף 50 גרם של חרוזי adsorbent כדי 800 mL של מים כפולים מזוקקים (ddH2O) ולערבב עבור 1 דקות. לחכות 15 דקות, לדון את הסופרנט, ולחזור על ההליך עם PBS.
- קלטות דיאליזה מפרבשות (משקל מולקולרי לגזור: 20 kDa) או צינורות דיאליזה מתאימים ולהוסיף את הפתרון משלב 3.2.6, באמצעות מזרק על פי הוראות היצרן.
- הוסיפו את החרוזים המכופפים משלב 3.3.1 עד 3 ל-PBS ו-dialyze ב -4 ° c. לשנות את המאגר ואת החרוזים אחרי 1 h ו 2 שעות.
- לאחר 24 שעות, לשחזר את הפתרון החלקיקים HDL (rHDL) ולקבוע את ריכוז החלבון באמצעות שיטת ברדפורד. אחסן את פתרון החלקיקים rHDL תחת אווירת גז אדיש ב-4 ° c.
4. תוויות של חלקיקי LDL
- הכנת מאגר LDL בגודל 10x (1.5 M, 3 מ"מ EDTA, 1 מ"מ אתילן גליקול-bis (β-עמינח האתר)-N, N, N '-חומצה טטראצטט [EGTA, pH 7.4]) ולאחסן אותו בטמפרטורת החדר.
- הכינו פתרון טרי של 30 מ"מ במים בחינם RNase. מערבבים סדרת מחלקים (100 μl, 10 μm) של mirna סינתטי (ראה שלב 2.2) עם 100 μl של פתרון ספרמינה ו דגירה עבור 30 דקות ב 30 ° c.
הערה: עבור ניסויים בשליטה שלילית, החלף את הפתרון miRNA ו/או את התמיסה הספרמינה בעלת אותו הנפח של מאגר LDL של 1x. - הוסף 100 μL של DMSO לפתרון miRNA/ספרמינה משלב 4.2 ולדלל אותו עוד יותר עם 1.2 mL של מאגר LDL 1x.
- לדלל את הפתרון החלקיקים LDL לריכוז הסופי של כ 4 מ"ג/mL עם PBS ולערבב 450 μL עם 50 μL של מאגר LDL 10x. מודקון את זה במשך 10 דקות על הקרח.
- לשלב את הפתרון החלקיקים LDL מהשלב הקודם והפתרון miRNA/spermine וקש/DMSO (משלב 4.3) ו מודטה אותו עבור 2 h ב 40 ° c.
- לבצע דיאליזה דומה כמתואר בסעיף 3.3 ולאחסן את הפתרון המסומן חלקיקי LDL בהתאם.
5. בקרת איכות של חלקיקים ליפופרוטאין בעלי התווית
הערה: עבור בקרת איכות, הקוטר והצורה הכללית של ליפופרוטאין חלקיקים ניתן לקבוע באמצעות, למשל, AFM או אלקטרון מיקרוסקופ (EM). כאן, HS-AFM משמש כדי למדוד את התפלגות הגודל של חלקיקים הילידים/שכותרתו/התווית ליפופרוטאין.
- לדלל את ה-HDL/החלקיקים LDL הפתרון ב-PBS (1:100-1:1000) ו מודטה אותו על מנציץ טרי עבור 5 דקות. עבור יקוע נציץ12, הקש דבק קלטת נגד המצע ולהסיר את שכבות נציץ העליון על ידי משיכת הקלטת.
הערה: בהתאם לכלי ה-AFM המסוים, לאזור התצפית ולריכוז הראשוני של החלקיקים, יש לכוונן את מקדם הדילול כדי להתבונן בחלקיקים בודדים. - לאחר הדגירה, לשטוף את המדגם עם PBS ולבצע הדמיה HS-AFM ב-PBS במצב הקשה עם מנופים התלויה עם קבועים באביב של kצביעות ≪ 0.2 N/m. מומלץ להשתמש בגודלי סריקה < 1 יקרומטר2 וכדי לשמור על כוחות ההדמיה נמוכים ככל האפשר.
- קבעו את גובה חלקיקי התמונה ביחס למשטח הנציץ בתוכנה מתאימה.
- לטעון את הנתונים לתוך Gwyddion (freeware), לזהות את החלקיקים באמצעות ניתוח תבואה (סמן גרגירים על ידי הסף) ולהגדיר את הסף מעל רקע המצע. שטחו את התמונה (הסר רקע פולינומיאלי) בחירה באפשרות ' כלילת אזור מסיכה '.
- יצא את ערכי הגובה של החלקיקים שאותרו (הפצת מאפייני תבואה שונים) וחזור על שלבים אלה עבור כל התמונות המוקלטות. בצע ניתוח סטטיסטי על-ידי יצירת היסטגרמות או חישוב פונקציות צפיפות ההסתברות של גובה החלקיקים שהושג.
- חזור על הצעדים 5.1 – 5.3 עם מקורי, כמו גם ליפופרוטאין התווית החלקיקים ולהשוות את התוצאות המתקבלות כדי לאמת את איכות החלקיקים. אם התבוננות בפסולת ו/או בתאגידים, מחק את המדגם.
6. תרבית תאים
- הגדל תאים חסיד על פי פרוטוקול מבוסס (למשל, ldlA7-SRBI13) עד להשגת שטף.
הערה: מספר חדרים עצמאיים בהתאם למספר הניסויים (מומלץ שני תאים לכל הגדרה ניסיונית) וניסויי שליטה שליליים (מומלץ שני תאים ללא תוספת של חלקיקי ליפופרוטאין) נחוצים. בנוסף, נדרשים שני תאים לקביעת מספר הטלפון. - בעדינות לשטוף את התאים 3x עם הפתרון המלח מאוזנת של האנק (HBSS) כדי להסיר פסולת תא ולכסות את שכבת התא עם נפח מתאים של מדיום צמיחה ללא סרום. הוסף נפח מתאים ליפופרוטאין פתרון חלקיקים כדי להגיע לריכוז הסופי של 50 μg/mL חלקיקים ליפופרוטאין. מודטה ב 37 ° צ' ו 5% CO2 עבור 16 h.
הערה: בהתאם לעיצוב הנסיוני ולקו התאים, יש להתאים את זמן הדגירה כדי להשיג גידול מספיק (כלומר, מדידה) ברמת miRNA הסלולרית. - בעדינות לשטוף את התאים 3x עם prewarmed (37 ° c) HBSS כדי להסיר את הפסולת תא/ליפופרוטאין חלקיקים ולכסות את שכבת התא עם נפח מתאים של מדיום ללא סרום.
- לקבוע את צפיפות התא באמצעות שיטה מתאימה (למשל, המוציטר, מונה תאים אוטומטי) לפחות שני חדרים עצמאיים כדי לחשב את מספר התאים בנפח המדגם משלב 6.3. מספר זה משמש לנורמליזציה.
7. מירנה הוצאת מתוך תא ליפופרוטאין דגימות חלקיקים
הערה: הוצאת miRNA מתאים מבוצעת באמצעות ערכת החילוץ miRNA עם השינויים הבאים.
-
דגימות תאים
- המשך לצנן את הצנטריפוגה ל -4 ° c. הוסף 350 μL של הליזה מגיב כל אחד לשני חדרי התאים המכילים תאי. כניסוי בשליטה שלילית, השתמש בחדר ללא תאים.
התראה: לובשים ציוד הגנה אישי מתאים ולעבוד בתוך מכסה המנוע בזמן טיפול בפירוק מגיב כפי שהוא מכיל פנול ו-thiocyanate. - המתן 3 – 5 דקות (בהתאם לקו התא) עבור ניתוק התא. במקרה הצורך, בדוק אם יש ניתוק תאים עם מיקרוסקופ ברייטפילד. בריכת התוכן של שני התאים בצינור 1.5 mL.
- באמצעות המחט 20 G ו-5 מזרק mL, הומוגון/לשבש את המדגם 5x – 10x על ידי שאיפה ו דגירה עבור 5 דקות. להוסיף 140 μL של כלורופורם (CHCl3), לנער במרץ עבור 15 s, ו דגירה עבור 3 דקות.
- צנטריפוגה ב 12,000 x g עבור 15 דקות ב 4 ° c. . לאחר מכן, תפסיק לקרר את הצנטריפוגה
- העבר את השלב העליון מימית לצינור חדש 1.5 mL; למנוע ערבוב שלב/זיהום כמו האינטרפאזה מכיל DNA והשלב התחתון מכיל חלבונים. הוסף 1.5 x נפח של 100% אתנול ולערבב ביסודיות על ידי ליטוף.
- מניחים עמודת ספין בצינור האוסף 2 מ"ל ולהוסיף 700 μL של התערובת משלב 7.1.5. צנטריפוגה ב 8,000 x g עבור 15 s בטמפרטורת החדר. מחק את הזרימה וחזור על שלב זה עם עוצמת הדגימה השיורית.
- השמט את הזרימה והוסף 700 μL של מאגר הכביסה הראשון לעמודת הספין. צנטריפוגה אותו ב 8,000 x g עבור 15 s בטמפרטורת החדר.
- השמט את הזרימה והוסף 500 μL של מאגר הכביסה השני לעמודת הספין. צנטריפוגה אותו ב 8,000 x g עבור 15 s בטמפרטורת החדר. חזור על כל השלב הזה בפעם השנייה עם 2 דקות של צנטריפוגה time.
- מניחים את הטור ספין לתוך צינור חדש 2 מ"ל הקולקציה וצנטריפוגה אותו במהירות מלאה עבור 1 דקות כדי לייבש את הקרום.
- מקם את עמודת הספין לתוך שפופרת אוסף של 1.5 mL. הוסף 30 μL של מים חינם RNase במרכז הקרום עבור הימנעות וצנטריפוגה אותו ב 8,000 x g עבור 1 דקות. לחזור על כל שלב זה בפעם השנייה עם הזרימה הראשונה באמצעות פתרון הימנעות. הצעד ההפוך שעתוק נעשה מיד לאחר החילוץ; אחרת, אחסן את הדגימות miRNA שחולצו ב-20 ° c.
- המשך לצנן את הצנטריפוגה ל -4 ° c. הוסף 350 μL של הליזה מגיב כל אחד לשני חדרי התאים המכילים תאי. כניסוי בשליטה שלילית, השתמש בחדר ללא תאים.
-
ליפופרוטאין חלקיקים
- הגדר את הנפח של המדגם עם ריכוז החלבון הנמוך ביותר כדי 100 μL (= נפח מירבי לדוגמה). חשב את הכרכים לדוגמה של הדגימות האחרות בהתאם לנורמליזציה זו, תוך הפיכה להתרכזות. עבור ניסויים בשליטה שלילית, השתמש ב-100 μL של מים בחינם RNase.
הערה: נרמול אינו נדרש אך מפשט את ההשוואה הישירה של תוצאות במהלך השלב והניתוח של qPCR. - המשך לצנן את הצנטריפוגה ל -4 ° c. הוסף 700 μL של הליזה מגיב לנפח המדגם של שלב 7.2.1.
- בצע חילוץ miRNA על פי שלבים 7.1.3 – 7.1.10.
- הגדר את הנפח של המדגם עם ריכוז החלבון הנמוך ביותר כדי 100 μL (= נפח מירבי לדוגמה). חשב את הכרכים לדוגמה של הדגימות האחרות בהתאם לנורמליזציה זו, תוך הפיכה להתרכזות. עבור ניסויים בשליטה שלילית, השתמש ב-100 μL של מים בחינם RNase.
8. תמלול הפוך
הערה: שעתוק הפוכה של miRNA מבוצע באמצעות ערכת תמלול הפוכה עם השינויים הבאים.
- הפשרת ריאגנטים הערכה ואת התעתיק האחורי התחל על הקרח. להכין את התמהיל הראשי הבא בצינור התגובה על הקרח: 45.7 μL של RNase-H חינם2O, 16.5 μl של 10 x שעתוק הפוכה מאגר, 11 μl של הפוך האנזים תמלול, 2.1 μl של מעכב rnase, ו 1.7 μl של ערבוב dntp. מערבבים בעדינות, לא מערבולת.
הערה: גודל הדגימה תלוי בכמות המדגם; כאן, הוא מחושב עבור 10 תגובות. - תווית 0.2 mL צינורות בהתאם ומערבבים 7 μL של תערובת הורים משלב 8.1 עם 5 μL של המדגם שחולצו משלב 7.1.10 ו 3 μL של שעתוק הפוכה. לערבב בעדינות, צנטריפוגה בקרוב, ולאחסן את התערובת על הקרח.
- כדי להשתמש באותו מספר תא עבור כל קו תא, הפחת את נפח הדגימה של קו התא עם מספר תא כולל גבוה יותר; להשתמש בזה כאמצעי האחסון שיורית כדי להגיע לנפח מדגם הכולל של 5 μL של מים ללא RNase-.
הערה: ליפופרוטאין דגימות החלקיקים כבר מנורמלות בשלב 7.2.1. עבור הכנה עקומת הסטנדרטי, לדלל את סדרת מחלקים של mirna ברציפות במים rnase-חינם ולחשב את מספר קווצות לכל מדגם נפח. נדרשות לפחות חמש נקודות נתונים בטווח של ערכי המחזור (cq) של המדגם המתקבל. בדרך כלל, גורמי דילול כולל החל 102 עד 106 מתאימים. - מניחים צינורות לתוך מכונת התרמוציקלייר ומתחילים את התוכנית הבאה: 30 דקות ב -16 ° צ' (שלב הריפוי), 30 דקות ב 42 ° צ' (תעתיק הפוך), 5 דקות ב 85 ° צ' (התכה), והפסקה ב -4 ° צ' (אחסון). בצע את שלב ה-qPCR מיד לאחר שעתוק הפוך; אחרת, לאחסן את ה-DNA המשלים (cDNA) מסונתז מתוך דגימות miRNA ב-20 ° c.
9. qPCR
- לבצע qPCR של cDNA (הפוך ששועתק מ miRNA) באמצעות שיטת מסחרית זמין (לראות את הטבלה של חומרים) עם השינויים הבאים.
- הפשרת כל ריאגנטים (שילוב, RNase-H חינם2O), cdna דגימות (משלב 8.4), ואת התחל על קרח. הכינו את התמהיל הראשי הבא בשפופרת תגובה על הקרח: 75 μL של סופרמיקס, 47.5 μL של RNase-H חינם2O, 7.56 μl של התחל. מערבבים בעדינות, לא מערבולת.
הערה: גודל הדגימה תלוי בכמות המדגם; כאן, הוא מחושב עבור 10 תגובות. - תווית 0.2 mL צינורות בהתאם ולהוסיף 2 μL של דגימת cDNA כדי 13 μL של תערובת הורים ולערבב בעדינות. באופן כללי, יש למדוד כל דגם 2x.
הערה: לפחות שני דוגמאות שליטה שליליות נדרשות בנוסף-השתמש במים ללא RNase כמדגם. אם עקומת הכיול אינה נקבעת באותה הפעלה כמו המדגם, נדרשת גם דוגמה אחת ממדידת עקומת הכיול. הוא משמש כדי לכייל כל אדם לרוץ לאותו יעילות תגובה. - מניחים את הצינורות במכונת ה-PCR ומתחילים את התוכנית הבאה: 2 דקות ב 50 ° c, 10 דקות ב 95 ° c, 15 ס מ ב 95 ° c, ו 60 ב-60 ° c. חזור על שני השלבים האחרונים של התוכנית עד 50x.
- לניתוח של ערכי cq עם חבילת התוכנה של מחשב ה-PCR, הפעל נרמול שפופרת דינמיות (לפיצוי של רמות רקע שונות באמצעות הנגזרת השנייה של כל מעקב לדוגמה) ושיפוע הרעש תיקון (נורמליזציה לרמת הרעש).
הערה: ערך ה-cq של הפקד השלילי אמור להיות מספר מחזורי גבוה יותר מהערך הגבוה ביותר לדוגמה cq .- עבור ניתוח עקומת כיול, לקבוע את הסף לחישוב של cq עבור כל mirna מתוך עקומות סטנדרטיות של כל mirna בנפרד, באמצעות הפונקציה למצוא אוטומטית הסף של חבילת התוכנה, ולשמור על קבוע עבור כל miRNA ספציפי.
- לניתוח לדוגמה, במקרה הצורך, מפצים על יעילות תגובה שונה של המדגם הפעלה עם נקודת הנתונים מתוך דגימת עקומת הכיול. התוכנה מחשבת את ערכי cq של הדגימות מרמת הסף של מדידת עקומת הכיול המתאימה.
10. חישוב של תוכן miRNA
-
עקומת כיול
- לחשב, מהמספר ההתחלתי של קווצות mirna לכל סדרת מחלקים (100 μl של 10 μm mirna, משקל מולקולרי מגליון נתונים) ואת שלבי הדילול הסדרתי הבאים, מספר קווצות mirna באמצעי האחסון לדוגמה (5 μl לדוגמה נפח משלב 8.3).
הערה: בהנחה שתעתיק הפוך של 1, מספר זה שווה למספר קווצות cDNA. - חשב את מספר קווצות cDNA בנפח המדגם של 2 μL משלב 9.3. שקול ובכך את מקדם הדילול הנוסף של 7.5 (הנפח של 2 μL לדוגמה משלב 9.4 מ 15 הנפח μL לדוגמה משלב 8.4).
- התווה את ערך ה-c משלב 9.5.1 כנגד מספר הגדילי nקווצות שחושבו בשלב 10.1.2 בחלקה בסיסית 1-10, והתאם את נקודות הנתונים באמצעות עקומת הרגרסיה הבאה (M = השיפוע של הלינארי עקומת רגרסיה, B = היסט).
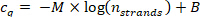
ודא שמקדם המתאם (R2) עבור הקו הוא > 0.99.
- לחשב, מהמספר ההתחלתי של קווצות mirna לכל סדרת מחלקים (100 μl של 10 μm mirna, משקל מולקולרי מגליון נתונים) ואת שלבי הדילול הסדרתי הבאים, מספר קווצות mirna באמצעי האחסון לדוגמה (5 μl לדוגמה נפח משלב 8.3).
-
ליפופרוטאין חלקיקים
- חישוב מספר קווצות miRNA לכל אמצעי אחסון באמצעות הדגם הנמדד cq (שלב 9.5.2) והמשוואה הבאה (M ו- B הם הפרמטרים של עקומת הכיול של mirna הספציפי).
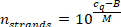
- לחשב את המספר המתאים של חלקיקים ליפופרוטאין בכרך לדוגמה, החל מאמצעי האחסון בשלב 7.2.1 (100 μL), הריכוז הידוע שלה, ואת שלבי הדילול הבאים (100 μL-> 30 μL לדוגמה אמצעי אחסון בשלב 7.1.10-> 5 μL [דילול 1:6] לדוגמה ב-15 נפח μL כולל בשלב 8.4-> 2 μL [דילול 1:7.5] בשלב 9.4). להניח משקל מולקולרי של 250 kda עבור חלקיקי HDL ו 3 מד א עבור חלקיקים LDL ו 100% שחזור של mirna במהלך החילוץ מירנא (התעלמות כל תרומת השומנים לתשואות משקל מולקולרי הערכה קלה של מספר קווצות mirna ל ליפופרוטאין חלקיק).
- לחלק את מספר קווצות miRNA משלב 10.2.1 על ידי מספר החלקיקים שחושבו בשלב הקודם כדי להניב את מספר קווצות miRNA ליפופרוטאין חלקיק.
- חישוב מספר קווצות miRNA לכל אמצעי אחסון באמצעות הדגם הנמדד cq (שלב 9.5.2) והמשוואה הבאה (M ו- B הם הפרמטרים של עקומת הכיול של mirna הספציפי).
-
תאים
- לחשב את מספר קווצות miRNA לכל אמצעי אחסון לפי מדגם בהתאם לשלב 10.2.1.
- חשב את מספר התאים המתאים באמצעי האחסון לדוגמה בהתאם לשלב 10.2.2, החל בריכוז מספר התאים ההתחלתי הנמדד בשלב 6.4.
- לחלק את מספר קווצות miRNA מ 10.3.1 על ידי מספר התאים שחושבו בשלב הקודם כדי להניב את מספר קווצות miRNA לכל תא.
- לחשב את שיעור ספיגת חלקיקים ליפופרוטאין על ידי חלוקת הסכום הכולל של קווצות miRNA מן השלב הקודם לאחר תיקון עבור ברמה miRNA הרקע של התאים המתקבלים מניסוי בקרה שלילית על ידי היחס miRNA/חלקיקים (שלב 10.2.3 ) ואת זמן הדגירה (16 h, ראה שלב 6.2).
11. מערכי מיקרופלואידיג מרובת היטב
-
חילוץ מירנה
- בצע חילוץ miRNA כמתואר בשלב 7.
-
תעתיק הפוך
- הפשרת שעתוק הפוכה, רכיבי ערכת התעתיק הפוכה, ו MgCl2 (25 מ"מ) על הקרח. עבור שמונה דגימות, מערבבים 8 μL של שעתוק הפוכה (10x), 2.25 μL של dNTPs עם Dntps (100 mM), 16.88 μL של היפוך הטרנססקריפט (50 U/μL), 9.00 μL של מאגר תמלול של 10 x הפוך, 10.12 μL של MgCl2, 1.12 μl של מעכב RNase (20 U/μl) , ו-1 μL של מיים ללא השכרה.
- מערבבים בעדינות וצנטריפוגה בקצרה. הוסף 4.3 μL של הפוך שעתוק התגובה ערבוב כדי 3.5 μL של חילוץ miRNA בצינור ולערבב, ספין למטה, ו-דגירה על הקרח עבור 5 דקות. מניחים את הצינורות במכונת התרמוציקלונט ולהתחיל את התוכנית הבאה: 16 ° צ' עבור 2 דקות, 42 ° צ' עבור 1 דקות , ו-50 ° c עבור 40 x חוזרות ונשנות בסך הכל, ולאחר מכן, כתגובת עצירה, 85 ° c עבור 5 דקות ולהחזיק ב 4 ° צ' עד שנעצר.
-
הגברה מראש
- הפשרת התחל על הקרח והיפוך וצנטריפוגה בקצרה. מערבבים את התערובת הראשית הגברה (2x) על ידי התערבל הבקבוק. הכינו את מיקס התגובה המוקדמת בהתאם להוראות הבאות לשמונה דגימות: 112.5 μL של שילוב מאסטר מקדים (2x), 22.5 μL של הגברה מראש, ו 67.5 μL של nuclease-מים ללא תשלום. היפוך וצנטריפוגה בקצרה.
- מערבבים 2.5 μL של המוצר הפוכה תגובת התגובה משלב 11.2.2 עם 22.5 μL של שילוב תגובה הגברה מהשלב הקודם והיפוך צנטריפוגה בקצרה. מודקון את הדגימות על הקרח עבור 5 דקות.
- מניחים את הצינורות במכונת התרמוציקלונט ו-דגירה בהגדרות הבאות: הפעלת אנזימים ב 95 ° c עבור 10 דקות, מריפוי ב 55 ° צ' עבור 2 דקות, הארכת ב 72 ° צ' עבור 2 דקות, חוזר על 12x: הרפתקאות ב 95 ° c עבור 15 וריפוי/הארכה ב 60 ° c עבור 4 דקות , ב99.9 מעלות צלזיוס למשך 10 דקות ו -4 ° c בהמתנה.
- ספין למטה, להוסיף 7.5 μL של 1 x TE (pH 8.0) ו 67.5 μL של nuclease-מים חינם, היפוך, ו צנטריפוגה בקצרה. ניתן לאחסן את הדגימות ב-20 ° צ' עד לשבוע אחד.
-
טרינריה
- מערבבים את התערובת הראשית על ידי מתערבל הבקבוק. הכינו את תערובת התגובה של ה-PCR עבור כרטיס אחד: 450 μL של מיקס בסיס, 441 μL של nuclease-מים ללא תשלום, ו -9 μL של דגימת הגברה משלב 11.3.4. היפוך וצנטריפוגה בקצרה.
- לטעון כל מאגר מילוי של כרטיס multifluאידיג מערך מיקרו עם 100 μL של הכנת התגובה PCR הכין על פי ההוראות של היצרן, צנטריפוגה 2x עבור 1 דקות ב 3,000 x g. ההאצה במהלך שני השלבים הצנטריפוגה הרצופים חשובה למילוי כראוי של הכרטיס. חתום את הכרטיס לפי הוראות היצרן.
- השתמש במערכת PCR עם התוכנית הבאה: הפעלת אנזימים ב-95 ° c למשך 10 דקות ולאחר מכן, וחזרה על 40x: הפעלה ב-95 ° c עבור 15 s וריפוי/הארכה ב-60 ° c עבור 1 דקות.
- יבא את קובץ התוצאות ממערכת ה-PCR וחשב את ערכי ה-RQ באמצעות חבילת התוכנה של המערכת באמצעות הגדרות הניתוח הבאות: ערך cq מירבי המותר של 40.0, ערכי cq מרביים בחישובים כלולים ומיירס בין המשכפלת שלא נכללו. הפעל את שיעור גילוי השקר של בנימיני-הוכברג כאפשרות להתאמת ערך p(תיקון המופע של תוצאות חיוביות שגויות14) ונורמליזציה כללית כשיטת נורמליזציה (באמצעות ערך סף חציון עבור כל הדגימות 15).
תוצאות
מערכת כללית של ליפופרוטאין חלקיקים בידוד
איור 1 מראה את הערכה הכללית של ליפופרוטאין בידוד חלקיקים החל דם שלם, באמצעות ציפה רציפה החוצה16. במידת הצורך, ליפופרוטאין שברים חלקיקים כמו החלקיקים VLDL ו-IDL ניתן לקצור במהלך פרוטוקול זה. הרוטור טיטניום בזווית קבועה בשילוב עם פוליפרופילן מהיר-חותם צינורות מתאים לעמוד בפני כוחות צנטריפוגה. כדי למנוע קריסת הצינור, חשוב למנוע בועות אוויר בצינור. צנטריפוגה מתבצעת ב 4 ° צ' כדי למזער את השפלה חלבון. בדרך כלל החל פלזמה (60-80 mL לכל תורם) של תרומות דם במאגר של שלושה מתנדבים, תשואה של כרכים של ה-LDL ו-HDL פתרון החלקיקים של 3 mL כל אחד עם ריכוזים בטווח של 1-3 mg/mL ניתן לצפות. כל התהליך, החל מתרומת הדם, לקח בערך 7 ימים.
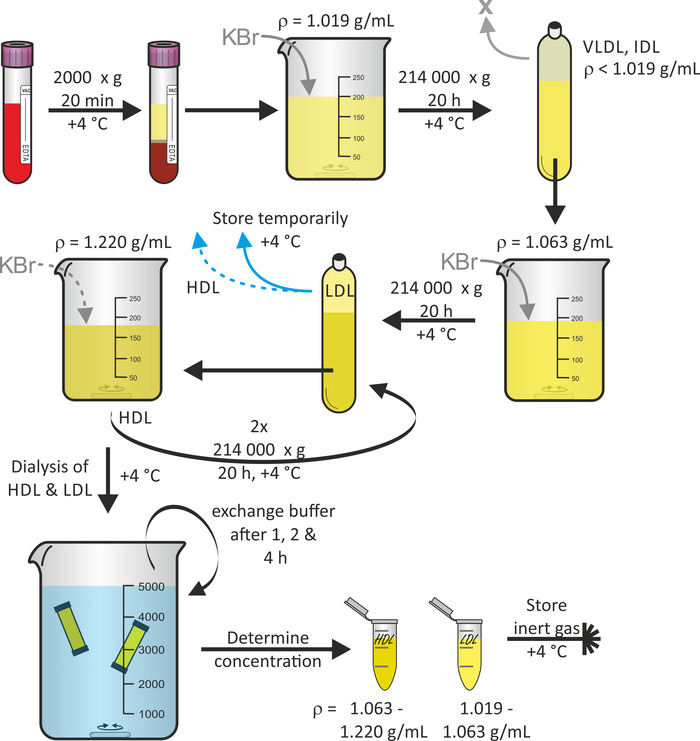
איור 1: תרשים זרימה של ליפופרוטאין בידוד. דם צנטריפוגה ממתנדבים בריאים צינורות מכולה ואקום ולאסוף פלזמה (השלב העליון). לאחר התאמת הצפיפות שלה ρ = 1.019 g/mL באמצעות kbr, צנטריפוגה את הפתרון ב 214,000 x g עבור 20 h ב 4 ° c. לאחר התאמת צפיפות השבר התחתון ל ρ = 1.063 g/mL באמצעות kbr, צנטריפוגה את הפתרון שוב ב 214,000 x g עבור 20 h ב 4 ° c. אחסן את השבר העליון המכיל את חלקיקי ה-LDL באופן זמני ב-4 ° c. לאחר התאמת צפיפות השבר התחתון ל ρ = 1.220 g/mL באמצעות kbr, צנטריפוגה את הפתרון פעמיים ב 214,000 x g עבור 20 h ב 4 ° c. לאסוף את השבר העליון המכיל את חלקיקי ה-HDL, dialyze הן את ה-HDL ואת פתרונות החלקיקים LDL ולהחליף את המאגר אחרי 1, 2, ו 4 h. לאחר 24 שעות, לקבוע את ריכוז החלבון ולאחסן את הדגימות תחת גז אדיש ב 4 ° c. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
החוקה החוזרת של חלקיקי HDL
החוקה של חלקיקי ה-HDL בוצעה על פי פרוטוקול שפרסם בעבר על ידי ג'ונאס7. הצעד הראשון היה מדליזציה של חלקיקי ה-HDL כפי שמוצג באיור 2A, ואחריו השלב השני של משככי כאבים (כלומר, החוקה) כפי שמוצג באיור 2a, באמצעות PC השומנים, CO, ו-C בנוסף תערובת של mirna ו ספרמינה. בחרנו בוגרת האדם מיר-223 ו מיר-155 כי מיר-223 מראה שפע גבוהה, מיר-155 נדיר ליפופרוטאין חלקיקים17. בדרך כלל, שני השלבים מבוצעים בשני ימים רציפים. במהלך החוקה, ניתן להוסיף ליפופילית ו/או מרכיבים אמפיפילי אחרים כרצונכם. אידוי מלאה של אתנול/diethyl אתר ו מתנול/כלורופורם הממס של PC, CO, C היה קריטי. השלב האחרון — כפי שמוצג באיור 2C— היה הליך הדיאליזה להפרדת החלקיקים האחרים של ה-HDL (rhdl) מפני שומנים וכלי ניקוי בחינם. זה לקח 1-2 ימים נוספים. התוספת של חרוזי ספיגה לתמיסה הדיאליזה שמרה על מעבר הצפיפות לאורך קבוע קרום הדיאליזה. ניתן לצפות לתשואה של 50% של חלקיקי rHDL.
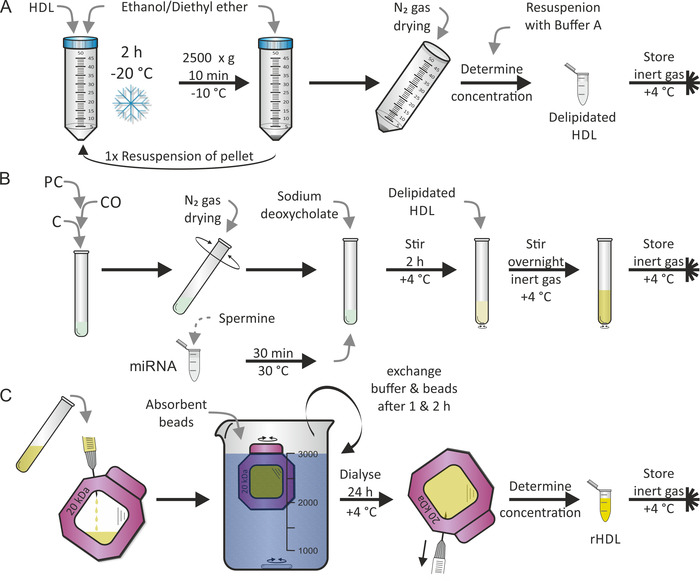
איור 2: תרשים זרימה של החוקה מחדש של חלקיקי HDL. (A) מדליזציה: לערבב את הפתרון של ה-HDL עם האתנול מקורר/diethyl אתר ו-מודטה ב-20 ° c עבור 2 h. לאחר שהשליך את הסופרנטאנט, השהה מחדש את הגלולה וחזור על התהליך. יבש את הגלולה עם N2 גז ולהשעות אותו מחדש במאגר A. לאחר קביעת ההתרכזות, אחסן את ה-HDL הטעים באווירת גז אינרטי ב -4 ° c. (ב) החוקה: לאחר ערבוב פוספולידיל-כולין (PC), cholesteryl אולאט (שיתוף), ו כולסטרול (ג), לאדות את הממס באמצעות N2 גז תוך כדי סיבוב הצינור. דגירה של miRNA עם פתרון הספרמינה עבור 30 דקות ב 30 ° c, להוסיף נתרן deoxycholate ולהשעות מחדש את הסרט השומנים מיובש. מערבבים את המדגם עבור 2 h ב 4 ° c, להוסיף את הפתרון HDL מדליק, ומערבבים את הדגימה שוב, הפעם בלילה ב 4 ° c תחת אווירת גז אדיש. (ג) דיאליזה: העבר את הפתרון מלוח B המכיל מחדש את החלקיקים HDL (rhdl) לחדר ממברנה דיאליזה (משקל מולקולרי לגזור: 20 kda) ו dialyze נגד מחרוזות מסוג PBS ו סופג ב 4 ° c. להחליף את המאגר ואת החרוזים אחרי 1 h ו 2 h. לשחזר את הפתרון החלקיקים rHDL לאחר 24 שעות, לקבוע את הריכוז, ולאחסן את המדגם מתחת לאטמוספירה גז אדיש ב 4 ° c. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוויות של חלקיקי LDL
התיוג של חלקיקי LDL עם miRNA (איור 3) כפי שמתואר עבור חלקיקי HDL לא היה אפשרי עקב הידרופוטניטי של חלבון apob-100, שהוא המרכיבים העיקריים של החלקיקים LDL. DMSO שימש לחדירת המונאולייר השומנים של החלקיקים LDL, ולכן, בתיווך האגודה miRNA. ההליך כולו לקח 1-2 ימים עם תשואה קרוב 100%.
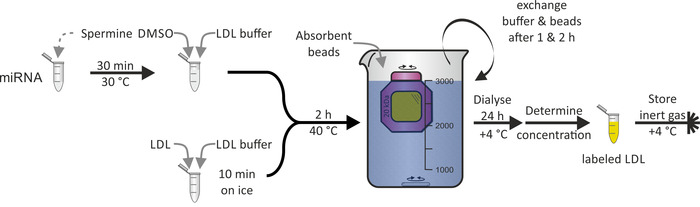
איור 3: תרשים זרימה של תיוג חלקיקי LDL. מודטה את mirna סדרת מחלקים עם פתרון ספרמינה עבור 30 דקות ב 30 ° צ' ולהוסיף dmso ו-LDL מאגר. הדגימה מדגם LDL שנינות מאגר LDL עבור 10 דקות על הקרח ולהוסיף miRNA/spermine/DMSO תערובת. לאחר הדגירה ב 40 ° c עבור 2 h, להעביר את הפתרון לתוך חדר ממברנה דיאליזה (לגזור משקל מולקולרי: 20 kDa) ו dialyze על חרוזי ה-PBS וסופג ב + 4 ° c. החלפת מאגר וחרוזים אחרי 1 & 2 h. לשחזר את התווית LDL בזיהוי הפתרון לאחר 24 שעות, לקבוע את הריכוז והחנות תחת אווירת גז אינרטי ב + 4 ° c. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בקרת איכות ליפופרוטאין חלקיקים
HS-AFM יכול לשמש כדי לבחון את הגודל והצורה של ליפופרוטאין חלקיקים מקוריים/שכותרתו על נציץ. רק לפני השימוש, נציץ צריך להיות טרי ביקע (דבק בסרט להשתמש כדי להסיר את השכבה העליונה [s]) כדי לספק משטח נקי ושטוח. בעת הדגירה של החלקיקים HDL/LDL על נציץ, גורם הדילול (ו/או זמן הדגירה) צריך להיות מותאם כדי להתבונן חלקיקים בודדים. אשכולות אינם מאפשרים קביעת ממדי חלקיקים. חלקיקי HDL הם ניידים על נציץ. בשימוש ב-AFM קונבנציונאלי במקום ב-HS-AFM, יש להתאים את פרוטוקול השתק בהתאם (מאגר, ציפוי משטח) כדי להפחית את הניידות בחלקיקים הצדדיים. במהלך סריקת המדגם, כוח ההדמיה צריך להישמר נמוך (הקשה מצב) כדי למנוע עיוות של החלקיקים, אשר לפיכך ישפיע על הערכים נמדד. לצורך ניתוח נתונים, זוהו חלקיקים באמצעות אלגוריתם הסף (למשל, בGwyddion: דגנים > סימון הסף) וגובהם נקבע ביחס למשטח הנציץ. מדידת גובה החלקיקים היא הדרך המדויקת ביותר לקביעת גודל החלקיקים, כיוון שממדי הרוחב הגלויים מרחיבה את צורת הקצה (ראה תמונות מופת באיור 4). פונקציות צפיפות ההסתברות (מסמכי pdf) של גובה החלקיקים חושבו עבור הערכה סטטיסטית והשוואת גודל הפצות של חלקיקי ליפופרוטאין שונים. השוואה בין חלקיקי ה-LDL מקורי לבין מירנה, כפי שמוצג באיור 4 , מאפשרת לאמת את הדמיון העיקרי בין התוויות והפריטים שאינם מתויגים (קרי, יליד) ליפופרוטאין חלקיקים (שכותרתו חלקיקי LDL ללא תוספת של mirna/ תערובות spermine מוצגים כפקד עבור הליך תיוג עצמו). התהליך כולו לקח בערך יום אחד.
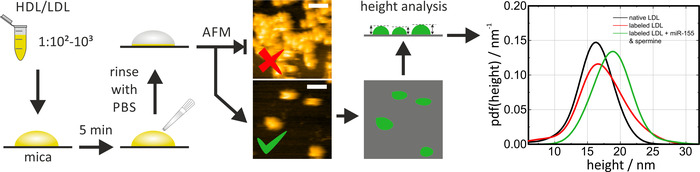
איור 4: תרשים זרימה ותוצאות מייצגות של מדידות HS-AFM. לדלל את ה-HDL/LDL מדגם החלקיקים ב-PBS (1:102-1:103) ו-מודייאת זה על מנציץ טרי עבור 5 דקות, ואחריו שטיפה זהירה עם PBS כדי להסיר ללא תשלום (לא אלקטרוסטטי adsorbed) חלקיקים. לבצע דימות HS-AFM ולבדוק את צפיפות החלקיקים על פני השטח. לבצע את המדידות ב-PBS בטמפרטורת החדר. התמונה העליונה של איור זה מראה צפיפות גבוהה מדי של חלקיקים; התמונה התחתונה מתאימה לניתוח. הגובה של חלקיקים בודדים נותח לאחר סף ו יליד (עקומת שחור) ו מחדש/מתויג (עקומת אדום וירוק) חלקיקים הושוו בהערכה סטטיסטית. סרגל קנה המידה = 100 ננומטר. דמות זו השתנתה מאקסון ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הוצאת miRNA, שעתוק הפוך, ו-qPCR
החילוץ של miRNA מתוך ליפופרוטאין יליד/באופן מלאכותי מועשר או דגימות תאים בוצעה באמצעות ערכת החילוץ miRNA כפי שמוצג באיור 5A. בזאת, סביבה נטולת RNase הייתה קריטית. צעד זה לקח כ 1 h. תמלול הפוכה של מדגם miRNA שחולצו (איור 5B) בוצעה באמצעות הליכים ביוכימיים סטנדרטיים כפי שמתואר על ידי היצרן. צעד זה לקח כ 1.5 h. לבסוף, כמות ה-Dna שהושג במהלך השלב האחרון נקבע באמצעות qPCR (איור 5C). עקום רגיל, המתייחס לערכי cq שהתקבלו למספר הסטרנד המוחלט של mirna, הניב את תוכן mirna המוחלט של המדגם ההתחלתי. זה לקח כ 2.5 h.
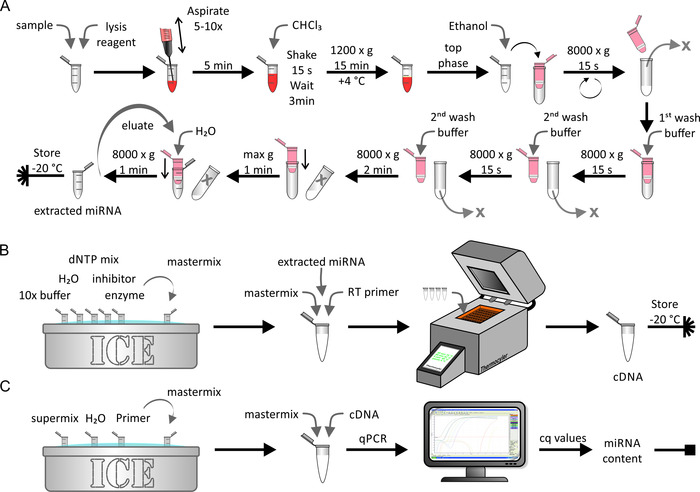
איור 5: תרשים זרימה של חילוץ miRNA, תמלול הפוכה, ו qPCR. (A) החילוץ mirna: לערבב את המדגם עם לפירוק מגיב ו lyse אותו באמצעות שאיפה באמצעות מזרק. דגירה עבור 5 דקות ולהוסיף CHCl3. לנער במרץ עבור 15 s ו דגירה עבור 3 דקות. לאחר צנטריפוגה ב 1,200 x g עבור 15 דקות ב 4 ° c, לאסוף את השלב העליון ולערבב אותו עם אתנול. העבר את הפתרון לעמודת ספין (נפח מרבי < 700 μL) ו צנטריפוגה אותו ב 8,000 x g עבור 15 s. למחוק את החומק ולחזור על השלב האחרון עם שאר הפתרון. הוסף את מאגר הכביסה הראשון ואת צנטריפוגה ב 8,000 x g עבור 15 s. למחוק את החומקת, להוסיף את מאגר הכביסה השני, ו צנטריפוגה ב 8,000 x g עבור 15 s. חזור על השלב האחרון עם זמן צנטריפוגה של 2 דקות. עוד יבש את הקרום דרך צנטריפוגה במהירות מקסימלית עבור 1 דקות. Elute עם H2O ו צנטריפוגה ב 80,000 x g עבור 1 דקות. לאחסן את מדגם mirna שחולצו ב-20 ° c. (ב) שעתוק הפוך: הפשרת מאגר 10X, H2O, לערבב dntp, מעכב, ואנזים על קרח ולהכין את התמהיל הראשי. הוסף את miRNA מחולץ מן הפאנל A כדי לערבב את המאסטר ואת שעתוק הפוכה ולבצע תמלול הפוכה באמצעות מכונת התרמוטרטרנר. אחסן את דגימת ה-Dna ב-20 ° c. (ג) qpcr: להפשיר את סופר לערבב, H2O, ו התחל על הקרח ולהכין את התמהיל הראשי. הוסף את cDNA מלוח B כדי לערבב את המאסטר ולבצע qpcr. ניתוח הנתונים כדי לקבל ערכי cq ולחשב את תוכן mirna המוחלט של המדגם (ראה איור 6 והנציג תוצאות לפרטים). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוכן מירנה מוחלט וקצב העברה
התוכן המוחלט miRNA של HDL מועשר מלאכותית ו-LDL חלקיקים חושבו מערכי cq של דגימות ועיקול סטנדרטי של mirna בהתאמה כפי שמוצג באיור 6. איור 6A מציג נתונים כפי שחושבו על-ידי תוכנת הניתוח (עם נורמליזציה מופעלת של שפופרת דינמיות [לפיצוי של רמות רקע שונות באמצעות הנגזרת השניה של כל מעקב לדוגמה] ותיקון מדרון הרעש [נורמליזציה לרמת הרעש]). ערכי cq של עקומות סטנדרטיות נקבעו באמצעות פונקציית הסף לחיפוש אוטומטי של חבילת התוכנה על אות הזריחה המנורמל שנמדד על ידי מכונת ה-qpcr. בזאת, התוכנה הוגדל את ערך ה-R של ההתאמה של העקומה הסטנדרטית. רמת הסף המשיכה להיות קבועה עבור כל ניתוח ספציפי של miRNA לדוגמה. לאחר מכן, ערכי cq הותוו כפונקציה של מספר קווצות mirna, ושורת רגרסיה חושבה. ערכי מדגם cq נקבעו באותה רמת סף כפי שמוצג באיור 6b; יעילות תגובה הבדלים בין הפעלת qPCR שונים היו מפוצה באופן אוטומטי על ידי התוכנה באמצעות אחת נוספת עקומת כיול מדגם כלול בכל לרוץ. באמצעות משוואת קו הרגרסיה, ניתן לחשב את הכמות הבלתי ידועה של miRNA במדגם. ליפופרוטאין מספר החלקיקים הוערך מפני ריכוז חלבון ראשוני משקל מולקולרי הממוצע שלה (MWHDL ~ 250 kda). ובכך, לא תרומת השומנים למשקל המולקולרי הניחו — ולכן, מספר קווצות miRNA ליפופרוטאין חלקיק היה מיותר באופן מערכתי. יתר על כן, a 100% שחזור שיעור של miRNA במהלך החילוץ מירנה בשלב הניח. יתר על כן, התוכן miRNA של התאים לפני ואחרי הדגירה עם חלקיקי HDL נקבע ואת קצב העברת miRNA היה מחושב כפי שמוצג באיור 6C.
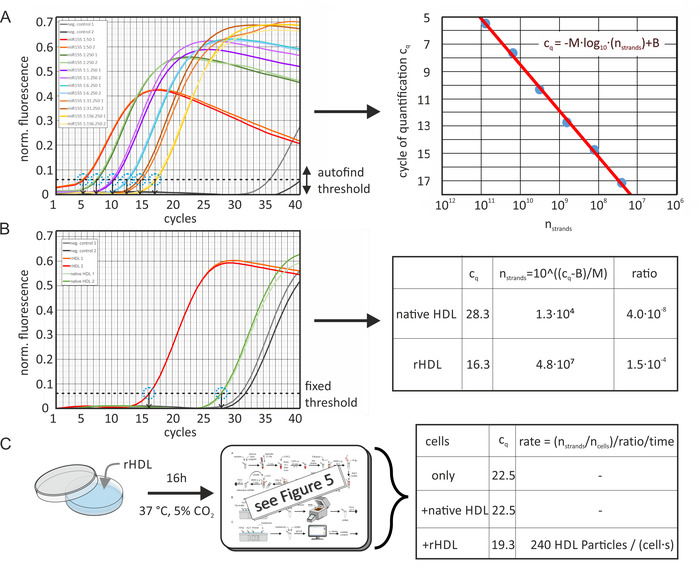
איור 6: תרשים זרימה של חישוב של תוכן miRNA המוחלט וקצב ההעברה. (A) העקומה הסטנדרטית עבור מיר-155: מיר-155 סדרת מחלקים (100 μl, 10 μm) היה מדולל באופן סדרתי עם מים ללא RNA כפי שצוין. qPCR הניב ערכיq עבור כל דגימת דילול טורית (נמדד פעמיים) באמצעות פונקציית הסף לחיפוש אוטומטי של חבילת התוכנה. ניסיונות שליטה שליליים (ללא תוספת של miRNA) הניבו ערכיq של > 35. נקודות נתונים של ערכי cq כפונקציה של מספר קווצות mirna לכל אמצעי לדוגמה (מחושב מפני הריכוז הראשוני והדילול הסדרתי) הותאמו עם המשוואה המוצגת (קו אדום, תמונה נכונה), מניב M =-3.36 ו B = 42.12. היעילות הנחושה של ה-PCR הייתה 0.98. קווי השגיאה חושבו מתוצאות החזרות הנסיוניות והיו קטנים יותר מקוטר מעגל נקודת הנתונים. (ב) הערכים cq של חלקיקי HDL מועשר באופן מלאכותי, נקבעו באותה רמת סף שנקבעה בלוח A והומרה למספר קווצות Mirna בכרך המדגם qpcr. היחס המוחלט של miRNA של המדגם המקורי חושבה מן המספר (ריכוז) של חלקיקי HDL בכרך לדוגמה (3.2 x 10 חלקיקים11 ). (ג) תא דגימות (קו התא LDLA7-srbi) היו מודבטים עבור 16 h עם חלקיקי HDL מועשר מלאכותית (50 Μg/mL) ונותחו באופן דומה. הערכים הקבועים cq היו 22.5, 22.5, ו 19.3 עבור תאים בלבד, עבור תאים מודבטים עם ה-HDL יליד, או עבור תאים הדגירה עם פתרון החלקיקים rhdl (שניהם מ50 μg/mL), בהתאמה. ערכים אלה הומרו למספר קווצות miRNA כפי שנעשה בלוח B. מספר קווצות miRNA לאחר הדגירה (7.3 x 106) תוקנו על ידי חיסור של מספר קווצות mirna לפני דגירה (8.6 x 105). התוצאה חולקה על-ידי מספר התאים בכרך לדוגמה (3,100), יחס החלקיקים miRNA (1.5 x 10-4), ואת תקופת זמן הדגירה (16 h). זה הניב את שיעור ההעברה של ליפופרוטאין חלקיקים באמצעות ספיגה miRNA (240 המאורעות HDL החלקיקים לתאי ו השני). דמות זו השתנתה מאקסון ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
מערך רב-מימדי מיקרופלואידיק
בשל תשואות קטנות של חילוץ miRNA, שעתוק הפוכה של miRNA שחולצו היה אחריו צעד הגברה. לבסוף, qPCR, כפי שמוצג באיור 6, בוצע. עבור כל השלבים, הליכים ביוכימיים סטנדרטיים שימשו כמתואר על-ידי היצרן. כאן, חלק הפרופיל הגלובלי miRNA על חלקיקי ה-HDL של חולים uremic גויס למחקר על ההשפעה של הסי. אר. כולסטרול על אפלוקס מקרופאגים18 מוצג. במחקר זה, את היכולת לקבלה כולסטרול של HDL או סרום ב-מלבד אחרים-17 מבוגרים צעירים uremic חולים (שלבים CKD 3-5) ו 14 מבוגרים צעירים באנליזה מטופלים ללא מחלות משויכות ושולטת התאמה נמדד. כדי לנתח את הנתונים, נעשה שימוש בהגדרות ברירת המחדל (הערך המרבי המותר של CT: 40.0, כולל ערכי CT מרביים בחישובים וללא היתר בין המשכפלת). ערכי Pהותאמו באמצעות שיעור גילוי שווא של בנימיני-הוכברג (תיקון התרחשות של תוצאות חיוביות שגויות), וכשיטת נורמליזציה, נבחרה האפשרות ' נורמליזציה כללית ', המוצאת את הערכים המשותפים בין כל דוגמאות לשימוש ב-CT החציוני שלה לנורמליזציה. בתוצאות הנציג, כמה RQs של miRNAs מבודדים HDLs של חולים uremic מתוארים (RQs של פקדים הם 1). ברור, מיר-122 ו מיר-224 מאוד מבוטא HDLs של חולים uremic. . כל הצעד הזה לקח בערך יום אחד
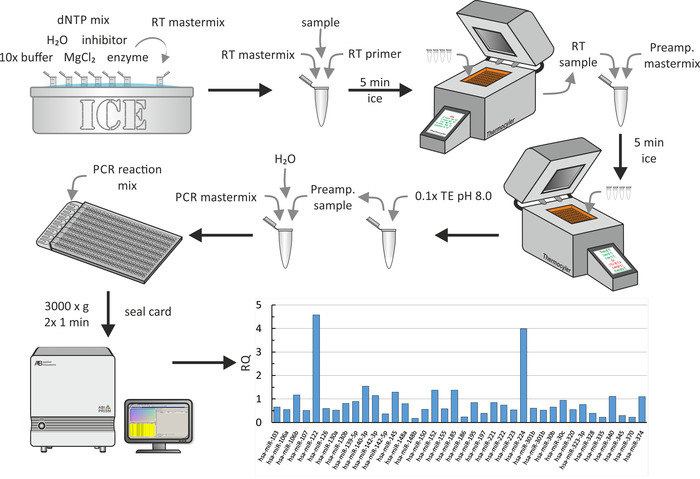
איור 7: תרשים זרימה ותוצאות מייצגות של מערך מיקרופלואידיג רב-היטב. לאחר החילוץ miRNA כפי שמוצג באיור 5A, לערבב את המדגם mirna עם שעתוק הפוכה ושילוב מאסטר המכיל 10x מאגר, H2O, שילוב dntp, מעכב, mgcl2, ו אנזים. לאחר הדגירה על קרח 5 דקות, לבצע את התמלול הפוכה באמצעות מכונת התרמוציקלer. הוסף את התמהיל הראשי לפני הגברה, מודטה עבור 5 דקות על הקרח, ולבצע הגברה מראש באמצעות מכונת התרמוציקלונט. להוסיף 0.1 x TE (pH 8.0) ולערבב סדרת מחלקים עם מיקס הראשי של ה-pcr ו-H2O. פיפטה התגובה הPCR לערבב לתוך נמל המילוי של מערך microflu, מיקרופלוג מרובת היטב, ספין פעמיים ב 3,000 x g עבור 1 דקות כל אחד. בצע qpcr באמצעות מערכת PCR ולנתח את הנתונים כדי להניב ערכי rq (כאן, הדמות מציגה ערכי rq של חלקיקי ה-HDL של החולים אורמיה בהשוואה לקבוצת שליטה בריאה18). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
כאן, הבידוד של ליפופרוטאין שברים חלקיק מהדם האנושי וקביעת תוכן miRNA הפרט שלהם מתואר צעד אחר צעד. זה קריטי לעבוד בסביבה RNase-free תוך טיפול מבודדים מסונתז miRNA-חלקיק מוטבע miRNA מוגן ללא ספק מהשפלה אנזימטית. כמו היחס של mirna/חלקיק של חלקיקים יליד ליפופרוטאין הוא נמוך למדי, העשרה מלאכותית עם mirna נדרש כדי ללמוד את קליטת חלקיקים הולוגרפי של תאים. ובכך, את החוקה של חלקיקי ה-HDL כפי שמתואר בעבר7 הוא שונה כדי לשלב קווצות mirna. בנוסף, את ההפרדה של שבר השומנים והחלבון במהלך הליך זה מאפשר למדענים לבחון את השומנים-ואת החומרים הקשורים חלבון של ליפופרוטאין חלקיק19. באופן דומה, את ההליך תיוג של חלקיקי LDL מותאם. מעניין, תוספת של הספרמינה-מייצב טבעי של נוקלאוטידים-לא השפיעו על יחס miRNA/חלקיקים. יצוין כי, בעיקרון, השיטה מאפשרת את חוסר קיפול של חומרים אחרים מאשר miRNA בתוך חלקיק ליפופרוטאין. כמובן, יש גבול ביחס לגודל הפיזי של החומר המבוסס על הגודל הכולל של ה-HDL (קוטר: 5-12 ננומטר) ו-LDL חלקיקים (קוטר: 18-25 nm).
בנוגע לבקרת איכות של חלקיקי ליפופרוטאין, HS-AFM היא שיטה ישימה לאפיון חלקיקי HDL/LDL ברמת החלקיק הבודד. בהשוואה ל-EM, היא מאפשרת זמני הכנה קצרים יותר ותנאים כמעט פיזיולוגיים (רטוב, טמפרטורת החדר).
בשל הרגישות הפנימית שלה הגברה, qPCR היא שיטת הבחירה כדי לזהות ריכוזי miRNA נמוכה. לחילופין, מיקרוסקופ חד-מולקולה רגיש מיקרוסקופית הזריחה, אשר מסוגל לזהות אפילו מולקולות בודדות, לא יהיה מתאים בשל ריכוזים נמוכים של, למשל, מסומן ברצועות מירונה לכל חלקיק. כך, את היחס של קווצות miRNA לכל ליפופרוטאין החלקיקים נמצא 10-8. העשרה מלאכותית מגבירה את היחס על ידי גורם של 10,000, אשר מקלה על הערכה של שיעור ספיגת ליפופרוטאין הסלולר (אין הבדל משמעותי מזוהה באמצעות חלקיקים ליפופרוטאין טבעי 19). רגישות גבוהה של qPCR מאפשר לקבוע את קצב ספיגת זה על ידי מדידת מספר קווצות miRNA לאחר הזמן הדגירה ואת יחס miRNA/חלקיק. יצוין כי הערך המחושב מתעלם השפלה סלולרית ושחרורו של miRNA, ולכן, מייצג לפחות מגבלה נמוכה יותר עבור היחס ספיגת חלקיקים ליפופרוטאין.
בעתיד, השיטה יכולה להיות מותאמת להעברת חומרים התרופות (בעיקר גם ליפופילית) בתאים ולהתאים את ההשפעה הביולוגית שלהם לריכוז תאיים (נקבע באמצעות שיעור ספיגת חלקיקים ליפופרוטאין).
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי פרויקט קרן המדע האוסטרי P29110-B21, "פרויקט H-3065/2011, הקרן האירופית לפיתוח האזור (EFRE, IWB2020), המדינה הפדרלית של החלק העליון של הבנק הלאומי" אוסטריה, והאדמה. "
Materials
| Name | Company | Catalog Number | Comments |
| Ultracentrifuge | Beckman | Optima L-100 XP | Lipoprotein isolation |
| Ultracentrifuge rotor | Beckman | TI 55.2 | Lipoprotein isolation |
| Vacutainer (EDTA) | Becton Dickinson | 366643 | Lipoprotein isolation |
| Kaliumbromid | Sigma Aldrich | 2110 | Lipoprotein isolation |
| Ultracentrifuge tubes | Beckman | 342414 | Lipoprotein isolation |
| Ultracentrifuge tube sealer | Beckman | 342428 | Lipoprotein isolation |
| Sodiumchlorid | Carl Roth GmbH | P029.2 | Lipoprotein isolation |
| EDTA | Fisher Scientific | D/0650/50 | Lipoprotein isolation |
| Dialysis tubes, MWCO 12 - 14k | Spectra | 132700 | Lipoprotein isolation |
| synthetic miRNA | microSynth | - | synthetic miRNA |
| TRIS buffer pH 7 | Ambion | AM9850G | synthetic miRNA |
| TRIS buffer pH 8 | Ambion | AM9855G | synthetic miRNA |
| sterile tubes | Carl Roth GmbH | ENE8.1 | synthetic miRNA |
| Photometer | Eppendorf | Eppendorf Biophotometer | Bradford assay |
| Cuvette | Carl Roth GmbH | XK20 | Bradford assay |
| Coomassie G-250 Stain | BioRad GmbH | 161-0786 | Bradford assay |
| Sodiumchlorid | Carl Roth GmbH | 3957.1 | Delipitation |
| EDTA | Fluka Analytical | 03690-100ML | Delipitation |
| TRIS buffer pH 8.0 | Ambion | AM9855G | Delipitation |
| Ethanol 100% | AustrAlco | Ethanol Absolut 99.9% | Delipitation |
| Diethyl ether | Carl Roth GmbH | 3942.1 | Delipitation |
| Centrifuge | Thermo Scientific | Multifuge X3R | Delipitation |
| Chloroform | Carl Roth GmbH | 3313.1 | Reconstitution |
| Methanol | Carl Roth GmbH | 4627.1 | Reconstitution |
| Phosphatidylcholine | Sigma Aldrich GmbH | P3556-25mg | Reconstitution |
| Cholesterol oleate | Sigma Aldrich GmbH | C-9253-250mg | Reconstitution |
| cholesterol | Sigma Aldrich GmbH | C8667-500mg | Reconstitution |
| glass tubes | Carl Roth GmbH | K226.1 | Reconstitution |
| spermine | Sigma Aldrich GmbH | S3256-1G | Reconstitution |
| Thermomixer | Eppendorf | Thermomixer comfort | Reconstitution |
| Sodium deoxycholate | Sigma Aldrich GmbH | 3097-25G | Reconstitution |
| Magnetic stir bar | Carl Roth GmbH | 0955.2 | Reconstitution |
| 100µL micropipettes | Carl Roth GmbH | A762.1 | Reconstitution |
| PBS | Carl Roth GmbH | 9143.2 | Dialysis |
| Amberlite XAD-2 beads | Sigma Aldrich GmbH | 10357 | Dialysis |
| Slide-A-Lyzer casette (cut-off 20 kDa) | Thermo Scientific | 66003 | Dialysis |
| Syringe | Braun | 9161406V | Dialysis |
| Syringe needle | Braun | 465 76 83 | Dialysis |
| EGTA | Carl Roth GmbH | 3054.2 | Labeling of LDL particles |
| DMSO | life technologies | D12345 | Labeling of LDL particles |
| Atomic Force Microscope | RIBM | SS-NEX | Quality control of reconstituted/labeled lipoprotein particles |
| Muscovite Mica (V-1 Grade) | Christine Gröpl | G250-1/V1 | Quality control of reconstituted/labeled lipoprotein particles |
| AFM Cantilever | Nanoworld | USC-F1.2-k0.15 | Quality control of reconstituted/labeled lipoprotein particles |
| Gwyddion 2.49 | Czech Metrology Institute | http://gwyddion.net | Quality control of reconstituted/labeled lipoprotein particles |
| Chamber slides, Nunc Lab-Tek | VWR | 734-2122 | Cell culture |
| HBSS | Carl Roth GmbH | 9117.1 | Cell culture |
| Cell counter | Omni Life Science GmbH | Casy | Cell culture |
| miRNeasy Mini Kit | QIAGEN | 217004 | miRNA extraction |
| Centrifuge | Eppendorf | 5415R | miRNA extraction |
| 20G needle | Braun | Sterican 465 75 19 | miRNA extraction |
| 5ml syringe | Becton Dickinson | 309050 | miRNA extraction |
| PCR cabinet | Esco | PCR-3A1 | Reverse Transcription |
| TaqMan Reverse Transcription Kit | Thermo Scientific | 4366596 | Reverse Transcription |
| Rnase-free water | Carl Roth GmbH | T143 | Reverse Transcription |
| 0.2 ml tubes | Brand | 781305 | Reverse Transcription |
| Centrifuge | Carl Roth GmbH | Microcentrifuge AL | Reverse Transcription |
| Thermocycler | Sensoquest | Labcycler | Reverse Transcription |
| TaqMan Primer | Thermo Scientific | - | qPCR |
| iTaq Universal probe supermix | BioRad GmbH | 1725131 | qPCR |
| PCR machine | Corbett | Rotor-Gene RG-6000 | qPCR |
| TaqMan MicroRNA Reverse Transcription Kit | Applied Biosystems | 4366596 | TaqMan Array |
| Megaplex RT Primers, Human Pool A v2.1 | Applied Biosystems | 4399966 | TaqMan Array |
| TaqMan PreAmp Master Mix | Applied Biosystems | 4391128 | TaqMan Array |
| Megaplex PreAmp Primers, Human Pool A v2.1 | Applied Biosystems | 4399933 | TaqMan Array |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | TaqMan Array |
| TaqMan Advanced miRNA Human A Cards | Applied Biosystems | A31805 | TaqMan Array |
| Nuclease-free water | Thermo Scientific | R0581 | TaqMan Array |
| MgCl2 (25mM) | Thermo Scientific | R0971 | TaqMan Array |
| TE, pH 8.0 | Invitrogen | AM9849 | TaqMan Array |
| 7900HT Fast Real-Time PCR System | Applied Biosystems | 4351405 | TaqMan Array |
| TaqMan Array Card Sealer | Applied Biosystems | - | TaqMan Array |
References
- Vickers, K. C., Palmisano, B. T., Shoucri, B. M., Shamburek, R. D., Remaley, A. T. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nature Cell Biology. 13 (4), 423-435 (2011).
- Tabet, F., et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nature Communications. 5, (2014).
- Wahid, F., Shehzad, A., Khan, T., Kim, Y. Y. MicroRNAs: Synthesis, mechanism, function, and recent clinical trials. Biochimica et Biophysica Acta - Molecular Cell Research. 1803 (11), 1231-1243 (2010).
- Carthew, R. W., Sontheimer, E. J. Origins and Mechanisms of miRNAs and siRNAs. Cell. 136 (4), 642-655 (2009).
- Fabian, M. R., Sonenberg, N., Filipowicz, W. Regulation of mRNA Translation and Stability by microRNAs. Annual Review of Biochemistry. 79 (1), 351-379 (2010).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: Are the answers in sight?. Nature Reviews Genetics. 9 (2), 102-114 (2008).
- Jonas, A. Reconstitution of High-Density Lipoproteins. Methods in Enzymology. , 553-582 (1986).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Bustin, S. A., et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Patsch, J. R., Patsch, W. Zonal ultracentrifugation. Methods in Enzymology. 129 (1966), 3-26 (1986).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Yamamoto, D., et al. High-Speed Atomic Force Microscopy Techniques for Observing Dynamic Biomolecular Processes. Methods in Enzymology. 475, 541-564 (2010).
- Stangl, H., Cao, G., Wyne, K. L., Hobbs, H. H. Scavenger receptor, class B, type I-dependent stimulation of cholesterol esterification by high density lipoproteins, low density lipoproteins, and nonlipoprotein cholesterol. Journal of Biological Chemistry. 273 (47), 31002-31008 (1998).
- Hochberg, B. Controlling the False Discovery Rate: a Practical and Powerful Approach to Multiple Testing. Journal of the Royal Statistical Society. 57 (1), 289-300 (1995).
- Mestdagh, P., et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biology. 10 (6), (2009).
- Schumaker, V. N., Puppione, D. L. 6] Sequential Flotation Ultracentrifugation. Methods in Enzymology. 128 (C), 155-170 (1986).
- Wagner, J., et al. Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1392-1400 (2013).
- Meier, S. M., et al. Effect of chronic kidney disease on macrophage cholesterol efflux. Life Sciences. 136, 1-6 (2015).
- Axmann, M., et al. Serum and Lipoprotein Particle miRNA Profile in Uremia Patients. Genes. 9 (11), 533 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved