Method Article
عزل الخلايا الماية الأذينية من الفئران البالغة
In This Article
Summary
يتم استخدام هذا البروتوكول لعزل خلايا القلب الأذينية واحدة من قلب الماوس الكبار باستخدام نهج هضم قطعة. يتم استخدام هذا النهج لعزل الخلايا العضلية الأذينية اليمنى أو اليسرى التي يمكن استخدامها لوصف الفيزيولوجيا الكهربائية للخلايا العضلية الأذينية في دراسات التصحيح المشبك.
Abstract
الخصائص الكهرولوجية للخلايا الاستئصالية الأذينية تؤثر بشكل مهم على وظيفة القلب عموما. يمكن أن تسبب التعديلات في التيارات الأيونية الكامنة المسؤولة عن إمكانية العمل ركائز موالة لاضطراب عدم انتظام ضربات القلب التي تكمن وراء عدم انتظام ضربات القلب، مثل الرجفان الأذيني، والتي تنتشر بشكل كبير في العديد من الحالات وحالات المرض. عزل الخلايا القلبية الأذينية الماوس الكبار لاستخدامها في تجارب التصحيح المشبك قد عززت إلى حد كبير معرفتنا وفهم الفيزيولوجيا الكهربائية الخلوية في عضلة القلب الأذيني صحية وفي وضع الفيزيولوجيا المرضية الأذينية. وبالإضافة إلى ذلك، أوضحت الدراسات التي تستخدم نماذج الماوس الوراثية دور مجموعة واسعة من البروتينات في تنظيم الفيزيولوجيا الكهربائية الأذينية. هنا نقدم بروتوكول مفصل لعزل خلايا القلب من الزوائد الأذينية للفئران البالغة باستخدام مزيج من الهضم الأنزيمي والتفكك الميكانيكي لهذه الأنسجة. هذا النهج ينتج باستمرار وموثوق بها خلايا القلب الأذينية المعزولة التي يمكن استخدامها بعد ذلك لتوصيف الفيزيولوجيا الكهربائية الخلوية عن طريق قياس إمكانات العمل والتيارات الأيونية في تجارب التصحيح المشبك تحت عدد من التجريبية الظروف.
Introduction
الأتريا، والتي هي رقيقة الجدران، وغرف الضغط المنخفض من القلب التي تتلقى الدم من الوريد الأجوف متفوقة وأدنى، فضلا عن الأوردة الرئوية، هي جزء لا يتجزأ من علم وظائف الأعضاء القلبية العادية. مثل مناطق أخرى من القلب، تحتوي الأذينين على عدد من أنواع الخلايا، بما في ذلك خلايا القلب، والخلايا الليفية، والخلايا البطانية، وخلايا العضلات الملساء الوعائية، وغيرها. الخلايا العضلية الأذينية هي الخلايا المنفعلة كهربائيا التي تلعب دورا أساسيا في إجراء الإشارات الكهربائية من خلال القلب، وبالتالي ضمان تقلص الأذيني السليم خلال كل قلب ينبض1. الخلل الكهربائي في الأذين يمكن أن يؤدي إلى عدد من عدم انتظام ضربات القلب الأذيني محددة مثل رفرفة الأذيني والرجفان الأذيني2،3. وهذه المعدلات منتشرة إلى حد كبير، وإن كانت غير مفهومة بشكل جيد، وتؤدي إلى حدوث اعتلال ووفيات كبيرين. يمكن أن يحدث الرجفان الأذيني بالاقتران مع الطفرات الوراثية، بالاشتراك مع الشيخوخة أو فيوضع الأشكال المكتسبة من أمراض القلب، بما في ذلك ارتفاع ضغط الدم، وفشل القلب والسكري 2،4،5 ،6. هذه الشروط يمكن أن تغير الخصائص الكهربائية للخلايا العضلية الأذينية التي يمكن أن تخلق الركيزة التي تزيد من انتشار عدم انتظام ضربات القلب1،2.
الوظيفة الكهربائية العادية في الأذينين، فضلا عن عدم انتظام ضربات القلب الأذيني، تتأثر بشكل كبير من قبل مورفولوجيا إمكانية العمل (AP) المنتجة في الخلايا العضلية الأذينية. يتم إنشاء AP الأذيني من نشاط عدد من التيارات الأيونية، بمافي ذلك تيار الصوديوم (I Na، التي تحملها قنوات NaV1.5)، وتيار الكالسيوم من نوع L (ICa,L، التي يحملها Cav1.2 و CaV1.3 القنوات )، والعديد من تيارات البوتاسيوم بما في ذلك تيار البوتاسيوم المعدل المتأخر فائق السرعة (IKur، الذي يحمله KV1.5 القنوات)، وتيار البوتاسيوم الخارجي العابر (Ito، الذي يحمله KV4.2 و KV4.3 القنوات)، وثبات حالة تيار البوتاسيوم (IKss،التي تحملها KV2.1 قنوات)، وتيار البوتاسيوم المعدل الداخلي (IK1،التي تحملها K الأشعةتحت الحمراء2.1 قنوات)1،7، 8. على الرغم من أنها لا تلعب دورا رئيسيا في الأذين الماوس، والمكونات السريعة والبطيئة من المعدل تأخر K+ الحالي (أناKr وIKs) تسهم أيضا في إعادة استقطاب AP في بعض الأنواع7. التعديلات في واحد أو أكثر من هذه التيارات الأيونية يمكن أن تغير بشكل كبير الخصائص الكهربائية للخلايا العضلية الأذينية، والتي يمكن أن تؤدي إلى عدم انتظام ضربات القلب الأذيني. على سبيل المثال، يمكن أن يؤدي انخفاض في INa إلى إبطاء سرعة التوصيل عبر الأذينين عن طريق تقليل سرعة ضغط الضربات الشديدة AP. من ناحية أخرى، يمكن أن يؤدي انخفاض في إعادة استقطاب تيارات البوتاسيوم أو زيادة في إما أناCa، L أو فيوقت متأخر أناNa في تطوير الاستقطابات afterdeالتي يمكن أن تؤدي إلى نشاط عفوي في الأذين1، 2,9.
من المهم أن ندرك أن هناك اختلافات في مورفولوجيا AP في أجزاء مختلفة من عضلة القلب الأذيني التي من المرجح أن تكون بسبب الاختلافات في التعبير أو تنظيم هذه القنوات أيون الكامنة. على سبيل المثال، تم وصف الاختلافات في مدة AP بين الأذينين الأيمن والأيسر بالاقتران مع الاختلافات في الأولإلى الكثافة الحالية بشكل جيد10،11،12،13. أيضا، لقد أثبتنا مؤخرا أن هناك أنماط متميزة من إعادة عرض الكهربائية في الأذين الأيمن والأيسر من الفئران مع ارتفاع ضغط الدم المزمن6،14. الجدار الخلفي الأذيني الحق يحتوي أيضا على عقدة سينوتريل، التي لديها أنماط متميزة خاصة بها من مورفولوجيا AP وأنماط اطلاقالنار 15. يمكن التحقيق في الخصائص المميزة للخلايا العضلية في كل من هذه الأجزاء المختلفة من الأذينين بالتفصيل باستخدام الخلايا العضلية المعزولة من كل من هذه المناطق.
هناك طرق مختلفة التي يمكن استخدامها لعزل الخلايا العضلية الأذينية لدراسات الفيزيولوجيا الكهربائية التصحيح المشبك16. أحد الاحتمالات هو استخدام نهج التسريب الرجعي حيث يتم تعليب القلب عن طريق الأبهر لتسليم الإنزيمات. في حين أن هذا هو نهج قابل للتطبيق، فإنه يمكن أن تنتج تقلب في نوعية الخلايا العضلية الأذينية بسبب عدم الاتساق في التسريب من الأذينين. لقد اعتمدنا نهج الهضم "قطعة" لعزل الخلايا العضلية الأذينية التي تقضي على الحاجة إلى التسريب الرجعي للقلب. نهجنا يستخدم مزيج من الهضم الأنزيمي والتفكك الميكانيكي للأنسجة الأذينية التي تنتج باستمرار وموثوق بها أعداد كبيرة من الخلايا العضلية الأذينية المعزولة التي هي مناسبة لدراسات التصحيح المشبك. في حين أننا نصف نهجنا هنا باستخدام أنسجة الزائدة الأذينية، يمكن استخدام النهج على أي منطقة من عضلة القلب الأذينية (أي، الزوائد الأذينية اليمنى أو اليسرى، والجدران الحرة، والجدران الخلفية) التي يختارها المحقق. هذا النهج مثالي لدراسات الفيزيولوجيا الكهربائية للخلايا الأتريلفية في الفئران المعدلة وراثيا،في نماذج الماوس من أمراض القلب والأوعية الدموية، أو لدراسة آثار المركبات الدوائية 5،6،17 , 18 سنة , 19.
Protocol
وقد وافقت لجنة رعاية الحيوانات واستخدامها في جامعة كالغاري على جميع الإجراءات الحيوانية، وأجريت وفقا للمبادئ التوجيهية للمجلس الكندي لرعاية الحيوانات. تم الحصول على عزل الخلايا الاستئصالية الأذينية والصور والنتائج التمثيلية الموضحة أدناه من فأر ة من النوع البري C57Bl/6 ذكر يبلغ من العمر 15 أسبوعًا. نستخدم هذا البروتوكول بشكل روتيني لعزل الخلايا المائة الأذينية من الفئران من النوع البري17و18والفئران التي تحمل طفرات جينية19و20 ونماذج الماوس من الأمراض مثل ارتفاع ضغط الدم المزمن6 ، 14. ويمكن استخدام البروتوكول بالمثل للفئران الذكور أو الإناث. كما استعنا نسخة مماثلة من إجراء العزل هذا لعزل العقدة السنوية للخلايا من قلب الماوس17،21،22،23. يوجد مخطط انسيابي لهذا البروتوكول التجريبي في الشكل 1.
1. إعداد حلول المخزون والمعدات
- إعداد 1 طبق تشريح عن طريق إضافة الاستومر سيليكون وفقا لتعليمات الشركة المصنعة. إضافة ما يكفي من مركب الاستومر سيليكون لتغطية الجزء السفلي من طبق بيتري 10 سم إلى عمق 1 سم.
ملاحظة: يمكن إعادة استخدام هذا الطبق تشريح السيليكون لعدة أشهر وتخزينها في درجة حرارة الغرفة. - إعداد 3 ماصات باستور مصقولة بالنار مع فتحة 1 ملم (تتحمل صغيرة)، 3 ملم (تتحمل المتوسطة)، أو 5 ملم (تتحمل كبيرة) في القطر كما هو مبين في الشكل 2A. لجعل هذه الماصات، ويسجل ماصة باستور ومن ثم المفاجئة على طول علامة النتيجة لإنتاج فتحة أكبر قليلا من حجم تتحمل المطلوب. استخدام ملف معدني لتنعيم السطح ومن ثم تلميع النار هذا الافتتاح باستخدام لهب مفتوح.
ملاحظة: وهذا سوف تنتج على نحو سلس، والنار مصقول الحافة مع فتحة من القطر المطلوب. من المهم أن يكون الافتتاح خالياً من الشقوق والأسطح الخشنة. ويمكن تخزين هذه الماصات المصقولة بالنار في درجة حرارة الغرفة وإعادة استخدامها لعدة أشهر. - إعداد حلول الأسهم لحل Tyrode pH 6.9 وحل Tyrode pH 7.4 كما هو موضح في الجدول 1. أيضا إعداد 10 مل كل من1 M MgCl 2, 1 M CaCl2,و 100 mM CaCl2. استخدم الماء النقي للغاية لجميع الحلول واخزنه عند درجة حرارة 4 درجات مئوية لمدة تصل إلى شهرين.
- إعداد 1 لتر من حل Kraft-Brühe المعدل (KB) كما هو مبين في الجدول 2. استخدام المياه فائقة النقاء. تقسيم الحل إلى aliquots 20 مل وتخزينها في -20 درجة مئوية لمدة تصل إلى 2 أشهر.
2. إعداد الحلول وإعداد العزل لعزل الخلايا الاستئصالية الأذينية
- إعداد 50 مل من حل PH 7.4 المعدلة Tyrode كما هو موضح في الجدول 3 في قارورة Erlenmeyer 125 مل، وذلك باستخدام 1 M CaCl2 و 1 M MgCl2 حلول الأسهم. ضع قارورة Erlenmeyer في حمام مائي 35 درجة مئوية حتى الاستخدام، كما هو موضح في الشكل 2B.
- إعداد الحل المعدل ة PH 6.9 Tyrode كما هو موضح في الجدول 4 في أنبوب 50 مل، وذلك باستخدام 100 مل CaCl2 الأوراق المالية الحل. Aliquot 2.5 مل من هذا الحل في كل من ثلاثة أنابيب أسفل جولة 5 مل. ضع هذه الأنابيب في رف سلك يوضع في حمام مائي بزاوية 35 درجة مئوية حتى يتم استخدامه، كما هو موضح في الشكل 2B.
- إعداد محلول الإنزيم كما هو موضح في الجدول 5 في أنبوب أسفل جولة 14 مل. لجعل محلول البروتياز، إضافة 1 ملغ من البروتياز لكل 100 درجة مئوية من المياه فائقة النقاء. ضع الأنبوب الذي يحتوي على هذا الأنزيم في رف الأسلاك واحتضنه في حمام مائي بزاوية 35 درجة مئوية حتى يتم استخدامه.
- إذابة واحدة aliquot من حل KB المعدلة في حمام المياه 35 درجة مئوية. Aliquot 2.5 مل من حل كيلو بايت في كل من ثلاثة أنابيب أسفل جولة 5 مل و 2.5 مل في أنبوب أسفل جولة 14 مل. ضع هذه الأنابيب في رف الأسلاك وحضانة في حمام مائي 35 درجة مئوية حتى الاستخدام، كما هو مبين في الشكل 2B.
- وضع لوحة تشريح، وأدوات تشريح، ماصة باستور، والماصات المصقولة بالنار كما هو مبين في الشكل 2B.
3. تشريح الإلحاق الأذيني الماوس
- حقن الماوس مع 0.2 مل من الهيبارين (10 000 USP U/10 مل) عن طريق الحقن داخل الشبكية والانتظار 5 دقائق للامتصاص.
- وضع الماوس في غرفة التعريفي والتخدير عن طريق استنشاق isoflurane (3-4٪). يتم تسليم الإيسوفيلوران والأكسجين باستخدام آلة مخدرة ويتم مسح النفايات الغاز مخدر. مرة واحدة يتم التخدير الماوس، ولا يظهر رد فعل قرصة اصبع القدم، قتل الماوس عن طريق خلع عنق الرحم السريع. وضع الماوس على منشفة ورقية أو لوحة الفلين والشريط الكفوف وصولا الى عقد الماوس في المكان.
- بلل صدر الفأر مع الإيثانول 70٪. إزالة الفراء والجلد التي تغطي الصدر باستخدام مقص منحني. بعد ذلك، استخدم ملقط أسنان الفئران لرفع القص ثم قطع الحجاب الحاجز على طول حافة الأضلاع. إزالة القفص الصدري بأكمله باستخدام مقص منحني لفضح القلب.
- لإزالة الزائدة الأذينية (يمين أو يسار)، قم برفع الزائدة بلطف باستخدام ملقط تشريح غرامة وقطعها مع مقص الربيع. نقل على الفور الزائدة الأذينية إلى طبق تشريح المغلفة سيليكون تحتوي على 20 مل من الحل المعدلة درجة الحموضة 7.4 في Tyrode الدافئة الموصوفة في الخطوة 2.1.
- وضع دبوس تشريح واحد في الجزء العلوي ودبوس واحد في الجزء السفلي من افتتاح الزائدة الأذينية. باستخدام ماصة المراعي، اغسل الأذينين بمحلول TyH 7.4 المعدل الدافئ لإزالة الدم. فتح الزائدة الأذينية عن طريق قطع على طول الحافة العليا والسفلية من الزائدة الأذيني. بعد ذلك، دبوس زوايا الزائدة الأذينية وصولا الى خلق شقة، قطعة مستطيلة من الأنسجة، كما هو مبين في الشكل 3A.
4. عزل الخلايا الماية الأذينية
ملاحظة: يتم تنفيذ جميع الخطوات في هذا القسم عند 35 درجة مئوية، مع أنابيب مغمورة في حمام مائي 35 درجة مئوية. كن حذرا عند نقل شرائط الأنسجة بين أنابيب القاع جولة لضمان أن يتم نقل الأنسجة فقط (وليس الحل) بين الأنابيب.
- قطع الزائدة الأذينية إلى ما يقرب من 8-10 شرائط متساوية الحجم (حوالي 0.7 ملم في العرض) باستخدام مقص الربيع وملقط غرامة. يظهر مثال على شرائط الأنسجة الأذينية في الشكل 3B. لاحظ أن الشرائط العقد بمجرد قطعها خالية من قطعة رئيسية من الأنسجة. باستخدام ماصة صغيرة ملمعة بالنار، نقل شرائط الأنسجة إلى الأنبوب الأول الذي يحتوي على الحل المعدلة الدافئة Tyrode درجة الحموضة 6.9 الموصوفة في الخطوة 2.2. انتظر 5 دقائق.
- غسل شرائط الأنسجة عن طريق نقلها إلى الثانية ثم أنبوب أسفل الجولة الثالثة التي تحتوي على تعديل حل درجة الحموضة 6.9 Tyrode أعدت في الخطوة 2.2 باستخدام ماصة متوسطة تحمل النار مصقول.
- لغسل شرائط الأنسجة، قم بغطاء الأنبوب السفلي الدائري بـ 5 مل وعكس الأنبوب برفق 3 مرات. السماح شرائط الأنسجة تسوية إلى الجزء السفلي من الأنبوب قبل نقل شرائط الأنسجة إلى الأنبوب التالي باستخدام ماصة متوسطة تحمل النار مصقول.
- نقل شرائط الأنسجة في محلول الإنزيم الموضح في الخطوة 2.3 باستخدام ماصة متوسطة ملمعة بالنار وحضانة لمدة 30 دقيقة.
ملاحظة: في بداية الهضم الأنزيمي ، تستقر شرائط الأنسجة بسرعة بعد الدوران. في حوالي 20 دقيقة من الهضم، تبدأ شرائط الأنسجة في الطفو في الحل الأنزيمي بعد الدوامة. خلال هذا الوقت، شرائط الأنسجة الأذينية تتغير أيضا في المظهر من الوردي الشاحب إلى الأبيض كما يتم هضمها. - بعد الهضم الأنزيمي، قم بإجراء ثلاث عمليات تجميع باستخدام 2.5 مل من محلول كيلو بايت في أنابيب القاع الدائرية 5 مل المعدة في الخطوة 2.4. لكل غسل، عكس بلطف الأنبوب 3 مرات قبل نقل الأنسجة إلى الأنبوب التالي باستخدام ماصة متوسطة ملمعة بالنار. بعد الغسيل النهائي، نقل شرائط في أنبوب أسفل جولة 14 مل تحتوي على 2.5 مل من محلول كيلو بايت. انتظر 5 دقائق.
- تُطوّر الأنسجة بلطف لمدة 7.5 دقيقة باستخدام ماصة مُلمعة بالنار. وهذا سوف ينفصل ميكانيكيا شرائط الأنسجة وتسفر عن حل غائم مليئة الخلايا المائع الأذينية الفردية.
ملاحظة: أثناء التتطر، يصبح النسيج أبيض ويصبح الحل غائمًا. وينبغي أن تكون قوة التتقوى، التي تتحقق عن طريق تغيير تواتر وسرعة طرد شرائط الأنسجة من الماصة الواسعة المصقولة بالنار، مصممة خصيصاً للعزلة الفردية. إذا كان التتطر لطيف جداً، فإن العائد الخلوي سيكون منخفضاً، في حين أن التتطر الذي هو قاس جداً سوف تسفر عن العديد من الخلايا الميتة. تجنب فقاعات في حين triturating. - ملء أنبوب أسفل جولة 14 مل تحتوي على شرائط الأنسجة triturated مع حل كيلو بايت إلى حجم نهائي من 7-10 مل اعتمادا على الكثافة المطلوبة من الخلايا للاستخدام التجريبي. ضع هذا الأنبوب في درجة حرارة الغرفة لمدة 1 ساعة. بعد فترة الحضانة هذه، يمكن استخدام الخلايا لمجموعة متنوعة من التجارب لمدة تصل إلى 7 ح. ويمكن أيضا تخزين الخلايا في 4 درجة مئوية لمدة تصل إلى 7 ساعة.
النتائج
يمكن استخدام الخلايا المابية الأذينية المعزولة باستخدام هذا البروتوكول لتوصيف الخصائص الكهرولوجية لهذه الخلايا باستخدام تقنية التصحيح المشبك. Aliquots من myocytes الأذيني في حل KB يمكن أن تضاف إلى غرفة التسجيل من جهاز التصحيح المشبك القياسية وsuperfused مع الحلول المناسبة لهذا النوع من تسجيل يرغب التجريبية لأداء. يتم استخدام الخلايا العضلية الأذينية المعزولة باستخدام هذا البروتوكول على أفضل وجه للدراسات الفسيولوجية الكهربائية في غضون 6-7 ساعة من العزلة. يتم عرض البيانات التمثيلية التصحيح المشبك من مختبرنا أدناه.
يوضح الشكل 4 أمثلة على خلايا الـ mytrial المعزولة من الفئران العادية التي تم إعدادها باستخدام البروتوكول أعلاه. عادة ما تكون الخلايا العضلية الأذينية المعزولة في حدود 100 ميكرومتر في الطول و10 ميكرومتر في العرض مع تشققات واضحة. السعة من معزولة الخلايا اللاتجريبية هو عادة 40-70 pF.
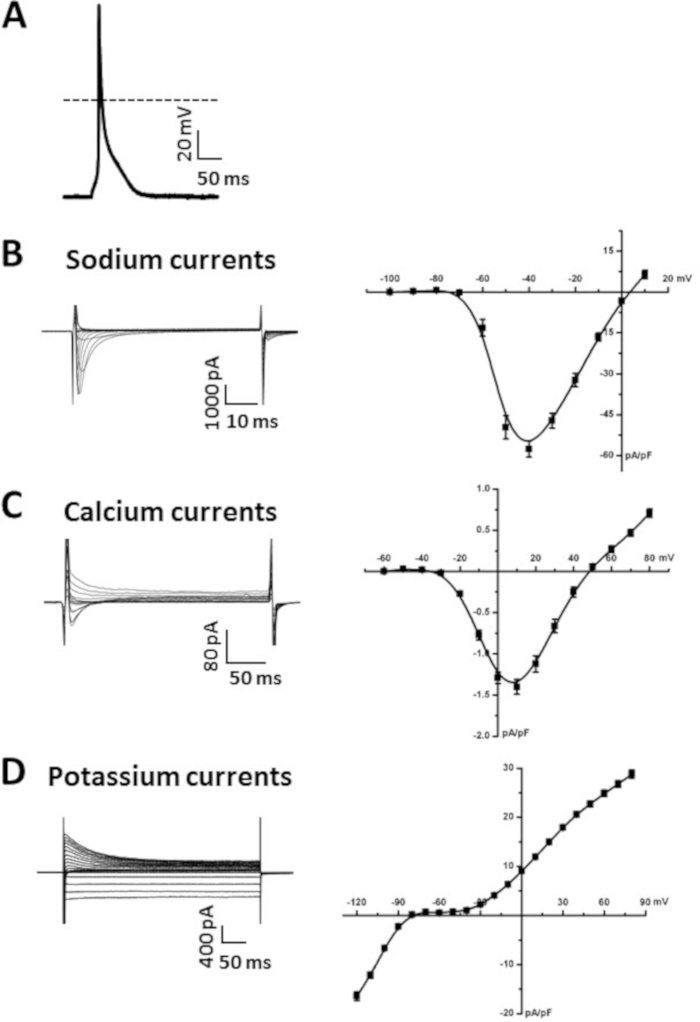
الشكل 5A يوضح مثالا على AP الخلية الأذينية المسجلة باستخدام تقنية مثقبالتصحيح المشبك فيوضع المشبك الحالي، كما سبق وصفنا 6،19،20. وترد في الجدول 6بيانات موجزة توضح المعلمات النموذجية لـ ap للخلايا الأذينية. على وجه التحديد، نقدم بيانات موجزة لقياسات إمكانات غشاء يستريح(RMP)، أقصى سرعة ضغطة فوقية (V ماكس)، تجاوز (نظام التشغيل) ومدة AP في 50٪ (APD50)،70٪ (APD70)و 90٪ (APD90)إعادة الاستقطاب الوقت(الجدول6). يمكن أيضًا تسجيل الـ APs في تكوين الخلية بالكامل14. وتتوفر حلول التسريب والماصات لتسجيل النقاط المائدة في الجدول 7 والجدول 8.
الشكل 5B يوضح عائلة تمثيلية من Na+ التيارات (INa)سجلت في تكوين الخلية بأكملها من تقنية التصحيح المشبك. تم تسجيل هذه التيارات باستخدام 50 مللي خطوة الجهد المشبك بين -100 و +10 ملفي من احتمال عقد من -120 مل في V. لقد وصفنا النهج والبروتوكولات لتسجيل أنانا سابقا6،14،20. ويرد أيضا ً موجز عن العلاقة بين "أنالا الرابع" و"الشكل 5باء". وترد الحلول المستخدمة لتسجيل INa في الجدول 7 والجدول 8.
الشكل 5C يوضح عائلة تمثيلية من التيارات Ca2 + (ICa,L) المسجلة في تكوين الخلية بأكملها من تقنية التصحيح المشبك. تم تسجيل هذه التيارات باستخدام 250 مللي ثانية الجهد المشبك الخطوات بين -60 و +80 مل في V من إمكانية عقد من -70 مل في V. الشروط التجريبية التي يمكن استخدامها لقياسI Ca,L سبق وصفها17,18,20. ويرد أيضا ملخص الأولCa, L IV العلاقة في الشكل 5C. الحلول المستخدمة لتسجيلI Ca,L متوفرة في الجدول 7 والجدول 8.
الشكل 5D يوضح عائلة تمثيلية من K+ التيارات (IK)سجلت في تكوين الخلية بأكملها من تقنية التصحيح المشبك. تم تسجيل هذه التيارات من إمكانات عقد -80 مل فولت باستخدام 500 مللي ثانية الجهد المشبك الخطوات بين -120 مل فولت و +80 مل في، كما وصفنا سابقا6،14. ويرد الموجز الرابع للعلاقة بالنسبة لمجموع IK أيضا في الشكل 5دال. الحلول المستخدمة لتسجيل IK متوفرة في الجدول 7 والجدول 8.
باستخدام هذه النهج لتسجيل APs والأسر الرئيسية من التيارات الأيونية، بما في ذلك Na+، Ca2 + و K+ التيارات (كما هو موضح أعلاه)، يسمح للمحقق لاستجواب صارم الفيزيولوجيا الكهربائية الخلية الأذيني في عدد كبير من الظروف التجريبية. وقد استخدم مختبرنا بشكل روتيني هذه التقنيات لدراسة الفيزيولوجيا الكهربائية للخلايا في الفئرانالعادية، في نماذج الماوس من أمراض القلب، وفي الفئران المعدلة وراثيا 6،14،17،18 ،19،20.

الشكل 1: مخطط انسيابي لبروتوكول عزل الخلايا الأذينية. ملخص الخطوات المستخدمة لعزل الخلايا الاستئصالية الأذينية باستخدام هذا البروتوكول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
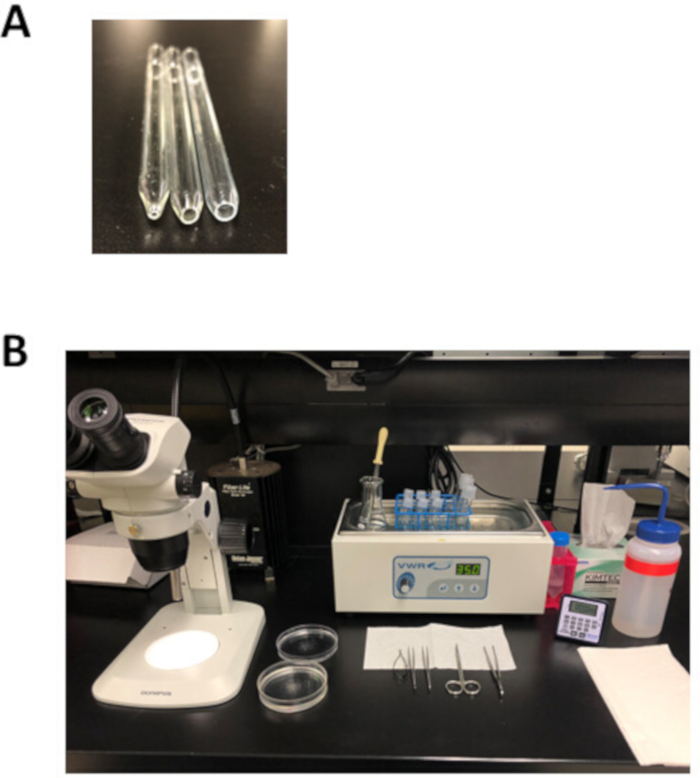
الشكل 2: أدوات الإعداد والتشريح التجريبية لعزل الخلايا الاستئصالية الأذينية. (A). يتم استخدام ماصة صغيرة ملاب النار مصقول مع فتحة 1 ملم في القطر (اليسار) لنقل الأنسجة بعد تشريح، ومتوسطة تتحمل ماصة مصقولة بالنار مع فتحة 3 ملم في القطر (الأوسط) يستخدم لنقل شرائط الأنسجة خلال العزلة، وتحمل كبيرة ماصة مصقولة بالنار مع فتحة 5 ملم في القطر (يمين) يستخدم لtrituration من الأنسجة الأذينية هضمها. (ب). الإعداد التجريبي لعزل الخلية الأذينية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
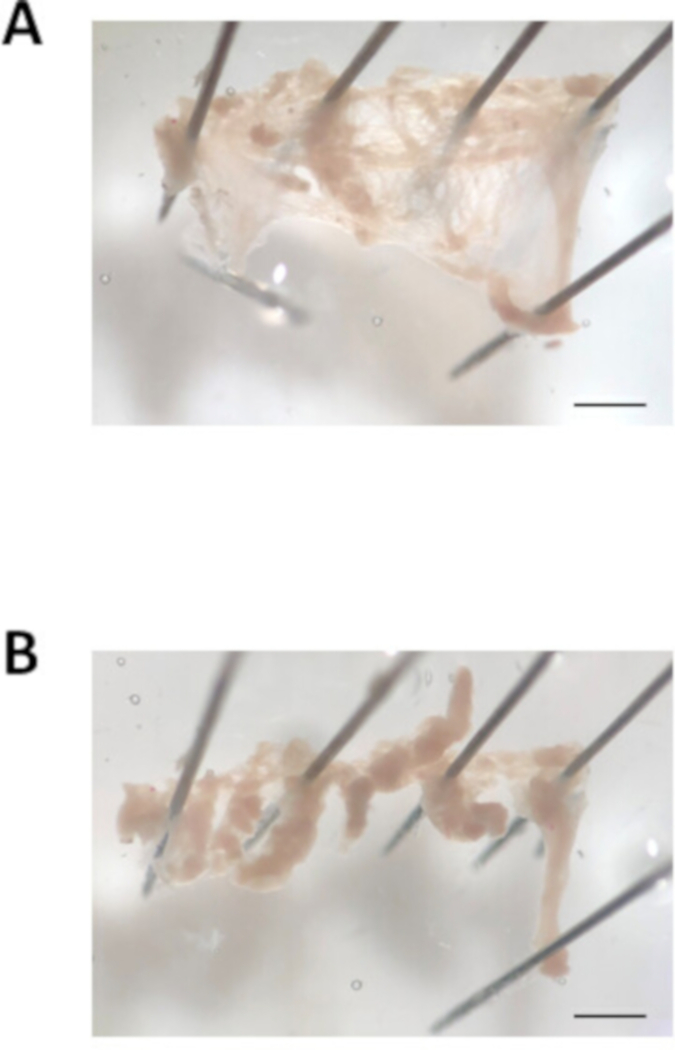
الشكل 3: صورة تشريح الزائدة الأذينية. (A). صورة ميدانية مشرقة ممثل من الزائدة الأذينية المقتطعة قطع مفتوحة ومثبتة. (B). صورة ميدانية مشرقة ممثلة للملحق الأذيني مقطعة إلى شرائح من الأنسجة يبلغ عرضها حوالي 0.7 مم. شريط مقياس = 1 ملم.
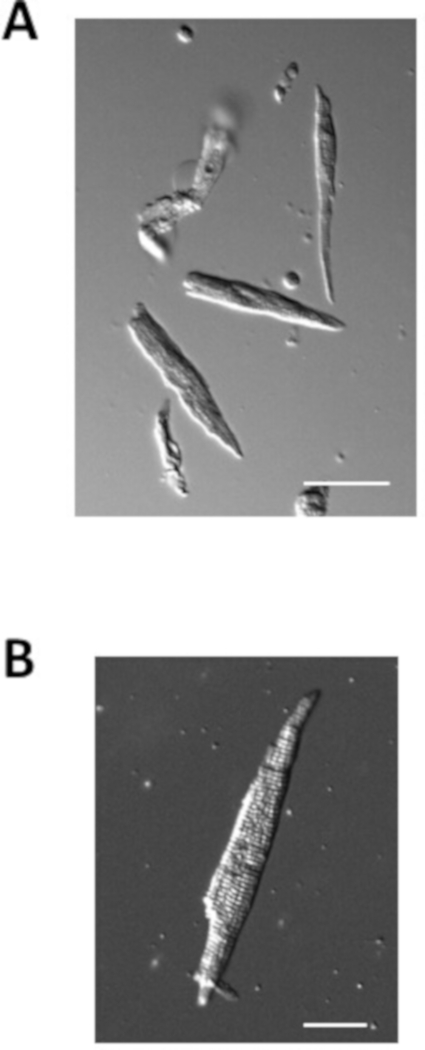
الشكل 4: صور لخلايا الـmyocytes الأذينية المعزولة. (A). صورة برايتفيلد من الخلايا اللامحاكمة معزولة مباشرة بعد العزلة. شريط مقياس = 50 درجة مئوية. صورةبرايتفيلد لـ "أمية" واحدة معزولة شريط مقياس = 100 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: بيانات المشبك المصحح التمثيلي التي تم الحصول عليها من الخلايا العضلية الأذينية المعزولة. (A). حفز ممثل AP تسجيل من myocyte الأذيني معزولة. ويرد موجز لبارامترات AP في الجدول6. تمت إضافة أمفوتيريسين B (200 ميكروغرام/مل) إلى محلول الماصة لنفاذية الغشاء الخلوي. (B). ممثل أناNa التسجيلات (يسار) وملخص الأولNa IV منحنى (يمين) من myocyte الأذيني معزولة. تمت إضافة Nifedipine (10 μM) إلى حل Tyrode المعدلة لمنع أناكاليفورنيا، L عند تسجيل أناNa. C. ممثل ICa, L تسجيلات (يسار) وملخص الأولCa, L IV منحنى (يمين) من myocyte الأذيني معزولة. (D). ممثل IK التسجيلات (يسار) وملخص IK IV منحنى (يمين) من myocyte الأذيني معزولة. وترد الحلول المستخدمة لتسجيل كل من هذه التيارات في الجدول 7 والجدول 8. المنحنيات الموجز الرابع هي قياسات متوسط من 10 خلايا مباحثات الأذينية معزولة عن فأرة من النوع البري C57Bl/6 ذكر عمرها 15 أسبوعاً. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مؤشر بورصة تايرود رقم 6.9 | مؤشر بورصة تايرود رقم الهيدروجيني 7.4 | |
| الكيميائيه | في MM | في MM |
| فى الان | 140 | 140 |
| KCl | 5.4 | 5.4 |
| KH2PO4 | 1.2 | 1.2 |
| HEPES | 5 | 5 |
| المجلد النهائي | 500 مل | 1 لام |
| الحموضة النهائية مع هيدروكسيد الصوديوم | 6.9 | 7.4 |
الجدول 1: الأوراق المالية 7.4 والأسهم Tyrode الحلول الـ 6.9. تكوين الأوراق المالية Tyrode الحلول (درجة الحموضة 7.4 و درجة الحموضة 6.9) التي يمكن إجراؤها مقدما وتخزينها في 4 درجة مئوية لمدة تصل إلى 2 أشهر.
| الكيميائيه | في MM |
| K-غلوتامات | 100 |
| K-aspartate | 10 سنوات |
| KCl | 25 |
| KH2PO4 | 10 سنوات |
| MgSO4 | 2 |
| تورين | 20 |
| Creatine | 5 |
| فى هذا العنونة | 0.5 0.5 |
| الجلوكوز | 20 |
| HEPES | 5 |
| جيش صرب البوسنه | 0.10 في المائة |
| المجلد النهائي | 1 لام |
| الحموضة النهائية مع KOH | 7.2 |
الجدول 2: حل قاعدة المعارف المعدلة. وصفة للحل KB المعدلة التي يمكن إجراؤها مقدما، aliquoted، وتخزينها في -20 درجة مئوية لمدة تصل إلى 2 أشهر.
| الكيميائيه | المبلغ |
| الجلوكوز | 5.55 مليون متر مربع |
| إم جي إل2 | 1 مليون متر مربع |
| كاليفورنيا2 | 1.8 مليون متر مربع |
| مؤشر بورصة تايرود رقم الهيدروجيني 7.4 | 50 مل |
| الهيبارين | 250 ميكرولتر |
الجدول 3: تعديل حل Tyrode الحموضة 7.4 مع الجلوكوز والمغنيسيوم والكالسيوم والهيبارين. تكوين تعديل حل PH 7.4 Tyrode المستخدمة في تشريح الأنسجة الأذينية. وينبغي أن يكون هذا الحل الطازجة والحفاظ عليها في حمام مائي 35 درجة مئوية حتى الاستخدام.
| الكيميائيه | المبلغ |
| الجلوكوز | 18.5 مليون متر مربع |
| تورين | 49.96 متر مربع |
| جيش صرب البوسنه | 15 ملغ |
| كاليفورنيا2 | 0.066 mM |
| مؤشر بورصة تايرود رقم 6.9 | 15 مل |
الجدول 4: حل Tyrode المعدل للدرجة الهيدروجينية 6.9 الذي يحتوي على الجلوكوز والتورين وBSA وانخفاض الكالسيوم. تكوين الحل المعدل ة PH 6.9 من Tyrode المستخدم لعزل الخلايا العضلية الأذينية. وينبغي أن يكون هذا الحل الطازجة والحفاظ عليها في حمام مائي 35 درجة مئوية حتى الاستخدام.
| الكيميائيه | المبلغ |
| كولاجيناز | 1,064 U |
| إيلاستاز | 9 U |
| محلول البروتياز | 65.2 ميكرولتر |
| تعديل معدل ة | 5 مل |
الجدول 5: الحل الأنزيمي. تكوين الحل الأنزيمي المستخدمة لهضم الأنزيمية شرائط الأنسجة الأذينية. وينبغي أن يكون هذا الحل الطازجة والحفاظ عليها في حمام مائي 35 درجة مئوية حتى الاستخدام.
| المعلمه | متوسط |
| RMP (mV) | -74.2 ± 0.7 |
| Vmax (V / S) | 144.6 ± 5.8 |
| نظام التشغيل (mV) | 71.9 ± 3.0 |
| APD50 (مللي ثانية) | 11.1 ± 1.7 |
| APD70 (مللي ثانية) | 23.0 ± 4.6 |
| APD90 (مللي ثانية) | 54.7 ± 7.8 |
الجدول 6: ملخص معلمات AP من الخلايا العضلية الأذينية المعزولة. يتم تقديم البيانات على أنها يعني ± SEM، ن = 10 الخلايا الاستئصالية الأذينية معزولة من 15 أسبوعا الذكور البرية C57Bl/6 الماوس.
| تيارات البوتاسيوم وAPs | تيارات الصوديوم | تيارات الكالسيوم | |
| الكيميائيه | في MM | في MM | في MM |
| فى الان | 140 | 5 | |
| KCl | 5.4 | ||
| إم جي إل 2 | 1 | 1 | 1 |
| CaCl2 | 1 | 1 | 2 |
| HEPES | 10 سنوات | 10 سنوات | 10 سنوات |
| الجلوكوز | 5.5 | 5.5 | 5.5 |
| CsCl | 130 | ||
| تي-كل | 5.4 | 145.5 | |
| الرقم الهيدروجيني | 7.4 مع [نوه] | 7.4 مع [كسوه] | 7.4 مع [كسوه] |
الجدول 7: تكوين حلول Tyrode المستخدمة أثناء تجارب التصحيح المشبك. تكوين حلول Tyrode المستخدمة لتسجيل APs،أنا Na، أناكاليفورنيا،L، وأناK من الخلايا الماتيرية معزولة.
| تيارات البوتاسيوم وAPs | تيارات الصوديوم | تيارات الكالسيوم | |
| الكيميائيه | في MM | في MM | في MM |
| فى الان | 5 | 5 | 5 |
| KCl | 140 | ||
| إم جي إل 2 | 1 | 1 | 1 |
| CaCl2 | 0.2 | 0.2 | 0.2 |
| HEPES | 10 سنوات | 10 سنوات | 10 سنوات |
| فى هذا العنونة | 5 | 5 | |
| ملغ ATP | 4 | 5 | 4 |
| Na-GTP | 0.3 | 0.3 | 0.3 |
| نا فوسفوكرياتين | 6.6 | 6.6 | |
| CsCl | 130 | 135 | |
| BAPTA | 5 | ||
| الرقم الهيدروجيني | 7.2 مع [كوه] | 7.2 مع [كسوه] | 7.2 مع [كسوه] |
الجدول 8: تكوين محلول الماصات الداخلي المستخدم أثناء تجارب المشبك التصحيح. تكوين حلول ملء الماصات المستخدمة لتسجيلAPs، أنا Na، أناكاليفورنيا،L، وأناK من myocytes الأذيني معزولة.
Discussion
يستخدم مختبرنا هذا البروتوكول بشكل روتيني لعزل الخلايا العضلية الأذينية للماوس لاستخدامها في تجارب التصحيح المشبك من أجل التحقيق في آثار أشكال مختلفة من أمراض القلب والأوعية الدموية، والطفرات الوراثية، أو المركبات الدوائية على الخلايا العضلية الأذينية الفيزيولوجيا الكهربائية. على الرغم من أن استنساخ للغاية، ونوعية البيانات التي تم الحصول عليها من myocytes الأذيني المعزول يعتمد على نوعية العزلة. وبالإضافة إلى ذلك، فإن إعادة إدخال الكالسيوم بعد عزل الخلايا الأذينية سيؤدي إلى موت الخلايا لسكان الخلايا المعزولة بسبب مفارقة الكالسيوم16. وبناء على ذلك، فإن عزل الخلايا الاستئصالية القابلة للبقاء والجودة العالية باستخدام هذا النهج يتطلب الممارسة والتحسين في نقاط متعددة في جميع أنحاء العزلة. مرة واحدة الأمثل، ويقدر أن ما بين 70-90٪ من مجموع الخلايا المابية الأذينية المعزولة باستخدام هذا النهج سوف تكون على حد سواء الكالسيوم على شكل قضيب. وترد أدناه مناقشة للخطوات التي تتطلب أقصى قدر من الممارسة والتحسين.
سرعة وكفاءة تشريح سيكون لها آثار المصب على نوعية الخلايا المعزولة. من المهم أن تأخذ بعض الوقت لضمان إزالة جميع الدم من الأنسجة الأذينية وأن يتم قطع شرائط الأنسجة إلى حجم مماثل. وينبغي أن يستغرق ما يقرب من 5 دقائق لإزالة الزائدة الأذينية، وقطع الأنسجة إلى شرائح، ونقل شرائط الأنسجة في الأنبوب الأول من الحل المعدل ة درجة الحموضة 6.9 تايرود. ومع ذلك، إذا كانت هذه الخطوة تستغرق وقتاً طويلاً جداً، قد تتعرض نوعية الأنسجة للخطر.
من المهم أيضا أن يتم قطع شرائط الأنسجة إلى حجم موحد داخل العزلة وبين القلوب. إذا كانت شرائط الأنسجة كبيرة جداً أو صغيرة جداً، أو إذا لم تكن موحدة داخل العزلة، وهذا يمكن أن يسبب مشاكل أثناء كل من الهضم الأنزيمي وtrituration. وذلك لأن شرائط صغيرة سوف تكون أكثر دقة هضمها وشرائط كبيرة سوف تكون تحت هضمها. من المهم بنفس القدر النظر في النمط الجيني والإعداد المرض التي تجري دراستها كما يمكن أن يختلف حجم الزائدة الأذينية بين الحيوانات. على سبيل المثال، القلوب الضخامية لديها الزوائد الأذينية أكبر مقارنة مع قلوب صحية، وبالتالي يمكن للمجرّب قطع المزيد من الشرائط في القلوب الضخامية مقارنة بقلوب الحجم الطبيعي. وبناء على ذلك، فإن تحسين حجم شرائط الأنسجة المقطوعة وتطبيق هذه الأبعاد على كل ملحق الأذيني الفردي ة سيحسن إلى حد كبير من إمكانية استنساخ انعزال الخلايا العضلية بين الظروف التجريبية.
التوازن الدقيق بين الهضم الأنزيمي والتفكك الميكانيكي هو المفتاح لعزل الخلايا الاستئصالية الأذينية الناجحة باستخدام هذا البروتوكول. إذا لم يتم تدوير الأنسجة بشكل كاف خلال الهضم الأنزيمي شرائط الأنسجة الفردية سوف تميل إلى تكتل والعصا معا، والتي سوف تحد من فعالية الهضم الأنزيمي. إذا كان المهتاج في كثير من الأحيان أو بقوة، وهذا يمكن أن تضر الأنسجة الأذينية، والتي سوف تؤدي إلى عزل الخلايا غير القابلة للحياة. التفكك الميكانيكي للخلايا اللاترية المعزولة من شرائط الأنسجة أثناء التطرّف هو الخطوة الأكثر أهمية لممارسة وتحسين استخدام هذا النهج لعزل الخلايا العضلية الأذينية. إذا كان التتطر لطيف جداً، فإن عائد الخلايا سيكون منخفضاً. من ناحية أخرى، إذا كان التتثثير قاسية جدا، ثم سيتم عزل وفرة من الخلايا العضلية غير قابلة للحياة، ونوعية البيانات التي تم الحصول عليها خلال تجارب التصحيح المشبك سوف تتعرض للخطر. وبالإضافة إلى ذلك، يمكن أن يؤثر تكوين الأذينين على العزلة. على سبيل المثال، إذا كانت الأنسجة ليفية، قد تحتاج إلى تعديل الهضم الأنزيمي وخطوات التقرحات. ولذلك من المهم أن تأخذ من الوقت لتطوير المهارات اللازمة للحصول على خلايا ذات جودة عالية أثناء trituration التي يمكن استخدامها لتجارب التصحيح المشبك.
كما هو الحال مع جميع التقنيات التجريبية هناك قيود. هذه التقنية تتطلب الممارسة من أجل عزل reproducibly قابلة للحياة، والخلايا العضلية ذات جودة عالية، والتي بدورها سوف تؤثر على جدوى أي تجارب التي يتعين إجراؤها باستخدام هذه الخلايا العضلية. هذا النهج هو أيضا الطرفية والخلايا الاستئصالية الأذينية معزولة باستخدام هذا النهج يمكن استخدامها في يوم العزلة فقط. يستخدم مختبرنا الخلايا ضمن 6-7 ساعة من العزلة.
هذا النهج من عزل خلايا القلب الأذينية لديها العديد من التطبيقات. على سبيل المثال، يمكن تعديل هذا النهج لعزل الخلايا العضلية الأذينية (وكذلك الخلايا الليفية القلبية) عن الأنواع الأخرى بما في ذلك الخزعات الأنسجة الأذينية البشرية. وبالإضافة إلى ذلك، فائدة لاستخدام هذه الطريقة قطعة لعزل الخلايا الاستئصالية الأذينية (على النقيض من التسريب الرجعي للقلب) هو أنه يمكن تعديلها لعزل خلايا القلب من مناطق أخرى من القلب، مثل العقدة سينوتريل أو مناطق محددة أخرى من عضلة القلب الأذيني، أو تشمل المنطقة فوق البطينية بأكملها من القلب. يستخدم مختبرنا خلايا القلب الأذينية لتجارب التصحيح المشبك لقياس إمكانات العمل والتيارات الأيونية، على الرغم من أن هذا النهج لا ينبغي أن يقتصر على هذه التقنية. على سبيل المثال، يمكن استخدام الخلايا العضلية المعزولة للتحقيق في التعديلات في عابري الكالسيوم والانقباض في مجموعة متنوعة من الإعدادات التجريبية. كما يمكن استخدام خلايا القلب الأذينية في دراسات الفلورة المناعية لدراسة موقع البروتينات أو الهياكل ذات الأهمية. وبناء على ذلك، فإن هذا النهج متعدد الاستخدامات للغاية مع العديد من التطبيقات الممكنة.
Disclosures
ولا يتعين على أصحاب البلاغ أن يكشفوا عن أي شيء.
Acknowledgements
ويدعم هذا العمل منح تشغيلية من المعاهد الكندية للبحوث الصحية (MOP 93718, 142486) ومؤسسة القلب والسكتة الدماغية الكندية إلى R.A. Rose. ه. ج. جانسن هو حاصل على زمالة كيلام ما بعد الدكتوراه.
Materials
| Name | Company | Catalog Number | Comments |
| 1, 2-Bis(2-Aminophenoxy)ethane-N, N, N', N'-tetraacetic acid 98% | Sigma | A4926-1G | |
| Adenosine 5'-triphosphate disodium salt hydrate BioXtra, > 99%, from microbial | Sigma | A7699-1G | |
| Adenosine 5'-triphosphate magnesium salt > 95%, bacterial | Sigma | A9187-1G | |
| Amphocetericin B from Streptomyces sp. ~80% (HPLC), powder | Sigma | A4888-500 MG | |
| Bovine serum albumin | Sigma | A3059-50G | |
| Calcium chloride dihydrate | Sigma | 223506-500G | |
| Cesium chloride ReagentPlus, 99.9% | Sigma | 289329-100G | |
| Cesium hydroxide monohydrate > 99.5% trace metals basis | Sigma | 562505-1KG | |
| Collagenase Type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine anhydrous | Sigma | C0780 | |
| D-(+)-Glucose | Sigma | G7021-1KG | |
| DL-Aspartic acid potassium salt | Sigma | A2025-100G | |
| Elastase suspension | Worthington Biochemical Corporation | LS002279 | |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid >97.0% | Sigma | E4378-25G | |
| Guanosine 5'-triphosphate sodium salt hydrate > 95% (HPLC), powder | Sigma | G8877-250MG | |
| Heparin 10 000 USP units/10mL | SANDOZ | 10750 | |
| HEPES > 99.5% (titration) | Sigma | H3375-500G | |
| L-Glutamic acid potassium salt monohydrate > 99% (HPLC), powder | Sigma | G1501-500G | |
| Magnesium sulfate | Sigma | M2643-500G | |
| Nifedipine > 98% (HPLC), powder | Sigma | N7634-1G | |
| Phosphocreatine disodium salt hydrate enzymatic, approx 98% | Sigma | P7936-5G | |
| Potassium chloride ACS reagent, 99.0-100.5% | Sigma | P3911-500G | |
| Potassium hydroxide | EM Science | PX1480-1 | |
| Potassium phosphate monobasic | EMD | PX1565-1 | |
| Protease from Streptomyces griseus, type XIV, >3.5 units/mg solid, powder | Sigma | P5147-1G | |
| Sodium chloride ACS reagent, > 99.0% | Sigma | S9888-2.5KG | |
| Sodium hydroxide, pellets, 97+%, A.C.S. reagent | Sigma | 221465-500G | |
| Sylgard 184 silicone elastomer kit | World Precision Instruments Inc | SYLG184 | |
| Taurine | Sigma | T0625-100G | |
| Tetraethylammonium chloride > 98% (titration) | Sigma | T2265-100G |
References
- Bartos, D. C., Grandi, E., Ripplinger, C. M. Ion Channels in the Heart. Comprehensive Physiology. 5 (3), 1423-1464 (2015).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circulation Research. 114 (9), 1483-1499 (2014).
- Jalife, J. Mechanisms of persistent atrial fibrillation. Current Opinion in Cardiology. 29 (1), 20-27 (2014).
- Nattel, S., Maguy, A., Le Bouter, S., Yeh, Y. H. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation. Physiological Reviews. 87 (2), 425-456 (2007).
- Jansen, H. J., et al. Atrial structure, function and arrhythmogenesis in aged and frail mice. Scientific Reports. 7, 44336 (2017).
- Jansen, H. J., et al. Distinct patterns of atrial electrical and structural remodeling in angiotensin II mediated atrial fibrillation. Journal of Molecular and Cellular Cardiology. 124, 12-25 (2018).
- Nerbonne, J. M., Kass, R. S. Molecular physiology of cardiac repolarization. Physiological Reviews. 85 (4), 1205-1253 (2005).
- Grant, A. O. Cardiac ion channels. Circulalation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Schmitt, N., Grunnet, M., Olesen, S. P. Cardiac potassium channel subtypes: new roles in repolarization and arrhythmia. Physiological Reviews. 94 (2), 609-653 (2014).
- Lomax, A. E., Kondo, C. S., Giles, W. R. Comparison of time- and voltage-dependent K+ currents in myocytes from left and right atria of adult mice. American Journal of Physiology Heart and Circulatory Physiology. 285 (5), H1837-H1848 (2003).
- Li, D., Zhang, L., Kneller, J., Nattel, S. Potential ionic mechanism for repolarization differences between canine right and left atrium. Circ Res. 88 (11), 1168-1175 (2001).
- Wirth, K. J., Knobloch, K. Differential effects of dofetilide, amiodarone, and class lc drugs on left and right atrial refractoriness and left atrial vulnerability in pigs. Naunyn Schmiedebergs Archives of Pharmacology. 363 (2), 166-174 (2001).
- Qi, A., Yeung-Lai-Wah, J. A., Xiao, J., Kerr, C. R. Regional differences in rabbit atrial repolarization: importance of transient outward current. American Journal of Physiology. 266 (2 Pt 2), H643-H649 (1994).
- Jansen, H. J., et al. NPR-C (Natriuretic Peptide Receptor-C) Modulates the Progression of Angiotensin II-Mediated Atrial Fibrillation and Atrial Remodeling in Mice. Circulation: Arrhythmia and Electrophysiology. 12 (1), e006863 (2019).
- Mangoni, M. E., Nargeot, J. Genesis and regulation of the heart automaticity. Physiological Reviews. 88 (3), 919-982 (2008).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Springer, J., et al. The natriuretic peptides BNP and CNP increase heart rate and electrical conduction by stimulating ionic currents in the sinoatrial node and atrial myocardium following activation of guanylyl cyclase-linked natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 52 (5), 1122-1134 (2012).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. A. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PLoS One. 7 (10), e47652 (2012).
- Egom, E. E., et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. Journal of Physiology. 593 (5), 1127-1146 (2015).
- Hua, R., et al. Effects of Wild-Type and Mutant Forms of Atrial Natriuretic Peptide on Atrial Electrophysiology and Arrhythmogenesis. Circulation: Arrhythmia and Electrophysiology. 8 (5), 1240-1254 (2015).
- Krishnaswamy, P. S., et al. Altered parasympathetic nervous system regulation of the sinoatrial node in Akita diabetic mice. Journal of Molecular and Cellular Cardiology. 82, 125-135 (2015).
- Mackasey, M., et al. Natriuretic peptide receptor C (NPR-C) protects against angiotensin II mediated sinoatrial disease in mice. JACC Basic to Translational Science. , (2018).
- Azer, J., Hua, R., Vella, K., Rose, R. A. Natriuretic peptides regulate heart rate and sinoatrial node function by activating multiple natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 53 (5), 715-724 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved