Method Article
성인 마우스에서 심방 근세포의 격리
요약
이 프로토콜은 청크 소화 접근법을 사용하여 성인 마우스 심장으로부터 단일 심방 심근세포를 분리하는 데 사용됩니다. 이 접근법은 패치 클램프 연구에서 심방 근세포 전기 생리학을 특성화하는 데 사용할 수 있는 우측 또는 좌심방 근세포를 분리하는 데 사용됩니다.
초록
심방 근세포의 전기 생리학적 특성은 전반적인 심장 기능에 중요한 영향을 미칩니다. 활동 잠재력에 책임 있는 근본적인 이온 전류에 있는 변경은 많은 조건 및 질병 상태에서 높게 널리 퍼진 심방 세동과 같은 부정맥의 밑에 있는 pro 부정맥 기판을 일으키는 원인이 될 수 있습니다. 패치 클램프 실험에 사용하기 위해 성인 마우스 심방 심근 세포체를 분리하는 것은 건강한 심방 심근과 심방 병리생리학의 설정에서 세포 전기 생리학에 대한 우리의 지식과 이해를 크게 발전시켰습니다. 추가로, 유전 마우스 모형을 사용하여 연구 결과는 심방 전기 생리학통제에 있는 단백질의 광대한 배열의 역할을 설명했습니다. 여기에서 우리는 이 조직의 효소 소화 그리고 기계적인 해리의 조합을 사용하여 성인 마우스의 심방 부속물에서 심근세포의 격리를 위한 상세한 프로토콜을 제공합니다. 이 접근법은 일관되고 안정적으로 고립된 심방 심근구를 생성하여 여러 실험하에 패치 클램프 실험에서 작용 전위 및 이온 전류를 측정하여 세포 전기 생리학을 특성화하는 데 사용할 수 있습니다. 조건.
서문
심방은 우수하고 열등한 정맥뿐만 아니라 폐 정맥에서 혈액을 받는 심장의 얇은 벽, 저압 챔버이며 정상적인 심장 생리학에 필수적입니다. 심혼의 그밖 지구 같이, 심방은 심근세포, 섬유아세포, 내피 세포, 혈관 평활근 세포 및 그 외를 포함하여 세포 모형의 수를 포함합니다. 심방 근세포는 심장을 통한 전기 신호의 전도에 필수적인 역할을 하는 전기적으로 흥분되는 세포로서, 각 심장 박동1동안 적절한 심방 수축을 보장합니다. 심방의 전기 기능 장애는 심방 펄터 및 심방 세동과 같은 심방 특정 부정맥의 수로 이어질 수있습니다2,3. 이들은 매우 널리 퍼짐, 아직 제대로 이해, 상당한 사망률과 사망률로 이어지는 심방 부정맥. 심방 세동은 유전 적 돌연변이와 관련하여, 노화와 관련하여 또는 고혈압, 심부전 및 당뇨병을 포함한후천적 인 형태의 심장 질환의 설정에서 발생할 수 있습니다 2,4,5 ,6. 이러한 조건은 부정맥 발생의 유병률을 증가시키는 기질을 생성할 수 있는 심방근세포의 전기적 특성을 변경할 수 있다 1,2.
심방 부정맥 발생뿐만 아니라 심방의 정상적인 전기 적 기능은 심방 근세포에서 생성 되는 행동 전위 (AP)의 형태에 의해 중요하게 영향을받습니다. 심방 AP는 나트륨 전류(INa,Na 1.5 채널에 의해 운반됨),L형 칼슘 전류(ICa,L, Cav1.2 및 CaV1.3 채널에 의해 운반됨)를 포함한 다수의 이온 전류의 활성으로부터 생성된다. ), 초고속 지연 정류기 칼륨 전류(IKur,KV1.5 채널로 운반), 일시적인 외부 칼륨 전류(Ito, KV4.2 및 KV4.3에 의해 운반됨) 등 여러 칼륨 전류 채널), 정상 상태 칼륨 전류 (IKss,KV2.1 채널에 의해 수행), 및 내부 정류기 칼륨 전류 (IK1,Kir2.1 채널에 의해 수행)1,7 ,7, 8. 그들은 마우스 심트리아에서 중요한 역할을하지 않지만, 지연 정류기 K+ 전류의 신속하고 느린 구성 요소 (IKr 및 IKs)또한 일부 종7에서AP 재분극에 기여한다. 이러한 이온 전류 중 하나 이상의 변화는 심방 심근 세포의 전기적 특성을 크게 변화시킬 수 있으며, 이는 심방 부정맥으로 이어질 수 있습니다. 예를 들어, INa의 감소는 AP 업스트로크 속도를 줄임으로써 심미국 전체의 전도 속도를 느리게 할 수 있습니다. 한편, 칼륨 전류의 재분극 감소 또는 ICa, L 또는 후기 INa의 증가는 심방1에서 자발적인 활동을 유발할 수 있는 분과분극의 발달을 초래할 수 있다. 2,9.
이러한 기본 이온 채널의 발현 또는 조절의 차이로 인해 심방 심근의 다른 부분에 AP 형태에 차이가 있음을 인식하는 것이 중요합니다. 예를 들어, 현재 밀도에 대한 I의 차이와 관련하여 좌우 심트리아 사이의 AP 지속 시간 차이는10,11,12,13을잘 기재되어 있다. 또한, 최근에는 만성 고혈압6,14를가진 마우스의 좌우 심증에 전기 리모델링의 뚜렷한 패턴이 있음을 입증했습니다. 오른쪽 심방 후방 벽에는 AP 형태와 발사 패턴15의고유한 패턴이있는 심방 노드가 포함되어 있습니다. 심방의 이 다른 부분의 각각에 있는 myocytes의 명백한 속성은 이 지구의 각각에서 고립된 myocytes를 사용하여 상세히 조사될 수 있습니다.
패치 클램프 전기 생리학 연구16에대한 심방 근세포를 분리하는 데 사용할 수있는 다른 접근법이 있다. 한 가지 가능성은 심장이 효소의 전달을 위해 대류를 통해 절제되는 역행 관류 접근법을 사용하는 것입니다. 이것은 실행 가능한 접근하는 동안, 그것은 심방 근세포 질에 있는 가변성을 심방의 관류에 있는 불일치 때문에 생성할 수 있습니다. 우리는 심방 근세포의 격리를 위한 '덩어리' 소화 접근법을 채택하여 심장의 역행 관류의 필요성을 제거합니다. 우리의 접근 방식은 항문 산화와 심방 조직의 기계적 해리의 조합을 사용하여 패치 클램프 연구에 적합한 많은 수의 단고심 심근 세포가 일관되고 안정적으로 산출합니다. 우리는 심방 부속기 조직을 사용하여 여기에서 우리의 접근을 기술하는 동안, 접근은 조사자가 선택하는 심방 심근의 어떤 지역든지에 사용될 수 있습니다 (즉, 오른쪽 또는 왼쪽 심방 부속기, 자유로운 벽, 후방 벽). 이 접근법은 유전자 변형 마우스의 심방 근세포 전기생리학, 심혈관 질환의 마우스 모델 또는 약리화합물 5,6,17의 효과를 연구하는 데 이상적입니다. , 18세 , 19.
프로토콜
모든 동물 절차는 캘거리 대학 동물 관리 및 사용 위원회의 승인을 받았으며 캐나다 동물 관리 위원회의 지침에 따라 수행되었습니다. 아래에 기술된 심방 근세포 격리, 이미지 및 대표적인 결과는 15주령의 남성 야생형 C57Bl/6 마우스로부터 얻어졌다. 우리는 정기적으로 야생형 마우스17,18,유전 돌연변이를 운반하는 마우스19,20 및 만성 고혈압과 같은 질병의 마우스 모델에서 심방 myocytes를 분리하기 위하여 이 프로토콜을 이용합니다6, 14. 프로토콜은 남성 또는 암컷 마우스에 대해 유사하게 사용될 수 있다. 우리는 또한 마우스 심혼17,21, 22,23에서중방 노드 근세포를 격리하기 위하여 이 격리 절차의 유사한 버전을 이용했습니다. 이 실험 프로토콜의 순서도는 그림1에 있습니다.
1. 재고 솔루션 및 장비 준비
- 제조업체의 지침에 따라 실리콘 엘라스토머를 추가하여 해부 접시 1개준비합니다. 10cm 페트리 접시의 바닥을 1cm 깊이로 덮을 만큼 충분한 실리콘 엘라스토머 화합물을 추가합니다.
참고: 이 실리콘 해부 접시는 몇 달 동안 재사용할 수 있으며 실온에서 보관할 수 있습니다. - 그림 2A와같이 직경 1mm(소형 보어), 3mm(중형 보어) 또는 직경 5mm(대형 보어)의 개구부로 3개의 화재 광택 파스퇴르 파이펫을 준비합니다. 이러한 파이펫을 만들려면 파스퇴르 피펫을 채점한 다음 점수 표시를 따라 스냅하여 원하는 보어 크기보다 약간 큰 개구부를 생성합니다. 금속 파일을 사용하여 표면을 부드럽게 한 다음 화염을 사용하여 이 개구부를 연마합니다.
참고: 이것은 원하는 직경의 개구부와 부드러운, 화재 광택 가장자리를 생성합니다. 개구부가 균열과 거친 표면이 없는 것이 중요합니다. 이 화재 광택 파이펫은 실온에서 보관하고 몇 달 동안 재사용할 수 있습니다. - 표1에 나열된 Tyrode의 pH 6.9 솔루션 및 Tyrode의 pH 7.4 솔루션에 대한 재고 솔루션을 준비합니다. 또한 1M MgCl 2, 1M CaCl2,및 100 mM CaCl 2 각각 10 mL을 준비합니다. 모든 용액에 초순수를 사용하고 최대 2개월 동안 4°C에 보관하십시오.
- 표2에 나타낸 대로 수정된 크래프트-브뤼허(KB) 용액 1L을 준비합니다. 초순수를 사용하십시오. 용액을 20 mL aliquots로 나누고 -20 °C에서 최대 2 개월 동안 보관하십시오.
2. 심방 근세포 격리를 위한 솔루션 및 절연 설정 준비
- 1M CaCl2 및 1 MgCl 2 스톡 솔루션을 사용하여 125 mL Erlenmeyer 플라스크에서 표 3에 설명된 대로 수정된 Tyrode의 pH 7.4 용액의 50 mL를 준비합니다. 그림 2B와같이 사용 될 때까지 35 °C 수조에 Erlenmeyer 플라스크를 놓습니다.
- 100 mM CaCl2 스톡 용액을 사용하여 50 mL 튜브에서 표 4에 기재된 바와 같이 변형된 Tyrode의 pH 6.9 용액을 준비한다. 이 용액의 2.5 mL을 3 개의 5 mL 둥근 바닥 튜브 각각에 Aliquot. 그림 2B와같이 사용 될 때까지 35 °C 수조에 배치 와이어 랙에이 튜브를 배치합니다.
- 14 mL 원형 하부 튜브에서 표 5에 기재된 바와 같이 효소 용액을 준비한다. 프로테아제 용액을 만들려면 초순수 100 μL당 프로테아제 1 mg을 추가하십시오. 이 효소 용액을 함유한 튜브를 와이어 랙에 놓고 사용 될 때까지 35 °C 수조에서 배양하십시오.
- 35°C 수조에서 변형된 KB 용액의 하나의 알리쿼트를 해동합니다. Kb 용액의 Aliquot 2.5 mL는 각각 3개의 5 mL 라운드 바닥 튜브및 2.5 mL를 14 mL 라운드 바닥 튜브로 넣습니다. 도 2B와같이 이러한 튜브를 와이어 랙에 놓고 사용 될 때까지 35 °C 수조에서 배양하십시오.
- 그림 2B에표시된 대로 해부 플레이트, 해부 도구, 파스퇴르 파이펫 및 화재 광택 파이펫을 배치합니다.
3. 마우스 심방 부속물의 해부 (들)
- 복강 내 주사를 통해 0.2 mL의 헤파린 (10 000 USP U/ 10 mL)으로 마우스를 주입하고 흡수를 위해 5 분 기다립니다.
- 유도 챔버에 마우스를 놓고 이소플루란 흡입 (3-4 %)에 의해 마취. 이소플루란과 산소는 마취기계를 사용하여 전달되고 폐마취가스는 폐기된다. 일단 마우스가 마취되고, 발가락 핀치 반사를 나타내지 않는 것은, 빠른 자궁 경부 탈구에 의해 마우스를 안락사시. 종이 타월이나 코르크 보드에 마우스를 놓고 발을 테이프로 붙이면 마우스를 제자리에 고정시됩니다.
- 마우스가슴을 70% 에탄올로 적시다. 구부러진 가위를 사용하여 가슴을 덮는 털과 피부를 제거합니다. 다음으로, 쥐 의자 집게를 사용하여 흉골을 들어 올린 다음 갈비뼈 가장자리를 따라 횡격막을 자른다. 곡선가위를 사용하여 흉곽 전체를 제거하여 심장을 노출시다.
- 심방 부속물(오른쪽 또는 왼쪽)을 제거하려면 미세해부를 사용하여 부속기를 부드럽게 들어 올리고 스프링 가위로 잘라냅니다. 2.1단계에서 기재된 온난한 Tyrode의 pH 7.4 용액의 20 mL를 함유하는 실리콘 코팅 해부 접시에 즉시 심방 부속기를 옮니다.
- 해부 핀 을 위쪽에 놓고 심방 부속기의 개구부 하단에 하나의 핀을 놓습니다. 목초지 파이펫을 사용하여, 혈액을 제거하기 위해 따뜻하게 수정 된 Tyrode의 pH 7.4 용액으로 심토리를 플러시. 심방 부속기의 위쪽 및 아래쪽 가장자리를 따라 절단하여 심방 부속기열기. 다음으로, 그림 3A와같이 심방 부속기의 모서리를 아래로 고정하여 평평한 직사각형 조직 조각을 만듭니다.
4. 심방 근세포의 격리
참고: 이 섹션의 단계는 모두 35 °C에서 수행되며 튜브는 35 ° C 수조에 잠겼습니다. 둥근 바닥 튜브 사이에 조직 스트립을 옮길 때 는 조직 (용액이 아닌)만 튜브 간에 전달되도록주의하십시오.
- 스프링 가위와 미세 집게를 사용하여 심방 부속기를 약 8-10 개의 동일한 크기의 스트립 (폭 약 0.7mm)으로 자른다. 심방 조직의 스트립의 예는 도 3B에도시되어 있다. 그들은 조직의 주요 조각에서 무료로 절단되면 스트립 계약. 작은 보어 불 광택 파이펫을 사용하여, 2.2 단계에서 설명한 온난변형 Tyrode의 pH 6.9 용액을 포함하는 첫 번째 튜브로 조직 스트립을 전달한다. 5분 기다립니다.
- 조직 스트립을 2차 및 제3 원형 바닥 튜브로 이송한 다음, 중간 보어 불 광택 피펫을 사용하여 2.2단계에서 제조된 Tyrode의 pH 6.9 용액을 함유하는 제3 라운드 하단 튜브를 세척한다.
- 티슈 스트립을 세척하려면 5 mL 둥근 바닥 튜브를 캡하고 튜브를 3 번 부드럽게 반전시다. 조직 스트립이 중간 구멍 화재 광택 피펫을 사용하여 다음 튜브로 조직 스트립을 전송하기 전에 튜브의 바닥에 정착시키십시오.
- 2.3단계에서 설명한 효소 용액으로 조직 스트립을 옮기고 중간 보어 불 광택 피펫을 사용하여 30분 동안 배양합니다.
참고: 효소 소화의 시작 부분에서, 조직 스트립 소용돌이 다음 신속 하 게 정착. 소화의 대략 20 분에서, 조직 스트립은 소용돌이 다음 효소 용액에서 떠 다니기 시작합니다. 이 시간 동안, 심방 조직 스트립은 또한 소화될 때 옅은 분홍색에서 백색으로 외관에 변화합니다. - 효소 소화 후, 2.4단계에서 제조된 5 mL 라운드 하단 튜브에서 2.5 mL의 KB 용액을 사용하여 3개의 세차서를 수행한다. 각 세척의 경우, 중간 보어 화재 연마 피펫을 사용하여 다음 튜브로 조직을 이동하기 전에 튜브를 3 번 부드럽게 반전시다. 최종 세척 후, KB 용액의 2.5 mL를 포함하는 14 mL 둥근 바닥 튜브로 스트립을 옮김. 5분 기다립니다.
- 와이드 보어 화재 연마 피펫을 사용하여 7.5 분 동안 조직을 부드럽게 삼분화하십시오. 이것은 기계적으로 조직 스트립을 해리하고 개별 심방 근세포로 채워진 흐린 해결책을 산출할 것입니다.
참고: 삼조 중에 조직이 하얗게되고 용액이 흐리게됩니다. 넓은 보어 화재 연마 파이펫에서 조직 스트립을 추방하는 주파수와 속도를 모두 변경하여 달성 삼중의 힘은 개별 절연에 맞게조정되어야한다. 삼조가 너무 온화하면 세포 수율이 낮아지며 너무 가혹한 삼조는 많은 죽은 세포를 생성합니다. 삼중화하는 동안 거품을 피하십시오. - 실험용 세포밀도에 따라 7-10 mL의 최종 부피에 KB 용액으로 삼중 조직 스트립을 함유하는 14 mL 둥근 바닥 튜브를 채웁니다. 이 튜브를 실온에서 1시간 동안 놓습니다. 이러한 잠복기에 따라, 세포는 최대 7시간 동안 다양한 실험을 위해 사용될 수 있다.
결과
이 프로토콜을 사용하여 단리된 심방 근세포는 패치 클램프 기술을 사용하여 이들 세포의 전기생리학적 특성을 특성화하는데 사용될 수 있다. KB 용액에서 심방 근세포의 Aliquots는 표준 패치 클램프 장치의 기록 챔버에 첨가될 수 있고 실험가가 수행하고자 하는 기록의 종류에 적합한 용액으로 과급될 수 있다. 이 프로토콜을 사용하여 분리된 심방 근세포는 6-7시간 이내에 전기 생리학 연구에 가장 잘 사용됩니다. 당사 실험실의 대표적인 패치 클램프 데이터는 아래에 제시되어 있습니다.
도 4는 상기 프로토콜을 사용하여 제조된 정상 마우스로부터의 분리된 심방 근세포의 예를 나타낸다. 분리된 심방 근세포는 일반적으로 길이가 100 μm이고 너비가 10 μm이며 명확한 줄무늬가 있습니다. 분리된 심방 근세포의 정전 용량은 전형적으로 40-70 pF입니다.
도 5A는 앞서 6,19,20에대해 설명한 바와 같이, 현재 클램프 모드에서 천포된 패치 클램프 기술을 사용하여 기록된 심방 근세포 AP의 예를 도시한다. 일반적인 심방 근세포 AP 파라미터를 예시하는 요약 데이터는 표6에 제공된다. 구체적으로, 우리는 50 %(APD50),70 %(APD70)및 90 % (APD90)재분극에서 휴식 멤브레인 전위 (RMP), 최대 업 스트로크 속도 (V최대),오버 슈트 (OS) 및 AP 지속 시간의 측정을위한 요약 데이터를 제시 시간(표 6)을 참조하십시오. AP는 또한 전체 셀구성(14)에기록될 수 있다. AP 를 기록하기 위한 수퍼퓨전 및 파이펫 솔루션은 표 7 및 표8에서 사용할 수 있습니다.
도 5B는 패치 클램프 기술의 전체 셀 구성에 기록된 Na+전류(I Na)의 대표적인 패밀리를 도시한다. 이러한 전류는 -120 mV의 유지 전위로부터 -100과 +10 mV 사이의 50 ms 전압 클램프 단계를 사용하여 기록되었습니다. 우리는 이전에 6,14,20기록 INa에 대한 접근 방식과 프로토콜을 설명했다 . 요약 INa IV 관계는 도 5B에도나와 있다. I Na를 기록하는 데 사용되는 솔루션은 표 7 및 표8에 나와 있습니다.
도 5C는 패치 클램프 기술의 전체 셀 구성에 기록된 Ca2+ 전류(ICa,L)의대표적인 제품군을 도시한다. 이러한 전류는 -70 mV의 유지 전위에서 -60 및 +80 mV 사이의 250 ms 전압 클램프 단계를 사용하여 기록되었습니다. ICa,L을 측정하는 데 사용할 수 있는 실험 조건은 이전에17,18,20을기술하였다. 요약 ICa,L IV 관계는 도 5C에도제시되어 있다. ICa,L을 기록하는 데 사용되는 솔루션은 표 7 및 표8에서 사용할 수 있습니다.
도 5D는 패치 클램프 기술의 전체 셀 구성에 기록된 K+ 전류(I K)의 대표적인 제품군을 도시한다. 이러한 전류는 우리가 이전에 설명한 대로 -120 mV와 +80 mV 사이의 500 ms 전압 클램프 단계를 사용하여 -80 mV의 보유 전위에서 기록되었다6,14. 총 I K에 대한 요약 IV 관계는 도 5D에제시된다. I K를 기록하는 데 사용되는 솔루션은 표 7 및 표8에서 사용할 수 있습니다.
이러한 접근법을 사용하여 NA+, Ca2 + 및 K+ 전류 (위 그림과 같이)를 포함한 이온 전류의 주요 제품군을 기록하면 조사관이 심방 근세포 전기 생리학을 엄격하게 심문 할 수 있습니다. 실험 조건의 과다. 우리의 실험실은 일상적으로 심장 병의 마우스 모형에 있는 일반적인 마우스에 있는 심방 myocyte 전기생리학을 공부하기 위하여 이 기술을, 및 유전으로 변형한 마우스6,14,17,18에서 이용했습니다 ,19,20.

그림 1: 심방 근세포 격리 프로토콜에 대한 순서도. 이 프로토콜을 사용하여 심방 근세포를 분리하는 데 사용되는 단계의 요약. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
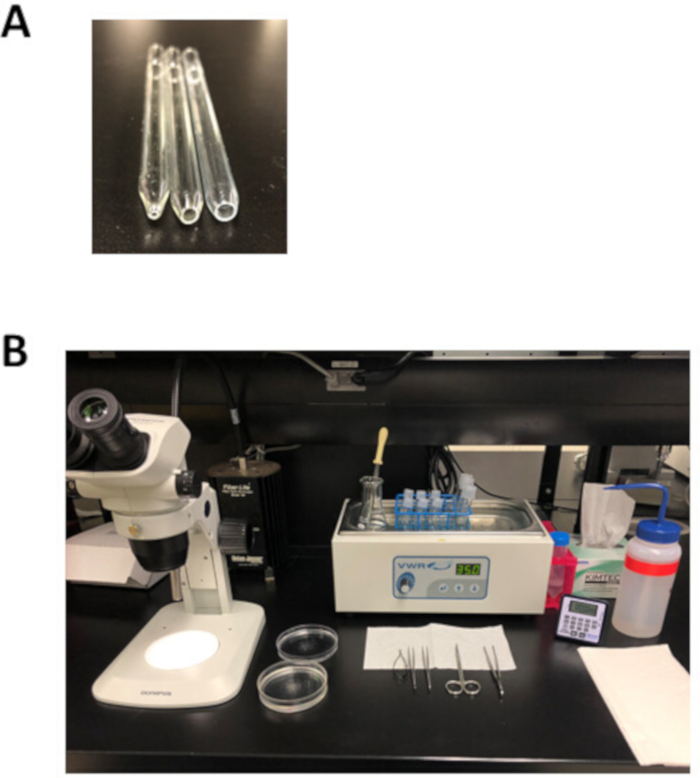
그림 2: 심방 근세포 격리를 위한 실험 적 설정 및 해부 도구. (A). 직경 1mm의 개구부(왼쪽)가 있는 작은 보어 불광택 피펫이 해부 후 조직 전달에 사용되며, 중간 보어 불 광택 파이펫은 직경 3mm의 개구부(가운데)를 사용하여 조직 스트립을 전달하는 데 사용됩니다. 직경 5mm의 개구부(오른쪽)를 가진 대형 보어 화재 연마 피펫을 소화된 심방 조직의 삼각화에 사용한다. (B). 심방 근세포 격리를 위한 실험적 설정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
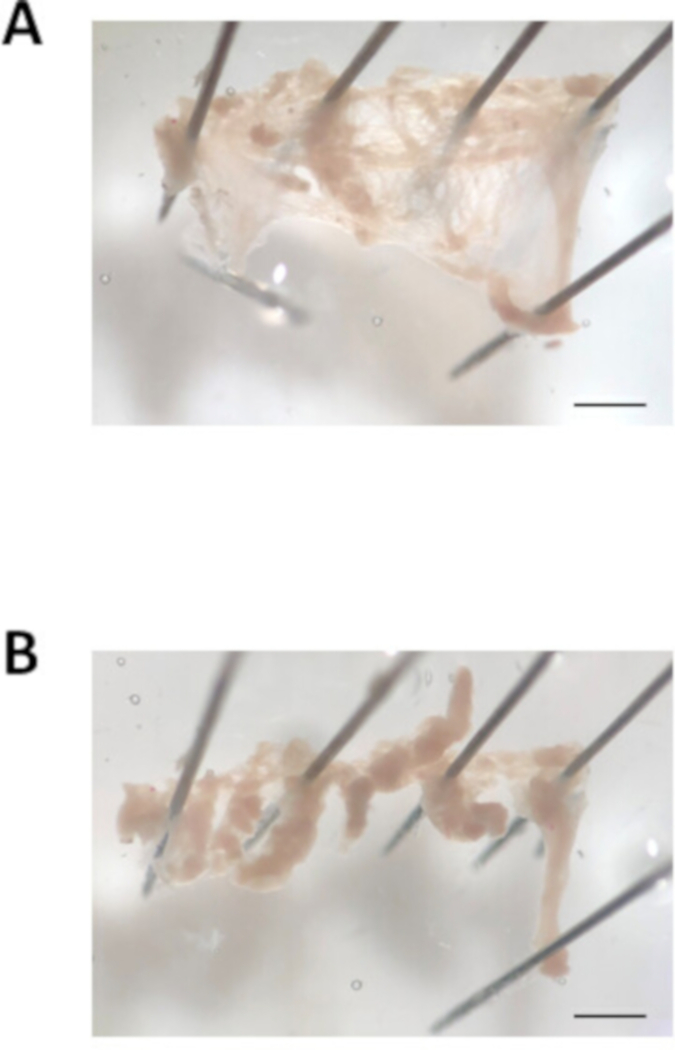
그림 3: 심방 부속기 해부 이미지. (A). 절제된 심방 부속기의 대표적인 밝은 필드 이미지가 열리고 고정되어 있습니다. (B). 약 0.7 mm폭의 조직 스트립으로 잘라 심방 부속기의 대표적인 밝은 필드 이미지. 배율 표시줄 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
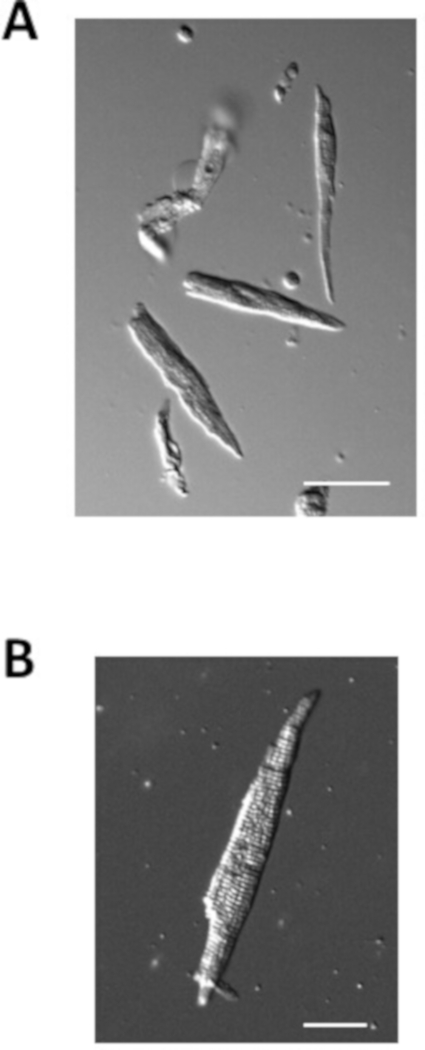
그림 4: 고립된 심방 근세포의 이미지. (A). 격리 직후 에 고립된 심방 근세포의 브라이트필드 이미지. 배율 막대 = 50 μm. (B). 단일 분리 심방 근세포의 브라이트필드 이미지. 배율 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
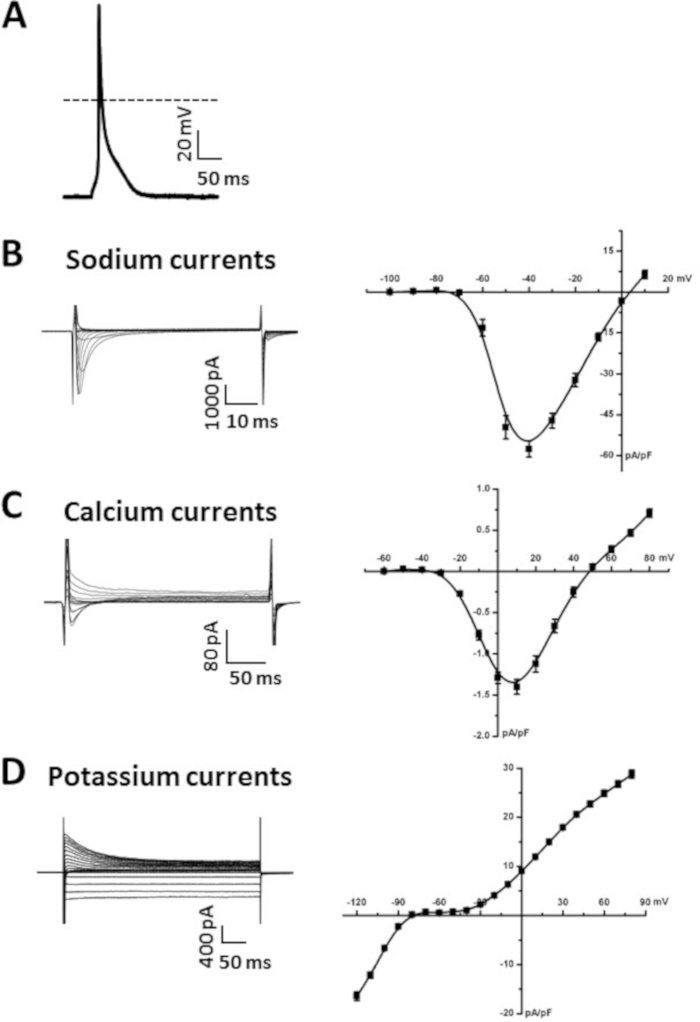
도 5: 단경 심방 근세포로부터 얻은 대표적인 패치 클램프 데이터. (A). 대표는 고립된 심방 근세포로부터 AP 녹음을 자극하였다. AP 매개 변수의 요약은 표6에 표시됩니다. 암포테리신 B(200 μg/mL)를 피펫 용액에 첨가하여 세포막을 투과화하였다. (B). 대표 INa 녹음 (왼쪽) 및 요약 INa IV 곡선 (오른쪽) 고립 된 심방 근세포에서. 니페디핀(10 μM)은 I Na를 기록할 때 ICa,L을 차단하기 위해 수정된 티로데용 용액에 첨가하였다. C. 대표 ICa,L 녹음 (왼쪽) 및 요약 ICa, L IV 곡선 (오른쪽) 고립 된 심방 근세포에서. (D). 대표 IK 녹음 (왼쪽) 및 요약 IK IV 곡선 (오른쪽) 고립 된 심방 근세포에서. 이러한 각 전류를 기록하는 데 사용되는 솔루션은 표 7 및 표8에 나열되어 있습니다. 요약 IV 곡선은 15주령 의 남성 야생형 C57Bl/6 마우스로부터 분리된 10개의 심방 근세포로부터의 평균 측정이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 주식 티로드의 pH 6.9 | 주식 티로드의 pH 7.4 | |
| 화학 | mM에서 | mM에서 |
| Nacl | 140개 | 140개 |
| KCl | 5.4 | 5.4 |
| KH2PO4 | 1.2 | 1.2 |
| 헤페스 (주)는 | 5개 | 5개 |
| 최종 볼륨 | 500 mL | 1L |
| NaOH를 가진 최종 pH | 6.9 | 7.4 |
표 1: 주식 티로드의 pH 7.4 및 재고 Tyrode의 pH 6.9 솔루션. 최대 2개월 동안 4°C에서 미리 만들어 보관할 수 있는 재고 Tyrode의 용액(pH 7.4 및 pH 6.9)의 조성.
| 화학 | mM에서 |
| K-글루타메이트 | 100개 |
| K-아스파르타테 | 10개 |
| KCl | 25개 |
| KH2PO4 | 10개 |
| MgSO4 | 2개 |
| 황소자리 | 20개 |
| Creatine | 5개 |
| EGTA | 0.5 |
| 포도 당 | 20개 |
| 헤페스 (주)는 | 5개 |
| Bsa | 0.10% |
| 최종 볼륨 | 1L |
| KOH와 최종 pH | 7.2 |
표 2: 수정된 KB 솔루션입니다. 최대 2개월 동안 -20°C에서 미리, aliquoted 및 보관할 수 있는 변형된 KB 용액을 위한 레시피.
| 화학 | 금액 |
| 포도 당 | 5.55 mM |
| MgCl2 | 1 mM |
| CaCl2 | 1.8 mM |
| 주식 티로드의 pH 7.4 | 50 mL |
| 덤플링을 | 250 μL |
표 3: 포도당, 마그네슘, 칼슘 및 헤파린을 함유한 Tyrode의 pH 7.4 용액을 수정했습니다. 심방 조직 해부에 사용되는 변형된 티로드의 pH 7.4 용액의 조성. 이 용액은 신선하게 만들어서 사용할 때까지 35°C의 수조에 보관해야 한다.
| 화학 | 금액 |
| 포도 당 | 18.5 mM |
| 황소자리 | 49.96 mM |
| Bsa | 15 mg |
| CaCl2 | 0.066 mM |
| 주식 티로드의 pH 6.9 | 15 mL |
표 4: 포도당, 타우린, BSA 및 낮은 칼슘을 함유하는 변형된 티로드의 pH 6.9 용액. 심방 근세포 격리에 사용되는 변형된 티로데의 pH 6.9 용액의 조성. 이 용액은 신선하게 만들어서 사용할 때까지 35°C의 수조에 보관해야 한다.
| 화학 | 금액 |
| 콜라게나아제 | 1,064 U |
| 엘라타아제 | 9 U |
| 프로테아제 솔루션 | 65.2 μL |
| 수정된 티로드의 pH 6.9 | 5 mL |
표 5: 효소 솔루션. 효소성 으로 심방 조직 스트립을 소화하는 데 사용되는 효소 용액의 조성. 이 용액은 신선하게 만들어서 사용할 때까지 35°C의 수조에 보관해야 한다.
| 매개 변수 | 평균 |
| RMP(mV) | -74.2 ± 0.7 |
| Vmax (V / s) | 144.6 ± 5.8 |
| OS(mV) | 71.9 ± 3.0 |
| APD50 (ms) | 11.1 ± 1.7 |
| APD70 (ms) | 23.0 ± 4.6 |
| APD90 (ms) | 54.7 ± 7.8 |
표 6: 분리된 심방 근세포로부터의 AP 파라미터의 요약. 데이터는 평균 ± SEM, n = 15 주 남성 야생형 C57Bl/6 마우스로부터 분리된 심방 근세포로 제시된다.
| 칼륨 전류 및 AP | 나트륨 전류 | 칼슘 전류 | |
| 화학 | mM에서 | mM에서 | mM에서 |
| Nacl | 140개 | 5개 | |
| KCl | 5.4 | ||
| MgCl2 | 1개 | 1개 | 1개 |
| 카클2 | 1개 | 1개 | 2개 |
| 헤페스 (주)는 | 10개 | 10개 | 10개 |
| 포도 당 | 5.5 | 5.5 | 5.5 |
| CsCl | 130명 | ||
| 티 클 | 5.4 | 145.5 | |
| Ph | 7.4 NaOH | 7.4 와 CsOH | 7.4 와 CsOH |
표 7: 패치 클램프 실험 중에 사용되는 Tyrode 솔루션의 구성. AP를 기록하는 데 사용되는 Tyrode의 솔루션의 구성, INa, ICa, L및 IK는 격리 된 심방 근세포에서.
| 칼륨 전류 및 AP | 나트륨 전류 | 칼슘 전류 | |
| 화학 | mM에서 | mM에서 | mM에서 |
| Nacl | 5개 | 5개 | 5개 |
| KCl | 140개 | ||
| MgCl2 | 1개 | 1개 | 1개 |
| 카클2 | 0.2 | 0.2 | 0.2 |
| 헤페스 (주)는 | 10개 | 10개 | 10개 |
| EGTA | 5개 | 5개 | |
| Mg-ATP | 4개 | 5개 | 4개 |
| 나-GTP | 0.3 | 0.3 | 0.3 |
| 나포스포크레아틴 | 6.6 | 6.6 | |
| CsCl | 130명 | 135세 | |
| 세례 | 5개 | ||
| Ph | 7.2 와 KOH | 7.2 와 CsOH | 7.2 와 CsOH |
표 8: 패치 클램프 실험 중에 사용되는 내부 파이펫 용액의 구성. AP, INa,I Ca,L및 IK를 격리된 심방 근세포로부터 기록하는 데 사용되는 파이펫 충진 용액의 조성.
토론
우리의 실험실은 심방 근세포에 대한 다양한 형태의 심혈관 질환, 유전 돌연변이 또는 약리화합물의 효과를 조사하기 위해 패치 클램프 실험에 사용하기 위해 마우스 심방 근세포계를 분리하기 위해 이 프로토콜을 일상적으로 사용합니다. 전기 생리학. 높은 재현성이지만, 분리된 심방 근세포로부터 얻은 데이터의 품질은 절연의 품질에 달려 있다. 또한, 심방 근세포 격리 에 따른 칼슘의 재도입은 칼슘 역설16로인한 고립된 근세포 집단에 대한 세포 사멸을 초래할 것이다. 따라서, 이 접근법을 사용하여 실행 가능한 고품질 심방 근세포를 분리하려면 격리 전반에 걸쳐 여러 지점에서 연습 및 최적화가 필요합니다. 일단 최적화되면, 이 접근법을 사용하여 분리된 총 심방 근세포의 70-90% 사이에서 칼슘 내성과 막대 모양둘 다 일 것이라는 추정된다. 가장 많은 연습과 최적화가 필요한 단계는 아래에서 설명합니다.
해부의 속도와 효율은 단리 된 세포의 품질에 다운 스트림 영향을 미칠 것입니다. 모든 혈액이 심방 조직에서 제거되고 조직 스트립이 비슷한 크기로 절단되도록 하는 데 시간이 걸리는 것이 중요합니다. 심방 부속기를 제거하고 조직을 스트립으로 자르고 조직 스트립을 변형 된 Tyrode의 pH 6.9 용액의 첫 번째 튜브로 옮기는 데 약 5 분이 소요됩니다. 그러나,이 단계가 너무 오래 걸리는 경우, 조직의 품질이 손상 될 수 있습니다.
조직 스트립은 격리 내에서 그리고 마음 사이 균일 한 크기로 절단하는 것이 중요합니다. 조직 스트립이 너무 크거나 너무 작거나 격리 내에서 균일하지 않은 경우 효소 소화및 삼조 중에 문제가 발생할 수 있습니다. 작은 스트립이 더 철저하게 소화되고 큰 스트립이 소화되기 때문입니다. 심방 부속기의 크기가 동물마다 다를 수 있기 때문에 연구되고 있는 유전자형 및 질병 설정을 고려하는 것이 동등하게 중요합니다. 예를 들어, 비대 심장은 건강한 심장에 비해 심방 부속기가 더 크므로 실험자는 정상적인 크기의 심장에 비해 비대 심장에서 더 많은 스트립을 자를 수 있습니다. 따라서, 절단 조직 스트립의 크기를 최적화하고 각 개별 심방 부속기에 이러한 치수를 적용하면 실험 조건 사이의 근세포 격리의 재현성이 크게 향상될 것이다.
효소 소화와 기계적 해리 사이의 섬세한 균형은이 프로토콜을 사용하여 성공적인 심방 근세포 격리의 핵심입니다. 조직이 효소 소화 도중 적당하게 소용돌이치지 않는 경우에 개별 조직 조직은 응집하고 함께 붙는 경향이 있을 것이고, 이는 효소 소화의 효과를 제한할 것입니다. 너무 자주 또는 적극적으로 교반 하는 경우, 이 심 방 조직을 손상 시킬 수 있습니다., 실행 불가능 한 세포의 격리 귀 착될 것 이다. 삼조 동안 조직 스트립에서 분리 된 심방 근세포의 기계적 해리는 심방 근세포를 분리하기 위해이 접근법을 사용하여 연습하고 최적화하는 가장 중요한 단계입니다. 삼조가 너무 부드러우면 셀 수율이 낮습니다. 반면에 삼조가 너무 가혹하면 실행 불가능한 근세포가 풍부하게 격리되고 패치 클램프 실험 중에 얻은 데이터의 품질이 위태로워집니다. 또한, 심트리아의 조성은 격리에 영향을 미칠 수 있다. 예를 들면, 조직이 섬유성인 경우에, 효소 소화 및 삼각 단계는 수정될 필요가 있을 수 있습니다. 따라서 패치 클램프 실험에 사용할 수있는 삼조 중에 고품질의 세포를 얻는 데 필요한 기술을 개발하는 데 시간이 걸리는 것이 중요합니다.
모든 실험 기술과 마찬가지로 한계가 있습니다. 이 기술은 재현 가능한, 고품질 myocytes를 재현하기 위하여 연습을 요구합니다, 차례차례로 이 근세포를 사용하여 수행되는 어떤 실험든지의 타당성에 영향을 미칠 것입니다. 이러한 접근법은 또한 단말 및 심방 근세포가 이 접근법을 사용하여 격리된 날에만 사용될 수 있다. 우리의 실험실은 격리의 6-7 시간 안에 세포를 이용합니다.
심방 심근구를 격리하는 이 접근법에는 여러 가지 응용 분야가 있습니다. 예를 들면, 이 접근은 인간 적인 심방 조직 생검을 포함하여 그밖 종에서 심방 myocytes (뿐만 아니라 심장 섬유아세포)를 격리하기 위하여 수정될 수 있습니다. 또한 심방 심근 세포 격리 (심장의 역행 관류와는 대조적으로)에 이 청크 방법을 사용하면 심근 세포가 심혼의 다른 영역(예: 심방 노드 또는 기타 특정 영역)으로부터 심근구를 분리하도록 수정할 수 있다는 장점이 있습니다. 심방 심근의, 또는 심장의 전체 상심 영역을 포괄. 우리의 실험실은 이 접근법이 이 기술에 국한될 필요는 없지만, 패치 클램프 실험을 위해 심방 심근세포를 사용하여 작용 전위 및 이온 전류를 측정합니다. 예를 들어, 고립 된 근세포는 다양한 실험 환경에서 칼슘 과도 및 수축성의 변화를 조사하는 데 사용할 수 있습니다. 심방 심근세포는 또한 관심 있는 단백질 또는 구조물의 위치를 공부하기 위하여 면역 형광 연구 결과에서 이용될 수 있습니다. 따라서 이 방법은 가능한 많은 응용 분야에서 매우 다재다능합니다.
공개
저자는 공개 할 필요가 없습니다.
감사의 말
이 작품은 캐나다 보건 연구 기관 (MOP 93718, 142486)과 R.A. Rose에 캐나다의 심장 및 뇌졸중 재단에서 보조금을 운영하여 지원됩니다. H.J. 얀센은 킬람 박사 후 펠로우십의 수혜자입니다.
자료
| Name | Company | Catalog Number | Comments |
| 1, 2-Bis(2-Aminophenoxy)ethane-N, N, N', N'-tetraacetic acid 98% | Sigma | A4926-1G | |
| Adenosine 5'-triphosphate disodium salt hydrate BioXtra, > 99%, from microbial | Sigma | A7699-1G | |
| Adenosine 5'-triphosphate magnesium salt > 95%, bacterial | Sigma | A9187-1G | |
| Amphocetericin B from Streptomyces sp. ~80% (HPLC), powder | Sigma | A4888-500 MG | |
| Bovine serum albumin | Sigma | A3059-50G | |
| Calcium chloride dihydrate | Sigma | 223506-500G | |
| Cesium chloride ReagentPlus, 99.9% | Sigma | 289329-100G | |
| Cesium hydroxide monohydrate > 99.5% trace metals basis | Sigma | 562505-1KG | |
| Collagenase Type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine anhydrous | Sigma | C0780 | |
| D-(+)-Glucose | Sigma | G7021-1KG | |
| DL-Aspartic acid potassium salt | Sigma | A2025-100G | |
| Elastase suspension | Worthington Biochemical Corporation | LS002279 | |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid >97.0% | Sigma | E4378-25G | |
| Guanosine 5'-triphosphate sodium salt hydrate > 95% (HPLC), powder | Sigma | G8877-250MG | |
| Heparin 10 000 USP units/10mL | SANDOZ | 10750 | |
| HEPES > 99.5% (titration) | Sigma | H3375-500G | |
| L-Glutamic acid potassium salt monohydrate > 99% (HPLC), powder | Sigma | G1501-500G | |
| Magnesium sulfate | Sigma | M2643-500G | |
| Nifedipine > 98% (HPLC), powder | Sigma | N7634-1G | |
| Phosphocreatine disodium salt hydrate enzymatic, approx 98% | Sigma | P7936-5G | |
| Potassium chloride ACS reagent, 99.0-100.5% | Sigma | P3911-500G | |
| Potassium hydroxide | EM Science | PX1480-1 | |
| Potassium phosphate monobasic | EMD | PX1565-1 | |
| Protease from Streptomyces griseus, type XIV, >3.5 units/mg solid, powder | Sigma | P5147-1G | |
| Sodium chloride ACS reagent, > 99.0% | Sigma | S9888-2.5KG | |
| Sodium hydroxide, pellets, 97+%, A.C.S. reagent | Sigma | 221465-500G | |
| Sylgard 184 silicone elastomer kit | World Precision Instruments Inc | SYLG184 | |
| Taurine | Sigma | T0625-100G | |
| Tetraethylammonium chloride > 98% (titration) | Sigma | T2265-100G |
참고문헌
- Bartos, D. C., Grandi, E., Ripplinger, C. M. Ion Channels in the Heart. Comprehensive Physiology. 5 (3), 1423-1464 (2015).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circulation Research. 114 (9), 1483-1499 (2014).
- Jalife, J. Mechanisms of persistent atrial fibrillation. Current Opinion in Cardiology. 29 (1), 20-27 (2014).
- Nattel, S., Maguy, A., Le Bouter, S., Yeh, Y. H. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation. Physiological Reviews. 87 (2), 425-456 (2007).
- Jansen, H. J., et al. Atrial structure, function and arrhythmogenesis in aged and frail mice. Scientific Reports. 7, 44336 (2017).
- Jansen, H. J., et al. Distinct patterns of atrial electrical and structural remodeling in angiotensin II mediated atrial fibrillation. Journal of Molecular and Cellular Cardiology. 124, 12-25 (2018).
- Nerbonne, J. M., Kass, R. S. Molecular physiology of cardiac repolarization. Physiological Reviews. 85 (4), 1205-1253 (2005).
- Grant, A. O. Cardiac ion channels. Circulalation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Schmitt, N., Grunnet, M., Olesen, S. P. Cardiac potassium channel subtypes: new roles in repolarization and arrhythmia. Physiological Reviews. 94 (2), 609-653 (2014).
- Lomax, A. E., Kondo, C. S., Giles, W. R. Comparison of time- and voltage-dependent K+ currents in myocytes from left and right atria of adult mice. American Journal of Physiology Heart and Circulatory Physiology. 285 (5), H1837-H1848 (2003).
- Li, D., Zhang, L., Kneller, J., Nattel, S. Potential ionic mechanism for repolarization differences between canine right and left atrium. Circ Res. 88 (11), 1168-1175 (2001).
- Wirth, K. J., Knobloch, K. Differential effects of dofetilide, amiodarone, and class lc drugs on left and right atrial refractoriness and left atrial vulnerability in pigs. Naunyn Schmiedebergs Archives of Pharmacology. 363 (2), 166-174 (2001).
- Qi, A., Yeung-Lai-Wah, J. A., Xiao, J., Kerr, C. R. Regional differences in rabbit atrial repolarization: importance of transient outward current. American Journal of Physiology. 266 (2 Pt 2), H643-H649 (1994).
- Jansen, H. J., et al. NPR-C (Natriuretic Peptide Receptor-C) Modulates the Progression of Angiotensin II-Mediated Atrial Fibrillation and Atrial Remodeling in Mice. Circulation: Arrhythmia and Electrophysiology. 12 (1), e006863 (2019).
- Mangoni, M. E., Nargeot, J. Genesis and regulation of the heart automaticity. Physiological Reviews. 88 (3), 919-982 (2008).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Springer, J., et al. The natriuretic peptides BNP and CNP increase heart rate and electrical conduction by stimulating ionic currents in the sinoatrial node and atrial myocardium following activation of guanylyl cyclase-linked natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 52 (5), 1122-1134 (2012).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. A. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PLoS One. 7 (10), e47652 (2012).
- Egom, E. E., et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. Journal of Physiology. 593 (5), 1127-1146 (2015).
- Hua, R., et al. Effects of Wild-Type and Mutant Forms of Atrial Natriuretic Peptide on Atrial Electrophysiology and Arrhythmogenesis. Circulation: Arrhythmia and Electrophysiology. 8 (5), 1240-1254 (2015).
- Krishnaswamy, P. S., et al. Altered parasympathetic nervous system regulation of the sinoatrial node in Akita diabetic mice. Journal of Molecular and Cellular Cardiology. 82, 125-135 (2015).
- Mackasey, M., et al. Natriuretic peptide receptor C (NPR-C) protects against angiotensin II mediated sinoatrial disease in mice. JACC Basic to Translational Science. , (2018).
- Azer, J., Hua, R., Vella, K., Rose, R. A. Natriuretic peptides regulate heart rate and sinoatrial node function by activating multiple natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 53 (5), 715-724 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유