Method Article
Isolamento de miócitos atriais de camundongos adultos
Neste Artigo
Resumo
Este protocolo é usado para isolar cardiomiócitos atriais únicos do coração do rato adulto usando uma abordagem de digestão do pedaço. Esta aproximação é usada para isolar os miócitos atrial direito ou esquerdos que podem ser usados para caracterizar a electrofisiologia atrial do miócitos em estudos da remendo-braçadeira.
Resumo
As propriedades electrofisiológicas de miócitos atrial afetam importante a função cardíaca total. Alterações nas correntes iônicas subjacentes responsáveis pelo potencial de ação podem causar substratos pró-arrítmicos que sustentam arritmias, como fibrilação atrial, que são altamente prevalentes em muitas condições e Estados de doença. Isolar os cardiomiócitos atriais do camundongo adulto para uso em experimentos de patch-Clamp tem avançado muito nosso conhecimento e compreensão da eletrofisiologia celular no miocárdio atrial saudável e no ajuste da fisiopatologia atrial. Além disso, estudos que utilizam modelos genéticos de camundongo elucidaram o papel de uma vasta gama de proteínas na regulação da eletrofisiologia atrial. Aqui nós fornecemos um protocolo detalhado para o isolamento dos cardiomiócitos dos apêndices atriais de camundongos adultos usando uma combinação de digestão enzimática e dissociação mecânica desses tecidos. Essa abordagem produz de forma consistente e confiável os cardiomiócitos atriais isolados que podem ser usados para caracterizar a eletrofisiologia celular medindo potenciais de ação e correntes iônicas em experimentos de patch-Clamp um número experimental de Condições.
Introdução
Os átrios, que são as câmaras de paredes finas, de baixa pressão do coração que recebem sangue da veia cava superior e inferior, bem como as veias pulmonares, são integrais na fisiologia cardíaca normal. Como outras regiões do coração, os átrios contêm um número de tipos de células, incluindo cardiomiócitos, fibroblastos, células endoteliais, células musculares lisas vasculares, e outros. Os miócitos atriais são células eletricamente excitável que desempenham um papel essencial na condução de sinais elétricos através do coração, assegurando assim a contração atrial adequada durante cada batimento cardíaco1. A disfunção elétrica nos átrios pode levar a um número de arritmias específicas atriais, como flutter atrial e fibrilação atrial2,3. Estas são altamente prevalentes, contudo mal compreendidas, arritmias atrial que conduzem à morbosidade e à mortalidade significativas. A fibrilação atrial pode ocorrer em associação com mutações genéticas, em associação com o envelhecimento ou no estabelecimento de formas adquiridas de doença cardíaca, incluindo hipertensão, insuficiência cardíaca e diabetes2,4,5 ,6. Essas condições podem alterar as propriedades elétricas dos miócitos atriais que podem criar um substrato que aumente a prevalência de arritmogênese1,2.
A função elétrica normal nos átrios, bem como a arritmogênese atrial, são mais afetadas pela morfologia do potencial de ação (AP) produzido em miócitos atriais. O AP atrial é gerado a partir da atividade de um número de correntes iônicas, incluindo a corrente de sódio (Ina, transportado por naV1,5 canais), o L-tipo corrente de cálcio (iCA, l, transportado por cav1,2 e CAv1,3 canais ), e diversas correntes do potássio que incluem a corrente retardada ultra-rápida do potássio do retificador (IKur, carreg por Kv1,5 canaletas), a corrente externa transiente do potássio (ia, carreg por kv4,2 e kv4,3 canais), uma corrente de potássio de estado estacionário (iKSS, transportado por KV2,1 canais), e a corrente de potássio do retificador interno(iK1, transportado por Kir2,1 canais)1,7, a 8. Embora não desempenhe um papel importante nos átrios do camundongo, os componentes rápidos e lentos do retificador tardio K+ Current (iKr e iKS) também contribuem para a repolarização AP em algumas espécies7. Alterações em uma ou mais dessas correntes iônicas podem alterar significativamente as propriedades elétricas dos miócitos atriais, o que pode levar a arritmias atriais. Por exemplo, uma redução de Ina pode retardar a velocidade de condução através dos átrios, reduzindo a velocidade de subida AP. Por outro lado, uma redução nas correntes de potássio repolarizante ou um aumento em ICA, L ou o ina tardia pode resultar no desenvolvimento de afterdepolarizações que podem desencadear atividade espontânea nos átrios1, 2,9.
É importante reconhecer que existem diferenças na morfologia da AP em diferentes partes do miocárdio atrial que são prováveis devido a diferenças na expressão ou regulação desses canais iônicos subjacentes. Por exemplo, as diferenças na duração da AP entre os átrios direito e esquerdo em associação com as diferenças na densidade atual foram bem descritas10,11,12,13. Além disso, temos demonstrado recentemente que existem padrões distintos de remodelação elétrica nos átrios direito e esquerdo de camundongos com hipertensão crônica6,14. A parede posterior atrial direita também contém o nó sinoatrial, que tem seus próprios padrões distintos de morfologia AP e padrões de queima15. As propriedades distintas dos miócitos em cada um destas partes diferentes dos átrios podem ser investigadas em detalhe usando miócitos isolados de cada uma destas regiões.
Existem diferentes abordagens que podem ser usadas para isolar os miócitos atriais para estudos de eletrofisiologia de patch-Clamp16. Uma possibilidade é usar uma aproximação retrógrada da perfusão onde o coração seja canulados através da aorta para a entrega das enzimas. Embora esta seja uma abordagem viável, pode produzir variabilidade na qualidade dos miócitos atriais devido a inconsistências na perfusão dos átrios. Nós adotamos um ' pedaço ' abordagem de digestão para o isolamento de miócitos atriais que elimina a necessidade de perfusão retrógrada do coração. Nossa aproximação usa uma combinação de digestão enzimática e de dissociação mecânica do tecido atrial que produz consistentemente e confiantemente o grande número de miócitos atrial isolados que são apropriados para estudos da remendo-braçadeira. Quando nós descrevemos nossa aproximação aqui usando o tecido atrial do apêndice, a aproximação pode ser usada em toda a região do miocárdio atrial (isto é, apêndices atrial direito ou esquerdos, paredes livres, paredes posteriores) que o investigador escolhe. Esta abordagem é ideal para estudos de eletrofisiologia de miócitos atrial em camundongos geneticamente modificados, em modelos de camundongo de doença cardiovascular, ou para o estudo dos efeitos de compostos farmacológicos5,6,17 , 18 anos de , a 19.
Protocolo
Todos os procedimentos animais foram aprovados pelo Comitê de cuidados e uso de animais da Universidade de Calgary e foram conduzidos de acordo com as diretrizes do Conselho canadense de cuidados com animais. A isolação, as imagens, e os resultados representativos do miócitos atrial descritos abaixo foram obtidos de um rato tipo selvagem masculino de 15 week-old C57Bl/6. Nós usamos rotineiramente este protocolo para isolar miócitos atrial dos ratos17,18do tipo selvagem, ratos que carreg mutações genéticas19,20 e modelos do rato da doença tal como a hipertensão crônica6, a 14. O protocolo pode ser usado similarmente para ratos masculinos ou fêmeas. Nós igualmente utilizamos uma versão similar deste procedimento da isolação para isolar miócitos sinoatrial do nó do coração do rato17,21,22,23. Um fluxograma deste protocolo experimental está localizado na Figura 1.
1. preparação de soluções e equipamentos de stock
- Prepare 1 prato de dissecação adicionando elastômero de silicone de acordo com as instruções do fabricante. Adicione o suficiente composto de elastômero de silicone para cobrir a parte inferior de um prato de Petri de 10 cm a uma profundidade de 1 cm. permitir a cura e, em seguida, inserir 6 pinos de insetos no prato.
Nota: Este prato de dissecação do silicone pode reúso por meses e ser armazenado na temperatura ambiente. - Prepare 3 pipetas Pasteur polidas a fogo com uma abertura de 1 mm (furo pequeno), 3 mm (furo médio) ou 5 mm (furo grande) de diâmetro, como mostrado na Figura 2a. Para fazer estas pipetas, marcar uma pipeta Pasteur e, em seguida, encaixar ao longo da marca de Pontuação para produzir uma abertura que é ligeiramente maior do que o tamanho do furo desejado. Use um arquivo de metal para suavizar a superfície e, em seguida, fogo-polonês esta abertura usando uma chama aberta.
Nota: Isto produzirá uma borda lisa, fogo-lustrada com uma abertura do diâmetro desejado. É importante que a abertura está livre de rachaduras e superfícies ásperas. Estas pipeta fogo-lustradas podem ser armazenadas na temperatura ambiente e reúso por meses. - Prepare soluções de estoque para a solução de pH 6,9 da Tyrode e a solução de pH 7,4 da Tyrode, conforme listado na tabela 1. Prepare também 10 mL cada um de 1 M MgCl2, 1 m CAcl2, e 100 mm CAcl2. Use água ultrapura para todas as soluções e armazene a 4 ° c por até 2 meses.
- Prepare 1 L de solução modificada de Kraft-Brühe (KB), conforme indicado na tabela 2. Use água ultrapura. Divida a solução em alíquotas de 20 mL e armazene a-20 ° c por até 2 meses.
2. preparação de soluções e configuração de isolamento para isolamento de miócitos atrial
- Prepare 50 mL de uma solução modificada de pH 7,4 de Tyrode, conforme descrito na tabela 3 em um balão de 125 ml de Erlenmeyer, usando soluções de estoque de 1 m de CAcl2 e 1 m MgCl2 . Coloque o frasco de Erlenmeyer num banho de água de 35 ° c até ao seu uso, como indicado na Figura 2b.
- Prepare a solução de pH 6,9 modificada de Tyrode conforme descrito na tabela 4 em um tubo de 50 ml, usando a solução de estoque de 100 mm CAcl2 . Aliquot 2,5 mL desta solução em cada um dos três tubos inferiores redondos de 5 mL. Coloque esses tubos em um rack de arame colocado em um banho de água de 35 ° c até o uso, como mostrado na Figura 2b.
- Prepare a solução enzimática conforme descrito na tabela 5 em um tubo inferior redondo de 14 ml. Para fazer a solução de protease, adicione 1 mg de protease por 100 μL de água ultrapura. Coloque o tubo que contém esta solução enzimática no rack de arame e incubar em um banho de água de 35 ° c até o uso.
- Descongelar uma alíquota da solução KB modificada num banho de água de 35 ° c. Aliquot 2,5 mL de solução de KB em cada um dos três tubos inferiores redondos de 5 mL e 2,5 mL num tubo inferior redondo de 14 mL. Coloque estes tubos na cremalheira do fio e incubar em um banho de água de 35 ° c até o uso, como mostrado na Figura 2b.
- Colocar para fora a placa de dissecação, ferramentas de dissecação, uma pipeta de Pasteur, e as pipetas fogo-lustradas como mostrado na Figura 2b.
3. dissecção do Apêndice Atrial do rato (s)
- Injete o rato com 0,2 mL de heparina (10 000 USP U/10 mL) via injeção intraperitoneal e aguarde 5 min para a absorção.
- Colocar o rato numa câmara de indução e anestesiar por inalação de isoflurano (3-4%). Isoflurano e oxigênio são entregues usando uma máquina anestésica e resíduos de gás anestésico é eliminado. Uma vez que o rato é anestesiado, e não exibe um reflexo pitada de dedo do pé, eutanizar o mouse por luxação cervical rápida. Coloque o mouse sobre uma toalha de papel ou uma placa de cortiça e tape as patas para baixo para segurar o mouse no lugar.
- Molhe o peito do rato com 70% de etanol. Retire o pêlo e pele cobrindo o peito usando tesoura curvada. Em seguida, use o fórceps do dente do rato para levantar o esterno e para cortar então o diafragma ao longo da borda das costelas. Retire toda a caixa torácica usando tesouras curvas para expor o coração.
- Para remover o Apêndice Atrial (direito ou esquerdo), levante delicadamente o apêndice usando o fórceps de dissecação fino e corte-o para fora com tesouras da mola. Transfira imediatamente o Apêndice Atrial para um prato de dissecação revestido com silicone contendo 20 mL da solução de pH 7,4 modificada de Tyrode, descrita na etapa 2,1.
- Coloc um pino de dissecação na parte superior e um pino na parte inferior da abertura do appendage atrial. Usando uma pipeta do pasto, lave os átrios com a solução de pH 7,4 de Tyrode modificada para remover o sangue. Abra o Apêndice Atrial cortando ao longo da borda superior e inferior do apêndice atrial. Em seguida, fixar os cantos do Apêndice Atrial para baixo para criar um pedaço de tecido liso, retangular, como mostrado na Figura 3a.
4. isolamento de miócitos atriais
Nota: As etapas nesta seção são todas executadas em 35 ° c, com os tubos submergidos em um banho de água de 35 ° c. Tenha cuidado ao transferir tiras de tecido entre os tubos de fundo redondo para garantir que apenas o tecido (e não a solução) é transferido entre os tubos.
- Corte o Apêndice Atrial em aproximadamente 8-10 tiras feitas medida iguais (aproximadamente 0,7 milímetros na largura) usando a tesoura da mola e o fórceps fino. Um exemplo das tiras do tecido atrial é mostrado na Figura 3B. Note que as tiras de contrato uma vez que eles são cortados livre do pedaço principal de tecido. Usando a pipeta fogo-lustrada pequena do furo, transfira as tiras do tecido no primeiro tubo que contem a solução modificada pH 6,9 de Tyrode descrita na etapa 2,2. Aguarde 5 min.
- Lave as tiras de tecido transferindo-as para o segundo e, em seguida, o terceiro tubo inferior redondo contendo a solução de pH 6,9 modificada de Tyrode preparada na etapa 2,2 usando a pipeta com polimento de fogo de meio furo.
- Para lavar as tiras de tecido, tampe o tubo inferior redondo de 5 mL e inverta suavemente o tubo 3 vezes. Deixe as tiras do tecido estabelecir-se à parte inferior do tubo antes de transferir as tiras do tecido ao tubo seguinte usando a pipeta fogo-lustrada do furo médio.
- Transfira as tiras de tecido para a solução enzimática descrita na etapa 2,3 usando uma pipeta com polimento de fogo médio e incubar por 30 min. Gire o tubo a cada 3-5 min para evitar que as tiras de tecido aderindo juntas.
Nota: No início da digestão enzimática, tiras de tecido resolver rapidamente após a roda. A aproximadamente 20 min de digestão, as tiras de tecido começam a flutuar na solução enzimática após a roda. Durante este tempo, as tiras de tecido atrial também mudam na aparência de rosa pálido a branco como eles são digeridos. - Após a digestão enzimática, realize três lavagens usando 2,5 mL de solução de KB nos tubos inferiores redondos de 5 mL preparados na etapa 2,4. Para cada lavagem, inverta suavemente o tubo 3 vezes antes de mover o tecido para o tubo seguinte utilizando a pipeta com polimento de fogo de médio diâmetro. Após a lavagem final, transfira as tiras para o tubo inferior redondo de 14 mL contendo 2,5 mL de solução KB. Aguarde 5 min.
- Triturar suavemente o tecido por 7,5 min usando a pipeta de largo furo de fogo polido. Isso irá dissociar mecanicamente as tiras de tecido e produzir uma solução turva cheia de miócitos atriais individuais.
Nota: Durante a trituração, o tecido fica branco e a solução fica turva. A força do trituration, conseguida alterando a freqüência e a velocidade de expelir as tiras do tecido da pipeta fogo-lustrada larga do furo, deve ser costurada ao isolamento individual. Se a trituração é demasiado delicada, o rendimento da pilha será baixo, quando a trituração que é demasiado áspera renderá muitas pilhas inoperantes. Evite bolhas ao triturar. - Encha o tubo inferior redondo de 14 mL contendo as tiras de tecido trituradas com solução KB para um volume final de 7-10 mL, dependendo da densidade desejada de células para uso experimental. Coloque este tubo à temperatura ambiente durante 1 h. Após este período de incubação, as células podem ser usadas para uma variedade de experimentos para até 7 h. as células também podem ser armazenadas a 4 ° c por até 7 h.
Resultados
Os miócitos atrial isolados usando este protocolo podem ser usados para caracterizar as propriedades electrofisiológicas destas pilhas usando a técnica da remendo-braçadeira. Alíquotas de miócitos atriais em solução KB podem ser adicionadas à câmara de gravação de um aparelho de fixação de remendo padrão e superfundidos com soluções apropriadas para o tipo de gravação dos desejos experimentalistas de realizar. Os miócitos atrial isolados usando este protocolo são usados melhor para estudos electrofisiológicos dentro de 6-7 h do isolamento. Os dados representativos do remendo-grampo de nosso laboratório são apresentados abaixo.
A Figura 4 ilustra exemplos de miócitos atriais isolados de camundongos normais preparados com o protocolo acima. Os miócitos atriais isolados estão tipicamente na ordem de 100 μm de comprimento e 10 μm de largura com estrias claras. A capacitância de miócitos atrial isolados é tipicamente 40-70 pF.
A Figura 5a ilustra um exemplo de um miócitos atrial AP gravado usando a técnica perfurada da remendo-braçadeira no modo atual da braçadeira, como nós descrevemos previamente6,19,20. Os dados resumidos ilustrando os parâmetros típicos de AP de miócitos atrial são fornecidos na tabela 6. Especificamente, apresentamos dados resumidos para medições de potencial de membrana de repouso (PGR), velocidade máxima de subida (Vmáx), OVERSHOOT (os) e duração de AP em 50% (APD50), 70% (apd70) e 90% (APD90) repolarização tempo (tabela 6). Os AP podem igualmente ser gravados na configuração de célula inteira14. As soluções de superfusão e pipeta para gravação de APs estão disponíveis na tabela 7 e na tabela 8.
A Figura 5b ilustra uma família representativa de na+ correntes (Ina) registradas em toda a configuração da célula da técnica de patch-Clamp. Estas correntes foram gravadas usando 50 ms tensão braçadeira passos entre-100 e + 10 mV a partir de um potencial de exploração de-120 mV. Descrevemos abordagens e protocolos para gravação de Ina anteriormente6,14,20. Um resumo Ina IV relação também é apresentado na Figura 5b. As soluções utilizadas para gravar Ina são apresentadas na tabela 7 e na tabela 8.
A Figura 5C ilustra uma família representativa de CA2 + correntes (ICA, L) gravadas em toda a configuração da célula da técnica de remendo-grampo. Estas correntes foram gravadas usando 250 MS tensão braçadeira passos entre-60 e + 80 mV a partir de um potencial de exploração de-70 mV. As condições experimentais que podem ser usadas para medir ICA, L foram descritas previamente17,18,20. Um sumário ICA, L IV relacionamento também é apresentado na Figura 5C. As soluções utilizadas para gravar ICA, L estão disponíveis na tabela 7 e na tabela 8.
A Figura 5D ilustra uma família representativa de k+ correntes (Ik) gravadas na configuração inteira da pilha da técnica da remendo-braçadeira. Estas correntes foram gravadas a partir de um potencial de retenção de-80 MV usando 500 MS tensão Clamp passos entre-120 MV e + 80 MV, como descrevemos anteriormente6,14. O resumo da relação IV para o total IK também é apresentado na Figura 5D. As soluções utilizadas para gravar IK estão disponíveis na tabela 7 e na tabela 8.
Usando essas abordagens para registrar APs e grandes famílias de correntes iônicas, incluindo na+, CA2 + e K+ correntes (como ilustrado acima), permite ao investigador interrogar rigorosamente a eletrofisiologia do miócitos atrial em um pletora de condições experimentais. Nosso laboratório empregou rotineiramente essas técnicas para estudar a eletrofisiologia dos miócitos atriais em camundongos normais, em modelos de camundongo de cardiopatia e emcamundongos geneticamente modificados6,14,17,18 ,19,20.

Figura 1: fluxograma para o protocolo de isolamento de miócitos atrial. Sumário das etapas usadas para isolar miócitos atrial usando este protocolo. Por favor clique aqui para ver uma versão maior desta figura.
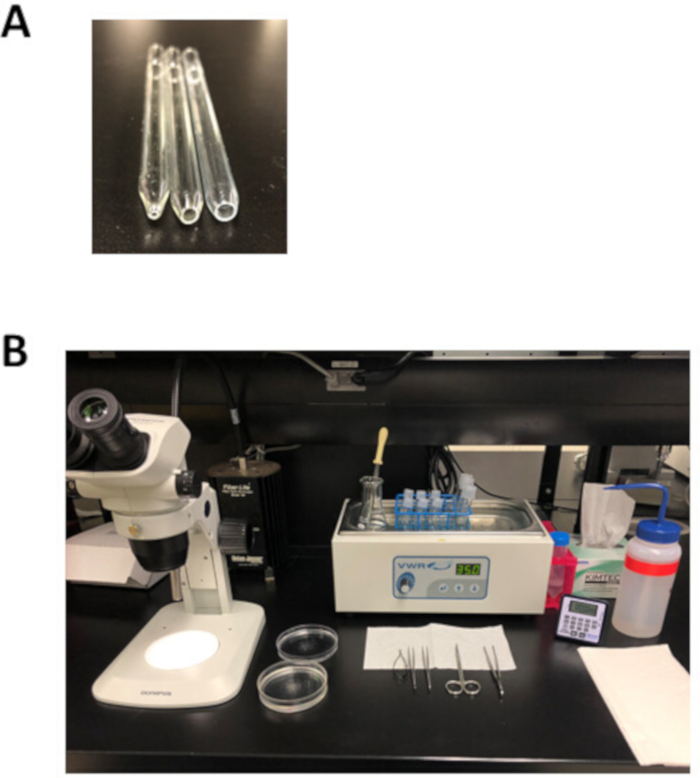
Figura 2: instalação experimental e ferramentas de dissecção para isolamento de miócitos atriais. (A). uma pipeta fogo-lustrada pequena do furo com uma abertura 1 milímetro no diâmetro (esquerdo) é usada para a transferência do tecido depois da dissecção, uma pipeta fogo-lustrada do furo médio com uma abertura 3 milímetros no diâmetro (meio) é usada para transferir tiras do tecido durante isolamento, e um grande furo de fogo-polido pipeta com uma abertura 5 mm de diâmetro (direito) é usado para a trituração de digerido tecido atrial. (B). configuração experimental para a isolação atrial do miócitos. Por favor clique aqui para ver uma versão maior desta figura.
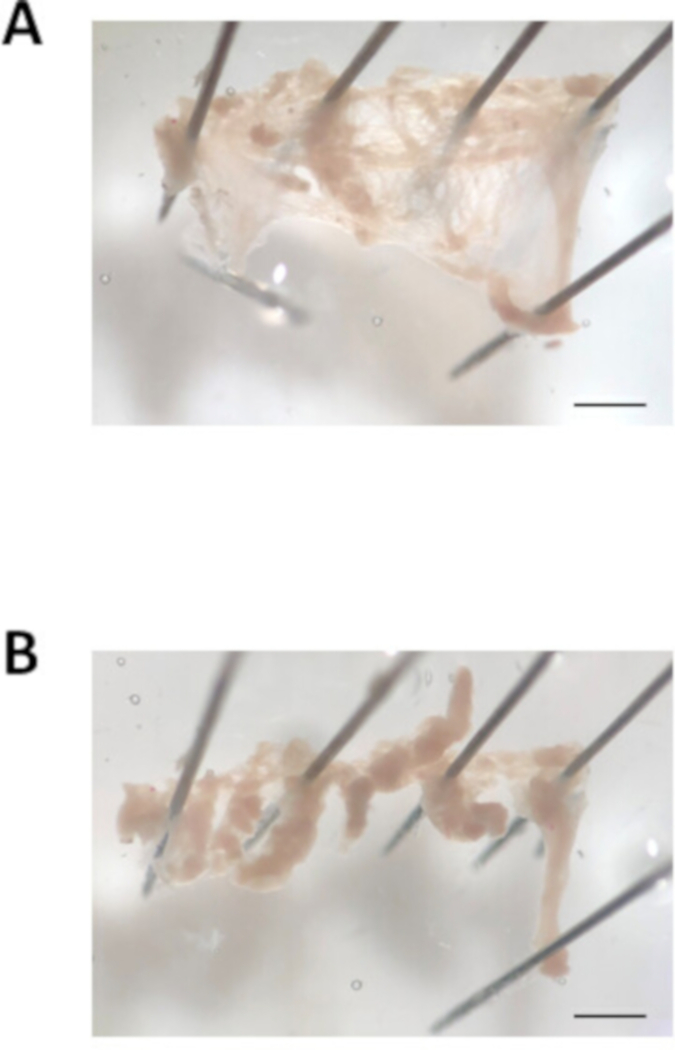
Figura 3: imagem da dissecção do apêndice atrial. (A). a imagem de campo brilhante representativa de um apêndice atrial extirpado cortou aberto e fixado para fora. (B). imagem de campo brilhante representativa do Apêndice Atrial cortado em tiras de tecido de aproximadamente 0,7 mm de largura. Barra de escala = 1 mm. por favor clique aqui para ver uma versão maior desta figura.
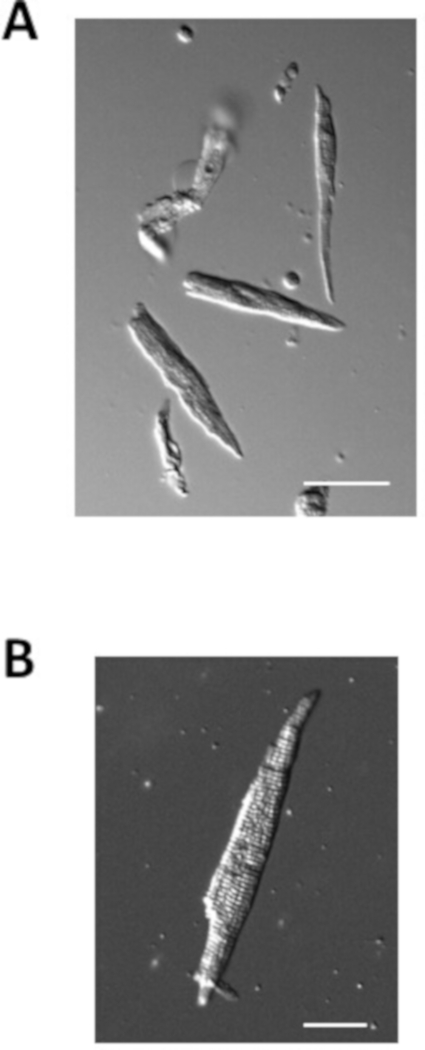
Figura 4: imagens de miócitos atriais isolados. (A). imagem do brightfield de miócitos atrial isolados imediatamente depois da isolação. Barra de escala = 50 μm. Imagem de (B). brightfield de um único myocyte atrial isolado. Barra de escala = 100 μm. Por favor clique aqui para ver uma versão maior desta figura.
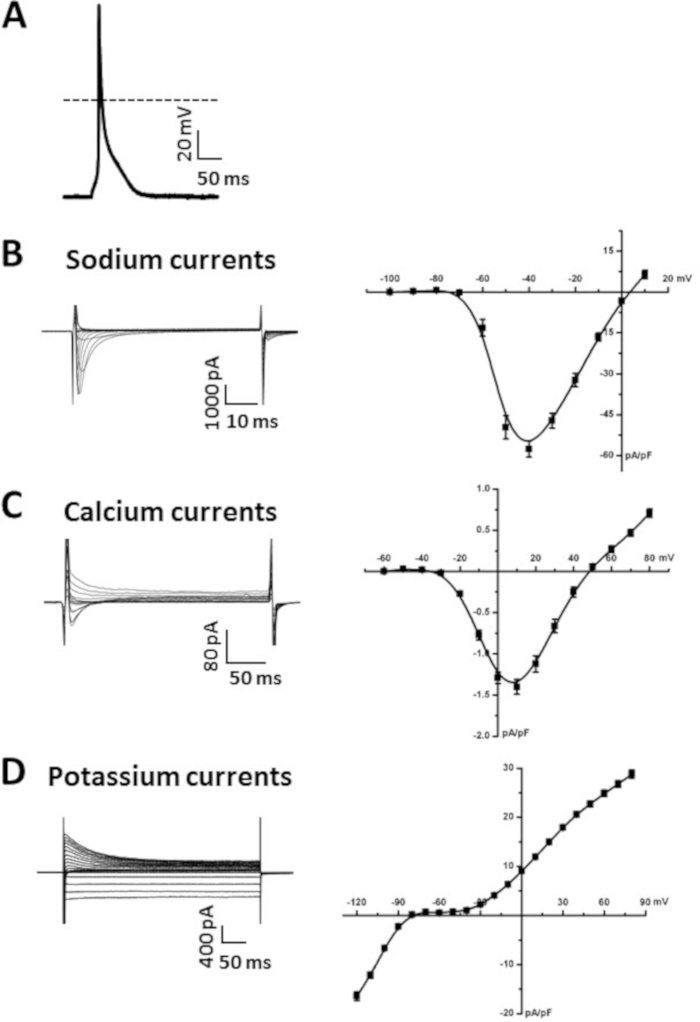
Figura 5: dados representativos do remendo-grampo obtidos dos myocytes atrial isolados. (A). representante estimulou a gravação de AP de um miócito atrial isolado. O resumo dos parâmetros de AP é apresentado na tabela 6. A anfotericina B (200 μg/mL) foi adicionada à solução de pipeta para permeabilizar a membrana celular. (B). representante ina gravações (esquerda) e Resumo ina IV Curve (direita) de um miócito atrial isolado. A nifedipina (10 μM) foi adicionada à solução modificada de Tyrode para bloquear ICA, L ao gravar ina. C. representante ICA, l gravações (esquerda) e Sumário iCA, curva de l IV (direita) de um myocyte atrial isolado. (D). representante ik gravações (esquerda) e Resumo ik IV Curve (direita) de um miócito atrial isolado. As soluções utilizadas para registrar cada uma dessas correntes estão listadas na tabela 7 e na tabela 8. As curvas Sumário IV são medidas médias de 10 miócitos atriais isolados de um rato tipo selvagem C57Bl/6 masculino de 15 semanas de idade. Por favor clique aqui para ver uma versão maior desta figura.
| PH do estoque Tyrode 6,9 | PH do estoque Tyrode 7,4 | |
| Química | em mM | em mM |
| Nacl | 140 | 140 |
| Kcl | 5,4 | 5,4 |
| KH2po4 | 1,2 | 1,2 |
| HEPES | 5 | 5 |
| Volume final | 500 mL | 1 litro |
| PH final com NaOH | 6,9 | 7,4 |
Tabela 1: pH do estoque tyrode 7,4 e soluções de ph 6,9 do estoque de Tyrode. Composição das soluções de stock Tyrode (pH 7,4 e pH 6,9) que podem ser feitas com antecedência e armazenadas a 4 ° c por até 2 meses.
| Química | em mM |
| K-glutamato | 100 |
| K-aspartato | 10 |
| Kcl | 25 |
| KH2PO4 | 10 |
| MgSO4 | 2 |
| Taurina | 20 |
| Creatina | 5 |
| EGTA | 0,5 |
| Glicose | 20 |
| HEPES | 5 |
| Bsa | 0,10% de |
| Volume final | 1 litro |
| PH final com KOH | 7,2 |
Tabela 2: solução KB modificada. Receita para solução KB modificada que pode ser feita com antecedência, aliquotada e armazenada em-20 ° c por até 2 meses.
| Química | Quantidade |
| Glicose | 5,55 milímetros |
| MgCl2 | de 1 mM |
| CaCl2 | 1,8 milímetros |
| PH do estoque Tyrode 7,4 | 50 mL |
| Heparina | 250 μL |
Tabela 3: modificada a solução de pH 7,4 de Tyrode com glicose, magnésio, cálcio e heparina. Composição da solução de pH 7,4 modificada de Tyrode usada para a dissecção do tecido atrial. Esta solução deve ser feita fresca e mantida em um banho de água de 35 ° c até o uso.
| Química | Quantidade |
| Glicose | 18,5 milímetros |
| Taurina | 49,96 milímetros |
| Bsa | 15 mg de |
| CaCl2 | 0, 66 milímetros |
| PH do estoque Tyrode 6,9 | 15 mL de |
Tabela 4: solução de pH 6,9 modificada de Tyrode contendo glicose, taurina, BSA e baixo cálcio. Composição da solução modificada do pH 6,9 de Tyrode usada para o isolamento atrial do miócitos. Esta solução deve ser feita fresca e mantida em um banho de água de 35 ° c até o uso.
| Química | Quantidade |
| Colagenase | 1.064 U |
| Elastase | 9 de U |
| Solução de protease | 65,2 μL |
| PH modificado de Tyrode 6,9 | 5 mL de |
Tabela 5: solução enzimática. Composição da solução enzimática usada para digerir enzimaticamente tiras de tecido atrial. Esta solução deve ser feita fresca e mantida em um banho de água de 35 ° c até o uso.
| Parâmetro | Média |
| RMP (mV) | -74,2 ± 0,7 |
| VMAx (V/s) | 144,6 ± 5,8 |
| OS (mV) | 71,9 ± 3,0 |
| APD50 (Senhora) | 11,1 ± 1,7 |
| APD70 (Senhora) | 23,0 ± 4,6 |
| APD90 (Senhora) | 54,7 ± 7,8 |
Tabela 6: Resumo dos parâmetros de AP de miócitos atriais isolados. Os dados são apresentados como média ± MEV, n = 10 miócitos atriais isolados de um rato C57Bl/6 masculino de 15 semanas.
| Correntes de potássio e APs | Correntes de sódio | Correntes de cálcio | |
| Química | em mM | em mM | em mM |
| Nacl | 140 | 5 | |
| Kcl | 5,4 | ||
| MgCl2 | 1 | 1 | 1 |
| CaCl2 | 1 | 1 | 2 |
| HEPES | 10 | 10 | 10 |
| Glicose | 5,5 | 5,5 | 5,5 |
| Cscl | 130 | ||
| TEA-CL | 5,4 | 145,5 | |
| Ph | 7,4 com NaOH | 7,4 com CsOH | 7,4 com CsOH |
Tabela 7: composição das soluções de Tyrode utilizadas durante experimentos de patch-Clamp. Composição das soluções de Tyrode usadas para gravar APs, Ina, iCA, L, e iK de myocytes atrial isolados.
| Correntes de potássio e APs | Correntes de sódio | Correntes de cálcio | |
| Química | em mM | em mM | em mM |
| Nacl | 5 | 5 | 5 |
| Kcl | 140 | ||
| MgCl2 | 1 | 1 | 1 |
| CaCl2 | 0,2 | 0,2 | 0,2 |
| HEPES | 10 | 10 | 10 |
| EGTA | 5 | 5 | |
| Mg-ATP | 4 | 5 | 4 |
| Na-GTP | 0,3 | 0,3 | 0,3 |
| Na-fosfocreatina | 6,6 | 6,6 | |
| Cscl | 130 | 135 | |
| EGTA | 5 | ||
| Ph | 7,2 com KOH | 7,2 com CsOH | 7,2 com CsOH |
Tabela 8: composição da solução de pipeta interna usada durante experimentos de patch-Clamp. Composição das soluções de enchimento de pipeta usadas para gravar APs, Ina, iCA, L, e iK de miócitos atrial isolados.
Discussão
Nosso laboratório rotineiramente usa este protocolo para isolar os miócitos atriais do camundongo para uso em experimentos de patch-Clamp, a fim de investigar os efeitos de diferentes formas de doença cardiovascular, mutações genéticas ou compostos farmacológicos em miócitos atriais Eletrofisiologia. Embora altamente reprodutível, a qualidade dos dados obtidos dos miócitos atriais isolados depende da qualidade do isolamento. Além disso, a reintrodução do cálcio após o isolamento do miócitos atrial resultará na morte celular de uma população de miócitos isolados devido ao paradoxo do cálcio16. Assim, isolar os miócitos atriais viáveis e de alta qualidade usando essa abordagem requer prática e otimização em múltiplos pontos ao longo do isolamento. Uma vez otimizado, estima-se que entre 70-90% dos miócitos atrial totais isolados usando esta abordagem será tanto o cálcio tolerante e haste em forma. As etapas que exigem mais prática e otimização são discutidas abaixo.
A velocidade e a eficiência da dissecção terão efeitos a jusante sobre a qualidade das células isoladas. É importante tomar o tempo para assegurar-se de que todo o sangue esteja removido do tecido atrial e que as tiras do tecido estejam cortadas a um tamanho similar. Deve demorar aproximadamente 5 min para remover o Apêndice Atrial, cortar o tecido em tiras e transferir as tiras de tecido para o primeiro tubo da solução de pH 6,9 modificada de Tyrode. No entanto, se esta etapa demorar muito, a qualidade do tecido pode ser comprometida.
Também é importante que as tiras de tecido são cortadas para um tamanho uniforme dentro de um isolamento e entre os corações. Se tiras de tecido são muito grandes ou muito pequenas, ou se eles não são uniformes dentro de um isolamento, isso pode causar problemas durante a digestão enzimática e trituração. Isto é porque as tiras pequenas serão digeridas mais completamente e as grandes tiras estarão digerido. É igualmente importante considerar o genótipo e o ajuste da doença que está sendo estudado enquanto o tamanho do apêndice atrial pode variar entre animais. Por exemplo, os corações hipertróficos têm apêndices atriais maiores em comparação com corações saudáveis, e, portanto, o experimentador pode cortar mais tiras em corações hipertróficos em comparação com os corações de tamanho normal. Assim, otimizar o tamanho das tiras de tecido cortado e aplicar essas dimensões a cada Apêndice Atrial individual melhorará muito a reprodutibilidade das isolações de miócitos entre as condições experimentais.
O delicado equilíbrio entre a digestão enzimática e a dissociação mecânica é a chave para um isolamento de miócitos atrial bem-sucedido usando este protocolo. Se o tecido não é adequadamente roto durante a digestão enzimática, as tiras de tecido individuais tenderão a se amontoarem e ficar juntas, o que limitará a eficácia da digestão enzimática. Se agitado com demasiada frequência ou vigorosamente, isso pode danificar o tecido atrial, o que resultará no isolamento de células não viáveis. A dissociação mecânica de miócitos atriais isolados de tiras de tecido durante a trituração é o passo mais crítico para a prática e otimização usando essa abordagem para isolar os miócitos atriais. Se a trituração for muito delicada, o rendimento das células será baixo. Por outro lado, se a trituração for muito dura, então uma abundância de miócitos não viáveis será isolada, e a qualidade dos dados obtidos durante os experimentos de patch-Clamp será comprometida. Além disso, a composição dos átrios pode afetar o isolamento. Por exemplo, se o tecido é fibrótico, a digestão enzimática e as etapas de trituração podem precisar ser modificadas. Portanto, é importante ter tempo para desenvolver as habilidades necessárias para obter células de alta qualidade durante a trituração que pode ser usado para experimentos de patch-Clamp.
Como em todas as técnicas experimentais existem limitações. Essa técnica requer prática para isolar de forma revisível os miócitos viáveis e de alta qualidade, o que, por sua vez, impactará a viabilidade de quaisquer experimentos a serem realizados usando esses miócitos. Esta aproximação é igualmente os miócitos terminais e atrial isolados usando esta aproximação podem ser usados no dia do isolamento somente. Nosso laboratório usa as células dentro de 6-7 h de isolamento.
Esta aproximação de isolar cardiomiócitos atrial tem diversas aplicações. Por exemplo, esta abordagem pode ser modificada para isolar os miócitos atriais (bem como os fibroblastos cardíacos) de outras espécies, incluindo biópsias de tecido atrial humano. Além disso, um benefício para o uso deste método de bloco para o isolamento de miócitos atrial (em contraste com a perfusão retrógrada do coração) é que ele pode ser modificado para isolar os cardiomiócitos de outras regiões do coração, como o nó sinoatrial ou outras regiões específicas do miocárdio atrial, ou abranger toda a região supraventricular do coração. Nosso laboratório utiliza cardiomiócitos atriais para experimentos de patch-Clamp para medir potenciais de ação e correntes iônicas, embora essa abordagem não precise ser limitada a essa técnica. Por exemplo, os miócitos isolados podem ser usados para investigar alterações em transientes de cálcio e contratilidade em uma variedade de configurações experimentais. Os cardiomiócitos atriais também podem ser usados em estudos de imunofluorescência para estudar a localização de proteínas ou estruturas de interesse. Consequentemente, esta aproximação é altamente versátil com muitas aplicações possíveis.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho é apoiado por subsídios operacionais da Canadian institutos de pesquisa em saúde (MOP 93718, 142486) e do coração e Stroke Foundation do Canadá para a ra. Rose. H.J. Jansen é o destinatário de uma bolsa de pós-doutorado Killam.
Materiais
| Name | Company | Catalog Number | Comments |
| 1, 2-Bis(2-Aminophenoxy)ethane-N, N, N', N'-tetraacetic acid 98% | Sigma | A4926-1G | |
| Adenosine 5'-triphosphate disodium salt hydrate BioXtra, > 99%, from microbial | Sigma | A7699-1G | |
| Adenosine 5'-triphosphate magnesium salt > 95%, bacterial | Sigma | A9187-1G | |
| Amphocetericin B from Streptomyces sp. ~80% (HPLC), powder | Sigma | A4888-500 MG | |
| Bovine serum albumin | Sigma | A3059-50G | |
| Calcium chloride dihydrate | Sigma | 223506-500G | |
| Cesium chloride ReagentPlus, 99.9% | Sigma | 289329-100G | |
| Cesium hydroxide monohydrate > 99.5% trace metals basis | Sigma | 562505-1KG | |
| Collagenase Type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine anhydrous | Sigma | C0780 | |
| D-(+)-Glucose | Sigma | G7021-1KG | |
| DL-Aspartic acid potassium salt | Sigma | A2025-100G | |
| Elastase suspension | Worthington Biochemical Corporation | LS002279 | |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid >97.0% | Sigma | E4378-25G | |
| Guanosine 5'-triphosphate sodium salt hydrate > 95% (HPLC), powder | Sigma | G8877-250MG | |
| Heparin 10 000 USP units/10mL | SANDOZ | 10750 | |
| HEPES > 99.5% (titration) | Sigma | H3375-500G | |
| L-Glutamic acid potassium salt monohydrate > 99% (HPLC), powder | Sigma | G1501-500G | |
| Magnesium sulfate | Sigma | M2643-500G | |
| Nifedipine > 98% (HPLC), powder | Sigma | N7634-1G | |
| Phosphocreatine disodium salt hydrate enzymatic, approx 98% | Sigma | P7936-5G | |
| Potassium chloride ACS reagent, 99.0-100.5% | Sigma | P3911-500G | |
| Potassium hydroxide | EM Science | PX1480-1 | |
| Potassium phosphate monobasic | EMD | PX1565-1 | |
| Protease from Streptomyces griseus, type XIV, >3.5 units/mg solid, powder | Sigma | P5147-1G | |
| Sodium chloride ACS reagent, > 99.0% | Sigma | S9888-2.5KG | |
| Sodium hydroxide, pellets, 97+%, A.C.S. reagent | Sigma | 221465-500G | |
| Sylgard 184 silicone elastomer kit | World Precision Instruments Inc | SYLG184 | |
| Taurine | Sigma | T0625-100G | |
| Tetraethylammonium chloride > 98% (titration) | Sigma | T2265-100G |
Referências
- Bartos, D. C., Grandi, E., Ripplinger, C. M. Ion Channels in the Heart. Comprehensive Physiology. 5 (3), 1423-1464 (2015).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circulation Research. 114 (9), 1483-1499 (2014).
- Jalife, J. Mechanisms of persistent atrial fibrillation. Current Opinion in Cardiology. 29 (1), 20-27 (2014).
- Nattel, S., Maguy, A., Le Bouter, S., Yeh, Y. H. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation. Physiological Reviews. 87 (2), 425-456 (2007).
- Jansen, H. J., et al. Atrial structure, function and arrhythmogenesis in aged and frail mice. Scientific Reports. 7, 44336 (2017).
- Jansen, H. J., et al. Distinct patterns of atrial electrical and structural remodeling in angiotensin II mediated atrial fibrillation. Journal of Molecular and Cellular Cardiology. 124, 12-25 (2018).
- Nerbonne, J. M., Kass, R. S. Molecular physiology of cardiac repolarization. Physiological Reviews. 85 (4), 1205-1253 (2005).
- Grant, A. O. Cardiac ion channels. Circulalation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Schmitt, N., Grunnet, M., Olesen, S. P. Cardiac potassium channel subtypes: new roles in repolarization and arrhythmia. Physiological Reviews. 94 (2), 609-653 (2014).
- Lomax, A. E., Kondo, C. S., Giles, W. R. Comparison of time- and voltage-dependent K+ currents in myocytes from left and right atria of adult mice. American Journal of Physiology Heart and Circulatory Physiology. 285 (5), H1837-H1848 (2003).
- Li, D., Zhang, L., Kneller, J., Nattel, S. Potential ionic mechanism for repolarization differences between canine right and left atrium. Circ Res. 88 (11), 1168-1175 (2001).
- Wirth, K. J., Knobloch, K. Differential effects of dofetilide, amiodarone, and class lc drugs on left and right atrial refractoriness and left atrial vulnerability in pigs. Naunyn Schmiedebergs Archives of Pharmacology. 363 (2), 166-174 (2001).
- Qi, A., Yeung-Lai-Wah, J. A., Xiao, J., Kerr, C. R. Regional differences in rabbit atrial repolarization: importance of transient outward current. American Journal of Physiology. 266 (2 Pt 2), H643-H649 (1994).
- Jansen, H. J., et al. NPR-C (Natriuretic Peptide Receptor-C) Modulates the Progression of Angiotensin II-Mediated Atrial Fibrillation and Atrial Remodeling in Mice. Circulation: Arrhythmia and Electrophysiology. 12 (1), e006863 (2019).
- Mangoni, M. E., Nargeot, J. Genesis and regulation of the heart automaticity. Physiological Reviews. 88 (3), 919-982 (2008).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Springer, J., et al. The natriuretic peptides BNP and CNP increase heart rate and electrical conduction by stimulating ionic currents in the sinoatrial node and atrial myocardium following activation of guanylyl cyclase-linked natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 52 (5), 1122-1134 (2012).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. A. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PLoS One. 7 (10), e47652 (2012).
- Egom, E. E., et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. Journal of Physiology. 593 (5), 1127-1146 (2015).
- Hua, R., et al. Effects of Wild-Type and Mutant Forms of Atrial Natriuretic Peptide on Atrial Electrophysiology and Arrhythmogenesis. Circulation: Arrhythmia and Electrophysiology. 8 (5), 1240-1254 (2015).
- Krishnaswamy, P. S., et al. Altered parasympathetic nervous system regulation of the sinoatrial node in Akita diabetic mice. Journal of Molecular and Cellular Cardiology. 82, 125-135 (2015).
- Mackasey, M., et al. Natriuretic peptide receptor C (NPR-C) protects against angiotensin II mediated sinoatrial disease in mice. JACC Basic to Translational Science. , (2018).
- Azer, J., Hua, R., Vella, K., Rose, R. A. Natriuretic peptides regulate heart rate and sinoatrial node function by activating multiple natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 53 (5), 715-724 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados