Method Article
成体マウスからの心房筋細胞の単離
要約
このプロトコルは、チャンク消化アプローチを使用して、成人マウス心臓から単一の心筋細胞を単一の心筋細胞を分離するために使用される。このアプローチは、パッチクランプ研究で心房筋細胞電気生理学を特徴付けるために使用できる右または左心房筋細胞を単離するために使用されます。
要約
心房筋細胞の電気生理学的特性は、全体的な心臓機能に重要な影響を与える。作用電位を引き起こす基礎電解電流の変化は、多くの状態や疾患状態で非常に一般的である心房細動などの不整脈の根底にある不整脈基板を引き起こす可能性がある。パッチクランプ実験で使用するために成人マウス心筋細胞を分離することは、健康な心房心筋および心房病理の設定における細胞電気生理学に関する我々の知識と理解を大きく進歩させた。さらに、遺伝的マウスモデルを用いた研究は、心房電気生理学を調節する上で膨大なタンパク質の役割を解明した。ここでは、酵素消化とこれらの組織の機械的解離の組み合わせを用いて、成体マウスの心房付属体から心筋細胞を単離するための詳細なプロトコルを提供する。このアプローチは、一貫して確実に分離された心筋細胞を生み出し、その後、多くの実験の下でパッチクランプ実験における作用電位とイオン電流を測定することにより、細胞の電気生理学を特徴付けるために使用することができる条件。
概要
心房は、肺静脈と同様に、優れた、劣った静脈から血液を受け取る心臓の薄い壁、低圧の部屋であり、正常な心臓生理学に不可欠である。心臓の他の領域と同様に、心房には心筋細胞、線維芽細胞、内皮細胞、血管平滑筋細胞など、多くの細胞型が含まれています。心房筋細胞は、心臓を通る電気信号の伝導に重要な役割を果たす電気的興奮性細胞であり、それによって各心臓拍動1の間に適切な心房収縮を保証する。心房の電気的機能不全は、心房フラッターおよび心房細動2、3などの心房特異的不整脈の数を引き起こす可能性がある。これらは非常に一般的であり、まだ十分に理解されていない、重大な罹患率および死亡率につながる心房不整脈である。心房細動は、遺伝子変異に関連して、加齢に関連して、または高血圧、心不全および糖尿病を含む後天性心疾患の設定で起こり得る2、4、5 、6.これらの条件は、不整脈発生1、2の有病率を増加させる基板を作成することができる心房筋細胞の電気的特性を変更することができます。
心房における正常な電気機能は、心房不整脈と同様に、心房筋細胞で産生される作用電位(AP)の形態によって重要に影響を受ける。心房APは、ナトリウム電流(I Na、NaV1.5チャネルによって運ばれる)、L型カルシウム電流(ICa,L、Cav 1.2およびCaV1.3チャネルによって運ばれる)を含む多数のイオン電流の活性から生成される。)、超急速遅延整流カリウム電流(I Kur、KV1.5チャンネルによって運ばれる)を含むいくつかのカリウム電流、一過性外向カリウム電流(Iに、KV4.2およびKV4.3によって運ばれる)チャネル)、定常状態カリウム電流(IKss、KV2.1チャンネルによって運ばれる)、および内側の整流カリウム電流(IK1、Kir2.1チャネルによって運ばれる)1、7、 8.それらはマウスのアトリアで大きな役割を果たしていないが、遅延整流器K+電流(IKrおよびIKs)の急速かつ遅い成分はまた、いくつかの種7におけるAP再分極に寄与する。これらのイオン電流の1つ以上の変化は、心房筋細胞の電気的特性を著しく変化させることができ、心房不整脈を引き起こす可能性がある。例えば、INaの減少は、APアップストローク速度を小さくすることによって、アトリア全体の伝導速度を遅くすることができる。一方、再分光カリウム電流の減少またはICa、Lまたは後期INaの増加は、心房1における自発的な活動を引き起こす可能性のある脱分極後の発症をもたらし得る。 2,9.
心房心筋の異なる部分にAP形態の違いがあり、これらの基礎となるイオンチャネルの発現または調節の違いが生じ得ることを認識することが重要である。例えば、現在の密度に対するIの差と関連して左右のアトリア間のAP持続時間の差は、10、11、12、13とよく記載されている。また、最近では、慢性高血圧6,14を有するマウスの左右の心房に電気改造の明確なパターンがあることを実証した。右心房後壁には、AP形態および発射パターン15の独自のパターンを有するSina房ノードも含まれている。心房のこれらの異なる部分のそれぞれにおける筋細胞の特徴は、これらの各領域からの単離された筋細胞を用いて詳細に調べることができる。
パッチクランプ電気生理学研究のための心房筋細胞を単離するために使用することができるさまざまなアプローチがあります 16.1つの可能性は、心臓が酵素の送達のために大小間を介してカニュールされる逆行灌流アプローチを使用することです。これは実行可能なアプローチですが、心房の灌流の不整合による心房筋細胞質の変動を生じる可能性があります。心房筋細胞の単離に「チャンク」消化アプローチを採用し、心臓の逆行灌流の必要性を排除しました。我々のアプローチは、パッチクランプ研究に適した多数の単離された心房筋細胞を一貫して確実に得る心房組織の酵素消化と機械的解離の組み合わせを使用しています。我々は心房付録組織を使用してここで私たちのアプローチを説明しながら、アプローチは、研究者が選択した心房心筋(すなわち、右または左心房の付属器、自由壁、後壁)の任意の領域で使用することができます。このアプローチは、遺伝子組み換えマウスにおける心房筋細胞電気生理学の研究、心血管疾患のマウスモデル、または薬理学的化合物5、6、17の効果を研究するための理想的な方法です。,18歳,19.
プロトコル
すべての動物の手順は、カルガリー大学動物ケアと使用委員会によって承認され、カナダ動物ケア協議会のガイドラインに従って実施されました。心房筋細胞単離、画像、および以下の代表的な結果は、15週齢の雄野生型C57Bl/6マウスから得られた。我々は日常的にこのプロトコルを使用して、野生型マウス17,18、遺伝子変異を運ぶマウス19、20、および慢性高血圧症などの疾患のマウスモデルから心房筋細胞を単離する6、 14.プロトコルは、雄または雌のマウスに対して同様に使用することができる。我々はまた、マウス心臓17、21、22、23から中房内筋細胞を単離するために、この単離手順の同様のバージョンを利用した。この実験プロトコルのフローチャートは図 1にあります。
1. ストックソリューションおよび機器の準備
- メーカーの指示に従ってシリコーンエラストマーを追加して1解剖皿を準備します。10cmペトリ皿の底を1cmの深さに覆うのに十分なシリコーンエラストマー化合物を追加し、硬化させ、皿に6つの昆虫ピンを挿入します。
注:このシリコーン解剖皿は数ヶ月間再利用され、室温で貯えることができる。 - 図2Aに示すように、直径1mm(小さな穴)、3mm(中ボア)、または直径5mm(大きな穴)の開口部を持つ3つの火磨きパスツールピペットを準備します。これらのピペットを作るために、パストゥールピペットをスコアし、スコアマークに沿ってスナップし、所望のボアサイズよりもわずかに大きい開口部を生成します。金属ファイルを使用して表面を滑らかにし、開いた炎を使用してこの開口部を火磨きます。
注:これは、所望の直径の開口部と滑らかな、火磨かれたエッジを生成します。開口部に亀裂や粗い表面が含まれなることが重要です。これらの火磨かれたピペットは室温で貯えられ、数ヶ月間再利用することができる。 - 表 1に示すように、Tyrode の pH 6.9 ソリューションとタイロードの pH 7.4 ソリューションのストック ソリューションを準備します。また、1M MgCl 2、1M CaCl2、および 100 mM CaCl2の各 10 mL を準備します。すべての溶液に超純水を使用し、最大2ヶ月間4°Cで保存します。
- 表 2に示すように、変更されたクラフト ブリュエ (KB) ソリューションの 1 L を準備します。超純水を使用してください。溶液を20mLのアリコートに分割し、最大2ヶ月間-20°Cで保存します。
2. 心房筋細胞分離のためのソリューションと分離セットアップの準備
- 1M CaCl2および1 M MgCl2ストックソリューションを使用して、表3に記載されている改変されたタイロードのpH 7.4溶液の50 mLを125 mLのエルレンマイヤーフラスコに用意します。図 2Bに示すように、使用するまで 35 °C の水浴にエルレンマイヤー フラスコを置きます。
- 100 mM CaCl2ストック溶液を使用して、50 mL チューブで表 4に記載されている変更された Tyrode の pH 6.9 溶液を準備します。この溶液のアリコート2.5 mLは、3つの5 mLラウンドボトムチューブのそれぞれに。図 2Bに示すように、これらのチューブを使用するまで 35 °C の水浴に置いたワイヤ ラックに入れます。
- 表5に記載の酵素溶液を14mL丸底管に調製する。プロテアーゼ溶液を作るために、超純水の100 μLあたり1mgのプロテアーゼを加えます。この酵素溶液を含むチューブをワイヤーラックに入れ、使用するまで35°Cの水浴にインキュベートします。
- 35°Cの水浴で改変されたKB溶液の1つのアリコートを解凍する。アリコート 2.5 mL の KB 溶液を 3 つの 5 mL ラウンド ボトム チューブと 2.5 mL の各チューブに 14 mL ラウンド ボトム チューブに入れます。これらのチューブをワイヤラックに入れ、使用するまで35°Cの水浴にインキュベートします(図2Bに示すように)。
- 図2Bに示すように、解剖プレート、解剖ツール、パスツールピペット、および火磨きピペットをレイアウトします。
3. マウス心房付録の解剖
- 腹腔内注射を介してヘパリン(10 000 USP U/10 mL)の0.2 mLでマウスを注入し、吸収のために5分待ちます。
- マウスを誘導室に入れ、イソファラン吸入(3-4%)で麻酔する。イソファランと酸素は麻酔機を使用して送達され、無駄な麻酔ガスが清掃されます。マウスが麻酔され、つま先のピンチ反射を示さなかったら、急速な頚部脱臼によってマウスを安楽死させる。ペーパータオルまたはコルク板の上にマウスを置き、マウスを所定の位置に保持するために足をテープで留める。
- 70%のエタノールでマウスの胸を濡らします。湾曲したはさみを使って胸を覆う毛皮と皮膚を取り除きます。次に、ラットの歯鉗子を使用して胸骨を持ち上げ、肋骨の縁に沿って横隔膜を切断します。湾曲したはさみを使用してリブケージ全体を取り外し、心臓を露出させます。
- 心房の付属品(右または左)を取り除くために、細かい解剖鉗子を使用して付属品をそっと持ち上げ、春のはさみで切り取ります。直ちに心房付属品を、ステップ2.1に記載の温変性タイロードのpH 7.4溶液の20mLを含むシリコーンコーティング解剖皿に移す。
- 解剖ピンを上部に1本、心房付属の開口部の下部に1本のピンを置きます。牧草地のピペットを使用して、血液を除去するために温められた変性タイロードのpH 7.4溶液でアトリアを洗い流します。心房付属の上部と下端に沿って切断して、心房付属品を開きます。次に、心房付属品の角をピン留めして、図 3Aに示すように、平らな長方形の組織を作成します。
4. 心房筋細胞の単離
注:このセクションのステップはすべて35 °Cで行われ、管は35°Cの水浴に沈んだ。丸い底管の間でティッシュストリップを移す際には、組織(溶液ではなく)だけがチューブ間で転送されるように注意してください。
- スプリングハサミと細かい鉗子を使用して、心房の付属品を約8-10等サイズのストリップ(幅約0.7mm)にカットします。心房組織のストリップの一例を図3Bに示す。ストリップは、組織の主要部分から自由に切断されると収縮します。小さなボア火磨きピペットを使用して、ステップ2.2に記載の温められた変性タイロードのpH 6.9溶液を含む最初のチューブにティッシュストリップを移します。5分待って
- 第2にそれらを転送することにより、組織ストリップを洗浄し、その後、媒体ボア火磨きピペットを使用してステップ2.2で調製された変更されたタイロードのpH 6.9溶液を含む第3ラウンド底管。
- ティッシュストリップを洗浄するには、5 mL丸底チューブをキャップし、チューブを3回静かに反転させます。組織ストリップをチューブの底部に落ち着かせ、中程度の焼火磨きピペットを使用して次のチューブにティッシュストリップを移します。
- ステップ2.3で説明した酵素溶液に組織ストリップを移し、培地ボア火磨きピペットを使用し、30分間インキュベートし、3〜5分ごとにチューブを旋回させ、組織ストリップが一緒に付着するのを防ぎます。
注:酵素消化の開始時に、組織ストリップは渦巻き後すぐに落ち着く。消化の約20分で、組織ストリップは渦巻く後の酵素溶液に浮き始める。この間、心房組織ストリップは、消化されるにつれて淡いピンクから白に見え変化します。 - 酵素消化後、ステップ2.4で調製した5mL丸底管に2.5mLのKB溶液を用いて3回の洗い出しを行う。洗浄ごとに、チューブを3回軽く反転してから、培地を使用して次のチューブに組織を移動させ、火磨きピペットを使用します。最終的な洗浄の後、KB溶液の2.5 mLを含む14 mLの丸底チューブにストリップを移します。5分待って
- 広い穴の火磨かれたピペットを使用して7.5分間ティッシュを穏やかにトリチュレートします。これは、機械的に組織ストリップを解離し、個々の心房筋細胞で満たされた曇った溶液を得る。
注:トリチュレーション中、組織は白くなり、溶液は白くなります。トリチュレーションの力は、広いボア火磨かれたピペットから組織ストリップを排出する頻度と速度の両方を変更することによって達成され、個々の分離に合わせて調整されるべきである。トリチュレーションが穏やかすぎると、細胞収率は低くなりますが、過酷なトリチュレーションは多くの死んだ細胞を生み出します。トリチュアをしながら気泡を避けてください。 - 実験用の細胞の所望の密度に応じて、KB溶液でトリチュレートされた組織ストリップを含む14 mLの丸底チューブを7-10 mLの最終容積に充填します。このチューブを室温で1時間置きます。このインキュベーション期間に続いて、細胞は7時間までの様々な実験に使用することができ、細胞はまた7時間まで4°Cで貯えることができる。
結果
このプロトコルを用いて単離された心房筋細胞は、パッチクランプ技術を用いてこれらの細胞の電気生理学的特性を特徴付けるために使用することができる。KB溶液中の心房筋細胞のアリコートは、標準的なパッチクランプ装置の記録室に添加し、実験者が行いたい記録の種類に適した溶液でスーパーフ融合することができる。このプロトコルを使用して単離された心房筋細胞は、単離の6〜7時間以内の電気生理学的研究に最もよく使用される。当研究室の代表的なパッチクランプデータを以下に示します。
図4は、上記のプロトコルを用いて調製した正常マウスから単離された心房筋細胞の例を示す。単離された心房筋細胞は、通常、長さが 100 μm、幅が 10 μm の順序で明確なストレーションを伴います。単離された心房筋細胞の容量は、典型的には40〜70 pFである。
図5Aは、前述の6、19、20に記載したように、現在のクランプモードで穿止パッチクランプ技術を用いて記録された心房筋細胞APの例を示す。典型的な心房筋細胞APパラメータを示す要約データは、表6に示す。具体的には、安静膜電位(RMP)、最大上げ速度(Vmax)、オーバーシュート(OS)、AP持続時間の測定に関する要約データを50%(APD 50)、70%(APD 70)、90%(APD90)再偏光で示します。時間 (表6)AP は、セル構成14全体に記録することもできます。AP を記録するためのスーパーフュージョンおよびピペット ソリューションは、表 7および表 8で使用できます。
図5Bは、パッチクランプ技術のセル構成全体に記録されたNa+電流(INa)の代表的なファミリーを示す。これらの電流は、-120mVの保持電位から-100~+10mVの間の50ms電圧クランプステップを用いて記録した。私たちは、以前にINaを記録するためのアプローチとプロトコルを説明しました 6,14,20.図5Bの要約I Na IV 関係も示します。INaを記録するために使用されるソリューションは、表 7および表 8に示されています。
図5Cは、パッチクランプ技術のセル構成全体に記録されたCa2+電流(ICa,L)の代表的なファミリーを示す。これらの電流は、-70 mVの保持電位から-60~+80mVの間の250ms電圧クランプステップを用いて記録した。ICa,Lを測定するために使用できる実験条件は、前述の17,18,20.要約ICa,L IV関係も図5Cに示されている。ICa,Lを記録するために使用されるソリューションは、表 7および表 8で使用できます。
図5Dは、パッチクランプ技術のセル構成全体に記録されたK+電流(IK)の代表的なファミリーを示す。これらの電流は、前述したように、-120 mVと+80 mVの間の500ms電圧クランプステップを使用して-80 mVの保持電位から記録されました6,14.合計 IKの要約 IV 関係も図 5Dに示されています。IKを記録するために使用されるソリューションは、表 7および表 8で使用できます。
これらのアプローチを使用して、Na+、Ca2+および K+電流を含むイオン電流の主要な家族を記録するために、研究者は、心房筋細胞電気生理学を厳密に尋問することができます。実験条件の多く。私たちの研究室は、通常のマウス、心臓病のマウスモデル、および遺伝子組み換えマウス6、14、17、18の心房筋細胞電気生理学を研究するために、これらの技術を日常的に採用してきました。 、19、20.

図1:心房筋細胞単離プロトコルのフローチャート。このプロトコルを使用して心房筋細胞を単離するために使用される手順の概要。この図のより大きなバージョンを表示するには、ここをクリックしてください。
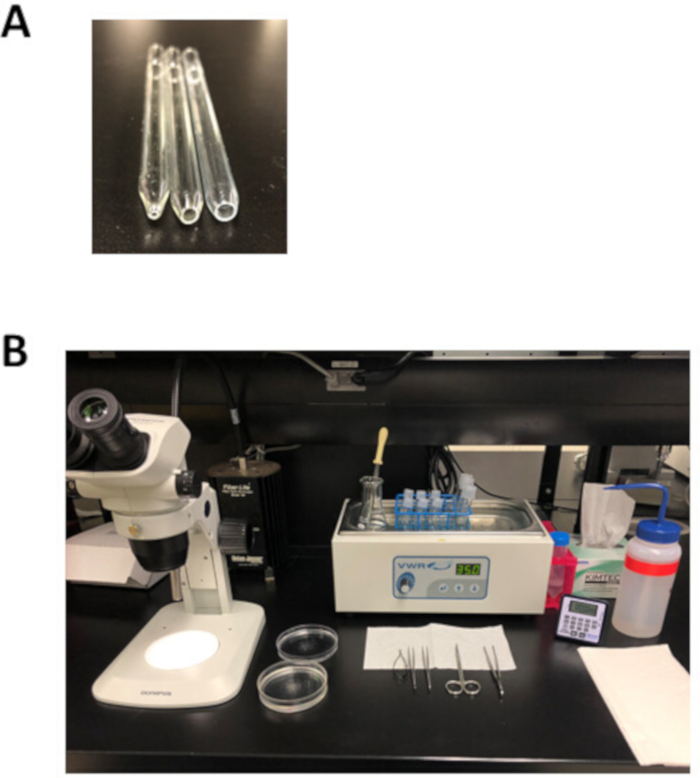
図2:心房筋細胞単離のための実験的セットアップおよび解剖ツール(A)直径1mmの開口部を持つ小さなボア火磨きピペット(左)は解剖後の組織移動に使用され、直径3mm(中央)の開口部を持つ媒体ボア火磨きピペットは、組織ストリップを移動するために使用されます。分離し、直径5mmの開口部を持つ大きなボア火磨きピペット(右)は、消化された心房組織のトリチュレーションに使用されます。(B) 心房筋細胞単離のための実験的セットアップ。この図のより大きなバージョンを表示するには、ここをクリックしてください。
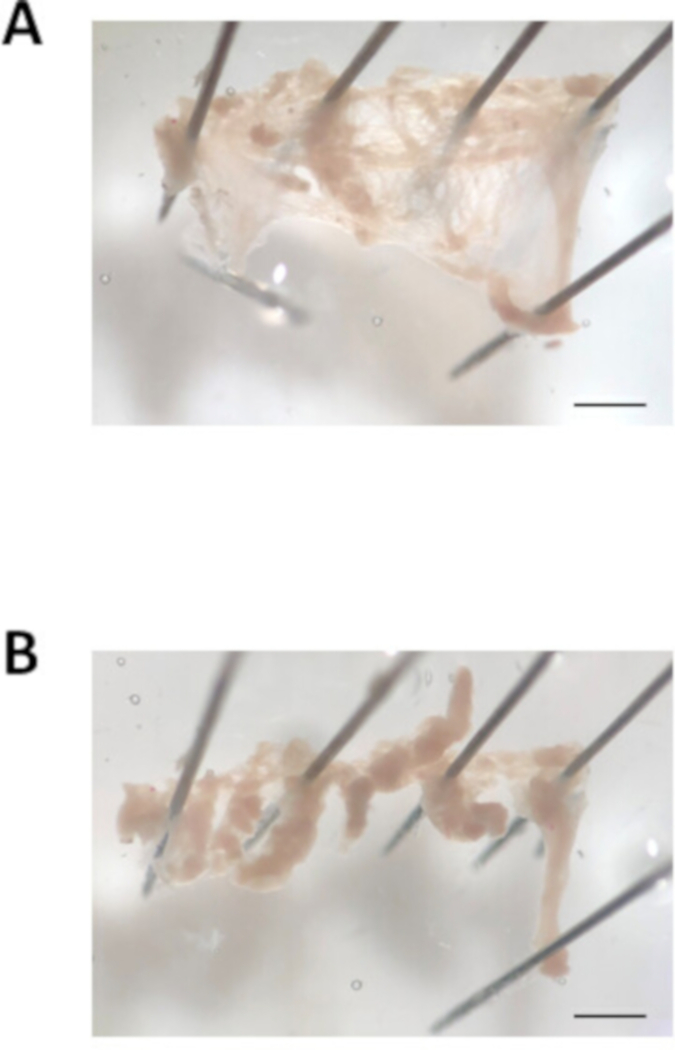
図3:心房付属解剖の画像。(A)切除された心房付録の代表的な明るいフィールド画像を開いてピン留めした。(B)心房付属の代表的な明視野画像は、幅約0.7mmの組織ストリップに切断した。スケールバー = 1 mm.この図の大きなバージョンを表示するには、ここをクリックしてください。
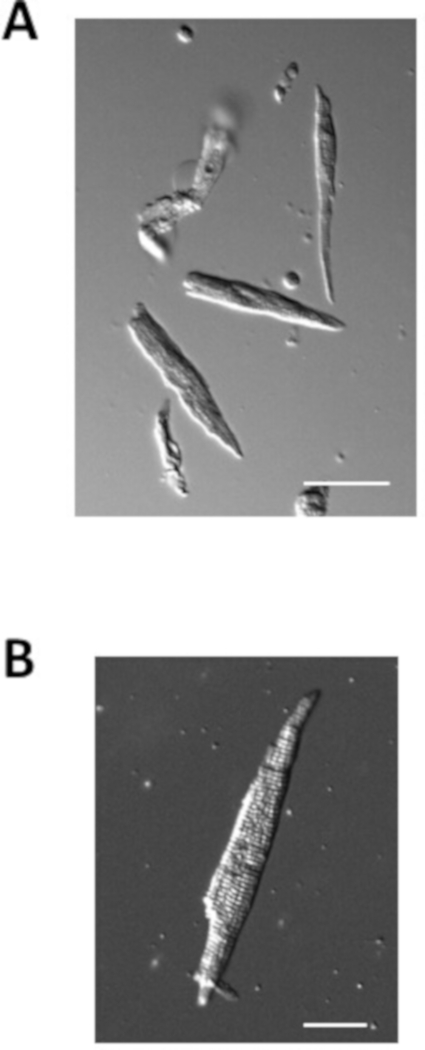
図4:単離された心房筋細胞の画像。(A)単離直後の単離心筋細胞のブライトフィールド画像。スケールバー = 50 μm.(B)単一の単個体心筋細胞のブライトフィールド画像。スケールバー = 100 μm。この図のより大きなバージョンを表示するには、ここをクリックしてください。
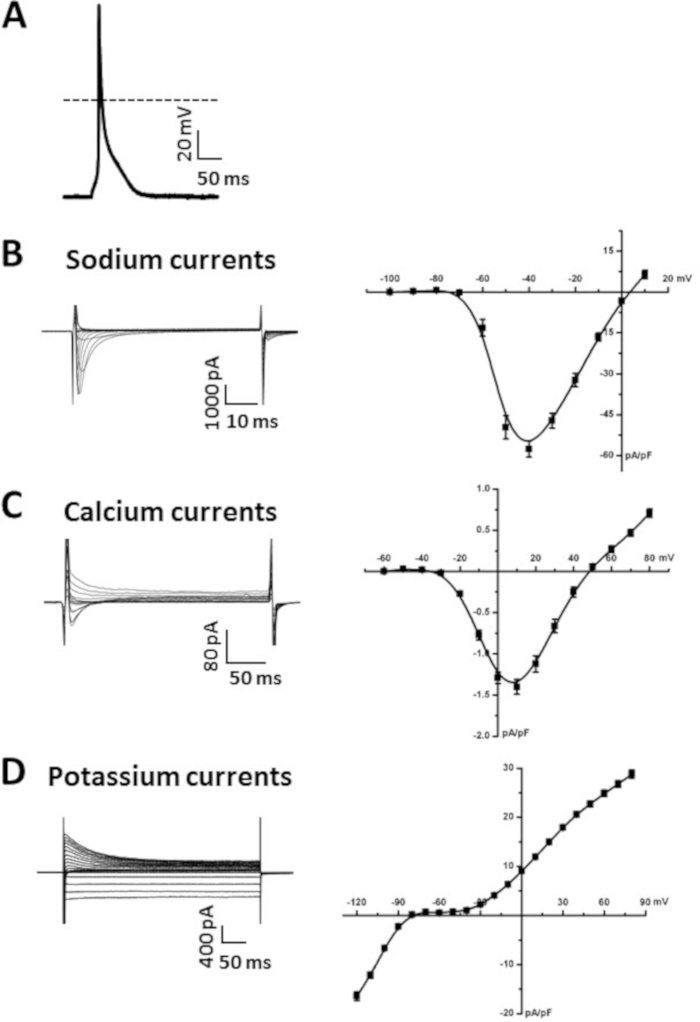
図5:単離された心房筋細胞から得られた代表的なパッチクランプデータ。(A)代表は、単離された心房筋細胞からのAP記録を刺激した。AP パラメータの概要を表6に示します。アンホテリシンB(200μg/mL)をピペット溶液に添加し、細胞膜を透過化した。(B)代表INa記録(左)とサマリーINa IV曲線(右)を単離された心房筋細胞から。ニフェジピン(10 μM)は、INaを記録する際にICa、Lをブロックするために変更されたタイロードの溶液に添加された。C.代表ICa,L録音(左)及び単離された心房筋細胞からのICa,L IV曲線(右)の要約。(D)代表的なIK記録(左)とサマリーIK IV曲線(右)を単離された心房筋細胞から。これらの電流の記録に使用されるソリューションは、表 7および表 8に示されています。要約IV曲線は、15週齢の雄野生型C57Bl/6マウスから単離された10の心房筋細胞からの平均測定値である。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| 株式タイロードのpH 6.9 | 株式タイロードのpH 7.4 | |
| 化学 | mM で | mM で |
| 塩化 ナトリウム | 140の | 140の |
| Kcl | 5.4年 | 5.4年 |
| KH2PO4 | 1.2年 | 1.2年 |
| Hepes | 5 | 5 |
| 最終巻 | 500 mL | 1 L |
| ナオとの最終pH | 6.9年 | 7.4年 |
表 1: 株式タイロードの pH 7.4 および株式タイロードの pH 6.9 ソリューション。あらかじめ作られ、最大2ヶ月間4°Cで保存できる株式タイロードの溶液(pH 7.4およびpH 6.9)の組成。
| 化学 | mM で |
| Kグルタミン酸 | 100人 |
| Kアスパラテート | 10歳 |
| Kcl | 25名 |
| KH2PO4 | 10歳 |
| MgSO4 | 2 |
| タウリン | 20歳 |
| クレアチン | 5 |
| エグタ | 0.5年 |
| グルコース | 20歳 |
| Hepes | 5 |
| Bsa | 0.10パーセント |
| 最終巻 | 1 L |
| KOH を使用した最終 pH | 7.2年 |
表 2: 変更された KB ソリューション。あらかじめ作り、引用符で囲み、-20°Cで最大2ヶ月間保存できる改変KB溶液のレシピ。
| 化学 | 量 |
| グルコース | 5.55メートル |
| MgCl2 | 1 mM |
| カクル2 | 1.8 mM |
| 株式タイロードのpH 7.4 | 50 mL |
| ヘパリン | 250 μL |
表3:ブドウ糖、マグネシウム、カルシウム、ヘパリンを用いたチロードのpH7.4溶液を改変した。心房組織解剖に用いられる修飾タイロードのpH 7.4溶液の組成。この溶液は新鮮にし、使用するまで35°Cの水浴に保管する必要があります。
| 化学 | 量 |
| グルコース | 18.5メートル |
| タウリン | 49.96メートル |
| Bsa | 15 mg |
| カクル2 | 0.066メートル |
| 株式タイロードのpH 6.9 | 15 mL |
表4:ブドウ糖、タウリン、BSA、および低カルシウムを含む改変チロードのpH6.9溶液。心房筋細胞単離に用いられる修飾タイロードのpH 6.9溶液の組成。この溶液は新鮮にし、使用するまで35°Cの水浴に保管する必要があります。
| 化学 | 量 |
| コラゲナーゼ | 1,064 U |
| エラスターゼ | 9 U |
| プロテアーゼソリューション | 65.2 μL |
| 変更されたタイロードのpH 6.9 | 5 mL |
表 5: 酵素溶液。心房組織ストリップを酵素的に消化するために使用される酵素溶液の組成。この溶液は新鮮にし、使用するまで35°Cの水浴に保管する必要があります。
| パラメーター | 平均 |
| RMP (mV) | -74.2 ± 0.7 |
| Vマックス (V/s) | 144.6 ± 5.8 |
| OS (mV) | 71.9 ± 3.0 |
| APD50 (ミリ秒) | 11.1 ± 1.7 |
| APD70 (ミリ秒) | 23.0 ± 4.6 |
| APD90 (ミリ秒) | 54.7 ± 7.8 |
表6:単離された心房筋細胞からのAPパラメータの概要。データは、平均±SEMとして提示され、n=10心房筋細胞は、15週の雄野生型C57Bl/6マウスから単離される。
| カリウム電流とAP | ナトリウム電流 | カルシウム電流 | |
| 化学 | mM で | mM で | mM で |
| 塩化 ナトリウム | 140の | 5 | |
| Kcl | 5.4年 | ||
| MgCl2 | 1 | 1 | 1 |
| カクル2 | 1 | 1 | 2 |
| Hepes | 10歳 | 10歳 | 10歳 |
| グルコース | 5.5年 | 5.5年 | 5.5年 |
| Cscl | 130の | ||
| ティー-クル | 5.4年 | 145.5年 | |
| 博士 | 7.4 ナオと | 7.4 CsOH 付き | 7.4 CsOH 付き |
表7:パッチクランプ実験で使用されるタイロードの溶液の組成。AP、I Na、ICa、L、およびIKを単離された心筋細胞から記録するために使用されるタイロードの溶液の組成。
| カリウム電流とAP | ナトリウム電流 | カルシウム電流 | |
| 化学 | mM で | mM で | mM で |
| 塩化 ナトリウム | 5 | 5 | 5 |
| Kcl | 140の | ||
| MgCl2 | 1 | 1 | 1 |
| カクル2 | 0.2年 | 0.2年 | 0.2年 |
| Hepes | 10歳 | 10歳 | 10歳 |
| エグタ | 5 | 5 | |
| Mg-ATP | 4 | 5 | 4 |
| ナ-GTP | 0.3年 | 0.3年 | 0.3年 |
| ナホスホクレアチン | 6.6年 | 6.6年 | |
| Cscl | 130の | 135名 | |
| バプタ | 5 | ||
| 博士 | 7.2 KOH付き | 7.2 CsOH付き | 7.2 CsOH付き |
表8:パッチクランプ実験中に使用される内部ピペット溶液の組成。AP、I Na、ICa、L、およびIKを単離された心房筋細胞から記録するために使用されるピペット充填溶液の組成。
ディスカッション
私たちの研究室は、心房筋細胞に対する異なる形態の心血管疾患、遺伝子変異、または薬理学的化合物の影響を調べるために、パッチクランプ実験で使用するマウス心房筋細胞を日常的に分離するためにこのプロトコルを使用しています。電気 生理 学。非常に再現性は高いが、単離された心房筋細胞から得られるデータの品質は、単離の質に依存する。さらに、心房筋細胞単離に続くカルシウムの再導入は、カルシウムパラドックス16に起因する単離性筋細胞の集団に対する細胞死をもたらす。したがって、このアプローチを用いて生存可能で高品質な心房筋細胞を単離するには、分離全体を通じて複数のポイントでの練習と最適化が必要です。最適化されると、このアプローチを使用して単離された全心筋細胞の70〜90%がカルシウム耐性とロッド形状の両方になると推定されます。最も多くのプラクティスと最適化を必要とする手順については、以下で説明します。
解剖の速度および効率は単離された細胞の質に下流の影響を与える。すべての血液が心房組織から除去され、組織ストリップが同様のサイズに切断されることを確認するために時間を取ることが重要です。心房の付属品を取り除き、組織をストリップに切断し、組織ストリップを改変されたTyrodeのpH 6.9溶液の最初のチューブに移すのに約5分かかります。しかし、このステップに時間がかかりすぎると、組織の品質が損なわれる可能性があります。
また、組織ストリップを単離内および心臓間で均一なサイズに切断することも重要です。組織ストリップが大きすぎるか小さすぎる場合、または単離内で均一でない場合は、酵素消化とトリチュレーションの両方で問題を引き起こす可能性があります。これは、小さなストリップがより徹底的に消化され、大きなストリップが消化されるからです。心房の付属品の大きさは動物によって異なる可能性があるため、研究されている遺伝子型と疾患の設定を考慮することは同様に重要です。例えば、肥大型心臓は健康な心臓に比べて心房の付属物が大きいため、実験者は通常の大きさの心臓と比較して肥大性心のより多くのストリップをカットすることができます。したがって、切断された組織ストリップのサイズを最適化し、個々の心房付録にこれらの寸法を適用することは、実験条件間の筋細胞単離の再現性を大幅に向上させます。
酵素消化と機械的解離の微妙なバランスは、このプロトコルを使用して心房筋細胞分離を成功させる鍵となります。酵素消化中に組織が十分に渦巻かない場合、個々の組織ストリップは凝集し、一緒に固執する傾向があり、酵素消化の有効性を制限します。あまりにも頻繁にまたは激しく攪拌された場合、これは心房組織を損傷し、生存不可能な細胞の単離をもたらす。トリチュレーション中の組織ストリップからの単離された心房筋細胞の機械的解離は、心房筋細胞を単離するためにこのアプローチを使用して練習し、最適化するための最も重要なステップです。トリチュレーションが穏やかすぎると、細胞収率が低くなります。一方、トリチュレーションが過酷すぎると、生存不可能な筋細胞が大量に分離され、パッチクランプ実験中に得られたデータの質が危険にさらされます。さらに、アトリアの組成は、単離に影響を与えることができる。例えば、組織が線維性である場合、酵素消化および三分の1を修飾する必要がある場合がある。したがって、パッチクランプ実験に使用できるトリチュレーション中に高品質の細胞を得るために必要なスキルを開発するために時間を取ることが重要です。
すべての実験的なテクニックと同様に、制限があります。この技術は、実行可能で高品質な筋細胞を再現可能に分離するために練習を必要とし、これらの筋細胞を使用して行われる実験の実現可能性に影響を与えます。このアプローチはまた、このアプローチを用いて単離された末端および心房筋細胞であり、単離の日にのみ使用することができる。私たちの研究室は、単離の6-7時間以内の細胞を使用しています。
心房心筋細胞を分離するこのアプローチは、いくつかの用途を有する。例えば、このアプローチは、ヒト心房組織生検を含む他の種から心房筋細胞(ならびに心臓線維芽細胞)を分離するように改変することができる。さらに、心房筋細胞単離にこのチャンク法を使用する利点は、(心臓の逆行灌流とは対照的に)、心房節または他の特定の領域などの心臓の他の領域から心筋細胞を分離するように修飾することができるということです。心房心筋の、または心臓の上室領域全体を包含する。私たちの研究室では、パッチクランプ実験に心房心筋細胞を使用して作用電位とイオン電流を測定していますが、この手法に限定される必要はありません。例えば、単離された筋細胞は、カルシウム過渡の変化および収縮性を様々な実験設定で調べるために使用することができる。心房心筋細胞は、タンパク質または目的の構造の位置を研究するために免疫蛍光研究にも使用することができます。したがって、このアプローチは、多くの可能なアプリケーションで非常に汎用性が高いです。
開示事項
著者は何も開示する必要はありません。
謝辞
この研究は、カナダ保健研究所(MOP 93718,142486)とカナダの心臓・脳卒中財団からR.A.ローズへの運営助成金によって支えられています。 H.J.ヤンセンはキラムポストドクターフェローシップの受領者です。
資料
| Name | Company | Catalog Number | Comments |
| 1, 2-Bis(2-Aminophenoxy)ethane-N, N, N', N'-tetraacetic acid 98% | Sigma | A4926-1G | |
| Adenosine 5'-triphosphate disodium salt hydrate BioXtra, > 99%, from microbial | Sigma | A7699-1G | |
| Adenosine 5'-triphosphate magnesium salt > 95%, bacterial | Sigma | A9187-1G | |
| Amphocetericin B from Streptomyces sp. ~80% (HPLC), powder | Sigma | A4888-500 MG | |
| Bovine serum albumin | Sigma | A3059-50G | |
| Calcium chloride dihydrate | Sigma | 223506-500G | |
| Cesium chloride ReagentPlus, 99.9% | Sigma | 289329-100G | |
| Cesium hydroxide monohydrate > 99.5% trace metals basis | Sigma | 562505-1KG | |
| Collagenase Type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine anhydrous | Sigma | C0780 | |
| D-(+)-Glucose | Sigma | G7021-1KG | |
| DL-Aspartic acid potassium salt | Sigma | A2025-100G | |
| Elastase suspension | Worthington Biochemical Corporation | LS002279 | |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid >97.0% | Sigma | E4378-25G | |
| Guanosine 5'-triphosphate sodium salt hydrate > 95% (HPLC), powder | Sigma | G8877-250MG | |
| Heparin 10 000 USP units/10mL | SANDOZ | 10750 | |
| HEPES > 99.5% (titration) | Sigma | H3375-500G | |
| L-Glutamic acid potassium salt monohydrate > 99% (HPLC), powder | Sigma | G1501-500G | |
| Magnesium sulfate | Sigma | M2643-500G | |
| Nifedipine > 98% (HPLC), powder | Sigma | N7634-1G | |
| Phosphocreatine disodium salt hydrate enzymatic, approx 98% | Sigma | P7936-5G | |
| Potassium chloride ACS reagent, 99.0-100.5% | Sigma | P3911-500G | |
| Potassium hydroxide | EM Science | PX1480-1 | |
| Potassium phosphate monobasic | EMD | PX1565-1 | |
| Protease from Streptomyces griseus, type XIV, >3.5 units/mg solid, powder | Sigma | P5147-1G | |
| Sodium chloride ACS reagent, > 99.0% | Sigma | S9888-2.5KG | |
| Sodium hydroxide, pellets, 97+%, A.C.S. reagent | Sigma | 221465-500G | |
| Sylgard 184 silicone elastomer kit | World Precision Instruments Inc | SYLG184 | |
| Taurine | Sigma | T0625-100G | |
| Tetraethylammonium chloride > 98% (titration) | Sigma | T2265-100G |
参考文献
- Bartos, D. C., Grandi, E., Ripplinger, C. M. Ion Channels in the Heart. Comprehensive Physiology. 5 (3), 1423-1464 (2015).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circulation Research. 114 (9), 1483-1499 (2014).
- Jalife, J. Mechanisms of persistent atrial fibrillation. Current Opinion in Cardiology. 29 (1), 20-27 (2014).
- Nattel, S., Maguy, A., Le Bouter, S., Yeh, Y. H. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation. Physiological Reviews. 87 (2), 425-456 (2007).
- Jansen, H. J., et al. Atrial structure, function and arrhythmogenesis in aged and frail mice. Scientific Reports. 7, 44336 (2017).
- Jansen, H. J., et al. Distinct patterns of atrial electrical and structural remodeling in angiotensin II mediated atrial fibrillation. Journal of Molecular and Cellular Cardiology. 124, 12-25 (2018).
- Nerbonne, J. M., Kass, R. S. Molecular physiology of cardiac repolarization. Physiological Reviews. 85 (4), 1205-1253 (2005).
- Grant, A. O. Cardiac ion channels. Circulalation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Schmitt, N., Grunnet, M., Olesen, S. P. Cardiac potassium channel subtypes: new roles in repolarization and arrhythmia. Physiological Reviews. 94 (2), 609-653 (2014).
- Lomax, A. E., Kondo, C. S., Giles, W. R. Comparison of time- and voltage-dependent K+ currents in myocytes from left and right atria of adult mice. American Journal of Physiology Heart and Circulatory Physiology. 285 (5), H1837-H1848 (2003).
- Li, D., Zhang, L., Kneller, J., Nattel, S. Potential ionic mechanism for repolarization differences between canine right and left atrium. Circ Res. 88 (11), 1168-1175 (2001).
- Wirth, K. J., Knobloch, K. Differential effects of dofetilide, amiodarone, and class lc drugs on left and right atrial refractoriness and left atrial vulnerability in pigs. Naunyn Schmiedebergs Archives of Pharmacology. 363 (2), 166-174 (2001).
- Qi, A., Yeung-Lai-Wah, J. A., Xiao, J., Kerr, C. R. Regional differences in rabbit atrial repolarization: importance of transient outward current. American Journal of Physiology. 266 (2 Pt 2), H643-H649 (1994).
- Jansen, H. J., et al. NPR-C (Natriuretic Peptide Receptor-C) Modulates the Progression of Angiotensin II-Mediated Atrial Fibrillation and Atrial Remodeling in Mice. Circulation: Arrhythmia and Electrophysiology. 12 (1), e006863 (2019).
- Mangoni, M. E., Nargeot, J. Genesis and regulation of the heart automaticity. Physiological Reviews. 88 (3), 919-982 (2008).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Springer, J., et al. The natriuretic peptides BNP and CNP increase heart rate and electrical conduction by stimulating ionic currents in the sinoatrial node and atrial myocardium following activation of guanylyl cyclase-linked natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 52 (5), 1122-1134 (2012).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. A. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PLoS One. 7 (10), e47652 (2012).
- Egom, E. E., et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. Journal of Physiology. 593 (5), 1127-1146 (2015).
- Hua, R., et al. Effects of Wild-Type and Mutant Forms of Atrial Natriuretic Peptide on Atrial Electrophysiology and Arrhythmogenesis. Circulation: Arrhythmia and Electrophysiology. 8 (5), 1240-1254 (2015).
- Krishnaswamy, P. S., et al. Altered parasympathetic nervous system regulation of the sinoatrial node in Akita diabetic mice. Journal of Molecular and Cellular Cardiology. 82, 125-135 (2015).
- Mackasey, M., et al. Natriuretic peptide receptor C (NPR-C) protects against angiotensin II mediated sinoatrial disease in mice. JACC Basic to Translational Science. , (2018).
- Azer, J., Hua, R., Vella, K., Rose, R. A. Natriuretic peptides regulate heart rate and sinoatrial node function by activating multiple natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 53 (5), 715-724 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved