Method Article
Isolement des myocytes auriculaires des souris adultes
Dans cet article
Résumé
Ce protocole est utilisé pour isoler les cardiomyocytes auriculaires simples du cœur adulte de souris en utilisant une approche de digestion de morceau. Cette approche est utilisée pour isoler les myocytes auriculaires de droite ou de gauche qui peuvent être utilisés pour caractériser l'électrophysiologie du myocyte auriculaire dans les études de patch-clamp.
Résumé
Les propriétés électrophysiologiques des myocytes auriculaires affectent considérablement la fonction cardiaque globale. Les altérations des courants ioniques sous-jacents responsables du potentiel d'action peuvent causer des substrats pro-arythmiques qui sous-tendent les arythmies, comme la fibrillation auriculaire, qui sont très répandues dans de nombreuses conditions et états pathotiques. Isoler les cardiomyocytes auriculaires adultes de souris pour l'usage dans des expériences de correction-clamp a considérablement avancé notre connaissance et compréhension de l'électrophysiologie cellulaire dans le myocarde auriculaire sain et dans l'arrangement de la pathophysiologie auriculaire. En outre, des études utilisant des modèles génétiques de souris ont élucidé le rôle d'un vaste éventail de protéines dans la régulation de l'électrophysiologie auriculaire. Ici nous fournissons un protocole détaillé pour l'isolement des cardiomyocytes des appendices auriculaires des souris adultes utilisant une combinaison de digestion enzymatique et de dissociation mécanique de ces tissus. Cette approche donne constamment et de façon fiable des cardiomyocytes auriculaires isolés qui peuvent ensuite être utilisés pour caractériser l'électrophysiologie cellulaire en mesurant les potentiels d'action et les courants ioniques dans le cadre d'expériences de pinces à patch dans le cadre d'un certain nombre d'expériences expérimentales. Conditions.
Introduction
Les atriums, qui sont les chambres minces murées et basses pressions du cœur qui reçoivent le sang de la veine cavae supérieure et inférieure ainsi que les veines pulmonaires, font partie intégrante de la physiologie cardiaque normale. Comme d'autres régions du cœur, les atriums contiennent un certain nombre de types de cellules, y compris les cardiomyocytes, les fibroblastes, les cellules endothéliales, les cellules musculaires vasculaires lisses, et d'autres. Les myocytes auriculaires sont des cellules électriquement excitables qui jouent un rôle essentiel dans la conduction des signaux électriques à travers le cœur, assurant ainsi une contraction auriculaire appropriée pendant chaque battement cardiaque1. Le dysfonctionnement électrique dans les atriums peut mener à un certain nombre d'arythmies spécifiques auriculaires telles que le flottement auriculaire et la fibrillation auriculaire2,3. Ce sont des arythmies auriculaires très répandues, mais mal comprises, qui mènent à une morbidité et à une mortalité significatives. La fibrillation auriculaire peut se produire en association avec des mutations génétiques, en association avec le vieillissement ou dans le cadre de formes acquises de maladie cardiaque, y compris l'hypertension, l'insuffisance cardiaque et le diabète2,4,5 ,6. Ces conditions peuvent altérer les propriétés électriques des myocytes auriculaires qui peuvent créer un substrat qui augmente la prévalence de l'arythmatèse1,2.
La fonction électrique normale dans les atriums, aussi bien que l'arythmie auriculaire, sont considérablement affectées par la morphologie du potentiel d'action (AP) produit dans les myocytes auriculaires. L'AP auriculaire est généré par l'activité d'un certain nombre de courants ioniques, y compris le courant de sodium (INa, porté par NaV1.5 canaux), le courant de calcium de type L (ICa,L, porté par Cav1.2 et CaV1.3 canaux ), et plusieurs courants de potassium, y compris le courant de rectificateur retardé ultra-rapide de potassium (IKur, porté par KV1.5 canaux), le courant transitoire de potassium extérieur (Ià, porté par KV4.2 et KV4.3 canaux), un courant de potassium d'état régulier (IKss, porté par KV2.1 canaux), et le courant de potassium de rectifier vers l'intérieur (IK1, porté par Kir2.1 canaux)1,7, 8. Bien qu'ils ne jouent pas un rôle majeur dans les atria de souris, les composants rapides et lents du rectifier retardé K- courant (IKr et IKs) contribuent également à la repolarisation AP dans certaines espèces7. Les altérations d'un ou de plusieurs de ces courants ioniques peuvent modifier considérablement les propriétés électriques des myocytes auriculaires, ce qui peut conduire à des arythmies auriculaires. Par exemple, une réduction de INa peut ralentir la vitesse de conduction à travers les atriums en réduisant la vitesse de course AP. D'autre part, une réduction des courants de potassium repolarisantous ou une augmentation de ICa,L ou de la fin INa peut entraîner le développement d'afterdepolarisations qui peuvent déclencher une activité spontanée dans l'atria1, 2,9.
Il est important de reconnaître qu'il existe des différences dans la morphologie AP dans différentes parties du myocarde auriculaire qui sont probablement dues à des différences dans l'expression ou la régulation de ces canaux ioniques sous-jacents. Par exemple, les différences dans la durée AP entre les atrias droite et gauche en association avec les différences dans ià la densité actuelle ont été bien décrits10,11,12,13. En outre, nous avons récemment démontré qu'il y a des modèles distincts de remodelage électrique dans les atria sténopées droites et gauches des souris avec l'hypertension chronique6,14. Le mur postérieur auriculaire droit contient également le nœud sinoatrial, qui a ses propres modèles distincts de morphologie AP et les modèles de tir15. Les propriétés distinctes des myocytes dans chacune de ces différentes parties de l'atrium peuvent être étudiées en détail à l'aide de myocytes isolés de chacune de ces régions.
Il existe différentes approches qui peuvent être utilisées pour isoler les myocytes auriculaires pour les études d'électrophysiologie patch-clamp16. Une possibilité est d'utiliser une approche de perfusion rétrograde où le cœur est cannulated via l'aorte pour la livraison d'enzymes. Bien qu'il s'agisse d'une approche viable, elle peut produire une variabilité dans la qualité des myocytes auriculaires en raison d'incohérences dans la perfusion des atriums. Nous avons adopté une approche de digestion 'chunk' pour l'isolement des myocytes auriculaires qui élimine le besoin de perfusion rétrograde du cœur. Notre approche utilise une combinaison de digestion enzymatique et de dissociation mécanique du tissu auriculaire qui donne constamment et de façon fiable un grand nombre de myocytes auriculaires isolés qui conviennent aux études de patch-clamp. Bien que nous décrivions notre approche ici en utilisant le tissu d'appendice auriculaire, l'approche peut être employée sur n'importe quelle région du myocarde auriculaire (c.-à-d., appendices auriculaires droits ou gauches, murs libres, murs postérieurs) que l'investigateur choisit. Cette approche est idéale pour les études de l'électrophysiologie du myocyte auriculaire chez des souris génétiquement modifiées, dans les modèles murins de maladies cardiovasculaires, ou pour l'étude des effets des composés pharmacologiques5,6,17 , 18 ans, états-unis qui , 19.
Protocole
Toutes les procédures relatives aux animaux ont été approuvées par le Comité des soins et de l'utilisation des animaux de l'Université de Calgary et ont été menées conformément aux lignes directrices du Conseil canadien sur les soins aux animaux. L'isolement de myocyte auriculaire, les images, et les résultats représentatifs décrits ci-dessous ont été obtenus à partir d'une souris sauvage mâle de 15 semaines de type C57Bl/6. Nous utilisons systématiquement ce protocole pour isoler les myocytes auriculaires des souris de type sauvage17,18, souris porteuses de mutations génétiques19,20 et modèles murins de la maladie tels que l'hypertension chronique6, 14. Le protocole peut être utilisé de la même façon pour les souris mâles ou femelles. Nous avons également utilisé une version similaire de cette procédure d'isolement pour isoler les myocytes de noeud sinisoïdal du cœur de souris17,21,22,23. Un diagramme de flux de ce protocole expérimental se trouve dans la figure 1.
1. Préparation de solutions et d'équipements de stock
- Préparer 1 plat disséquer en ajoutant de l'élastomère de silicone selon les instructions du fabricant. Ajouter suffisamment de composé d'élastomère de silicone pour couvrir le fond d'un plat Petri de 10 cm à une profondeur de 1 cm. Laissez guérir puis insérez 6 broches d'insectes dans le plat.
REMARQUE: Ce plat de dissection de silicone peut être réutilisé pendant des mois et stocké à température ambiante. - Préparer 3 pipettes Pasteur polies par le feu avec une ouverture de 1 mm (petit forage), 3 mm (alésage moyen), ou 5 mm (grand forage) de diamètre comme le montre la figure 2A. Pour faire ces pipettes, marquer une pipette Pasteur, puis claquer le long de la marque pour produire une ouverture qui est légèrement plus grande que la taille de forage souhaitée. Utilisez un fichier métallique pour lisser la surface, puis polir cette ouverture à l'aide d'une flamme nue.
REMARQUE: Ceci produira un bord lisse et poli de feu avec une ouverture du diamètre désiré. Il est important que l'ouverture soit exempte de fissures et de surfaces rugueuses. Ces pipettes polies par le feu peuvent être entreposées à température ambiante et réutilisées pendant des mois. - Préparer des solutions d'actions pour la solution pH 6.9 de Tyrode et la solution pH 7.4 de Tyrode telle qu'elle est inscrite dans le tableau 1. Préparer également 10 ml chacun de 1 M MgCl2, 1 M CaCl2, et 100 mM CaCl2. Utilisez de l'eau ultrapure pour toutes les solutions et entreposez-les à 4 oC pendant une température pouvant aller jusqu'à 2 mois.
- Préparer 1 L de solution modifiée Kraft-Bràhe (KB) comme indiqué dans le tableau 2. Utilisez de l'eau ultrapure. Diviser la solution en aliquots de 20 ml et conserver à -20 oC pendant une durée pouvant aller jusqu'à 2 mois.
2. Préparation de solutions et d'isolement pour l'isolement des myocytes auriculaires
- Préparer 50 ml de la solution de pH 7.4 d'un Tyrode modifié, tel que décrit dans le tableau 3 dans un flacon Erlenmeyer de 125 ml, à l'aide de 1 M CaCl2 et 1 M MgCl2 solutions de stock. Placer le flacon Erlenmeyer dans un bain d'eau de 35 oC jusqu'à l'utilisation, comme le montre la figure 2B.
- Préparer la solution de pH 6.9 du Tyrode modifié, telle que décrite dans le tableau 4 dans un tube de 50 ml, en utilisant la solution de 100 mM CaCl2. Aliquot 2,5 ml de cette solution dans chacun des trois tubes de fond rond de 5 ml. Placez ces tubes dans une grille placée dans un bain d'eau de 35 oC jusqu'à l'utilisation, comme le montre la figure 2B.
- Préparer la solution enzymatique telle que décrite dans le tableau 5 dans un tube de fond rond de 14 ml. Pour faire la solution de protéase, ajouter 1 mg de protéase par 100 l d'eau ultrapure. Placez le tube contenant cette solution enzymatique dans la grille et incubez-le dans un bain d'eau de 35 oC jusqu'à l'utilisation.
- Décongeler un aliquot de solution KB modifiée dans un bain d'eau à 35 oC. Aliquot 2,5 mL de solution KB dans chacun des trois tubes de fond rond de 5 ml et 2,5 ml dans un tube de fond rond de 14 ml. Placez ces tubes dans la grille et incubez-les dans un bain d'eau de 35 oC jusqu'à l'utilisation, comme le montre la figure 2B.
- Disposez la plaque de dissection, les outils de dissection, une pipette Pasteur et les pipettes polies par le feu, comme le montre la figure 2B.
3. Dissection de l'appendice auriculaire de souris (s)
- Injecter la souris avec 0,2 ml d'héparine (10 000 USP U/10 ml) par injection intrapéritonéale et attendre 5 min pour l'absorption.
- Placer la souris dans une chambre d'induction et anesthésier par inhalation d'isoflurane (3-4%). L'isoflurane et l'oxygène sont livrés à l'aide d'une machine anesthésique et les déchets de gaz anesthésique sont récupérés. Une fois que la souris est anesthésié, et ne montre pas un réflexe de pincement d'orteil, euthanasier la souris par dislocation cervicale rapide. Placez la souris sur une serviette en papier ou un panneau de liège et scotcher les pattes vers le bas pour maintenir la souris en place.
- Mouillez la poitrine de la souris avec 70% d'éthanol. Enlever la fourrure et la peau qui recouvrent la poitrine à l'aide de ciseaux incurvés. Ensuite, utilisez des forceps de dent de rat pour soulever le sternum et puis coupez le diaphragme le long du bord des côtes. Retirez toute la cage thoracique à l'aide de ciseaux incurvés pour exposer le cœur.
- Pour enlever l'appendice auriculaire (droite ou gauche), soulevez délicatement l'appendice à l'aide de fines forceps de disséquement et coupez-le avec des ciseaux de printemps. Transférez immédiatement l'appendice auriculaire dans un plat de dissection enduit de silicone contenant 20 ml de la solution de pH 7.4 modifiée modifiée réchauffée de Tyrode décrite à l'étape 2.1.
- Placez une épingle disséquente en haut et une broche au bas de l'ouverture de l'appendice auriculaire. À l'aide d'une pipette de pâturage, rincer les atriums avec la solution de pH 7.4 modifiée de Tyrode réchauffée pour enlever le sang. Ouvrez l'appendice auriculaire en coupant le long du bord supérieur et inférieur de l'appendice auriculaire. Ensuite, épinglez les coins de l'appendice auriculaire pour créer un morceau de tissu plat et rectangulaire, comme le montre la figure 3A.
4. Isolement des myocytes auriculaires
REMARQUE: Les étapes de cette section sont toutes exécutées à 35 oC, avec des tubes immergés dans un bain d'eau de 35 oC. Soyez prudent lors du transfert des bandes de tissu entre les tubes de fond ronds pour s'assurer que seul le tissu (et non la solution) est transféré entre les tubes.
- Couper l'appendice auriculaire en 8 à 10 bandes de taille égale (environ 0,7 mm de largeur) à l'aide de ciseaux à ressort et de forceps fins. Un exemple des bandes de tissu auriculaire est montré dans la figure 3B. Notez que les bandes se contractent une fois qu'elles sont coupées à l'abri du morceau principal de tissu. À l'aide de la petite pipette polie par le feu, transférez les bandes de tissu dans le premier tube contenant la solution pH 6.9 modifiée réchauffée de Tyrode décrite à l'étape 2.2. Attendez 5 min.
- Laver les bandes de tissu en les transférant à la deuxième, puis le tube de fond troisième rond contenant modifié Tyrode pH 6.9 solution préparée à l'étape 2.2 à l'aide de la pipette à alésage moyen poli par le feu.
- Pour laver les bandes de tissu, plafonner le tube de fond rond de 5 ml et inverser doucement le tube 3 fois. Laissez les bandes de tissu s'installer au fond du tube avant de transférer les bandes de tissu au tube suivant à l'aide de la pipette polie par le feu.
- Transférer les bandes de tissu dans la solution enzymatique décrite à l'étape 2.3 à l'aide d'une pipette polie par le feu à l'aide d'un alésage moyen et incuber pendant 30 min. Faites tourbillonner le tube toutes les 3-5 minutes pour empêcher les bandes tissulaires d'adhérer ensemble.
REMARQUE: Au début de la digestion enzymatique, les bandes de tissu se déposent rapidement après le tourbillonnement. À environ 20 min de la digestion, les bandes de tissu commencent à flotter dans la solution enzymatique après le tourbillonnement. Pendant ce temps, les bandes de tissu atrial changent également dans l'aspect du rose pâle au blanc pendant qu'elles sont digérées. - Après digestion enzymatique, effectuer trois lavages en utilisant 2,5 ml de solution KB dans les tubes de fond rond de 5 ml préparés à l'étape 2.4. Pour chaque lavage, inverser délicatement le tube 3 fois avant de déplacer le tissu vers le tube suivant à l'aide de la pipette polie par le feu. Après le lavage final, transférer les bandes dans le tube de fond rond de 14 ml contenant 2,5 ml de solution KB. Attendez 5 min.
- Trituratez délicatement le tissu pendant 7,5 min à l'aide de la pipette polie par le feu. Ceci dissociera mécaniquement les bandes de tissu et donnera une solution nuageuse remplie de myocytes auriculaires individuels.
REMARQUE: Pendant la trituration, le tissu devient blanc et la solution devient trouble. La force de la trituration, obtenue en modifiant à la fois la fréquence et la vitesse d'expulser les bandes de tissu de la pipette polie par le feu large, devrait être adaptée à l'isolement individuel. Si la trituration est trop douce, le rendement cellulaire sera faible, tandis que la trituration qui est trop dure donnera de nombreuses cellules mortes. Évitez les bulles tout en tritutant. - Remplissez le tube de fond rond de 14 ml contenant les bandes de tissu triturées avec la solution KB à un volume final de 7-10 ml selon la densité désirée des cellules pour l'utilisation expérimentale. Placez ce tube à température ambiante pendant 1 h. Après cette période d'incubation, les cellules peuvent être utilisées pour une variété d'expériences jusqu'à 7 h. Les cellules peuvent également être stockées à 4 oC jusqu'à 7 h.
Résultats
Les myocytes auriculaires isolés à l'aide de ce protocole peuvent être utilisés pour caractériser les propriétés électrophysiologiques de ces cellules en utilisant la technique patch-clamp. Les aliquots des myocytes auriculaires dans la solution KB peuvent être ajoutés à la chambre d'enregistrement d'un appareil standard de patch-clamp et superfused avec des solutions appropriées pour le type d'enregistrement que l'expérimentateur souhaite effectuer. Les myocytes auriculaires isolés à l'aide de ce protocole sont mieux utilisés pour les études électrophysiologiques dans les 6-7 h de l'isolement. Les données représentatives de patch-clamp de notre laboratoire sont présentées ci-dessous.
La figure 4 illustre des exemples de myocytes auriculaires isolés de souris normales préparées à l'aide du protocole ci-dessus. Les myocytes auriculaires isolés sont généralement de l'ordre de 100 m de longueur et de 10 m de largeur avec des stries claires. La capacité des myocytes auriculaires isolés est typiquement 40-70 pF.
Figure 5A illustre un exemple d'un myocyte auriculaire AP enregistré à l'aide de la technique perforée patch-clamp en mode de pince actuelle, comme nous l'avons décrit précédemment6,19,20. Les données sommaires illustrant les paramètres ap typiques des myocytes auriculaires sont fournies dans le tableau 6. Plus précisément, nous présentons des données sommaires pour les mesuresdu potentiel de membrane au repos (RMP), de la vitesse maximale de la course (V max), de la portée (OS) et de la durée de l'AP à 50 % (APD50), 70 % (APD70) et 90 % (APD90) repolarisation temps(tableau 6). Les AP peuvent également être enregistrés dans toute la configuration cellulaire14. Les solutions de superfusion et de pipette pour l'enregistrement des AP sont disponibles dans les peles 7 et 8.
La figure 5B illustre une famille représentative de courants Na (INa)enregistrées dans toute la configuration cellulaire de la technique patch-clamp. Ces courants ont été enregistrés à l'aide d'étapes de pince de tension de 50 ms entre -100 et 10 mV à partir d'un potentiel de rétention de -120 mV. Nous avons décrit des approches et des protocoles pour l'enregistrement INa précédemment6,14,20. Un résumé INa IV relation est également présenté dans la figure 5B. Les solutions utilisées pour enregistrer INa sont présentées dans le tableau 7 et le tableau 8.
La figure 5C illustre une famille représentative de courants Ca2 (ICa,L)enregistrés dans toute la configuration cellulaire de la technique de pince à patch. Ces courants ont été enregistrés à l'aide d'étapes de pince de tension de 250 ms entre -60 et 80 mV à partir d'un potentiel de rétention de -70 mV. Les conditions expérimentales qui peuvent être utilisées pour mesurer ICa,L ont été précédemment décrits17,18,20. Un résumé ICa,L IV relation est également présenté dans la figure 5C. Les solutions utilisées pour enregistrer ICa,L sont disponibles dans le tableau 7 et le tableau 8.
La figure 5D illustre une famille représentative de k- courants (IK) enregistré dans toute la configuration cellulaire de la technique patch-clamp. Ces courants ont été enregistrés à partir d'un potentiel de rétention de -80 mV en utilisant des étapes de pince de tension de 500 ms entre -120 mV et 80 mV, comme nous l'avons décrit précédemment6,14. La relation sommaire IV pour le total IK est également présentée dans la figure 5D. Les solutions utilisées pour enregistrer IK sont disponibles dans le tableau 7 et le tableau 8.
L'utilisation de ces approches pour enregistrer les AP etles grandes familles de courants ioniques, y compris les courants Na, Ca2 et K (comme illustré ci-dessus), permet à l'investigateur d'interroger rigoureusement l'électrophysiologie des myocytes auriculaires dans un pléthore de conditions expérimentales. Notre laboratoire a régulièrement utilisé ces techniques pour étudier l'électrophysiologie des myocytes auriculaires chez les souris normales, chez les modèles murins de maladies cardiaques, et chez les souris génétiquement modifiées6,14,17,18 ,19,20.

Figure 1 : Diagramme de flux pour le protocole d'isolement de myocyte auriculaire. Résumé des étapes utilisées pour isoler les myocytes auriculaires à l'aide de ce protocole. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
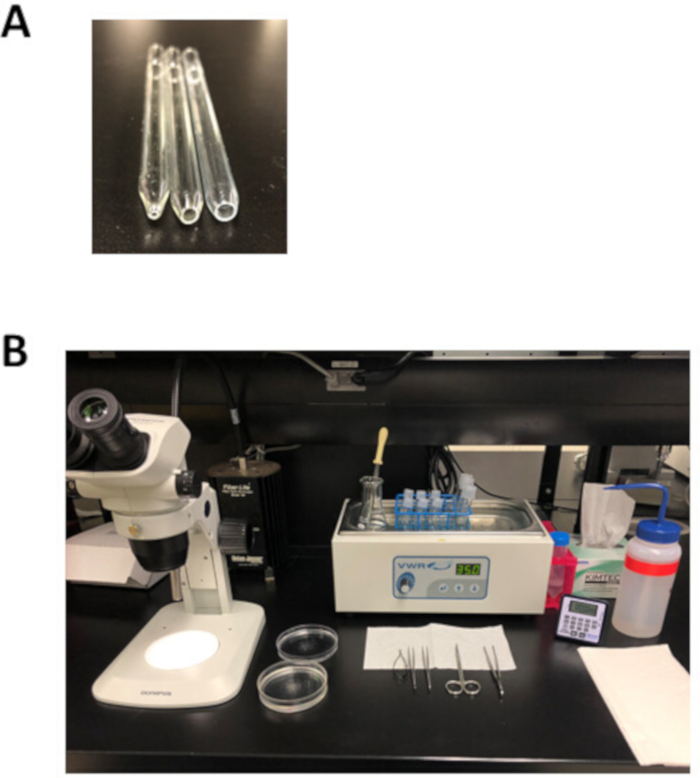
Figure 2 : Outils expérimentaux de configuration et de dissection pour l'isolement des myocytes auriculaires. (A). Une petite pipette polie par le feu avec une ouverture de 1 mm de diamètre (à gauche) est utilisée pour le transfert de tissu après la dissection, une pipette polie par le feu à l'alésage moyen avec une ouverture de 3 mm de diamètre (au milieu) est utilisée pour transférer des bandes de tissu pendant le l'isolement, et une grande pipette polie de feu de perçant avec une ouverture 5 mm de diamètre (droite) est employée pour la trituration du tissu auriculaire digéré. (B). Configuration expérimentale pour l'isolement des myocytes auriculaires. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
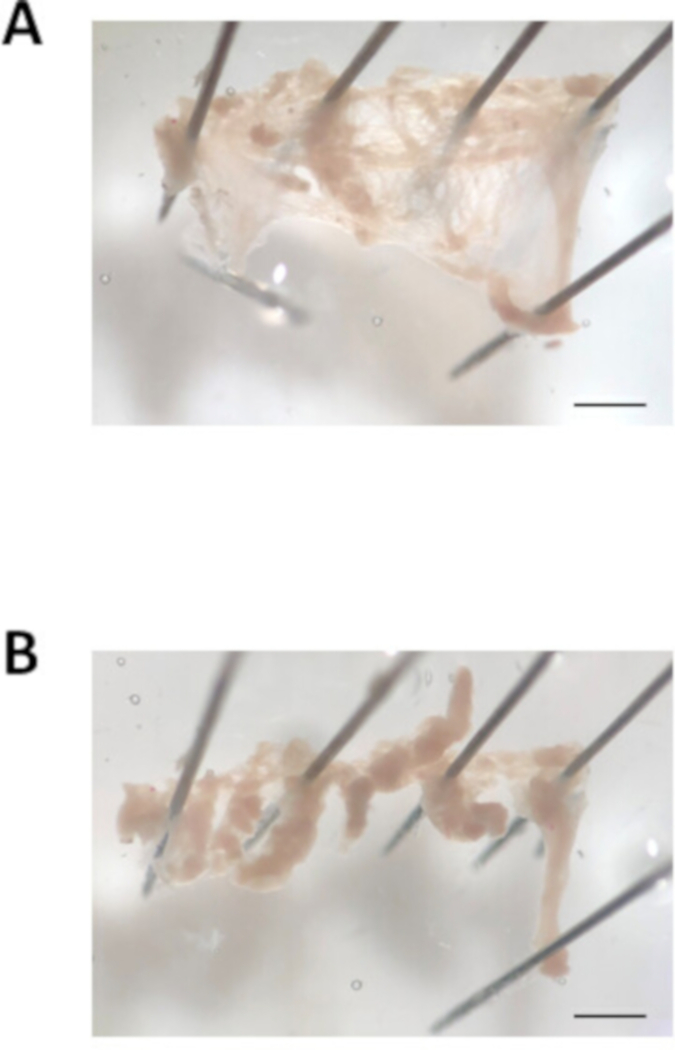
Figure 3 : Image de la dissection de l'appendice auriculaire. (A. Représentant image de champ lumineux d'un appendice auriculaire excisé ouvert et épinglé. (B). Image de champ lumineuse représentative de l'appendice auriculaire coupé en bandes de tissu d'environ 0,7 mm de largeur. Barre d'échelle de 1 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
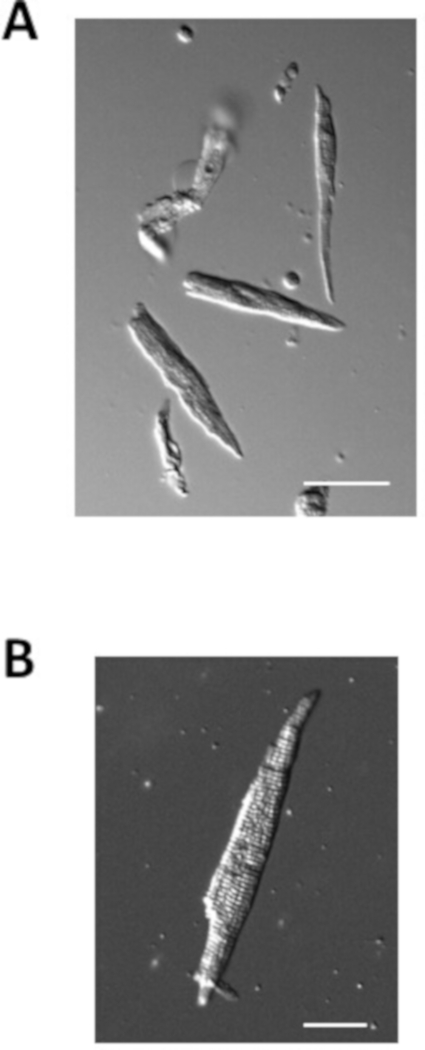
Figure 4 : Images de myocytes auriculaires isolés. (A. Image Brightfield de myocytes auriculaires isolés immédiatement après l'isolement. Barre d'échelle de 50 m. (B). Image Brightfield d'un seul myocyte auriculaire isolé. Barre d'échelle de 100 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
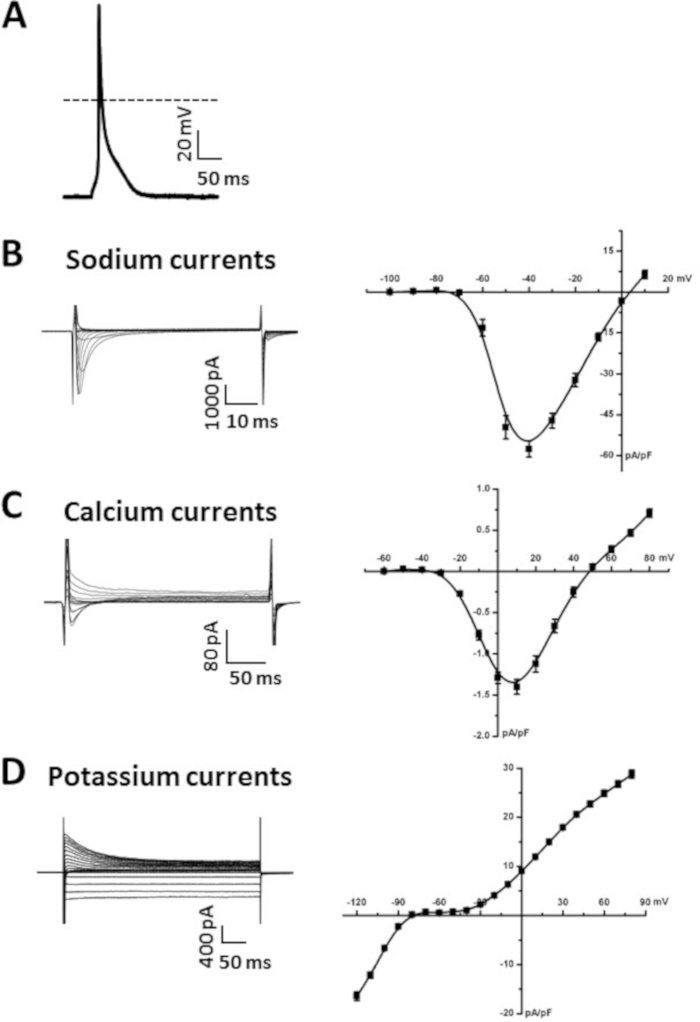
Figure 5 : Données représentatives de patch-clamp obtenues à partir de myocytes auriculaires isolés. (A. Représentant a stimulé l'enregistrement AP d'un myocyte auriculaire isolé. Le résumé des paramètres de l'AP est présenté dans le tableau 6. L'amphotericine B (200 g/mL) a été ajoutée à la solution de pipette pour perméabiliser la membrane cellulaire. (B). Représentant INa enregistrements (gauche) et résumé INa IV courbe (droite) à partir d'un myocyte auriculaire isolé. Nifedipine (10 M) a été ajouté à la solution modifiée de Tyrode pour bloquer ICa,L lors de l'enregistrement INa. C. Représentant ICa,L enregistrements (gauche) et résumé ICa, courbe L IV (droite) d'un myocyte auriculaire isolé. (D) Enregistrements représentatifs IK (à gauche) et résumé IK IV courbe (à droite) à partir d'un myocyte auriculaire isolé. Les solutions utilisées pour enregistrer chacun de ces courants sont énumérées dans le tableau 7 et le tableau 8. Les courbes de résumé IV sont des mesures moyennes de 10 myocytes auriculaires isolés d'une souris mâle de type sauvage C57Bl/6 vieille de 15 semaines. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Stock Tyrode pH 6.9 | Stock Tyrode pH 7.4 | |
| produit chimique | en mM | en mM |
| Nacl | 140 Ans et plus | 140 Ans et plus |
| Kcl | 5,4 Annonces | 5,4 Annonces |
| KH2PO4 | 1,2 | 1,2 |
| Hepes | 5 Annonces | 5 Annonces |
| Volume final | 500 ml | 1 L |
| PH final avec NaOH | 6,9 | 7,4 Annonces |
Tableau 1 : PH 7.4 de Stock Tyrode et pH 6.9 de Tyrode. Composition des solutions de Stock Tyrode (pH 7.4 et pH 6.9) qui peuvent être faites à l'avance et stockées à 4 oC pendant un temps pouvant aller jusqu'à 2 mois.
| produit chimique | en mM |
| K-glutamate | 100 ans |
| K-aspartate K-aspartate | 10 Ans et plus |
| Kcl | 25 Annonces |
| KH2PO4 KH2PO4 | 10 Ans et plus |
| MgSO4 (en) | 2 (en) |
| Taurine | 20 Ans, états-unis |
| Créatine | 5 Annonces |
| EGTA (en anglais seulement) | 0,5 |
| glucose | 20 Ans, états-unis |
| Hepes | 5 Annonces |
| Bsa | 0,10 % |
| Volume final | 1 L |
| PH final avec KOH | 7,2 Annonces |
Tableau 2 : Solution KB modifiée. Recette pour la solution KB modifiée qui peut être faite à l'avance, aliquoted, et stockée à -20 oC pendant jusqu'à 2 mois.
| produit chimique | quantité |
| glucose | 5,55 mM |
| MgCl2 | 1 mM |
| CaCl2 (en) | 1,8 mm |
| Stock Tyrode pH 7.4 | 50 ml |
| Héparine | 250 l |
Tableau 3 : Solution de pH 7.4 modifiée de Tyrode avec glucose, magnésium, calcium et héparine. Composition de la solution de pH 7.4 de Tyrode modifiée utilisée pour la dissection du tissu auriculaire. Cette solution doit être fraîche et conservée dans un bain d'eau de 35 oC jusqu'à l'utilisation.
| produit chimique | quantité |
| glucose | 18,5 mm |
| Taurine | 49,96 mM |
| Bsa | 15 mg |
| CaCl2 (en) | 0,066 mM |
| Stock Tyrode pH 6.9 | 15 ml |
Tableau 4 : Solution de pH 6.9 de Tyrode modifiée contenant du glucose, de la taurine, de la BSA et un faible taux de calcium. Composition de la solution de pH 6.9 modifiée de Tyrode utilisée pour l'isolement du myocyte auriculaire. Cette solution doit être fraîche et conservée dans un bain d'eau de 35 oC jusqu'à l'utilisation.
| produit chimique | quantité |
| Collagènase | 1 064 U |
| Élastase | 9 U |
| Solution de protéase | 65,2 l |
| PH 6.9 de Tyrode modifié | 5 mL |
Tableau 5 : Solution enzymatique. Composition de la solution enzymatique utilisée pour digérer enzymatiquement les bandes de tissu auriculaire. Cette solution doit être fraîche et conservée dans un bain d'eau de 35 oC jusqu'à l'utilisation.
| paramètre | moyenne |
| RMP (mV) | -74,2 à 0,7 |
| Vmax (V/s) | 144,6 à 5,8 |
| OS (mV) | 71,9 à 3,0 |
| APD50 (ms) | 11,1 à 1,7 |
| APD70 (ms) | 23,0 à 4,6 |
| APD90 (ms) | 54,7 à 7,8 |
Tableau 6 : Résumé des paramètres AP des myocytes auriculaires isolés. Les données sont présentées comme étant moyennes : SEM, n - 10 myocytes auriculaires isolés d'une souris de type sauvage mâle de 15 semaines C57Bl/6.
| Courants et APs de potassium | Courants de sodium | Courants de calcium | |
| produit chimique | en mM | en mM | en mM |
| Nacl | 140 Ans et plus | 5 Annonces | |
| Kcl | 5,4 Annonces | ||
| MgCl2 (en) | 1 Fois | 1 Fois | 1 Fois |
| CaCl2 (CaCl2) | 1 Fois | 1 Fois | 2 (en) |
| Hepes | 10 Ans et plus | 10 Ans et plus | 10 Ans et plus |
| glucose | 5,5 annonces | 5,5 annonces | 5,5 annonces |
| CsCl (En) | 130 Ans et plus | ||
| TEA-Cl | 5,4 Annonces | 145,5 | |
| Ph | 7.4 avec NaOH | 7.4 avec CsOH | 7.4 avec CsOH |
Tableau 7 : Composition des solutions de Tyrode utilisées lors d'expériences de pince soumisement. Composition des solutions du Tyrode utilisées pour enregistrer APs, INa, ICa,L, et IK de myocytes auriculaires isolés.
| Courants et APs de potassium | Courants de sodium | Courants de calcium | |
| produit chimique | en mM | en mM | en mM |
| Nacl | 5 Annonces | 5 Annonces | 5 Annonces |
| Kcl | 140 Ans et plus | ||
| MgCl2 (en) | 1 Fois | 1 Fois | 1 Fois |
| CaCl2 (CaCl2) | 0,2 (en) | 0,2 (en) | 0,2 (en) |
| Hepes | 10 Ans et plus | 10 Ans et plus | 10 Ans et plus |
| EGTA (en anglais seulement) | 5 Annonces | 5 Annonces | |
| Mg-ATP (en) | 4 ( en plus) | 5 Annonces | 4 ( en plus) |
| Na-GTP (en anglais seulement) | 0,3 | 0,3 | 0,3 |
| Na-phosphocreatine | 6,6 | 6,6 | |
| CsCl (En) | 130 Ans et plus | 135 Annonces | |
| BAPTA (BAPTA) | 5 Annonces | ||
| Ph | 7.2 avec KOH | 7.2 avec CsOH | 7.2 avec CsOH |
Tableau 8 : Composition de la solution interne de pipette utilisée lors d'expériences de patch-clamp. Composition des solutions de remplissage de pipette utilisées pour enregistrer APs, INa, ICa,L, et IK de myocytes auriculaires isolés.
Discussion
Notre laboratoire utilise régulièrement ce protocole pour isoler les myocytes auriculaires de souris pour une utilisation dans des expériences de patch-clamp afin d'étudier les effets de différentes formes de maladie cardio-vasculaire, de mutations génétiques, ou de composés pharmacologiques sur le myocyte auriculaire Électrophysiologie. Bien que hautement reproductible, la qualité des données obtenues à partir des myocytes auriculaires isolés dépend de la qualité de l'isolement. En outre, la réintroduction du calcium suivant l'isolement auriculaire de myocyte aura comme conséquence la mort cellulaire pour une population de myocytes isolés dus au paradoxe de calcium16. Par conséquent, l'isolement des myocytes auriculaires viables et de haute qualité à l'aide de cette approche nécessite une pratique et une optimisation à plusieurs points tout au long de l'isolement. Une fois optimisé, on estime qu'entre 70 et 90 % du total des myocytes auriculaires isolés à l'aide de cette approche seront à la fois tolérants au calcium et en forme de tige. Les étapes nécessitant le plus de pratique et d'optimisation sont discutées ci-dessous.
La vitesse et l'efficacité de la dissection auront des effets en aval sur la qualité des cellules isolées. Il est important de prendre le temps de s'assurer que tout le sang est retiré du tissu auriculaire et que les bandes de tissu sont coupées à une taille similaire. Il devrait prendre environ 5 minutes pour enlever l'appendice auriculaire, couper le tissu en bandes, et transférer les bandes de tissu dans le premier tube de la solution modifiée de Tyrode pH 6.9. Cependant, si cette étape prend trop de temps, la qualité du tissu peut être compromise.
Il est également important que les bandes de tissu soient coupées à une taille uniforme dans un isolement et entre les coeurs. Si les bandes de tissu sont trop grandes ou trop petites, ou si elles ne sont pas uniformes dans un isolement, cela peut causer des problèmes pendant la digestion enzymatique et la trituration. C'est parce que les petites bandes seront plus soigneusement digérées et les grandes bandes seront sous-digérées. Il est tout aussi important de tenir compte du génotype et de l'établissement de la maladie à l'étude, car la taille de l'appendice auriculaire peut varier d'un animal à l'autre. Par exemple, les coeurs hypertrophiques ont de plus grands appendices auriculaires comparés aux coeurs sains, et donc l'expérimentateur peut couper plus de bandes dans les coeurs hypertrophiques comparés aux coeurs normaux de taille. En conséquence, l'optimisation de la taille des bandes de tissu coupées et l'application de ces dimensions à chaque appendice auriculaire individuel amélioreront considérablement la reproductibilité des isolements de myocyte entre les conditions expérimentales.
L'équilibre délicat entre la digestion enzymatique et la dissociation mécanique est la clé d'un isolement réussi de myocyte auriculaire utilisant ce protocole. Si le tissu n'est pas suffisamment tourbillonné pendant la digestion enzymatique les bandes de tissu individuelles auront tendance à s'agglutiner et coller ensemble, ce qui limitera l'efficacité de la digestion enzymatique. Si agité trop fréquemment ou vigoureusement, ceci peut endommager le tissu atrial, qui aura comme conséquence l'isolement des cellules non viables. La dissociation mécanique des myocytes auriculaires isolés des bandes de tissu pendant la trituration est l'étape la plus critique à pratiquer et optimiser utilisant cette approche pour isoler les myocytes auriculaires. Si la trituration est trop douce, le rendement cellulaire sera faible. D'autre part, si la trituration est trop sévère, alors une abondance de myocytes non viables sera isolée, et la qualité des données obtenues au cours des expériences de patch-clamp sera compromise. En outre, la composition des atriums peut affecter l'isolement. Par exemple, si le tissu est fibrotique, la digestion enzymatique et les étapes de trituration peuvent devoir être modifiées. Il est donc important de prendre le temps de développer les compétences nécessaires pour obtenir des cellules de haute qualité lors de la trituration qui peuvent être utilisées pour des expériences de patch-clamp.
Comme pour toutes les techniques expérimentales, il y a des limites. Cette technique nécessite une pratique afin d'isoler de façon reproductible des myocytes viables et de haute qualité, ce qui aura un impact sur la faisabilité de toutes les expériences à effectuer à l'aide de ces myocytes. Cette approche est également terminale et les myocytes auriculaires isolés à l'aide de cette approche peuvent être utilisés le jour de l'isolement seulement. Notre laboratoire utilise les cellules dans les 6-7 h de l'isolement.
Cette approche d'isoler les cardiomyocytes auriculaires a plusieurs applications. Par exemple, cette approche peut être modifiée pour isoler les myocytes auriculaires (ainsi que les fibroblastes cardiaques) d'autres espèces, y compris les biopsies des tissus auriculaires humains. En outre, un avantage à utiliser cette méthode de morceau pour l'isolement de myocyte auriculaire (contrairement à la perfusion rétrograde du coeur) est qu'il peut être modifié pour isoler des cardiomyocytes d'autres régions du coeur, telles que le nœud sinoatrial ou d'autres régions spécifiques du myocarde auriculaire, ou englobent toute la région supraventriculaire du cœur. Notre laboratoire utilise des cardiomyocytes auriculaires pour des expériences de patch-clamp pour mesurer les potentiels d'action et les courants ioniques, bien que cette approche ne doit pas être limitée à cette technique. Par exemple, les myocytes isolés peuvent être utilisés pour étudier les altérations des transitoires de calcium et la contractilité dans une variété de milieux expérimentaux. Les cardiomyocytes auriculaires peuvent également être utilisés dans les études d'immunofluorescence pour étudier l'emplacement des protéines ou des structures d'intérêt. En conséquence, cette approche est très polyvalente avec de nombreuses applications possibles.
Déclarations de divulgation
Les auteurs n'ont rien à divulguer.
Remerciements
Ces travaux sont appuyés par des subventions de fonctionnement des Instituts de recherche en santé du Canada (MOP 93718, 142486) et de la Fondation des maladies du cœur du Canada à R.A. Rose. H.J. Jansen est le récipiendaire d'une bourse postdoctorale Killam.
matériels
| Name | Company | Catalog Number | Comments |
| 1, 2-Bis(2-Aminophenoxy)ethane-N, N, N', N'-tetraacetic acid 98% | Sigma | A4926-1G | |
| Adenosine 5'-triphosphate disodium salt hydrate BioXtra, > 99%, from microbial | Sigma | A7699-1G | |
| Adenosine 5'-triphosphate magnesium salt > 95%, bacterial | Sigma | A9187-1G | |
| Amphocetericin B from Streptomyces sp. ~80% (HPLC), powder | Sigma | A4888-500 MG | |
| Bovine serum albumin | Sigma | A3059-50G | |
| Calcium chloride dihydrate | Sigma | 223506-500G | |
| Cesium chloride ReagentPlus, 99.9% | Sigma | 289329-100G | |
| Cesium hydroxide monohydrate > 99.5% trace metals basis | Sigma | 562505-1KG | |
| Collagenase Type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine anhydrous | Sigma | C0780 | |
| D-(+)-Glucose | Sigma | G7021-1KG | |
| DL-Aspartic acid potassium salt | Sigma | A2025-100G | |
| Elastase suspension | Worthington Biochemical Corporation | LS002279 | |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid >97.0% | Sigma | E4378-25G | |
| Guanosine 5'-triphosphate sodium salt hydrate > 95% (HPLC), powder | Sigma | G8877-250MG | |
| Heparin 10 000 USP units/10mL | SANDOZ | 10750 | |
| HEPES > 99.5% (titration) | Sigma | H3375-500G | |
| L-Glutamic acid potassium salt monohydrate > 99% (HPLC), powder | Sigma | G1501-500G | |
| Magnesium sulfate | Sigma | M2643-500G | |
| Nifedipine > 98% (HPLC), powder | Sigma | N7634-1G | |
| Phosphocreatine disodium salt hydrate enzymatic, approx 98% | Sigma | P7936-5G | |
| Potassium chloride ACS reagent, 99.0-100.5% | Sigma | P3911-500G | |
| Potassium hydroxide | EM Science | PX1480-1 | |
| Potassium phosphate monobasic | EMD | PX1565-1 | |
| Protease from Streptomyces griseus, type XIV, >3.5 units/mg solid, powder | Sigma | P5147-1G | |
| Sodium chloride ACS reagent, > 99.0% | Sigma | S9888-2.5KG | |
| Sodium hydroxide, pellets, 97+%, A.C.S. reagent | Sigma | 221465-500G | |
| Sylgard 184 silicone elastomer kit | World Precision Instruments Inc | SYLG184 | |
| Taurine | Sigma | T0625-100G | |
| Tetraethylammonium chloride > 98% (titration) | Sigma | T2265-100G |
Références
- Bartos, D. C., Grandi, E., Ripplinger, C. M. Ion Channels in the Heart. Comprehensive Physiology. 5 (3), 1423-1464 (2015).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circulation Research. 114 (9), 1483-1499 (2014).
- Jalife, J. Mechanisms of persistent atrial fibrillation. Current Opinion in Cardiology. 29 (1), 20-27 (2014).
- Nattel, S., Maguy, A., Le Bouter, S., Yeh, Y. H. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation. Physiological Reviews. 87 (2), 425-456 (2007).
- Jansen, H. J., et al. Atrial structure, function and arrhythmogenesis in aged and frail mice. Scientific Reports. 7, 44336 (2017).
- Jansen, H. J., et al. Distinct patterns of atrial electrical and structural remodeling in angiotensin II mediated atrial fibrillation. Journal of Molecular and Cellular Cardiology. 124, 12-25 (2018).
- Nerbonne, J. M., Kass, R. S. Molecular physiology of cardiac repolarization. Physiological Reviews. 85 (4), 1205-1253 (2005).
- Grant, A. O. Cardiac ion channels. Circulalation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Schmitt, N., Grunnet, M., Olesen, S. P. Cardiac potassium channel subtypes: new roles in repolarization and arrhythmia. Physiological Reviews. 94 (2), 609-653 (2014).
- Lomax, A. E., Kondo, C. S., Giles, W. R. Comparison of time- and voltage-dependent K+ currents in myocytes from left and right atria of adult mice. American Journal of Physiology Heart and Circulatory Physiology. 285 (5), H1837-H1848 (2003).
- Li, D., Zhang, L., Kneller, J., Nattel, S. Potential ionic mechanism for repolarization differences between canine right and left atrium. Circ Res. 88 (11), 1168-1175 (2001).
- Wirth, K. J., Knobloch, K. Differential effects of dofetilide, amiodarone, and class lc drugs on left and right atrial refractoriness and left atrial vulnerability in pigs. Naunyn Schmiedebergs Archives of Pharmacology. 363 (2), 166-174 (2001).
- Qi, A., Yeung-Lai-Wah, J. A., Xiao, J., Kerr, C. R. Regional differences in rabbit atrial repolarization: importance of transient outward current. American Journal of Physiology. 266 (2 Pt 2), H643-H649 (1994).
- Jansen, H. J., et al. NPR-C (Natriuretic Peptide Receptor-C) Modulates the Progression of Angiotensin II-Mediated Atrial Fibrillation and Atrial Remodeling in Mice. Circulation: Arrhythmia and Electrophysiology. 12 (1), e006863 (2019).
- Mangoni, M. E., Nargeot, J. Genesis and regulation of the heart automaticity. Physiological Reviews. 88 (3), 919-982 (2008).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Springer, J., et al. The natriuretic peptides BNP and CNP increase heart rate and electrical conduction by stimulating ionic currents in the sinoatrial node and atrial myocardium following activation of guanylyl cyclase-linked natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 52 (5), 1122-1134 (2012).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. A. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PLoS One. 7 (10), e47652 (2012).
- Egom, E. E., et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. Journal of Physiology. 593 (5), 1127-1146 (2015).
- Hua, R., et al. Effects of Wild-Type and Mutant Forms of Atrial Natriuretic Peptide on Atrial Electrophysiology and Arrhythmogenesis. Circulation: Arrhythmia and Electrophysiology. 8 (5), 1240-1254 (2015).
- Krishnaswamy, P. S., et al. Altered parasympathetic nervous system regulation of the sinoatrial node in Akita diabetic mice. Journal of Molecular and Cellular Cardiology. 82, 125-135 (2015).
- Mackasey, M., et al. Natriuretic peptide receptor C (NPR-C) protects against angiotensin II mediated sinoatrial disease in mice. JACC Basic to Translational Science. , (2018).
- Azer, J., Hua, R., Vella, K., Rose, R. A. Natriuretic peptides regulate heart rate and sinoatrial node function by activating multiple natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 53 (5), 715-724 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon