A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفحص الحركي للنشاط النواسي باستخدام مجسات الحمض النووي
* These authors contributed equally
In This Article
Summary
وقد ارتبط النشاط النيوداز المتغيرة مع الظروف البشرية المختلفة ، الكامنة وراء إمكاناتها باعتبارها البيولوجية. تسمح منهجيه الفحص النموذجية وسهله التنفيذ المعروضة في هذه الورقة باختيار مجسات محدده من الأحماض النووية لتسخير نشاط النيوداز كمؤشر حيوي للمرض.
Abstract
Nucleases هي فئة من الانزيمات التي تكسر الأحماض النووية عن طريق تحفيز التحلل المائي من السندات الفوسفاوديستر التي تربط السكريات الريبوز. عرض nucleases مجموعه متنوعة من الأدوار الفسيولوجية الحيوية في الكائنات البدائية النواة والنواة الحقيقية ، بدءا من الحفاظ علي استقرار الجينوم لتوفير الحماية ضد مسببات الامراض. وقد ارتبط النشاط النيوداز المتغيرة مع العديد من الحالات المرضية بما في ذلك العدوى البكتيرية والسرطان. وتحقيقا لهذه الغاية ، اظهر نشاط النيوداز امكانيه كبيره للاستغلال باعتباره مؤشرا إحيائيا محددا. ومع ذلك ، فان طريقه الفرز القوية والقابلة للتكرار المستندة إلى هذا النشاط لا تزال مستصوبه للغاية.
هنا ، نقدم طريقه تمكن من فحص نشاط النيوداز باستخدام مجسات الحمض النووي كركائز ، مع نطاق التمييز بين الظروف المرضية والصحية. هذا الأسلوب يوفر امكانيه تصميم مكتبات التحقيق الجديدة ، مع زيادة الخصوصية ، بطريقه تكراريه. التالي ، فان جولات متعددة من الفحص ضرورية لصقل تصميم المجسات مع ميزات محسنه ، مع الاستفادة من توافر الأحماض النووية المعدلة كيميائيا. وتكمن الإمكانات الكبيرة للتكنولوجيا المقترحة في مرونتها واستنساخها العالية وبراعتها في فحص نشاط النيوداز المرتبط بظروف المرض. ومن المتوقع ان تسمح هذه التكنولوجيا تطوير أدوات التشخيص واعده مع إمكانات كبيره في العيادة.
Introduction
Nucleases هي فئة من الانزيمات القادرة علي المرابط السندات فوسفوديستر التي تشكل الهيكل الأساسي لجزيئات الحمض النووي. التنوع الشاسع لل نوكليسيس يجعل تصنيفها صعبه نوعا ما. ومع ذلك ، هناك بعض المعايير الشائعة المستخدمة لوصف النوكلينس ، مثل تفضيل الركيزة (حمض ديكسيريبونريك (DNA) أو حمض الريبونسيك (RNA)) ، موقع الانشقاق (الكريات النووية أو التبرئة) ، أو التبعية أيون المعادن ، من بين أمور أخرى1. Nucleases هي الانزيمات الحفازه المحفوظة للغاية التي لها ادوار أساسيه في كل من الكائنات الحية النواة والنواة وقد استخدمت ، والاستمرار في استخدامها ، وأداات تحرير الجينات2. وهي أيضا جات فاعله أساسيه في صيانة الحمض النووي وتكراره ، مما يساعد علي الحفاظ علي استقرار الجينوم والمشاركة في عمليات القراءة المضادة3. في البكتيريا ، علي سبيل المثال ، تم تحديد نوكليسيس كعوامل الضراوة الهامه ، قادره علي تعزيز بقاء البكتيريا عن طريق الحد من فعاليه الجهاز المناعي للمضيف4،5،6،7 ،8. في الثدييات, وقد اقترح نوكليسيس ان تكون متورطة في المبرمج9, التكوين الحيوي الميتوكوندريا والصيانة10 والوساطة من الاستجابات المناعية الفطرية المضادة للبكتيريا والمضادة للفيروسات11. وليس من المستغرب ان تكون التغيرات في نشاط النيواز ، سواء كانت تعزيزا أو نقصا ، متورطة في مجموعه واسعه من الامراض البشرية. وتتراوح هذه الامراض من مجموعه واسعه من السرطانات12,13 إلى تضخم القلب10 أو امراض المناعة الذاتية14. ولذلك ، أصبحت نوكليسيس المرشحين مثيره للاهتمام كما المؤشرات الحيوية لمجموعه غير متجانسة من الظروف البشرية. في الواقع, وقد أظهرت بالفعل نوكليسيس إمكاناتها كاداات تشخيصيه ناجحه للكشف عن الإصابات الناجمة عن عوامل بكتيرية محدده, مثل المكورات العنقودية الذهبية أو القولونية15, 16. في العديد من أنواع السرطان ، والتعبير عن مكورات النيوداز التي تحتوي علي المجال البروتين 1 (SND1) ريبونكليوداز يدل علي سوء التكهن17. في مرضي سرطان البنكرياس ، تم الإبلاغ عن مستويات المصل المرتفعة (RNase I)18 واقترح ان تكون مرتبطة بالأنماط الظاهرية للخلايا السرطانية19. في حالات القلب الدماغية ، مثل احتشاء العضلة القلبية أو الذبحة الصدرية غير المستقرة ، فقد ثبت ان مستويات مصل الدم (dnase i) لتكون علامة تشخيصيه صالحه20،21.
وقد تم الافتراض بان المخطط العالمي للنشاط النواسي قد يكون مختلفا في الدول الصحية والامراض. في الواقع ، استخدمت التقارير الاخيره الاختلافات في نشاط النيوداز للتمييز بين الأنماط الظاهرية الصحية والسرطانية22 أو للتعرف علي العدوى البكتيرية المسببة للامراض بطريقه محدده من النوع15،23. وقد فتحت هذه النتائج وسيله جديده لاستخدام الجزيئات الحيوية للمرض. ولذلك ، توجد ضرورة لوضع طريقه فرز شامله قادره علي التحديد المنهجي للاختلافات المرتبطة بالامراض في نشاط النيوداز ، والتي قد تكون ذات اهميه رئيسيه في تطوير أدوات تشخيصيه جديده.
هنا ، نقدم ونقدم وصفا لنهج الفحص الجديد في المختبر (الشكل 1) لتحديد المجسات الحساسة والمحددة القادرة علي التمييز بين نشاط النيوداز في صحة وغير صحية ، أو النشاط المحدد لنوع من الخلايا أو البكتيريا. الاستفادة من نمطيه الأحماض النووية ، قمنا بتصميم مكتبه أوليه من المجسات الفلورية التي تتكون من مجموعه شامله من المتواليات المختلفة والكيميائية ، وكلاهما معلم مهم لتصميم المكتبة. ويحيط بهذه المسبارات القليلة النواة فلوكوفيري (فلوريسئين اميسيت ، فأم) والمروي (المد والجزر 2 ، TQ2) في 5 ' و 3 ' ينتهي علي التوالي (الجدول 1). باستخدام هذا الرنين الفلوري نقل الطاقة (الحنق) علي أساس الفحص الفلوري لقياس حركيه التحلل الانزيمي ، تمكنا من تحديد التحقيقات المرشح مع امكانيه التمييز بين الأنماط التفاضلية للنشاط النيوداز المرتبطة بالدول الصحية أو المرض. قمنا بتصميم عمليه تكراريه ، حيث يتم إنشاء المكتبات الجديدة استنادا إلى أفضل التحقيقات المرشحة ، والتي تسمح بتحديد التحقيقات المرشحة الأكثر تحديدا في خطوات الفرز اللاحقة. وعلاوة علي ذلك ، فان هذا النهج يستفيد من الطبيعة الحفازه لل نوكليسيس لزيادة الحساسية. ويتحقق ذلك من خلال الاستفادة من طبيعة activatable من التحقيقات مراسل وقدره نوكليسيس لمعالجه جزيئات الركيزة باستمرار ، وكلاهما يمثل المزايا الرئيسية علي الأجسام المضادة البديلة أو الصغيرة المستندة إلى جزيء طرق الفرز.
ويوفر هذا النهج أداه فحص ذات وحدات عاليه ومرنه وسهله التنفيذ لتحديد المجسات الخاصة بالأحماض النووية القادرة علي التمييز بين الدول الصحية والامراض ، ومنصة ممتازة لتطوير أدوات التشخيص التي يمكن تكييفها للتطبيقات السريرية في المستقبل. وعلي هذا النحو ، استخدم هذا النهج لتحديد النشاط النيوداز المستمدة من السالمونيلا التيفوئيد (المشار اليها هنا باسم السالمونيلا) لتحديد محدد لهذه البكتيريا. في البروتوكول التالي ، نقوم بالإبلاغ عن طريقه لفحص نشاط النيوداز البكتيري باستخدام التحليل الحركي.
Protocol
1-تصميم المكتبات واعدادها
- تصميم المكتبة
- بناء علي المعايير التالية تصميم مكتبه من الفلورسنت الفلورية القليلة من المجسات بين 8 و 12-مير طويلة لتجنب تشكيل الهيكل الثانوي ، مع طول متساو لجميع التحقيقات.
- وتشمل علي الأقل DNA واحد وتسلسل الحمض النووي الريبي عشوائية واحده تحتوي علي مزيج من الأدنين (a) ، الغوانين (G) ، السيتوزين (C) وألغام (T)/uracil (U) (الحمض النووي والجيش الملكي النيبالي تحقيقات في الجدول 1).
ملاحظه: كانت تسلسلات الحمض النووي و RNA الموصوفة في الجدول 1 مفيده كركائز أوليه لتصنيف نوع غير معروف من نشاط النواز ، اما Dnase أو rnase. ويوصي بهذين التسلسلين كنقطه انطلاق لأي فحص ، لأنهما اظهرا قدره واسعه علي الكشف عن ملامح نشاط النيوداز في عينات البكتيريا والانسجه. إذا لم يلاحظ نشاط النيوداز مع هذه التسلسلات الحمض النووي والجيش النيبالي الريبي ، مطلوب تصميم المزيد من القلة الكريات. - باستخدام نفس تسلسل بقايا النوكليوتيد كتسلسل الحمض النووي الاولي والجيش النيبالي الريبي ، وتشمل متواليات التي تحتوي علي النظير النيونوسايد إيواء التعديلات الكيميائية في 2 '-موقف السكر الريبوز ، مثل 2 '-فلورو و 2 '-O-ميثيل ، كخطوه صارمة لزيادة الانتقائية لل nucleases.
- تضمين تسلسلات معدله بالبالكامل تتكون بالكلية من 2 '-فلورو النظير النيونوسيد أو 2 '-O-الميثيل النظير النيونوسيد (كل 2 '-F وجميع 2 '-OMe ، الجدول 1)
- وتشمل متواليات خيالي تتكون من البورينات الطبيعية غير المعدلة و 2 '-فلورو بيريميدين النظير النيونوسيد (RNA pyr-2'f ، الجدول 1).
- وتشمل متواليات خيالي التي تتكون من البورينات الطبيعية غير المعدلة و 2 '-O-ميثيل بيريميدين النظير النيونوسيد (RNA pyr-2'ome ، الجدول 1).
- وتشمل متواليات خيالي التي تتكون من بيريمينيس الطبيعية غير المعدلة و 2 '-فلورو البيورين النظير النيونوسيد (RNA Pur-2'f ، الجدول 1).
- وتشمل متواليات خيالي تتكون من بيريمينيس الطبيعية غير المعدلة و 2 '-O-ميثيل البيورين النظير النيونوسيد (RNA Pur-2'ome ، الجدول 1).
- وتشمل علي الأقل DNA واحد وتسلسل الحمض النووي الريبي عشوائية واحده تحتوي علي مزيج من الأدنين (a) ، الغوانين (G) ، السيتوزين (C) وألغام (T)/uracil (U) (الحمض النووي والجيش الملكي النيبالي تحقيقات في الجدول 1).
- بناء علي المعايير التالية تصميم مكتبه من الفلورسنت الفلورية القليلة من المجسات بين 8 و 12-مير طويلة لتجنب تشكيل الهيكل الثانوي ، مع طول متساو لجميع التحقيقات.
- [اولنوكليوكليوتيد] تحقيق تحضير وتخزين
ملاحظه: يتم توليف قله الكريات الوحيدة بواسطة الأسلوب الفوسفاراميسيت. بعد التوليف ، يتم تنقيه قله الكريات الوحيدة باستخدام اللوني السائل عالي الأداء (HPLC) وتقاس الكتلة عن طريق قياس الطيف الكتلي.- قم بتدوير المجسات بالتجميد باستخدام جهاز الطرد المركزي وتمييعها في المخزن المؤقت تريس-أدتا (TE) لمنع تدهور النيوداز. تحديد حجم التخفيف وفقا لمحصول كل مسبار لتقديم حل الأسهم مع تركيز 500 pmol/μL.
- يحفظ المجفف بالتجميد عند 4 درجه مئوية أو درجه حرارة الغرفة لفتره قصيرة. للتخزين علي المدى الطويل (من أشهر إلى سنوات) ، وتخزينها بالتبريد المجفف القلة الكريات في-20 درجه مئوية. عند أعاده تعليق القلة المجففة بالتجميد في TE ، تخزين حلول الأسهم في-20 درجه مئوية أو ، ويفضل ، في-80 درجه مئوية.
2-الثقافة البكتيرية
- خذ حبه زجاجيه مساميه واحده من قارورة التخزين المبردة تحت ظروف معقمه.
- لعزل المستعمرات البكتيرية الفردية (السالمونيلا والقولونية) ، استخدم الطريقة الرباعية24 من خلال التلويح/المتداول حبه مباشره علي طبق بيتري التي تحتوي علي الصويا التريتيك أجار (TSA) المتوسطة تستكمل مع الأغنام بتحد الدم.
- احتضان الثقافة في 37 درجه مئوية لمده 24 ساعة.
3. اعداد سوبرناتانت
- نقل مستعمره واحده من وسائل الاعلام الصلبة إلى 50 mL الصويا التريتيك مرق (مكتب تقييس الاتصالات) واحتضان في 37 درجه مئوية ل 24 ح في 200 دوره في الدقيقة.
- تمييع الثقافة (1:500) في تقييس (الثقافة الفرعية) واحتضان في 37 درجه مئوية ل 24 ح في 200 دوره في الدقيقة في حاضنه الاهتزاز.
ملاحظه: من المتوقع انه بعد 24 ساعة من الاحتضان الثقافات البكتيرية في مرحله ثابته تصل القيم اعلي من 109 كفو/mL. - بعد فتره الحضانة ، نقل الثقافات إلى الأنابيب المعقمة المغطية والطاردة المركزية في 4,500 x g لمده 30 دقيقه.
- جمع ماده طافي واستخدامه علي الفور. بدلا من ذلك ، تخزين supernatants في 4 درجه مئوية أو-20 درجه مئوية.
4. مقايسة النشاط النواسي
- اعداد حلول العمل
- اعداد الحل 20 μL العمل لكل مسبار في 1.5 mL النيوداز الحرة أنابيب الطرد المركزي عن طريق تمييع (1:10 نسبه) حل الأسهم (500 pmol/μL) للتركيز العمل النهائي من 50 pmol/μL. لهذا الغرض ، مزيج 18 μL من الفوسفات العازلة المالحة (تلفزيوني) التي تحتوي علي MgCl2 و cacl2 مع 2 μl من الحل الأسهم التحقيق.
ملاحظه: انتبه إلى انه في حل العمل ، فان قله عدد الكريات الوحيدة أكثر عرضه للتدهور النواسي ، ولذلك ، فمن المستحسن لاعداد حلول العمل فقط قبل اعداد رد الفعل. - تجنب ملامسه الضوء المباشر اثناء التحضير واحفظه في الظلام (ملفوف في ورق القصدير) ، عند التعامل مع الفلوبورس.
- اعداد الحل 20 μL العمل لكل مسبار في 1.5 mL النيوداز الحرة أنابيب الطرد المركزي عن طريق تمييع (1:10 نسبه) حل الأسهم (500 pmol/μL) للتركيز العمل النهائي من 50 pmol/μL. لهذا الغرض ، مزيج 18 μL من الفوسفات العازلة المالحة (تلفزيوني) التي تحتوي علي MgCl2 و cacl2 مع 2 μl من الحل الأسهم التحقيق.
- رد فعل اعداد
- قبل الحارة فلوميتر (علي سبيل المثال ، الخلايا 1) إلى 37 درجه مئوية.
- اعداد مجموعه (أنبوب واحد/مسبار) من 1.5 mL النيوداز الحرة أنابيب الطرد المركزي لكل عينه (تقييس ، e. كولاي و السالمونيلا) والتسمية وفقا لذلك.
- بعناية أضافه 96 μl من مكتب تقييس الاعلام الثقافة العقيمة ، السالمونيلا ماده طافي أو e. القولونية ماده طافي (من الخطوة 3.4.). وبعد ذلك ، أضافه 4 μL/أنبوب من التحقيق حل العمل وفقا لذلك. تنفيذ هذه الخطوة في درجه حرارة الغرفة.
ملاحظه: استخدمت 10 تحقيقات للجولة الاولي من الفرز و 6 تحقيقات للجولة الثانية. - اخلط جيدا عن طريق التنضيد لاعلي ولأسفل للحصول علي حل متجانس. تجنب إدخال فقاعات الهواء في العينات اثناء المزج.
- تحميل 95 μl من كل حل (مسبار + ماده طافي أو ثقافة وسائل الاعلام) في بئر منفصلة من أسفل اسود ، غير المعالجة 96 لوحه جيدا. تقليل تشكيل فقاعات في الآبار عند التحميل عن طريق الاستغناء بعناية مع غيض علي مقربه من جدار البئر.
- غطي الصفيحة بغطاءها. فحص بصريا الغطاء والتحقق من علامات القلم أو تراكم الغبار الجسيمات التي قد إدخال التحف القياس. استبدل غطاء واحد جديد إذا كانت هذه هي الحالة.
- اعداد القياس
- افتح برنامج الاستحواذ (Gen5 3.05) بالنقر علي أيقونه اختصار البرنامج (الشكل S1A).
- حدد قراءه الآن من نافذه أداره المهام واختر جديد... لإنشاء بروتوكول القياس الحركي (الشكل S1B).
- انقر علي تعيين درجه الحرارة في اطار الحوار بعنوان الاجراء وحدد 37 درجه مئوية. تاكيد وحفظ الإعدادات عن طريق الضغط OK (الشكل S1C).
- انقر فوق بدء الحركية في اطار الحوار بعنوان الاجراء. ثم في نافذه الحوار المنبثقة ، بعنوان الخطوة الحركية، حدد 2 ح في مربع الإدخال وقت التشغيل و 2 دقيقه في مربع إدخال الفاصل الزمني . تاكيد وحفظ الإعدادات عن طريق الضغط OK (الشكل S1D).
- انقر فوق قراءه في اطار الحوار بعنوان الاجراء. ثم في نافذه الحوار المنبثقة ، بعنوان طريقه القراءة، حدد كثافة الفلورية كطريقه الكشف ، نقطه النهاية/الحركية كنوع القراءة والفلاتر كنوع البصريات. تاكيد وحفظ الإعدادات عن طريق الضغط OK (الشكل S1E).
- في نافذه الحوار المنبثقة بعنوان قراءه الخطوة (الحركية)، حدد الأخضر من مجموعه عوامل التصفية. تاكيد وحفظ الإعدادات عن طريق الضغط OK (الشكل S2A).
- في اطار الحوار المعنون الاجراء، حدد استخدام الغطاء وانقر فوق التحقق من الصحة للتاكد من صحة البروتوكول الذي تم إنشاؤه. يتم تاكيد ذلك بواسطة اطار حوار منبثق (الشكل S2B).
- حدد البروتوكول في شريط القوائم واختر الاجراء (الشكل S2C).
- في نافذه الحوار المعنونة الاجراء، حدد الآبار التي سيتم قياسها (الشكل S2D).
- ادخل اسم التجربة في مربع إدخال اسم الملف (الشكل S2E).
- تحميل لوحه مع غطاء لها في قارئ لوحه. تاكد من ان اللوحة في الاتجاه الصحيح.
- بدء الاستحواذ بالنقر فوق " قراءه زر جديد " في شريط الاداات (الشكل S2F).
- تحليل البيانات
- انقر علي أحد الآبار المقاسه في نافذه الحوار بعنوان لوحه 1 (الشكل S3A).
- انقر فوق تحديد الآبار وتضمين كافة الآبار المقاسه في نافذه الحوار تحديد البئر . تاكيد وحفظ الإعدادات عن طريق الضغط علي OK. (الشكل S3B).
- حدد البيانات في نافذه الحوار بعنوان اللوحة 1 لتصور النتائج المجدولة (الشكل S3C).
- تصدير البيانات إلى ورقه انتشار عن طريق تحديد التصدير السريع من قائمه السياق (الشكل S3C).
- في ورقه الانتشار ، تسميه أعمده البيانات وفقا لكل عينه والتحقيق.
- توليد الرسوم البيانية الحركية ، وذلك باستخدام خط مع علامات نمط ، من خلال التامر وحدات مضان النسبية (rfu) مقابل الوقت (محور س: الجدول الزمني للتفاعل ومحور ص: rfus).
ملاحظه: وصف إنشاء رسم بياني قابل للتطبيق عند استخدام برامج جداول البيانات (علي سبيل المثال ، Excel). ومع ذلك ، يمكن استخدام اي برامج أخرى لتوليد الرسوم البيانية من البيانات الخام التي تم الحصول عليها ، عن طريق التامر RFU مقابل الوقت. - حساب معدل رد الفعل الانزيمي لكل فتره تقاس وفقا للصيغة التالية25:
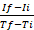 معدل = ، حيث إذا كان rfu في الفاصل الزمني القصوى نقطه الوقت والثاني هو rfu في الحد الأدنى الفاصل الزمني نقطه ، و Tf و Ti هي الحد الأقصى والحد الأدنى الفاصل الزمني النقاط ، علي التوالي.
معدل = ، حيث إذا كان rfu في الفاصل الزمني القصوى نقطه الوقت والثاني هو rfu في الحد الأدنى الفاصل الزمني نقطه ، و Tf و Ti هي الحد الأقصى والحد الأدنى الفاصل الزمني النقاط ، علي التوالي. - حدد المعدل الذي يحتوي علي اعلي قيمه (Rmax) لكل منحني. إذا كان هناك أكثر من Rmax واحد لكل نموذج ، حدد الواحد الذي يحدث في أقرب نقطه زمنيه للقياس.
- احسب النسبة بين Rmax ومتوسط قيمه الفاصل الزمني الذي يحدث فيه rmax : معامل المعدل =
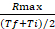
- حساب الفرق اضعاف (فد) بين معامل معدل السالمونيلا و e. كولاي لكل مسبار.
- النظر في قيمه الفرق اضعاف اعلي من 3 كما كبيره.
- النظر في التحقيقات الهامه مع اعلي القيم الفرق اضعاف (فد) كتحقيقات المرشح وكاساس لتصميم المكتبة في جولة الفرز المقبل.
5-معايير اختيار جولات الفرز (الشكل 1)
- الجولة الاولي من الفحص
- قم باجراء فحص النشاط النواسي (كما هو موضح في القسم 4) باستخدام الحمض النووي ، RNA ومسبار بولينوكليوتيد.
- تقييم تفضيل الكيمياء DNA أو كيمياء الحمض النووي الريبي عن طريق مقارنه عدد والأداء (FD القيمة) من الحمض النووي وتحقيقات المرشح RNA.
- حدد نوع كيمياء الحمض النووي الذي يجعل أكبر عدد من مجسات المرشحين ، كما هو موضح في الشكل 1.
- الجولة الثانية من الفحص
- اجراء فحص النشاط النواسي (كما هو موضح في القسم 4) باستخدام التحقيقات المعدلة بالبالكامل وتحقيقات الشمبانزي المصممة علي أساس الركيزة الحمضية النووية المختارة في جولة الفحص الاولي.
- تقييم التفضيل نحو المتواليات التي تحتوي علي 2 '-فلورو و 2 '-O-الميثيل النظير النيونوسيد من خلال مقارنه النتائج التي تم الحصول عليها ل 2 '-فلورو و 2 '-س-ميثيل تحقيقات المرشح المعدلة.
- حدد نوع التعديل التناظري الجانبي الذي يجعل أكبر عدد من مجسات المرشحين ، كما هو موضح في الشكل 1.
النتائج
ويبين الشكل 1 تدفق العمل لهذه المنهجية ، الذي ينقسم إلى جولتين للفحص. ويمكن الاطلاع علي البيانات الاوليه لجولة الفرز هذه في الجدول التكميلي 1. في الجولة الثانية ، تم توليفها التحقيقات المعدلة كيميائيا عن طريق استبدال تسلسل الجيش النيبالي الريبي مع النيونوسيدس الم...
Discussion
ارتبطت تعديلات نشاط النيواز بمجموعه واسعه من الأنماط الظاهرية للامراض ، بما في ذلك أنواع مختلفه من السرطان والتهابات البكتيرية. ويقترح ان تكون هذه التعديلات العامل المسبب للشرط14، في حين انها في حالات أخرى هي نتيجة لحدث فسيولوجي ضار20 أو العامل المسبب للامراض
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
ويود أصحاب البلاغ الاعتراف بالسيدة لويزا ا. هيرنانديز (جامعه لينكوبينغ) لمراجعتها المتانيه للمخطوطة وإسداء المشورة القيمة لها. وقد حظي هذا العمل بدعم مؤسسه كنوت واليس فالينبرغ ومنطقه البحوث الاستراتيجية التابعة للحكومة السويدية في مجال علوم المواد المتعلقة بالمواد الوظيفية المتقدمة في جامعه لينكوبينغ (الكلية غرانت SFO-مات-ليو رقم 2009-00971).
Materials
| Name | Company | Catalog Number | Comments |
| Black bottom, non-treated 96 well plate | Fisher Scientific | 10000631 | |
| Cytation1 | BioTek | CYT1FAV | |
| Eppendorf tubes | Thermofisher | 11926955 | |
| Escherichia coli | ATCC | 25922 | |
| Microbank cryogenic storage vial containing beads | Pro-Lab Diagnostics | 22-286-155 | |
| Nucleic acid probes | Biomers.net | # | |
| Phosphate Buffer Saline containing MgCl2 and CaCl2 | Gibco™ | 14040117 | |
| Salmonella enterica subs. Enterica | ATCC | 14028 | |
| Tris-EDTA | Fisher Scientific | 10647633 | |
| Tryptone Soya Agar with defibrinated sheep blood | Thermo Fisher Scientific | 10362223 | |
| Tryptic Soy Broth | Sigma Aldrich | 22092 |
References
- Yang, W. Nucleases: diversity of structure, function and mechanism. Quarterly Reviews of Biophysics. 44 (1), 1-93 (2011).
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nature Communication. 9 (1), 1911 (2018).
- Mason, P. A., Cox, L. S. The role of DNA exonucleases in protecting genome stability and their impact on ageing. Age (Dordr). 34 (6), 1317-1340 (2012).
- Berends, E. T., et al. Nuclease expression by Staphylococcus aureus facilitates escape from neutrophil extracellular traps. Journal of Innate Immunity. 2 (6), 576-586 (2010).
- Kiedrowski, M. R., et al. Staphylococcus aureus Nuc2 is a functional, surface-attached extracellular nuclease. PLoS One. 9 (4), 95574 (2014).
- Morita, C., et al. Cell wall-anchored nuclease of Streptococcus sanguinis contributes to escape from neutrophil extracellular trap-mediated bacteriocidal activity. PLoS One. 9 (8), 103125 (2014).
- Hasegawa, T., et al. Characterization of a virulence-associated and cell-wall-located DNase of Streptococcus pyogenes. Microbiology. 156, 184-190 (2010).
- Moon, A. F., et al. Structural insights into catalytic and substrate binding mechanisms of the strategic EndA nuclease from Streptococcus pneumoniae. Nucleic Acids Research. 39 (7), 2943-2953 (2011).
- Li, L. Y., Luo, X., Wang, X. Endonuclease G is an apoptotic DNase when released from mitochondria. Nature. 412 (6842), 95-99 (2001).
- McDermott-Roe, C., et al. Endonuclease G is a novel determinant of cardiac hypertrophy and mitochondrial function. Nature. 478 (7367), 114-118 (2011).
- Wang, Y. T., et al. A link between adipogenesis and innate immunity: RNase-L promotes 3T3-L1 adipogenesis by destabilizing Pref-1 mRNA. Cell Death & Disease. 7 (11), 2458 (2016).
- Li, C. L., Yang, W. Z., Shi, Z., Yuan, H. S. Tudor staphylococcal nuclease is a structure-specific ribonuclease that degrades RNA at unstructured regions during microRNA decay. RNA. 24 (5), 739-748 (2018).
- Wan, L., et al. MTDH-SND1 interaction is crucial for expansion and activity of tumor-initiating cells in diverse oncogene- and carcinogen-induced mammary tumors. Cancer Cell. 26 (1), 92-105 (2014).
- Keyel, P. A. Dnases in health and disease. Developmental Biology. 429 (1), 1-11 (2017).
- Hernandez, F. J., et al. Noninvasive imaging of Staphylococcus aureus infections with a nuclease-activated probe. Nature Medicine. 20 (3), 301-306 (2014).
- Flenker, K. S., et al. Rapid Detection of Urinary Tract Infections via Bacterial Nuclease Activity. Molecular Therapy. 25 (6), 1353-1362 (2017).
- Kannan, N., Eaves, C. J. Tipping the balance: MTDH-SND1 curbs oncogene-induced apoptosis and promotes tumorigenesis. Cell Stem Cell. 15 (2), 118-120 (2014).
- Kemmer, T. P., Malfertheiner, P., Buchler, M., Kemmer, M. L., Ditschuneit, H. Serum ribonuclease activity in the diagnosis of pancreatic disease. International Journal of Pancreatology. 8 (1), 23-33 (1991).
- Fernandez-Salas, E., Peracaula, R., Frazier, M. L., de Llorens, R. Ribonucleases expressed by human pancreatic adenocarcinoma cell lines. European Journal of Biochemistry. 267 (5), 1484-1494 (2000).
- Fujibayashi, K., et al. Serum deoxyribonuclease I activity can be a useful diagnostic marker for the early diagnosis of unstable angina pectoris or non-ST-segment elevation myocardial infarction. Journal of Cardiology. 59 (3), 258-265 (2012).
- Kawai, Y., et al. Diagnostic use of serum deoxyribonuclease I activity as a novel early-phase marker in acute myocardial infarction. Circulation. 109 (20), 2398-2400 (2004).
- Hernandez, L. I., Ozalp, V. C., Hernandez, F. J. Nuclease activity as a specific biomarker for breast cancer. Chemical Communication (Cambridge). 52 (83), 12346-12349 (2016).
- Machado, I., et al. Rapid and specific detection of Salmonella infections using chemically modified nucleic acid probes. Analytica Chimica Acta. 1054, 157-166 (2019).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiment. (63), e3064 (2012).
- Worthington Biochemical Corporation. . Manual of Clinical Enzyme Measurements. , (1972).
- Burghardt, E. L., et al. Rapid, Culture-Free Detection of Staphylococcus aureus Bacteremia. PLoS One. 11 (6), 0157234 (2016).
- Bibette, J. Gaining confidence in high-throughput screening. Proceedings of the National Academy of Science U. S. A. 109 (3), 649-650 (2012).
- Hernandez, L. I., Machado, I., Schafer, T., Hernandez, F. J. Aptamers overview: selection, features and applications. Current Topics in Medicinal Chemistry. 15 (12), 1066-1081 (2015).
- Pande, J., Szewczyk, M. M., Grover, A. K. Phage display: concept, innovations, applications and future. Biotechnology Advances. 28 (6), 849-858 (2010).
- Skerra, A. Alternative binding proteins: anticalins - harnessing the structural plasticity of the lipocalin ligand pocket to engineer novel binding activities. FEBS Journal. 275 (11), 2677-2683 (2008).
- Ku, T. H., et al. Nucleic Acid Aptamers: An Emerging Tool for Biotechnology and Biomedical Sensing. Sensors (Basel). 15 (7), 16281-16313 (2015).
- Jayasena, S. D. Aptamers: an emerging class of molecules that rival antibodies in diagnostics. Clinical Chemistry. 45 (9), 1628-1650 (1999).
- Gray, B. P., Brown, K. C. Combinatorial peptide libraries: mining for cell-binding peptides. Chemical Reviews. 114 (2), 1020-1081 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved