Method Article
تشريح والثقافة وتحليل خلايا الجمجمة العصبية الابتدائية من الماوس لدراسة الخلية كريست العصبية الترقيم والهجرة
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول تشريح وثقافة خلايا الجمجمة العصبية القحفيه من نماذج الفئران ، وذلك في المقام الأول لدراسة هجره الخلايا. نحن وصف تقنيات التصوير الحية المستخدمة وتحليل التغيرات السرعة وشكل الخلية.
Abstract
علي مدي العقود العديدة الماضية كان هناك زيادة توافر نماذج الفئران المعدلة وراثيا المستخدمة لتقليد الامراض البشرية. ومع ذلك ، فان القدرة علي دراسة حركات الخلايا والتمايز في الجسم المجري لا تزال صعبه للغاية. الاعتلال العصبي ، أو اضطرابات السلالة كريست العصبية ، هي تحديا خاصا للدراسة بسبب عدم امكانيه الوصول إلى المراحل الجنينية الرئيسية والصعوبات في فصل من القمه العصبية mesسبي لي من المتاخمة الجلدية الوسطي. هنا ، ونحن المنصوص عليها لإنشاء بروتوكول محدده جيدا ، والروتينية للثقافة الاوليه الخلايا العصبية الجمجمة كريست. في نهجنا ونحن تشريح الماوس الحدود لوحه العصبية خلال الاوليه العصبية قمة مرحله الاستقراء. المنطقة الحدودية للوحه العصبية يتم شرحها واستزراعها. تتشكل خلايا القمه العصبية في ورقه الظهاريه المحيطة بحدود الصفيحة العصبية ، وبحلول 24 ساعة بعد الشرح ، تبدا في الفصل بين المراحل الانتقالية (EMT) لتصبح خلايا كريست العصبية بالبالكامل. ونظرا لنهجنا الثنائي الابعاد ، فانه يمكن تمييز مجموعات الانسجه المتميزة (الصفيحة العصبية مقابل القمه العصبية البرية والمهاجرة) بسهوله. باستخدام نهج التصوير الحي ، يمكننا بعد ذلك تحديد التغييرات في الاستقراء كريست العصبية ، EMT والسلوكيات المهاجرة. سيكون الجمع بين هذه التقنية مع المسوخ الوراثية نهجا قويا جدا لفهم البيولوجيا خليه كريست العصبية العادية والمرضية.
Introduction
السلالة العصبية كريست (NC) هو السكان عابره ومتعددة القوية والمهاجرة من الخلايا التي تظهر حصرا في الفقاريات خلال النمو الجنيني المبكر1,2. المشتقات كريست العصبية هي متنوعة للغاية ، وتشمل الخلايا غير المحببة ، والعضلات الملساء ، والخلايا الصباغية ، والخلايا العصبية وعظم الوجه الجمجمة والغضروف3،4. لان القمه العصبية تساهم في وظيفة العديد من أنظمه الأعضاء ، هذا النسب ضروري لتولد الاجنه البشرية. الشاذة NC التنمية متورط في مجموعه واسعه من العيوب الخلقية البشرية الأكثر شيوعا (اي ، الشفة المشقوقة والحنك)5، وأيضا اضطرابات مثل مرض هيرشسبرونغ (hscr) ، متلازمة وارنسبرغ (WS) ، متلازمة تهمه ومتلازمة ويليامز6 و7و8و9.
وقد تم استكشاف التنمية NC في عدد من النظم النموذجية غير الثدييات بما في ذلك xenopus, الفرخ ونماذج الزرد. في الثدييات, وقد حددت العمل في نماذج الفئران بعض الاحداث الوراثية الرئيسية الكامنة وراء تنميه كريست العصبية; ومع ذلك ، كان من الصعب متابعه بيولوجيا الخلية من الهجرة كريست العصبية ، وذلك بسبب عدم الوصول إلى الجنين الفار (استعرض في مكان آخر10،11). وعلاوة علي ذلك ، في حين ان الدراسات في الفرخ ، xenopus و الزرد إنشات شبكه الجينات التنظيمية NC ، فقدان الدراسات وظيفة في هذه النماذج الحيوانية في بعض الأحيان لا يحمل النمط الظاهري للمقارنة في الماوس. علي سبيل المثال ، في xenopus ، الزرد والفرخ ، والإشارات غير المتعارف عليها wnt هي واحده من أليات الخلوية التي تسمح NC للحصول علي قدرتها الهجرة12،13،14،15 . ومع ذلك ، في الماوس ، فقدان الإشارات Wnt غير المتعارف عليه لا يبدو ان تؤثر علي الهجرة16. كما هو الحال في NC الهجرة كان من الصعب تتبع لفترات طويلة في الماوس ، فمن غير الواضح ما إذا كانت هذه الأنواع-الاختلافات تعكس أنماط مختلفه من الهجرة ، أو الاختلافات في التنظيم الجزيئي.
كما لوحظ ، كانت دراسات NC في الماوس تحديا كبيرا لان ثقافة الاجنه السابقة للجنين شاقه. وعلاوة علي ذلك ، فان NC باستمرار في اتصال حميم مع الانسجه المجاورة مثل الأديم الوسطي و نيوريتوديرم. الاستخدام الأخير للسائقين Cre العصبية الخاصة كريست أو الاصباغ الخارجية قد سمح لنا لفلوريسسينتلي تسميه NC المهاجرة; ومع ذلك ، لا تزال هذه النهج محدوده. علي الرغم من تقارير متعددة تصف تقنيات مختلفه لتصور الهجرة NC17,18, وقد كان من الصعب حل هذه التقنيات في اجراء بسيط وروتيني.
ومن الواضح ان هناك حاجه إلى التقنيات التي تسمح بالتعامل مع وتوصيف NC الثدييات. ركزنا جهودنا علي الماوس الجمجمة NC كما هو النموذج الأساسي لدراسة التنمية البشرية القحف الوجه والأعصاب. قمنا بصقل نهجنا استنادا إلى عده تقارير مثيره للاهتمام تصف الثقافة الاساسيه للخلايا NC19،20،21. هنا ، ونحن تصف بدقه تقنيات الثقافة المثلي لاكسبلانتينج خلايا NC الاساسيه. ونحن نظهر طريقه التصوير الخلوي الحي والاستخدام الأمثل لمصفوفات مختلفه لطلاء لوحات الثقافة. بروتوكولنا يصف كيفيه التقاط الهجرة من الخلايا NC الحية باستخدام المجهر المقلوب ، والذي يهدف كمبدا توجيهي للاستخدام مع المجاهر الأخرى ، فضلا عن ملخص مفصل للتحليلات الخلوية لدينا.
يجب ان تكون النتيجة المتوقعة من الشرح الواضح توزيع الخلايا التي تتميز بوضوح تحت المجهر ، حيث يمكن للمرء ان يري ثلاثه من السكان مختلفه من الخلايا التي تمثل ' 1 ' الصفيحة العصبية ، ' 2 ' الهجرة المسبقة ، و ، ' 3 ' خلايا كريست العصبية المهاجرة. ونحن نظهر كيفيه تحليل سلوكيات الخلية علي الحدود بين السكان السابقين للهجرة من الخلايا خلال الانتقال الظهاريه-المستوي. كما ركزنا جهودنا علي دراسة الخلايا المهاجرة بالبالكامل لسرعه الخلية والمسافة وشكل الخلية.
Protocol
وقد خضع جميع الاعمال الحيوانية الموافقة الاخلاقيه من قبل "الملك" كليه لندن الاخلاقيه مراجعه العملية وأجريت وفقا لP8D5E2773 المملكة العربية البريطانية ترخيص مشروع المكتب الرئيسي (KJL).
1. اعداد الكواشف
- اعداد الحلول والاداات العامة بما في ذلك المحلول الملحي المعقم للفوسفات العقيم ، 70% الايثانول ، أدوات التشريح (ملقط وشفرات التشريح أو الابر المعقمة) ، لوحات بلاستيكية أو شرائح زجاجيه مغلفه بمصفوفة خارج الخلية متاحه تجاريا ( ECM) القائم علي هيدروجيل أو الفيبرونكتين (انظر جدول المواد) ، ووسائل الاعلام العصبية كريست (انظر أدناه).
- 100 55 0.1 4500 الوحدات/مل البنسلين ، 100 وحدات/ستربتومايسين مل ، و 2 مم L-الجلوتامين.
- شرط الوسائط بين عشيه وضحيها باستخدام النمو-تثبيط الخلايا المغذية STO21.
- اعداد الخلايا STO (انظر جدول المواد) وسائل الاعلام لاحتواء dmem تستكمل بنسبه 10 ٪ و100 u/ml البنسلين ، 100 u/ml ستربتومايسين. تنمو وتوسع الخلايا STO إلى التقاء في 25 سم2 قوارير المغلفة مع 0.1 ٪ الجيلاتين. تطبيق 5000 راد من إشعاع جاما.
- البذور ما يقرب من 3 × 106 النمو الخلايا التي تحولت إلى 10 سم2 صحن أو 25 سم2 قارورة (من الخطوة 1.2.1.1). أضافه ما يقرب من 10-12 مل من العصبية كريست القاعدية المتوسطة واحتضان بين عشيه وضحيها.
ملاحظه: يمكن استخدام الخلايا المصنفة لإنتاج متوسط مشروط لمده تصل إلى 10 أيام. التحقق من ظهور الخلايا بانتظام
- تصفيه المتوسطة (0.22 μm حجم المسام) ، وتكمله مع 25 نانوغرام/مل عامل نمو الخلايا الليفية الاساسيه (bFGF) و 1000 U من عامل مثبطات ابيضاض الدم (ليف).
ملاحظه: يخزن عند درجه حرارة 4 درجات مئوية ويستخدم خلال شهر أو يخزن عند-20 درجه مئوية ويستخدم في غضون 3 أشهر.
- شرط الوسائط بين عشيه وضحيها باستخدام النمو-تثبيط الخلايا المغذية STO21.
- معطف الانسجه ثقافة الأسطح مع مصفوفة خارج الخلية.
ملاحظه: اعتمادا علي المسالة البيولوجية التي يتم طرحها ، يمكن ان تكون مغلفه المصفوفة علي الاطباق الثقافية القاع الزجاج ، والاطباق البلاستيكية ثقافة الانسجه أو كشوف الغطاء الزجاجي. انظر أدناه لاختلاف المحتويات الهيدروجيل القائم علي ECM تعتمد علي الركيزة مصفوفة. وقد تم اختبار فيبروكتين علي الاطباق الزجاجية القاع وتغطيه ينزلق فقط في تركيزات المحددة أدناه. هنا علي ، وسوف نشير إلى الأسطح المغلفة الركيزة باسم "لوحات المغلفة".- معطف الأسطح ثقافة الانسجه مع القائم علي المحتوي هيدروجيل.
ملاحظه: الحفاظ علي الركيزة الباردة حتى الطلاء ، اما عن طريق تبريد وسائل الاعلام أو الحفاظ علي الجليد.- ذوبان هيدروجيل في 4 درجه مئوية بين عشيه وضحيها. أضافه 5 مل من 10 ٪ في DMEM إلى 5 مل من هيدروجيل لحجم النهائي من 10 مل (انظر جدول المواد).
- جعل 0.5-1 مل قسامات كما مريحه وتخزين في-20 درجه مئوية.
- أذابه الجليد الهيدروجيل علي الثلج.
- استخدام 1:20 التخفيف من الأسهم هيدروجيل لمعطف من البلاستيك.
- استخدام 1:5 التخفيف من الأسهم هيدروجيل لمعطف الشرائح الزجاجية والزجاج القاع لوحات ثقافة الانسجه.
ملاحظه: تمييع هيدروجيل في dmem الباردة . - تطبيق ما يكفي من هيدروجيل المخفف لتغطيه المنطقة المطلوبة علي لوحات/الشرائح واحتضان لمده 30-45 دقيقه في 37 درجه مئوية.
- استخدام لوحات المغلفة/الشرائح علي الفور أو تخزين الشرائح المغلفة في 4 °C بين عشيه وضحيها.
- أزاله التجاوزات وشطف الشرائح مع الجلوكوز عاليه DMEM (اختياري) قبل الاستخدام.
- معطف الانسجه ثقافة السطوح مع الفيبرونكتين.
- جعل قسامات من 1 مغ/مل الفيبرونكتين جنيني الأسهم حل وتخزين في-80 درجه مئوية. تمييع الفيبرونكتين مع التلفزيونية دولبيكو (dPBS) إلى تركيز نهائي من 1 ميكروغرام/مل.
- تطبيق الفيبرونكتين جنيني كافيه لتغطيه المنطقة المطلوبة واحتضان في درجه حرارة الغرفة لمده 15 دقيقه.
- أزاله الفيبروكتين المتبقية والسماح للزجاج لتجف لمده 30-45 دقيقه.
- شطف الآبار أو تغطيه زلات مع الجلوكوز عاليه DMEM (اختياري) قبل الاستخدام.
- معطف الأسطح ثقافة الانسجه مع القائم علي المحتوي هيدروجيل.
2. اليوم 1: تشريح الاجنه المرحلة المبكرة الجسيده
ملاحظه: استخدام أدوات معقمه وحلول معقمه. إذا كانت هناك حاجه إلى التنميط الجيني ، وجمع الجسم من الجنين لاستخراج الحمض النووي.
- ويقتصر تشريح الصفيحة العصبية القحفيه علي الاجنه في أيام ال8.5 التالية. حدد الاجنه في مرحله 5 – 8 الجسيده. تشريح الرحم في الاذاعه التلفزيونية وقطع الغشاء المسماري لفصل كل جنين (الشكل 1A). الجدار العضلي للعقود الرحم والانسجه الساقطيه سوف تصبح مرئية (الشكل 1b).
ملاحظه: الحفاظ علي الاجنه في الرحم في الجليد الباردة في حين يتم اجراء التفكيك جنين واحد في كل مره. انقل الاجنه بماصه زجاجيه إلى الصورة المعقمة الجديدة لتحسين الرؤية وتقليل التلوث. - الشريحة ملقط بين طبقه العضلات والانسجه الساقطيه وأزاله طبقه العضلات مع زوج ثان من ملقط (الشكل 1c).
- باستخدام ملقط ، يخترق الديسيدووم علي حواف القطب المسميميتريال ومع زوج ثان من ملقط المسيل للدموع لفتح عموديا إلى القطب.
- قشر الظهر الانسجه الساقطيه مع ملقط لتصور غشاء ريشرت.
- أزاله غشاء ريشرت بعناية. يصبح كيس صفار الأحشاء مرئيا ويمكن رؤية الجنين في الداخل (الشكل 1d).
- أزاله كيس صفار الأحشاء والرحم (الشكل 1E) ووضع الجنين من أجل تصور اضعاف الراس (الشكل 1e).
- قطع الراس اضعاف فوق القلب وكشط بعيدا الأديم الوسطي الكامنة باستخدام ملقط و/أو أدوات رمش للحصول علي لوحه العصبية نظيفه (NP) (الشكل 1H).
ملاحظه: يمكن الحفاظ علي NP كامله أو تقسيمها إلى أسفل محور انتيبيوستيريور بحيث يمكن ان يكون كل جانب مطلي بشكل فردي. ويمكن خفض الحدود لوحه العصبية بعيدا عن الصفيحة العصبية من أجل تقليل مساهمات الخلايا العصبية لشرح. - استخدم الماصة الزجاجية لنقل الصفيحة العصبية التي تم تشريحها إلى طبق مغلف بالهيدروجيل مليء بوسائل الاعلام العصبية المكيفة.
- دوامه بلطف الطبق لوضع NP في منتصف البئر. وهذا مهم لتعظيم جوده المرحلة للتصوير الخلوي الحي (في اليوم الثاني).
- احتضان بين عشيه وضحيها (أو إلى الوقت المطلوب نقطه) في 37 درجه مئوية في 5 ٪ CO2. يجب ان تكون خلايا القمه العصبية تهاجر بشكل واضح من الصفيحة العصبية.
ملاحظه: عاده ما يتم إرفاق الخلايا في غضون 6 – 8 ساعات. بعد إرفاق شرح ، والسماح لمزيد من الوقت لتصور الخلايا المهاجرة. عاده من قبل 24 ساعة بعد الشرح ، يمكننا ان نجد ثلاثه من السكان مميزه من الخلايا. السكان اولي, في المركز من ال [اكسبلونت], الصفيحة عصبيه ([نب]). يحيط السكان الثاني ، وهو NC المهاجر (الشرطة الكونغولية) ، NP في ورقه الظهاريه من الخلايا. يتم تشكيل السكان الثالث ، في الحلبة الخارجية ، من NC المهاجرة (mNC) ، والتي هي أكبر في الحجم ، وتظهر بالبالكامل المسمارية (الشكل 2).
3-اليوم الثاني: التصوير الخلوي الحي لخلايا كريست العصبية القحفيه
ملاحظه: يجب ان يتم التصوير في 24 ساعة بعد اكسبلانتينج للصورة علي الشكل الأمثل وقياس هجره الخلايا كريست العصبية. لا تحتاج وسائل الاعلام التعريفي NC ليتم تحديثها قبل التصوير الخلية الحية. مطلوب الوصول إلى المجهر المقلوب ، مع مرحله الميكانيكية وغرفه البيئة المدمجة. استخدام اطباق ثقافة الانسجه المتعددة الآبار المناسبة للتصوير (جدول المواد).
-
المجهر الاعداد
- تعيين غرفه البيئة في 37 درجه مئوية و 5 ٪ CO2.
- بيرس ثقب في غطاء غطاء لوحه ثقافة الانسجه للسماح لل CO2 ابره ، متصلا المشترك2 غرفه الترطيب ، للجلوس داخل لوحه.
- وضع الطبق الثقافة الانسجه في حامل العينة والشريط أسفل غطاء لوحه و CO2 ابره لمنع الاهتزاز اثناء الاستحواذ متعددة الآبار.
- التبديل علي وحده تحكم المجهر ، وحده تحكم المرحلة وبرنامج التصوير.
- التركيز علي خلايا NC الجمجمة في التكبير 10x (مع حلقه مرحله مطابقه في المكثف المحدد).
- تعيين عاليه الجودة المرحلة التباين علي المجهر عن طريق ضبط الحجاب الحاجز قزحية المجال ، الفتحة قزحية الحجاب الحاجز وتوسيط التلسكوب ، كما هو محدد في دليل اعداد المجهر.
-
تصوير الخلايا الحية علي النقيض من المرحلة
- تعيين موقع الدليل أو الملف حيث سيتم حفظ ملفات الفاصل الزمني.
- اضبط وقت التعريض ، والتسلق ، ومنطقه الكاميرا.
- تعيين عدد النقاط الزمنيه ومده التصوير والفاصل الزمني بين الإطارات.
- لقياس القدرة المهاجرة NC الخلية ، تعيين المجهر إلى التكبير 10x ، مع 1 اطار كل 5 دقائق (217 نقاط الوقت أكثر من 18 ساعة). لقياس شكل الخلية ، قم بتعيين التكبير إلى 40x ، مع الأخذ 1 اطار/دقيقه (61 نقطه زمنيه أكثر من 1 ساعة). لقياس ديناميات lamellipodial ، تعيين التكبير إلى 40x أو 60x التكبير ، مع 1 اطار كل 10 s (أكثر من 10 دقيقه).
- للتصوير متعدد الآبار ، اضبط المرحلة الميكانيكية للتنقل بين مواضع الاهتمام المحددة من XY. تاكد من ان خلايا NC الجمجمة في التركيز ومواضع المرحلة صحيحه.
- استخدم الأمر اكتساب لبدء التصوير بفواصل زمنيه.
- بمجرد اكتمال التصوير بالفواصل الزمنيه ، راجع البيانات متعددة الابعاد وملفات التصدير. stk للتحليل.
ملاحظه:. stk هو ملف مكدس TIFF. - إنهاء البرنامج ، وإيقاف تشغيل الكمبيوتر وإيقاف المرحلة ، والكاميرا والمجهر وحدات تحكم.
4. تحليل التصوير: القياس الكمي لهجره الخلايا كريست العصبية
ملاحظه: لتحديد أفضل السلوكيات الخلوية التي أظهرتها الهجرة murine الخلايا كريست العصبية الجمجمة ، قمنا بتحليل سلسله من المعلمات الهجرة كميا ، مع التركيز علي وجه التحديد علي القدرة علي الهجرة وديناميات شكل الخلية. (1) الهجرة (المسافة المتراكمة) هي الطول الكلي للمسار الذي تسلكه الخلية (ميكرومتر) ؛ (2) الهجرة (المسافة الاقليديه) هي مسافة الخط المستقيم بين الوضع الاولي والنهائي للخلية (ميكرومتر) ؛ (3) الهجرة (سرعه الخلية) هو المسافة التي تقطعها الخلية لكل وحده من الوقت (μm/دقيقه) ؛ (4) شكل الخلية (منطقه الخلية) هو السطح الإجمالي التي تغطيها الخلية. تعيين بكسل إلى مقياس ميكرون وفقا لمجهر التصوير. (A = px x n px ، حيثpx = منطقه بكسل و npx = عدد البيكسلات. الوحدات: ميكرومتر2; (5) شكل الخلية (دوران الخلية) هو انحراف شكل الخلية من دائره الكمال الذي يشار اليه بقيمه دائريه من 1.0 (4Π (a/P2)) حيث a = المنطقة و P = محيط.
-
تتبع خليه واحده
ملاحظه: لقياس ترحيل الخلايا NC ، يتم إنشاء إحداثيات XY للخلايا الفردية عبر كافة إطارات الفاصل الزمني. ويسمح ذلك باجراء تحليل لاحق لقياسات المسافة والسرعة والثبات لهجره الخلايا.- افتح ImageJ واستيراد البيانات كملفات مكدس TIFF.
- انقر علي تحليل | تعيين مقياس لمعايره الملفات. stk وفقا لإعدادات المجهر ، والعمل في بكسل/μm.
- انقر فوق الإضافات | التتبع | تتبع دليل لفتح صوره J دليل تتبع الخلية المساعد. لبدء تتبع الخلية ، حدد أضافه مسار.
- تتبع الخلايا من خلال جميع الإطارات من الأفلام الفاصلة الزمنيه ، وذلك باستخدام النواة كنقطه مرجعيه.
ملاحظه: يجب ان يتم تعقب 10-20 خليه لكل شرح ، مع إجمالي 60 خليه تتبع (ن = 3). وينبغي استبعاد الخلايا التي تخضع لانقسام الخلايا خلال فتره الفاصل الزمني من التحليل. - حفظ وتصدير النتائج كملف .csv. تمثل النتائج رقم مسار الخلية الفردية ورقم الشريحة وإحداثيات XY علي جميع الإطارات.
-
الكمية من الخلايا العصبية كريست القدرة علي الهجرة
- فتح البيانات تتبع خليه واحده (انظر أعلاه). تحويل ملفات .csv إلى تنسيق ملف .txt.
- افتح برنامج الترحيل ( جدول المواد). انقر فوق علامة التبويب استيراد البيانات لاستيراد بيانات تعقب الخلية كملف .txt.
- ضمن مجموعات البيانات | التهيئة، حدد عدد الشرائح أو الإطارات التي سيتم تحليلها واضبط معايره XY والفاصل الزمني بين الإطارات. حدد تطبيق الإعدادات لحفظ الإعدادات.
- حدد رمز بيانات الرسم لتشكيل مخططات مسار. حدد رمز الإحصائيات لتحديد قياسات المسافة والسرعة.
- احفظ مخططات المسار كملفات الصورة النقطية (bmp.) ومقاييس المسافة والسرعة كملفات .txt. حدد أزاله رمز البيانات . كرر لملفات الفاصل الزمني الأخرى.
ملاحظه: يمكن استخدام مخططات المسار لتصور المباشرة لمسارات الخلايا الفردية لحاله خليه معينه أو حاله علي مدي الأفلام الفاصلة الزمنيه (الشكل 4A). ويمكن بعد ذلك استخدام بيانات المسافة والسرعة المخزنة في ملفات .txt لمزيد من التحليل.
-
القياس الكمي لمنطقه الخلايا كريست العصبية والدوران
- فتح ملفات stk الفاصلة الزمنيه في ImageJ ومعايره وفقا لإعدادات المجهر ، والعمل في بكسل/μm.
- تحت التحليل | تعيين القياسات، انقر لتحديد معلمات شكل الخلية: منطقه الخلية والمحيط وواصف الشكل.
- استخدم أداه تحديد اليد الحرة لرسم يدويا حول كل خليه ، وذلك باستخدام حدود غشاء الخلية كدليل.
- اضغط Ctrl + B مفاتيح علي لوحه المفاتيح للحفاظ علي المخطط التفصيلي للخلية أستعص علي الصورة. كرر للخلايا علي كل اطار الفاصل الزمني.
- استخدام الصورة | التراكب | إلى مدير ROI لتخزين القيم.
- بمجرد ان يتم تحديد كافة خلايا الفائدة لكل اطار ، انقر فوق قياس. حفظ النتائج كملف .csv.
ملاحظه: 10 – 20 الخلايا لكل فيلم يجب ان تكون مبينه ، مع ما مجموعه 30-60 خلايا تحليلها لكل حاله (ن = 3). يمكن استخدام بيانات شكل الخلية (ملفات .csv) لتحديد كيفيه تغير ديناميات شكل الخلية بمرور الوقت (الشكل 4C) أو كيف يمكن تغيير التشكل تحت العلاجات الخلوية المختلفة.
النتائج
وباستخدام الاجراء الموضح هنا ، تم تشريح أجنه الفئران من الرحم ، وأزيلت الانسجه غير الجنينية (الشكل 1ا – د). وكانت الاجنه التي يتم تنظيمها (باستخدام الاجنه فقط في 5-8 الجسيده (ss) ، الشكل 1ه ، و). ثم تم تشريح الصفيحة العصبية القحفيه وتم عزل ظهاره الأعصاب. وقد نحيت الخلايا المتوسطة الجلد ، التي تم التعرف عليها بالخلايا السائبة والدائرية والوسطي ، برفق (الشكل 1G-L). الصفيحة العصبية الاماميه يمكن تفسيرها بالبالكامل ، وفي هذه الحالة ستظهر انسجه القمه العصبية أفقيا ستتوسع بشكل شعاعي حول المفسر ، أو يمكن شرح كل حدود اللوحة العصبية (يمينا ويسارا) علي حده. وهذا مفيد بشكل خاص عندما اكسبلانتينج من المسوخ الوراثية.
في غضون 24 ساعة ، يمكن بوضوح ان ينظر إلى منطقه من البرية (الظهاريه) الجمجمة العصبية كريست المحيطة المفسر لوحه العصبية (الشكل 2B). وعلاوة علي ذلك ، خضعت الفئات الفرعية من خلايا القمه العصبية الظهاريه للانتقال المسسبي وتظهر بالبالكامل (الشكل 2). التالي ، لدينا عده حلقات مركزه من خلايا متميزة ، مع الصفيحة العصبية (NP) في الوسط ، والقمه العصبية السابقة للهجرة (الشرطة الكونغولية) في الدائرة المتوسطة ، والسكان من كريست العصبية المهاجرة (mNC) في حلقه خارجيه (الشكل 2B). من أجل تتبع خلايا NC ، فمن الممكن استخدام نماذج الماوس المعدلة وراثيا كما نظهر في الشكل 2C. في هذه الحالة ، وقد استخدمنا كريست العصبية محدده Wnt1:: Cre ؛ روزاMtmg التي ينتج عنها خلايا NC المسمية باللون الأخضر. في هذه الفئران ، والخلايا التعبير عن الطماطم غشاء (mT ، باللون الأحمر) الا إذا كانوا يعبرون عن Cre للالطبيعيه. أعاده الجمع يؤدي إلى خلايا التعبير عن غشاء البروتين الفلوري الأخضر (GFP ، باللون الأخضر). الخلايا الحمراء التي تظهر في مركز الشرح هي خلايا الصفيحة العصبية. بعض خلايا الصفيحة العصبية الظهرية أيضا التعبير عن GFP; للثقافة علي المدى الطويل ، فاننا المكوس كل من الخلايا في المركز. لأغراضنا ، ونقاء المفسر كافيه لتتبع السكان الخلايا كريست العصبية المختلفة. حيث نقاء اعلي من القمه العصبية من الضروري ، ويمكن الجمع بين هذه الاستراتيجية التسمية الوراثية مع الفرز الخلايا المنشطة الفلورسنت (FACS) لضمان نقاء السكان. بدلا من ذلك ، فمن الممكن لإصلاح الشرح وتحديد السكان NC مع وضع العلامات الأجسام المضادة.
وكان واضحا أيضا من قبل 24 ح ان الحلقات المميزة المتمركزة بين خلايا NC المهاجرة والمهاجرة الكاملة للثقافات المفسرة لا تعتمد ولا تحكمها مصفوفة الاختيار (الشكل 3). الثقافات التوضيحية مطلي علي كل من هيدروجيل القائم علي ECM و الفيبرونكتين جنيني شكلت هياكل الشرح مماثله ، والتي تتالف من ثلاثه من السكان الخلية ، NP ، الشرطة المحلية الكونغولية و mnc (الشكل 3ا ، ج). وكانت المورفولوجية العصبية للخلايا البارزة أيضا قابله للمقارنة بين تلك المطلية علي هيدروجيل القائم علي ECM و الفيبرونكتين جنيني (الشكل 3ب ، د). ومع ذلك ، الشرح مطلي علي الفيبرونكتين جنيني أنتجت الخلايا مع lamellipodia أكثر بروزا في الخلية الرائدة الحافة ، علي ما يبدو أكثر استقطابا في اتجاه الهجرة (الشكل 3ب ، د).
مره واحده من سكان خلايا كريست العصبية المهاجرة واضحة ، يمكن الانتهاء من التصوير الخلوي الحية. يتم تعيين المجهر الفاصل الزمني إلى التكبير 10x (18 ساعة ، 1 الإطار/5 دقيقه) للتحليل اللاحق للهجرة خليه NC (الشكل 4A). ImageJ دليل تتبع المكونات في يولد إحداثيات XY من الخلايا الفردية علي جميع الإطارات من الأفلام الفاصلة الزمنيه (الشكل 4B). يمكن معالجه هذه الإحداثيات باستخدام برنامج الترحيل. هذا البرنامج يتيح التصور من المسارات الخلية الفردية مع مرور الوقت (الشكل 4B) ويمكن استخدامها لقياس المسافة المتراكمة والاقليديه ، فضلا عن سرعه الخلية.
وتوفر بيانات التصوير بالفواصل الزمنيه أيضا ثروة من المعلومات عن تشكل الخلايا اثناء هجره خلايا كريست العصبية القحفيه (الشكل 4 ج). من خلال تحديد اغشيه الخلايا الفردية ، يمكن حساب منطقه الخلية وقياسات المحيط من جميع إطارات الأفلام (الشكل 4C). وتسمح هذه القياسات بالتحديد الكمي اللاحق لمساحة الخلية والدوران (الشكل 4 د). يظهر الشكل 4C تحليلا لتغيرات شكل الخلية علي مدي 18 ساعة. لاحظ انه كخلايا تهاجر بعيدا عن الشرح ، منطقه الخلية يزيد بشكل كبير بينما الخلية الدوران يبقي ثابت نسبيا (ANOVA في اتجاه واحد ، tukey المقارنات المتعددة اختبار) ( الشكل 4 هاء،و). وهذا يشير إلى انه كما تغادر الخلايا من الحافة الظهاريه وتفقد جات الاتصال خليه الخلية ، فانها تظهر زيادة مساحة الخلية انتشار. لم تتغير إجراءات دوران الخلايا بشكل كبير مع مرور الوقت; غير انه يمكن النظر إلى التغيرات القصيرة الأجل في الدوران إذا ما تم تحديد عدد متزايد من النقاط الزمنيه. ويمكن أيضا ان توفر تدابير تدوير الخلايا بيانات مثيره للاهتمام بشان ديناميات شكل الخلية في وجود جديلة كيميائية أو في ظل ظروف محصورة.
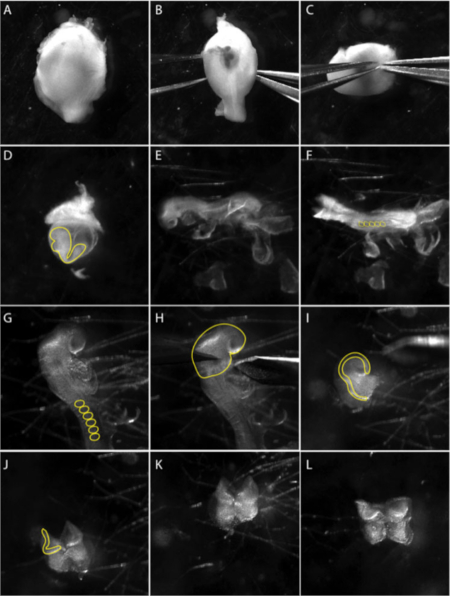
الشكل 1: عزل من الجمجمة العصبية القحفيه من جنين e 8.5.
الصور هي لقطات من فيديو يوثق تقنيه التشريح المجهري. (الف – جيم) تشريح الجنين من الرحم. (ب-ج) باستخدام اثنين من ملقط حاد ، وسحب بلطف بعيدا عن الطبقة العضلية. لوحه (D) يظهر الجنين داخل كيس صفار الأحشاء (الخط الأصفر). استخراج الجنين من كيس صفار الأحشاء. (ه) الآراء الجانبية للجنين في المرحلة 8.5 الجانبية. (F) الرؤية الظهرية للجنين في المرحلة 8.5. العد التنازلي (ss) لتحديد سن الاجنه ؛ عاده 5 – 8 ss (الدوائر الصفراء في F). (ز) نظره عن قرب في منطقه الجمجمة من الجنين. أزاله الاغشيه خارج الجنين من منطقه الجمجمة. يتم وضع علامة الجسيدات مع خط اصفر. (H) يتم تنفيذ الأجزاء من الصفيحة العصبية الاماميه تحت القوس الأول (الخط الأصفر). (I) المنظر الجانبي لتشريح الصفيحة العصبية الاماميه. الطيات العصبية ، حيث تنشا خلايا القمه العصبية ، وتتميز بخط اصفر. (J – L) أزاله الانسجه الجلدية الوسطي (الخلايا المسمارية الرقيقة) الكامنة وراء الطيات العصبية الاماميه قدر الإمكان قبل الطلاء NP علي الاطباق الثقافة المعدة. تم التقاط الفيلم باستخدام المجهر ستيريو مع عدسه ويديفيلد تعدد في 3.0 X التكبير (انظر جدول المواد). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
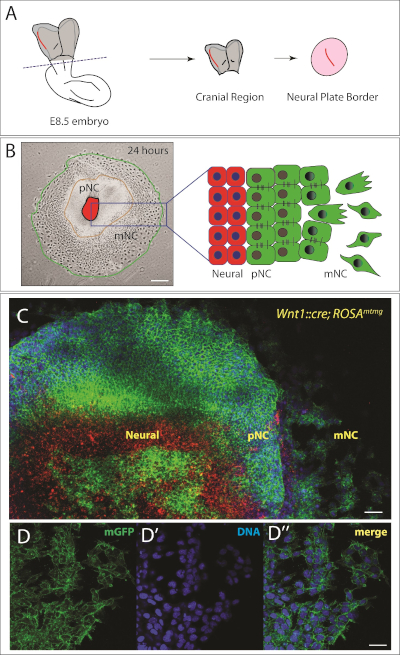
الشكل 2: الجمجمة العصبية للمونين
(ا) التمثيل التخطيطي للراي الظهري لجنين الفاره e 8.5. يتم قطع منطقه الجمجمة من الجنين في خط متقطع. يتم عزل حدود الصفيحة العصبية (التي تم تمييزها باللون الأحمر) من انسجه الأديم الوسطي المحيطة والمستزرعة لمده 24 ساعة للسماح للقمه العصبية القحفيه بالهجرة. تخطيطيه يكيف من22,23. (ب) اليسار: صوره الحقل الساطع التمثيلي لكريست العصبية القحفيه بعد 24 ساعة من الطلاء. لوحظت ثلاثه السكان من الخلايا ، والتي هي أيضا المخطط علي اليمين. NP = الصفيحة العصبية ، الشرطة الكونغولية = قمة العصبية قبل الهجرة و mNC = كريست العصبية المهاجرة. شريط مقياس = 250 μm. (ج) صور تكبير اعلي لمفسر من الماوس المسمي وراثيا (Wnt1:: cre ؛ روزاMtmg). الخلايا دون سائق Cre التعبير عن الطماطم غشاء (mT) باللون الأحمر. التعبير عن Cre تحت سيطرة قمة العصبية محدده Wnt1 المروج يؤدي إلى استئصال كاسيت mT والتعبير عن غشاء GFP (mG) باللون الأخضر. وملطخه النوى مع Hoescht (باللون الأزرق). شريط مقياس = 200 μm. (d-d '''') صور تكبير اعلي للخلايا المهاجرة التي تعبر عن غشاء gfp (d). (D ') ويوصف الحمض النووي مع Hoescht (الأزرق). (D '''') دمج D و D '. شريط مقياس = 20 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
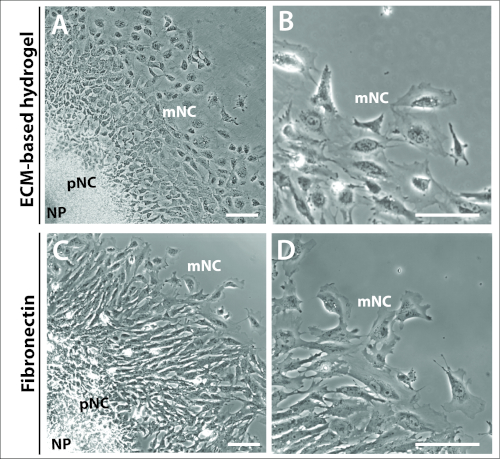
الشكل 3: الشرح المستزرع علي ركائز مختلفه.
(الف – باء) صور علي النقيض من المرحلة من الشرح مثقف علي التجارية ECM-هيدروجيل. ) جيم-دال ( الشرح مثقف علي 1 ميكروغرام/مل فيبرونكتين. يمكن تمييز الصفيحة العصبية (NP) ، والهجرة المسبقة (الشرطة الكونغولية) ، وخلايا الكريست العصبية المهاجرة (mNC) من خلال تحويرات خلاياها المختلفة. شريط مقياس = 100 μm. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
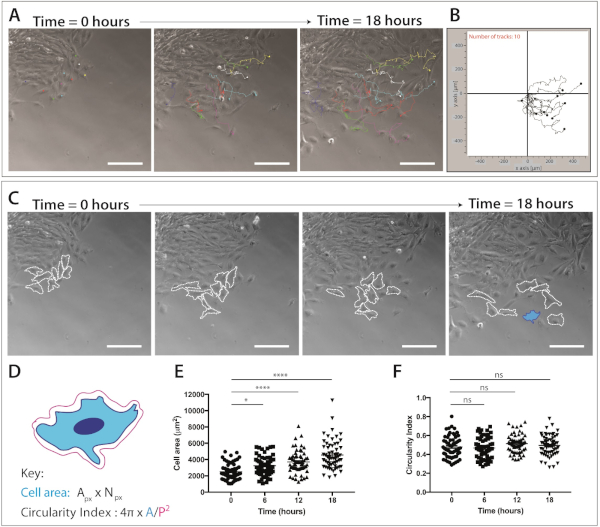
الشكل 4: القياس الكمي لهجره خلايا كريست العصبية القحفيه وديناميات شكل الخلية.
(A) إطارات المرحلة النقيض من التصوير الفاصل الزمني للثقافات الشرح مضافه مع المسارات خليه كريست العصبية واحده ، وذلك باستخدام Imagej/فيجي دليل الخلية تتبع المكونات الاضافيه. تم تعقب الخلايا mnc التمثيلية العشرة يدويا علي مدي 18 ساعة (217 إطارات) و XY تم تصدير الإحداثيات. يتم تمثيل البيانات كنقطه تراكب وقطع خطوط. وقد تم طلاء الخلايا علي 1 ميكروغرام/مل فيبرونكتين. شريط مقياس = 200 μm. (ب) مؤامرة تمثيليه من 10 خلايا mnc ، تم إنشاؤها باستخدام برامج الترحيل. (ج) أطر التباين التدريجي الماخوذه من تحليل الفواصل الزمنيه للثقافات المفسرة. خطوط متقطعه مخطط 8 المهاجرين الخلايا كريست العصبية الممثلة تحليلها لديناميات شكل الخلية عندما مطلي علي 1 ميكروغرام/مل fibronectin. شريط مقياس = 200 μm. (د) التمثيل التخطيطي للحسابات المستخدمة لقياس مساحة الخلية ودورانها. خليه شكل من التخطيطية ان من الخلية يسلط داخل [بلو] ([ك]). Apx = منطقه بكسل ، نpx = عدد بكسل ، A = المنطقة ، P = محيط (1 بكسل = 1.60772 μm2). (هاء-واو) القياس الكمي لمنطقه الخلية وإجراءات دوران الخلايا مع مرور الوقت. يمثل البيانات يعني ± SEM. كل نقطه تمثل خليه واحده (ن = 60) ، ماخوذه من 3 تجارب مستقله ، وتحليلها في 0 h ، 6 h ، 12 h و 18 h (ns غير هامه ، * p < 0.05 ، * * * * p < 0.0001 في اتجاه واحد ANOVA ، Tukey في مقارنات متعددة اختبار). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
وكانت دراسة خلايا الثدييات العصبية الثديية تحديا للعلماء بسبب طبيعة الرحم في تنميه الثدييات. في الجسم الحي الدراسات من الصعب إنشاء ، كما يجب ان يتم التلاعب الجنين في ظل الظروف التي تحاكي الحياة في الرحم. في الممارسة العملية ، يكاد يكون من المستحيل ان التكرار الثقافة هذه الاجنه (+ +) لفتره أطول من 24 ساعة ، وخاصه بالنسبة للتصوير الحي. وعلاوة علي ذلك ، تحدث الاستقراء كريست العصبية والهجرة في وقت واحد مع إغلاق الأنبوب العصبي وتحول الجنينية في الماوس. هذا هو الحدث الحيوي والمجهدة المسببة للتوتر ، والتي تفشل في كثير من الأحيان عندما يتم استزراع الاجنه السابقين الرحم. التالي ، فان معدل نجاح النهج السابقة للولادة منخفض بشكل عام. استخدام خلايا NC الخلد21 هو أداه مفيده للحد من استخدام الحيوانية ، وانها قد توفر مصدرا أفضل من خلايا كريست العصبية للتحليل علي المدى الطويل ، الانتقال ، والدراسات التخصيب. ومع ذلك ، هناك حاجه واضحة إلى ثقافة الخلايا الاوليه العصبية بشكل موثوق. طريقتنا ينطبق علي الماوس ضرب الخروج أو النماذج الجينية المشروطة. وقد وصفت طريقه مماثله لنا لغيرها من السكان كريست العصبية20; ومع ذلك ، طريقتنا يصف بدقه العزلة خطوه بخطوه من خلايا NC الجمجمة murine. كما نقوم بوصف استخدام المصفوفات المختلفة وكذلك اجراء تحليل الهجرة بالتفصيل.
ولتحقيق نتائج متسقة ، وجدنا ان اهتماما خاصا قد دفع نحو التدريج اثناء اختيار الاجنه. ليس من المستغرب ، وعدد من الجسيدات يرتبط مع مراحل مختلفه في التنمية NC الجمجمة. ولذلك ، فان معرفه تشريح الجنين مهمة جدا قبل الحصول علي اي بيانات تجريبية. ويمكن بعد ذلك تكييف هذا النهج نحو عزل السكان المنفصلين من خلايا القمه العصبية ، اعتمادا علي السؤال البيولوجي والخلايا المستهدفة.
وبمجرد اختيار الاجنه وتشريحها ، يمكن تمييز الخلايا الجلدية الوسطي بسهوله وينبغي ازالتها للسماح بتصور أفضل وللحد من التلوث. للثقافات علي المدى الطويل ، يمكن أزاله انسجه الصفيحة العصبية في 24 ساعة من الطلاء من أجل منع التلوث بالانسجه العصبية. ويمكن لمزيد من الصقل ان يكون استخدام العلامات النسب الفلورسنت (علي سبيل المثال ، باستخدام Wnt1:: cre أو Sox10:: creert السائقين جنبا إلى جنب مع الصحفيين الفلورسنت24،25) للتمييز بين الخلايا كريست العصبية من الانسجه الأخرى كما هو مبين في الشكل 2C.
وقد سلطت التقارير السابقة الضوء علي إمكانات طلاء الماوس NC الثقافات التوضيحية علي المصفوفات المختلفة ، والأكثر شيوعا علي المائية ECM التجارية ، الفيبرونكتين والكولاجين انا20,21,26. في ايدينا ، تنمو بنجاح الثقافات التوضيحية NC الماوس الجمجمة علي جميع المصفوفات الثلاثة ، في تركيزات المحددة في التقارير الاصليه (البيانات لم تظهر). النهج المكرر الاوليه التي قمنا بتكييفها لدينا الثقافات التوضيحية NC استخدام هيدروجيل التجارية كمصفوفة من الاختيار ، والتي تتالف في المقام الأول من laminin و كولاجين21(الشكل 3الف – باء). ومع ذلك ، تكوين هذا هيدروجيل ليست محدده بوضوح ، مع عامل النمو غير معروف ومحتوي البروتين. علي هذا النحو ، لدينا منذ تحولت نهجنا لطلاء الماوس NC الثقافات التوضيحية علي الفيبرونكتين جنيني (الشكل 3C – D). يتم تعريف fibronectin جيدا والتعبير عنها بشكل كبير في ECM والاغشيه السفلي علي طول الخلايا NC التي تهاجرin vivo28,29,30. لتحسين مصفوفة الفيبرونكتين التي تحاكي أفضل العصبية الهجرة الخلية كريست والمورفولوجية كما راينا باستخدام هيدروجيل ، قارننا السلوكيات الخلية NC عرضت علي هيدروجيل ضد المعايرة من 0.25-30 ميكروغرام/مل الفيبرونكتين جنيني ، وتعريف 1 ميكروغرام/مل فيبرونكتين كما توفير خصائص مثاليه (لا تظهر البيانات). ونحن نعتقد ان هذا العمل التمهيدي قد يساعد في وضع اطار للمقارنة المنهجية للمصفوفات ، مثل الفيبروكتين ، ضد تلك التي سبق وصفها ، وهي الكولاجين والlaminin32,33,34. سيكون من المثير للاهتمام خصوصا مقارنه الماوس NC خليه الهجرة القدرة علي الفيبرونكتين مقابل الكولاجين الأول ، نظرا لان الكولاجين IA1 يفرز بواسطة الماوس ، الطيور وخلايا NC البشرية28,30,31,32. كولاجين [اي] لذلك بما ان مناسبه بما ان [فيبرونكتين] في النظر من مصفوفة اختبار. ومن الجدير بالتنويه أيضا ان التوافر البيولوجي لعوامل النمو في وسائل الاعلام يمكن ان تتغير من قبل مكونات مصفوفة مختلفه ، وخاصه بالنظر إلى محتوي المصل عاليه من وسائل الاعلام لدينا. وللتغلب علي ذلك ، نعمل حاليا علي إنتاج ظروف ثقافيه محدده خاليه من المصل. يتم استخدام هذه الوسائط المعرفة بنجاح في بروتوكولات التعريفي قمة العصبية في مجال الخلايا الجذعية مستحث ، ولكن تتطلب المزيد من التحسين لنظامنا الثقافة NC الشرح33,34. قد يكون عملنا أيضا بمثابه نقطه انطلاق لتحسين الظروف لأنواع أخرى من خلايا NC مثل القلب والجذع NC ، والدراسات اللاحقة من التمايز NC. والاهم من ذلك ، يسمح هذا البروتوكول بعزل خلايا NC الجمجمة لمجموعه متنوعة من التطبيقات. نحن نتصور دراسات حول الهجرة الموجهة والهجرة ثلاثية الابعاد والغزو. يمكن معالجه الخلايا المعزولة بهذه الطريقةin vitroلعدد من التحليلات. علي سبيل المثال ، يمكن معالجه الخلايا بسهوله باستخدام جزيئات صغيره مختلفه لاستهداف بروتينات محدده ، ويمكن علاجها عند نقاط زمنيه محدده ، ويمكن تصميم تجارب الغسيل لتحديد استرداد سلوكيات الخلايا (الشكل 4). ثقافة طويل الأجل لاختبارات التفاضل والتمايز هو ممكن ، فضلا عن مرور الخلايا (البيانات لم تظهر). ومع ذلك ، يجب التحقق من صلاحيه تجديد الخلايا والقدرة المتعددة بعد المرور. ويمكن أيضا ان تستخدم الخلايا المطلية علي الشفتين الزجاجية في بروتوكولات تلطيخ النيون ، بعد التصوير الحي. وأخيرا ، يمثل هذا النهج نظاما قويا بشكل هائل لدراسة هجره NC من نماذج الماوس الجينية22,23,24,25.
Disclosures
ولا يوجد تضارب في المصالح بين أصحاب البلاغ.
Acknowledgements
ونحن ممتنون لوحده الخدمات البيولوجية التابعة لكليه الملك لندن ، وخاصه تيفاني جارفيس وليندا كاسهنيلا لدعمهما المستمر. نشكر ديريك Stemple ، مامورو ايشي وروبرت Maxson للحصول علي المشورة والمساعدة مع الكواشف خلال التاسيس الاولي لهذا البروتوكول. نشكر ديريج تاهيم علي المساعدة في تشعيع أشعه جاما لخلايا STO. ونحن نشكر مختبرات ليو و Krause ، وخاصه تؤمي Pallett ، لدعم كبير. وقد تم تمويل هذا العمل من خلال منح من BBSRC (BB/R015953/1 إلى KJL/MK) ، وهي دراسة من برنامج تدريب الدكتوراه في الجمهورية ، وصندوق نيولاند بيدلي (ALM) ، والامانه العامة للبحوث والتكنولوجيا (GSRT) ، ووزارة التعليم والشؤون الدينية الشؤون ، اليونان ومؤسسه سانتيه (إلى SGGM).
Materials
| Name | Company | Catalog Number | Comments |
| bFGF | R&D systems | 233-FB | |
| b-mercaptoethanol | Gibco | 31350-010 | |
| Tissue culture flasks | Corning | 430639 | 25cm2 culture flasks |
| DMEM (4500 mg/L glucose) | Sigma | D5671 | |
| Dulbecco's phosphate-buffered saline (dPBS) | Sigma | D8537 | |
| Ethanol | Fisher Chemicals | E/0650DF/C17 | |
| Fetal Bovine Serum | Sigma | TFS AA 10-155 | |
| Fetal Bovine Serum (ES Cell FBS) | Gibco | 26140079/16141-079 | |
| Fibronectin bovine plasma | Sigma | F1141 | |
| Gelatin from bovine skin | Sigma | G9382 | |
| L-glutamine | Sigma | G7513 | |
| Glass-bottomed, multi-well 24-well tissue culture plate | Ibidi | 82406 | Glass-bottomed, No 1.5, 24-well tissue culture dish with black sides |
| Cell migration analysis tool | Ibidi | v2.0 | Manuals for this software can be found at: https://ibidi.com/manual-image-analysis/171-chemotaxis-and-migration-tool.html. |
| Circularity Plug-in | ImageJ | v1.29 or later | The circularity plug-in is an extended version of ImageJ/Fiji’s Measure command, designed by Rasband, W., (2000) (wsr@nih.gov). |
| LIF | ESGRO by Millipore | ESG1106 | |
| Manual Cell Tracking Plug-in | ImageJ | v1.34k or later | ref Cordelieres F. Institut Curie, Orsay (France) 2005 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| MEM non-essential aminoacids 100X | Gibco | 11140-050 | |
| Matrigel (ECM-based Hydrogel) | Corning | 356234 | |
| Microscope | Olympus | 1X81 | Olympus 1X81 inverted microscope |
| Microscope camera | Photometrics | 512B | Photometrics Cascadell 512B camera (4x UPlanFL N, 10x UPlanFL N, 20x UPlanFL N, 40x UPlanFL N objectives) |
| Microscope controller | Olympus | 1X2-UCB | Olympus 1X2-UCB microscope controller |
| Microscope temperature controller | Solent Scientific | RS232 | Maintained at 37°C |
| Penicillin/streptomycin | Sigma | A5955 | |
| Sodium Pyruvate | Sigma | S8636 | |
| Statistics software | Graphpad Prism | v7.0 | |
| STO feeder cells | ATCC | CRL-1503 | |
| Stereomicroscope | Nikon | SMZ | |
| XY microscope stage controller | Applied Scientific Instrumentation (ASI) | MS-4400 |
References
- Duband, J. L. Diversity in the molecular and cellular strategies of epithelium-to-mesenchyme transitions: Insights from the neural crest. Cell Adhesion & Migration. 4, 458-482 (2010).
- Mayor, R., Carmona-Fontaine, C. Keeping in touch with contact inhibition of locomotion. Trends in Cell Biology. 20, 319-328 (2010).
- Le Douarin, N., Kalcheim, C. . The neural crest. 2nd edn. , (1999).
- Trainor, P. A. . Neural Crest Cells : Evolution, Development, and Disease. , (2014).
- Jiang, R., Bush, J. O., Lidral, A. C. Development of the upper lip: morphogenetic and molecular mechanisms. Developmental dynamics : an official publication of the American Association of Anatomists. 235, 1152-1166 (2006).
- Ahola, J. A., et al. Increased incidence of Hirschsprung's disease in patients with hypoplastic left heart syndrome--a common neural crest-derived etiology?. Journal of Pediatric Surgery. 44, 1396-1400 (2009).
- Bajpai, R., et al. CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature. 463, 958-962 (2010).
- Inoue, K., et al. Congenital hypomyelinating neuropathy, central dysmyelination, and Waardenburg-Hirschsprung disease: phenotypes linked by SOX10 mutation. Annals of Neurology. 52, 836-842 (2002).
- Kim, H., Kang, K., Ekram, M. B., Roh, T. Y., Kim, J. Aebp2 as an epigenetic regulator for neural crest cells. PloS one. 6, e25174 (2011).
- Barriga, E. H., Trainor, P. A., Bronner, M., Mayor, R. Animal models for studying neural crest development: is the mouse different?. Development. 142, 1555-1560 (2015).
- Bronner, M. E., LeDouarin, N. M. Development and evolution of the neural crest: an overview. Developmental Biology. 366, 2-9 (2012).
- De Calisto, J., Araya, C., Marchant, L., Riaz, C. F., Mayor, R. Essential role of non-canonical Wnt signalling in neural crest migration. Development. 132, 2587-2597 (2005).
- Carmona-Fontaine, C., et al. Contact inhibition of locomotion in vivo controls neural crest directional migration. Nature. 456, 957-961 (2008).
- Matthews, H. K., et al. Directional migration of neural crest cells in vivo is regulated by Syndecan-4/Rac1 and non-canonical Wnt signaling/RhoA. Development. 135, 1771-1780 (2008).
- Banerjee, S., et al. A novel role for MuSK and non-canonical Wnt signaling during segmental neural crest cell migration. Development. 138, 3287-3296 (2011).
- Pryor, S. E., et al. Vangl-dependent planar cell polarity signalling is not required for neural crest migration in mammals. Development. 141, 3153-3158 (2014).
- Serbedzija, G. N., Bronner-Fraser, M., Fraser, S. E. Vital dye analysis of cranial neural crest cell migration in the mouse embryo. Development. 116, 297-307 (1992).
- Kawakami, M., Umeda, M., Nakagata, N., Takeo, T., Yamamura, K. Novel migrating mouse neural crest cell assay system utilizing P0-Cre/EGFP fluorescent time-lapse imaging. BMC Developmental Biology. 11, 68 (2011).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nature protocols. 6, 1568-1577 (2011).
- Ishii, M., et al. A stable cranial neural crest cell line from mouse. Stem Cells and Development. 21, 3069-3080 (2012).
- Gonzalez Malagon, S. G., Liu, K. J. ALK and GSK3: Shared Features of Neuroblastoma and Neural Crest Cells. Journal of Experimental Neuroscience. 12, 1179069518792499 (2018).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9, 1126 (2018).
- Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K., McMahon, A. P. Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Current Biology : CB. 8, 1323-1326 (1998).
- Laranjeira, C., et al. Glial cells in the mouse enteric nervous system can undergo neurogenesis in response to injury. Journal of Clinical Investigation. 121, 3412-3424 (2011).
- Pfaltzgraff, E. R., Mundell, N. A., Labosky, P. A. Isolation and culture of neural crest cells from embryonic murine neural tube. Journal Of Visualized Experiments : JoVE. , e4134 (2012).
- Sternberg, J., Kimber, S. J. The relationship between emerging neural crest cells and basement membranes in the trunk of the mouse embryo: a TEM and immunocytochemical study. Journal of Embryology and Experimental Morphology. 98, 251-268 (1986).
- Sternberg, J., Kimber, S. J. Distribution of fibronectin, laminin and entactin in the environment of migrating neural crest cells in early mouse embryos. Journal of Embryology and Experimental Morphology. 91, 267-282 (1986).
- George, E. L., Georges-Labouesse, E. N., Patel-King, R. S., Rayburn, H., Hynes, R. O. Defects in mesoderm, neural tube and vascular development in mouse embryos lacking fibronectin. Development. 119, 1079-1091 (1993).
- Henderson, D. J., Copp, A. J. Role of the extracellular matrix in neural crest cell migration. Journal of Anatomy. 191 (Pt 4), 507-515 (1997).
- Thomas, S., et al. Human neural crest cells display molecular and phenotypic hallmarks of stem cells. Human Molecular Genetics. 17 (21), 3411-3425 (2008).
- Greenberg, J. H., Seppa, S., Seppa, H., Hewitt, T. Role of collagen and fibronectin in neural crest cell adhesion and migration. Developmental Biology. 87 (2), 259-266 (1981).
- Leung, A. W., et al. WNT/β-catenin signaling mediates human neural crest induction via a pre-neural border intermediate. Development. 143 (3), 398-410 (2016).
- Zhu, Q., Lu, Q., Gao, R., Cao, T. Prospect of Human Pluripotent Stem Cell-Derived Neural Crest Stem Cells in Clinical Application. Stem Cells International. 2016, 7695836 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved