Method Article
חיתוך, תרבות וניתוח של הגולגולת הראשי ציצה עצביים תאים מעכבר לחקר של ציצה של תא העצבים העצבי והגירה
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר את הניתוח והתרבות של תאי ציצה עצביים הגולגולת מדגמי העכבר, בעיקר למחקר של הגירה תא. אנו מתארים את טכניקות ההדמיה החי בשימוש וניתוח של מהירות וצורה תא שינויים.
Abstract
במהלך העשורים האחרונים יש כבר זמינות מוגברת של מודלים העכבר מהונדסים גנטית המשמש לחיקוי הפתווגיות האדם. עם זאת, היכולת ללמוד תנועות תאים ובידול ב vivo הוא עדיין קשה מאוד. נוירוקריסטואטאס, או הפרעות של שושלת הנוצות העצבית, מאתגרות במיוחד ללימוד בשל חוסר נגישות של שלבים עובריים מרכזיים והקשיים בהפרדת הרכס העצבי מתוך העור הצמוד. כאן, יצאנו כדי ליצור פרוטוקול מוגדר היטב, שגרתי עבור התרבות של תאים הגולגולת הראשי נוצות הגולגולתי. בדרך שלנו אנו מנתחים את הגבול לוחית העכבר העצבית במהלך השלב הראשוני האינדוקציה העצבים העצבית. אזור הגבול של הלוחית העצבית מהסבר ומתורבת. התאים העצביים העצבית טופס בגיליון אפיתל המקיף את גבול הצלחת העצבית, ועל ידי 24 שעות לאחר לחקור, להתחיל לדלל, שעברו האפיתל-mesenchymal מעבר (צוות החירום) כדי להפוך במלואו האריחים העצביים העצבים התאים. בשל הגישה דו מימדית שלנו, אוכלוסיות הרקמה ברורים (הלוח העצבי לעומת הראש ציצה העצבי הנדידה) יכול להיות מכובד בקלות. באמצעות גישות הדמיה חיה, נוכל לזהות שינויים האינדוקציה ציצה עצבית, התנהגויות הפעולה נדידה. השילוב של טכניקה זו עם המוטציות הגנטיות תהיה גישה רבת עוצמה להבנת הביולוגיה העצבית הנורמלית והפתולוגית של התאים.
Introduction
הסמל העצבי (NC) שושלת היוחסין היא האוכלוסייה ארעי, רב עוצמה ונדידה של תאים שמופיע באופן בלעדי בחוליות במהלך פיתוח מוקדם העובריים1,2. נגזרות של ציצה עצבית הם מגוונים מאוד, וכוללים גליה, שריר חלק, מלנוציטים, נוירונים ועצמות הגולגולת ואת הסחוס3,4. מאחר והציצה העצבית תורמת לתפקוד של מערכות איברים רבות, שושלת היוחסין הזו חיונית לembryogenesis האנושי. הפיתוח החריג הינו מעורב במגוון רחב של מומים מולדים בעלי החיים הנפוצים ביותר (כלומר, שפה שסועה והחך)5, וגם הפרעות כגון מחלת הירשרונג (hscr), תסמונת וורנסבורג (WS), תסמונת הסתערות ותסמונת ויליאמס6 ,7,8,9.
פיתוח NC התפתחות במספר מערכות מודל שאינן מספרות, כולל קסנפוס, חומוס ומודלים של דגים. ב יונקים, העבודה בדגמי העכבר זיהה חלק מהאירועים הגנטיים מפתח בבסיס התפתחות ציצה עצבית; עם זאת, היה קשה יותר לעקוב אחר ביולוגיה התא של הגירה ציצה עצבית, בשל הנגישות של העובר העכבר (נבדק במקום אחר10,11). יתר על כן, בעוד מחקרים בחורה, xenopus ו-דג דג זברה הקימו רשת הרגולציה גנים עבור NC, אובדן של לימודי פונקציה אלה מודלים בעלי חיים לפעמים לא מפגין פנוטיפ דומה בעכבר. לדוגמה, ב- xenopus, דג ואפרוח, לא קנוני wnt איתות הוא אחד המנגנונים הסלולריים המאפשר את NC לרכוש קיבולת הנדידה שלו12,13,14,15 . עם זאת, בעכבר, אובדן של איתות Wnt שאינו קאנוני לא נראה להשפיע על הגירה16. כמו ב vivo NC הגירה קשה לעקוב אחר תקופות ארוכות בעכבר, לא ברור אם אלה מינים הבדלים משקפים מצבים שונים של הגירה, או הבדלים ברגולציה מולקולרית.
כפי שצוין, מחקרים NC בעכבר כבר מאתגרת מאוד כי התרבות לשעבר הרחם של העוברים הוא מפרך. יתר על כן, NC הוא כל הזמן במגע אינטימי עם רקמות סמוכות כגון מזועור ומלא עור. השימוש האחרון של מנהלי ההתקנים הנוירוניים העצביים או צבעי האקסוגני אפשרה לנו לתייג בדגל את NC הנדידה; עם זאת, גישות אלה עדיין מוגבלות. למרות דיווחים מרובים המתארים טכניקות שונות להמחיש NC הגירה17,18, היה קשה לפתור את הטכניקות הללו לתוך הליך פשוט ושגרתי.
ברור כי יש צורך בטכניקות המאפשרות טיפול ואפיון של מהיונקים NC. התמקדנו במאמצים שלנו על הגולגולת בעכבר NC כפי שהוא המודל העיקרי ללימוד התפתחות הגולגולת האנושית ונוירוקריסטואטאס. אנו זיקוק הגישה שלנו מבוסס על מספר דיווחים מעניינים המתארים את התרבות הראשית של תאים NC19,20,21. כאן, אנו מתארים ביסודיות את טכניקות התרבות אופטימלית להסבר תאים NC הראשי. אנו מדגימים את שיטת הדמיה של התא החי ואת השימוש האופטימלי של מטריצות שונות כדי לחלוק את לוחיות התרבות. הפרוטוקול שלנו מתאר כיצד ללכוד את הגירה של תאים בשידור חי NC באמצעות מיקרוסקופ הפוך, אשר מיועד כמנחה לשימוש עם מיקרוסקופים אחרים, כמו גם סיכום מפורט של הניתוחים הסלולריים שלנו.
התוצאה הצפויה של ההסבר צריכה להיות התפלגות יפה החוצה של תאים שנבדלים בבירור מתחת למיקרוסקופ, שם ניתן לראות שלוש אוכלוסיות שונות של תאים המייצגים (אני) הלוח העצבי, (ii) מראש, ו-, (iii) תאי ציצה עצבית מנודדים. אנו מדגימים כיצד לנתח את התנהגויות התא בגבול האוכלוסיה הקדם-מראשות של תאים במהלך המעבר האפיתל-mesenchymal. אנו מתמקדים גם המאמץ שלנו על לימוד תאים נודדים מלא עבור מהירות התא, מרחק ומורפולוגיה התא.
Protocol
כל העבודה בעלי חיים עברה אישור מוסרי על ידי המלך של המכללה בלונדון ביקורת אתית תהליך ובוצע בהתאם בבריטניה הבית Office רישיון P8D5E2773 (KJL).
1. הכנת ריאגנטים
- הכנת פתרונות כלליים וכלים כולל תמיסת פוספט סטרילי מאגר (PBS), 70% אתנול, כלים לחיתוך (מלקחיים ולהבי חיתוך או מחטים סטרילי), צלחות פלסטיק או שקופיות זכוכית מצופה עם מטריצה מסחרית זמין מסחרי ( ECM)-הידרוג'ל מבוסס או פיברוטין (ראו טבלת חומרים), ומדיה ציצה עצבית (ראו להלן).
- הכן את הבסיס הבסיסי של ציצה עצבית באמצעות מדיום שונה של הנשר של דולבקה (DMEM 4500 mg/L גלוקוז), 15% סרום של שור העובר (FBS), 0.1 mM חומצות אמינו בינונית מינימלית מינימלי (הגברת NEAA 100X), 1 מ"מ נתרן פירובט, 55 μM β-mercaptoethanol, 100 יחידות/100 מסטרפטומיצין, 1/2 מ ל-גלוטמין.
- השתמש במדיה הנמצאת בתוך הלילה באמצעות גידול בתאי המזין ל-21.
- הכינו תאי מדיה (ראה טבלת חומרים) כדי להכיל dmps שיושלם על ידי 10% fbs ו 100 u/ml פניצילין, 100 U/ml סטרפטומיצין. לגדול ולהרחיב את התאים STO למפגש בתוך 25 ס"מ2 מבחנות מצופה עם 0.1% ג'לטין. . החל 5000 ראד של הקרנה גאמה
- זרעי כ 3 x 106 צמיחה-מעכבות תאים על 10 ס מ2 צלחת או 25 ס מ2 בקבוקון (משלב 1.2.1.1). הוסף כ 10 – 12 מ ל של הבסיס ציצה עצבית בינונית בתוך הלילה.
הערה: ניתן להשתמש בתאים המשמשים להפקת אמצעי בינוני מותנה למשך עד 10 ימים. בדיקת המראה של תאים באופן סדיר
- לסנן את המדיום (0.22 יקרומטר גודל הנקבוביות), ותוספת עם 25 ng/mL מקדם צמיחה פיברופיצוץ בסיסי (bfgf) ו 1000 U של גורם מעכב לוקמיה (אבל).
הערה: החנות ב-4 ° צ' ושימוש בתוך חודש או בחנות ב-20 ° c ושימוש בתוך 3 חודשים.
- השתמש במדיה הנמצאת בתוך הלילה באמצעות גידול בתאי המזין ל-21.
- מעילים את משטחי התרבות רקמה עם מטריקס מסחטות.
הערה: בהתאם לשאלה הביולוגית שנשאלת, המטריצה יכולה להיות מצופה על מנות תרבות עם תחתית זכוכית, מנות תרבות של רקמה פלסטית או כיסוי זכוכית. ראה להלן לדילול שונות ECM מבוססי הידרוג'ל תלוי המצע מטריצה. Fibronectin נבדק על מנות התחתית זכוכית ומכסים מחליק רק בריכוזים המפורטים להלן. כאן והלאה, נתייחס למשטחים מצופי המצע כ"לוחות מצופים".- העילו את משטחי תרבות הרקמה באמצעות הידרוג'ל מבוסס ECM.
הערה: השאר את המצע קר עד לציפוי, או על-ידי קירור המדיה או שמירה על קרח.- הפשרת ההידרוג'ל ב -4 ° c בלילה. הוסף 5 מ ל של 10% FBS ב DMEM ל 5 מ ל של הידרוג'ל עבור נפח סופי של 10 מ ל (ראה את שולחן החומרים).
- הפוך 0.5 – 1 mL הקלה כנוחה וחנות ב-20 ° c.
- . להפשיר את ההידרוג'ל על הקרח
- השתמש בדילול 1:20 של מלאי ההידרוג'ל לפלסטיק מעיל.
- השתמש בדילול 1:5 של מלאי ההידרוג'ל לשקופיות זכוכית מעילים ולוחיות של תרבות עם תחתית זכוכית.
הערה: יש לדלל את ההידרוג'ל בזיכרון קר . - החלת הידרוג'ל מדולל מספיק כדי לכסות את האזור הרצוי על לוחות/שקופיות דגירה של 30-45 דקות ב 37 ° c.
- השתמש בלוחות מצופים/שקופיות מיידית או אחסן שקופיות מצופות ב-4 ° c בלילה.
- הסר עודפים ושטוף שקופיות עם הסוכר הגבוה (אופציונלי) לפני השימוש.
- מעילים את משטחי תרבות הרקמה עם fibronectin.
- להפוך את התשובה של 1 מ"ג/mL fibronectin פתרון מניות וחנות ב-80 ° c. לדלל את הבית עם הערוץ הבינלאומי של Dulbecco (dPBS) לריכוז הסופי של 1 μg/mL.
- החלת fibronectin מספיק כדי לכסות את האזור הרצוי הדגירה בטמפרטורת החדר עבור 15 דקות.
- הסירו את הזכוכית לייבוש במשך 30-45 דקות.
- שטפו בארות או תעודות מכסות בגלוקוז גבוה (אופציונלי) לפני השימוש.
- העילו את משטחי תרבות הרקמה באמצעות הידרוג'ל מבוסס ECM.
2. יום 1: ניתוח של העוברים בשלב מוקדם של הבמה
הערה: השתמש בכלים סטריליים ובפתרונות סטריליים. לאסוף את הגופה של העובר. להפקת דנ א
- חיתוך של צלחת עצבית הגולגולת מוגבלת העוברים ב 8.5 ימים post coitum (dpc). לבחור עוברים על הבמה 5-8 somite. מנתחים את הרחם לתוך הPBS וחותכים את המעי הלבן כדי להפריד בין העובר (איור 1A). קיר השרירים של חוזי הרחם והרקמה הדצידקדואלית יהפכו לגלויים (איור 1B).
הערה: לשמור על עוברים ברחם ב-PBS קר קרח בזמן הניתוח מבוצעים עובר אחד בכל פעם. העבר עוברים עם מפית מזכוכית פסטר לתוך הערוץ החדש סטרילי כדי לשפר את הניראות ולהפחית את הזיהום. - השקופית מלקחיים בין שכבת השריר לבין רקמת הסרת כפול ולהסיר את שכבת השריר עם זוג שני של מלקחיים (איור 1C).
- באמצעות מלקחיים, לנקב את ההחלטה בקצוות של עמוד המשפט meסומי ועם זוג שני של מלקחיים דמעה לפתוח ניצב לעמוד.
- . כדי לדמיין את קרום הריצ'רט
- הסר את קרום. רייצ'רט בזהירות שק החלמון הקרביים הופך גלוי העובר ניתן לראות בתוך (איור 1D).
- הסר את שק החלמון הקרביים ואת בדיקת השפיר (איור 1E) ומקם את העובר כדי להמחיש את קיפול הראש (איור 1e).
- חותכים את הראש מתקפל מעל הלב ומגרדים את העור הבסיסי באמצעות מלקחיים ו/או עפעף כלים כדי להשיג צלחת עצבית נקייה (NP) (איור 1H).
הערה: ניתן לשמור את ה-NP או לחלק את הציר הanteroposterior כך שכל צד יוכל להיות מצופה בנפרד. גבול הצלחת העצבית יכול להיות מגזז הרחק מלוחית העצבים כדי למזער את התרומה העצבית לתוך האקכורים. - השתמש מזכוכית פסטר כדי להעביר את הצלחת לגזור את לוחית מצופה הידרוג'ל מלא מדיה ציצה עצבית ממוזג.
- מערבולת בעדינות את הצלחת כדי למקם את NP באמצע הבאר. זה חשוב למקסם את איכות השלב עבור הדמיה תא חי (ביום 2).
- דגירה לילה (או לנקודת זמן הרצויה) ב 37 ° c ב 5% CO2. בתאי ציצה עצביים צריך להיות בעליל מעביר מתוך הצלחת העצבית.
הערה: תאים בדרך כלל לצרף בתוך 6 – 8 h. לאחר צירוף ההסבר, אפשר זמן נוסף להמחיש את התאים הנודדים. בדרך כלל על ידי הודעה 24 שעות ההסבר, אנחנו יכולים למצוא שלוש אוכלוסיות ברורים של תאים. האוכלוסייה הראשונה, במרכז ההסבר, היא הלוחית העצבית (NP). האוכלוסייה השנייה, מקדם השיא של NC (pNC), מקיפה את NP בגיליון האפיתל של תאים. האוכלוסייה השלישית, בזירה החיצונית, נוצרת מ-NC נדידה (mNC), אשר גדולים יותר בגודלם, ומופיעים במלואו mesenchymal (איור 2).
3. יום 2: הדמיה של תאים חיים של הגולגולת מוריין בתאי ציצה עצבי
הערה: יש לבצע הדמיה 24 שעות פוסט הסבר על התמונה בצורה אופטימלית ומכמת הגירה העצבים של התא ציצה. מדיה אינדוקציה NC לא צריך להיות רענן לפני הדמיה תא חי. יש צורך בגישה למיקרוסקופ הפוך, עם שלב ממונע וחדר סביבה משולב. השתמש במנות מרובות מנות תרבות הרקמה המתאימות להדמיה (רשימת חומרים).
-
הגדרת מיקרוסקופ
- הגדר את חדר הסביבה ב 37 ° צ' ו 5% CO2.
- פירס חור לתוך המכסה של המכסה של הצלחת תרבות הרקמה כדי לאפשר את המחט CO2 , מחובר לחדר לחות2 מחולל, כדי לשבת בתוך הצלחת.
- מניחים את הצלחת תרבות הרקמה לתוך מחזיק הדגימה והקלטת במורד המכסה לוחית ושיתוף2 מחט כדי למנוע טלטול במהלך רכישה מרובת היטב.
- הפעל את בקר המיקרוסקופ, את בקר הבמה ואת תוכנת ההדמיה.
- להתמקד בתאי הגולגולת NC בהגדלה 10x (עם התאמת טבעת השלב העבה שנבחר).
- להגדיר באיכות גבוהה שלב-ניגודיות על המיקרוסקופ על ידי התאמת בסרעפת הקשתית השדה, הסרעפת הצמצם מפתח ומרכוז טלסקופ, כפי שצוין במדריך הגדרת המיקרוסקופ.
-
הדמיית תאים חיים בניגוד לפאזה
- הגדר את הספריה או את מיקום הקובץ שבו יישמרו קבצי הזמן האחזור.
- הגדר את זמן החשיפה, הביננינג ואזור המצלמה.
- הגדר את מספר נקודות הזמן, משך הדימות ומרווח הזמן בין מסגרות.
- כדי לכמת קיבולת הנדידה של תא NC, להגדיר את המיקרוסקופ כדי הגדלה 10x, לקיחת 1 מסגרת כל 5 דקות (217 הזמן נקודות על 18 h). כדי לכמת את מורפולוגיה התא, להגדיר את ההגדלה ל 40x, לקיחת 1 מסגרת/דקה (61 נקודות זמן מעל 1 h). כדי לכמת את דינמיקת החיוג, הגדר את ההגדלה להגדלה 40x או 60x, לקיחת 1 מסגרת כל 10 s (מעל 10 דקות).
- להדמיה מרובת היטב, הגדר את השלב המכני למעבר בין מיקומי הריבית הנבחרים של XY. ודא כי תאים הגולגולת NC הם בפוקוס ועמדות הבמה נכונים.
- השתמש בפקודה ' רכוש ' כדי להפעיל דימות בזמן הדמיה.
- ברגע שהשלמת ההדמיה, עיין בנתונים רב-ממדיים ובייצוא קבצי. stk לצורך ניתוח.
הערה:. stk הוא קובץ מחסנית TIFF. - צא מהתוכנה, כבה את המחשב וכבה את בקרי השלב, המצלמה והמיקרוסקופ.
4. ניתוח הדמיה: קוונפיקציה של הגירה של מציצה עצבית
הערה: כדי להגדיר טוב יותר את התנהגויות הסלולר הציגו על-ידי העברת הגולגולת מוריין בתאי ציצה עצבית, ניתחנו סדרה של פרמטרים נדידה הניתנות לכימות, במיוחד התמקדות קיבולת נדידה ודינמיקה בצורת תא. (1) הגירה (מרחק שנצבר) היא אורך הנתיב הכולל שנלקח התא (μm); (2) הגירה (מרחק אוקלידי) היא מרחק הקו הישר בין המיקום הראשוני והסופי של התא (μm); (3) הגירה (מהירות התא) היא מרחק שנסע על ידי התא לכל יחידת זמן (μm/min); (4) תא צורה (אזור תא) הוא המשטח הכולל המכוסה בתאים. קבעו פיקסל לקנה מידה מיקרון בהתאם למיקרוסקופ דימות. (A = px x N px, שם האזורPx = פיקסל ו-Npx = מספר הפיקסלים. יחידות: יקרומטר2; (5) הצורה תא (מעגליות תא) היא סטייה של הצורה תא ממעגל מושלם אשר מצוין על ידי ערך מעגלי של 1.0 (4Π (a/P2)) שבו = אזור ו P = היקף.
-
מעקב אחר תאים בודדים
הערה: כדי למדוד הגירת תאים NC, קואורדינטות XY של תאים בודדים בכל מסגרות הזמן מופקים. הדבר מאפשר ניתוח מרחוק של מרחק, מהירות והתמדה של העברת תאים.- פתח את ImageJ ויבא נתונים כקבצי מחסנית TIFF.
- לחץ על נתח | הגדר קנה מידה לכיול קבצי. stk בהתאם להגדרות מיקרוסקופ, עבודה בפיקסל/μm.
- לחץ על תוספים | מעקב | מעקב ידני כדי לפתוח את התמונה הידנית של מעקב אחר התאים plugin. כדי להתחיל מעקב אחר תאים, בחר באפשרות ' הוסף רצועה'.
- עקוב אחר התאים דרך כל המסגרות של סרטים לפקיעה זמן, באמצעות הגרעין כנקודת התייחסות.
הערה: 10 – 20 תאים יש לעקוב אחר לחקור, עם סך של 60 תאים מסומנים (n = 3). תאים שעוברים את חלוקת התא במהלך מהלך הזמן צריך להיות מחוץ לניתוח. - שמור וייצא את התוצאות כקובץ csv. התוצאות מייצגות מספר מסלול תא בודד, מספר פרוסה וקואורדינטות XY מעל כל המסגרות.
-
קוונפיקציה של קיבולת הנדידה של תא של ציצה עצבית
- פתח נתוני מעקב אחר תאים (ראה לעיל). המרת קבצי. csv לתבנית קובץ. txt.
- פתח את תוכנת ההעברה ( טבלת החומרים). לחץ על הכרטיסיה ייבוא נתונים כדי לייבא את נתוני המעקב אחר תאים כקובץ txt.
- תחת ערכות נתונים | אתחול, בחר את מספר הפרוסות או המסגרות לניתוח והגדר את כיול ה-XY ואת מרווח הזמן בין מסגרות. בחר באפשרות החל הגדרות כדי לשמור את ההגדרות.
- בחר את ההתוויה של סמל הנתונים כדי ליצור מחלקות מסלול. בחרו בסמל הסטטיסטיקה למרחק לכמת ולאמצעי מהירות.
- שמור את מחלקות הנתיב כקבצי bitmap (. bmp) ואמצעי מרחק ומהירות כקבצי txt. בחר באפשרות הסר את סמל הנתונים . חזור על הפעולה עבור קבצים אחרים של השגות בזמן.
הערה: ניתן להשתמש בחלקות מסלול כדי להמחיש את הכיוון של שבילי תאים בודדים עבור תנאי תא מסוים או מדינה במהלך הסרטים הניתנים לקפיצה בזמן (איור 4A). לאחר מכן ניתן להשתמש במרחק ובנתוני מהירות המאוחסנים בקבצי. txt לצורך ניתוח נוסף.
-
כימות השטח של תא ציצה עצבית ומעגליות
- פתח את קבצי ה-stk של הזמן הפנוי ב-ImageJ וכיול לפי הגדרות המיקרוסקופ, עבודה בפיקסל/μm.
- תחת ניתוח | הגדר מדידות, לחץ כדי לבחור את פרמטרי צורת התא: אזור תא, מתאר היקפי וצורה.
- השתמש בכלי בחירה ביד חופשית כדי לצייר באופן ידני סביב כל תא, תוך שימוש בגבולות קרום התא כמנחה.
- הקש Ctrl + B מקשים בלוח המקשים כדי לשמור על מסלע החלוקה לרמות של התא בתמונה. חזור על הפעולה עבור תאים מעל לכל מסגרת שמעידה על הזמן.
- השתמש בתמונה | שכבת-על | ל-ROI Manager כדי לאחסן את הערכים.
- לאחר שכל תאי העניין לכל מסגרת מתוארים, לחץ על מדידה. שמור את התוצאות כקובץ csv.
הערה: 10 – 20 תאים לסרט צריך להיות מחולק, עם סך של 30-60 תאים שנותחו לפי תנאי (n = 3). ניתן להשתמש בנתוני צורת תא (קבצי. csv) כדי לכמת את אופן השינוי של הדינמיקה בצורת תא לאורך זמן (איור 4C) או כיצד ניתן לשנות מורפולוגיה תחת טיפולי תאים שונים.
תוצאות
באמצעות ההליך הפגינו כאן, עוברי העכבר היו גזור מן הרחם, רקמות מעובריים הוסרו (איור 1A – D). העוברים היו מבוים (באמצעות העוברים רק ב 5-8 מסוענים (ss), איור 1E, F). . והנוירואפיתל הייתה מבודדת תאים מזועורי, מזוהה כתאים רופפים, עגולים, mesenchymal, היו מוברש בעדינות את (איור 1G-L). הלוח העצבי הקדמי יכול להיות הסבר שלם, ובמקרה זה רקמת הרכס העצבי יהיה לצאת באופן משני ולהרחיב מסביב את ההסבר, או כל גבול הלוח העצבי (ימין ושמאל) ניתן להסבר בנפרד. זה שימושי במיוחד כאשר ההסבר מוטציות גנטיות.
בתוך 24 h, אזור של הפרעות (אפיתל) סמל הגולגולת העצבי ניתן לראות בבירור סביב לוחית העצבים לחקור (איור 2B). יתר על כן, אוכלוסיית משנה של תאים של ציצה עצבית עברו האפיתל למעבר mesenchymal ולהופיע במלואו mesenchymal (איור 2). לכן, יש לנו מספר טבעות קונצנטריים של תאים נפרדים, עם הלוחית העצבית (NP) במרכז, ציצה עצבית מראש (pNC) במעגל הביניים, ואוכלוסיה של ציצה עצבית הנדידה (mNC) בזירה החיצונית (איור 2B). על מנת לעקוב אחר תאים NC, אפשר להשתמש גנטית מודלים העכבר שונה כפי שאנו מראים באיור 2C. במקרה זה, השתמשנו בסמל Wnt1 העצבי הספציפי :: יצור; רוזהMtmg אשר התוצאה של תאים NC להיות מתויג בירוק. בעכברים אלה, תאים לבטא עגבניות קרום (mT, באדום) אלא אם כן הם מבטאים את הrecombinase. שילוב מוביל לתאים המבטא חלבון פלורסנט ירוק ממברנה (GFP, בירוק). התאים האדומים המוצגים במרכז ההסבר הם תאי צלחת עצביים. חלק מתאי הצלחת העצביים גם מבטאים את GFP; עבור תרבות ארוכת טווח, היינו לבלו את כל התאים במרכז. למטרות שלנו, טוהר ההסבר מספיק כדי לעקוב אחר האוכלוסיות השונות של הרכס העצבי. איפה טוהר גבוה יותר של הרכס העצבי הוא הכרחי, זו אסטרטגיה תיוג גנטי ניתן לשלב עם מיון תא פלורסנט המופעל (FACS) כדי להבטיח טוהר של האוכלוסייה. לחילופין, ניתן לתקן את האקסוצמחים ולזהות את אוכלוסיית NC עם תיוג נוגדנים.
זה היה גם ברור על ידי 24 h כי האופייני טבעות קונצנטריים של מראש התאים NC הנדידה של התרבויות ההסבר לא היה תלוי ולא נשלט על ידי בחירה מטריצה (איור 3). לחקור את התרבויות מצופה הן הידרו ECM מבוססי הידרוג'ל ו fibronectin יצרו מבנים דומים לחקור, המורכב שלוש אוכלוסיות תאים, NP, pNC ו mNC (איור 3A, C). מורפולוגיה של תא ציצה עצבית היתה גם דומה בין אלה מצופה הידרוג'ל מבוססי ECM ו fibronectin (איור 3B, D). עם זאת, explants מצופה על התאים המיוצרים fibronectin עם הרבה יותר בולטים בקצה המוביל של התא, לכאורה מקוטב יותר בכיוון של הגירה (איור 3B, D).
לאחר האוכלוסייה של תאים הנדידה העצבית העצביים ניכרת, הדמיה תא חי ניתן להשלים. מיקרוסקופ הזמן מוגדר להגדלה של 10x (18 שעות, 1 מסגרת/5 דקות) לניתוח עוקב אחר הגירה של תאים NC (איור 4A). ImageJ מעקב ידני plug-in יוצר קואורדינטות XY של תאים בודדים על כל המסגרות של הסרטים מפקיעה זמן (איור 4B). ניתן לעבד קואורדינטות אלה באמצעות תוכנת ההעברה. תוכנה זו מאפשרת ויזואליזציה של רצועות תאים בודדים לאורך זמן (איור 4B) והוא יכול לשמש לכמת מרחק אוקלידית, כמו גם מהירות התא.
זמן הדמיה נתוני ההדמיה גם מספק שפע של מידע על מורפולוגיה התא במהלך הגירה של תאי ציצה עצביים הגולגולת (איור 4C). על-ידי חלוקה לרמות של ממברנות תאים בודדים, אזור התא ומדידות היקפית ניתן לחשב מכל המסגרות של הסרטים (איור 4C). מדידות אלה מאפשרות הקוונפיקציה של אזור התא ומעגליות (איור 4D). איור 4C מציג ניתוח של שינויים בצורה תא מעל 18 שעות. שים לב כי כאשר התאים עוברים הרחק מן ההסבר, אזור התא גדל באופן משמעותי בזמן שפיצול התא נשאר קבוע יחסית (ANOVA בכיוון אחד, בדיקת ההשוואות המרובות של tukey) ( איור 4E,F). זה מרמז כי כמו תאים לצאת מהקצה האפיתל ולאבד אנשי קשר תא התא, הם מראים שטח התפשטות התא מוגבר. פעולות מעגליות של תאים לא השתנו באופן משמעותי לאורך זמן; עם זאת, ניתן לראות שינויים לטווח קצר במעגל, אם מספר מוגבר של נקודות זמן מכמת. פעולות מעגליות של תאים יכולות גם לספק נתונים מעניינים בדינמיקה של צורת תא בנוכחות של מכשיר כימוטקטיק או בתנאים סגורים.
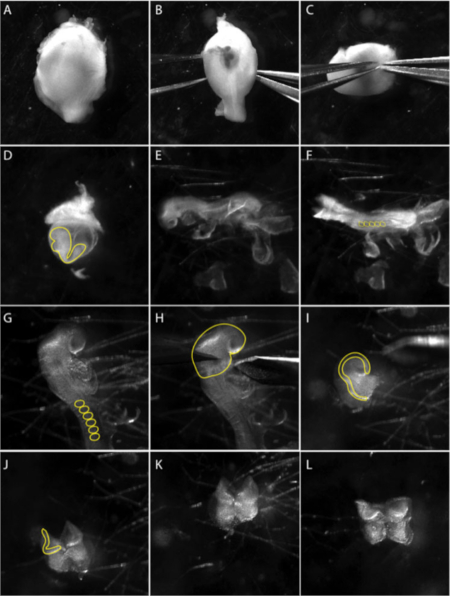
איור 1: בידוד של ציצה עצבית הגולגולת מפני העובר ה-8.5.
תמונות הן צילומי סטילס מתוך וידאו המתעד את הטכניקה לחיתוך מיקרו. (א – ג) . חיתוך העובר מהרחם (B – C) באמצעות שני מלקחיים חדים, בעדינות להפריד את שכבת השרירים. פאנל (ד) מראה העובר בתוך שק חלמון הקרביים (הקו הצהוב). לחלץ את העובר מתוך שק חלמון הקרביים. (ה) נוף צדדי של העובר בשלב 8.5 לרוחב. (ו) לראות את העובר בשלב 8.5. הרוזן מסוענים (ss) כדי לקבוע את גיל העוברים; בדרך כלל 5 – 8 ss (עיגולים צהובים ב F). (G) לסגור מבט באזור הגולגולת של העובר. להסיר קרום מעובריים מאזור הגולגולת; מסוענים מסומנים בקו צהוב. (ח) הניתוח של לוחית העצבים הקדמית מבוצעים תחת הקשת הראשונה של בראנצ'יאל (קו צהוב). מבט לרוחב של ניתוח. לוחית העצבים הקדמית הקפלים העצביים, שבו התאים ציצה עצבית מתעורר, מסומנים בקו צהוב. (J – L) הסרת רקמה מזועורי (תאי mesenchymal רך) בבסיס קפלי העצבי הקדמי כמה שיותר לפני ציפוי NP על מנות תרבות מוכנות. הסרט צולם באמצעות סטריאו-מיקרוסקופ עם עדשה רחבה האפורומטית ב 3.0 X זום (לראות את הטבלה של חומרים). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
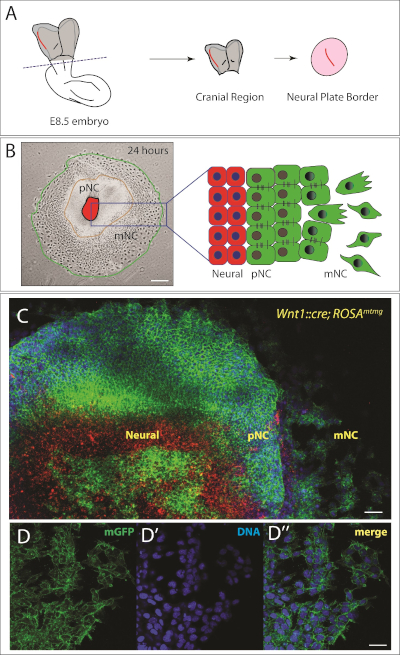
איור 2: הרכס העצבי של הגולגולת מורנה לחקור.
(א) ייצוג סכמטי של ההשקפה המקובית של עובר העכבר 8.5. אזור הגולגולת של העובר נחתך בקו מקווקו. גבול הצלחת העצבית (המסומן באדום) מבודד מרקמת העור המקיפה והתרבותי למשך 24 שעות כדי לאפשר את פסגת הגולגולת להגר. סכימטי הותאם מ-22,23. (ב) עזב: הנציג באור שדה בהיר של ציצה עצבית הגולגולת לחקור 24 שעות לאחר ציפוי. שלוש אוכלוסיות של תאים נצפו, אשר גם שוכן מימין. NP = צלחת עצבית, pNC = ציצה עצבית טרום הנדידה ו mNC = ציצה עצבית הנדידה. סרגל קנה מידה = 250 μm. (ג) תמונות הגדלה גבוהה יותר של החוקר מתוך העכבר מתויג גנטית (Wnt1:: היצורים; רוזהMtmg). תאים ללא מנהל ההתקן של היצור לבטא עגבניות קרום (mT) באדום. ביטוי של היצור תחת השליטה של ציצה עצבית ספציפית היזם Wnt1 מוביל כריתה של הקלטת mT וביטוי של ממברנה GFP (mG) בירוק. גרעינים הם מוכתם עם Hoescht (בכחול). סרגל קנה מידה = 200 μm. (d – d ' ') תמונות הגדלה גבוהה יותר של תאים נודדים ביטוי ממברנה gfp (D). (ד) דנ א מתויג עם Hoescht (כחול). (ד ') מיזוג של D ו-D. סרגל קנה מידה = 20 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
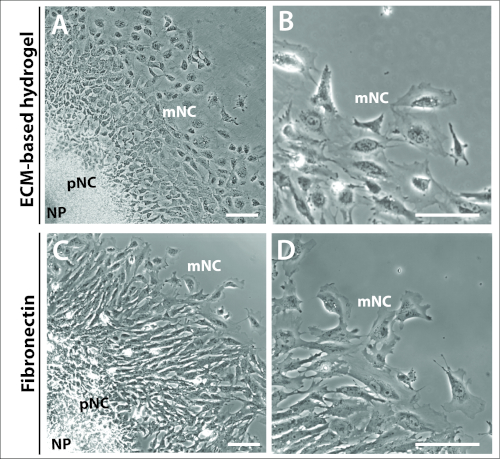
איור 3: Explants תרבותי על מצעים שונים.
(א – ב) חדות הפאזה תמונות של explants המתורמים על ECM הידרוג'ל מסחרי. (ג – ד) הידרוצמחים מתורבתים ב-1 μg/mL fibronectin. הלוח העצבי (NP), בכורה (pNC) ו נדידה (mNC) בתאי ציצה עצביים יכול להיות מכובד על ידי תאים שונים שלהם מורפולוגיות. סרגל קנה מידה = 100 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
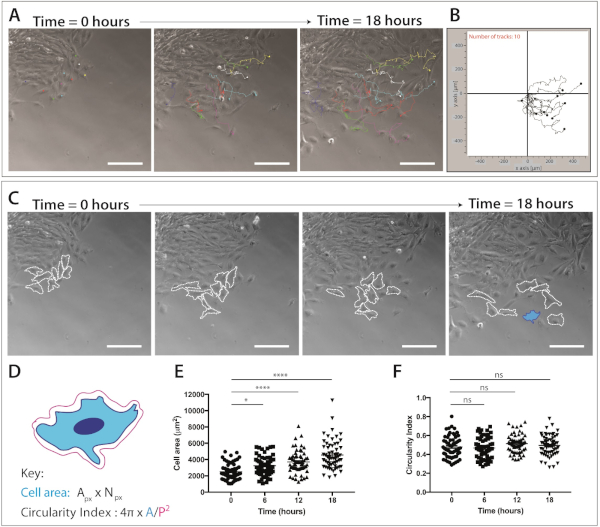
איור 4: כימות של הגירה של הגולגולת נוצות הגלגול ואת הדינמיקה הצורה תא.
(A) מסגרות לניגודיות פאזה מהדמיה בזמן הדמיה של תרבויות מצופים ברצועות של תאים עצביים בודדות, תוך שימוש בתוסף מעקב התאים הידני של imagej/פיג'י. עשרה התאים הנציג mnc מסומנים באופן ידני מעל 18 h (217 מסגרות) ו-XY הקואורדינטות יוצאו. נתונים מיוצגים כנקודות שכבת-על וכחלקות קו. תאים היו מצופים ב-1 μg/mL fibronectin. סרגל קנה מידה = 200 μm. (ב) מסלול ייצוגית של 10 תאי mnc, שנוצר באמצעות תוכנת הגירה. (ג) מסגרות בחדות הפאזה שנלקחו מניתוח בזמן הקפיצה של תרבויות ההסבר. קווים מקווקווים חלוקה לרמות 8 הנציג הנדידה העצבית תאים שנותחו עבור דינמיקת צורה תא כאשר מצופה ב-1 μg/mL fibronectin. סרגל קנה מידה = 200 μm. (ד) ייצוג סכמטי של החישובים המשמשים לכמת אזור תאים ומעגליות. המבנה התאי של התרשים הוא של התא המסומן בכחול (C). Px = באזור פיקסל, Npx = מספר פיקסל, A = אזור, P = היקף (1 פיקסל = 1.60772 יקרומטר2). (E – F) הכמת של אזור התאים ומעגלי התא לאורך זמן. הנתונים מייצגים את הממוצע ± SEM. כל נקודה מייצגת תא אחד (n = 60), נלקח 3 ניסויים עצמאיים, ומנותח ב 0 h, 6 h, 12 h ו 18 h (ns לא משמעותי, * p < 0.05, * * * * p < 0.0001 בדרך אחת ANOVA, השוואות מרובות של Tukey). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
לימוד התאים העצביים של היונקים מהווה אתגר למדענים בגלל הטבע הרחם של התפתחות היונקים. במחקרים vivo קשה להגדיר, כמו העובר חייב להיות מניפולציות בתנאים לחקות את החיים ברחם. בפועל, כמעט בלתי אפשרי לאפשר לתרבות אלה (E8 +) עוברים עבור יותר מ -24 שעות, במיוחד עבור הדמיה חיה. יתר על כן, השראה הרכס העצבי והגירה מתרחשים במקביל עם הסגר צינור עצבי הופך עובריים בעכבר; זהו אירוע קריטי מורפולגנטיקה מלחיץ, אשר לעתים קרובות נכשל כאשר העוברים הם הרחם התרבותי לשעבר. לפיכך, שיעור ההצלחה של גישות הרחם לשעבר נמוך בדרך כלל. השימוש ב-NC תאים מונצח21 הוא כלי שימושי כדי להפחית את השימוש בעלי חיים והוא עשוי לספק מקור טוב יותר של תאים של ציצה עצבית עבור ניתוח לטווח ארוך, העברה לימודי העשרה. עם זאת, יש בבירור צורך לתרבות מהימנה בתאי ציצה עצבית העיקרי. השיטה שלנו ישימה העכבר מעלף או מודלים גנטיים מותנה. שיטה דומה לשלנו תוארה עבור אוכלוסיות הרכס העצבי האחרות20; עם זאת, השיטה שלנו מתארת ביסודיות את צעד אחר צעד בידוד של תאים מורמין הגולגולת NC. אנו מתארים גם את השימוש של מטריצות שונות, כמו גם את ההליך ניתוח הגירה בפירוט.
כדי להגיע לתוצאות עקביות, גילינו שתשומת לב מיוחדת ששולמה לקראת ההיערכות במהלך מבחר העוברים. לא באופן מפתיע, מספר הגוונים הקשורים עם שלבים שונים בפיתוח הגולגולת NC. לכן, הידע של אנטומיה של העובר חשוב מאוד לפני שהוא רוכש מידע ניסיוני. גישה זו יכולה להיות מותאמת כלפי בידוד אוכלוסיות נפרדות של התאים ציצה עצבית, בהתאם לשאלה הביולוגית ותאי היעד.
לאחר העוברים נבחרו לגזור, תאים מזועורי יכול להיות מכובד בקלות יש להסיר כדי לאפשר הדמיה טובה יותר כדי להפחית את הזיהום. בתרבויות ארוכות-טווח ניתן להסיר את רקמת הצלחת העצבית בגובה 24 שעות של ציפוי על מנת למנוע זיהום של רקמות עצביות. עידון נוסף יכול להיות השימוש של תיוג השושלת הפלואורסצנטית (למשל, באמצעות Wnt1:: יצורים או Sox10:: creert מנהלי התקנים בשילוב עם כתבים פלורסנט24,25) כדי להבחין בתאי ציצה עצביים מ רקמות אחרות כפי שמוצג באיור 2C.
הדיווחים הקודמים הדגישו את הפוטנציאל של העכבר ציפוי משנת NC לחקור את התרבויות על מטריצות שונות, הנפוץ ביותר על הידרוג ECM מסחרי, fibronectin ו קולגן אני20,21,26. בידינו, העכבר הגולגולת NC לחקור תרבויות הם גדלו בהצלחה על כל שלוש מטריצות, בריכוזים שצוין דוחות המקורי (נתונים לא מוצגים). הגישה המעודנת הראשונית שלנו לתרבויות צפון קרוליינה שלנו השתמשו הידרוג'ל מסחרי כמטריצה של בחירה, אשר מורכבת בעיקר של למינציה ו collagens21(איור 3א – ב). עם זאת, הרכב של הידרוג'ל זה לא מוגדר בבירור, עם גורם גדילה לא ידוע ותוכן חלבון. ככזה, יש לנו מאז העביר את הגישה שלנו לציפוי העכבר NC לחקור תרבויות על fibronectin (איור 3C – D). Fibronectin מוגדר היטב ומבוטא במידה רבה בקרומים ECM ו מרתף לאורך תאים NC להעבירin vivo28,29,30. כדי לייעל את מטריצת fibronectin המשכפלת את הגירה של תא הנוצות העצבי ואת מורפולוגיה כפי שנראה באמצעות הידרוג'ל, השוונו התנהגויות תא NC הציגו על ההידרוג'ל נגד טיטור של 0.25 – 30 μg/ml fibronectin, והגדיר 1 μg/ml fibronectin כמו מתן מאפיינים אידיאליים (נתונים לא מוצגים). אנו מאמינים כי עבודה ראשונית זו עשויה לסייע בהקמת מסגרת להשוואה שיטתית של מטריצות, כגון fibronectin, נגד אלה שתוארו בעבר, כלומר קולגן ולמינציה32,33,34. זה יהיה מעניין במיוחד כדי להשוות עכבר מצפון קרוליינה קיבולת הנדידה על fibronectin לעומת קולגן אני, בהינתן כי קולגן-IA1 מופרש באופן שורש על ידי העכבר, העופות והאדם NC תאים28,30,31,32. קולגן אני אפוא רלוונטי כמו fibronectin בשיקול הבחירה של מטריקס. כדאי גם להכיר בכך שהזמינות של גורמי גדילה במדיה עשויה להשתנות על ידי רכיבי מטריצה שונים, במיוחד בהתחשב בתוכן הסרום הגבוה של המדיה שלנו. כדי להתגבר על זה, אנו פועלים כיום כדי לייצר ללא נסיוב תנאי תרבות מוגדרים. מדיה מוגדרים אלה משמשים בהצלחה בפרוטוקולים השראה הרכס העצבי בשדה הגזע pluriפוטנטי, אבל דורשים אופטימיזציה נוספת עבור מערכת התרבות שלנו NC ההסבר33,34. העבודה שלנו יכול גם לשמש נקודת התחלה עבור תנאי זיקוק עבור סוגים אחרים של תאים NC כגון לב טרונק NC, ולמחקרים הבאים של בידול NC. החשוב ביותר, פרוטוקול זה מאפשר בידוד של תאים מסוג NC הגולגולת עבור מגוון יישומים. אנו מתארים מחקרים על הגירה מכוונת, הגירה תלת-ממדית ופלישה. תאים בודדים באופן זה ניתן לטפלin vitroעבור מספר ניתוחים. לדוגמה, תאים יכולים להיות מטופלים בקלות באמצעות מולקולות קטנות שונות כדי למקד חלבונים ספציפיים, הם יכולים להיות מטופלים בנקודות זמן מוגדרות, וניסויים כשלון ניתן לתכנן כדי לקבוע שחזור של התנהגויות תא (איור 4). תרבות לטווח ארוך יותר עבור העברה ובידול ניתן, כמו גם מעבר של תאים (נתונים לא מוצגים). עם זאת, הכדאיות, יכולת חידוש התאים וריבוי העוצמה צריך להיות מאומת לאחר הפסנת. תאים מצופה שמיכות זכוכית יכול לשמש גם בפרוטוקולים אימונוofor, כתמים בעקבות הדמיה חיה. לבסוף, גישה זו מייצגת מערכת רבת עוצמה ללימוד הגירה של NC מדגמי עכבר גנטיים22,23,24,25.
Disclosures
למחברים אין ניגודי אינטרסים.
Acknowledgements
אנו אסירי תודה ליחידת השירותים הביולוגיים של המלך בלונדון, במיוחד טיפאני ג'רביס ולינדזי בלנלה על תמיכתם המתמשכת. אנו מודים לדרק סטוררוב, מאמורו אישיי ורוברט מקסון לקבלת ייעוץ ועזרה עם ריאגנטים במהלך הקמתה הראשונית של פרוטוקול זה. אנו מודים לדהרג טאוו לעזרה עם גמא-הקרנה של תאי STO. אנו מודים למעבדות ליאו וקראוס, ובמיוחד לטומי פאללט, לתמיכה גדולה. העבודה הזאת ממומנת על ידי מענקים BBSRC (BB/R015953/1 כדי KJL/MK), הספינה מתוך התוכנית להכשרת דוקטורט MRC (LD), הקרן הניופסטי (ALM) ו KRIPIS II, מזכירות כללי של מחקר וטכנולוגיה (GSRT), משרד החינוך והדת עניינים, יוון ופונפה סנטרה (עד SGGM).
Materials
| Name | Company | Catalog Number | Comments |
| bFGF | R&D systems | 233-FB | |
| b-mercaptoethanol | Gibco | 31350-010 | |
| Tissue culture flasks | Corning | 430639 | 25cm2 culture flasks |
| DMEM (4500 mg/L glucose) | Sigma | D5671 | |
| Dulbecco's phosphate-buffered saline (dPBS) | Sigma | D8537 | |
| Ethanol | Fisher Chemicals | E/0650DF/C17 | |
| Fetal Bovine Serum | Sigma | TFS AA 10-155 | |
| Fetal Bovine Serum (ES Cell FBS) | Gibco | 26140079/16141-079 | |
| Fibronectin bovine plasma | Sigma | F1141 | |
| Gelatin from bovine skin | Sigma | G9382 | |
| L-glutamine | Sigma | G7513 | |
| Glass-bottomed, multi-well 24-well tissue culture plate | Ibidi | 82406 | Glass-bottomed, No 1.5, 24-well tissue culture dish with black sides |
| Cell migration analysis tool | Ibidi | v2.0 | Manuals for this software can be found at: https://ibidi.com/manual-image-analysis/171-chemotaxis-and-migration-tool.html. |
| Circularity Plug-in | ImageJ | v1.29 or later | The circularity plug-in is an extended version of ImageJ/Fiji’s Measure command, designed by Rasband, W., (2000) (wsr@nih.gov). |
| LIF | ESGRO by Millipore | ESG1106 | |
| Manual Cell Tracking Plug-in | ImageJ | v1.34k or later | ref Cordelieres F. Institut Curie, Orsay (France) 2005 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| MEM non-essential aminoacids 100X | Gibco | 11140-050 | |
| Matrigel (ECM-based Hydrogel) | Corning | 356234 | |
| Microscope | Olympus | 1X81 | Olympus 1X81 inverted microscope |
| Microscope camera | Photometrics | 512B | Photometrics Cascadell 512B camera (4x UPlanFL N, 10x UPlanFL N, 20x UPlanFL N, 40x UPlanFL N objectives) |
| Microscope controller | Olympus | 1X2-UCB | Olympus 1X2-UCB microscope controller |
| Microscope temperature controller | Solent Scientific | RS232 | Maintained at 37°C |
| Penicillin/streptomycin | Sigma | A5955 | |
| Sodium Pyruvate | Sigma | S8636 | |
| Statistics software | Graphpad Prism | v7.0 | |
| STO feeder cells | ATCC | CRL-1503 | |
| Stereomicroscope | Nikon | SMZ | |
| XY microscope stage controller | Applied Scientific Instrumentation (ASI) | MS-4400 |
References
- Duband, J. L. Diversity in the molecular and cellular strategies of epithelium-to-mesenchyme transitions: Insights from the neural crest. Cell Adhesion & Migration. 4, 458-482 (2010).
- Mayor, R., Carmona-Fontaine, C. Keeping in touch with contact inhibition of locomotion. Trends in Cell Biology. 20, 319-328 (2010).
- Le Douarin, N., Kalcheim, C. . The neural crest. 2nd edn. , (1999).
- Trainor, P. A. . Neural Crest Cells : Evolution, Development, and Disease. , (2014).
- Jiang, R., Bush, J. O., Lidral, A. C. Development of the upper lip: morphogenetic and molecular mechanisms. Developmental dynamics : an official publication of the American Association of Anatomists. 235, 1152-1166 (2006).
- Ahola, J. A., et al. Increased incidence of Hirschsprung's disease in patients with hypoplastic left heart syndrome--a common neural crest-derived etiology?. Journal of Pediatric Surgery. 44, 1396-1400 (2009).
- Bajpai, R., et al. CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature. 463, 958-962 (2010).
- Inoue, K., et al. Congenital hypomyelinating neuropathy, central dysmyelination, and Waardenburg-Hirschsprung disease: phenotypes linked by SOX10 mutation. Annals of Neurology. 52, 836-842 (2002).
- Kim, H., Kang, K., Ekram, M. B., Roh, T. Y., Kim, J. Aebp2 as an epigenetic regulator for neural crest cells. PloS one. 6, e25174 (2011).
- Barriga, E. H., Trainor, P. A., Bronner, M., Mayor, R. Animal models for studying neural crest development: is the mouse different?. Development. 142, 1555-1560 (2015).
- Bronner, M. E., LeDouarin, N. M. Development and evolution of the neural crest: an overview. Developmental Biology. 366, 2-9 (2012).
- De Calisto, J., Araya, C., Marchant, L., Riaz, C. F., Mayor, R. Essential role of non-canonical Wnt signalling in neural crest migration. Development. 132, 2587-2597 (2005).
- Carmona-Fontaine, C., et al. Contact inhibition of locomotion in vivo controls neural crest directional migration. Nature. 456, 957-961 (2008).
- Matthews, H. K., et al. Directional migration of neural crest cells in vivo is regulated by Syndecan-4/Rac1 and non-canonical Wnt signaling/RhoA. Development. 135, 1771-1780 (2008).
- Banerjee, S., et al. A novel role for MuSK and non-canonical Wnt signaling during segmental neural crest cell migration. Development. 138, 3287-3296 (2011).
- Pryor, S. E., et al. Vangl-dependent planar cell polarity signalling is not required for neural crest migration in mammals. Development. 141, 3153-3158 (2014).
- Serbedzija, G. N., Bronner-Fraser, M., Fraser, S. E. Vital dye analysis of cranial neural crest cell migration in the mouse embryo. Development. 116, 297-307 (1992).
- Kawakami, M., Umeda, M., Nakagata, N., Takeo, T., Yamamura, K. Novel migrating mouse neural crest cell assay system utilizing P0-Cre/EGFP fluorescent time-lapse imaging. BMC Developmental Biology. 11, 68 (2011).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nature protocols. 6, 1568-1577 (2011).
- Ishii, M., et al. A stable cranial neural crest cell line from mouse. Stem Cells and Development. 21, 3069-3080 (2012).
- Gonzalez Malagon, S. G., Liu, K. J. ALK and GSK3: Shared Features of Neuroblastoma and Neural Crest Cells. Journal of Experimental Neuroscience. 12, 1179069518792499 (2018).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9, 1126 (2018).
- Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K., McMahon, A. P. Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Current Biology : CB. 8, 1323-1326 (1998).
- Laranjeira, C., et al. Glial cells in the mouse enteric nervous system can undergo neurogenesis in response to injury. Journal of Clinical Investigation. 121, 3412-3424 (2011).
- Pfaltzgraff, E. R., Mundell, N. A., Labosky, P. A. Isolation and culture of neural crest cells from embryonic murine neural tube. Journal Of Visualized Experiments : JoVE. , e4134 (2012).
- Sternberg, J., Kimber, S. J. The relationship between emerging neural crest cells and basement membranes in the trunk of the mouse embryo: a TEM and immunocytochemical study. Journal of Embryology and Experimental Morphology. 98, 251-268 (1986).
- Sternberg, J., Kimber, S. J. Distribution of fibronectin, laminin and entactin in the environment of migrating neural crest cells in early mouse embryos. Journal of Embryology and Experimental Morphology. 91, 267-282 (1986).
- George, E. L., Georges-Labouesse, E. N., Patel-King, R. S., Rayburn, H., Hynes, R. O. Defects in mesoderm, neural tube and vascular development in mouse embryos lacking fibronectin. Development. 119, 1079-1091 (1993).
- Henderson, D. J., Copp, A. J. Role of the extracellular matrix in neural crest cell migration. Journal of Anatomy. 191 (Pt 4), 507-515 (1997).
- Thomas, S., et al. Human neural crest cells display molecular and phenotypic hallmarks of stem cells. Human Molecular Genetics. 17 (21), 3411-3425 (2008).
- Greenberg, J. H., Seppa, S., Seppa, H., Hewitt, T. Role of collagen and fibronectin in neural crest cell adhesion and migration. Developmental Biology. 87 (2), 259-266 (1981).
- Leung, A. W., et al. WNT/β-catenin signaling mediates human neural crest induction via a pre-neural border intermediate. Development. 143 (3), 398-410 (2016).
- Zhu, Q., Lu, Q., Gao, R., Cao, T. Prospect of Human Pluripotent Stem Cell-Derived Neural Crest Stem Cells in Clinical Application. Stem Cells International. 2016, 7695836 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved