Method Article
신경 문장 세포 박리 및 이동의 연구를 위한 마우스에서 1 차적인 두개골 신경 문장 세포의 해부, 문화 및 분석
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 주로 세포 이동 연구를 위해 마우스 모델에서 두개골 신경 문장 세포의 해부 및 배양을 설명합니다. 우리는 사용된 살아있는 화상 진찰 기술 및 속도 및 세포 모양 변경의 분석을 기술합니다.
초록
지난 수십 년 동안 인간의 병리학을 모방하는 데 사용되는 유전자 변형 마우스 모델의 가용성이 증가했습니다. 그러나, 생체 내에서 세포 운동 및 분화를 연구하는 능력은 여전히 매우 어렵다. 신경 조직 병증, 또는 신경 문장 계보의 무질서는, 중요한 배아 단계의 접근성의 부족 및 인접한 중피 중간엽에서 신경 문장 중간엽을 분리하는 어려움 때문에 공부하기 위하여 특히 도전적입니다. 여기에서, 우리는 1 차적인 두개골 신경 문장 세포의 문화를 위한 잘 정의된, 일상적인 프로토콜을 설치하기 위하여 착수했습니다. 우리의 접근에서 우리는 초기 신경 문장 유도 단계 도중 마우스 신경 판 경계를 해부합니다. 신경판 경계 영역은 이식되고 배양된다. 신경 문장 세포는 신경 판 테두리를 둘러싼 상피 시트에서 형성하고, 24 h에 의해 이식 후, 박리하기 시작, 상피 - 중간엽 전환을 겪고 (EMT) 완전히 운동성 신경 문장 세포가 될. 우리의 2 차원 배양 접근 때문에, 명백한 조직 인구 (신경 판 대 premigratory 및 철새 신경 문장)는 쉽게 구별될 수 있습니다. 라이브 이미징 접근법을 사용하여 신경 문장 유도, EMT 및 철새 동작의 변화를 식별할 수 있습니다. 유전 돌연변이와 이 기술의 조합은 정상 및 병리학 신경 문장 세포 생물학을 이해하기위한 매우 강력한 접근 방식이 될 것입니다.
서문
신경 문장 (NC) 혈통은 초기 배아 발달1,2동안 척추동물에서 독점적으로 나타나는 세포의 일시적, 다능성 및 철새 집단이다. 신경 문장 유도체는 매우 다양하며, 신경교신경, 평활근, 멜라닌세포, 뉴런 및 두개안면 뼈 및 연골을포함하며 3,4. 신경 문장은 많은 기관 시스템의 기능에 기여하기 때문에,이 혈통은 인간의 배아 발생에 필수적입니다. 비정상적인 NC 발달은 가장 일반적인 인간 출생 결함 (즉, 갈라진 입술과 구개)의 넓은 범위에서 연루된다5,또한 히르츠프룽병과 같은 장애 (HSCR), 소장 버그 증후군 (WS), CHARGE 증후군 및 윌리엄스 증후군6 ,7,8,9.
NC 개발은 제노푸스,병아리 및 제브라피시 모델을 포함한 다수의 비 포유류 모델 시스템에서 탐구되었습니다. 포유류에서, 마우스 모형에 있는 일은 신경 문장 발달의 밑에 있는 중요한 유전 사건의 몇몇을 확인했습니다; 그러나, 마우스 배아의 접근성 때문에 신경 문장 이동의 세포 생물학을 따르는 것이 더 어려웠다 (다른 곳에서 검토10,11). 더욱이, 병아리, 제노푸스 및 제브라피시에 대한 연구가 NC에 대한 유전자 조절 네트워크를 확립하는 동안, 이러한 동물 모델에서 기능 연구의 손실은 때때로 마우스에서 유사한 표현형을 나타내지 않는다. 예를 들어, 제노푸,제브라피쉬 및 병아리에서 비정식 Wnt 시그널링은 NC가 철새 용량12,13,14,15를 획득할 수 있는 셀룰러 메커니즘 중 하나입니다. . 그러나 마우스에서 비표준 Wnt 신호의 손실은 마이그레이션16에영향을 미치지 않는 것으로 보입니다. 생체 내 NC 마이그레이션은 마우스에서 장기간 추적하기 어려웠기 때문에 이러한 종 차이가 다른 이동 모드를 반영하는지 또는 분자 조절의 차이를 반영하는지 여부는 불분명합니다.
언급했듯이, 마우스에 있는 NC 연구 결과는 태아의 전 자궁 배양이 힘들기 때문에 아주 도전적이었습니다. 또한, NC는 중두절제 및 신경절과 같은 인접 한 조직과 지속적으로 밀접한 접촉을 하고 있습니다. 신경 문장 특이적 Cre 드라이버 또는 외인성 염료의 최근 사용은 우리가 형광성으로 철새 NC를 표시 할 수 있게; 그러나 이러한 접근 방식은 여전히 제한적입니다. NC 마이그레이션17,18을시각화하기 위해 다양한 기술을 설명하는 여러 보고서에도 불구하고 이러한 기술을 간단하고 일상적인 절차로 해결하는 것은 어려웠습니다.
포유류 NC의 취급 및 특성화를 허용하는 기술이 필요하다는 것은 분명합니다. 우리는 인간의 두개안면 발달과 신경 병증을 연구하기위한 기본 모델이기 때문에 마우스 두개골 NC에 우리의 노력을 집중했습니다. 우리는 NC 세포19,20,21의1 차적인 배양을 기술하는 몇몇 흥미로운 보고에 근거를 둔 우리의 접근을 정제했습니다. 여기서, 우리는 1 차적인 NC 세포를 배식하기 위한 최적 배양 기술을 철저히 기술한다. 우리는 살아있는 세포 화상 진찰 방법 및 배양 판을 코팅하기 위하여 다른 행렬의 최적 사용을 설명합니다. 우리의 프로토콜은 다른 현미경과 함께 사용하기위한 지침으로 의도 된 반전 된 현미경을 사용하여 살아있는 NC 세포의 이동을 캡처하는 방법뿐만 아니라 세포 분석의 자세한 요약을 설명합니다.
이식에서 예상되는 결과는 현미경의 밑에 명확하게 구별되는 세포의 분포를 아름답게 배치해야 합니다, 여기서 하나는 (i) 신경 판, (ii) premigratory, 및 , (iii) 나타내는 세포의 3개의 다른 인구를 볼 수 있습니다 철새 신경 문장 세포. 우리는 상피 -중간엽 전이 동안 세포의 사전 이민 집단의 경계에서 세포 행동을 분석하는 방법을 보여줍니다. 우리는 또한 세포 속도, 거리 및 세포 형태에 대한 완전한 철새 세포를 연구하는 데 집중했습니다.
프로토콜
모든 동물 작업은 킹스 칼리지 런던 윤리 검토 프로세스에 의해 윤리적 승인을 받았으며 영국 홈 오피스 프로젝트 라이센스 P8D5E2773 (KJL)에 따라 수행되었습니다.
1. 시약의 준비
- 멸균 인산완충식염수(PBS), 70% 에탄올, 해부도구(집게 및 해부날 또는 멸균 바늘), 플라스틱 플레이트 또는 시판성 외 매트릭스로 코팅된 유리 슬라이드를 포함한 일반 솔루션 및 도구를 준비하십시오. ECM)-기반 하이드로겔 또는 피브로넥틴(재료 표참조), 신경 문장 매체(아래 참조).
- 덜베코의 변형 된 독수리 배지 (DMEM, 4500 mg / L 포도당), 15 % 태아 소 혈청 (FBS), 0.1 mM 최소 필수 배지 비 필수 아미노산 (MEM NEAA 100X), 1 mM 나트륨 피루바테, 55 μM-mercaptoe를 사용하여 신경 문장 기저 배지를 준비하십시오. 단위 /mL 페니실린, 100 단위 / mL 연쇄상 구균, 2 mM L-글루타민.
- 성장 억제 STO 피더세포(21)를사용하여 하룻밤 동안 미디어를 컨디셔닝한다.
- 10% FBS 및 100 U/mL 페니실린, 100 U/mL 스트렙토마이신으로 보충된 DMEM을 함유하는 STO 세포(재료 표참조) 매체를 준비한다. 0.1% 젤라틴으로 코팅된 25 cm2 플라스크에 합류하도록 STO 세포를 성장시키고 확장합니다. 감마 조사 5000 래드를 적용하십시오.
- 종자 약 3 x 106 성장 억제 세포를 10 cm2 접시 또는 25 cm2 플라스크 위에 (단계 1.2.1.1로부터). 신경 문장 기저 배지의 약 10-12 mL를 추가하고 밤새 배양.
참고: 시드 세포를 사용하여 최대 10일 동안 조건부 배지를 생성할 수 있습니다. 정기적으로 세포의 모양을 확인
- 배지(0.22 μm 기공 크기)를 걸러내고, 25 ng/mL 기본 섬유아세포 성장 인자(bFGF) 및 백혈병 억제제 인자 1000U(LIF)를 보충한다.
참고: 4°C에서 보관하고 한 달 이내에 사용하거나 -20°C에서 보관하고 3개월 이내에 사용하십시오.
- 성장 억제 STO 피더세포(21)를사용하여 하룻밤 동안 미디어를 컨디셔닝한다.
- 세포 외 매트릭스로 조직 배양 표면을 코팅하십시오.
참고 : 생물학적 질문에 따라 매트릭스는 유리 바닥 배양 접시, 플라스틱 조직 배양 접시 또는 유리 커버 전표에 코팅 될 수 있습니다. 매트릭스 기판에 의존하는 상이한 ECM 기반 하이드로겔 희석은 아래를 참조하십시오. Fibronectin은 유리 바닥 접시에 테스트 되었습니다 및 아래 명시된 농도에서만 전표를 커버. 여기서, 우리는 "코팅 플레이트"로 기판 코팅 표면을 참조합니다.- ECM 기반 하이드로겔로 조직 배양 표면을 코팅합니다.
참고: 매체를 냉각하거나 얼음을 유지하여 도금될 때까지 기판을 차갑게 유지하십시오.- 하이드로겔을 밤새 4°C에서 해동합니다. 최종 부피가 10 mL(재료 표참조)에 대해 DMEM에 10% FBS 5mL를 하이드로겔 5mL에 추가합니다.
- 0.5-1 mL aliquots를 편리하고 -20 °C에 보관하십시오.
- 얼음에 하이드로겔 알리쿼트해.
- 하이드로겔 스톡을 1:20 희석하여 플라스틱코팅합니다.
- 하이드로겔 스톡을 1:5 희석하여 유리 슬라이드와 유리 바닥 조직 배양 판을 코팅합니다.
참고: 차가운 DMEM에 하이드로겔을 희석합니다. - 희석된 하이드로겔을 충분히 바르면 원하는 부위를 접시/슬라이드에 덮고 37°C에서 30-45분 동안 배양합니다.
- 코팅된 플레이트/슬라이드를 즉시 사용하거나 코팅된 슬라이드를 밤새 4°C에서 보관하십시오.
- 사용하기 전에 과잉을 제거하고 높은 포도당 DMEM (선택 사항)으로 슬라이드를 헹구십시오.
- 섬유넥틴으로 조직 배양 표면을 코팅합니다.
- 1 mg/mL 피브로넥틴 스톡 용액의 알리쿼트를 만들고 -80°C에 보관하십시오. 덜베코의 PBS(dPBS)로 피브로넥틴을 1 μg/mL의 최종 농도로 희석합니다.
- 원하는 부위를 커버하기 위해 충분한 피브로넥틴을 바르고 실온에서 15분 동안 배양합니다.
- 잔류 피브로넥틴을 제거하고 유리가 30-45분 동안 건조되도록 합니다.
- 사용하기 전에 우물을 헹구거나 높은 포도당 DMEM(선택 사항)으로 전표를 덮어주세요.
- ECM 기반 하이드로겔로 조직 배양 표면을 코팅합니다.
2. 1일차: 조기 소미트 단계 배아 의 해부
참고: 멸균 도구와 멸균 용액을 사용하십시오. 지질 형질 분석이 필요한 경우 DNA 추출을 위해 배아의 시체를 수집하십시오.
- 두개골 신경판의 해부는 8.5 일 후 coitum (dpc)에서 배아로 제한됩니다. 5-8 소미트 단계에서 배아를 선택하십시오. 자궁을 PBS로 해부하고 각 배아를 분리하기 위해 메소메움을 잘라냅니다(그림 1A). 자궁의 근육 벽이 수축하고 데시탈 조직이 보이게됩니다(그림 1B).
참고 : 해부가 한 번에 하나의 배아를 수행하는 동안 얼음 차가운 PBS에서 자궁에서 배아를 유지합니다. 유리 파스퇴르 피펫으로 배아를 신선한 멸균 PBS로 옮겨 가시성을 높이고 오염을 줄입니다. - 근육 층과 데시듀얼 조직 사이에 집게를 밀어 내고 두 번째 집게 쌍으로 근육 층을 제거합니다(그림 1C).
- 집게를 사용하여 메소메심 극의 가장자리에 데시두움을 관통하고 두 번째 포셉 이 찢어서 기둥에 수직으로 열립니다.
- 집게로 데시추 조직을 벗겨 내어 라이허트의 막을 시각화합니다.
- 라이허트의 막을 조심스럽게 제거하십시오. 내장 노른자 낭이 보이고 배아를 내부에서 볼 수 있습니다(그림 1D).
- 내장 노른자 낭과 양막(도1E)을제거하고 머리 접기를 가시화하기 위해 배아를 위치시다(도1F).
- 머리를 심장 위로 접어서 집게 및/또는 속눈썹 도구를 사용하여 기본 중두질을 긁어 내어 깨끗한 신경판(NP)(그림1H)을얻습니다.
참고: NP는 각 면을 개별적으로 도금할 수 있도록 전방 축전체를 유지하거나 분할할 수 있습니다. 신경 판 경계는 이식에 대한 신경 기여도를 최소화하기 위해 신경 판에서 더 멀리 다듬을 수 있습니다. - 유리 파스퇴르 피펫을 사용하여 해부된 신경판을 컨디셔닝된 신경 문장 매체로 채워진 하이드로겔 코팅 접시에 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮기자.
- 접시를 부드럽게 돌리면 NP가 우물 한가운데에 놓이게 됩니다. 이것은 살아있는 세포 화상 진찰을 위한 위상 질을 최대화하기 위해 중요합니다 (2일째).
- 5%CO2에서37°C에서 하룻밤(또는 원하는 시간 점)으로 배양합니다. 신경 문장 세포는 신경 판에서 눈에 띄게 마이그레이션되어야 합니다.
참고 : 세포는 일반적으로 6-8 시간 이내에 부착됩니다. 이식이 연결된 후 마이그레이션 셀을 시각화하는 데 더 많은 시간을 할애합니다. 일반적으로 24 시간 후 이식에 의해, 우리는 세포의 세 가지 구별 인구를 찾을 수 있습니다. 첫 번째 인구는 이식의 중심에 신경판 (NP)입니다. 두 번째 인구, 사전 이민 NC (pNC), 세포의 상피 시트에 NP를 둘러싸고. 세 번째 인구는 외부 고리에서, 크기가 크고 완전히 중간 엽으로 나타나는 철새 NC (mNC)로 형성됩니다(그림 2).
3. 일 2: 뮤린 두개 신경 문장 세포의 살아있는 세포 화상 진찰
참고: 이미징은 24시간 후 심형래에서 최적으로 이미지를 하고 신경 문장 세포 이동을 정량화해야 합니다. NC 유도 매체는 라이브 셀 이미징 전에 새로 고칠 필요가 없습니다. 전동 단계와 통합 된 환경 챔버가있는 반전 된 현미경에 대한 액세스가 필요합니다. 이미징에 적합한 멀티 웰 조직 배양 접시를 사용하십시오(재료 표).
-
현미경 설정
- 환경 챔버를 37 °C 및 5 %CO2로설정합니다.
- CO2가습 챔버에 연결된 CO2 바늘이 플레이트 내에 앉을 수 있도록 조직 배양 플레이트 뚜껑의 뚜껑에 구멍을 뚫습니다.
- 조직 배양 접시를 시편 홀더에 넣고 플레이트 뚜껑과 CO2 바늘아래로 테이프를 내려 다중 웰 획득 시 흔들림을 방지합니다.
- 현미경 컨트롤러, 스테이지 컨트롤러 및 이미징 소프트웨어를 켭타.
- 10배 배율로 두개골 NC 세포에 초점을 맞춥니다(선택한 응축기의 상 링 일치).
- 현미경 설정 매뉴얼에 명시된 필드 홍채 다이어프램, 조리개 조리개 조리개 다이어프램 및 센터링 망원경을 조정하여 현미경에서 고품질 위상 대비를 설정합니다.
-
위상 대조 라이브 셀 이미징
- 시간 경과 파일이 저장될 디렉토리 또는 파일 위치를 설정합니다.
- 노출 시간, 비닝 및 카메라 영역을 설정합니다.
- 시간 점 수, 이미징 지속 시간 및 프레임 간 시간 간격을 설정합니다.
- NC 세포 철새 용량을 정량화하려면 현미경을 10배 배율로 설정하고 5분마다 1프레임(18시간 이상 217시간)을 차지합니다. 셀 형태를 정량화하려면 배율을 40x로 설정하고 1 프레임/분(1시간 동안 61시간)을 차지합니다. 라멜리포디얼 역학을 정량화하려면 배율을 40x 또는 60배 배율로 설정하고 10초마다 1프레임(10분 이상)을 차지합니다.
- 다중 웰 이미징의 경우 선택한 XY 위치 간에 이동하도록 기계적 단계를 설정합니다. 두개골 NC 세포가 초점이 맞고 스테이지 위치가 올바른지 확인합니다.
- 획득 명령을 사용하여 시간 경과 이미징을 시작합니다.
- 타임랩스 이미징이 완료되면 다차원 데이터를 검토하고 .stk 파일을 내보내 분석을 위해 내보냅니다.
참고: .stk는 TIFF 스택 파일입니다. - 소프트웨어를 종료하고 컴퓨터를 종료하고 스테이지, 카메라 및 현미경 컨트롤러를 끕니다.
4. 이미징 분석 : 신경 문장 세포 이동의 정량화
참고: 뮤린 두개골 신경 문장 세포를 마이그레이션하여 나타나는 세포 행동을 더 잘 정의하기 위해, 우리는 특히 철새 용량 및 세포 모양 역학에 초점을 맞춘 일련의 정량화 가능한 철새 매개 변수를 분석했습니다. (1) 이동(누적 거리)은 셀(μm)에 의해 취해진 총 경로 길이이다. (2) 이동 (유클리드 거리)는 세포의 초기 위치와 최종 위치 사이의 직선 거리 (μm); (3) 이동 (셀 속도)은 시간 단위 당 셀로 이동 거리 (μm / min); (4) 셀 모양(셀 영역)은 셀로 덮인 총 표면입니다. 이미징 현미경에 따라 픽셀을 미크로넨 규모로 설정합니다. (A =px x Npx, 여기서Px = 픽셀 영역 및 Npx = 픽셀 수입니다. 단위: μm2; (5) 셀 모양(cell Circularity)은 A = 영역 및 P = 둘레가 있는 1.0(4π(A/P2))의 원형 값으로 표시되는 완벽한 원으로부터의 셀 형상의 편차입니다.
-
단일 셀 추적
참고: NC 셀 마이그레이션을 측정하기 위해 모든 시간 경과 프레임에서 개별 셀의 XY 좌표가 생성됩니다. 이를 통해 세포 이동의 거리, 속도 및 지속성 측정값을 후속 분석할 수 있습니다.- ImageJ를 열고 데이터를 TIFF 스택 파일로 가져옵니다.
- 분석 | 클릭 픽셀/μm에서 작동하는 현미경 설정에 따라 .stk 파일을 보정하도록 배율을 설정합니다.
- 플러그인을 클릭합니다 | 추적 | 수동 추적을 열어 이미지 J 수동 셀 추적 플러그인. 셀 추적을 시작하려면 트랙 추가를선택합니다.
- 핵을 기준점으로 사용하여 시간 경과 동영상의 모든 프레임을 통해 세포를 추적합니다.
참고: 10-20개의 셀은 이식당 추적되어야 하며 총 60개의 셀이 추적되어야 합니다(n = 3). 시간 경과의 과정 동안 세포 분열을 겪는 세포는 분석에서 제외되어야 합니다. - 결과를 저장하고 .csv 파일로 내보냅니다. 결과는 모든 프레임에 걸쳐 개별 셀 트랙 번호, 슬라이스 번호 및 XY 좌표를 나타냅니다.
-
신경 문장 세포 철새 용량의 정량화
- 단일 셀 추적 데이터를 엽니다(위 참조). .csv 파일을 .txt 파일 형식으로 변환합니다.
- 마이그레이션 소프트웨어(재료 표)를엽니다. 데이터 가져오기 탭을 클릭하여 셀 추적 데이터를 .txt 파일로 가져옵니다.
- 데이터 집합 에서 | 초기화,분석할 슬라이스 또는 프레임 수를 선택하고 프레임 간 XY 보정 및 시간 간격을 설정합니다. 설정을 저장하려면 설정 적용을 선택합니다.
- 도표 데이터 기호를 선택하여 궤적 플롯을 형성합니다. 거리 및 속도 측정값을 정량화하려면 통계 기호를 선택합니다.
- 궤적 플롯을 비트맵(.bmp) 파일로 저장하고 거리 및 속도 측정값을 .txt 파일로 저장합니다. 데이터 제거 기호를 선택합니다. 다른 시간 경과 파일에 대해 반복합니다.
참고: 궤적 플롯은 시간 경과 동영상의 과정을 통해 주어진 셀 상태 또는 상태에 대한 개별 셀 경로의 지시성을 시각화하는 데 사용할 수있습니다(그림 4A). 그런 다음 .txt 파일에 저장된 거리 및 속도 데이터를 추가 분석에 사용할 수 있습니다.
-
신경 문장 세포 영역 및 원형의 정량화
- ImageJ에서 시간 경과 .stk 파일을 열고 픽셀 / μm에서 작동하는 현미경 설정에 따라 보정하십시오.
- 분석 중 | 측정 설정,셀 모양 매개 변수(셀 영역, 둘레 및 모양 설명자)를 클릭하여 선택합니다.
- 자유형 선택 도구를 사용하여 셀 멤브레인 경계를 가이드로 사용하여 각 셀 주위를 수동으로 그립니다.
- 키보드의 Ctrl + B 키를 눌러 이미지의 셀 윤곽선을 오버레이합니다. 각 시간 경과 프레임에서 셀에 대해 반복합니다.
- 이미지 사용 | 오버레이 | 값을 저장하는 ROI 관리자에게.
- 프레임당 관심 셀의 모든 윤곽이 요약되면 측정을클릭합니다. 결과를 .csv 파일로 저장합니다.
참고: 동영상당 10-20개의 셀을 개략해야 하며, 조건당 총 30~60개의 셀이 분석되어야 합니다(n = 3). 셀 모양 데이터(.csv 파일)는 셀 형상 역학이 시간이 지남에 따라 어떻게 변화하는지(그림4C)또는 다른 세포 치료하에 형태가 어떻게 변경될 수 있는지를 정량화하는 데 사용할 수 있습니다.
결과
여기에서 입증된 절차를 사용하여, 마우스 배아를 자궁에서 해부하고, 엑스트라 배아 조직을 제거하였다(도1A-D). 배아는 소미트(5-8 somites(ss), 도 1E,F에서배아만을 사용하여 단계화하였다. 두개골 신경 판은 그 때 해부되고 신경 상피는 격리되었습니다. 중피, 느슨한, 원형, 중간 엽 세포로 확인, 부드럽게 닦아 했다(그림 1G-L). 전방 신경판은 전체를 이식할 수 있으며, 이 경우 신경 문장 조직이 측면으로 출현하여 이식 주위로 방사형으로 확장되거나 각 신경판 경계(오른쪽및 왼쪽)를 별도로 이식할 수 있습니다. 이것은 유전 돌연변이에서 이식할 때 특히 유용합니다.
24 시간 이내, premigratory의 영역 (상피) 두개골 신경 문장은 명확하게 신경 판 이식 을 둘러싼 볼 수 있습니다(그림 2B). 더욱이, 신경 문장 세포의 소집단은 중간엽 전이를 상피로 겪고 완전히 중간엽으로나타난다(그림 2). 따라서, 우리는 중앙에 신경판 (NP) 및 중간 원에 있는 premigratory 신경 문장 (pNC) 및 외부 반지에 있는 철새 신경 문장 (mNC)의 인구와 함께, 별개의 세포의 몇몇 동심 고리를 가지고 있습니다(그림 2B). NC 세포를 추적하기 위해, 우리가 그림 2C에도시 된 바와 같이 유전자 변형 마우스 모델을 사용할 수있다. 이 경우, 우리는 신경 문장 특정 Wnt1을 사용했습니다::Cre; NC 세포가 녹색으로 표지되는 결과 로사 mTmG. 이들 마우스에서, 세포는 Cre 재조합아제(Cre recombinase)를 발현하지 않는 한 막 토마토(mT, 적색)를 발현한다. 재조합은 막 녹색 형광 단백질을 발현하는 세포로 이어집니다 (GFP, 녹색). 이식의 중심에 표시된 적색 세포는 신경판 세포입니다. 일부 등쪽 신경 판 세포는 또한 GFP를 발현; 장기 배양을 위해, 우리는 중앙에 있는 모든 세포를 절제할 것입니다. 우리의 목적을 위해, 이식의 순도는 다른 신경 문장 세포 집단을 추적하기에 충분하다. 신경 문장의 더 높은 순도가 필요한 곳에, 이 유전 표지 전략은 인구의 순도를 지키기 위하여 형광 활성화 세포 분류 (FACS)와 결합될 수 있습니다. 대안적으로, 이식을 고치고 항체 라벨링을 통해 NC 집단을 식별할 수 있다.
또한 24h에 의해 이식 배양물의 선제 및 완전 이동 NC 세포의 특징적인 동심고리가 매트릭스 선택에 의해 의존하거나 지배되지 않았다는 것이분명했다(도 3). ECM 계 하이드로겔 및 피브로넥틴 둘 다에 도금된 배양 배양배양체는 3개의 세포 집단, NP, pNC 및 mNC를 포함하는 유사한 이식 구조를 형성하였다(그림3A,C). 신경 문장 세포 형태는 또한 ECM 계 하이드로겔 및 피브로넥틴상에 도금된 이들 사이에서 도금된형태(도 3B,D)와비교되었다. 그러나, 피브로넥틴에 도금된 이식은 세포 선두 가장자리에서 더 두드러진 라멜리포디아를 가진 세포를 생산하, 겉보기에 더 편광된 이동의 방향으로(그림 3B,D).
일단 철새 신경 문장 세포의 인구가 명백해지면, 살아있는 세포 화상 진찰은 완료될 수 있습니다. 시간 경과 현미경 검사는 NC 세포 이동의 후속 분석을 위해 10 배배 (18 시간, 1 프레임 / 5 분)로 설정됩니다(그림 4A). ImageJ 수동 추적 플러그인은 시간 경과 동영상의 모든 프레임에 걸쳐 개별 셀의 XY 좌표를 생성합니다(그림4B). 이러한 좌표는 마이그레이션 소프트웨어를 사용하여 처리할 수 있습니다. 이 소프트웨어는 시간에 따라 개별 셀 트랙의 시각화를 가능하게(그림 4B)축적 및 유클리드 거리뿐만 아니라 세포 속도를 정량화하는 데 사용할 수 있습니다.
타임랩스 이미징 데이터는 또한 두개골 신경 문장 세포의 이동 동안 세포 형태에 대한 풍부한 정보를제공한다(그림 4C). 개별 세포막을 개략적으로 설명함으로써, 세포면적 및 둘레 측정은 영화의 모든 프레임으로부터 계산될 수있다(도 4C). 이러한 측정은 세포 영역 및 원형의 후속 정량화를 허용합니다(도4D). 그림 4C는 18시간 이상 세포 모양 변화에 대한 분석을 보여줍니다. 세포가 이식에서 멀어질수록 세포 순환도가 상대적으로 일정하게 유지되는 동안 세포 영역이 크게 증가한다는 점에 유의하십시오(단방향 ANOVA, Tukey의 다중 비교 테스트)( 그림 4E,F). 이것은 세포가 상피 가장자리에서 출발하고 세포 세포 접촉을 분실할 때, 증가한 세포 퍼짐 지역을 보여주기 때문에 건의합니다. 세포 순환 측정은 시간이 지남에 따라 크게 변경되지 않았습니다. 그러나 증가된 시간 포인트 수를 정량화하면 순환성의 단기적인 변화가 나타날 수 있습니다. 세포 순환 측정은 또한 화학 적 큐의 존재 또는 제한된 조건 하에서 세포 모양 역학에 대한 흥미로운 데이터를 제공 할 수 있습니다.
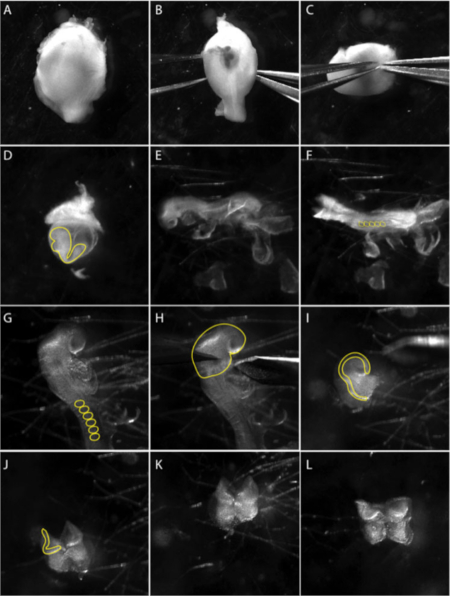
그림 1: e8.5 배아로부터 두개골 신경 문장 의 분리.
이미지는 미세 해부 기술을 문서화하는 비디오의 스틸 이미지입니다. (A-C) 자궁에서 배아의 해부. (B-C) 두 개의 날카로운 집게를 사용하여 근육 층을 부드럽게 분리합니다. 패널(D)은 내장 노른자 낭(노란색 선) 내부에 배아를 나타낸다. 내장 노른자 낭에서 배아를 추출합니다. (E) 단계 8.5 측측에서 배아의 측면 보기. (F) 단계 8.5에서 배아의 등쪽 보기. 배아의 나이를 결정하기 위해 소미트 (ss)를 계산합니다. 일반적으로 5-8 ss (F의 노란색 원). (G) 배아의 두개골 부위를 자세히 살펴본다. 두개골 영역에서 엑스트라 배아 막을 제거; 소미는 노란색 선으로 표시됩니다. (H) 전방 신경판의 해부는 제1 분기 아치(노란색 선)에서 수행된다. (I) 전방 신경판 해부의 측면 도면. 신경 문장 세포가 발생하는 신경 주름은 노란색 선으로 표시됩니다. (J-L) 준비된 배양 접시에 NP를 도금하기 전에 가능한 한 전방 신경 주름을 기본 중피 조직 (푹신한 중간 엽 세포)을 제거하십시오. 영화는 3.0배 줌에서 광시야 식형 렌즈를 사용하여 촬영한 것입니다(재료 표참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
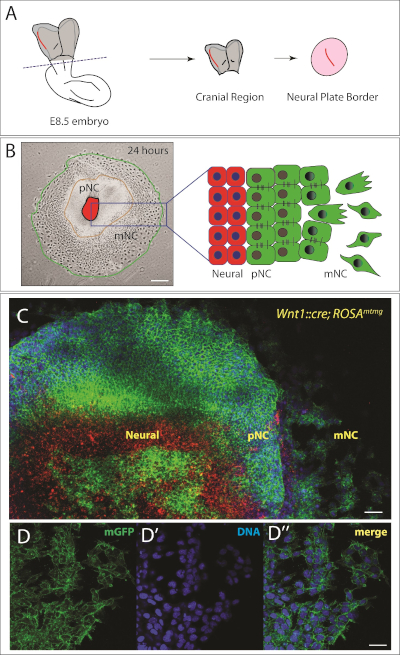
그림 2: 뮤린 두개신경 문장 이식.
(a) e8.5 마우스 배아의 등쪽 뷰의 개략적 표현. 배아의 두개골 부위는 파선에서 절단됩니다. 신경판 경계 (빨간색으로 강조 표시)는 주변 중두체 조직으로부터 분리되고 두개골 신경 문장이 이주할 수 있도록 24 시간 동안 배양됩니다. 도식은 22,23에서적응. (B) 왼쪽: 도금 후 24시간 동안 두개골 신경문장을 배란한 대표적인 밝은 필드 이미지. 세포의 3개의 인구는 또한 오른쪽에 schematized 관찰됩니다. NP = 신경판, pNC = 철새 전 신경 문장 및 mNC = 철새 신경 문장. 배율 막대 = 250 μm. (C) 유전적으로 표지된 마우스로부터 배란된 더 높은 배율이미지(Wnt1::cre; 로사mTmG). Cre 드라이버가 없는 세포는 적색으로 막 토마토(mT)를 발현한다. 신경 문장 특이적인 Wnt1 프로모터의 제어 하에 Cre의 발현은 mT 카세트의 절제 및 녹색막 GFP(mG)의 발현을 유도한다. 핵은 Hoescht (파란색)으로 염색됩니다. 스케일 바 = 200 μm. (D-D') 멤브레인 GFP (D)를 발현하는 철새 세포의 더 높은 배율 이미지. (D') DNA는 Hoescht (파란색)로 표시되어 있습니다. (D') D와 D'의 병합. 배율 표시줄 = 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
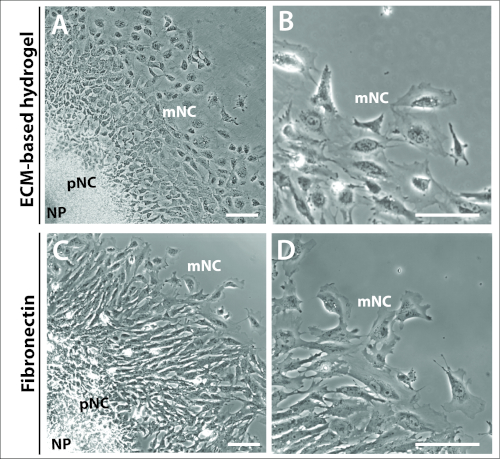
그림 3: 다른 기판상에서 배양된 이식.
(A-B) 상용 ECM-하이드로겔상에서 배양된 이식의 위상 대비 이미지. (C-D) 1 μg/mL 피브로넥틴에 배양된 식물. 신경판(NP), 사전(pNC) 및 철새(mNC) 신경 문장 세포는 그들의 상이한 세포 형태에 의해 구별될 수 있다. 배율 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
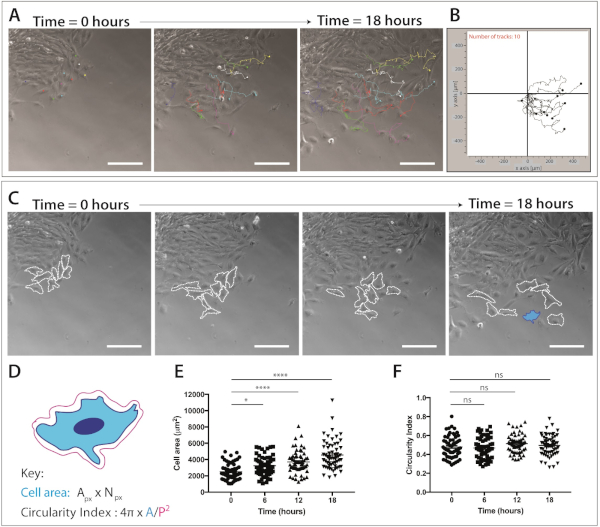
그림 4: 두개골 신경 문장 세포 이동 및 세포 모양 역학의 정량화.
(A) ImageJ/Fiji 수동 셀 추적 플러그인을 사용하여 단일 신경 문장 세포 트랙으로 중첩된 이식 배양물의 시간 경과 이미징에서 단계 대비 프레임. 10개의 대표 mNC 셀은 18시간(217프레임) 및 XY를 수동으로 추적했습니다. 좌표를 내보냈습니다. 데이터는 오버레이 점과 선 도표로 표시됩니다. 세포를 1 μg/mL 피브로넥틴에 도금하였다. 배율 막대 = 200 μm. (B) 마이그레이션 소프트웨어를 사용하여 생성된 10mNC 셀의 대표적인 궤적 플롯. (C) 이식 배양의 시간 경과 분석에서 가져온 위상 대비 프레임. 파선은 1 μg/mL 섬유넥틴에 도금될 때 세포 모양 역학을 위해 분석된 8개의 대표적인 철새 신경 문장 세포를 윤곽을 그었다. 배율 막대 = 200 μm. (D) 셀 면적 및 원형을 정량화하는 데 사용되는 계산의 개략적 표현. 회로도의 세포 형태는 파란색(C)으로강조 표시된 셀의 형태입니다. px = 픽셀 영역, Npx = 픽셀 수, A = 영역, P = 둘레 (1 픽셀 = 1.60772 μm2). (E-F) 시간이 지남에 따라 세포 영역 및 세포 순환 측정의 정량화. 데이터는 평균 ± SEM을 나타낸다. 각 도트는 3개의 독립적인 실험으로부터 가져온 하나의 셀(n=60)을 나타내고, 0h, 6h, 12h 및 18시간(ns 비유의, * p&0.05, **** p < 0.0001 편도 ANOVA, Tukey의 다중 비교 시험)에서 분석하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
포유류 신경 문장 세포를 공부하는 것은 포유류 발달의 자궁 특성 때문에 과학자들에게 도전이었습니다. 생체 내 연구는 태아가 자궁에서 의 생활을 모방하는 조건하에서 조작되어야 하기 때문에, 설치하기 어렵습니다. 실제로, 특히 살아있는 화상 진찰을 위해 24 시간 이상 동안 이 (E8+) 배아를 재현하는 것은 거의 불가능합니다. 더욱이, 신경 문장 유도 및 이동은 마우스에 있는 신경관 폐쇄 및 배아 선회와 동시에 생깁니다; 이것은 배아가 전 자궁을배양할 때 자주 실패하는 결정적이고 스트레스가 많은 형태 유전학 사건입니다. 따라서, 전 자궁 접근법의 성공률은 일반적으로 낮다. 불멸화된 NC세포(21)의 사용은 동물 사용을 감소시키는 유용한 도구이며 장기 분석, 형질전환 및 농축 연구를 위한 신경 문장 세포의 더 나은 공급원을 제공할 수 있다. 그러나, 1차 신경 문장 세포를 안정적으로 배양할 필요성이 명백히 존재한다. 우리의 방법은 마우스 녹아웃 또는 조건부 유전 모델에 적용 할 수 있습니다. 우리의 비교 가능한 방법은 다른 신경 문장 인구에 대해 설명되었다20; 그러나, 우리의 방법은 철저하게 뮤린 두개골 NC 세포의 단계별 격리를 설명합니다. 또한 다른 행렬의 사용과 마이그레이션 분석 절차에 대해서도 자세히 설명합니다.
일관된 결과를 달성하기 위해, 우리는 배아의 선택 중에 준비쪽으로 특별한주의를 기울였다는 것을 발견했습니다. 당연히, somites의 수는 두개골 NC 발달에 있는 다른 단계와 상관관계가 있습니다. 따라서, 배아 해부학의 지식은 어떤 실험적인 데이터를 취득하기 전에 아주 중요합니다. 이 접근은 그 때 생물학 질문 및 표적 세포에 따라서 신경 문장 세포의 분리인구를 격리하는 쪽으로 적응될 수 있습니다.
일단 배아가 선택되고 해부되면, 중피 세포는 쉽게 구별될 수 있고 더 나은 시각화를 허용하고 오염을 감소시키기 위하여 제거되어야 합니다. 장기 배양을 위해, 신경 판 조직은 신경 조직에 의한 오염을 방지하기 위하여 도금의 24 시간에서 제거될 수 있습니다. 또 다른 개선은 형광 계보 라벨링의 사용일 수 있습니다 (예를 들어, Wnt1::cre 또는 Sox10::creERT 드라이버를 형광 기자와결합하여 24,25)신경 문장 세포와 구별할 수 있습니다. 그림 2C에표시된 다른 조직.
이전 보고서는 상용 ECM 하이드로겔, 피브로넥틴 및 콜라겐 I에서 가장 일반적으로 다른 매트릭스에 마우스 NC 배양 배양의 잠재력을 강조했다20,21,26. 우리의 손에, 마우스 두개골 NC 배원 배양성공적으로 원래 보고서에 지정된 농도에서, 세 개의 행렬에 성장 (데이터는 표시되지 않음). 우리가 우리의 NC 배양 문화에 적응 초기 정제 된 접근 방식은 주로 라미닌과 콜라겐으로 구성된 선택의 매트릭스로 상용 하이드로 겔을 사용21(그림 3A-B). 그러나, 이 하이드로겔의 조성물은 알 수 없는 성장 인자 및 단백질 함량을 명확하게 정의하지 않는다. 이와 같이, 우리는 이후 섬유넥틴에 마우스 NC 배양 배양에 우리의 접근 방식을 이동 (그림 3C-D). Fibronectin잘 정의 하 고 높은 ECM 및 NC 세포 마이그레이션을 따라 지하실 막에서 발현in vivo28,29,30. 하이드로겔을 사용하여 볼 수 있듯이 신경 문장 세포 이동 및 형태를 가장 잘 복제하는 섬유넥틴 매트릭스를 최적화하기 위해 하이드로겔에 나타난 NC 세포 거동을 0.25-30 μg/mL 섬유넥틴의 적정에 대해 비교하고 1 μg/mL fibronectin을 정의했습니다. 이상적인 속성 제공(표시되지 않은 데이터). 우리는 이 예비 작업이 이전에 설명한 것과, 즉 콜라겐과 라미닌에 대하여, fibronectin와 같은 매트릭스의 체계적인 비교를 위한 틀을 설치하는 것을 도울 수 있다고 믿습니다32,33,34. 콜라겐-IA1이 마우스, 조류 및 인간 NC 세포에 의해 내인성으로 분비된다는 점을 감안할 때, 섬유넥틴과 콜라겐 I에 대한 마우스 NC 세포 철새 용량을 비교하는 것은 특히 흥미로웠을 것입니다.28,30,31,32. 따라서 콜라겐 I은 매트릭스 선택을 고려하여 피브로넥틴과 관련이 있다. 또한 미디어의 성장 인자의 생체 이용률은 특히 우리 미디어의 높은 혈청 함량을 감안할 때 다른 매트릭스 성분에 의해 변경 될 수 있음을 인정 할 가치가 있습니다. 이를 극복하기 위해, 우리는 현재 무혈청 정의 배양 조건을 생산하기 위해 노력하고 있습니다. 이러한 정의된 배지는 다능성 줄기 세포 분야에서 신경 문장 유도 프로토콜에 성공적으로 사용되지만 NC 이식 배양 시스템에 대한 추가 최적화가 필요합니다.33,34. 우리의 일은 또한 심장과 트렁크 NC와 같은 NC 세포의 그밖 모형을 위한 조건을 정제하고, NC 분화의 후속 연구 결과를 위한 출발점으로 봉사할 수 있습니다. 가장 중요한 것은, 이 프로토콜은 다양한 응용에 대한 두개골 NC 세포의 분리를 허용한다. 우리는 지시 된 마이그레이션, 3-D 마이그레이션 및 침략에 대한 연구를 구상합니다. 이러한 방식으로 단리된 세포는 치료할 수 있습니다.in vitro여러 분석에 사용할 수 있습니다. 예를 들어, 세포는 특정 단백질을 표적으로 하기 위하여 다른 작은 분자를 사용하여 쉽게 취급될 수 있고, 정의된 시점에서 취급될 수 있고, 세척 실험은 세포 행동의 복구를 결정하기 위하여 디자인될 수 있습니다 (그림 4). 형질감염 및 분화 분석에 대한 장기 배양은 세포의 통과뿐만 아니라 가능하다(데이터는 도시되지 않음). 그러나, 생존 가능성, 세포 재생 및 다중 능력의 능력은 통과 후 검증되어야한다. 유리 커버립에 도금 된 세포는 또한 살아있는 화상 진찰에 따라 면역 형광 염색 프로토콜에서 사용될 수 있습니다. 마지막으로, 이 접근법은 유전 마우스 모델에서 NC의 이주를 연구하기 위한 대단히 강력한 시스템을 나타냅니다.22,23,24,25.
공개
저자는 이해관계의 충돌이 없습니다.
감사의 말
우리는 킹스 칼리지 런던 생물학 서비스 단위, 특히 티파니 자비스와 린지 캐쉬넬라의 지속적인 지원에 감사드립니다. 우리는 데릭 사원, 이시이 마모루와 로버트 맥슨이 프로토콜의 초기 설립 하는 동안 조언과 시약에 도움이 감사 합니다. 우리는 STO 세포의 감마 조사에 도움을 Dheraj Taheem 감사합니다. 우리는 리우와 크라우스 연구소, 특히 토미 팔레트에게 큰 도움을 주셔서 감사합니다. 이 작품은 BBSRC (BB / R015953 /1 KJL / MK), MRC 박사 교육 프로그램 (LD), 뉴 랜드 페들리 기금 (ALM) 및 KRIPIS II, 연구 및 종교 교육부의 사무 총장의 학생에 의해 지원되었다 업무, 그리스 와 산테 (SGGM에).
자료
| Name | Company | Catalog Number | Comments |
| bFGF | R&D systems | 233-FB | |
| b-mercaptoethanol | Gibco | 31350-010 | |
| Tissue culture flasks | Corning | 430639 | 25cm2 culture flasks |
| DMEM (4500 mg/L glucose) | Sigma | D5671 | |
| Dulbecco's phosphate-buffered saline (dPBS) | Sigma | D8537 | |
| Ethanol | Fisher Chemicals | E/0650DF/C17 | |
| Fetal Bovine Serum | Sigma | TFS AA 10-155 | |
| Fetal Bovine Serum (ES Cell FBS) | Gibco | 26140079/16141-079 | |
| Fibronectin bovine plasma | Sigma | F1141 | |
| Gelatin from bovine skin | Sigma | G9382 | |
| L-glutamine | Sigma | G7513 | |
| Glass-bottomed, multi-well 24-well tissue culture plate | Ibidi | 82406 | Glass-bottomed, No 1.5, 24-well tissue culture dish with black sides |
| Cell migration analysis tool | Ibidi | v2.0 | Manuals for this software can be found at: https://ibidi.com/manual-image-analysis/171-chemotaxis-and-migration-tool.html. |
| Circularity Plug-in | ImageJ | v1.29 or later | The circularity plug-in is an extended version of ImageJ/Fiji’s Measure command, designed by Rasband, W., (2000) (wsr@nih.gov). |
| LIF | ESGRO by Millipore | ESG1106 | |
| Manual Cell Tracking Plug-in | ImageJ | v1.34k or later | ref Cordelieres F. Institut Curie, Orsay (France) 2005 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| MEM non-essential aminoacids 100X | Gibco | 11140-050 | |
| Matrigel (ECM-based Hydrogel) | Corning | 356234 | |
| Microscope | Olympus | 1X81 | Olympus 1X81 inverted microscope |
| Microscope camera | Photometrics | 512B | Photometrics Cascadell 512B camera (4x UPlanFL N, 10x UPlanFL N, 20x UPlanFL N, 40x UPlanFL N objectives) |
| Microscope controller | Olympus | 1X2-UCB | Olympus 1X2-UCB microscope controller |
| Microscope temperature controller | Solent Scientific | RS232 | Maintained at 37°C |
| Penicillin/streptomycin | Sigma | A5955 | |
| Sodium Pyruvate | Sigma | S8636 | |
| Statistics software | Graphpad Prism | v7.0 | |
| STO feeder cells | ATCC | CRL-1503 | |
| Stereomicroscope | Nikon | SMZ | |
| XY microscope stage controller | Applied Scientific Instrumentation (ASI) | MS-4400 |
참고문헌
- Duband, J. L. Diversity in the molecular and cellular strategies of epithelium-to-mesenchyme transitions: Insights from the neural crest. Cell Adhesion & Migration. 4, 458-482 (2010).
- Mayor, R., Carmona-Fontaine, C. Keeping in touch with contact inhibition of locomotion. Trends in Cell Biology. 20, 319-328 (2010).
- Le Douarin, N., Kalcheim, C. . The neural crest. 2nd edn. , (1999).
- Trainor, P. A. . Neural Crest Cells : Evolution, Development, and Disease. , (2014).
- Jiang, R., Bush, J. O., Lidral, A. C. Development of the upper lip: morphogenetic and molecular mechanisms. Developmental dynamics : an official publication of the American Association of Anatomists. 235, 1152-1166 (2006).
- Ahola, J. A., et al. Increased incidence of Hirschsprung's disease in patients with hypoplastic left heart syndrome--a common neural crest-derived etiology?. Journal of Pediatric Surgery. 44, 1396-1400 (2009).
- Bajpai, R., et al. CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature. 463, 958-962 (2010).
- Inoue, K., et al. Congenital hypomyelinating neuropathy, central dysmyelination, and Waardenburg-Hirschsprung disease: phenotypes linked by SOX10 mutation. Annals of Neurology. 52, 836-842 (2002).
- Kim, H., Kang, K., Ekram, M. B., Roh, T. Y., Kim, J. Aebp2 as an epigenetic regulator for neural crest cells. PloS one. 6, e25174 (2011).
- Barriga, E. H., Trainor, P. A., Bronner, M., Mayor, R. Animal models for studying neural crest development: is the mouse different?. Development. 142, 1555-1560 (2015).
- Bronner, M. E., LeDouarin, N. M. Development and evolution of the neural crest: an overview. Developmental Biology. 366, 2-9 (2012).
- De Calisto, J., Araya, C., Marchant, L., Riaz, C. F., Mayor, R. Essential role of non-canonical Wnt signalling in neural crest migration. Development. 132, 2587-2597 (2005).
- Carmona-Fontaine, C., et al. Contact inhibition of locomotion in vivo controls neural crest directional migration. Nature. 456, 957-961 (2008).
- Matthews, H. K., et al. Directional migration of neural crest cells in vivo is regulated by Syndecan-4/Rac1 and non-canonical Wnt signaling/RhoA. Development. 135, 1771-1780 (2008).
- Banerjee, S., et al. A novel role for MuSK and non-canonical Wnt signaling during segmental neural crest cell migration. Development. 138, 3287-3296 (2011).
- Pryor, S. E., et al. Vangl-dependent planar cell polarity signalling is not required for neural crest migration in mammals. Development. 141, 3153-3158 (2014).
- Serbedzija, G. N., Bronner-Fraser, M., Fraser, S. E. Vital dye analysis of cranial neural crest cell migration in the mouse embryo. Development. 116, 297-307 (1992).
- Kawakami, M., Umeda, M., Nakagata, N., Takeo, T., Yamamura, K. Novel migrating mouse neural crest cell assay system utilizing P0-Cre/EGFP fluorescent time-lapse imaging. BMC Developmental Biology. 11, 68 (2011).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nature protocols. 6, 1568-1577 (2011).
- Ishii, M., et al. A stable cranial neural crest cell line from mouse. Stem Cells and Development. 21, 3069-3080 (2012).
- Gonzalez Malagon, S. G., Liu, K. J. ALK and GSK3: Shared Features of Neuroblastoma and Neural Crest Cells. Journal of Experimental Neuroscience. 12, 1179069518792499 (2018).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9, 1126 (2018).
- Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K., McMahon, A. P. Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Current Biology : CB. 8, 1323-1326 (1998).
- Laranjeira, C., et al. Glial cells in the mouse enteric nervous system can undergo neurogenesis in response to injury. Journal of Clinical Investigation. 121, 3412-3424 (2011).
- Pfaltzgraff, E. R., Mundell, N. A., Labosky, P. A. Isolation and culture of neural crest cells from embryonic murine neural tube. Journal Of Visualized Experiments : JoVE. , e4134 (2012).
- Sternberg, J., Kimber, S. J. The relationship between emerging neural crest cells and basement membranes in the trunk of the mouse embryo: a TEM and immunocytochemical study. Journal of Embryology and Experimental Morphology. 98, 251-268 (1986).
- Sternberg, J., Kimber, S. J. Distribution of fibronectin, laminin and entactin in the environment of migrating neural crest cells in early mouse embryos. Journal of Embryology and Experimental Morphology. 91, 267-282 (1986).
- George, E. L., Georges-Labouesse, E. N., Patel-King, R. S., Rayburn, H., Hynes, R. O. Defects in mesoderm, neural tube and vascular development in mouse embryos lacking fibronectin. Development. 119, 1079-1091 (1993).
- Henderson, D. J., Copp, A. J. Role of the extracellular matrix in neural crest cell migration. Journal of Anatomy. 191 (Pt 4), 507-515 (1997).
- Thomas, S., et al. Human neural crest cells display molecular and phenotypic hallmarks of stem cells. Human Molecular Genetics. 17 (21), 3411-3425 (2008).
- Greenberg, J. H., Seppa, S., Seppa, H., Hewitt, T. Role of collagen and fibronectin in neural crest cell adhesion and migration. Developmental Biology. 87 (2), 259-266 (1981).
- Leung, A. W., et al. WNT/β-catenin signaling mediates human neural crest induction via a pre-neural border intermediate. Development. 143 (3), 398-410 (2016).
- Zhu, Q., Lu, Q., Gao, R., Cao, T. Prospect of Human Pluripotent Stem Cell-Derived Neural Crest Stem Cells in Clinical Application. Stem Cells International. 2016, 7695836 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유