A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
النغمة القاعدية القاعدية القاعدية والاختبار السلبي للجهاز التناسلي للمورين باستخدام جهاز قياس ضغط
In This Article
Summary
استخدم هذا البروتوكول نظام موغرافي للضغط متاح تجارياً لإجراء اختبار الضغط على المهبل وعنق الرحم. باستخدام وسائل الإعلام مع وبدون الكالسيوم، تم عزل مساهمات خلايا العضلات الملساء (SMC) لهجة القاعدية والمصفوفة السلبية خارج الخلية (ECM) للأعضاء في ظل الظروف الفسيولوجية المقدرة.
Abstract
وتتألف الأعضاء التناسلية الأنثوية، وعلى وجه التحديد المهبل وعنق الرحم،من مكونات خلوية مختلفة ومصفوفة فريدة من نوعها خارج الخلية (ECM). تظهر خلايا العضلات الملساء وظيفة تقلصداخل جدران المهبل وعنق الرحم. اعتمادا على البيئة البيوكيميائية والتفكك الميكانيكي لجدران الجهاز، وخلايا العضلات الملساء تغيير الظروف العقدية. يتم تصنيف مساهمة خلايا العضلات الملساء في ظل الظروف الفسيولوجية الأساسية كنغمة أساسية. وبشكل أكثر تحديدا، لهجة القاعدية هو انقباض جزئي خط الأساس من خلايا العضلات الملساء في غياب التحفيز الهرموني والعصبي. وعلاوة على ذلك، يوفر إدارة المحتوى في المؤسسة الدعم الهيكلي لجدران الأعضاء ووظائفها كمستودع للإشارات البيوكيميائية. هذه العظة البيوكيميائية حيوية لمختلف وظائف الأعضاء، مثل التحريض على النمو والحفاظ على التوازن. يتكون ECM من كل عضو في المقام الأول من ألياف الكولاجين (في الغالب أنواع الكولاجين الأول والثالث والخامس)، والألياف المرنة، وغليكوسامينوغليكانس / بروتيوغليكانس. تكوين وتنظيم ECM تملي الخصائص الميكانيكية لكل جهاز. قد يؤدي تغيير في تكوين ECM إلى تطوير الأمراض التناسلية، مثل تدلي أعضاء الحوض أو إعادة عرض عنق الرحم قبل الأوان. وعلاوة على ذلك، فإن التغيرات في البنية الدقيقة ECM وتصلب قد يغير نشاط خلايا العضلات الملساء والنمط الظاهري، مما يؤدي إلى فقدان القوة العقدية.
في هذا العمل، يتم استخدام البروتوكولات المبلغ عنها لتقييم لهجة القاعدية والخصائص الميكانيكية السلبية للمهبل غير الحامل وعنق الرحم في 4-6 أشهر من العمر في estrus. وقد تم تركيب الأعضاء في جهاز قياس ضغط متاح تجارياً، وأجريت اختبارات قطر الضغط وطول القوة على حد سواء. وتشمل نماذج البيانات وتقنيات تحليل البيانات للتوصيف الميكانيكي للأعضاء التناسلية. وقد تكون هذه المعلومات مفيدة في بناء نماذج رياضية وتصميم التدخلات العلاجية بعقلانية للأمراض الصحية للمرأة.
Introduction
يتكون الجدار المهبلي من أربع طبقات، ظهارة، بروبريا لامينا، العضلات، وadventitia. يتكون الظهارة في المقام الأول من الخلايا الظهارية. اللامينا بروبريا لديه كمية كبيرة من ألياف الكولاجين المرنة والفيبريلار. ويتكون العضلات أيضا من ألياف الإيلاستين والكولاجين ولكن لديه كمية متزايدة من خلايا العضلات الملساء. ويتكون adventitia من الإيلاستين، الكولاجين، والخلايا الليفية، وإن كان في تركيزات مخفضة بالمقارنة مع الطبقات السابقة. خلايا العضلات الملساء هي ذات أهمية لمجموعات البحوث المحفزة بيولوجيا لأنها تلعب دورا في الطبيعة العقدية للأعضاء. على هذا النحو، وكمي جزء منطقة الخلية العضلات الملساء والتنظيم هو المفتاح لفهم وظيفة الميكانيكية. تشير التحقيقات السابقة إلى أن محتوى العضلات الملساء داخل الجدار المهبلي يتم تنظيمه في المقام الأول في المحور المحيطي والطولي. التحليل النسيجي يشير إلى أن كسر منطقة العضلات الملساء هو ما يقرب من 35٪ لكل من الأجزاء القريبة والبعيدة من الجدار1.
عنق الرحم هو بنية الكولاجين للغاية، وأنه حتى وقت قريب، كان يعتقد أن يكون الحد الأدنى من محتوى الخلايا العضلية الملساء2،3. الدراسات الحديثة, ومع ذلك, وقد اقترح أن خلايا العضلات الملساء قد يكون لها وفرة أكبر ودور في عنق الرحم4,5. يعرض عنق الرحم تدرجًا في خلايا العضلات الملساء. نظام التشغيل الداخلي يحتوي على 50-60٪ خلايا العضلات الملساء حيث نظام التشغيل الخارجي يحتوي فقط على 10٪. دراسات الماوس، ومع ذلك، تقرير عنق الرحم أن تتكون من 10-15٪ خلايا العضلات الملساء و 85-90٪ الأنسجة الضامة الليفية مع عدم ذكر الاختلافات الإقليمية6،7،8. وبالنظر إلى أن نموذج الماوس يختلف عن النموذج البشري المبلغ عنه في كثير من الأحيان، هناك حاجة إلى مزيد من التحقيقات المتعلقة عنق الرحم الماوس.
وكان الغرض من هذا البروتوكول توضيح الخصائص الميكانيكية للمهبل وعنق الرحم. وقد تم تحقيق ذلك باستخدام جهاز myograph الضغط التي تمكن من تقييم الخصائص الميكانيكية في الاتجاهات المحيطة والمحورية في وقت واحد مع الحفاظ على التفاعلات الأصلية مصفوفة الخلية وهندسة الجهاز. شنت الأجهزة على اثنين من قنية مخصصة وتأمينها مع الحرير 6-0 الغرز. وقد أجريت اختبارات قطر الضغط حول الامتداد المحوري الفسيولوجي المقدر لتحديد الامتثال ومعامل الظل9. وأجريت اختبارات طول القوة للتأكد من الامتداد المحوري المقدر وللتأكد من أن الخصائص الميكانيكية قد تم تحديدها كميا في النطاق الفسيولوجي. تم إجراء البروتوكول التجريبي على المهبل غير الحامل وعنق الرحم في 4-6 أشهر من العمر في estrus.
وينقسم البروتوكول إلى قسمين رئيسيين للاختبار الميكانيكي: النغمة القاعدية والاختبار السلبي. يتم تعريف لهجة القاعدية على أنها انقباض جزئي خط الأساس من خلايا العضلات الملساء، حتى في غياب التحفيز المحلي والهرموني والعصبي الخارجي10. هذه الطبيعة العقدية الأساسية للمهبل وعنق الرحم تسفر عن السلوكيات الميكانيكية المميزة التي تقاس بعد ذلك من قبل نظام myograph الضغط. يتم تقييم الخصائص السلبية عن طريق إزالة الكالسيوم بين الخلايا التي تحافظ على حالة خط الأساس للانكماش، مما أدى إلى استرخاء خلايا العضلات الملساء. في الحالة السلبية، الكولاجين وألياف الإيلاستين توفير المساهمات المهيمنة للخصائص الميكانيكية للأعضاء.
ويستخدم نموذج المورين على نطاق واسع لدراسة الأمراض في الصحة الإنجابية للمرأة. يوفر الماوس العديد من المزايا لتحديد العلاقات المتطورة بين إدارة المحتوى في المؤسسة والخصائص الميكانيكية داخل الجهاز التناسلي11،12،13،14. وتشمل هذه المزايا دورات estrous قصيرة وتتميز بشكل جيد، وتكلفة منخفضة نسبيا، وسهولة المناولة، ووقت الحمل قصيرة نسبيا15. بالإضافة إلى ذلك، فإن جينوم الفئران المختبرية هو جيد التعيين والفئران المعدلة وراثيا هي أدوات قيمة لاختبار الفرضيات الميكانيكية16،17،18.
وتستخدم أنظمة الضغط myograph المتاحة تجاريا على نطاق واسع لتحديد كمية الاستجابات الميكانيكية لمختلف الأنسجة والأجهزة. بعض الهياكل البارزة التي تم تحليلها على نظام الضغط myograph تشمل الشرايين المرنة19،20،21،22، الأوردة والأنسجة الطعوم الوعائية المهندسة23،24، المريء25، والأمعاء الغليظة26. تسمح تكنولوجيا الضغط myograph بإجراء تقييم متزامن للخصائص في الاتجاهات المحورية ومحيطية مع الحفاظ على تفاعلات الخلية الأصلية -ECM وفي هندسة الجسم الحي. على الرغم من الاستخدام الواسع لأنظمة myograph في الأنسجة الرخوة وميكانيكا الأعضاء، لم يتم تطوير بروتوكول باستخدام تكنولوجيا الضغط myograph للمهبل وعنق الرحم. تم تقييم التحقيقات السابقة في الخصائص الميكانيكية للمهبل وعنق الرحم uniaxially27،28. هذه الأجهزة، ومع ذلك، تجربة تحميل متعدد المحوري داخل الجسم29،30، وبالتالي قياس الاستجابة الميكانيكية ثنائي المحور المهم.
وعلاوة على ذلك، فإن العمل الأخير يشير إلى خلايا العضلات الملساء قد تلعب دورا محتملا في أمراض الأنسجة الرخوة5،28،31،32. وهذا يوفر جاذبية أخرى لاستخدام تكنولوجيا الضغط myograph، كما أنه يحافظ على التفاعلات مصفوفة الخلية الأصلية، مما يسمح تحديد المساهمة التي تلعب خلايا العضلات الملساء في الفسيولوجية وpathophysiological الظروف. هنا، نقترح بروتوكولا لتحديد الخصائص الميكانيكية متعددة المحورية للمهبل وعنق الرحم في كل من لهجة القاعدية والظروف السلبية.
Protocol
Nulliparous 4-6 أشهر الإناث C57BL6J الفئران (29.4 ± 6.8 غرام) في estrus استخدمت لهذه الدراسة. وقد وافقت لجنة رعاية الحيوانات واستخدامها التابعة لمعهد رعاية الحيوانات في جامعة تولين على جميع الإجراءات. بعد الولادة، تكييف الفئران لمدة أسبوع واحد قبل القتل الرحيم، وكانت موجودة في ظل ظروف قياسية (12 ساعة ضوء / دورات مظلمة).
1. الماوس التضحية في estrus
- تحديد دورة الإثارة: تم رصد دورة الإثارة من خلال التقييم البصري وفقا للدراسات السابقة15،33،34. تتكون الدورة الإستثارية من أربع مراحل: بروستروس، إستروس، ميستروس، وديستروس. خلال مرحلة proestrus الأعضاء التناسلية منتفخة، وردي، رطبة، والتجاعيد. مرحلة الإستروس هي مجعد ولكن أقل تورم، الوردي، ورطبة. يتم الإبلاغ عن Metestrus وdiestrus على حد سواء كما تظهر أي تورم والتجاعيد، وتفتقر إلى هوى الوردي، والجافة34،35.
- إجراء تجربة في estrus: تم إجراء جميع الاختبارات الميكانيكية في حين كانت الفئران في estrus، وهذا هو أسهل لتصور ويوفر نقطة زمنية متسقة وقابلة للتكرار.
- بالنسبة للفئران التي تخضع لاختبار النغمة القاعدية، يتم قتلها عن طريق المقصلة. بالنسبة للفئران التي يتم اختبارها فقط في ظلالظروف السلبية، يتم قتلها باستخدام استنشاق ثاني أكسيد الكربون (CO 2). المقصلة يعمل على الحفاظ على وظيفة خلايا العضلات الملساء من الجهاز التناسلي، كما الغاز CO2 يغير خصائص العقد من خلايا العضلات الملساء36،37،38، 39،40،41،42. لا بد من إجراء تشريح في غضون 30 دقيقة لتقليل فرصة المبرمج الخلية.
2 - تشريح الجهاز التناسلي
- إعداد: وضع وسادة ماصة على محطة العمل وملء طبق بيتري وحقنة مع 4 درجة مئوية هانك محلول الملح المتوازن (HBSS) الحل. استخدام مسح للتخلص من الأنسجة الدهنية. وضع الجانب البطن الماوس حتى والشريط الكفوف والذيل. تشغيل أضواء المجهر على ووضع مقص صغير، مقص، اثنين من أزواج من ملاقط مستقيمة، واثنين من أزواج من ملاقط منحنية.
- باستخدام ملاقط الزاوية والمقص، ورفع الجلد حول البطن وجعل شق في قاعدة البطن، فوق عظم العانة. يجب أن يكون الشق ضحلًا بما يكفي لعدم ثقب جدار عضلة البطن. الاستمرار في استخدام مقص لقطع متفوقة نحو القفص الصدري وعميقة من خلال عضلات البطن.
- إزالة الدهون السطحية عن طريق سحب طفيفة على الدهون مع ملاقط منحنية ومقص صغير. سوف تعكس الأنسجة الدهنية الضوء غير متجانسة مع مظهر مثل بريق. ضع جميع الدهون والأنسجة التي تمت إزالتها على المسح. تحديد كل من قرون الرحم وعظم العانة.
- وضع مقص مغلق بين جدار المهبل وعظم العانة. قطع بعناية منتصف عظم العانة (symphysis العانة). وضع ملاقط منحنية على طرفي العظام العانة قطع. سحب كلا قطع ينتهي أفقيا للسماح للوصول بشكل أفضل إلى الأعضاء التناسلية.
- إزالة المثانة والإحليل من الجدار المهبلي. ويمكن القيام بذلك باستخدام ملاقط مستقيمة ومقص صغير. عقد المثانة مع ملاقط مستقيمة لخلق التوتر واستخدام تقنيات تشريح حادة لفصل الأنسجة المحيطة بها من المهبل. بمجرد تشريح المثانة والإحليل، اقطعالقاعدة وإزالة من تجويف الجسم.
- تحديد الجهاز التناسلي: تُفصل قرون الرحم من عنق الرحم. يمكن تحديد عنق الرحم من المهبل بسبب الاختلافات في الهندسة والتصلب. القطر الخارجي لعنق الرحم أصغر من المهبل. عنق الرحم هو أكثر صلابة من المهبل ويشعر مماثلةلتلك التي من حبة (الشكل 1).
- استخدام الحبر والفرجار لوضع علامة 3 نقاط مم على طول الأجهزة. تبدأ تحت المبيضين على أنابيب الرحم ووضع علامة النقاط أقل شأنا للوصول إلى عنق الرحم. استخدم نقطة عنق الرحم المركزية لبدء مسار نقطة وصولاً إلى مقدمة المهبل.
- السماح للحبر لتجف وفصل الأعضاء التناسلية من الأنسجة الدهنية المحيطة، والأنسجة الضامة، والقولون. تنظيف المهبل أقرب إلى مقدمة المهبل قدر الإمكان. باستخدام مقص، وقطع حول مقدمة المهبل.
ملاحظة: من الممكن أن تجف الأعضاء أثناء هذه العملية. إذا كان هذا مصدر قلق، يمكن استخدام حقنة مليئة بـ 4 درجة مئوية HBSS لإضافة رطوبة إلى الأعضاء. - قطع قرون الرحم على الفور أدنى من المبيضين. لاحظ أن الأعضاء سوف تتراجع من طول explant آخر كما تتم إزالة النسيج الضام والجهاز نكص. ضع الأعضاء التناسلية المنهوبة في طبق بيتري مملوء بـ 4 درجات مئوية HBSS. ويمكن استخدام هذا التغير في الطول لحساب التقديرات في طول الجسم الحي (القسم 5).
ملاحظة: لقد حددنا أن استخدام HBSS في هذه درجة الحرارة أثناء تشريح وتراكم لا يؤثر على صلاحية خلايا العضلات الملساء. الحفاظ على رقم الهيدروجيني من 7.4، ومع ذلك، أمر لا بد منه للحفاظ على صلاحية خلايا العضلات الملساء. في هذه درجة الحرارة، HBSS لديه مستوى الحموضة من 7.4. - بعد فترة معادلة مدتها 15 دقيقة في HBSS 4 درجة مئوية، قم بقياس المسافة بين النقاط باستخدام الفرجار. تسجيل القياسات لكل مسافة في جدول بيانات. سيتم استخدام هذه القيم لحساب نسبة التمدد في الجسم الحي (الطول الأصلي / طول explanted).
- تعيين المسح الذي يحتوي على الأنسجة المهملة على منطقة البطن مع الأنسجة الزائدة التي تواجه داخل الماوس ونقع في 4 درجة مئوية HBSS. لف الماوس والأنسجة الزائدة في احباط ووضعها في كيس آمن الفريزر ليتم تخزينها في -20 درجة مئوية. لم يتم العثور على السلوك الميكانيكي السلبي على المهبل لتكون مختلفة بشكل كبير بعد دورة واحدة تجميد ذوبان43. وقد استخدمت جميع الأعضاء التي تم اختبارها مباشرة بعد القتل الرحيم أو بعد دورة واحدة من ذوبان التجميد.
3. قنية
- تحديد حجم قنية مناسب لنوع الجهاز. في ماوس C57BL6J نموذجي، يستخدم المهبل قنية التي هي على حد سواء 3.75 ملم في القطر وينصب. يستخدم عنق الرحم قنية واحدة هي 3.75 ملم للنهاية المهبلية وقنية قطرها 0.75 ملم لنهاية الرحم (الشكل2)قنية 0.75 مم ناعمة.
ملاحظة: يتم استخدام أحجام القطر المشار إليها أعلاه للفئران C57BL6 nulliparous نموذجية 4-6 أشهر، C57BL6 × 129SvEv، والفئران nonparous الذين تتراوح أعمارهم بين 7-9 أشهر. ومع ذلك، قد تتطلب بعض الظروف، مثل التدلي أو الحمل، قنية أكبر حجمًا. - مع كل عضو، جبل الجانب عنق الرحم على جزء محول القوة من جهاز التعليب. جبل الطرف الآخر من الجهاز (المهبل أو الرحم) على جزء ميكرومتر من الجهاز. تشديد كلا الطرفين مع الغرز.
- بسبب الفرق في سمك ودرجة الانقباض بين المهبل وعنق الرحم، يمكن استخدام تقنيات مختلفة لأداء التعليب الأكثر فعالية. للمهبل، ضع 2 غرز في ما بين 2الثاني والثالثالمسامير من قنية بطريقة "X". عند قنية عنق الرحم ، لا يتم تثبيت قنية بحيث يتم وضع الجهاز على أفضل وجه في الجزء الخلفي من قنية مع 3 غرز أفقية على نهاية الرحم و 4 غرز على نظام التشغيل الخارجي. لكلا الجهازين، يجب أن يكون الحد الأقصى للطوللا يزيد عن 7 مم بين الغرز (الشكل 3).
4. الضغط myograph إعداد
- من أجل إعداد نظام myograph الضغط، والسلطة على نظام الاختبار وملء زجاجة الخزان مع 200 مل من HBSS (الشكل4). قم بتشغيل الحرارة إلى "تشغيل" والسماح لـ HBSS في زجاجة الخزان بتسخينها. بعد ذلك، قم بتشغيل المجهر وفتح برنامج الكمبيوتر. تأكد من أن صورة الجهاز المُقَرَّب، وواجهة الضغط، وقراءاتمقياس التدفق، وأداة وظيفة التسلسل، كلها مرئية (الشكل 5).
5. الباساصية لهجة الاختبار الميكانيكي
ملاحظة: أظهر عنق الرحم طبيعة المراحل الأولى من الاختبار. غير أن ذلك تضاءل بعد شروط مسبقة. يتم اختبار النغمة القاعدية باستخدام حاجز كريبس رينجر (KRB) في حوض جهاز DMT. يتم eerated المخزن المؤقت مع 95٪ O2 و 5٪ CO2. بعد اكتمال الجزء النزعة القاعدية، يتم استخدام KRB خالية من الكالسيوم.
- العثور على الهندسة تفريغ: تمتد الجهاز بحيث الجدار ليس في التوتر. للمهبل، لاحظ الأخاديد على جدار المهبل. لعنق الرحم، قطع مباشرة تحت نقاط الحبر التي تقع فوق وتحت علامة عنق الرحم المركزية. هذا يستنبط طريقة قابلة للتكرار لعنق الرحم في الموقع طول 6 مم44. قياس طول من خياطة إلى خياطة مع الفرجار
- العثور على الضغط التفريغ (UP): زيادة الضغط من 0 إلى 10 مم زئبق في زيادات من 1 مم زئبق. تحديد الضغط الذي لم يعد الجهاز ينهار. ويمكن تحديد هذا كأكبر قفزة في القطر الخارجي في ضغط معين، كما هو معروض على شاشة البرنامج. بعد تسجيل الضغط والقطر الخارجي، لاحظ هذا كالنقطة الأولى حيث لا ينهار الجهاز وصفر القوة.
- المقدرة في امتداد الجسم الحي: حساب المقدرة في امتداد الجسم الحي عن طريق تقسيم طول تقاس في الجسم الحي من قبل طول قياس بعد explant:

- الضغط قطر ما قبل التكييف: تعيين الضغط إلى 0 مم زئبق، وطول إلى المقدرة في طول
 الجسم الحي والتدرج إلى 1.5 مم زئبق / ث. تشغيل تسلسل الذي يأخذ الضغط من 0 ملم زئبق إلى الضغط في الجسم الحي + تفريغ (الجدول1)،عقد لمدة 30 ثانية، واتخاذ الضغط إلى 0 mmHg مع فترة عقد 30 ثانية. بعد تكرار ما مجموعه 5 دورات، اضغط إيقاف في برنامج الكمبيوتر وحفظ الملف.
الجسم الحي والتدرج إلى 1.5 مم زئبق / ث. تشغيل تسلسل الذي يأخذ الضغط من 0 ملم زئبق إلى الضغط في الجسم الحي + تفريغ (الجدول1)،عقد لمدة 30 ثانية، واتخاذ الضغط إلى 0 mmHg مع فترة عقد 30 ثانية. بعد تكرار ما مجموعه 5 دورات، اضغط إيقاف في برنامج الكمبيوتر وحفظ الملف. - العثور على التجريبية في امتداد الجسم الحي: ضبط الجهاز ليكون في طول الجسم الحي المقدرة في حين في الضغط تفريغ هاف ابدأ. تقييم قيم الضغط مقابل القوة لقيم الضغط التي تتراوحبين الضغط التفريغ إلى أقصى ضغط (الجدول 1). اضغط على الزر إيقاف في برنامج الكمبيوتر وحفظ الملف.
ملاحظة: يتم حساب قيمة التمدد المقاسة في الموقع. ويرافق هذا من قبل الحد الذي لا يمكن قياسه إلا بعد فك التناظر العانة. ونتيجة لذلك، يتم فقدان الربط الطبيعي، مما قد يعدل الطول. الامتداد النظري، ومع ذلك، يستند إلى نظرية أدخلت سابقا أن الجهاز سوف تواجه تغييرات طفيفة في القوة عندما تتعرض لضغوط فسيولوجية للحفاظ على الطاقة45. في البروتوكول، فإن قياس في امتداد الجسم الحي يكون قيمة تمتد محسوبة باستخدام طول محددة تجريبيا حيث يكون هناك الحد الأدنى من التغيير في القوة عندما تتعرض لمجموعة من الضغوط الفسيولوجية. - الضغط قطر ما قبل التكييف: تعيين الضغط إلى 0 مم زئبق، وطول التجريبية في طول الجسم الحي، والتدرج من 1.5 ملم زئبق / ثانية. تشغيل تسلسل يأخذ الضغط من 0 mmHg إلى الضغط الأقصى + UP، عقد لمدة 30 ثانية، والعودة إلى 0 مم زئبق مع إعلان 30 ثانية عقد فترة. بعد تكرار هذا لما مجموعه 5 دورات، اضغط على الزر إيقاف في واجهة البرنامج وحفظ الملف.
ملاحظة: 5.4 أمر حتمي لتحقيق قراءة قوة محورية أكثر اتساقا مع زيادة الضغط. تساعد هذه الخطوة في العثور على الصحيح في امتداد الجسم الحي، والتي غالبا ً ما يتم التقليل من قيمتها استناداً إلى الإشارات البصرية. 5.6 بمثابة خطوة وقائية للحد من الهستيريا وتحقيق استجابة متسقة وقابلة للتكرار وقابلة للتفسير رياضيا من الجهاز. - قوة طول قبل التكييف: أدخل 1/3 أقصى ضغط + UP لكل من مدخل ومخرج الضغط. ضبط الجهاز إلى -2٪ من طول في الجسم الحي واضغط على ابدأ. ضبط طول إلى +2٪ في طول الجسم الحي ثم العودة إلى أسفل إلى -2٪ في 10 ميكرومتر / ثانية. اضغط على إيقاف في برنامج الكمبيوتر وحفظ الملف.
- معادلة: مع الجهاز في ال يقرّر في طول فيبو, عيّن على حدّ سواء المدخل ومخرجة ضغطة في 1/3 من الضغطة قصوى + فوق. معادلة الجهاز لمدة 10 دقائق. ببطء جلب كلا الضغوط مرة أخرى إلى 0 مم زئبق مع مجموعة التدرج كما 1.5 مم زئبق / ث.
- إعادة تقييم الهندسة تفريغ: تعيين الجهاز إلى طول في الجسم الحي والضغط على الضغط تفريغها. تقليل الطول المحوري نحو طول تفريغ المقدرة بمعدل 10 درجة مئوية / ثانية حتى يكون هناك تغيير طفيف في القوة. ويعرف هذا الطول المقابل باسم طول تفريغها، أو حيث الجهاز ليس في التوتر ولا الضغط. قبل إلغاء الصفر في القوة، قم بتسجيل طول التفريغ، القطر الخارجي، وقيمة القوة.
ملاحظة: تم تحديد هندسة تفريغ السابقة بواسطة الإشارات المرئية، وهو نوعي بحت. ومن الضروري إعادة التقييم من أجل طريقة كمية ولمراعاة التغيرات المحتملة في الطول التي قد تحدث أثناء وضع الشروط المسبقة. وستستخدم هذه الهندسة في القسم 8. - إعداد الموجات فوق الصوتية: استخدم حزمة البطن التصوير العام لتصور الأعضاء في جهاز الاختبار. (الشكل6). قبل الاختبار، تقليل القطع الأثرية من الجزء السفلي من حوض معدني myograph الضغط. ضبط قنية إلى الارتفاع الذي هو المسافة القصوى من القاع مع الأنسجة لا تزال مغمورة بالكامل في حل الاختبار. يتم طباعة حامل مخصص ثلاثي الأبعاد لتثبيت محول في وضع عمودي أثناء التصوير.
- التصوير بالموجات فوق الصوتية: تحديد قنية بالقرب من محول القوة وضبط مرحلة المجهر إلى صورة على طول الأنسجة. في جميع أنحاء عملية الاختبار، يتم تعقب المنطقة الوسطى على طول (الشكل6A،C). بعد التصوير، راجع حلقة "Cine store" التي تتكون من سلسلة من إطارات الوضع B وحدد الإطار بأكبر قطر خارجي. وستستخدم حسابات السماكة في القسم 8.
- اختبار قطر الضغط (-2٪ في طول الجسم الحي): اضغط على ابدأ وضبط الجهاز بحيث يكون -2٪ من طول الجسم الحي، وتعيين الضغط إلى 0 مم زئبق والتدرج إلى 1.5 ملم زئبق / ث. زيادة الضغط من 0 ملم زئبقي إلى أقصى ضغط. خفض الضغط مرة أخرى إلى 0 مم زئبق مع فترة احتجاز 20 ثانية. كرر هذا لمدة 5 دورات.
- اختبار قطر الضغط (في طول الجسم الحي): اضغط على ابدأ وضبط الجهاز بحيث يكون على طول الجسم الحي، وتعيين الضغط إلى 0 مم زئبق، والتدرج إلى 1.5 مم زئبق / ث. زيادة الضغط من 0 ملم زئبقي إلى أقصى ضغط. خفض الضغط مرة أخرى إلى 0 مم زئبق مع فترة احتجاز 20 ثانية. كرر هذا لمدة 5 دورات.
- اختبار قطر الضغط (+2% في طول الجسم الحي): ضبط الجهاز بحيث يكون +2% في طول الجسم الحي، وتعيين الضغط إلى 0 مم زئبق، والتدرج إلى 1.5 مم زئبق/ثانية. زيادة الضغط من 0 مم زئبق إلى أقصى ضغط ثم العودة إلى 0 مم زئبق مع فترة احتجاز ثانية 20. كرر هذا لمدة 5 دورات. وستستخدم بيانات الضغط من جميع الأطوال الثلاثة في القسم 8.
- اختبار طول القوة (الضغط الاسمي): تعيين الضغط على الضغط تفريغ والجهاز إلى -2٪ من طول في الجسم الحي. تمتد الجهاز إلى +2٪ من طول الجسم الحي والعودة إلى -2٪ في طول الجسم الحي بمعدل 10 ميكرومتر / ثانية.
- اختبار طول القوة (1/3 أقصى ضغط + UP): تعيين الضغط إلى 1/3 من الضغط الأقصى + UP وضبط الجهاز إلى -2٪ في طول الجسم الحي. بعد الضغط على ابدأ، تمتد الجهاز إلى +2٪ في طول الجسم الحي والعودة إلى -2٪ في طول الجسم الحي بمعدل 10 درجة مئوية / ثانية. بعد تكرار ما مجموعه 3 دورات، اضغط على إيقاف وحفظ البيانات.
- اختبار طول القوة (2/3 أقصى ضغط + UP): تعيين الضغط إلى 2/3 من الضغط الأقصى + UP وضبط الجهاز إلى -2٪ في طول الجسم الحي. اضغط على بدء وتمتد الجهاز إلى +2٪ في طول الجسم الحي والعودة إلى -2٪ في طول الجسم الحي بمعدل 10 ميكرومتر / ثانية. بعد تكرار ما مجموعه 3 دورات، اضغط على إيقاف وحفظ البيانات.
- اختبار طول القوة (أقصى ضغط + UP): تعيين الضغط إلى أقصى ضغط + UP وضبط الجهاز إلى -2٪ في طول الجسم الحي. بمعدل 10 ميكرومتر/ ثانية، تمتد الجهاز إلى +2٪ من طول الجسم الحي والعودة إلى -2٪ في طول الجسم الحي. بعد تكرار ما مجموعه 3 دورات، حفظ البيانات. وستستخدم جميع بيانات القوة في الفرع 8.
- إزالة وسائط اختبار KRB وغسل مع KRB خالية من الكالسيوم. استبدال وسائل الإعلام مع حل KRB خالية من الكالسيوم تكملها 2 MM EGTA. احتضان الأنسجة لمدة 30 دقيقة. إزالة الحل واستبدال وسائل الإعلام مع KRB الطازجة خالية من الكالسيوم.
6. الاختبار الميكانيكي السلبي
ملاحظة: إذا بدأت مع بدء الاختبار الخامل في الخطوة 1. إذا تم إجراء اختبار النغمة القاعدية قبل البدء السلبي في الخطوة 6. إذا بدأت مع الأنسجة المجمدة، والسماح لفترة معادلة 30 دقيقة في درجة حرارة الغرفة قبل قنية الجهاز.
- العثور على الهندسة تفريغ: تمتد الجهاز حتى جدار الجهاز ليس في التوتر. قياس الجهاز المُقَدَّم من الخياطة إلى الخياطة وتسجيل هذا على أنه طول تفريغ.
- العثور على الضغط تفريغ: بعد الضغط علىابدأ، وزيادة الضغط من 0 إلى 10 مم زئبق في زيادات من 1 مم زئبق. أثناء مرورك بهذه العملية، حدد الضغط الذي لا يكون فيه الجهاز في حالة توتر. باستخدام شاشة برنامج الكمبيوتر، يمكن تحديد هذا من أكبر قفزة في القطر الخارجي. بعد الصفر القوة، سجل هذا الضغط وكذلك القطر الخارجي ولاحظ هذا كنقطة الأولى التي لا ينهار الجهاز.
- يقدر في امتداد الجسم الحي: حساب المقدرة في امتداد الجسم الحي عن طريق تقسيم طول تقاس في الجسم الحي من قبل طول قياس ما بعد explant.
- قطر الضغط قبل التكييف: بعد الضغط على ابدأ،تعيين الضغط إلى 0 مم زئبق، الطول كما يقدر في طول الجسم الحي، والتدرج إلى 1.5 مم زئبق / ث. ابدأ تشغيل تسلسل يأخذ الضغط من 0 mmHg إلى أقصى ضغط والعودة إلى 0 مم زئبق. كرر هذه العملية من خلال 5 دورات مع 30 ثانية عقد الوقت.
- شرط مسبق بطول القوة: اضبط الجهاز على طول الجسم الحي وأدخل الضغط التفريغ يدويًا في برنامج الكمبيوتر لكل من الضغوط. بعد الضغط على ابدأ، قم بتعيين التدرج إلى 2 مم زئبق والضغط إلى 1/3 الحد الأقصى. تمتد الجهاز تصل إلى +2٪ والعودة إلى -2٪ تمتد في 10 ميكرومتر / ثانية.
- العثور على التجريبية في طول الجسم الحي: البحث عن ومؤامرة قيم القوة في -2٪ من طول في الجسم الحي، في طول الجسم الحي، و +2٪ من طول في الجسم الحي. تأخذ القوات في ضغوط متباعدة بالتساوي تتراوح بين 0 mmHg إلى أقصى ضغط. التجريبية في امتداد الجسم الحي ستكون قيمة تمتد التي تعرض خط مسطح نسبيا على مجموعة من الضغوط.
- كرر قطر الضغط وخطوات التكييف المحورية في طول الجسم الحي الجديد.
- معادلة: مع الجهاز في ال يقرّر في طول فيبو, ثبتت المدخل ومخرجة ضغطة إلى ال يفرّغ ضغطة. دع الجهاز يعيد التوازن لمدة 15 دقيقة. بعد 15 دقيقة، ببطء جلب مدخل وضغط منفذ مرة أخرى إلى 0 مم زئبق.
- إعادة تقييم التكوين الذي تم تفريغه: إحضار الجهاز إلى طول إلغاء التحميل وإعادة تقدير طول إلغاء التحميل. تسجيل طول تفريغ وقطرها الخارجي في حين أن الضغط هو 0 mmHg، والضغط تفريغها، و 1/3 الضغط الأقصى. صفر القوة في الضغط تفريغها. القطر في الضغط تفريغ هو في قطر الجسم الحي.
ملاحظة: إعادة تقدير طول تفريغ ضروري كما لوحظ تتشوهات بلاستيكية صغيرة سابقا في الأنسجة البيولوجية الناعمة بعد شروط مسبقة. وسيكون هذا التكوين الذي تم تفريغه هو التكوين المستخدم في القسم 8. - الموجات فوق الصوتية: إجراء التصوير بالموجات فوق الصوتية B-وضع على طول تفريغ والضغط.
- اختبار قطر الضغط: مع الجهاز في -2٪ من تحديد تجريبيا في طول الجسم الحي والضغط في 0 mmHg، اضغط ابدأ. زيادة الضغط من 0 mmHg إلى أقصى ضغط والعودة إلى 0 مم زئبق. اضغط على خطوة 2-0 مم زئبق لمدة 20 ثانية. بعد تكرار ما مجموعه 5 مرات، اضغط على زر إيقاف في الواجهة وحفظ الملف.
ملاحظة: كرر في التجريبية في طول الجسم الحي، +2٪ من التجريبية في طول الجسم الحي. - اختبار طول القوة: تعيين الضغط إلى الضغط الاسمي وضبط الجهاز إلى -2٪ من طول في الجسم الحي. تمتد الجهاز تصل إلى +2٪ من طول الجسم الحي والعودة إلى -2٪ من طول الجسم الحي بمعدل 10 ميكرومتر / ثانية. بعد التكرار لما مجموعه 3 مرات، احفظ البيانات. كرر هذا لضغط الحد الأقصى، 2/3 أقصى ضغط، وعند الضغط الأقصى.
- حساب سمك تفريغها من الصور بالموجات فوق الصوتية B-وضع الصورة. باستخدام برنامج التصوير، ارسم خطًا للدلالة على عمق الاختراق. تعيين المقياس إلى طول الخط (أي 2000 ميكرومتر كما هو مبين في الشكل 6B و6D).
- حسابات سمك الجدار: باستخدام برنامج كمبيوتر، تتبع وقياس القطر الداخلي والخارجي للجهاز. ثم، رسم وقياس خط بين أقطار. رسم ما مجموعه 25 خطوط عبر الجدارية. متوسط جميع نقاط البيانات وتكرار ما مجموعه 3 مرات.
7. تنظيف
- تأكد من أن الضغط هو 0 مم زئبق وإيقاف تشغيله. أغلق مدخل ومخرج رئيسي لكل من الصمامات ثلاثية الاتجاه. يستنشق السائل المتبقي من حوض جهاز التعليب.
- إزالة الجهاز من المرحلة وملء زجاجة الخزان مع الماء منزوع الأيونات. باستخدام حقنة، شطف قنية بالماء. قم بتوصيل الأنابيب لتجاوز القنية.
- تشغيل الضغط والتدفق، وتعيين ضغط مدخل إلى 200 مم زئبق، وضغط منفذ إلى 0 مم زئبق، التدرج إلى 10 مم زئبق / ث، والسماح للتدفق تشغيل لمدة 5 دقائق. السماح للنظام لتشغيل في حين أن زجاجة الخزان فارغة والسماح للهواء تشغيل لمدة 5 دقائق أو حتى خطوط جافة.
8 - تحليل البيانات
- لاختبار قطر الضغط، جمع البيانات من حيث يبدأ الضغط في الزيادة من الحد الأدنى للقيمة حتى الحد الأقصى. لاختبار طول القوة، جمع البيانات من أقل بقليل من الحد الأقصى للذروة المعمول بها حتى توقفت القوة عن الانخفاض.
- افتح ملف البيانات لكل اختبار قطر الضغط وحدد علامة تبويب الضغط المتوسط. انتقل إلى منطقة التحميل في المنحنى الأخير، 0 مم زئبق إلى أقصى ضغط، وأسقط البيانات في جدول بيانات. حدد نفس المنطقة على القطر الخارجي، وضغط مدخل، وضغط المنفذ، والقوة، ودرجة الحرارة، ودرجة الحموضة، وعلامة تبويب التدفق وضع كل عنصر في نفس المستند.
- افتح البيانات لكل اختبار طول القوة. انتقل إلى منطقة التحميل للمنحنى، -2% إلى +2%، واسحب البيانات وأسقطها في جدول بيانات. حدد نفس المنطقة للمتغيرات المقاسة الأخرى ووضع كل عنصر في نفس جدول البيانات.
- لقطر الضغط واختبار طول القوة طرح UP من جميع قيم الضغط.
- متوسط بيانات قطر الضغط كل 1 مم زئبق (أي 0+/- 0.5، 1+/-0.5، 2+/- 0.5).
- العثور على حجم تفريغالجهاز (V). المعادلة 1 يمكن استخدامها للعثور على V، بالنظر إلى أن R02 هو دائرة نصف قطرها الخارجي تفريغها تقاس بواسطة المجهر، L هو طول تفريغها، وH هو سمك تفريغ كما تم الكشف عنها من قبل الموجات فوق الصوتية. يتم الاستفادة من افتراض عدم القدرة على الضغط، وهذا يعني أن الجهاز يحافظ على حجم بينما يتعرض للتشوهات.
ملاحظة: يتم قياس طول تفريغ مع الفرجار من خياطة إلى خياطة. يتم قياس قطر تفريغ عن طريق المجهر، والكاميرا، والبرمجياتتليها حساب نصف قطرها (الشكل 5) يتم حساب سمك تفريغ من الصور بالموجات فوق الصوتية (الشكل6).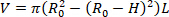 المعادلة 1
المعادلة 1 - باستخدام افتراض عدم القدرة على الضغط، استخدم وحدة التخزين
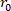 التي تم
التي تم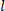 تفريغها، دائرة
تفريغها، دائرة 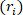 نصف قطرها الخارجي المشوهة ( ) ، وطول ( ) لتحديد نصف القطر الداخلي مشوهة.
نصف قطرها الخارجي المشوهة ( ) ، وطول ( ) لتحديد نصف القطر الداخلي مشوهة.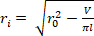 المعادلة 2
المعادلة 2 - استخدم المعادلات 3 و4 و5 لحساب كل إجهاد على التوالي. في المعادلات 3-5، يتم تعريف P على أنه الضغط داخل الإنارة وFt هي القوة التي تقاس بواسطة محول.
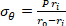 المعادلة 3
المعادلة 3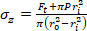 المعادلة 4
المعادلة 4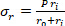 المعادلة 5
المعادلة 5 - رسم العلاقة بين الضغط وقطرها، والعلاقة بين القوة والضغط، والعلاقة الظرفية للإجهاد والتوتر، والإجهاد المحوري وقيم التمدد المحيطي (الشكل7، الشكل8). يمكن حساب قيم التمدد باستخدام نصف قطر الجدار الأوسط. ويمكن العثور على حسابات الضغوط المحيطة والمحورية في المعادلتين 6 و7 على التوالي.
 المعادلة 6
المعادلة 6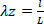 المعادلة 7
المعادلة 7 - حساب الامتثال بالقرب من نطاق الضغط الفسيولوجي وعلى امتداد في الجسم الحي. الحد الأدنى للضغط (LPB) هو انحراف معياري واحد أقل من متوسط الضغط المقاس. حد الضغط العلوي (UPB) هو 1 الانحراف المعياري فوق متوسط قياس الضغط9.
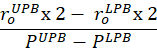
- حساب معامل الظل لتحديد صلابة المواد. تحديد الإجهاد المحيطي المحسوب الذي يتوافق مع الضغط المنخفض المنضم والضغط العلوي. تناسب خط خطي إلى منحنى تمتد الإجهاد المحيطة- محيطية داخل نطاق الإجهاد المحدد في طول الجسم الحي. حساب ميل السطر9.
النتائج
التحليل الناجح للخصائص الميكانيكية للأعضاء التناسلية الأنثوية يتوقف على تشريح الأعضاء المناسبة، وتراكم التعليب، والاختبار. لا بد من استئصال قرون الرحم إلى المهبل دونأي عيوب (الشكل 1). اعتمادا على نوع الجهاز، فإن حجم قنية تختلف (الشكل2). يجب أن يتم التعليب بحيث ل?...
Discussion
يقدم البروتوكول المنصوص عليه في هذه المقالة طريقة لتحديد الخصائص الميكانيكية للمهبل وعنق الرحم. وتشمل الخصائص الميكانيكية التي تم تحليلها في هذا البروتوكول كل من ظروف النغمة السلبية والقاعدية للأعضاء. يتم المستحثة الظروف السلبية والقاعدية عن طريق تغيير البيئة البيوكيميائية التي يتم غم...
Disclosures
اي.
Acknowledgements
تم تمويل هذا العمل من #1751050 منحة المؤسسة الوطنية للتوظيف المهنية.
Materials
| Name | Company | Catalog Number | Comments |
| 2F catheter | Millar | SPR-320 | catheter to measure cervical pressure |
| 6-0 Suture | Fine Science Tools | 18020-60 | larger suture ties |
| CaCl2 (anhydrous) | VWR | 97062-590 | HBSS concentration: 140 mg/ mL |
| CaCl2-2H20 | Fischer chemical | BDH9224-1KG | KRB concentration: 3.68 g/L |
| Dextrose (D-glucose) | VWR | 101172-434 | HBSS concentration: 1000 mg/mL KRB concentration: 19.8 g/L |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | curved forceps |
| Dumont SS Forceps | Fine Science Tools | 11203-25 | straight forceps |
| Eclipse | Nikon | E200 | microscope used for imaging |
| Flow meter | Danish MyoTechnologies | 161FM | flow meter within the testing apparatus |
| Force Transducer - 110P | Danish MyoTechnologies | 100079 | force transducer |
| ImageJ | SciJava | ImageJ1 | used to measure volume |
| Instrument Cases | Fine Science Tools | 20830-00 | casing to hold dissection tools |
| KCl | Fisher Chemical | 97061-566 | HBSS concentration: 400 mg/ mL KRB concentration: 3.5 g/L |
| KH2PO4 | G-Biosciences | 71003-454 | HBSS concentration: 60 mg/ mL |
| MgCl2 | VWR | 97064-150 | KRB concentration: 1.14 g/L |
| MgCl2-6H2O | VWR | BDH9244-500G | HBSS concentration: 100 mg/ mL |
| MgSO4-7H20 | VWR | 97062-134 | HBSS concentration: 48 mg/ mL |
| Mircosoft excel | Microsoft | 6278402 | program used for spreadsheet |
| Na2HPO4 (dibasic anhydrous) | VWR | 97061-588 | HBSS concentration: 48 mg/mL KRB concentration: 1.44 g/L |
| NaCl | VWR | 97061-274 | HBSS concentration: 8000 mg/mL KRB concentration: 70.1 g/L |
| NaHCO3 | VWR | 97062-460 | HBSS concentration: 350 mg/ mL KRB concentration: 21.0 g/L |
| Pressure myograph systems | Danish MyoTechnologies | 110P and 120CP | Pressure myograph system: prorgram, cannulation device, and controller unit |
| Pressure Transducer | Danish MyoTechnologies | 100106 | pressure transducer |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | straight forceps |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | micro-scissors |
| Tissue dye | Bradley Products | 1101-3 | ink to measure in vivo stretch |
| Ultrasound transducer | FujiFilm Visual Sonics | LZ-550 | ultrasound transducer used; 256 elements, 40 MHz center frequency |
| VEVO2100 | FujiFilm Visual Sonics | VS-20035 | ultrasound used for imaging |
| Wagner Scissors | Fine Science Tools | 14069-12 | larger scissors |
References
- Capone, D., et al. Evaluating Residual Strain Throughout the Murine Female Reproductive System. Journal of Biomechanics. 82, 299-306 (2019).
- Danforth, D. The fibrous nature of the human cervix, and its relation to the isthmic segment in gravid and nongravid uteri. American Journal of Obstetrics and Gynecology. 53 (4), 541-560 (1947).
- Hughesdon, P. The fibromuscular structure of the cervix and its changes during pregnancy and labour. Journal of Obstetrics and Gynecology of the British Commonwealth. 59, 763-776 (1952).
- Bryman, I., Norstrom, A., Lindblo, B. Influence of neurohypophyseal hormones on human cervical smooth muscle cell contractility in vitro. Obstetrics and Gynecology. 75 (2), 240-243 (1990).
- Joy, V., et al. A New Paradigm for the Role of Smooth Muscle Cells in the Human Cervix. Obstetrics. 215 (4), e471-e478 (2016).
- Xu, X., Akgul, Y., Mahendroo, M., Jerschow, A. Ex vivo assessment of mouse cervical remodeling through pregnancy via Na (23) MRS. NMR Biomedical. 23 (23), 907-912 (2014).
- Leppert, P. Anatomy and Physiology of cervical ripening. Clinical Obstetrics and Gynecology. 43 (43), 433-439 (2000).
- Schlembach, D., et al. Cervical ripening and insufficiency: from biochemical and molecular studies to in vivo clinical examination. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 144, S70-S79 (2000).
- Stoka, K., et al. Effects of Increased Arterial Stiffiness on Atherosclerotic Plaque Amounts. Journal of Biomechanical Engineering. 140 (5), (2018).
- Mohram, D., Heller, L. Ch. 7. Cardiovascular Physiology. , (2006).
- Yoshida, K., et al. Quantitative Evaluation of Collagen Crosslinks and Corresponding Tensile Mechanical Properties in Mouse Cervical Tissue during Normal Pregnancy. PLoS One. 9, e112391 (2014).
- Mahendroo, M. Cervical remodeling in term and preterm birth: insight from an animal model. Society for Reproduction and Fertility. 143 (4), 429-438 (2012).
- Elovitz, M., Miranlini, C. Can medroxyprogesterone acetate alter Toll-like receptor expression in a mouse model of intrauterine inflammation?. American Journal of Obstetrics and Gynecology. 193 (3), 1149-1155 (2005).
- Ripperda, C., et al. Vaginal estrogen: a dual-edged sword in postoperative healing of the vaginal wall. North American Menopause Society. 24 (7), 838-849 (2017).
- Nelson, J., Felicio, P., Randall, K., Sims, C., Finch, E. A Longitudinal Study of Estrous Cyclicity in Aging C57/6J Mice: Cycle, Frequency, Length, and Vaginal Cytology. Biology of Reproduction. 27 (2), 327-339 (1982).
- Ferruzzi, J., Collins, M., Yeh, A., Humphrey, J. Mechanical assessment of elastin integrity in fibrillin-1-deficient carotid arteries: implications for Marfan Syndrome. Cardiovascular Research. 92 (2), 287-295 (2011).
- Mariko, B., et al. Fribrillin-1 genetic deficiency leads to pathological ageing of arteries in mice. The Journal of Pathology. 224 (1), 33-44 (2011).
- Rahn, D., Ruff, M., Brown, S., Tibbals, H., Word, R. Biomechanical Properties of The Vaginal Wall: Effect of Pregnancy, Elastic Fiber Deficiency, and Pelvic Organ Prolapse. American Urogynecological Society. 198 (5), (2009).
- Caulk, A., Nepiyushchikh, Z., Shaw, R., Dixon, B., Gleason, R. Quantification of the passive and active biaxial mechanical behavior and microstructural organization of rat thoracic ducts. Royal Society Interface. 12 (108), 20150280 (2015).
- Amin, M., Le, V., Wagenseil, J. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. Journal of Visualized Experiments. (60), e3733 (2012).
- Sokolis, D., Sassani, S., Kritharis, E., Tsangaris, S. Differential histomechanical response of carotid artery in relation to species and region: mathematical description accounting for elastin and collagen anisiotropy. Medical and Biological Engineering and Computing. 49 (8), 867-879 (2011).
- Kim, J., Baek, S. Circumferential variations of the mechanical behavior of the porcine thoracic aorta during the inflation test. Journal of Biomechanics. 44 (10), 1941-1947 (2011).
- Faury, G., et al. Developmental adaptation of the mouse cardiovascular system to elastin haploinsufficency. Journal of Clinical Investigation. 11 (9), 1419-1428 (2003).
- Naito, Y., et al. Beyond Burst Pressure: Initial Evaluation of the Natural History of the Biaxial Mechanical Properties of Tissue-Engineered Vascular Grafts in the Venous Circulation Using a Murine Model. Tissue Engineering. 20, 346-355 (2014).
- Sommer, G., et al. Multaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
- Sokolis, D., Orfanidis, I., Peroulis, M. Biomechanical testing and material characterization for the rat large intestine: regional dependence of material parameters. Physiological Measurement. 32 (12), 1969-1982 (2011).
- Martins, P., et al. Prediction of Nonlinear Elastic Behavior of Vaginal Tissue: Experimental Results and Model Formation. Computational Methods of Biomechanics and Biomedical Engineering. 13 (3), 317-337 (2010).
- Feola, A., et al. Deterioration in Biomechanical Properties of the Vagina Following Implantation of a High-stiffness Prolapse Mesh. BJOG: An International Journal of Obstetrics and Gynaecology. 120 (2), 224-232 (2012).
- Huntington, A., Rizzuto, E., Abramowitch, S., Prete, Z., De Vita, R. Anisotropy of the Passive and Active Rat Vagina Under Biaxial Loading. Annals of Biomedical Engineering. 47, 272-281 (2018).
- Tokar, S., Feola, A., Moalli, P., Abramowitch, S. Characterizing the Biaxial Mechanical Properties of Vaginal Maternal Adaptations During Pregnancy. ASME 2010 Summer Bioengineering Conference, Parts A and B. , 689-690 (2010).
- Feloa, A., et al. Impact of Pregnancy and Vaginal Delivery on the Passive and Active Mechanics of the Rat Vagina. Annals of Biomedical Engineering. 39 (1), 549-558 (2010).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical Analysis of the Uterosacral Ligament: Swine vs Human. Annual Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Champlin, A. Determining the Stage of the Estrous Cycle in the Mouse by the Appearance. Biology of Reproduction. 8 (4), 491-494 (1973).
- Byers, S., Wiles, M., Dunn, S., Taft, R. Mouse Estrous Cycle Identification Tool and Images. PLoS One. 7 (4), e35538 (2012).
- McLean, A. Performing Vaginal Lavage, Crystal Violet Staining and Vaginal Cytological Evaluation for Mouse Estrous Cycle Staging Identification. Journal of Visualized Experiments. 67, e4389 (2012).
- Bugg, G., Riley, M., Johnston, T., Baker, P., Taggart, M. Hypoxic inhibition of human myometrial contractions in vitro: implications for the regulation of parturition. European Journal of Clinical Investigation. 36 (2), 133-140 (2006).
- Taggart, M., Wray, S. Hypoxia and smooth muscle function: key regulatory events during metabolic stress. Journal of Physiology. 509, 315-325 (1998).
- Yoo, K., et al. The effects of volatile anesthetics on spontaneous contractility of isolated human pregnant uterine muscle: a comparison among sevoflurane, desflurane, isoflurane, and halothane. Anesthesia and Analgesia. 103 (2), 443-447 (2006).
- de Souza, L., et al. Effects of redox disturbances on intentional contractile reactivity in rats fed with a hypercaloric diet. Oxidative Medicine and Cellular Longevity. , 6364821 (2018).
- Jaue, D., Ma, Z., Lee, S. Cardiac muscarinic receptor function in rats with cirrhotic cardiomyopathy. Hepatology. 25, 1361-1365 (1997).
- Xu, Q., Shaffer, E. The potential site of impaired gallbladder contractility in an animal mode of cholesterol gallstone disease. Gastroenterology. 110 (1), 251-257 (1996).
- Rodriguez, U., et al. Effects of blast induced Neurotrauma on pressurized rodent middle cerebral arteries. Journal of Visualized Experimentals. (146), e58792 (2019).
- Rubod, C., Boukerrou, M., Brieu, M., Dubois, P., Cosson, M. Biomechanical Properties of Vaginal Tissue Part 1: New Experimental Protocol. Journal of Urology. 178, 320-325 (2007).
- Robison, K., Conway, C., Desrosiers, L., Knoepp, L., Miller, K. Biaxial Mechanical Assessment of the Murine Vaginal Wall Using Extension-Inflation Testing. Journal of Biomechanical Engineering. 139 (10), 104504 (2017).
- Van loon, P. Length-Force and Volume-Pressure Relationships of Arteries. Biorheology. 14 (4), 181-201 (1977).
- Fernandez, M., et al. Investigating the Mechanical Function of the Cervix During Pregnancy using Finite Element Models Derived from High Resolution 3D MRI. Computational Methods Biomechanical and Biomedical Engineering. 19 (4), 404-417 (2015).
- House, M., Socrate, S. The Cervix as a Biomechanical Structure. Ultrasound Obstetric Gynecology. 28 (6), 745-749 (2006).
- Martins, P., et al. Biomechanical Properties of Vaginal Tissue in Women with Pelvic Organ Prolapse. Gynecologic and Obstetrics Investigation. 75, 85-92 (2013).
- Rada, C., Pierce, S., Grotegut, C., England, S. Intrauterine Telemetry to Measure Mouse Contractile Pressure In vivo. Journal of Visualized Experiments. (98), e52541 (2015).
- Lumsden, M. A., Baird, D. T. Intra-uterine pressure in dysmenorrhea. Acta Obstectricia at Gynecologica Scandinavica. 64 (2), 183-186 (1985).
- Milsom, I., Andersch, B., Sundell, G. The Effect of Flurbiprofen and Naproxen Sodium On Intra-Uterine Pressure and Menstrual Pain in Patients With Primary Dysmennorrhea. Acta Obstetricia et Gynecologica Scandinavica. 67 (8), 711-716 (1988).
- Park, K., et al. Vasculogenic female sexual dysfunction: the hemodynamic basis for vaginal engorgement insufficiency and clitoral erectile insufficiency. International Journal of Impotence Journal. 9 (1), 27-37 (1997).
- Bulletti, C., et al. Uterine Contractility During Menstrual Cycle. Human Reproduction. 15, 81-89 (2000).
- Kim, N. N., et al. Effects of Ovariectomy and Steroid Hormones on Vaginal Smooth Muscle Contractility. International Journal of Impotence Research. 16, 43-50 (2004).
- Giraldi, A., et al. Morphological and Functional Characterization of a Rat Vaginal Smooth Muscle Sphincter. International Journal of Impotence Research. 14, 271-282 (2002).
- Gleason, R., Gray, S. P., Wilson, E., Humphrey, J. A Multiaxial Computer-Controlled Organ Culture and Biomechanical Device for Mouse Carotid Arteries. Journal of Biomechanical Engineering. 126 (6), 787-795 (2005).
- Swartz, M., Tscumperlin, D., Kamm, R., Drazen, J. Mechanical Stress is Communicated Between Different Cell Types to Elicit Matrix Remodeling. Proceedings of the National Academy of Sciences of the United States of America. 98 (11), 6180-6185 (2001).
- Rachev, A. Remodeling of Arteries in Response to Changes in their Mechanical Environment. Biomechanics of Soft Tissue in Cardiovascular Systems. 441, 221-271 (2003).
- Lee, E. J., Holmes, J., Costa, K. Remodeling of Engineered Tissue Anisotropy in Response to Altered Loading Conditions. Annals of Biomedical Engineering. 36 (8), 1322-1334 (2008).
- Akintunde, A., et al. Effects of Elastase Digestion on the Murine Vaginal Wall Biaxial Mechanical Response. Journal of Biomechanical Engineering. 141 (2), 021011 (2018).
- Griffin, M., Premakumar, Y., Seifalian, A., Butler, P., Szarko, M. Biomechanical Characterization of Human Soft Tissues Using Indentation and Tensile Testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Myers, K., Socrate, S., Paskaleva, A., House, M. A Study of the Anisotripy and Tension/Compression Behavior of Human Cervical Tissue. Journal of Biomechanical Engineering. 132 (2), 021003 (2010).
- Murtada, S., Ferruzzi, J., Yanagisawa, H., Humphrey, J. Reduced Biaxial Contractility in the Descending Thoracic Aorta of Fibulin-5 Deficent Mice. Journal of Biomechanical Engineering. 138 (5), 051008 (2016).
- Berkley, K., McAllister, S., Accius, B., Winnard, K. Endometriosis-induced vaginal hyperalgesia in the rat: effect of estropause, ovariectomy, and estradiol replacement. Pain. 132, s150-s159 (2007).
- van der Walt, I., Bø, K., Hanekom, S., Rienhardt, G. Ethnic Differences in pelvic floor muscle strength and endurance in South African women. International Urogynecology Journal. 25 (6), 799-805 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved