É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Tom basal biaxial e teste passivo do sistema reprodutivo murino usando um Miografo de pressão
Neste Artigo
Resumo
Este protocolo utilizou um sistema de miografo de pressão disponível comercialmente para realizar testes miográficos de pressão na vagina e colo do útero murino. Utilizando meios com e sem cálcio, as contribuições do tom básico das pilhas de músculo liso (SMC) e da matriz extracelular passiva (ECM) foram isoladas para os órgãos circunstâncias physiological estimadas.
Resumo
Os órgãos reprodutivos femininos, especificamente a vagina e o colo do útero, são compostos por vários componentes celulares e uma matriz extracelular única (ECM). Células musculares lisas exibem uma função contrátil dentro das paredes vaginal e cervical. Dependendo do ambiente bioquímico e da distensão mecânica das paredes dos órgãos, as células musculares lisas alteram as condições contráctil. A contribuição das células musculares lisas em condições fisiológicas iniciais é classificada como um tom basal. Mais especificamente, um tom basal é a constrição parcial basal das células musculares lisas na ausência de estimulação hormonal e neural. Além disso, o ECM fornece o apoio estrutural para as paredes e as funções do órgão como um reservatório para pistas bioquímicas. Essas pistas bioquímicas são vitais para várias funções de órgãos, como incitar o crescimento e manter a homeostase. A ECM de cada órgão é composta principalmente de fibras colágenas (principalmente colágeno tipos I, III e V), fibras elásticas e glicosaminoglicanos/proteoglicanos. A composição e organização do ECM determinam as propriedades mecânicas de cada órgão. Uma mudança na composição do ECM pode conduzir ao desenvolvimento de patologias reprodutivas, tais como o prolapso pélvico do órgão ou o remodelamento cervical prematuro. Além disso, as alterações na microestrutura e rigidez da ECM podem alterar a atividade e o fenótipo da célula muscular lisa, resultando na perda da força contrátil.
Neste trabalho, os protocolos relatados são usados para avaliar o Tom basal e as propriedades mecânicas passivas da vagina e da cerviz murino nonpregnant em 4-6 meses da idade no estro. Os órgãos foram montados em um miógrafo de pressão comercialmente disponível e os testes do pressão-diâmetro e da força-comprimento foram executados. São incluídos dados de amostra e técnicas de análise de dados para a caracterização mecânica dos órgãos reprodutivos. Essas informações podem ser úteis para a construção de modelos matemáticos e racionalmente projetar intervenções terapêuticas para as patologias de saúde das mulheres.
Introdução
A parede vaginal é composta de quatro camadas, o epitélio, o propria do lamina, os muscularis, e o adventitia. O epitélio é composto principalmente de células epiteliais. O própria do lamina tem uma grande quantidade de fibras elásticas e fibrilar do colagénio. Os muscularis também são compostos de fibras de elastina e colágeno, mas tem uma quantidade aumentada de células musculares lisas. A adventícia é composta por elastina, colágeno e fibroblastos, embora em concentrações reduzidas em comparação com as camadas anteriores. As células musculares lisas são de interesse para grupos de pesquisa biomecânica motivados como desempenham um papel na natureza contrátil dos órgãos. Como tal, quantificar a fração da área da célula muscular lisa e a organização é fundamental para a compreensão da função mecânica. As investigações precedentes sugerem que o índice liso do músculo dentro da parede vaginal esteja organizado primeiramente no eixo circunferencial e longitudinal. A análise histológica sugere que a fração da área do músculo liso é de aproximadamente 35% para as secções proximal e distal da parede1.
O colo do útero é uma estrutura altamente colagenosa, que até recentemente, foi pensado para ter o conteúdo mínimodecélulas musculares lisas 2,3. Estudos recentes, no entanto, sugeriram que as células musculares lisas podem ter uma maior abundância e papel no colo do útero4,5. O colo do útero exibe um gradiente de células musculares lisas. O sistema operacional interno contém 50-60% de células musculares lisas, onde o sistema operacional externo contém apenas 10%. Os estudos do rato, entretanto, relatam o cerviz para ser compor de 10-15% pilhas de músculo liso e 85-90% tecido conexivo fibroso sem menção de diferenças regionais6,7,8. Dado que o modelo do rato difere do modelo humano freqüentemente relatado, umas investigações mais adicionais a respeito da cerviz do rato são precisadas.
O objetivo deste protocolo foi elucidar as propriedades mecânicas da vagina e colo uterino murino. Isto foi conseguido usando um dispositivo do miógrafo da pressão que permita a avaliação de propriedades mecânicas nas direções circunferenciais e axiais simultaneamente ao manter interações nativas da pilha-matriz e a geometria do órgão. Os órgãos foram montados em duas cânulas personalizadas e fixadas com seda 6-0 suturas. Os testes de pressão-diâmetro foram realizados em torno do estiramento axial fisiológico estimado para determinar a complacência e a moduli tangente9. Testes de força-comprimento foram conduzidos para confirmar o estiramento axial estimado e para garantir que as propriedades mecânicas fossem quantificadas na faixa fisiológica. O protocolo experimental foi realizado na vagina Murina não-grávida e no colo do útero aos 4-6 meses de idade em estro.
O protocolo é dividido em duas seções principais do teste mecânico: tom básico e teste passivo. Um tom basal é definido como a constrição parcial basal das células musculares lisas, mesmo nas ausências de estimulação local, hormonal e neural externa10. Esta natureza contrátil basal da vagina e colo do útero produz comportamentos mecânicos característicos que são então medidos pelo sistema de miografia de pressão. As propriedades passivas são avaliadas pela remoção do cálcio intercelular que mantém o estado basal de contração, resultando no relaxamento das células musculares lisas. No estado passivo, as fibras de colágeno e elastina fornecem as contribuições dominantes para as características mecânicas dos órgãos.
O modelo murino é usado extensivamente para estudar patologias na saúde reprodutiva das mulheres. O mouse oferece várias vantagens para quantificar as relações evolutivas entre ECM e propriedades mecânicas dentro do sistema reprodutivo11,12,13,14. Estas vantagens incluem ciclos estral curtos e bem caracterizados, custo relativamente baixo, facilidade de manuseio e um tempo gestacional relativamente curto15. Além disso, o genoma de camundongos laboratoriais é bem mapeado e os camundongos geneticamente modificados são ferramentas valiosas para testar hipóteses mecanísticas16,17,18.
Os sistemas de miografia de pressão disponíveis comercialmente são amplamente utilizados para quantificar as respostas mecânicas de vários tecidos e órgãos. Algumas estruturas notáveis analisadas no sistema de miografo de pressão incluem as artérias elásticas19,20,21,22, veias e enxertos vasculares de engenharia tecidual23,24, o esôfago25, e os grandes intestinos26. A tecnologia do miógrafo da pressão permite a avaliação simultânea das propriedades nas direções axiais e circunferenciais ao manter as interações nativas do Cell-ECM e na geometria in vivo. Apesar do uso extensivo de sistemas do miógrafo na mecânica macia do tecido e do órgão, um protocolo que utiliza a tecnologia do miógrafo da pressão não tinha sido desenvolvido previamente para o vagina e a cerviz. Investigações anteriores sobre as propriedades mecânicas da vagina e do colo do útero foram avaliadas uniaxialmente27,28. Estes órgãos, entretanto, experimentam o carregamento multiaxial dentro do corpo29,30, assim quantificando sua resposta mecânica biaxial é importante.
Além disso, o trabalho recente sugere que as células musculares lisas podem desempenhar um papel potencial nas patologias dos tecidos moles5,28,31,32. Isto fornece uma outra atração de utilizar a tecnologia do miógrafo da pressão, porque preserva as interações nativas da pilha-matriz, assim permitindo o delineamento da contribuição que as pilhas de músculo lisas jogam em fisiológico e fisiopatológico Condições. Nisto, nós propor um protocolo para quantificar as propriedades mecânicas multiaxial do vagina e da cerviz o tom básico e as circunstâncias passivas.
Protocolo
Nulíparas 4-6 meses fêmeas C57BL6J camundongos (29,4 ± 6,8 gramas) no estro foram utilizados para este estudo. Todos os procedimentos foram aprovados pelo Comitê de cuidados e uso de animais do Instituto na Universidade de Tulane. Após a entrega, os camundongos aclimatados durante uma semana antes da eutanásia e foram alojados em condições padrão (ciclos de luz/escuro de 12 horas).
1. sacrifício do rato no estro
- Determinar o ciclo estral: o ciclo estral foi monitorado por avaliação visual de acordo com estudos prévios15,33,34. O ciclo estral consiste em quatro estágios: proestro, estro, metestro e diestro. Durante a fase do proestro os genitais são inchados, cor-de-rosa, húmidos, e enrugado. A fase do estro é enrumente mas menos inchada, cor-de-rosa, e húmida. Metestro e diestro são ambos relatados como exibindo nenhum inchaço e enrugamento, faltando em um matiz cor de rosa, e seco34,35.
- Realizar experimento no estro: todos os testes mecânicos foram realizados enquanto os camundongos estavam em estro, pois este é o mais fácil de Visualizar e fornece um timepoint consistente e repetível.
- Para camundongos submetidos a testes de Tom basal, eutanizar via guilhotina. Para camundongos testados apenas as condições passivas, eutanizar usando a inalação de dióxido de carbono (CO2). A guilhotina serve para preservar a função das células musculares lisas do trato reprodutivo, pois o gás co2 altera as propriedades contrátil das células musculares lisas36,37,38, 39,40,41,42. É imperativo realizar a dissecção dentro de 30 minutos para minimizar a possibilidade de apoptose celular.
2. dissecção do sistema reprodutivo
- Configurar: Coloque uma almofada absorvente na estação de trabalho e encha uma placa de Petri e uma seringa com a solução de sal equilibrado de Hank de 4 ° c (HBSS). Use um apagamento para a eliminação do tecido adiposo. Coloque o lado ventral do mouse para cima e tape as patas e cauda. Gire as luzes do microscópio sobre e ajuste para fora micro-tesouras, tesouras, dois pares de tweezers retos, e dois pares de tweezers curvados.
- Usando pinças e tesouras angulares, levante a pele em torno do abdômen e faça uma incisão na base do abdômen, acima do osso púrico. A incisão deve ser rasa o suficiente para não perfurar a parede do músculo abdominal. Continue usando a tesoura para cortar superiormente para a caixa torácica e profundamente através dos músculos abdominais.
- Remova a gordura superficial puxando levemente sobre a gordura com as pinças curvas e Microtesouras. O tecido adiposo refletirá a luz heterogênea com uma aparência glitter-like. Coloc toda a gordura e o tecido removidos na limpeza. Identifique ambos os chifres uterine e o osso púrico.
- Coloque as tesouras fechadas entre a parede vaginal e o osso púrico. Corte cuidadosamente o meio do osso púbica (sínfise púbica). Coloque os pinças curvados em ambas as extremidades do osso púnico cortado. Puxe ambas as extremidades cortadas lateralmente para permitir um melhor acesso aos órgãos reprodutivos.
- Retire a bexiga e a uretra da parede vaginal. Isso pode ser feito usando pinças retas e Microtesouras. Segure a bexiga com pinças retas para criar tensão e usar técnicas de dissecção sem corte para separar o tecido circundante da vagina. Uma vez que a bexiga ea uretra são dissecados afastado, cortar a base e retire da cavidade do corpo.
- Identificar o sistema reprodutivo: os chifres uterinos bifurcar-se do colo do útero. O colo do útero pode ser identificado a partir da vagina devido a diferenças na geometria e rigidez. O diâmetro externo do colo do útero é menor do que a vagina. O colo do útero é mais duro do que a vagina e se sente semelhante ao de uma pérola (Figura 1).
- Use tinta e pinças para marcar pontos de 3 mm ao longo dos órgãos. Comece abaixo dos ovários nos tubos uterine e marque pontos inferiormente para alcangar o colo do útero. Use o ponto do colo do útero central para iniciar um caminho de ponto até a vagina Introitus.
- Permita que a tinta seque e separe os órgãos reprodutivos do tecido adiposo circundante, do tecido conjuntivo e do cólon. Limpe a vagina tão perto do Introitus vaginal quanto possível. Usando tesouras, corte em torno do Introitus vaginal.
Nota: é possível que os órgãos SECem durante este processo. Se esta é uma preocupação, uma seringa enchida com 4 ° c HBSS pode ser usada para adicionar a umidade aos órgãos. - Corte os chifres uterinos imediatamente inferiores aos ovários. Note que os órgãos irão retrair-se do comprimento do explante do borne enquanto o tecido conexivo é removido e o órgão recoils. Coloque os órgãos reprodutivos dissecados em uma placa de Petri preenchida com 4 ° c HBSS. Esta alteração de comprimento pode ser utilizada para calcular o comprimento in vivo estimado (secção 5).
Nota: identificamos que o uso de HBSS nesta temperatura durante a dissecção e a canulação não afetam a viabilidade da célula muscular lisa. Manter um pH de 7,4, no entanto, é imperativo para manter a viabilidade das células musculares lisas. A esta temperatura, o HBSS tem um nível de pH de 7,4. - Após um período de equilíbrio de 15 minutos em 4 ° c HBSS, meça o espaço entre os pontos usando calipers. Registre as medições para cada distância em uma planilha. Estes valores serão utilizados para calcular a relação de estiramento in vivo (comprimento original/comprimento explanted).
- Defina a limpeza que contém o tecido Descartado na região abdominal com o excesso de tecido voltado para o interior do mouse e mergulhe a limpeza em 4 ° c HBSS. Enrole o mouse e o excesso de tecido em folha e coloque em um saco de freezer seguro para ser armazenado em-20 ° c. O comportamento mecânico passivo na vagina não foi encontrado para ser significativamente diferente após um ciclo do Freeze-Thaw43. Todos os órgãos testados foram utilizados imediatamente após a eutanásia ou após um ciclo de congelamento-degelo.
3. cannulating
- Determine o tamanho adequado da cânula para o tipo de órgão. Em um típico C57BL6J mouse, a vagina usa cânulas que são ambos 3,75 mm de diâmetro e rebitadas. O colo do útero utiliza uma cânula de 3,75 mm para a extremidade vaginal e uma cânula de 0,75 mm de diâmetro para a extremidade uterina (Figura 2) a cânula de 0,75 mm é Lisa.
Nota: os tamanhos de diâmetro denotados acima são usados para os camundongos nulíparas 4-6 meses C57BL6, C57BL6 x 129SvEv e camundongos não parosos com idades compreendidas entre 7-9 meses. Entretanto, determinadas circunstâncias, tais como o prolapso ou a gravidez, podem exigir uma cânula maior do tamanho. - Com cada órgão, monte o lado cervical na porção do transdutor de força do dispositivo de canulação. Monte a extremidade oposta do órgão (vaginal ou uterino) na porção do micrômetro do dispositivo. Aperte ambas as extremidades com suturas.
- Devido à diferença de espessura e grau de contratilidade entre a vagina e o colo do útero, técnicas variadas podem ser utilizadas para realizar a canulação mais efetiva. Para a vagina, coloque 2 suturas entre os rebites 2ND e 3RD da cânula em uma forma "X". Quando canulação a cerviz, a cânula não é rebitada assim que o órgão é coloc melhor na parte traseira da cânula com 3 suturas horizontais na extremidade uterine e em 4 suturas no ósmio externo. Para ambos os órgãos, o comprimento máximo não deve ser superior a 7 mm entre as suturas (Figura 3).
4. pressão miógrafo set up
- A fim de configurar o sistema de miograma de pressão, ligue o sistema de teste e encha o frasco de reservatório com 200 mL de HBSS (Figura 4). Gire o calor para "sobre" e permita que o HBSS na garrafa de reservatório aqueça acima. Em seguida, ligue o microscópio e abra o programa de computador. Assegure-se de que a imagem do órgão canulado, da interface de pressão, das leituras do medidor de vazão e da ferramenta de função do sequenciador estejam visíveis (Figura 5).
5. teste mecânico do tom básico
Nota: o colo do útero exibiu uma natureza fásica durante os estágios iniciais do teste. No entanto, isso diminuiu após o pré-condicionamento. Teste de Tom basal é feito utilizando Krebs Ringer buffer (KRB) na bacia do dispositivo DMT. O tampão é aerado com 95% O2 e 5% co2. Depois que a porção basal do Tom está completa, o cálcio KRB livre é utilizado.
- Encontrando a geometria descarregada: esticar o órgão de modo que a parede não está em tensão. Para a vagina, observe os sulcos na parede vaginal. Para o colo do útero, corte imediatamente abaixo dos pontos de tinta que se localizam acima e abaixo da marca do colo central. Isto elabora um método repetível para um comprimento in situ cervical de 6 milímetros44. Meça o comprimento da sutura à sutura com pinças
- Encontrando a pressão descarregada (UP): aumente a pressão de 0 a 10 mmHg em incrementos de 1 mmHg. Determine a pressão na qual o órgão não está mais recolhido. Isto pode ser determinado como o salto o maior no diâmetro exterior em uma pressão dada, como exibido no monitor do programa. Depois de gravar a pressão e o diâmetro exterior, anote isto como o primeiro ponto em que o órgão não é recolhido e zero a força.
- Estique in vivo estimado: Calcule o estiramento in vivo estimado dividindo o comprimento medido in vivo pelo explante medido do borne do comprimento:

- Pré-condicionamento pressão-diâmetro: ajuste a pressão para 0 mmHg, o comprimento para o comprimento
 estimado in vivo e o gradiente para 1,5 mmHg/s. execute uma sequência que leve a pressão de 0 mmHg para a pressão in vivo + descarregada (tabela 1), segure por 30 segundos, e tome a pressão a 0 mmHg com um período de preensão de 30 segundos. Depois de repetir para um total de 5 ciclos, pressione parar no programa de computador e salve o arquivo.
estimado in vivo e o gradiente para 1,5 mmHg/s. execute uma sequência que leve a pressão de 0 mmHg para a pressão in vivo + descarregada (tabela 1), segure por 30 segundos, e tome a pressão a 0 mmHg com um período de preensão de 30 segundos. Depois de repetir para um total de 5 ciclos, pressione parar no programa de computador e salve o arquivo. - Encontrando o trecho experimental in vivo: ajuste o órgão para estar no comprimento estimado in vivo enquanto na pressão descarregada e pressione Start. Avalie os valores de pressão versus força para valores de pressão que vão desde a pressão descarregada até a pressão máxima (tabela 1). Pressione o botão parar no programa de computador e salve o arquivo.
Nota: o valor de estiramento medido é calculado in situ. Isto é acompanhado pela limitação que só pode ser medido após a desarticulação da sínfise púbica. Como resultado, o tethering natural é perdido, o que pode modificar o comprimento. O estiramento teórico, entretanto, é baseado na teoria previamente introduzida que o órgão experimentará mudanças mínimas na força quando expor às pressões physiological para conservar a energia45. No protocolo, o trecho in vivo medido será o valor de estiramento calculado usando o comprimento experimentalmente identificado em que há uma alteração mínima na força quando exposta a uma faixa fisiológica de pressões. - Pressão-diâmetro pré-condicionamento: definir a pressão para 0 mmHg, o comprimento para o experimental in vivo comprimento, e o gradiente de 1,5 mmHg/s. executar uma seqüência que leva a pressão de 0 mmHg para a pressão máxima + UP, segure por 30 segundos, e volta para 0 mmHg com um anúncio período de espera de 30 segundos de informação adicional. Depois de repetir isso para um total de 5 ciclos, pressione o botão parar na interface do programa e salve o arquivo.
Nota: 5,4 é imperativo para alcançar uma leitura de força axial mais consistente com pressão crescente. Esta etapa auxilia na busca do trecho correto in vivo, que muitas vezes é subestimado com base em pistas visuais. 5,6 serve como um passo de precaução para minimizar a histerese e para conseguir uma resposta consistente, repetível, matematicamente interpretável do órgão. - Pré-condicionamento de força-comprimento: Insira 1/3 pressão máxima + UP para a pressão de entrada e saída. Ajuste o órgão para-2% do comprimento in vivo e pressione Start. Ajuste o comprimento para + 2% in vivo comprimento, em seguida, de volta para baixo para-2% a 10 μm/s. Repita a extensão axial para um total de 5 ciclos. Pressione parar no programa de computador e salve o arquivo.
- Equilibration: com o órgão no comprimento in vivo determinado, ajuste a pressão da entrada e da tomada em 1/3 da pressão máxima + acima. Equilibram o órgão por 10 minutos. Lentamente, leve ambas as pressões de volta para 0 mmHg com o gradiente definido como 1,5 mmHg/s.
- Reavalie a geometria descarregada: defina o órgão para o comprimento in vivo e a pressão para a pressão descarregada. Diminua o comprimento axial para o comprimento descarregado estimado a uma taxa de 10 μm/s até que haja uma mudança mínima na força. Este comprimento correspondente é conhecido como o comprimento descarregado, ou onde o órgão não está em tensão nem compressão. Antes de zerar a força, registre o comprimento descarregado, o diâmetro externo e o valor da força.
Nota: a geometria descarregada anterior foi determinada por pistas visuais, que é puramente qualitativa. Uma reavaliação é necessária para um método quantitativo e para dar conta de possíveis mudanças de comprimento que podem ocorrer durante o pré-condicionamento. Esta geometria será utilizada na secção 8. - Configuração do ultra-som: Use o pacote abdominal de imagem latente geral para visualizar os órgãos no dispositivo de teste. (Figura 6). Antes de testar, minimize artefatos da parte inferior da bacia do metal do miógrafo da pressão. Ajuste a cânula para uma altura que é a distância máxima do fundo com o tecido ainda está totalmente submerso na solução de teste. Um suporte personalizado é 3D impresso para estabilizar o transdutor em uma posição vertical durante a imagem.
- Imagem latente do ultra-som: identifique a cânula perto do transdutor da força e ajuste o estágio do microscópio à imagem ao longo do comprimento do tecido. Durante todo o processo de teste, a região intermediária ao longo do comprimento é rastreada (figura 6A, C). Depois da imagem latente, reveja o laço da "loja da cinematografia" que consiste em uma série de frames do B-modo e identifica o frame com o diâmetro exterior o maior. Os cálculos de espessura feitos serão usados na seção 8.
- Teste de diâmetro de pressão (-2% in vivo length): pressione Start e ajuste o órgão de modo que seja-2% do comprimento in vivo, defina a pressão para 0 mmHg e gradiente para 1,5 mmHg/s. aumente a pressão de 0 mmHg para a pressão máxima. Coloque a pressão de volta para 0 mmHg com um período de retenção de 20 segundos. Repita isso por 5 ciclos.
- Teste do diâmetro da pressão (in vivo comprimento): Pressione o começo e ajuste o órgão de modo que esteja no comprimento vivo, ajuste a pressão a 0 mmHg, e o inclinação a 1,5 mmHg/s. aumente a pressão de 0 mmHg à pressão máxima. Coloque a pressão de volta para 0 mmHg com um período de retenção de 20 segundos. Repita isso por 5 ciclos.
- Teste do diâmetro da pressão (+ 2% in vivo comprimento): ajuste o órgão de modo que seja + 2% in vivo comprimento, defina a pressão para 0 mmHg, e gradiente para 1,5 mmHg/s. aumente a pressão de 0 mmHg para a pressão máxima e, em seguida, volte para 0 mmHg com um período de retenção de 20 segundos. Repita isso por 5 ciclos. Os dados de pressão dos três comprimentos serão utilizados na secção 8.
- Teste da força-comprimento (pressão nominal): ajuste a pressão à pressão descarregada e ao órgão a-2% do comprimento in vivo. Esticar o órgão para + 2% do comprimento in vivo e voltar a-2% o comprimento in vivo a uma taxa de 10 μm/s. Repita para um total de 3 ciclos.
- Teste de força-comprimento (1/3 pressão máxima + UP): ajuste a pressão para 1/3 da pressão máxima + UP e ajuste o órgão para-2% o comprimento in vivo. Depois de pressionar Start, esticar o órgão para + 2% o in vivo comprimento e volta para-2% o in vivo comprimento a uma taxa de 10 μm/s. Depois de repetir para um total de 3 ciclos, pressione parar e salvar os dados.
- Teste de força-comprimento (2/3 pressão máxima + UP): ajuste a pressão para 2/3 da pressão máxima + UP e ajuste o órgão para-2% o comprimento in vivo. Pressione Start e esticar o órgão para + 2% o in vivo comprimento e volta para-2% o in vivo comprimento a uma taxa de 10 μm/s. Depois de repetir para um total de 3 ciclos, pressione parar e salvar os dados.
- Teste da força-comprimento (pressão máxima + acima): ajuste a pressão à pressão máxima + acima e ajuste o órgão a-2% o comprimento in vivo. A uma taxa de 10 μm/s, esticar o órgão para + 2% do in vivo comprimento e volta para-2% o in vivo comprimento. Depois de repetir para um total de 3 ciclos, salve os dados. Todos os dados de força serão usados na seção 8.
- Remova a mídia de teste KRB e lave com KRB sem cálcio. Substitua a mídia por solução de KRB livre de cálcio suplementada com 2 mM EGTA. Incubar o tecido durante 30 minutos. Retire a solução e substitua a mídia por KRB sem cálcio fresco.
6. teste mecânico passivo
Nota: se começar com o teste passivo iniciar no passo 1. Se o teste de Tom basal foi realizado antes do início passivo na etapa 6. Se começar com o tecido congelado, permita um período de equilíbrio de 30 minutos na temperatura ambiente antes de canulação o órgão.
- Encontrando a geometria descarregada: esticar o órgão para que a parede do órgão não está em tensão. Meça o órgão canulado da sutura à sutura e registre-o como o comprimento descarregado.
- Encontrando a pressão descarregada: após ter pressionado o começo, aumente a pressão de 0 a 10 mmHg nos incrementos de 1 mmHg. Ao atravessar este processo, determine a pressão em que o órgão não está na tensão. Usando o monitor do programa do computador, isto pode ser determinado do salto o maior no diâmetro exterior. Depois de zerar a força, registre esta pressão, bem como o diâmetro exterior e anote isso como o primeiro ponto em que o órgão não é recolhido.
- Estique in vivo estimado: Calcule o trecho in vivo estimado dividindo o comprimento medido in vivo pelo comprimento medido após o explante.
- Pre-condicionamento do diâmetro da pressão: após ter pressionado o começo, ajuste a pressão ajustada a 0 mmHg, o comprimento como o comprimento estimado in vivo, e o inclinação a 1,5 mmHg/s. comece a executar uma seqüência que leva a pressão de 0 mmHg para a pressão máxima e de volta para 0 Mmhg. Repita este processo através de 5 ciclos com um tempo de espera de 30 segundos.
- Pré-condicionamento do comprimento da força: ajuste o órgão ao comprimento in vivo e incorpore manualmente a pressão descarregada no programa de computador para ambas as pressões. Depois de pressionar Start, defina o gradiente para 2 mmHg e a pressão para 1/3 do máximo. Esticar o órgão até + 2% e recuar para-2% trecho a 10 μm/s. Repita este ciclo para um total de 5 vezes e prima Stop.
- Encontrando o comprimento experimental in vivo: encontre e plotar valores de força em-2% do comprimento in vivo, do comprimento in vivo e + 2% do comprimento in vivo. Tome forças em pressões uniformemente espaçadas variando de 0 mmHg à pressão máxima. O trecho experimental in vivo será o valor de estiramento que exibe uma linha relativamente plana sobre uma série de pressões.
- Repita o diâmetro da pressão e os passos de pré-condicionamento axial no novo comprimento in vivo.
- Equilibration: com o órgão no comprimento in vivo determinado, ajuste a pressão da entrada e da tomada à pressão descarregada. Deixe o órgão re-Equilibrate por 15 minutos. Após 15 minutos, lentamente, coloque a pressão de entrada e saída de volta para 0 mmHg.
- Reavalie a configuração descarregada: leve o órgão para o comprimento descarregado e reestime o comprimento descarregado. Registre o comprimento descarregado e o diâmetro exterior quando a pressão for 0 mmHg, a pressão descarregada, e 1/3 a pressão máxima. Zero a força na pressão descarregada. O diâmetro na pressão descarregada é o diâmetro in vivo.
Nota: reestimar o comprimento descarregado é necessário porque as deformações plásticas pequenas foram observadas previamente em tecidos biológicos macios que seguem o precondicionamento. Esta configuração descarregada será aquela utilizada na seção 8. - Ultra-som: Realize a imagem latente do modo B do ultra-som no comprimento descarregado e na pressão.
- Teste de pressão-diâmetro: com o órgão em-2% do comprimento experimentalmente determinado in vivo e a pressão em 0 mmHg, pressione Start. Aumente a pressão de 0 mmHg para a pressão máxima e de volta para 0 mmHg. Segure a etapa 2-0 mmHg por 20 segundos. Depois de repetir para um total de 5 vezes, pressione o botão parar na interface e salve o arquivo.
Nota: repita no comprimento experimental in vivo, + 2% do comprimento experimental in vivo. - Teste do força-comprimento: ajuste a pressão à pressão nominal e ajuste o órgão a-2% do comprimento in vivo. Esticar o órgão até + 2% do comprimento in vivo e voltar a-2% do comprimento in vivo a uma taxa de 10 μm/s. Depois de repetir para um total de 3 vezes, salve os dados. Repita isso para 1/3 pressão máxima, 2/3 pressão máxima, e na pressão máxima.
- Calcule a espessura descarregada da imagem do modo B das imagens do ultra-som. Usando o software de imagem, desenhe uma linha para denotar a profundidade de penetração. Ajuste a escala ao comprimento da linha (isto é, 2000 μm como mostrado na Figura 6B e 6D).
- Cálculos de espessura de parede: usando um software de computador, Trace e meça o diâmetro interno e externo do órgão. Em seguida, desenhe e meça uma linha entre os diâmetros. Desenhe um total de 25 linhas transmurais. Média de todos os pontos de dados e repita para um total de 3 vezes.
7. Limpe
- Assegure-se de que a pressão é 0 mmHg e desligada. Feche a entrada principal e a saída para ambas as válvulas de três vias. Aspirar o fluido remanescente da bacia do dispositivo de canulação.
- Retire o órgão do palco e encha a garrafa de reservatório com água desionizada. Utilizando uma seringa, lave a cânula com água. Ligue a tubagem para contornar a cânula.
- Gire a pressão e o fluxo sobre, ajuste a pressão de entrada a 200 mmHg, a pressão da tomada a 0 mmHg, gradient a 10 mmHg/s, e deixe o fluxo funcionar por 5 minutos. Permita que o sistema funcione enquanto a garrafa de reservatório está vazia e deixe o ar funcionar por 5 minutos ou até que as linhas estejam secas.
8. análise de dados
- Para o teste do diâmetro da pressão, colete dados de onde a pressão começa a aumentar do valor mínimo até o máximo. Para testes de força-comprimento, colete dados de um pouco abaixo do pico máximo em vigor até que a força parou de diminuir.
- Abra o arquivo de dados para cada teste de pressão-diâmetro e selecione a guia de pressão média. Navegue até a região de carregamento da última curva, 0 mmHg até a pressão máxima e solte os dados em uma planilha. Selecione a mesma região no diâmetro externo, pressão de entrada, pressão de saída, força, temperatura, pH e guia de fluxo colocando cada item no mesmo documento.
- Abra os dados para cada teste de comprimento de força. Navegue até a região de carregamento da curva,-2% a + 2% e arraste e solte os dados em uma planilha. Selecione a mesma região para as outras variáveis de medida e coloque cada item na mesma planilha.
- Para o diâmetro da pressão e o teste do comprimento da força subtrair o UP de todos os valores da pressão.
- Média dos dados de pressão-diâmetro a cada 1 mmHg (i.e., 0 +/-0,5, 1 +/-0,5, 2 +/-0,5).
- Encontre o volume descarregado do órgão (V). A equação 1 pode ser utilizada para encontrar V, dado que R02 é o raio externo descarregado medido pelo microscópio, L é o comprimento descarregado, e H é a espessura descarregada como detectada pelo ultra-som. A suposição da incompressibilidade é leveraged, significando que o órgão conserva o volume quando sujeitado às deformações.
Nota: o comprimento descarregado é medido com pinças da sutura à sutura. O diâmetro descarregado é medido através do microscópio, da câmera, e do software seguido pelo cálculo do raio (Figura 5) a espessura descarregada é calculada a partir das imagens de ultrassom (Figura 6).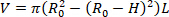 Equação 1
Equação 1 - Usando a suposição de incompressibilidade, use o volume descarregado, raio externo deformado (
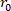 ) e length (
) e length (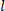 ) para determinar o raio
) para determinar o raio 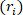 interno deformado.
interno deformado.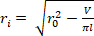 Equação 2
Equação 2 - Use as equações 3, 4 e 5 para calcular cada tensão, respectivamente. Nas equações 3-5, P é definida como a pressão intraluminal e Ft é a força medida pelo transdutor.
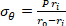 Equação 3
Equação 3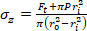 Equação 4
Equação 4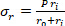 Equação 5
Equação 5 - Plotar a relação pressão-diâmetro, relação força-pressão, relação estiramento circunferencial do estresse circunferencial e o estresse axial e os valores de estiramento circunferencial (Figura 7, Figura 8). Os valores do estiramento podem ser calculados usando o raio do midwall. Cálculos das tensões circunferenciais e axiais podem ser encontrados nas equações 6 e 7, respectivamente.
 Equação 6
Equação 6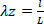 Equação 7
Equação 7 - Calcule a conformidade perto da faixa de pressão fisiológica e no trecho in vivo. O limite de pressão inferior (LPB) é 1 desvio padrão abaixo da pressão média medida. O limite de pressão superior (UPB) é de 1 desvio padrão acima da pressão média medida9.
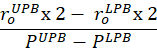
- Calcule a moduli tangente para quantificar a rigidez do material. Identifique a tensão circunferencial calculada que corresponde ao limite inferior de pressão e à pressão do limite superior. Ajuste uma linha linear à curva circunferencial do estiramento da tensão-circunferencial dentro da escala de esforço identificada no comprimento in vivo. Calcule a inclinação da linha9.
Resultados
A análise bem sucedida das propriedades mecânicas dos órgãos reprodutivos femininos depende da dissecção, canulação e teste de órgãos apropriados. É imperativo explante os chifres uterinos para a vagina sem quaisquer defeitos (Figura 1). Dependendo do tipo de órgão, o tamanho da cânula variará (Figura 2). A canulação deve ser feita para que o órgão não se mova durante o experimento, mas também não danifique a parede do órgão durante o procedimento...
Discussão
O protocolo fornecido neste artigo apresenta um método para determinar as propriedades mecânicas da vagina Murina e colo do útero. As propriedades mecânicas analisadas neste protocolo incluem as condições de Tom passivo e basal dos órgãos. As condições de Tom passivo e basal são induzidas alterando o ambiente bioquímico em que o órgão está submerso. Para este protocolo, a mídia envolvida no teste basal contém cálcio. Testar a condição basal do Tom permite a isolação da contribuição mecânica da pi...
Divulgações
Nenhum.
Agradecimentos
O trabalho foi financiado pela concessão do prêmio da carreira de NSF #1751050.
Materiais
| Name | Company | Catalog Number | Comments |
| 2F catheter | Millar | SPR-320 | catheter to measure cervical pressure |
| 6-0 Suture | Fine Science Tools | 18020-60 | larger suture ties |
| CaCl2 (anhydrous) | VWR | 97062-590 | HBSS concentration: 140 mg/ mL |
| CaCl2-2H20 | Fischer chemical | BDH9224-1KG | KRB concentration: 3.68 g/L |
| Dextrose (D-glucose) | VWR | 101172-434 | HBSS concentration: 1000 mg/mL KRB concentration: 19.8 g/L |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | curved forceps |
| Dumont SS Forceps | Fine Science Tools | 11203-25 | straight forceps |
| Eclipse | Nikon | E200 | microscope used for imaging |
| Flow meter | Danish MyoTechnologies | 161FM | flow meter within the testing apparatus |
| Force Transducer - 110P | Danish MyoTechnologies | 100079 | force transducer |
| ImageJ | SciJava | ImageJ1 | used to measure volume |
| Instrument Cases | Fine Science Tools | 20830-00 | casing to hold dissection tools |
| KCl | Fisher Chemical | 97061-566 | HBSS concentration: 400 mg/ mL KRB concentration: 3.5 g/L |
| KH2PO4 | G-Biosciences | 71003-454 | HBSS concentration: 60 mg/ mL |
| MgCl2 | VWR | 97064-150 | KRB concentration: 1.14 g/L |
| MgCl2-6H2O | VWR | BDH9244-500G | HBSS concentration: 100 mg/ mL |
| MgSO4-7H20 | VWR | 97062-134 | HBSS concentration: 48 mg/ mL |
| Mircosoft excel | Microsoft | 6278402 | program used for spreadsheet |
| Na2HPO4 (dibasic anhydrous) | VWR | 97061-588 | HBSS concentration: 48 mg/mL KRB concentration: 1.44 g/L |
| NaCl | VWR | 97061-274 | HBSS concentration: 8000 mg/mL KRB concentration: 70.1 g/L |
| NaHCO3 | VWR | 97062-460 | HBSS concentration: 350 mg/ mL KRB concentration: 21.0 g/L |
| Pressure myograph systems | Danish MyoTechnologies | 110P and 120CP | Pressure myograph system: prorgram, cannulation device, and controller unit |
| Pressure Transducer | Danish MyoTechnologies | 100106 | pressure transducer |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | straight forceps |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | micro-scissors |
| Tissue dye | Bradley Products | 1101-3 | ink to measure in vivo stretch |
| Ultrasound transducer | FujiFilm Visual Sonics | LZ-550 | ultrasound transducer used; 256 elements, 40 MHz center frequency |
| VEVO2100 | FujiFilm Visual Sonics | VS-20035 | ultrasound used for imaging |
| Wagner Scissors | Fine Science Tools | 14069-12 | larger scissors |
Referências
- Capone, D., et al. Evaluating Residual Strain Throughout the Murine Female Reproductive System. Journal of Biomechanics. 82, 299-306 (2019).
- Danforth, D. The fibrous nature of the human cervix, and its relation to the isthmic segment in gravid and nongravid uteri. American Journal of Obstetrics and Gynecology. 53 (4), 541-560 (1947).
- Hughesdon, P. The fibromuscular structure of the cervix and its changes during pregnancy and labour. Journal of Obstetrics and Gynecology of the British Commonwealth. 59, 763-776 (1952).
- Bryman, I., Norstrom, A., Lindblo, B. Influence of neurohypophyseal hormones on human cervical smooth muscle cell contractility in vitro. Obstetrics and Gynecology. 75 (2), 240-243 (1990).
- Joy, V., et al. A New Paradigm for the Role of Smooth Muscle Cells in the Human Cervix. Obstetrics. 215 (4), e471-e478 (2016).
- Xu, X., Akgul, Y., Mahendroo, M., Jerschow, A. Ex vivo assessment of mouse cervical remodeling through pregnancy via Na (23) MRS. NMR Biomedical. 23 (23), 907-912 (2014).
- Leppert, P. Anatomy and Physiology of cervical ripening. Clinical Obstetrics and Gynecology. 43 (43), 433-439 (2000).
- Schlembach, D., et al. Cervical ripening and insufficiency: from biochemical and molecular studies to in vivo clinical examination. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 144, S70-S79 (2000).
- Stoka, K., et al. Effects of Increased Arterial Stiffiness on Atherosclerotic Plaque Amounts. Journal of Biomechanical Engineering. 140 (5), (2018).
- Mohram, D., Heller, L. Ch. 7. Cardiovascular Physiology. , (2006).
- Yoshida, K., et al. Quantitative Evaluation of Collagen Crosslinks and Corresponding Tensile Mechanical Properties in Mouse Cervical Tissue during Normal Pregnancy. PLoS One. 9, e112391 (2014).
- Mahendroo, M. Cervical remodeling in term and preterm birth: insight from an animal model. Society for Reproduction and Fertility. 143 (4), 429-438 (2012).
- Elovitz, M., Miranlini, C. Can medroxyprogesterone acetate alter Toll-like receptor expression in a mouse model of intrauterine inflammation?. American Journal of Obstetrics and Gynecology. 193 (3), 1149-1155 (2005).
- Ripperda, C., et al. Vaginal estrogen: a dual-edged sword in postoperative healing of the vaginal wall. North American Menopause Society. 24 (7), 838-849 (2017).
- Nelson, J., Felicio, P., Randall, K., Sims, C., Finch, E. A Longitudinal Study of Estrous Cyclicity in Aging C57/6J Mice: Cycle, Frequency, Length, and Vaginal Cytology. Biology of Reproduction. 27 (2), 327-339 (1982).
- Ferruzzi, J., Collins, M., Yeh, A., Humphrey, J. Mechanical assessment of elastin integrity in fibrillin-1-deficient carotid arteries: implications for Marfan Syndrome. Cardiovascular Research. 92 (2), 287-295 (2011).
- Mariko, B., et al. Fribrillin-1 genetic deficiency leads to pathological ageing of arteries in mice. The Journal of Pathology. 224 (1), 33-44 (2011).
- Rahn, D., Ruff, M., Brown, S., Tibbals, H., Word, R. Biomechanical Properties of The Vaginal Wall: Effect of Pregnancy, Elastic Fiber Deficiency, and Pelvic Organ Prolapse. American Urogynecological Society. 198 (5), (2009).
- Caulk, A., Nepiyushchikh, Z., Shaw, R., Dixon, B., Gleason, R. Quantification of the passive and active biaxial mechanical behavior and microstructural organization of rat thoracic ducts. Royal Society Interface. 12 (108), 20150280 (2015).
- Amin, M., Le, V., Wagenseil, J. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. Journal of Visualized Experiments. (60), e3733 (2012).
- Sokolis, D., Sassani, S., Kritharis, E., Tsangaris, S. Differential histomechanical response of carotid artery in relation to species and region: mathematical description accounting for elastin and collagen anisiotropy. Medical and Biological Engineering and Computing. 49 (8), 867-879 (2011).
- Kim, J., Baek, S. Circumferential variations of the mechanical behavior of the porcine thoracic aorta during the inflation test. Journal of Biomechanics. 44 (10), 1941-1947 (2011).
- Faury, G., et al. Developmental adaptation of the mouse cardiovascular system to elastin haploinsufficency. Journal of Clinical Investigation. 11 (9), 1419-1428 (2003).
- Naito, Y., et al. Beyond Burst Pressure: Initial Evaluation of the Natural History of the Biaxial Mechanical Properties of Tissue-Engineered Vascular Grafts in the Venous Circulation Using a Murine Model. Tissue Engineering. 20, 346-355 (2014).
- Sommer, G., et al. Multaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
- Sokolis, D., Orfanidis, I., Peroulis, M. Biomechanical testing and material characterization for the rat large intestine: regional dependence of material parameters. Physiological Measurement. 32 (12), 1969-1982 (2011).
- Martins, P., et al. Prediction of Nonlinear Elastic Behavior of Vaginal Tissue: Experimental Results and Model Formation. Computational Methods of Biomechanics and Biomedical Engineering. 13 (3), 317-337 (2010).
- Feola, A., et al. Deterioration in Biomechanical Properties of the Vagina Following Implantation of a High-stiffness Prolapse Mesh. BJOG: An International Journal of Obstetrics and Gynaecology. 120 (2), 224-232 (2012).
- Huntington, A., Rizzuto, E., Abramowitch, S., Prete, Z., De Vita, R. Anisotropy of the Passive and Active Rat Vagina Under Biaxial Loading. Annals of Biomedical Engineering. 47, 272-281 (2018).
- Tokar, S., Feola, A., Moalli, P., Abramowitch, S. Characterizing the Biaxial Mechanical Properties of Vaginal Maternal Adaptations During Pregnancy. ASME 2010 Summer Bioengineering Conference, Parts A and B. , 689-690 (2010).
- Feloa, A., et al. Impact of Pregnancy and Vaginal Delivery on the Passive and Active Mechanics of the Rat Vagina. Annals of Biomedical Engineering. 39 (1), 549-558 (2010).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical Analysis of the Uterosacral Ligament: Swine vs Human. Annual Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Champlin, A. Determining the Stage of the Estrous Cycle in the Mouse by the Appearance. Biology of Reproduction. 8 (4), 491-494 (1973).
- Byers, S., Wiles, M., Dunn, S., Taft, R. Mouse Estrous Cycle Identification Tool and Images. PLoS One. 7 (4), e35538 (2012).
- McLean, A. Performing Vaginal Lavage, Crystal Violet Staining and Vaginal Cytological Evaluation for Mouse Estrous Cycle Staging Identification. Journal of Visualized Experiments. 67, e4389 (2012).
- Bugg, G., Riley, M., Johnston, T., Baker, P., Taggart, M. Hypoxic inhibition of human myometrial contractions in vitro: implications for the regulation of parturition. European Journal of Clinical Investigation. 36 (2), 133-140 (2006).
- Taggart, M., Wray, S. Hypoxia and smooth muscle function: key regulatory events during metabolic stress. Journal of Physiology. 509, 315-325 (1998).
- Yoo, K., et al. The effects of volatile anesthetics on spontaneous contractility of isolated human pregnant uterine muscle: a comparison among sevoflurane, desflurane, isoflurane, and halothane. Anesthesia and Analgesia. 103 (2), 443-447 (2006).
- de Souza, L., et al. Effects of redox disturbances on intentional contractile reactivity in rats fed with a hypercaloric diet. Oxidative Medicine and Cellular Longevity. , 6364821 (2018).
- Jaue, D., Ma, Z., Lee, S. Cardiac muscarinic receptor function in rats with cirrhotic cardiomyopathy. Hepatology. 25, 1361-1365 (1997).
- Xu, Q., Shaffer, E. The potential site of impaired gallbladder contractility in an animal mode of cholesterol gallstone disease. Gastroenterology. 110 (1), 251-257 (1996).
- Rodriguez, U., et al. Effects of blast induced Neurotrauma on pressurized rodent middle cerebral arteries. Journal of Visualized Experimentals. (146), e58792 (2019).
- Rubod, C., Boukerrou, M., Brieu, M., Dubois, P., Cosson, M. Biomechanical Properties of Vaginal Tissue Part 1: New Experimental Protocol. Journal of Urology. 178, 320-325 (2007).
- Robison, K., Conway, C., Desrosiers, L., Knoepp, L., Miller, K. Biaxial Mechanical Assessment of the Murine Vaginal Wall Using Extension-Inflation Testing. Journal of Biomechanical Engineering. 139 (10), 104504 (2017).
- Van loon, P. Length-Force and Volume-Pressure Relationships of Arteries. Biorheology. 14 (4), 181-201 (1977).
- Fernandez, M., et al. Investigating the Mechanical Function of the Cervix During Pregnancy using Finite Element Models Derived from High Resolution 3D MRI. Computational Methods Biomechanical and Biomedical Engineering. 19 (4), 404-417 (2015).
- House, M., Socrate, S. The Cervix as a Biomechanical Structure. Ultrasound Obstetric Gynecology. 28 (6), 745-749 (2006).
- Martins, P., et al. Biomechanical Properties of Vaginal Tissue in Women with Pelvic Organ Prolapse. Gynecologic and Obstetrics Investigation. 75, 85-92 (2013).
- Rada, C., Pierce, S., Grotegut, C., England, S. Intrauterine Telemetry to Measure Mouse Contractile Pressure In vivo. Journal of Visualized Experiments. (98), e52541 (2015).
- Lumsden, M. A., Baird, D. T. Intra-uterine pressure in dysmenorrhea. Acta Obstectricia at Gynecologica Scandinavica. 64 (2), 183-186 (1985).
- Milsom, I., Andersch, B., Sundell, G. The Effect of Flurbiprofen and Naproxen Sodium On Intra-Uterine Pressure and Menstrual Pain in Patients With Primary Dysmennorrhea. Acta Obstetricia et Gynecologica Scandinavica. 67 (8), 711-716 (1988).
- Park, K., et al. Vasculogenic female sexual dysfunction: the hemodynamic basis for vaginal engorgement insufficiency and clitoral erectile insufficiency. International Journal of Impotence Journal. 9 (1), 27-37 (1997).
- Bulletti, C., et al. Uterine Contractility During Menstrual Cycle. Human Reproduction. 15, 81-89 (2000).
- Kim, N. N., et al. Effects of Ovariectomy and Steroid Hormones on Vaginal Smooth Muscle Contractility. International Journal of Impotence Research. 16, 43-50 (2004).
- Giraldi, A., et al. Morphological and Functional Characterization of a Rat Vaginal Smooth Muscle Sphincter. International Journal of Impotence Research. 14, 271-282 (2002).
- Gleason, R., Gray, S. P., Wilson, E., Humphrey, J. A Multiaxial Computer-Controlled Organ Culture and Biomechanical Device for Mouse Carotid Arteries. Journal of Biomechanical Engineering. 126 (6), 787-795 (2005).
- Swartz, M., Tscumperlin, D., Kamm, R., Drazen, J. Mechanical Stress is Communicated Between Different Cell Types to Elicit Matrix Remodeling. Proceedings of the National Academy of Sciences of the United States of America. 98 (11), 6180-6185 (2001).
- Rachev, A. Remodeling of Arteries in Response to Changes in their Mechanical Environment. Biomechanics of Soft Tissue in Cardiovascular Systems. 441, 221-271 (2003).
- Lee, E. J., Holmes, J., Costa, K. Remodeling of Engineered Tissue Anisotropy in Response to Altered Loading Conditions. Annals of Biomedical Engineering. 36 (8), 1322-1334 (2008).
- Akintunde, A., et al. Effects of Elastase Digestion on the Murine Vaginal Wall Biaxial Mechanical Response. Journal of Biomechanical Engineering. 141 (2), 021011 (2018).
- Griffin, M., Premakumar, Y., Seifalian, A., Butler, P., Szarko, M. Biomechanical Characterization of Human Soft Tissues Using Indentation and Tensile Testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Myers, K., Socrate, S., Paskaleva, A., House, M. A Study of the Anisotripy and Tension/Compression Behavior of Human Cervical Tissue. Journal of Biomechanical Engineering. 132 (2), 021003 (2010).
- Murtada, S., Ferruzzi, J., Yanagisawa, H., Humphrey, J. Reduced Biaxial Contractility in the Descending Thoracic Aorta of Fibulin-5 Deficent Mice. Journal of Biomechanical Engineering. 138 (5), 051008 (2016).
- Berkley, K., McAllister, S., Accius, B., Winnard, K. Endometriosis-induced vaginal hyperalgesia in the rat: effect of estropause, ovariectomy, and estradiol replacement. Pain. 132, s150-s159 (2007).
- van der Walt, I., Bø, K., Hanekom, S., Rienhardt, G. Ethnic Differences in pelvic floor muscle strength and endurance in South African women. International Urogynecology Journal. 25 (6), 799-805 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados