Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tono Basal Biaxial y Pruebas Pasivas del Sistema Reproductivo Murino Usando un Miógrafo de Presión
En este artículo
Resumen
Este protocolo utilizó un sistema de miógrafo de presión disponible comercialmente para realizar pruebas de miógrafo de presión en la vagina murina y el cuello uterino. Utilizando medios con y sin calcio, las contribuciones del tono basal de las células musculares lisas (SMC) y la matriz extracelular pasiva (ECM) se aislaron para los órganos en condiciones fisiológicas estimadas.
Resumen
Los órganos reproductores femeninos, específicamente la vagina y el cuello uterino, se componen de varios componentes celulares y una matriz extracelular única (ECM). Las células musculares lisas exhiben una función contráctea dentro de las paredes vaginales y cervicales. Dependiendo del entorno bioquímico y la distensión mecánica de las paredes del órgano, las células musculares lisas alteran las condiciones contráctas. La contribución de las células musculares lisas en condiciones fisiológicas basales se clasifica como un tono basal. Más específicamente, un tono basal es la constricción parcial basal de las células musculares lisas en ausencia de estimulación hormonal y neuronal. Además, el ECM proporciona soporte estructural para las paredes de los órganos y funciona como un reservorio para señales bioquímicas. Estas señales bioquímicas son vitales para varias funciones del órgano, como incitar al crecimiento y mantener la homeostasis. El ECM de cada órgano se compone principalmente de fibras de colágeno (principalmente tipos de colágeno I, III y V), fibras elásticas y glicosaminoglicanos/proteoglicanos. La composición y organización del ECM dicta las propiedades mecánicas de cada órgano. Un cambio en la composición de la ECM puede conducir al desarrollo de patologías reproductivas, como el prolapso de órganos pélvicos o la remodelación cervical prematura. Además, los cambios en la microestructura y rigidez de ECM pueden alterar la actividad celular muscular lisa y el fenotipo, lo que resulta en la pérdida de la fuerza contráctea.
En este trabajo, los protocolos reportados se utilizan para evaluar el tono basal y las propiedades mecánicas pasivas de la vagina de la murina no embarazada y el cuello uterino a los 4-6 meses de edad en estrus. Los órganos se montaron en un miógrafo de presión disponible comercialmente y se realizaron pruebas de diámetro de presión y de longitud de fuerza. Se incluyen datos de muestra sin muestras y técnicas de análisis de datos para la caracterización mecánica de los órganos reproductivos. Dicha información puede ser útil para construir modelos matemáticos y diseñar racionalmente intervenciones terapéuticas para las patologías de salud de las mujeres.
Introducción
La pared vaginal se compone de cuatro capas, el epitelio, lamina propria, muscularis, y adventitia. El epitelio se compone principalmente de células epiteliales. La lámina propria tiene una gran cantidad de fibras elásticas y fibrilares de colágeno. El muscularis también se compone de fibras de elastina y colágeno, pero tiene una mayor cantidad de células musculares lisas. La adventitia se compone de elastina, colágeno y fibroblastos, aunque en concentraciones reducidas en comparación con las capas anteriores. Las células musculares lisas son de interés para los grupos de investigación biomecánicos motivados, ya que juegan un papel en la naturaleza contráctea de los órganos. Como tal, cuantificar la fracción de área muscular lisa y la organización es clave para entender la función mecánica. Investigaciones anteriores sugieren que el contenido muscular liso dentro de la pared vaginal está organizado principalmente en el eje circunferencial y longitudinal. El análisis histológico sugiere que la fracción de área muscular lisa es aproximadamente 35% para las secciones proximal y distal de la pared1.
El cuello uterino es una estructura altamente colágeno, que hasta hacepoco, se pensaba que tenía un contenido mínimo de células musculares lisas 2,3. Estudios recientes, sin embargo, han sugerido que las células musculares lisas pueden tener una mayor abundancia y papel en el cuello uterino4,5. El cuello uterino presenta un gradiente de células musculares lisas. El os interno contiene 50-60% células musculares lisas donde el os externo sólo contiene 10%. Estudios de ratón, sin embargo, reportan que el cuello uterino está compuesto de 10-15% células musculares lisas y 85-90% tejido conectivo fibroso sin mención de diferencias regionales6,7,8. Dado que el modelo de ratón difiere del modelo humano frecuentemente reportado, se necesitan más investigaciones sobre el cuello uterino del ratón.
El propósito de este protocolo era dilucidar las propiedades mecánicas de la vagina murina y el cuello uterino. Esto se logró mediante el uso de un dispositivo miógrafo de presión que permite la evaluación de las propiedades mecánicas en las direcciones circunferenciales y axiales simultáneamente, manteniendo las interacciones célula-matriz nativas y la geometría de órganos. Los órganos se montaron en dos cánulas personalizadas y se aseguraron con suturas de seda 6-0. Se realizaron pruebas de diámetro de presión alrededor del estiramientoaxial fisiológico estimado para determinar el cumplimiento y el mínimo tangente 9. Se realizaron pruebas de longitud de fuerza para confirmar el estiramiento axial estimado y para asegurar que las propiedades mecánicas se cuantificaran en el rango fisiológico. El protocolo experimental se realizó en la vagina murina no embarazada y el cuello uterino a los 4-6 meses de edad en estrus.
El protocolo se divide en dos secciones principales de pruebas mecánicas: tono basal y pruebas pasivas. Un tono basal se define como la constricción parcial basal de las células musculares lisas, incluso en ausencias de estimulación local, hormonal y neuronal externa10. Esta naturaleza contráctea basal de la vagina y el cuello uterino produce comportamientos mecánicos característicos que luego se miden por el sistema miógrafo de presión. Las propiedades pasivas se evalúan mediante la eliminación del calcio intercelular que mantiene el estado basal de contracción, lo que resulta en la relajación de las células musculares lisas. En el estado pasivo, las fibras de colágeno y elastina proporcionan las contribuciones dominantes para las características mecánicas de los órganos.
El modelo murino se utiliza ampliamente para estudiar patologías en la salud reproductiva de las mujeres. El ratón ofrece varias ventajas para cuantificar las relaciones en evolución entre eCM y las propiedades mecánicas dentro del sistema reproductivo11,12,13,14. Estas ventajas incluyen ciclos estrosos cortos y bien caracterizados, costo relativamente bajo, facilidad de manejo, y un tiempo gestacional relativamente corto15. Además, el genoma de los ratones de laboratorio es bien mapeado y los ratones modificados genéticamente son herramientas valiosas para probar hipótesis mecanicistas16,17,18.
Los sistemas de miógrafo a presión disponibles comercialmente se utilizan ampliamente para cuantificar las respuestas mecánicas de diversos tejidos y órganos. Algunas estructuras notables analizadas en el sistema de miógrafo de presión incluyen arterias elásticas19,20,21,22, venas e injertos vasculares de ingeniería de tejido23,24, el esófago25,y los intestinos gruesos26. La tecnología de miógrafo de presión permite la evaluación simultánea de las propiedades en las direcciones axial y circunferencial, manteniendo las interacciones celulares nativas y la geometría in vivo. A pesar del uso extensivo de sistemas de miógrafo en la mecánica de tejidos blandos y órganos, no se había desarrollado previamente un protocolo que utilizaba la tecnología de miógrafo de presión para la vagina y el cuello uterino. Se evaluaron las investigaciones previas sobre las propiedades mecánicas de la vagina y el cuello uterino uniaxialmente27,28. Estos órganos, sin embargo, experimentan carga multiaxial dentro del cuerpo29,30, por lo tanto cuantificar su respuesta mecánica biaxial es importante.
Por otra parte, trabajos recientes sugieren células musculares lisas pueden desempeñar un papel potencial en patologías de tejidos blandos5,28,31,32. Esto proporciona otra atracción de la utilización de la tecnología de miógrafo de presión, ya que preserva las interacciones célula-matriz nativas, permitiendo así la delineación de la contribución que las células musculares lisas juegan en fisiológica y fisiopatológica Condiciones. Aquí, proponemos un protocolo para cuantificar las propiedades mecánicas multiaxiales de la vagina y el cuello uterino tanto en el tono basal como en las condiciones pasivas.
Protocolo
Para este estudio se utilizaron ratones hembra Singarantías de 4-6 meses (29,4 x 6,8 gramos) en estrus. Todos los procedimientos fueron aprobados por el Comité de Cuidado y Uso de Animales del Instituto de la Universidad de Tulane. Después del parto, los ratones se aclimataron durante una semana antes de la eutanasia y fueron alojados en condiciones estándar (ciclos de luz/oscuridad de 12 horas).
1. Sacrificio del ratón en estrus
- Determinar el ciclo estercio: El ciclo estroso fue monitoreado por evaluación visual de acuerdo con estudios anteriores15,33,34. El ciclo estroso consta de cuatro etapas: proestrus, estrus, metestrus y diestrus. Durante la fase de proestrus, los genitales están hinchados, rosados, húmedos y arrugados. La fase de estrus es arrugada pero menos hinchada, rosa da rosa y húmeda. Metestrus y diestrus se divulgan como no presentan hinchazón y arrugas, carentes de un tono rosa, y seco34,35.
- Realizar experimentos en estrus: Todas las pruebas mecánicas se realizaron mientras los ratones estaban en estrus, ya que es el más fácil de visualizar y proporciona un punto de tiempo consistente y repetible.
- Para ratones sometidos a pruebas de tono basal, eutanasia a través de guillotina. Para ratones probados sólo en condiciones pasivas, euthanizar utilizando dióxido de carbono (CO2) inhalación. La guillotina sirve para preservar la función de las células musculares lisas del tracto reproductivo, ya que el gas CO2 altera las propiedades contrácles de las células musculares lisas36,37,38, 39,40,41,42. Es imperativo realizar la disección dentro de 30 minutos para minimizar la posibilidad de apoptosis celular.
2. Disección del sistema reproductivo
- Configuración: Coloque una almohadilla absorbente en la estación de trabajo y llene una placa Petri y una jeringa con una solución de sal equilibrada (HBSS) de Hank de 4 oC. Use una toallita para la eliminación de tejido adiposo. Coloque el lado ventral del ratón hacia arriba y pegue las patas y la cola. Encienda las luces del microscopio y ponga las microtijeras, las tijeras, dos pares de pinzas rectas y dos pares de pinzas curvas.
- Usando pinzas y tijeras en ángulo, levante la piel alrededor del abdomen y haga una incisión en la base del abdomen, por encima del hueso púbico. La incisión debe ser lo suficientemente superficial como para no perforar la pared muscular abdominal. Continúe usando las tijeras para cortar superiormente hacia la caja torácica y profundamente a través de los músculos abdominales.
- Retire la grasa superficial tirando ligeramente de la grasa con las pinzas curvadas y microtijeras. El tejido adiposo reflejará la luz heterogéneamente con una apariencia similar a la brillante. Coloque toda la grasa y el tejido eliminados en la toallita. Identifique los cuernos uterinos y el hueso púbico.
- Coloque tijeras cerradas entre la pared vaginal y el hueso púbico. Cortar cuidadosamente la mitad del hueso púbico (sínfisis púbica). Coloque pinzas curvadas en ambos extremos del hueso púbico cortado. Tire de ambos extremos cortados lateralmente para permitir un mejor acceso a los órganos reproductivos.
- Retire la vejiga y la uretra de la pared vaginal. Esto se puede hacer mediante el uso de pinzas rectas y microtijeras. Sostenga la vejiga con pinzas rectas para crear tensión y utilice técnicas de disección contundente para separar el tejido circundante de la vagina. Una vez que la vejiga y la uretra se diseccionan, corta la base y retírala de la cavidad corporal.
- Identificar el sistema reproductivo: Los cuernos uterinos se bifurcan desde el cuello uterino. El cuello uterino se puede identificar desde la vagina debido a diferencias en geometría y rigidez. El diámetro exterior del cuello uterino es más pequeño que la vagina. El cuello uterino es más rígido que la vagina y se siente similar al de un cordón (Figura1).
- Utilice tinta y pinzas para marcar puntos de 3 mm a lo largo de los órganos. Comience por debajo de los ovarios en los tubos uterinos y marque los puntos de forma inferior para llegar al cuello uterino. Usa el punto del cuello uterino central para iniciar un camino de puntos hasta la vagina introitus.
- Deje que la tinta seque y separe los órganos reproductivos del tejido adiposo circundante, el tejido conectivo y el colon. Limpie la vagina lo más cerca posible del introitus vaginal. Usando tijeras, corta alrededor del introitus vaginal.
NOTA: Es posible que los órganos se sequen durante este proceso. Si se trata de una preocupación, se puede utilizar una jeringa llena de HBSS de 4 oC para añadir humedad a los órganos. - Cortar los cuernos uterinos inmediatamente inferiores a los ovarios. Tenga en cuenta que los órganos se retraerán de la longitud posterior de la explanta a medida que se extrae el tejido conectivo y el órgano retrocede. Colocar los órganos reproductivos diseccionados en una placa de Petri llena de 4 oC HBSS. Este cambio de longitud se puede utilizar para calcular la longitud in vivo estimada (sección 5).
NOTA: Hemos identificado que el uso de HBSS a esta temperatura durante la disección y la cannullación no afecta a la viabilidad de las células musculares lisas. Mantener un pH de 7.4, sin embargo, es imperativo para mantener la viabilidad de las células musculares lisas. A esta temperatura, el HBSS tiene un nivel de pH de 7,4. - Después de un período de equilibrio de 15 minutos en 4 oC HBSS, mida el espacio entre los puntos utilizando pinzas. Registre las mediciones de cada distancia en una hoja de cálculo. Estos valores se utilizarán para calcular la relación de estiramiento in vivo (longitud original/longitud explantada).
- Fije la toallita que contiene el tejido desechado en la región abdominal con el exceso de tejido mirando hacia el interior del ratón y empape la toallita en 4 oC HBSS. Envuelva el ratón y el exceso de tejido en papel de aluminio y colóquelo en una bolsa de seguridad congeladora que se almacenará a -20 oC. No se encontró que el comportamiento mecánico pasivo en la vagina fuera significativamente diferente después de un ciclo de congelación-descongelación43. Todos los órganos analizados se utilizaron inmediatamente después de la eutanasia o después de un ciclo de congelación y descongelación.
3. Canulación
- Determine el tamaño adecuado de la cánula para el tipo de órgano. En un ratón C57BL6J típico, la vagina utiliza cánulas de 3,75 mm de diámetro y remachadas. El cuello uterino utiliza una cánula de 3,75 mm para el extremo vaginal y una cánula de 0,75 mm de diámetro para el extremo uterino (Figura 2) La cánula de 0,75 mm es lisa.
NOTA: Los tamaños de diámetro indicados anteriormente se utilizan para ratones C57BL6 de 4-6 meses de nulo típicos, C57BL6 x 129SvEv y ratones no parosos de 7 a 9 meses. Sin embargo, ciertas circunstancias, como el prolapso o el embarazo, pueden requerir una cánula de mayor tamaño. - Con cada órgano, monte el lado cervical en la parte del transductor de fuerza del dispositivo de cánula. Monte el extremo opuesto del órgano (vaginal o uterino) en la parte del micrómetro del dispositivo. Apriete ambos extremos con suturas.
- Debido a la diferencia de grosor y grado de contractilidad entre la vagina y el cuello uterino, se pueden utilizar diversas técnicas para realizar la cannulación más eficaz. Para la vagina, coloque 2 suturas entre los remaches 2y 3 de la cánula de una manera "X". Al canular el cuello uterino, la cánula no se remacha por lo que el órgano se coloca mejor en la parte posterior de la cánula con 3 suturas horizontales en el extremo uterino y 4 suturas en el os externo. Para ambos órganos, la longitud máxima no debe ser superior a 7 mm entre las suturas (Figura3).
4. Miógrafo de presión configurado
- Para configurar el sistema de miógrafo de presión, encienda el sistema de ensayo y llene la botella del depósito con 200 ml de HBSS (Figura4). Encienda el fuego y deje que el HBSS de la botella del depósito se caliente. A continuación, encienda el microscopio y abra el programa informático. Asegúrese de que la imagen del órgano cannulado, la interfaz de presión, las lecturas del medidor de flujo y la herramienta de función del secuenciador estén visibles (Figura5).
5. Pruebas mecánicas de tono basal
NOTA: El cuello uterino exhibió una naturaleza fásica durante las etapas iniciales de las pruebas. Sin embargo, esto disminuyó después del preacondicionamiento. Las pruebas de tono basal se realizan utilizando Krebs Ringer Buffer (KRB) en la cuenca del dispositivo DMT. El búfer se airea con 95% O2 y 5% CO2. Una vez completada la porción del tono basal, se utiliza KRB libre de calcio.
- Búsqueda de la geometría descargada: Estire el órgano para que la pared no esté en tensión. Para la vagina, observe los surcos en la pared vaginal. Para el cuello uterino, corte inmediatamente debajo de los puntos de tinta que se encuentran por encima y por debajo de la marca del cuello uterino central. Esto idea un método repetible para una longitud in situ cervical de 6 mm44. Mida la longitud de la sutura a la sutura con pinzas
- Encontrar la presión descargada (UP): Aumente la presión de 0 a 10 mmHg en incrementos de 1 mmHg. Determinar la presión en la que el órgano ya no está colapsado. Esto se puede determinar como el salto más grande en el diámetro exterior a una presión dada, como se muestra en el monitor del programa. Después de registrar la presión y el diámetro exterior, tenga en cuenta esto como el primer punto en el que el órgano no se derrumba y cero la fuerza.
- Estiramiento in vivo estimado: Calcule el estiramiento in vivo estimado dividiendo la longitud medida in vivo por la longitud medida después de la explantación:

- Preacondicionamiento de diámetro de presión: Ajuste la presión a 0 mmHg, la longitud a la longitud
 in vivo estimada y el gradiente a 1,5 mmHg/s. Ejecute una secuencia que lleve la presión de 0 mmHg a la presión in vivo + descargada (Tabla1), sostenga durante 30 segundos, y tomar la presión a 0 mmHg con un período de retención de 30 segundos. Después de repetir un total de 5 ciclos, pulse Detener en el programa informático y guarde el archivo.
in vivo estimada y el gradiente a 1,5 mmHg/s. Ejecute una secuencia que lleve la presión de 0 mmHg a la presión in vivo + descargada (Tabla1), sostenga durante 30 segundos, y tomar la presión a 0 mmHg con un período de retención de 30 segundos. Después de repetir un total de 5 ciclos, pulse Detener en el programa informático y guarde el archivo. - Encontrar el estiramiento experimental in vivo: Ajuste el órgano a la longitud in vivo estimada mientras está a la presión descargada y presione Start. Evalúe los valores de presión frente a fuerza para valores de presión que van desde la presión descargada hasta la presión máxima (Tabla 1). Pulse el botón Parar en el programa informático y guarde el archivo.
NOTA: El valor de estiramiento medido se calcula in situ. Esto va acompañado de la limitación de que sólo se puede medir después de desarticular la sínfisis púbica. Como resultado, se pierde el anclaje natural, que puede modificar la longitud. El estiramiento teórico, sin embargo, se basa en la teoría introducida anteriormente de que el órgano experimentará cambios mínimos en la fuerza cuando se expone a presiones fisiológicas para conservar la energía45. En el protocolo, el estiramiento in vivo medido será el valor de estiramiento calculado utilizando la longitud identificada experimentalmente en la que hay un cambio mínimo de fuerza cuando se expone a un rango fisiológico de presiones. - Preacondicionamiento de diámetro de presión: Ajuste la presión a 0 mmHg, la longitud a la longitud in vivo experimental y el gradiente de 1,5 mmHg/s. Ejecute una secuencia que lleve la presión de 0 mmHg a la presión máxima + UP, mantenga pulsado durante 30 segundos y vuelva a 0 mmHg con un anuncio período de retención dicional de 30 segundos. Después de repetir esto durante un total de 5 ciclos, pulse el botón Parar en la interfaz del programa y guarde el archivo.
NOTA: 5.4 es imprescindible para lograr una lectura de fuerza axial más consistente con el aumento de la presión. Este paso ayuda a encontrar el estiramiento in vivo correcto, que a menudo se subestima en función de las señales visuales. 5.6 sirve como medida de precaución para minimizar la histéresis y lograr una respuesta consistente, repetible e interpretable matemáticamente del órgano. - Preacondicionamiento de longitud de fuerza: Introduzca 1/3 de presión máxima + UP tanto para la presión de entrada como de salida. Ajuste el órgano al -2% de la longitud in vivo y pulse Iniciar. Ajustar la longitud a +2% de longitud in vivo y luego volver a -2% a 10 m/s. Repita la extensión axial durante un total de 5 ciclos. Pulse Detener en el programa informático y guarde el archivo.
- Equilibrio: Con el órgano a la longitud in vivo determinada, ajuste la presión de entrada y salida a 1/3 de la presión máxima + UP. Equilibrar el órgano durante 10 minutos. Reducir lentamente ambas presiones a 0 mmHg con el gradiente establecido en 1,5 mmHg/s.
- Reevaluar la geometría descargada: Ajuste el órgano a la longitud in vivo y la presión a la presión descargada. Disminuya la longitud axial hacia la longitud descargada estimada a una velocidad de 10 m/s hasta que haya un cambio mínimo en la fuerza. Esta longitud correspondiente se conoce como la longitud descargada, o donde el órgano no está en tensión ni compresión. Antes de poner a cero la fuerza, registre la longitud descargada, el diámetro exterior y el valor de fuerza.
NOTA: La geometría descargada anterior se determinó por señales visuales, lo cual es puramente cualitativo. Una reevaluación es necesaria para un método cuantitativo y para tener en cuenta los posibles cambios de longitud que pueden ocurrir durante el preacondicionamiento. Esta geometría se utilizará en la sección 8. - Configuración por ultrasonido: Utilice el paquete abdominal de imágenes general para visualizar los órganos en el dispositivo de prueba. (Figura 6). Antes de realizar la prueba, minimice los artefactos de la parte inferior de la cuenca metálica del miógrafo de presión. Ajuste la cánula a una altura que sea la distancia máxima desde la parte inferior con el tejido todavía completamente sumergido en la solución de prueba. Un soporte personalizado se imprime en 3D para estabilizar el transductor en posición vertical durante la toma de imágenes.
- Imágenes por ultrasonido: Identifique la cánula cerca del transductor de fuerza y ajuste la etapa del microscopio para obtener imágenes a lo largo de la longitud del tejido. A lo largo del proceso de prueba, se realiza un seguimiento de la región media a lo largo de la longitud (Figura6A,C). Después de la toma de imágenes, revise el bucle de la imagen "Cine store" que consta de una serie de marcos en modo B e identifique el marco con el diámetro exterior más grande. Los cálculos de espesor realizados se utilizarán en la sección 8.
- Prueba de diámetro de presión (-2% de longitud in vivo): Pulse Start y ajuste el órgano para que sea -2% de la longitud in vivo, ajuste la presión a 0 mmHg y el gradiente a 1,5 mmHg/s. Aumente la presión de 0 mmHg a la presión máxima. Vuelva a reducir la presión a 0 mmHg con un período de retención de 20 segundos. Repita esto durante 5 ciclos.
- Prueba de diámetro de presión (longitud in vivo): Presione Inicio y ajuste el órgano para que esté a la longitud vivo, ajuste la presión a 0 mmHg y el gradiente a 1,5 mmHg/s. Aumente la presión de 0 mmHg a la presión máxima. Vuelva a reducir la presión a 0 mmHg con un período de retención de 20 segundos. Repita esto durante 5 ciclos.
- Prueba de diámetro de presión (+2% de longitud in vivo): Ajuste el órgano de modo que sea +2% de longitud in vivo, ajuste la presión a 0 mmHg y el gradiente a 1,5 mmHg/s. Aumente la presión de 0 mmHg a la presión máxima y luego vuelva a bajar a 0 mmHg con un período de retención de 20 segundos. Repita esto durante 5 ciclos. Los datos de presión de las tres longitudes se utilizarán en la sección 8.
- Pruebas de longitud de fuerza (presión nominal): Ajuste la presión a la presión descargada y el órgano en -2% de la longitud in vivo. Estirar el órgano hasta el +2% de la longitud in vivo y volver a -2% la longitud in vivo a una velocidad de 10 m/s. Repetir durante un total de 3 ciclos.
- Pruebas de longitud de fuerza (1/3 de presión máxima + UP): Ajuste la presión a 1/3 de la presión máxima + ARRIBA y ajuste el órgano a -2% de la longitud in vivo. Después de presionar Start, estire el órgano hasta +2% la longitud in vivo y de nuevo a -2% la longitud in vivo a una velocidad de 10 m/s. Después de repetir un total de 3 ciclos, pulse Detener y guarde los datos.
- Pruebas de longitud de fuerza (2/3 de presión máxima + UP): Ajuste la presión a 2/3 de la presión máxima + ARRIBA y ajuste el órgano a -2% de la longitud in vivo. Pulse Start y estire el órgano hasta +2% la longitud in vivo y de vuelta a -2% la longitud in vivo a una velocidad de 10 m/s. Después de repetir un total de 3 ciclos, pulse Detener y guarde los datos.
- Pruebas de longitud de fuerza (presión máxima + UP): Ajuste la presión a la presión máxima + ARRIBA y ajuste el órgano a -2% de la longitud in vivo. A una velocidad de 10 m/s, estire el órgano hasta el +2% de la longitud in vivo y de vuelta a -2% de la longitud in vivo. Después de repetir para un total de 3 ciclos, guarde los datos. Todos los datos de fuerza se utilizarán en la sección 8.
- Retire los medios de prueba KRB y lávelos con KRB sin calcio. Sustituya el medio por una solución KRB libre de calcio complementada con 2 mM DeGTA. Incubar el tejido durante 30 minutos. Retire la solución y sustituya los medios por KRB fresco sin calcio.
6. Pruebas mecánicas pasivas
NOTA: Si comienza con la prueba pasiva, comience en el paso 1. Si se realizaron pruebas de tono basal antes del inicio pasivo en el paso 6. Si comienza con tejido congelado, deje un período de equilibrio de 30 minutos a temperatura ambiente antes de canular el órgano.
- Encontrar la geometría descargada: Estire el órgano para que la pared del órgano no esté en tensión. Mida el órgano canulado de la sutura a la sutura y registre esto como la longitud descargada.
- Encontrar la presión descargada: Después de pulsar Start, aumente la presión de 0 a 10 mmHg en incrementos de 1 mmHg. Mientras pasa por este proceso, determine la presión en la que el órgano no está en tensión. Usando el monitor del programa de computadora, esto se puede determinar a partir del salto más grande en el diámetro exterior. Después de poner a cero la fuerza, registre esta presión, así como el diámetro exterior y observe esto como el primer punto en el que el órgano no se colapsa.
- Estiramiento in vivo estimado: Calcule el estiramiento in vivo estimado dividiendo la longitud medida in vivo por la longitud medida post-explantación.
- Preacondicionamiento del diámetro de presión: Después de pulsar Inicio, ajuste la presión establecida en 0 mmHg, la longitud como la longitud in vivo estimada y el gradiente a 1,5 mmHg/s. Comience a ejecutar una secuencia que lleve la presión de 0 mmHg a la presión máxima y de nuevo a 0 Mmhg. Repita este proceso a través de 5 ciclos con un tiempo de espera de 30 segundos.
- Preacondicionamiento de longitud de fuerza: Ajuste el órgano a la longitud in vivo e introduzca manualmente la presión descargada en el programa informático para ambas presiones. Después de pulsar Inicio, ajuste el gradiente a 2 mmHg y la presión en 1/3 del máximo. Estirar el órgano hasta +2% y retroceder a -2% de estiramiento a 10 m/s. Repita este ciclo para un total de 5 veces y presione Detener.
- Encontrar la longitud in vivo experimental: Encuentra y traza los valores de fuerza en -2% de la longitud in vivo, la longitud in vivo y +2% de la longitud in vivo. Tome fuerzas a presiones uniformemente espaciadas que van desde 0 mmHg hasta la presión máxima. El estiramiento in vivo experimental será el valor de estiramiento que exhibe una línea relativamente plana sobre un rango de presiones.
- Repita el diámetro de presión y los pasos de preacondicionamiento axial a la nueva longitud in vivo.
- Equilibrio: Con el órgano a la longitud in vivo determinada, ajuste la presión de entrada y salida a la presión descargada. Deje que el órgano se vuelva a equilibrar durante 15 minutos. Después de 15 minutos, vuelva a reducir lentamente la presión de entrada y salida a 0 mmHg.
- Reevaluar la configuración descargada: Lleve el órgano a la longitud descargada y vuelva a estimar la longitud descargada. Registre la longitud descargada y el diámetro exterior mientras la presión es de 0 mmHg, la presión descargada y 1/3 la presión máxima. Cero la fuerza a la presión descargada. El diámetro a la presión descargada es el diámetro in vivo.
NOTA: Es necesario reestimar la longitud descargada, ya que anteriormente se observaron pequeñas deformaciones plásticas en tejidos biológicos blandos después del preacondicionamiento. Esta configuración descargada será la utilizada en la sección 8. - Ultrasonido: Realice imágenes en modo B de ultrasonido a la longitud y presión descargadas.
- Pruebas de diámetro de presión: Con el órgano al -2% de la longitud in vivo determinada experimentalmente y la presión a 0 mmHg, pulse Start. Aumente la presión de 0 mmHg a la presión máxima y de vuelta a 0 mmHg. Sujete el paso de 2-0 mmHg durante 20 segundos. Después de repetir un total de 5 veces, pulse el botón Parar en la interfaz y guarde el archivo.
NOTA: Repita en la longitud in vivo experimental, +2% de la longitud in vivo experimental. - Pruebas de longitud de fuerza: Ajuste la presión a la presión nominal y ajuste el órgano al -2% de la longitud in vivo. Estire el órgano hasta +2% de la longitud in vivo y de vuelta al -2% de la longitud in vivo a una velocidad de 10 m/s. Después de repetir un total de 3 veces, guarde los datos. Repita esto para una presión máxima de 1/3, una presión máxima de 2/3 y una presión máxima.
- Calcule el grosor descargado de la imagen en modo B de las imágenes de ultrasonido. Usando software de imágenes, dibuje una línea para denotar la profundidad de penetración. Establezca la escala en la longitud de la línea (es decir, 2000 m como se muestra en las figuras 6B y 6D).
- Cálculos del espesor de la pared: Utilizando un software informático, trace y mida el diámetro interno y exterior del órgano. A continuación, dibuje y mida una línea entre los diámetros. Dibuja un total de 25 líneas transmurales. Promedio de todos los puntos de datos y repita un total de 3 veces.
7. Limpie
- Asegúrese de que la presión es de 0 mmHg y está apagada. Cierre la entrada principal y la salida para ambas válvulas de tres vías. Aspirar el líquido restante de la cuenca del dispositivo de cannulación.
- Retire el órgano del escenario y llene la botella del depósito con agua desionizada. Con una jeringa, enjuague la cánula con agua. Conecte el tubo para omitir la cánula.
- Encienda la presión y el flujo, ajuste la presión de entrada a 200 mmHg, la presión de salida a 0 mmHg, el gradiente a 10 mmHg/s, y deje que el flujo funcione durante 5 minutos. Deje que el sistema funcione mientras la botella del depósito está vacía y deje que el aire funcione durante 5 minutos o hasta que las líneas estén secas.
8. Análisis de datos
- Para las pruebas de diámetro de presión, recopile datos desde donde la presión comienza a aumentar desde el valor mínimo hasta el máximo. Para las pruebas de longitud de fuerza, recopile datos de justo debajo del pico máximo en vigor hasta que la fuerza deje de disminuir.
- Abra el archivo de datos para cada prueba de diámetro de presión y seleccione la pestaña de presión media. Seleccione la misma región en el diámetro exterior, la presión de entrada, la presión de salida, la fuerza, la temperatura, el pH y la pestaña de flujo colocando cada elemento en el mismo documento.
- Abra los datos de cada prueba de longitud de fuerza. Navegue a la región de carga de la curva, -2% a +2%, y arrastre y suelte los datos en una hoja de cálculo. Seleccione la misma región para las otras variables medidas y coloque cada elemento en la misma hoja de cálculo.
- Para la prueba de diámetro de presión y longitud de fuerza, reste el UP de todos los valores de presión.
- Promedio de los datos de diámetro de presión cada 1 mmHg (es decir, 0+/- 0.5, 1+/-0.5, 2+/- 0.5).
- Encuentre el volumen descargado del órgano (V). La ecuación 1 se puede utilizar para encontrar V, dado que R02 es el radio exterior descargado medido por el microscopio, L es la longitud descargada, y H es el espesor descargado según lo detectado por el ultrasonido. La asunción de incompresibilidad se aprovecha, lo que significa que el órgano conserva el volumen mientras está sujeto a deformaciones.
NOTA: La longitud descargada se mide con pinzas de sutura a sutura. El diámetro descargado se mide a través del microscopio, la cámara y el software seguido del cálculo del radio (Figura 5) El espesor descargado se calcula a partir de las imágenes de ultrasonido (Figura6).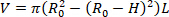 Ecuación 1
Ecuación 1 - Utilizando la suposición de incompresibilidad, utilice el
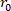 volumen descargado,
volumen descargado,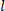 el radio exterior deformado ( ) y la longitud ( ) para determinar el radio
el radio exterior deformado ( ) y la longitud ( ) para determinar el radio 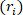 interno deformado.
interno deformado.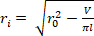 Ecuación 2
Ecuación 2 - Utilice las ecuaciones 3, 4 y 5 para calcular cada tensión, respectivamente. En las ecuaciones 3-5, P se define como la presión intraluminal y Ft es la fuerza medida por el transductor.
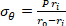 Ecuación 3
Ecuación 3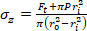 Ecuación 4
Ecuación 4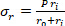 Ecuación 5
Ecuación 5 - Trazar la relación presión-diámetro, la relación fuerza-presión, la relación de estiramiento de tensión circunferencial-circunferencial y la tensión axial y los valores de estiramiento circunferenciales (Figura7, Figura8). Los valores de estiramiento se pueden calcular utilizando el radio de pared media. Los cálculos de las tensiones circunferenciales y axiales se pueden encontrar en las ecuaciones 6 y 7, respectivamente.
 Ecuación 6
Ecuación 6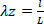 Ecuación 7
Ecuación 7 - Calcular el cumplimiento cerca del rango de presión fisiológica y en el estiramiento in vivo. El límite de presión inferior (LPB) es 1 desviación estándar por debajo de la presión media medida. El límite de presión superior (UPB) es 1 desviación estándar por encima de la presión media medida9.
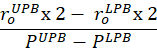
- Calcular los módulos tangentes para cuantificar la rigidez del material. Identifique la tensión circunferencial calculada que corresponde a la presión límite de presión inferior y la presión de límite superior. Ajuste una línea lineal a la curva de estiramiento circunferencial de tensión y circunferencial dentro del rango de tensión identificado a la longitud in vivo. Calcular la pendiente de la línea9.
Resultados
El análisis exitoso de las propiedades mecánicas de los órganos reproductores femeninos está supeditado a la disección adecuada de órganos, la cannulación y las pruebas. Es imperativo explantar los cuernos uterinos a la vagina sin defectos (Figura1). Dependiendo del tipo de órgano, el tamaño de la cánula variará (Figura 2). La cannulación debe hacerse para que el órgano no pueda moverse durante el experimento, pero tampoco dañar la pared del órgano durante...
Discusión
El protocolo proporcionado en este artículo presenta un método para determinar las propiedades mecánicas de la vagina murina y el cuello uterino. Las propiedades mecánicas analizadas en este protocolo incluyen las condiciones de tono pasivo y basal de los órganos. Las condiciones de tono pasivo y basal se inducen alterando el entorno bioquímico en el que el órgano está sumergido. Para este protocolo, los medios involucrados en las pruebas basales contienen calcio. La prueba de la condición del tono basal permite...
Divulgaciones
Ninguno.
Agradecimientos
La obra fue financiada por la concesión de la beca NSF CAREER #1751050.
Materiales
| Name | Company | Catalog Number | Comments |
| 2F catheter | Millar | SPR-320 | catheter to measure cervical pressure |
| 6-0 Suture | Fine Science Tools | 18020-60 | larger suture ties |
| CaCl2 (anhydrous) | VWR | 97062-590 | HBSS concentration: 140 mg/ mL |
| CaCl2-2H20 | Fischer chemical | BDH9224-1KG | KRB concentration: 3.68 g/L |
| Dextrose (D-glucose) | VWR | 101172-434 | HBSS concentration: 1000 mg/mL KRB concentration: 19.8 g/L |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | curved forceps |
| Dumont SS Forceps | Fine Science Tools | 11203-25 | straight forceps |
| Eclipse | Nikon | E200 | microscope used for imaging |
| Flow meter | Danish MyoTechnologies | 161FM | flow meter within the testing apparatus |
| Force Transducer - 110P | Danish MyoTechnologies | 100079 | force transducer |
| ImageJ | SciJava | ImageJ1 | used to measure volume |
| Instrument Cases | Fine Science Tools | 20830-00 | casing to hold dissection tools |
| KCl | Fisher Chemical | 97061-566 | HBSS concentration: 400 mg/ mL KRB concentration: 3.5 g/L |
| KH2PO4 | G-Biosciences | 71003-454 | HBSS concentration: 60 mg/ mL |
| MgCl2 | VWR | 97064-150 | KRB concentration: 1.14 g/L |
| MgCl2-6H2O | VWR | BDH9244-500G | HBSS concentration: 100 mg/ mL |
| MgSO4-7H20 | VWR | 97062-134 | HBSS concentration: 48 mg/ mL |
| Mircosoft excel | Microsoft | 6278402 | program used for spreadsheet |
| Na2HPO4 (dibasic anhydrous) | VWR | 97061-588 | HBSS concentration: 48 mg/mL KRB concentration: 1.44 g/L |
| NaCl | VWR | 97061-274 | HBSS concentration: 8000 mg/mL KRB concentration: 70.1 g/L |
| NaHCO3 | VWR | 97062-460 | HBSS concentration: 350 mg/ mL KRB concentration: 21.0 g/L |
| Pressure myograph systems | Danish MyoTechnologies | 110P and 120CP | Pressure myograph system: prorgram, cannulation device, and controller unit |
| Pressure Transducer | Danish MyoTechnologies | 100106 | pressure transducer |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | straight forceps |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | micro-scissors |
| Tissue dye | Bradley Products | 1101-3 | ink to measure in vivo stretch |
| Ultrasound transducer | FujiFilm Visual Sonics | LZ-550 | ultrasound transducer used; 256 elements, 40 MHz center frequency |
| VEVO2100 | FujiFilm Visual Sonics | VS-20035 | ultrasound used for imaging |
| Wagner Scissors | Fine Science Tools | 14069-12 | larger scissors |
Referencias
- Capone, D., et al. Evaluating Residual Strain Throughout the Murine Female Reproductive System. Journal of Biomechanics. 82, 299-306 (2019).
- Danforth, D. The fibrous nature of the human cervix, and its relation to the isthmic segment in gravid and nongravid uteri. American Journal of Obstetrics and Gynecology. 53 (4), 541-560 (1947).
- Hughesdon, P. The fibromuscular structure of the cervix and its changes during pregnancy and labour. Journal of Obstetrics and Gynecology of the British Commonwealth. 59, 763-776 (1952).
- Bryman, I., Norstrom, A., Lindblo, B. Influence of neurohypophyseal hormones on human cervical smooth muscle cell contractility in vitro. Obstetrics and Gynecology. 75 (2), 240-243 (1990).
- Joy, V., et al. A New Paradigm for the Role of Smooth Muscle Cells in the Human Cervix. Obstetrics. 215 (4), e471-e478 (2016).
- Xu, X., Akgul, Y., Mahendroo, M., Jerschow, A. Ex vivo assessment of mouse cervical remodeling through pregnancy via Na (23) MRS. NMR Biomedical. 23 (23), 907-912 (2014).
- Leppert, P. Anatomy and Physiology of cervical ripening. Clinical Obstetrics and Gynecology. 43 (43), 433-439 (2000).
- Schlembach, D., et al. Cervical ripening and insufficiency: from biochemical and molecular studies to in vivo clinical examination. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 144, S70-S79 (2000).
- Stoka, K., et al. Effects of Increased Arterial Stiffiness on Atherosclerotic Plaque Amounts. Journal of Biomechanical Engineering. 140 (5), (2018).
- Mohram, D., Heller, L. Ch. 7. Cardiovascular Physiology. , (2006).
- Yoshida, K., et al. Quantitative Evaluation of Collagen Crosslinks and Corresponding Tensile Mechanical Properties in Mouse Cervical Tissue during Normal Pregnancy. PLoS One. 9, e112391 (2014).
- Mahendroo, M. Cervical remodeling in term and preterm birth: insight from an animal model. Society for Reproduction and Fertility. 143 (4), 429-438 (2012).
- Elovitz, M., Miranlini, C. Can medroxyprogesterone acetate alter Toll-like receptor expression in a mouse model of intrauterine inflammation?. American Journal of Obstetrics and Gynecology. 193 (3), 1149-1155 (2005).
- Ripperda, C., et al. Vaginal estrogen: a dual-edged sword in postoperative healing of the vaginal wall. North American Menopause Society. 24 (7), 838-849 (2017).
- Nelson, J., Felicio, P., Randall, K., Sims, C., Finch, E. A Longitudinal Study of Estrous Cyclicity in Aging C57/6J Mice: Cycle, Frequency, Length, and Vaginal Cytology. Biology of Reproduction. 27 (2), 327-339 (1982).
- Ferruzzi, J., Collins, M., Yeh, A., Humphrey, J. Mechanical assessment of elastin integrity in fibrillin-1-deficient carotid arteries: implications for Marfan Syndrome. Cardiovascular Research. 92 (2), 287-295 (2011).
- Mariko, B., et al. Fribrillin-1 genetic deficiency leads to pathological ageing of arteries in mice. The Journal of Pathology. 224 (1), 33-44 (2011).
- Rahn, D., Ruff, M., Brown, S., Tibbals, H., Word, R. Biomechanical Properties of The Vaginal Wall: Effect of Pregnancy, Elastic Fiber Deficiency, and Pelvic Organ Prolapse. American Urogynecological Society. 198 (5), (2009).
- Caulk, A., Nepiyushchikh, Z., Shaw, R., Dixon, B., Gleason, R. Quantification of the passive and active biaxial mechanical behavior and microstructural organization of rat thoracic ducts. Royal Society Interface. 12 (108), 20150280 (2015).
- Amin, M., Le, V., Wagenseil, J. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. Journal of Visualized Experiments. (60), e3733 (2012).
- Sokolis, D., Sassani, S., Kritharis, E., Tsangaris, S. Differential histomechanical response of carotid artery in relation to species and region: mathematical description accounting for elastin and collagen anisiotropy. Medical and Biological Engineering and Computing. 49 (8), 867-879 (2011).
- Kim, J., Baek, S. Circumferential variations of the mechanical behavior of the porcine thoracic aorta during the inflation test. Journal of Biomechanics. 44 (10), 1941-1947 (2011).
- Faury, G., et al. Developmental adaptation of the mouse cardiovascular system to elastin haploinsufficency. Journal of Clinical Investigation. 11 (9), 1419-1428 (2003).
- Naito, Y., et al. Beyond Burst Pressure: Initial Evaluation of the Natural History of the Biaxial Mechanical Properties of Tissue-Engineered Vascular Grafts in the Venous Circulation Using a Murine Model. Tissue Engineering. 20, 346-355 (2014).
- Sommer, G., et al. Multaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
- Sokolis, D., Orfanidis, I., Peroulis, M. Biomechanical testing and material characterization for the rat large intestine: regional dependence of material parameters. Physiological Measurement. 32 (12), 1969-1982 (2011).
- Martins, P., et al. Prediction of Nonlinear Elastic Behavior of Vaginal Tissue: Experimental Results and Model Formation. Computational Methods of Biomechanics and Biomedical Engineering. 13 (3), 317-337 (2010).
- Feola, A., et al. Deterioration in Biomechanical Properties of the Vagina Following Implantation of a High-stiffness Prolapse Mesh. BJOG: An International Journal of Obstetrics and Gynaecology. 120 (2), 224-232 (2012).
- Huntington, A., Rizzuto, E., Abramowitch, S., Prete, Z., De Vita, R. Anisotropy of the Passive and Active Rat Vagina Under Biaxial Loading. Annals of Biomedical Engineering. 47, 272-281 (2018).
- Tokar, S., Feola, A., Moalli, P., Abramowitch, S. Characterizing the Biaxial Mechanical Properties of Vaginal Maternal Adaptations During Pregnancy. ASME 2010 Summer Bioengineering Conference, Parts A and B. , 689-690 (2010).
- Feloa, A., et al. Impact of Pregnancy and Vaginal Delivery on the Passive and Active Mechanics of the Rat Vagina. Annals of Biomedical Engineering. 39 (1), 549-558 (2010).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical Analysis of the Uterosacral Ligament: Swine vs Human. Annual Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Champlin, A. Determining the Stage of the Estrous Cycle in the Mouse by the Appearance. Biology of Reproduction. 8 (4), 491-494 (1973).
- Byers, S., Wiles, M., Dunn, S., Taft, R. Mouse Estrous Cycle Identification Tool and Images. PLoS One. 7 (4), e35538 (2012).
- McLean, A. Performing Vaginal Lavage, Crystal Violet Staining and Vaginal Cytological Evaluation for Mouse Estrous Cycle Staging Identification. Journal of Visualized Experiments. 67, e4389 (2012).
- Bugg, G., Riley, M., Johnston, T., Baker, P., Taggart, M. Hypoxic inhibition of human myometrial contractions in vitro: implications for the regulation of parturition. European Journal of Clinical Investigation. 36 (2), 133-140 (2006).
- Taggart, M., Wray, S. Hypoxia and smooth muscle function: key regulatory events during metabolic stress. Journal of Physiology. 509, 315-325 (1998).
- Yoo, K., et al. The effects of volatile anesthetics on spontaneous contractility of isolated human pregnant uterine muscle: a comparison among sevoflurane, desflurane, isoflurane, and halothane. Anesthesia and Analgesia. 103 (2), 443-447 (2006).
- de Souza, L., et al. Effects of redox disturbances on intentional contractile reactivity in rats fed with a hypercaloric diet. Oxidative Medicine and Cellular Longevity. , 6364821 (2018).
- Jaue, D., Ma, Z., Lee, S. Cardiac muscarinic receptor function in rats with cirrhotic cardiomyopathy. Hepatology. 25, 1361-1365 (1997).
- Xu, Q., Shaffer, E. The potential site of impaired gallbladder contractility in an animal mode of cholesterol gallstone disease. Gastroenterology. 110 (1), 251-257 (1996).
- Rodriguez, U., et al. Effects of blast induced Neurotrauma on pressurized rodent middle cerebral arteries. Journal of Visualized Experimentals. (146), e58792 (2019).
- Rubod, C., Boukerrou, M., Brieu, M., Dubois, P., Cosson, M. Biomechanical Properties of Vaginal Tissue Part 1: New Experimental Protocol. Journal of Urology. 178, 320-325 (2007).
- Robison, K., Conway, C., Desrosiers, L., Knoepp, L., Miller, K. Biaxial Mechanical Assessment of the Murine Vaginal Wall Using Extension-Inflation Testing. Journal of Biomechanical Engineering. 139 (10), 104504 (2017).
- Van loon, P. Length-Force and Volume-Pressure Relationships of Arteries. Biorheology. 14 (4), 181-201 (1977).
- Fernandez, M., et al. Investigating the Mechanical Function of the Cervix During Pregnancy using Finite Element Models Derived from High Resolution 3D MRI. Computational Methods Biomechanical and Biomedical Engineering. 19 (4), 404-417 (2015).
- House, M., Socrate, S. The Cervix as a Biomechanical Structure. Ultrasound Obstetric Gynecology. 28 (6), 745-749 (2006).
- Martins, P., et al. Biomechanical Properties of Vaginal Tissue in Women with Pelvic Organ Prolapse. Gynecologic and Obstetrics Investigation. 75, 85-92 (2013).
- Rada, C., Pierce, S., Grotegut, C., England, S. Intrauterine Telemetry to Measure Mouse Contractile Pressure In vivo. Journal of Visualized Experiments. (98), e52541 (2015).
- Lumsden, M. A., Baird, D. T. Intra-uterine pressure in dysmenorrhea. Acta Obstectricia at Gynecologica Scandinavica. 64 (2), 183-186 (1985).
- Milsom, I., Andersch, B., Sundell, G. The Effect of Flurbiprofen and Naproxen Sodium On Intra-Uterine Pressure and Menstrual Pain in Patients With Primary Dysmennorrhea. Acta Obstetricia et Gynecologica Scandinavica. 67 (8), 711-716 (1988).
- Park, K., et al. Vasculogenic female sexual dysfunction: the hemodynamic basis for vaginal engorgement insufficiency and clitoral erectile insufficiency. International Journal of Impotence Journal. 9 (1), 27-37 (1997).
- Bulletti, C., et al. Uterine Contractility During Menstrual Cycle. Human Reproduction. 15, 81-89 (2000).
- Kim, N. N., et al. Effects of Ovariectomy and Steroid Hormones on Vaginal Smooth Muscle Contractility. International Journal of Impotence Research. 16, 43-50 (2004).
- Giraldi, A., et al. Morphological and Functional Characterization of a Rat Vaginal Smooth Muscle Sphincter. International Journal of Impotence Research. 14, 271-282 (2002).
- Gleason, R., Gray, S. P., Wilson, E., Humphrey, J. A Multiaxial Computer-Controlled Organ Culture and Biomechanical Device for Mouse Carotid Arteries. Journal of Biomechanical Engineering. 126 (6), 787-795 (2005).
- Swartz, M., Tscumperlin, D., Kamm, R., Drazen, J. Mechanical Stress is Communicated Between Different Cell Types to Elicit Matrix Remodeling. Proceedings of the National Academy of Sciences of the United States of America. 98 (11), 6180-6185 (2001).
- Rachev, A. Remodeling of Arteries in Response to Changes in their Mechanical Environment. Biomechanics of Soft Tissue in Cardiovascular Systems. 441, 221-271 (2003).
- Lee, E. J., Holmes, J., Costa, K. Remodeling of Engineered Tissue Anisotropy in Response to Altered Loading Conditions. Annals of Biomedical Engineering. 36 (8), 1322-1334 (2008).
- Akintunde, A., et al. Effects of Elastase Digestion on the Murine Vaginal Wall Biaxial Mechanical Response. Journal of Biomechanical Engineering. 141 (2), 021011 (2018).
- Griffin, M., Premakumar, Y., Seifalian, A., Butler, P., Szarko, M. Biomechanical Characterization of Human Soft Tissues Using Indentation and Tensile Testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Myers, K., Socrate, S., Paskaleva, A., House, M. A Study of the Anisotripy and Tension/Compression Behavior of Human Cervical Tissue. Journal of Biomechanical Engineering. 132 (2), 021003 (2010).
- Murtada, S., Ferruzzi, J., Yanagisawa, H., Humphrey, J. Reduced Biaxial Contractility in the Descending Thoracic Aorta of Fibulin-5 Deficent Mice. Journal of Biomechanical Engineering. 138 (5), 051008 (2016).
- Berkley, K., McAllister, S., Accius, B., Winnard, K. Endometriosis-induced vaginal hyperalgesia in the rat: effect of estropause, ovariectomy, and estradiol replacement. Pain. 132, s150-s159 (2007).
- van der Walt, I., Bø, K., Hanekom, S., Rienhardt, G. Ethnic Differences in pelvic floor muscle strength and endurance in South African women. International Urogynecology Journal. 25 (6), 799-805 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados