Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Biaxialer Basalton und passive Tests des Murine Reproduktionssystems mit einem Druckmyographen
In diesem Artikel
Zusammenfassung
Dieses Protokoll nutzte ein kommerziell erhältliches Druckmyographensystem, um Druckmyographentests an der murinen Vagina und dem Gebärmutterhals durchzuführen. Unter Verwendung von Medien mit und ohne Kalzium wurden die Beiträge der glatten Muskelzellen (SMC) Basalton und der passiven extrazellulären Matrix (ECM) für die Organe unter geschätzten physiologischen Bedingungen isoliert.
Zusammenfassung
Die weiblichen Fortpflanzungsorgane, insbesondere die Vagina und der Gebärmutterhals, bestehen aus verschiedenen zellulären Komponenten und einer einzigartigen extrazellulären Matrix (ECM). Glatte Muskelzellen weisen eine kontraktile Funktion innerhalb der Vaginal- und Gebärmutterhalswände auf. Je nach biochemischer Umgebung und mechanischer Dehnung der Organwände verändern die glatten Muskelzellen die kontraktilen Bedingungen. Der Beitrag der glatten Muskelzellen unter physiologischen Ausgangsbedingungen wird als Basalton klassifiziert. Genauer gesagt, ein Basalton ist die grundlegende partielle Verengung von glatten Muskelzellen in Abwesenheit von hormoneller und neuronaler Stimulation. Darüber hinaus bietet das ECM strukturelle Unterstützung für die Orgelwände und fungiert als Reservoir für biochemische Hinweise. Diese biochemischen Hinweise sind entscheidend für verschiedene Organfunktionen, wie anregendes Wachstum und Aufrechterhaltung der Homöostase. Das ECM jedes Organs besteht hauptsächlich aus Kollagenfasern (meist Kollagentypen I, III und V), elastischen Fasern und Glycosaminoglycans/Proteoglykanen. Die Zusammensetzung und Organisation des ECM bestimmen die mechanischen Eigenschaften jedes Organs. Eine Änderung der ECM-Zusammensetzung kann zur Entwicklung von reproduktiven Pathologien führen, wie Beckenorganprolaps oder vorzeitige Zervix-Umbau. Darüber hinaus können Veränderungen der ECM-Mikrostruktur und Steifigkeit die Aktivität der glatten Muskelzellen und den Phänotyp verändern und somit zum Verlust der kontraktilen Kraft führen.
In dieser Arbeit werden die gemeldeten Protokolle verwendet, um den Basalton und die passiven mechanischen Eigenschaften der nicht schwangeren murinen Vagina und des Gebärmutterhalses im Alter von 4-6 Monaten in Estrus zu bewerten. Die Organe wurden in einem handelsüblichen Druckmyographen montiert und sowohl Druckdurchmesser- als auch Kraftlängentests durchgeführt. Beispieldaten und Datenanalysetechniken zur mechanischen Charakterisierung der Fortpflanzungsorgane sind enthalten. Solche Informationen können nützlich sein, um mathematische Modelle zu konstruieren und therapeutische Interventionen für Die Gesundheitspathologien von Frauen rational zu gestalten.
Einleitung
Die Vaginalwand besteht aus vier Schichten, dem Epithel, Lamina propria, Muscularis und Adventitia. Das Epithel besteht hauptsächlich aus Epithelzellen. Die Lamina Propria hat eine große Menge an elastischen und fibrillaren Kollagenfasern. Die Muskulatur besteht auch aus Elastin und Kollagenfasern, hat aber eine erhöhte Menge an glatten Muskelzellen. Die Adventitia besteht aus Elastin, Kollagen und Fibroblasten, wenn auch in reduzierten Konzentrationen im Vergleich zu den vorherigen Schichten. Die glatten Muskelzellen sind für biomechanisch motivierte Forschungsgruppen von Interesse, da sie eine Rolle in der kontraktilen Natur der Organe spielen. Daher ist die Quantifizierung der glatten Muskelzellbereichsfraktion und -organisation der Schlüssel zum Verständnis der mechanischen Funktion. Frühere Untersuchungen deuten darauf hin, dass der glatte Muskelgehalt innerhalb der Vaginalwand in erster Linie in der Umfangs- und Längsachse organisiert ist. Histologische Analysen deuten darauf hin, dass der glatte Muskelbereichsanteil für die proximalen und distalen Abschnitte der Wand1etwa 35% beträgt.
Der Gebärmutterhals ist eine hoch kollagenige Struktur, die bis vor kurzem gedacht wurde, um minimalen glatten Muskelzellgehalt2,3. Neuere Studien haben jedoch darauf hingedeutet, dass glatte Muskelzellen eine größere Fülle und Rolle im Gebärmutterhals4,5haben können. Der Gebärmutterhals weist einen Gradienten von glatten Muskelzellen auf. Das interne os enthält 50-60% glatte Muskelzellen, bei denen das externe Os nur 10% enthält. Maus-Studien, jedoch, berichten, dass der Gebärmutterhals aus 10-15% glatten Muskelzellen und 85-90% faserigem Bindegewebe ohne Erwähnung der regionalen Unterschiede6,7,8. Da sich das Mausmodell vom häufig gemeldeten menschlichen Modell unterscheidet, sind weitere Untersuchungen zum Maus-Gebärmutterhals erforderlich.
Der Zweck dieses Protokolls war es, die mechanischen Eigenschaften der murinen Vagina und des Gebärmutterhalses aufzuklären. Dies wurde durch die Verwendung einer Druckmyographenvorrichtung erreicht, die die gleichzeitige Beurteilung der mechanischen Eigenschaften in den umlaufenden und axialen Richtungen ermöglicht und dabei die nativen Zellmatrix-Wechselwirkungen und die Organgeometrie beibehält. Die Orgeln wurden auf zwei kundenspezifischen Kanülen montiert und mit Seide 6-0 Nähte gesichert. Druck-Durchmesser-Tests wurden um die geschätzte physiologische Axialdehnung durchgeführt, um die Konformität und Tangentenmoduli9zu bestimmen. Es wurden Kraftlängentests durchgeführt, um die geschätzte axiale Dehnung zu bestätigen und sicherzustellen, dass die mechanischen Eigenschaften im physiologischen Bereich quantifiziert wurden. Das experimentelle Protokoll wurde an der nicht-schwangeren murinen Vagina und des Gebärmutterhalses im Alter von 4-6 Monaten in Estrus durchgeführt.
Das Protokoll ist in zwei mechanische Hauptprüfabschnitte unterteilt: Basalton und passive Tests. Ein Basalton ist definiert als die grundlegende partielle Verengung glatter Muskelzellen, selbst in Abwesenheit externer lokaler, hormoneller und neuronaler Stimulation10. Diese Basiskontraktilen Natur der Vagina und des Gebärmutterhalses ergibt charakteristische mechanische Verhaltensweisen, die dann durch das Druckmyographensystem gemessen werden. Die passiven Eigenschaften werden bewertet, indem das interzelluläre Kalzium entfernt wird, das den Ausgangszustand der Kontraktion beibehält, was zu einer Entspannung der glatten Muskelzellen führt. Im passiven Zustand liefern Kollagen- und Elastinfasern die dominierenden Beiträge für die mechanischen Eigenschaften der Organe.
Das murine Modell wird ausgiebig verwendet, um Pathologien in der reproduktiven Gesundheit von Frauen zu studieren. Die Maus bietet mehrere Vorteile für die Quantifizierung der sich entwickelnden Beziehungen zwischen ECM und mechanischen Eigenschaften innerhalb des Fortpflanzungssystems11,12,13,14. Zu diesen Vorteilen zählen kurze und gut charakterisierte Estre-Zyklen, relativ niedrige Kosten, einfache Handhabung und eine relativ kurze Trächtigkeitszeit15. Darüber hinaus ist das Genom von Labormäusen gut abgebildet und genetisch veränderte Mäuse sind wertvolle Werkzeuge, um mechanistische Hypothesen zu testen16,17,18.
Kommerziell erhältliche Druckmyographensysteme werden ausgiebig eingesetzt, um die mechanischen Reaktionen verschiedener Gewebe und Organe zu quantifizieren. Einige bemerkenswerte Strukturen auf dem Druck Myographsystem analysiert sind elastische Arterien19,20,21,22, Venen und Gewebe entwickelt Vaskuläre23,24, die Speiseröhre25und der Dickdarm26. Die Druckmyographentechnologie ermöglicht die gleichzeitige Beurteilung der Eigenschaften in axialer und umlaufender Richtung unter Beibehaltung der nativen Zell-ECM-Wechselwirkungen und der In-vivo-Geometrie. Trotz des umfangreichen Einsatzes von Myographensystemen in der Weichteil- und Organmechanik wurde bisher kein Protokoll mit der Druckmyographentechnologie für die Vagina und den Gebärmutterhals entwickelt. Vorherige Untersuchungen der mechanischen Eigenschaften der Vagina und des Gebärmutterhalses wurden uniaxial27,28. Diese Organe erleben jedoch eine multiaxiale Belastung im Körper29,30, daher ist die Quantifizierung ihrer biaxialen mechanischen Reaktion wichtig.
Darüber hinaus, neuere Arbeit legt nahe, dass glatte Muskelzellen eine mögliche Rolle in Weichgewebe-Pathologien5,28,31,32spielen können. Dies bietet eine weitere Attraktion der Nutzung der Druck-Myographen-Technologie, da sie die nativen Zell-Matrix-Wechselwirkungen bewahrt und so eine Abgrenzung des Beitrags ermöglicht, den glatte Muskelzellen in physiologischen und pathophysiologischen Bedingungen. Hierin schlagen wir ein Protokoll vor, um die multiaxialen mechanischen Eigenschaften der Vagina und des Gebärmutterhalses sowohl unter Basalton als auch unter passiven Bedingungen zu quantifizieren.
Protokoll
Für diese Studie wurden nulliparöse 4-6 Monate weibliche C57BL6J-Mäuse (29,4 x 6,8 Gramm) an Estrus verwendet. Alle Verfahren wurden vom Institute Animal Care and Use Committee der Tulane University genehmigt. Nach der Entbindung akklimatierten sich die Mäuse eine Woche vor der Euthanasie und wurden unter Standardbedingungen (12-Stunden-Licht-/Dunkelzyklen) untergebracht.
1. Mausopfer bei estrus
- Bestimmen Sie den Estrous-Zyklus: Der Estrous-Zyklus wurde durch visuelle Bewertung in Übereinstimmung mit früheren Studien15,33,34überwacht. Der estre Zyklus besteht aus vier Stufen: Proestrus, Estrus, Metestrus und Diestrus. Während der Proestrusphase sind die Genitalien geschwollen, rosa, feucht und faltig. Die Estrusphase ist faltig, aber weniger geschwollen, rosa und feucht. Metestrus und Diestrus werden beide als keine Schwellung und Faltenbildung, fehlt in einem rosa Farbton, und trocken34,35berichtet.
- Experimentieren Sie auf estrus: Alle mechanischen Tests wurden durchgeführt, während die Mäuse bei estrus waren, da dies der einfachste zu visualisieren ist und einen konsistenten und wiederholbaren Zeitpunkt bietet.
- Bei Mäusen, die sich einer Basaltonprüfung unterziehen, wird über Guillotine eingeschläfert. Bei Mäusen, die nur unter passiven Bedingungengetestet wurden, wird mit Kohlendioxid (CO2 ) inhaliert. Die Guillotine dient dazu, die Funktion der glatten Muskelzellen des Fortpflanzungstraktes zu erhalten, da das CO2-Gas die kontraktilen Eigenschaften der glatten Muskelzellen36,37 ,38verändert 39,40,41,42. Es ist zwingend notwendig, die Sezieren innerhalb von 30 Minuten durchzuführen, um die Wahrscheinlichkeit einer Zellapoptose zu minimieren.
2. Reproduktive Systemsektion
- Einrichten: Legen Sie ein saugfähiges Pad auf den Arbeitsplatz und füllen Sie eine Petrischale und Spritze mit 4 °C Hanks Balanced Salt Solution (HBSS) Lösung. Verwenden Sie ein Tuch für die Fettgewebeentsorgung. Legen Sie die Maus ventrale Seite nach oben und band die Pfoten und Schwanz. Schalten Sie das Mikroskoplicht ein und setzen Sie Mikroschere, Schere, zwei Paar gerade Pinzette und zwei Paare von gekrümmten Pinzette.
- Mit abgewinkelter Pinzette und Schere, heben Sie die Haut um den Bauch und machen einen Schnitt an der Basis des Bauches, über dem Schambein. Der Schnitt sollte flach genug sein, um die Bauchmuskelwand nicht zu durchstechen. Verwenden Sie die Schere, um überlegen in Richtung des Rippenkäfigs und tief durch die Bauchmuskeln zu schneiden.
- Entfernen Sie oberflächliches Fett, indem Sie mit der gekrümmten Pinzette und Mikroschere leicht auf das Fett ziehen. Adipose Gewebe reflektiert Licht heterogen mit einem glitzernden Aussehen. Legen Sie das gesamte entfernte Fett und Gewebe auf das Tuch. Identifizieren Sie sowohl Uterushörner als auch den Schambein.
- Legen Sie geschlossene Schere zwischen der Vaginalwand und dem Schambein. Sorgfältig die Mitte des Schambeins schneiden (Schamsymphyse). Die gekrümmte Pinzette an beiden Enden des geschnittenen Schambeins legen. Ziehen Sie beide Schnitten seitlich, um einen besseren Zugang zu den Fortpflanzungsorganen zu ermöglichen.
- Entfernen Sie die Blase und die Harnröhre von der Vaginalwand. Dies kann mit geraden Pinzetten und Mikroscheren erfolgen. Halten Sie die Blase mit gerader Pinzette, um Spannung zu erzeugen und verwenden Sie stumpfe Seziertechniken, um das umgebende Gewebe von der Vagina zu trennen. Sobald die Blase und Harnröhre entfernt sind, schneiden Sie die Basis und entfernen Sie aus der Körperhöhle.
- Identifizieren Sie das Fortpflanzungssystem: Die Gebärmutterhörner bifurcate aus dem Gebärmutterhals. Der Gebärmutterhals kann aufgrund von Unterschieden in Geometrie und Steifigkeit aus der Vagina identifiziert werden. Der Außendurchmesser des Gebärmutterhalses ist kleiner als die Vagina. Der Gebärmutterhals ist steifer als die Vagina und fühlt sich ähnlich an wie eine Perle (Abbildung 1).
- Verwenden Sie Tinte und Bremssättel, um 3 mm Punkte entlang der Organe zu markieren. Beginnen Sie unter den Eierstöcken auf den Gebärmutterröhren und markieren Sie Punkte minderwertig, um den Gebärmutterhals zu erreichen. Verwenden Sie den mittleren Gebärmutterhalspunkt, um einen Punktpfad hinunter zum Vagina-Introitus zu starten.
- Lassen Sie die Tinte trocknen und trennen Sie die Fortpflanzungsorgane von umgebendem Fettgewebe, Bindegewebe und dickdarm. Reinigen Sie die Vagina so nah wie möglich am vaginalen Introitus. Mit einer Schere, um den vaginalen Introitus schneiden.
HINWEIS: Es ist möglich, dass Organe während dieses Prozesses austrocknen. Wenn dies ein Problem ist, kann eine Spritze, die mit 4 °C HBSS gefüllt ist, verwendet werden, um den Organen Feuchtigkeit zu verleihen. - Schneiden Sie die Uterushörner sofort schlechter als die Eierstöcke. Beachten Sie, dass sich die Organe von der Länge des Postexplantes zurückziehen, wenn das Bindegewebe entfernt wird und das Organ zurückschreckt. Legen Sie die sezierten Fortpflanzungsorgane in eine Petrischale gefüllt mit 4 °C HBSS. Diese Längenänderung kann für die Berechnung der geschätzten in vivo-Länge verwendet werden (Abschnitt 5).
HINWEIS: Wir haben festgestellt, dass die Verwendung von HBSS bei dieser Temperatur während der Zerlegung und Cannulation die Lebensfähigkeit der glatten Muskelzellen nicht beeinträchtigt. Die Aufrechterhaltung eines pH-Werts von 7,4 ist jedoch unerlässlich, um die Lebensfähigkeit der glatten Muskelzellen zu erhalten. Bei dieser Temperatur hat der HBSS einen pH-Wert von 7,4. - Messen Sie nach einer 15-minütigen Ausgleichsperiode in 4 °C HBSS den Abstand zwischen den Punkten mit Sätteln. Zeichnen Sie die Messungen für jede Entfernung in einer Kalkulationstabelle auf. Diese Werte werden verwendet, um das In-vivo-Stretchverhältnis (ursprüngliche Länge/Explantierte Länge) zu berechnen.
- Stellen Sie das Tuch, das das ausrangierte Gewebe auf dem Bauchbereich enthält, mit dem überschüssigen Gewebe auf die Innenseite der Maus und tränken Sie das Tuch in 4 °C HBSS. Die Maus und überschüssiges Gewebe in Folie wickeln und in einen Tiefkühlbeutel legen, der bei -20 °C gelagert werden kann. Passives mechanisches Verhalten an der Vagina wurde nach einem Frost-Tau-Zyklus43nicht signifikant unterschiedlich festgestellt. Alle getesteten Organe wurden unmittelbar nach der Euthanasie oder nach einem Frost-Tau-Zyklus verwendet.
3. Cannulating
- Bestimmen Sie die richtige Kanülengröße für den Organtyp. In einer typischen C57BL6J-Maus verwendet die Vagina Kanülen mit einem Durchmesser von 3,75 mm und Genie. Der Gebärmutterhals verwendet eine Kanüle, die 3,75 mm für das vaginale Ende ist und eine Kanüle 0,75 mm im Durchmesser für das Gebärmutterende (Abbildung 2) Die 0,75 mm Kanüle ist glatt.
HINWEIS: Die oben genannten Durchmessergrößen werden für typische nulliparöse 4-6 Monate C57BL6-Mäuse, C57BL6 x 129SvEv und nicht parale Mäuse im Alter von 7-9 Monaten verwendet. Bestimmte Umstände, wie Z.B. Prolaps oder Schwangerschaft, können jedoch eine größere Kanüle erfordern. - Mit jedem Organ die Halsbandseite auf den Kraftgeberteil der Kanulationsvorrichtung montieren. Montieren Sie das entgegengesetzte Ende des Organs (vaginal oder Uterus) auf dem Mikrometer-Teil des Geräts. Ziehen Sie beide Enden mit Nähten.
- Aufgrund der Unterschiedlichen in der Dicke und Grad der Kontraktilität zwischen der Vagina und Gebärmutterhals, verschiedene Techniken können verwendet werden, um die effektivste Cannulation durchzuführen. Für die Vagina, platzieren Sie 2 Nähte zwischen den 2. und 3. Nieten der Kanüle in einer "X" Art und Weise. Bei der Kanülierung des Gebärmutterhalses ist die Kanüle nicht genietet, so dass das Organ am besten auf der Rückseite der Kanüle mit 3 horizontalen Nähten am Gebärmutterende und 4 Nähten auf dem äußeren os platziertwird. Für beide Organe sollte die maximale Länge zwischen den Nähten nicht mehr als 7 mm betragen (Abbildung 3).
4. Druckmyograph eingerichtet
- Um das Druckmyographensystem einzurichten, schalten Sie das Prüfsystem ein und füllen Sie die Reservoirflasche mit 200 ml HBSS (Abbildung 4). Drehen Sie die Wärme auf "ein" und lassen Sie die HBSS in der Reservoirflasche erwärmen. Schalten Sie als Nächstes das Mikroskop ein und öffnen Sie das Computerprogramm. Stellen Sie sicher, dass das Bild des kanülierten Organs, der Druckschnittstelle, der Durchflussmesserstände und des Sequenzerfunktionswerkzeugs sichtbar sind (Abbildung 5).
5. Basalton mechanische Prüfung
HINWEIS: Der Gebärmutterhals zeigte in den Anfangsstadien der Tests eine phasische Natur. Dies ging jedoch nach der Vorbedingung zurück. Die Basaltonprüfung erfolgt unter Verwendung von Krebs Ringer Buffer (KRB) im Becken des DMT-Geräts. Der Puffer wird mit 95% O2 und 5% CO2 belüftet. Nachdem der Basaltonanteil vollständig ist, wird kalziumfreies KRB verwendet.
- Finden der entladenen Geometrie: Dehnen Sie das Organ so, dass die Wand nicht in Spannung ist. Für die Vagina, beobachten Sie die Rillen an der Vaginalwand. Für den Gebärmutterhals, schneiden Sie unmittelbar unter den Tintenpunkten, die über und unter der zentralen Gebärmutterhalsmarkierung befinden. Dies entwickelt eine wiederholbare Methode für eine zervikale In-situ-Länge von 6 mm44. Messen Sie die Länge von Naht zu Naht mit Sätteln
- Finden des unbelasteten Drucks (UP): Erhöhen Sie den Druck von 0 auf 10 mmHg in Schritten von 1 mmHg. Bestimmen Sie den Druck, unter dem das Organ nicht mehr zusammenbricht. Dies kann als größter Sprung im Außendurchmesser bei einem gegebenen Druck bestimmt werden, wie auf dem Programmmonitor ausgestellt. Nach der Aufzeichnung des Drucks und des Außendurchmessers, beachten Sie dies als den ersten Punkt, wobei das Organ nicht reduziert wird und Null die Kraft.
- Geschätzte in vivo-Dehnung: Berechnen Sie die geschätzte In-vivo-Dehnung, indem Sie die in vivo gemessene Länge durch die nach der Explantation gemessene Länge dividieren:

- Druck-Durchmesser-Vorkonditionierung: Stellen Sie den Druck auf 0 mmHg, die Länge auf die geschätzte in vivo Länge
 und den Gradienten auf 1,5 mmHg/s. Führen Sie eine Sequenz, die den Druck von 0 mmHg auf den in vivo Druck + entladen nimmt ( Tabelle1), halten Sie für 30 Sekunden und nehmen Sie den Druck auf 0 mmHg mit einer Haltedauer von 30 Sekunden. Nachdem Sie sich für insgesamt 5 Zyklen wiederholt haben, drücken Sie im Computerprogramm auf Stopp und speichern Sie die Datei.
und den Gradienten auf 1,5 mmHg/s. Führen Sie eine Sequenz, die den Druck von 0 mmHg auf den in vivo Druck + entladen nimmt ( Tabelle1), halten Sie für 30 Sekunden und nehmen Sie den Druck auf 0 mmHg mit einer Haltedauer von 30 Sekunden. Nachdem Sie sich für insgesamt 5 Zyklen wiederholt haben, drücken Sie im Computerprogramm auf Stopp und speichern Sie die Datei. - Finden der experimentellen in vivo-Stretch: Passen Sie das Organ auf die geschätzte in vivo Länge an, während beim unbelasteten Druck und drücken Sie Start. Bewerten Sie Druck-Kraft-Werte für Druckwerte, die vom entladenen Druck bis zum Maximaldruck reichen (Tabelle 1). Drücken Sie die Stopp-Taste im Computerprogramm und speichern Sie die Datei.
HINWEIS: Der gemessene Dehnungswert wird vor Ort berechnet. Damit einher geht die Einschränkung, dass sie erst nach der Disartikulation der Schamsymphyse gemessen werden kann. Dadurch geht das natürliche Ankleben verloren, was die Länge ändern kann. Die theoretische Dehnung basiert jedoch auf der zuvor eingeführten Theorie, dass das Organ minimale Veränderungen in kraft erfahren wird, wenn es physiologischen Drücken ausgesetzt ist, um Energie zu sparen45. Im Protokoll ist die gemessene in vivo-Dehnung der Dehnungswert, der mit der experimentell identifizierten Länge berechnet wird, wobei es minimale Kraftänderungen gibt, wenn sie einem physiologischen Druckbereich ausgesetzt sind. - Druck-Durchmesser-Vorkonditionierung: Stellen Sie den Druck auf 0 mmHg, die Länge auf die experimentelle in vivo-Länge und den Gradienten von 1,5 mmHg/s. Führen Sie eine Sequenz, die den Druck von 0 mmHg auf den maximalen Druck + UP nimmt, halten Sie für 30 Sekunden, und zurück auf 0 mmHg mit einer Anzeige 30 Sekunden Haltefrist. Nachdem Sie dies für insgesamt 5 Zyklen wiederholt haben, drücken Sie die Stop-Taste in der Programmoberfläche und speichern Sie die Datei.
HINWEIS: 5.4 ist unerlässlich, um eine konsistentere Axialkraftmessung bei steigendem Druck zu erreichen. Dieser Schritt hilft bei der Suche nach der richtigen in vivo-Dehnung, die aufgrund visueller Hinweise oft unterschätzt wird. 5.6 dient als Vorsichtsmaßnahme zur Minimierung der Hysterese und zur Erreichung einer konsistenten, wiederholbaren, mathematisch interpretierbaren Reaktion des Organs. - Kraft-Länge Vorkonditionierung: Geben Sie 1/3 max Druck + UP für den Ein- und Auslassdruck ein. Stellen Sie das Organ auf -2% der in vivo Länge ein und drücken Sie Start. Stellen Sie die Länge auf +2% in vivo Länge dann wieder bis -2% bei 10 m/s. Wiederholen Sie die axiale Verlängerung für insgesamt 5 Zyklen. Drücken Sie im Computerprogramm auf Stopp, und speichern Sie die Datei.
- Gleichgewicht: Mit dem Organ bei der ermittelten in vivo Länge stellen Sie sowohl den Ein- als auch den Auslassdruck auf 1/3 des Maximaldrucks + UP ein. Die Orgel 10 Minuten ausdemaieren. Bringen Sie beide Drücke langsam wieder auf 0 mmHg herab, wobei der Gradient auf 1,5 mmHg/s eingestellt ist.
- Neubewerten der entladenen Geometrie: Stellen Sie das Organ auf die In-vivo-Länge und den Druck auf den entladenen Druck ein. Verringern Sie die axiale Länge in Richtung der geschätzten unbelasteten Länge mit einer Rate von 10 m/s, bis sich die Kraft minimal ändert. Diese entsprechende Länge wird als unbelastete Länge bezeichnet, oder wenn das Organ weder in Spannung noch Kompression ist. Zeichnen Sie vor dem Nullen der Kraft die entladene Länge, den Außendurchmesser und den Kraftwert auf.
HINWEIS: Die vorherige entladene Geometrie wurde durch visuelle Hinweise bestimmt, die rein qualitativ sind. Für eine quantitative Methode und zur Berücksichtigung möglicher Längenänderungen, die während der Vorkonditionierung auftreten können, ist eine Neubewertung erforderlich. Diese Geometrie wird in Abschnitt 8 verwendet. - Ultraschall-Setup: Verwenden Sie das allgemeine bildgebende Bauchpaket, um die Organe im Testgerät zu visualisieren. (Abbildung 6). Minimieren Sie vor dem Testen Artefakte von der Unterseite des Druckmyographen-Metallbeckens. Passen Sie die Kanüle auf eine Höhe an, die den maximalen Abstand vom Boden darstellt, wobei das Gewebe noch vollständig in die Testlösung eingetaucht ist. Ein benutzerdefinierter Halter wird 3D gedruckt, um den Messumformer während der Bildgebung in vertikaler Position zu stabilisieren.
- Ultraschall-Bildgebung: Identifizieren Sie die Kanüle in der Nähe des Kraftwandlers und passen Sie das Stadium des Mikroskops entlang der Länge des Gewebes an das Bild an. Während des gesamten Testprozesses wird der mittlere Bereich entlang der Länge nachverfolgt (Abbildung 6A,C). Überprüfen Sie nach der Bildgebung die Bildschleife "Cine store", die aus einer Reihe von B-Modus-Frames besteht, und identifizieren Sie den Rahmen mit dem größten Außendurchmesser. Die vorgenommenen Dickenberechnungen werden in Abschnitt 8 verwendet.
- Druckdurchmesserprüfung (-2% in vivo Länge): Drücken Sie Start und stellen Sie das Organ so ein, dass es -2% der In-vivo-Länge beträgt, stellen Sie den Druck auf 0 mmHg und den Gradienten auf 1,5 mmHg/s ein. Erhöhen Sie den Druck von 0 mmHg auf den maximalen Druck. Bringen Sie den Druck mit einer Haltedauer von 20 Sekunden wieder auf 0 mmHg. Wiederholen Sie dies für 5 Zyklen.
- Druckdurchmesserprüfung (in vivo Länge): Drücken Sie Start und passen Sie das Organ so an, dass es sich auf der vivo-Länge befindet, stellen Sie den Druck auf 0 mmHg und den Gradienten auf 1,5 mmHg/s ein. Erhöhen Sie den Druck von 0 mmHg auf den maximalen Druck. Bringen Sie den Druck mit einer Haltedauer von 20 Sekunden wieder auf 0 mmHg. Wiederholen Sie dies für 5 Zyklen.
- Druckdurchmesserprüfung (+2% in vivo Länge): Stellen Sie das Organ so ein, dass es +2% in vivo-Länge ist, stellen Sie den Druck auf 0 mmHg und den Gradienten auf 1,5 mmHg/s. Erhöhen Sie den Druck von 0 mmHg auf den maximalen Druck und dann wieder auf 0 mmHg mit einer Haltedauer von 20 Sekunden. Wiederholen Sie dies für 5 Zyklen. Die Druckdaten aller drei Längen werden in Abschnitt 8 verwendet.
- Kraftlängenprüfung (Nenndruck): Stellen Sie den Druck auf den entladenen Druck und das Organ auf -2% der In-vivo-Länge ein. Dehnen Sie das Organ auf +2% der In-vivo-Länge und kehren Sie auf -2% der In-vivo-Länge mit einer Rate von 10 m/s zurück.
- Kraftlängenprüfung (1/3 Maximaldruck + UP): Stellen Sie den Druck auf 1/3 des maximalen Drucks + UP ein und stellen Sie das Organ auf -2% der In-vivo-Länge ein. Nach dem Drücken von Startdehnen Sie das Organ auf +2% der In-vivo-Länge und zurück auf -2% die In-vivo-Länge mit einer Rate von 10 m/s. Nach der Wiederholung für insgesamt 3 Zyklen drücken Sie Stop und speichern Sie die Daten.
- Kraftlängenprüfung (2/3 maximaler Druck + UP): Stellen Sie den Druck auf 2/3 des maximalen Drucks + UP ein und stellen Sie das Organ auf -2% der In-vivo-Länge ein. Drücken Sie Start und dehnen Sie das Organ auf +2% der In-vivo-Länge und zurück auf -2% die In-vivo-Länge mit einer Rate von 10 m/s. Nach der Wiederholung für insgesamt 3 Zyklen drücken Sie Stop und speichern Sie die Daten.
- Kraftlängenprüfung (maximaler Druck + UP): Stellen Sie den Druck auf den maximalen Druck + UP ein und stellen Sie das Organ auf -2% der In-vivo-Länge ein. Mit einer Rate von 10 m/s dehnen Sie das Organ auf +2% der In-vivo-Länge und zurück auf -2% der In-vivo-Länge. Nachdem Sie sich für insgesamt 3 Zyklen wiederholt haben, speichern Sie die Daten. Alle Kraftdaten werden in Abschnitt 8 verwendet.
- ENTFERNEN Sie KRB-Prüfmedien und waschen Sie es mit kalziumfreiem KRB. Ersetzen Sie das Medium durch eine kalziumfreie KRB-Lösung, die durch 2 mM EGTA ergänzt wird. Inkubieren Sie das Gewebe für 30 Minuten. Entfernen Sie die Lösung und ersetzen Sie das Medium durch frisches kalziumfreies KRB.
6. Passive mechanische Prüfung
HINWEIS: Wenn Sie mit passiven Tests beginnen, beginnen Sie mit Schritt 1. Wenn Basaltontests vor dem passiven Start in Schritt 6 durchgeführt wurden. Wenn Sie mit gefrorenem Gewebe beginnen, lassen Sie eine 30-minütige Ausgleichszeit bei Raumtemperatur vor der Kanulation des Organs.
- Finden der entladenen Geometrie: Dehnen Sie die Orgel, damit die Wand der Orgel nicht in Spannung ist. Messen Sie das kanülierte Organ von Naht zu Naht und nehmen Sie dies als unbelastete Länge auf.
- Finden des entladenen Drucks: Nach dem Drücken von Starterhöhen Sie den Druck von 0 auf 10 mmHg in Schritten von 1 mmHg. Bestimmen Sie während dieses Prozesses den Druck, in dem das Organ nicht in Spannung ist. Mit Hilfe des Computerprogrammmonitors kann dies aus dem größten Sprung im Außendurchmesser ermittelt werden. Zeichnen Sie diesen Druck sowie den Außendurchmesser nach dem Nullen auf und notieren Sie dies als ersten Punkt, an dem das Organ nicht zusammenbricht.
- Geschätzte In-vivo-Dehnung: Berechnen Sie die geschätzte In-vivo-Dehnung, indem Sie die in vivo gemessene Länge durch die nach der Explantation gemessene Länge dividieren.
- Druckdurchmesser Vorkonditionierung: Nach dem Drücken von Startden Druck auf 0 mmHg, die Länge als geschätzte in vivo-Länge und den Gradienten auf 1,5 mmHg/s einstellen. Beginnen Sie mit dem Ausführen einer Sequenz, die den Druck von 0 mmHg auf den maximalen Druck und zurück auf 0 Mmhg. Wiederholen Sie diesen Vorgang durch 5 Zyklen mit einer Haltezeit von 30 Sekunden.
- Kraftlängenvorbedingung: Passen Sie das Organ an die in vivo-Länge an und geben Sie den entladenen Druck im Computerprogramm für beide Drücke manuell ein. Stellen Sie nach dem Drücken von Start den Gradienten auf 2 mmHg und den Druck auf 1/3 des Maximums ein. Dehnen Sie die Orgel bis zu +2% und zurück nach unten bis -2% Dehnung bei 10 m/ s. Wiederholen Sie diesen Zyklus für insgesamt 5 Mal und drücken Sie Stop.
- Finden der experimentellen in vivo Länge: Finden und Plotten von Kraftwerten bei -2% der in vivo Länge, der in vivo Länge und +2% der in vivo Länge. Nehmen Sie Kräfte bei gleichmäßigen Drücken von 0 mmHg bis zum maximalen Druck. Die experimentelle in vivo-Stretch wird der Dehnungswert sein, der eine relativ flache Linie über eine Reihe von Drücken aufweist.
- Wiederholen Sie den Druckdurchmesser und die axialen Vorkonditionierungsschritte bei der neuen in vivo-Länge.
- Gleichgewicht: Mit dem Organ bei der ermittelten in vivo Länge den Ein- und Auslassdruck auf den unbelasteten Druck einstellen. Lassen Sie die Orgel 15 Minuten lang wieder ausduquirieren. Nach 15 Minuten den Ein- und Auslassdruck langsam wieder auf 0 mmHg senken.
- Entladene Konfiguration neu bewerten: Bringen Sie das Organ auf die entladene Länge und schätzen Sie die entladene Länge neu. Zeichnen Sie die unbelastete Länge und den Außendurchmesser auf, während der Druck 0 mmHg, der unbelastete Druck und 1/3 der maximale Druck beträgt. Null die Kraft beim entladenen Druck. Der Durchmesser am unbelasteten Druck ist der In-vivo-Durchmesser.
HINWEIS: Eine Neuschätzung der unbelasteten Länge ist notwendig, da nach der Vorbedingung zuvor kleine plastische Verformungen in weichen biologischen Geweben beobachtet wurden. Diese entladene Konfiguration wird in Abschnitt 8 verwendet. - Ultraschall: Führen Sie Ultraschall-B-Modus-Bildgebung bei unbelasteter Länge und Druck durch.
- Druck-Durchmesser-Prüfung: Mit dem Organ bei -2% der experimentell ermittelten in vivo Länge und dem Druck bei 0 mmHg drücken Sie Start. Erhöhen Sie den Druck von 0 mmHg auf den maximalen Druck und zurück auf 0 mmHg. Halten Sie den 2-0 mmHg-Schritt 20 Sekunden lang. Nach der Wiederholung für insgesamt 5 Mal, drücken Sie die Stop-Taste in der Schnittstelle und speichern Sie die Datei.
ANMERKUNG: Wiederholen Sie dies bei der experimentellen in vivo-Länge von +2% der experimentellen in vivo-Länge. - Kraftlängenprüfung: Stellen Sie den Druck auf Nenndruck ein und stellen Sie das Organ auf -2% der In-vivo-Länge ein. Dehnen Sie das Organ bis zu +2% der In-vivo-Länge und zurück auf -2% der In-vivo-Länge mit einer Rate von 10 m/s. Nachdem Sie die Daten insgesamt 3 Mal wiederholt haben, speichern Sie die Daten. Wiederholen Sie dies für 1/3 max Druck, 2/3 max Druck, und bei dem maximalen Druck.
- Berechnen Sie die unbelastete Dicke aus Ultraschallbildern B-Modus-Bild. Zeichnen Sie mithilfe von Bildverarbeitungssoftware eine Linie, um die Eindringtiefe zu bezeichnen. Stellen Sie die Skala auf die Länge der Linie ein (d. h. 2000 m, wie in Abbildung 6B und 6Ddargestellt).
- Wanddickenberechnungen: Verfolgen und messen Sie mit einer Computersoftware den Innen- und Außendurchmesser des Organs. Zeichnen und messen Sie dann eine Linie zwischen den Durchmessern. Zeichnen Sie insgesamt 25 transmuralische Linien. Durchschnittlich alle Datenpunkte und wiederholen Sie für insgesamt 3 Mal.
7. Aufräumen
- Stellen Sie sicher, dass der Druck 0 mmHg beträgt und ausgeschaltet ist. Schließen Sie den Hauptein- und Auslass für beide Dreiwegeventile. Die restliche Flüssigkeit aus dem Becken der Kanulationsvorrichtung ansaugen.
- Entfernen Sie die Orgel von der Bühne und füllen Sie die Reservoirflasche mit entionisiertem Wasser. Spülen Sie die Kanüle mit einer Spritze mit Wasser ab. Schließen Sie die Schläuche an, um die Kanüle zu umgehen.
- Druck und Durchfluss einschalten, den Einlassdruck auf 200 mmHg, den Auslassdruck auf 0 mmHg, Einen Gradienten auf 10 mmHg/s einstellen und den Durchfluss 5 Minuten laufen lassen. Lassen Sie das System laufen, während die Reservoirflasche leer ist, und lassen Sie die Luft für 5 Minuten laufen oder bis die Leitungen trocken sind.
8. Datenanalyse
- Sammeln Sie für die Prüfung des Druckdurchmessers Daten, von denen der Druck vom Mindestwert bis zum Maximum zu steigen beginnt. Sammeln Sie für Tests mit Kraftlänge Daten von knapp unter der maximalen Spitzenspitze, bis die Kraft nicht mehr abnimmt.
- Öffnen Sie die Datendatei für jeden Druckdurchmessertest und wählen Sie die mittlere Drucklasche. Navigieren Sie zum Ladebereich der letzten Kurve, 0 mmHg bis zum maximalen Druck, und legen Sie die Daten in eine Kalkulationstabelle ab. Wählen Sie den gleichen Bereich auf dem Außendurchmesser, Einlassdruck, Auslassdruck, Kraft, Temperatur, pH-Wert und Durchflusslasche aus, in der jedes Element im selben Dokument platziert wird.
- Öffnen Sie die Daten für jeden Force-Längentest. Navigieren Sie zum Ladebereich der Kurve, -2% bis +2%, und ziehen Sie die Daten in eine Kalkulationstabelle. Wählen Sie den gleichen Bereich für die anderen gemessenen Variablen aus, und platzieren Sie jedes Element in derselben Kalkulationstabelle.
- Für die Druckdurchmesser- und Kraftlängenprüfung subtrahieren Sie die UP von allen Druckwerten.
- Durchschnittlich die Druckdurchmesserdaten alle 1 mmHg (d.h. 0+/- 0,5, 1+/-0,5, 2+/- 0,5).
- Finden Sie das unbeladene Volumen der Orgel (V). Gleichung 1 kann verwendet werden, um Vzu finden, da R02 der vom Mikroskop gemessene unbelastete Äußere radius ist, L die entladene Länge und H die unbelastete Dicke, wie sie vom Ultraschall erkannt wird. Die Annahme der Inkomprimibilität wird genutzt, was bedeutet, dass das Organ Volumen konserviert, während es Verformungen ausgesetzt ist.
HINWEIS: Die unbelastete Länge wird mit Sätteln von Naht zu Naht gemessen. Der unbelastete Durchmesser wird über Mikroskop, Kamera und Software gemessen, gefolgt von der Berechnung des Radius (Abbildung 5) Die unbelastete Dicke wird aus den Ultraschallbildern berechnet (Abbildung 6).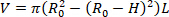 Gleichung 1
Gleichung 1 - Verwenden Sie unter Verwendung der Inkomprimibilität das unbelastete Volumen, den verformten äußeren Radius (
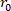 ), und die Länge (
), und die Länge (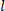 ), um den verformten inneren Radius
), um den verformten inneren Radius 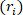 zu bestimmen.
zu bestimmen.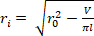 Gleichung 2
Gleichung 2 - Verwenden Sie die Gleichungen 3, 4 und 5, um jede Spannung zu berechnen. In den Gleichungen 3-5 wird P als intraluminaler Druck definiert und Ft ist die vom Messumformer gemessene Kraft.
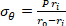 Gleichung 3
Gleichung 3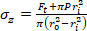 Gleichung 4
Gleichung 4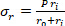 Gleichung 5
Gleichung 5 - Zeichnen Sie die Druck-Durchmesser-Beziehung, kraft-Druck-Beziehung, umfanglinale Spannungs-Umfang-Dehnungsbeziehung und die axialen Spannungs- und Umfangsdehnungswerte (Abbildung 7, Abbildung 8). Die Dehnungswerte können mit dem Mittelwandradius berechnet werden. Berechnungen der Umfangs- bzw. Axialspannungen finden sich in den Gleichungen 6 bzw. 7.
 Gleichung 6
Gleichung 6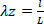 Gleichung 7
Gleichung 7 - Berechnen Sie die Konformität in der Nähe des physiologischen Druckbereichs und bei der In-vivo-Strecke. Die untere Druckgrenze (LPB) liegt 1 Standardabweichung unter dem mittleren gemessenen Druck. Die obere Druckgrenze (UPB) liegt 1 Standardabweichung über dem mittleren gemessenen Druck9.
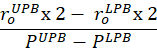
- Berechnen Sie die Tangentenmodule, um die Materialsteifigkeit zu quantifizieren. Identifizieren Sie die berechnete Umfangsspannung, die dem unteren Druck- und dem oberen Grenzdruck entspricht. Passen Sie eine lineare Linie an die umlaufende Spannungs-Umfangs-Stretchkurve innerhalb des identifizierten Spannungsbereichs an der in vivo-Länge an. Berechnen Sie die Steigung der Linie9.
Ergebnisse
Eine erfolgreiche Analyse der mechanischen Eigenschaften der weiblichen Fortpflanzungsorgane ist abhängig von einer geeigneten Organsektion, Kanulation und Prüfung. Es ist zwingend notwendig, die Gebärmutterhörner ohne Defekte in die Vagina zu pflanzen (Abbildung 1). Je nach Organtyp variiert die Kanülengröße (Abbildung 2). Die Kanulation muss so erfolgen, dass sich das Organ während des Experiments nicht bewegen kann, aber auch die Wand des Organs während des V...
Diskussion
Das in diesem Artikel enthaltene Protokoll stellt eine Methode zur Bestimmung der mechanischen Eigenschaften der murinen Vagina und des Gebärmutterhalses dar. Zu den in diesem Protokoll analysierten mechanischen Eigenschaften gehören sowohl die passiven als auch die basalen Tonbedingungen der Organe. Passive und basale Tonbedingungen werden durch eine Veränderung der biochemischen Umgebung induziert, in der das Organ untergetaucht ist. Für dieses Protokoll enthalten die an Basaltests beteiligten Medien Kalzium. Das T...
Offenlegungen
nichts.
Danksagungen
Die Arbeit wurde durch den NSF CAREER-Preis #1751050 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 2F catheter | Millar | SPR-320 | catheter to measure cervical pressure |
| 6-0 Suture | Fine Science Tools | 18020-60 | larger suture ties |
| CaCl2 (anhydrous) | VWR | 97062-590 | HBSS concentration: 140 mg/ mL |
| CaCl2-2H20 | Fischer chemical | BDH9224-1KG | KRB concentration: 3.68 g/L |
| Dextrose (D-glucose) | VWR | 101172-434 | HBSS concentration: 1000 mg/mL KRB concentration: 19.8 g/L |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | curved forceps |
| Dumont SS Forceps | Fine Science Tools | 11203-25 | straight forceps |
| Eclipse | Nikon | E200 | microscope used for imaging |
| Flow meter | Danish MyoTechnologies | 161FM | flow meter within the testing apparatus |
| Force Transducer - 110P | Danish MyoTechnologies | 100079 | force transducer |
| ImageJ | SciJava | ImageJ1 | used to measure volume |
| Instrument Cases | Fine Science Tools | 20830-00 | casing to hold dissection tools |
| KCl | Fisher Chemical | 97061-566 | HBSS concentration: 400 mg/ mL KRB concentration: 3.5 g/L |
| KH2PO4 | G-Biosciences | 71003-454 | HBSS concentration: 60 mg/ mL |
| MgCl2 | VWR | 97064-150 | KRB concentration: 1.14 g/L |
| MgCl2-6H2O | VWR | BDH9244-500G | HBSS concentration: 100 mg/ mL |
| MgSO4-7H20 | VWR | 97062-134 | HBSS concentration: 48 mg/ mL |
| Mircosoft excel | Microsoft | 6278402 | program used for spreadsheet |
| Na2HPO4 (dibasic anhydrous) | VWR | 97061-588 | HBSS concentration: 48 mg/mL KRB concentration: 1.44 g/L |
| NaCl | VWR | 97061-274 | HBSS concentration: 8000 mg/mL KRB concentration: 70.1 g/L |
| NaHCO3 | VWR | 97062-460 | HBSS concentration: 350 mg/ mL KRB concentration: 21.0 g/L |
| Pressure myograph systems | Danish MyoTechnologies | 110P and 120CP | Pressure myograph system: prorgram, cannulation device, and controller unit |
| Pressure Transducer | Danish MyoTechnologies | 100106 | pressure transducer |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | straight forceps |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | micro-scissors |
| Tissue dye | Bradley Products | 1101-3 | ink to measure in vivo stretch |
| Ultrasound transducer | FujiFilm Visual Sonics | LZ-550 | ultrasound transducer used; 256 elements, 40 MHz center frequency |
| VEVO2100 | FujiFilm Visual Sonics | VS-20035 | ultrasound used for imaging |
| Wagner Scissors | Fine Science Tools | 14069-12 | larger scissors |
Referenzen
- Capone, D., et al. Evaluating Residual Strain Throughout the Murine Female Reproductive System. Journal of Biomechanics. 82, 299-306 (2019).
- Danforth, D. The fibrous nature of the human cervix, and its relation to the isthmic segment in gravid and nongravid uteri. American Journal of Obstetrics and Gynecology. 53 (4), 541-560 (1947).
- Hughesdon, P. The fibromuscular structure of the cervix and its changes during pregnancy and labour. Journal of Obstetrics and Gynecology of the British Commonwealth. 59, 763-776 (1952).
- Bryman, I., Norstrom, A., Lindblo, B. Influence of neurohypophyseal hormones on human cervical smooth muscle cell contractility in vitro. Obstetrics and Gynecology. 75 (2), 240-243 (1990).
- Joy, V., et al. A New Paradigm for the Role of Smooth Muscle Cells in the Human Cervix. Obstetrics. 215 (4), e471-e478 (2016).
- Xu, X., Akgul, Y., Mahendroo, M., Jerschow, A. Ex vivo assessment of mouse cervical remodeling through pregnancy via Na (23) MRS. NMR Biomedical. 23 (23), 907-912 (2014).
- Leppert, P. Anatomy and Physiology of cervical ripening. Clinical Obstetrics and Gynecology. 43 (43), 433-439 (2000).
- Schlembach, D., et al. Cervical ripening and insufficiency: from biochemical and molecular studies to in vivo clinical examination. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 144, S70-S79 (2000).
- Stoka, K., et al. Effects of Increased Arterial Stiffiness on Atherosclerotic Plaque Amounts. Journal of Biomechanical Engineering. 140 (5), (2018).
- Mohram, D., Heller, L. Ch. 7. Cardiovascular Physiology. , (2006).
- Yoshida, K., et al. Quantitative Evaluation of Collagen Crosslinks and Corresponding Tensile Mechanical Properties in Mouse Cervical Tissue during Normal Pregnancy. PLoS One. 9, e112391 (2014).
- Mahendroo, M. Cervical remodeling in term and preterm birth: insight from an animal model. Society for Reproduction and Fertility. 143 (4), 429-438 (2012).
- Elovitz, M., Miranlini, C. Can medroxyprogesterone acetate alter Toll-like receptor expression in a mouse model of intrauterine inflammation?. American Journal of Obstetrics and Gynecology. 193 (3), 1149-1155 (2005).
- Ripperda, C., et al. Vaginal estrogen: a dual-edged sword in postoperative healing of the vaginal wall. North American Menopause Society. 24 (7), 838-849 (2017).
- Nelson, J., Felicio, P., Randall, K., Sims, C., Finch, E. A Longitudinal Study of Estrous Cyclicity in Aging C57/6J Mice: Cycle, Frequency, Length, and Vaginal Cytology. Biology of Reproduction. 27 (2), 327-339 (1982).
- Ferruzzi, J., Collins, M., Yeh, A., Humphrey, J. Mechanical assessment of elastin integrity in fibrillin-1-deficient carotid arteries: implications for Marfan Syndrome. Cardiovascular Research. 92 (2), 287-295 (2011).
- Mariko, B., et al. Fribrillin-1 genetic deficiency leads to pathological ageing of arteries in mice. The Journal of Pathology. 224 (1), 33-44 (2011).
- Rahn, D., Ruff, M., Brown, S., Tibbals, H., Word, R. Biomechanical Properties of The Vaginal Wall: Effect of Pregnancy, Elastic Fiber Deficiency, and Pelvic Organ Prolapse. American Urogynecological Society. 198 (5), (2009).
- Caulk, A., Nepiyushchikh, Z., Shaw, R., Dixon, B., Gleason, R. Quantification of the passive and active biaxial mechanical behavior and microstructural organization of rat thoracic ducts. Royal Society Interface. 12 (108), 20150280 (2015).
- Amin, M., Le, V., Wagenseil, J. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. Journal of Visualized Experiments. (60), e3733 (2012).
- Sokolis, D., Sassani, S., Kritharis, E., Tsangaris, S. Differential histomechanical response of carotid artery in relation to species and region: mathematical description accounting for elastin and collagen anisiotropy. Medical and Biological Engineering and Computing. 49 (8), 867-879 (2011).
- Kim, J., Baek, S. Circumferential variations of the mechanical behavior of the porcine thoracic aorta during the inflation test. Journal of Biomechanics. 44 (10), 1941-1947 (2011).
- Faury, G., et al. Developmental adaptation of the mouse cardiovascular system to elastin haploinsufficency. Journal of Clinical Investigation. 11 (9), 1419-1428 (2003).
- Naito, Y., et al. Beyond Burst Pressure: Initial Evaluation of the Natural History of the Biaxial Mechanical Properties of Tissue-Engineered Vascular Grafts in the Venous Circulation Using a Murine Model. Tissue Engineering. 20, 346-355 (2014).
- Sommer, G., et al. Multaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
- Sokolis, D., Orfanidis, I., Peroulis, M. Biomechanical testing and material characterization for the rat large intestine: regional dependence of material parameters. Physiological Measurement. 32 (12), 1969-1982 (2011).
- Martins, P., et al. Prediction of Nonlinear Elastic Behavior of Vaginal Tissue: Experimental Results and Model Formation. Computational Methods of Biomechanics and Biomedical Engineering. 13 (3), 317-337 (2010).
- Feola, A., et al. Deterioration in Biomechanical Properties of the Vagina Following Implantation of a High-stiffness Prolapse Mesh. BJOG: An International Journal of Obstetrics and Gynaecology. 120 (2), 224-232 (2012).
- Huntington, A., Rizzuto, E., Abramowitch, S., Prete, Z., De Vita, R. Anisotropy of the Passive and Active Rat Vagina Under Biaxial Loading. Annals of Biomedical Engineering. 47, 272-281 (2018).
- Tokar, S., Feola, A., Moalli, P., Abramowitch, S. Characterizing the Biaxial Mechanical Properties of Vaginal Maternal Adaptations During Pregnancy. ASME 2010 Summer Bioengineering Conference, Parts A and B. , 689-690 (2010).
- Feloa, A., et al. Impact of Pregnancy and Vaginal Delivery on the Passive and Active Mechanics of the Rat Vagina. Annals of Biomedical Engineering. 39 (1), 549-558 (2010).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical Analysis of the Uterosacral Ligament: Swine vs Human. Annual Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Champlin, A. Determining the Stage of the Estrous Cycle in the Mouse by the Appearance. Biology of Reproduction. 8 (4), 491-494 (1973).
- Byers, S., Wiles, M., Dunn, S., Taft, R. Mouse Estrous Cycle Identification Tool and Images. PLoS One. 7 (4), e35538 (2012).
- McLean, A. Performing Vaginal Lavage, Crystal Violet Staining and Vaginal Cytological Evaluation for Mouse Estrous Cycle Staging Identification. Journal of Visualized Experiments. 67, e4389 (2012).
- Bugg, G., Riley, M., Johnston, T., Baker, P., Taggart, M. Hypoxic inhibition of human myometrial contractions in vitro: implications for the regulation of parturition. European Journal of Clinical Investigation. 36 (2), 133-140 (2006).
- Taggart, M., Wray, S. Hypoxia and smooth muscle function: key regulatory events during metabolic stress. Journal of Physiology. 509, 315-325 (1998).
- Yoo, K., et al. The effects of volatile anesthetics on spontaneous contractility of isolated human pregnant uterine muscle: a comparison among sevoflurane, desflurane, isoflurane, and halothane. Anesthesia and Analgesia. 103 (2), 443-447 (2006).
- de Souza, L., et al. Effects of redox disturbances on intentional contractile reactivity in rats fed with a hypercaloric diet. Oxidative Medicine and Cellular Longevity. , 6364821 (2018).
- Jaue, D., Ma, Z., Lee, S. Cardiac muscarinic receptor function in rats with cirrhotic cardiomyopathy. Hepatology. 25, 1361-1365 (1997).
- Xu, Q., Shaffer, E. The potential site of impaired gallbladder contractility in an animal mode of cholesterol gallstone disease. Gastroenterology. 110 (1), 251-257 (1996).
- Rodriguez, U., et al. Effects of blast induced Neurotrauma on pressurized rodent middle cerebral arteries. Journal of Visualized Experimentals. (146), e58792 (2019).
- Rubod, C., Boukerrou, M., Brieu, M., Dubois, P., Cosson, M. Biomechanical Properties of Vaginal Tissue Part 1: New Experimental Protocol. Journal of Urology. 178, 320-325 (2007).
- Robison, K., Conway, C., Desrosiers, L., Knoepp, L., Miller, K. Biaxial Mechanical Assessment of the Murine Vaginal Wall Using Extension-Inflation Testing. Journal of Biomechanical Engineering. 139 (10), 104504 (2017).
- Van loon, P. Length-Force and Volume-Pressure Relationships of Arteries. Biorheology. 14 (4), 181-201 (1977).
- Fernandez, M., et al. Investigating the Mechanical Function of the Cervix During Pregnancy using Finite Element Models Derived from High Resolution 3D MRI. Computational Methods Biomechanical and Biomedical Engineering. 19 (4), 404-417 (2015).
- House, M., Socrate, S. The Cervix as a Biomechanical Structure. Ultrasound Obstetric Gynecology. 28 (6), 745-749 (2006).
- Martins, P., et al. Biomechanical Properties of Vaginal Tissue in Women with Pelvic Organ Prolapse. Gynecologic and Obstetrics Investigation. 75, 85-92 (2013).
- Rada, C., Pierce, S., Grotegut, C., England, S. Intrauterine Telemetry to Measure Mouse Contractile Pressure In vivo. Journal of Visualized Experiments. (98), e52541 (2015).
- Lumsden, M. A., Baird, D. T. Intra-uterine pressure in dysmenorrhea. Acta Obstectricia at Gynecologica Scandinavica. 64 (2), 183-186 (1985).
- Milsom, I., Andersch, B., Sundell, G. The Effect of Flurbiprofen and Naproxen Sodium On Intra-Uterine Pressure and Menstrual Pain in Patients With Primary Dysmennorrhea. Acta Obstetricia et Gynecologica Scandinavica. 67 (8), 711-716 (1988).
- Park, K., et al. Vasculogenic female sexual dysfunction: the hemodynamic basis for vaginal engorgement insufficiency and clitoral erectile insufficiency. International Journal of Impotence Journal. 9 (1), 27-37 (1997).
- Bulletti, C., et al. Uterine Contractility During Menstrual Cycle. Human Reproduction. 15, 81-89 (2000).
- Kim, N. N., et al. Effects of Ovariectomy and Steroid Hormones on Vaginal Smooth Muscle Contractility. International Journal of Impotence Research. 16, 43-50 (2004).
- Giraldi, A., et al. Morphological and Functional Characterization of a Rat Vaginal Smooth Muscle Sphincter. International Journal of Impotence Research. 14, 271-282 (2002).
- Gleason, R., Gray, S. P., Wilson, E., Humphrey, J. A Multiaxial Computer-Controlled Organ Culture and Biomechanical Device for Mouse Carotid Arteries. Journal of Biomechanical Engineering. 126 (6), 787-795 (2005).
- Swartz, M., Tscumperlin, D., Kamm, R., Drazen, J. Mechanical Stress is Communicated Between Different Cell Types to Elicit Matrix Remodeling. Proceedings of the National Academy of Sciences of the United States of America. 98 (11), 6180-6185 (2001).
- Rachev, A. Remodeling of Arteries in Response to Changes in their Mechanical Environment. Biomechanics of Soft Tissue in Cardiovascular Systems. 441, 221-271 (2003).
- Lee, E. J., Holmes, J., Costa, K. Remodeling of Engineered Tissue Anisotropy in Response to Altered Loading Conditions. Annals of Biomedical Engineering. 36 (8), 1322-1334 (2008).
- Akintunde, A., et al. Effects of Elastase Digestion on the Murine Vaginal Wall Biaxial Mechanical Response. Journal of Biomechanical Engineering. 141 (2), 021011 (2018).
- Griffin, M., Premakumar, Y., Seifalian, A., Butler, P., Szarko, M. Biomechanical Characterization of Human Soft Tissues Using Indentation and Tensile Testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Myers, K., Socrate, S., Paskaleva, A., House, M. A Study of the Anisotripy and Tension/Compression Behavior of Human Cervical Tissue. Journal of Biomechanical Engineering. 132 (2), 021003 (2010).
- Murtada, S., Ferruzzi, J., Yanagisawa, H., Humphrey, J. Reduced Biaxial Contractility in the Descending Thoracic Aorta of Fibulin-5 Deficent Mice. Journal of Biomechanical Engineering. 138 (5), 051008 (2016).
- Berkley, K., McAllister, S., Accius, B., Winnard, K. Endometriosis-induced vaginal hyperalgesia in the rat: effect of estropause, ovariectomy, and estradiol replacement. Pain. 132, s150-s159 (2007).
- van der Walt, I., Bø, K., Hanekom, S., Rienhardt, G. Ethnic Differences in pelvic floor muscle strength and endurance in South African women. International Urogynecology Journal. 25 (6), 799-805 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten