Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Le bip basal biaxial et l'essai passif du système reproducteur de Murine utilisant un myographe de pression
Dans cet article
Résumé
Ce protocole a utilisé un système de myographe de pression disponible dans le commerce pour effectuer des tests de myographe de pression sur le vagin murine et le col de l'utérus. Utilisant des médias avec et sans calcium, les contributions du tonus basal lisse de cellules de muscle (SMC) et de la matrice extracellulaire passive (ECM) ont été isolées pour les organes dans des conditions physiologiques estimées.
Résumé
Les organes reproducteurs féminins, en particulier le vagin et le col de l'utérus, sont composés de divers composants cellulaires et d'une matrice extracellulaire unique (ECM). Les cellules musculaires lisses présentent une fonction contractile dans les parois vaginales et cervicales. Selon l'environnement biochimique et la distension mécanique des parois des organes, les cellules musculaires lisses modifient les conditions contractiles. La contribution des cellules musculaires lisses dans des conditions physiologiques de base est classée comme un ton basal. Plus précisément, un ton basal est la constriction partielle de base des cellules musculaires lisses en l'absence de stimulation hormonale et neuronale. En outre, l'ECM fournit un soutien structurel pour les parois des organes et fonctionne comme un réservoir pour les indices biochimiques. Ces indices biochimiques sont essentiels à diverses fonctions d'organe, telles que l'incitation à la croissance et le maintien de l'homéostasie. L'ECM de chaque organe est composé principalement de fibres de collagène (principalement les types de collagène I, III et V), de fibres élastiques et de glycosaminoglycanes/protéoglycanes. La composition et l'organisation de l'ECM dictent les propriétés mécaniques de chaque organe. Un changement dans la composition de l'ECM peut conduire au développement de pathologies reproductrices, telles que le prolapsus des organes pelviens ou le remodelage cervical prématuré. En outre, les changements dans la microstructure et la rigidité d'ECM peuvent altérer l'activité lisse de cellules de muscle et le phénotype, ayant pour résultat la perte de la force contractile.
Dans ce travail, les protocoles rapportés sont employés pour évaluer le tonalité basale et les propriétés mécaniques passives du vagin murine non-pregnant et du col de l'utérus à 4-6 mois d'âge dans l'estrus. Les organes ont été montés dans un myographe de pression disponible dans le commerce et des essais de diamètre de pression et de longueur de force ont été exécutés. Des données d'échantillon et des techniques d'analyse de données pour la caractérisation mécanique des organes reproducteurs sont incluses. Ces informations peuvent être utiles pour construire des modèles mathématiques et concevoir rationnellement des interventions thérapeutiques pour les pathologies de santé des femmes.
Introduction
La paroi vaginale est composée de quatre couches, l'épithélium, lalame propria, muscularis, et adventitia. L'épithélium est principalement composé de cellules épithéliales. La lame propria a une grande quantité de fibres élastiques et fibrillaires de collagène. Le muscularis est également composé d'élastine et de fibres de collagène, mais a une quantité accrue de cellules musculaires lisses. L'adventitia est composée d'élastine, de collagène et de fibroblastes, bien qu'en concentrations réduites par rapport aux couches précédentes. Les cellules musculaires lisses sont d'intérêt pour les groupes de recherche biomécaniquement motivés car ils jouent un rôle dans la nature contractile des organes. En tant que tel, la quantification de la fraction de zone musculaire lisse et l'organisation est la clé pour comprendre la fonction mécanique. Les investigations précédentes suggèrent que le contenu lisse de muscle dans la paroi vaginale soit principalement organisé dans l'axe circonférences et longitudinal. L'analyse histologique suggère que la fraction lisse de secteur de muscle soit approximativement35% pour les sections proximales et distales du mur 1.
Le col de l'utérus est une structure très collagène, qui jusqu'à récemment, a été pensé pour avoir un minimum de contenu de cellules musculaires lisses2,3. Des études récentes, cependant, ont suggéré que les cellules musculaires lisses peuvent avoir une plus grande abondance et le rôle dans le col de l'utérus4,5. Le col de l'utérus présente un gradient de cellules musculaires lisses. L'os interne contient 50-60% de cellules musculaires lisses où l'os externe ne contient que 10%. Les études de souris, cependant, rapportent le col de l'utérus pour être composé de 10-15% de cellules musculaires lisses et 85-90% tissu conjonctif fibreux sans mention des différences régionales6,7,8. Étant donné que le modèle de souris diffère du modèle humain fréquemment rapporté, d'autres investigations concernant le col de l'utérus de souris sont nécessaires.
Le but de ce protocole était d'élucider les propriétés mécaniques du vagin murine et du col de l'utérus. Ceci a été accompli en utilisant un dispositif de myographe de pression qui permet d'évaluer des propriétés mécaniques dans les directions circonférences et axiales simultanément tout en maintenant les interactions cellulaires-matrice indigènes et la géométrie d'organe. Les orgues ont été montés sur deux canules personnalisées et fixés avec des sutures en soie 6-0. Des tests de diamètre de pression ont été effectués autour de l'étirement axial physiologique estimé pour déterminer la conformité et le moduli tangente9. Des essais de longueur de force ont été effectués pour confirmer l'étirement axial estimé et pour s'assurer que les propriétés mécaniques étaient quantifiées dans la plage physiologique. Le protocole expérimental a été exécuté sur le vagin murine non-pregnant et le col de l'utérus à 4-6 mois d'âge dans l'estrus.
Le protocole est divisé en deux sections d'essais mécaniques principales : le ton basal et les essais passifs. Un ton basal est défini comme la constriction partielle de base des cellules musculaires lisses, même en l'absence de stimulation locale, hormonale et neuronale externe10. Cette nature contractile de base du vagin et du col de l'utérus donne des comportements mécaniques caractéristiques qui sont ensuite mesurés par le système myographe de pression. Les propriétés passives sont évaluées en supprimant le calcium intercellulaire qui maintient l'état de base de contraction, ce qui entraîne une relaxation des cellules musculaires lisses. Dans l'état passif, les fibres de collagène et d'élastine fournissent les contributions dominantes pour les caractéristiques mécaniques des organes.
Le modèle murine est largement utilisé pour étudier les pathologies de la santé reproductive des femmes. La souris offre plusieurs avantages pour quantifier l'évolution des relations entre l'ECM et les propriétés mécaniques dans le système reproducteur11,12,13,14. Ces avantages comprennent des cycles estrous courts et bien caractérisés, un coût relativement faible, une facilité de manipulation et un temps gestationnel relativement court15. En outre, le génome des souris de laboratoire est bien cartographié et les souris génétiquement modifiées sont des outils précieux pour tester les hypothèses mécanistes16,17,18.
Les systèmes de myographie de pression disponibles dans le commerce sont largement utilisés pour quantifier les réponses mécaniques de divers tissus et organes. Quelques structures notables analysées sur le système de myographe de pression incluent les artères élastiques19,20,21,22, veines et greffes vasculaires machinées de tissu23,24, l'œsophage25, et les gros intestins26. La technologie du myographe sous pression permet une évaluation simultanée des propriétés dans les directions axiale et circonférence tout en maintenant les interactions cellules-ECM indigènes et la géométrie in vivo. En dépit de l'utilisation étendue des systèmes de myographe dans la mécanique molle de tissu et d'organe, un protocole utilisant la technologie de myographe de pression n'avait pas été précédemment développé pour le vagin et le col de l'utérus. Des investigations antérieures sur les propriétés mécaniques du vagin et du col de l'utérus ont été évaluées uniaxialement27,28. Ces organes, cependant, l'expérience de la charge multiaxiale dans le corps29,30, quantifiant ainsi leur réponse mécanique biaxiale est important.
En outre, des travaux récents suggèrent que les cellules musculaires lisses peuvent jouer un rôle potentiel dans les pathologies des tissus mous5,28,31,32. Ceci fournit une autre attraction de l'utilisation de la technologie de myographe de pression, car il préserve les interactions cellulaires-matrice indigènes, permettant ainsi la délimitation de la contribution que les cellules musculaires lisses jouent dans physiologique et pathophysiologique Conditions. Ici, nous proposons un protocole pour quantifier les propriétés mécaniques multiaxiales du vagin et du col de l'utérus sous le tonalité basale et les conditions passives.
Protocole
Des souris femelles nullipares de 4-6 mois de C57BL6J (29,4 à 6,8 grammes) à l'estrus ont été utilisées pour cette étude. Toutes les procédures ont été approuvées par le Comité des soins et de l'utilisation des animaux de l'Institut de l'Université Tulane. Après l'accouchement, les souris se sont acclimatées pendant une semaine avant l'euthanasie et ont été logées dans des conditions standard (cycles de lumière/obscurité de 12 heures).
1. Sacrifice de souris à l'estrus
- Déterminer le cycle estrous: Le cycle estrous a été surveillé par une évaluation visuelle conformément aux études précédentes15,33,34. Le cycle esturaire se compose de quatre étapes : proestrus, estrus, metestrus et diestrus. Pendant la phase proestrus les organes génitaux sont gonflés, roses, humides, et ridés. La phase de l'estrus est ridée mais moins enflée, rose et humide. Metestrus et diestrus sont tous deux signalés comme ne présentant aucun gonflement et froissements, manquant d'une teinte rose, et sec34,35.
- Effectuer une expérience à l'estrus: Tous les tests mécaniques ont été effectués alors que les souris étaient à l'estrus, car c'est le plus facile à visualiser et fournit un point de temps cohérent et répétable.
- Pour les souris subissant des tests de tonalité basale, euthanasiez par guillotine. Pour les souris testées uniquement dans des conditions passives, euthanasiez l'inhalation de dioxyde de carbone (CO2). La guillotine sert à préserver la fonction des cellules musculaires lisses de l'appareil reproducteur, comme le gaz CO2 modifie les propriétés contractiles des cellules musculaires lisses36,37,38, 39,40,41,42. Il est impératif d'effectuer la dissection dans les 30 minutes pour minimiser le risque d'apoptose cellulaire.
2. Dissection du système reproducteur
- Mise en place : Placez un tampon absorbant sur le poste de travail et remplissez un plat et une seringue Petri avec une solution de sel équilibré (HBSS) de 4 'C. Utilisez une lingette pour l'élimination des tissus adipeux. Placez le côté ventral de souris vers le haut et tapez les pattes et la queue. Allumez les lumières du microscope et éteignez des micro-ciseaux, des ciseaux, deux paires de pinces droites et deux paires de pinces courbes.
- À l'aide d'une pince à épiler et de ciseaux inclinés, soulevez la peau autour de l'abdomen et faites une incision à la base de l'abdomen, au-dessus de l'os pubien. L'incision doit être suffisamment peu profonde pour ne pas perforer la paroi musculaire abdominale. Continuer à utiliser les ciseaux pour couper en supériorité vers la cage thoracique et profondément à travers les muscles abdominaux.
- Enlever la graisse superficielle en tirant légèrement sur la graisse avec la pince incurvée et les micro-ciseaux. Le tissu adipeux reflétera la lumière de façon hétérogène avec un aspect scintillant. Placer toute la graisse enlevée et le tissu sur l'essuie-glace. Identifiez les cornes utérines et l'os pubien.
- Placez les ciseaux fermés entre la paroi vaginale et l'os pubien. Couper soigneusement le milieu de l'os pubien (symphyse pubienne). Placer les pinces courbes aux deux extrémités de l'os pubien coupé. Tirez les deux extrémités coupées latéralement pour permettre un meilleur accès aux organes reproducteurs.
- Retirer la vessie et l'urètre de la paroi vaginale. Cela peut être fait en utilisant des pinces droites et des micro-ciseaux. Tenez la vessie avec une pince à épiler droite pour créer de la tension et utilisez des techniques de dissection émoussée pour séparer le tissu environnant du vagin. Une fois que la vessie et l'urètre sont disséqués, couper la base et enlever de la cavité du corps.
- Identifier le système reproducteur : Les cornes utérines bifurquent du col de l'utérus. Le col de l'utérus peut être identifié à partir du vagin en raison de différences de géométrie et de rigidité. Le diamètre externe du col de l'utérus est plus petit que le vagin. Le col de l'utérus est plus rigide que le vagin et ressemble à celui d'une perle (Figure 1).
- Utilisez de l'encre et des étriers pour marquer des points de 3 mm le long des organes. Commencez sous les ovaires sur les tubes utérins et marquez les points de façon inférieure pour atteindre le col de l'utérus. Utilisez le point central du col de l'utérus pour commencer un chemin de point vers le vagin introitus.
- Laissez l'encre sécher et séparer les organes reproducteurs du tissu adipeux environnant, du tissu conjonctif et du côlon. Nettoyez le vagin aussi près que possible de l'introitus vaginal. À l'aide de ciseaux, couper autour de l'introitus vaginal.
REMARQUE : Il est possible que les organes se dessèchent au cours de ce processus. S'il s'agit d'un problème, une seringue remplie de 4 c HBSS peut être utilisée pour ajouter de l'humidité aux organes. - Couper les cornes utérines immédiatement inférieures aux ovaires. Notez que les organes se rétracteront de la longueur post-explantation que le tissu conjonctif est enlevé et l'organe recule. Placer les organes reproducteurs disséqués dans un plat Petri rempli de 4 c.C. HBSS. Ce changement de longueur peut être utilisé pour calculer la longueur in vivo estimée (section 5).
REMARQUE : Nous avons identifié que l'utilisation de HBSS à cette température pendant la dissection et l'annulation n'affecte pas la viabilité lisse de cellules de muscle. Le maintien d'un pH de 7,4, cependant, est impératif pour maintenir la viabilité des cellules musculaires lisses. À cette température, le HBSS a un niveau de pH de 7,4. - Après une période d'équilibre de 15 minutes dans un HBSS de 4 oC, mesurez l'espace entre les points à l'aide d'étriers. Enregistrez les mesures pour chaque distance dans une feuille de calcul. Ces valeurs seront utilisées pour calculer le rapport d'étirement in vivo (longueur d'origine/longueur explantée).
- Définir l'essuie-glace qui contient le tissu jeté sur la région abdominale avec l'excès de tissu face à l'intérieur de la souris et tremper la lingette dans 4 'C HBSS. Envelopper la souris et l'excès de tissu dans du papier d'aluminium et le placer dans un sac de congélation sécuritaire pour être entreposé à -20 oC. Le comportement mécanique passif sur le vagin ne s'est pas avéré sensiblement différent après un cycle de gel-dégel43. Tous les organes testés ont été utilisés immédiatement après l'euthanasie ou après un cycle de gel-dégel.
3. Cannulation
- Déterminer la taille appropriée de la canule pour le type d'organe. Dans une souris C57BL6J typique, le vagin utilise des canules qui sont à la fois 3,75 mm de diamètre et riveté. Le col de l'utérus utilise une canule de 3,75 mm pour l'extrémité vaginale et une canule de 0,75 mm de diamètre pour l'extrémité utérine (figure 2) La canule de 0,75 mm est lisse.
REMARQUE : Les tailles de diamètre indiquées ci-dessus sont employées pour les souris nulliparous typiques de 4-6 mois C57BL6, C57BL6 x 129SvEv, et les souris non parles âgées 7-9 mois. Cependant, certaines circonstances, telles que le prolapsus ou la grossesse, peuvent nécessiter une canule de plus grande taille. - À chaque organe, montez le côté cervical sur la partie transducteur de force du dispositif de cannulation. Montez l'extrémité opposée de l'organe (vaginal ou utérin) sur la partie micromètre de l'appareil. Resserrer les deux extrémités avec des sutures.
- En raison de la différence d'épaisseur et de degré de contractilité entre le vagin et le col de l'utérus, différentes techniques peuvent être utilisées pour effectuer le cannulation le plus efficace. Pour le vagin, placez 2 sutures entre les 2nd et 3rd rivets de la canule d'une manière "X". Lors de la cannulation du col de l'utérus, la canule n'est pas rivée de sorte que l'organe est mieux placé à l'arrière de la canule avec 3 sutures horizontales sur l'extrémité utérine et 4 sutures sur l'os externe. Pour les deux organes, la longueur maximale ne doit pas dépasser 7 mm entre les sutures (figure 3).
4. Myographie de pression mise en place
- Afin de mettre en place le système de myographie de pression, la puissance sur le système d'essai et de remplir la bouteille réservoir avec 200 ml de HBSS (Figure 4). Activez le feu et laissez le HBSS dans la bouteille du réservoir chauffer. Ensuite, allumez le microscope et ouvrez le programme informatique. Assurez-vous que l'image de l'organe cannulé, l'interface de pression, les relevés de débit mètre et l'outil de fonction du séquenceur sont tous visibles (Figure 5).
5. Essais mécaniques de tonalité basale
REMARQUE : Le col de l'utérus a montré une nature phasique pendant les étapes de début des essais. Cependant, cela a diminué après le préconditionnement. L'essai de tonalité basale est fait utilisant Krebs Ringer Buffer (KRB) dans le bassin de l'appareil DMT. Le tampon est aéré avec 95% O2 et 5% CO2. Une fois la partie de tonalité basale terminée, le KRB sans calcium est utilisé.
- Trouver la géométrie déchargée: Étirer l'organe de sorte que le mur n'est pas en tension. Pour le vagin, observez les rainures sur la paroi vaginale. Pour le col de l'utérus, couper immédiatement en dessous des points d'encre situés au-dessus et au-dessous de la marque centrale du col de l'utérus. Ceci permet de concevoir une méthode reproductible pour une longueur in situ cervicale de 6 mm44. Mesurer la longueur de la suture à la suture avec des étriers
- Trouver la pression déchargée (UP) : Augmenter la pression de 0 à 10 mmHg par incréments de 1 mmHg. Déterminer la pression dans laquelle l'organe n'est plus effondré. Cela peut être déterminé comme le plus grand saut dans le diamètre extérieur à une pression donnée, comme exposé sur le moniteur du programme. Après avoir enregistré la pression et le diamètre extérieur, notez que c'est le premier point où l'organe n'est pas effondré et zéro la force.
- Estimation de l'étirement in vivo : Calculez l'étirement in vivo estimé en divisant la longueur mesurée in vivo par la longueur mesurée après l'explantation :

- Préconditionnement de diamètre de pression : Définir la pression à 0 mmHg, la longueur à la longueur
 in vivo estimée et le gradient à 1,5 mmHg/s. Exécuter une séquence qui fait passer la pression de 0 mmHg à la pression in vivo - déchargée ( tableau1), maintenez 30 secondes, et de prendre la pression à 0 mmHg avec une période de maintien de 30 secondes. Après avoir répété pour un total de 5 cycles, appuyez sur Arrêtez dans le programme informatique et enregistrer le fichier.
in vivo estimée et le gradient à 1,5 mmHg/s. Exécuter une séquence qui fait passer la pression de 0 mmHg à la pression in vivo - déchargée ( tableau1), maintenez 30 secondes, et de prendre la pression à 0 mmHg avec une période de maintien de 30 secondes. Après avoir répété pour un total de 5 cycles, appuyez sur Arrêtez dans le programme informatique et enregistrer le fichier. - Trouver l'étirement in vivo expérimental : Ajustez l'organe pour qu'il soit à la longueur in vivo estimée pendant la pression déchargée et appuyez surDémarrer. Évaluer les valeurs de pression vs force pour les valeurs de pression allant de la pression déchargée à la pression maximale (tableau 1). Appuyez sur le bouton Stop dans le programme informatique et enregistrez le fichier.
REMARQUE : La valeur d'étirement mesurée est calculée in situ. Ceci est accompagné de la limitation qu'il ne peut être mesuré après la désarticulation de la symphyse pubienne. En conséquence, l'attache naturelle est perdue, ce qui peut modifier la longueur. L'étirement théorique, cependant, est basé sur la théorie précédemment introduite que l'organe connaîtra des changements minimes de force lorsqu'il est exposé à des pressions physiologiques pour conserver l'énergie45. Dans le protocole, l'étirement in vivo mesuré sera la valeur extensible calculée à l'aide de la longueur identifiée expérimentalement dans laquelle il y a un changement minimal de force lorsqu'il est exposé à une gamme physiologique de pressions. - Préconditionnement de diamètre de pression : Régler la pression à 0 mmHg, la longueur de la longueur in vivo expérimentale, et le gradient de 1,5 mmHg/s. Exécuter une séquence qui prend la pression de 0 mmHg à la pression maximale - UP , tenir pendant 30 secondes, et revenir à 0 mmHg avec une ad 30 secondes de période de prise. Après avoir répété cela pour un total de 5 cycles, appuyez sur le bouton Stop dans l'interface du programme et enregistrer le fichier.
REMARQUE : 5.4 est impératif pour réaliser une lecture plus cohérente de force axiale avec la pression croissante. Cette étape aide à trouver le tronçon in vivo correct, qui est souvent sous-estimé en fonction des indices visuels. 5.6 sert d'étape de précaution pour minimiser l'hystérèse et pour obtenir une réponse cohérente, répétable et mathématiquement interprétable de l'organe. - Préconditionnement de la longueur de force : Entrez une pression maximale de 1/3 et vers le haut pour la pression d'entrée et de sortie. Ajuster l'organe à -2% de la longueur in vivo et appuyez sur Démarrer. Ajuster la longueur à 2 % de longueur in vivo puis redescendre à -2 % à 10 m/s. Répétez l'extension axiale pour un total de 5 cycles. Appuyez sur Arrêtez dans le programme informatique et enregistrer le fichier.
- Équilibre : Avec l'organe à la longueur in vivo déterminée, régler à la fois l'aube et la pression de sortie à 1/3 de la pression maximale. Équilibrez l'orgue pendant 10 minutes. Ramenez lentement les deux pressions à 0 mmHg avec le gradient réglé comme 1,5 mmHg/s.
- Réévaluer la géométrie déchargée : Définir l'organe sur la longueur in vivo et la pression sur la pression déchargée. Diminuer la longueur axiale vers la longueur déchargée estimée à une vitesse de 10 m/s jusqu'à ce qu'il y ait un changement minimal dans la force. Cette longueur correspondante est connue sous le nom de longueur déchargée, ou lorsque l'organe n'est pas en tension ni compression. Avant de zéror la force, enregistrez la longueur déchargée, le diamètre extérieur et la valeur de force.
REMARQUE : La géométrie antérieure déchargée a été déterminée par des indices visuels, ce qui est purement qualitatif. Une réévaluation est nécessaire pour une méthode quantitative et pour tenir compte des changements possibles de longueur qui peuvent se produire pendant le préconditionnement. Cette géométrie sera utilisée dans la section 8. - Configuration de l'échographie : Utilisez le paquet abdominal d'imagerie générale pour visualiser les organes du dispositif d'essai. (Figure 6). Avant d'effectuer les essais, minimisez les artefacts du fond du bassin métallique myographique de pression. Ajustez la canule à une hauteur qui est la distance maximale du fond avec le tissu étant toujours entièrement immergé dans la solution d'essai. Un support personnalisé est imprimé en 3D pour stabiliser le transducteur en position verticale pendant l'imagerie.
- Imagerie par ultrasons : Identifiez la canule près du transducteur de force et ajustez le stade du microscope à l'image le long de la longueur du tissu. Tout au long du processus d'essai, la région du milieu le long de la longueur est suivie (figure 6A,C). Après l'imagerie, passez en revue l'image "Cine store" boucle qui se compose d'une série de cadres en mode B et d'identifier le cadre avec le plus grand diamètre extérieur. Les calculs d'épaisseur effectués seront utilisés à la section 8.
- Essais de diamètre de pression (-2 % de longueur in vivo) : Appuyez sur Démarrer et ajuster l'organe de sorte qu'il mesure -2 % de la longueur in vivo, réglez la pression à 0 mmHg et gradientz à 1,5 mmHg/s. Augmentez la pression de 0 mmHg à la pression maximale. Ramenez la pression à 0 mmHg avec une période de prise de 20 secondes. Répétez cette opération pendant 5 cycles.
- Essais de diamètre de pression (longueur in vivo) : Appuyez sur Démarrer et ajuster l'organe de sorte qu'il soit à la longueur vivo, réglez la pression à 0 mmHg, et gradient à 1,5 mmHg/s. Augmenter la pression de 0 mmHg à la pression maximale. Ramenez la pression à 0 mmHg avec une période de prise de 20 secondes. Répétez cette opération pendant 5 cycles.
- Essais de diamètre de pression (longueur in vivo de 2 % ) : Ajuster l'organe de manière à ce qu'il soit de 2 % de longueur in vivo, régler la pression à 0 mmHg et descendre à 1,5 mmHg/s. Augmenter la pression de 0 mmHg à la pression maximale, puis redescendre à 0 mmHg avec une période de prise de 20 secondes. Répétez cette opération pendant 5 cycles. Les données de pression des trois longueurs seront utilisées à l'article 8.
- Essai de force-longueur (pression nominale) : Fixez la pression à la pression déchargée et à l'organe à -2% de la longueur in vivo. Étirez l'organe jusqu'à 2 % de la longueur in vivo et revenez à -2 % la longueur in vivo à un taux de 10 m/s. Répétez l'opération pour un total de 3 cycles.
- Test de longueur de force (1/3 pression maximale - UP) : Réglez la pression à 1/3 de la pression maximale et ajustez l'organe à -2 % de la longueur in vivo. Après avoir appuyé sur Démarrer, étirer l'organe à 2% de la longueur in vivo et revenir à -2% de la longueur in vivo à un taux de 10 m/s. Après avoir répété pour un total de 3 cycles, appuyez sur Arrêtez et enregistrez les données.
- Essais de force-longueur (2/3 pression maximale - UP) : Réglez la pression à 2/3 de la pression maximale et ajustez l'organe à -2% de la longueur in vivo. Appuyez sur Démarrer et étirer l'organe à 2 % de la longueur in vivo et à -2 % la longueur in vivo à un taux de 10 m/s. Après avoir répété pour un total de 3 cycles, appuyez sur Arrêtez et enregistrez les données.
- Test de longueur de force (pression maximale et UP) : Réglez la pression à la pression maximale et réglez l'organe à -2 % de la longueur in vivo. À un taux de 10 m/s, étirer l'organe à 2 % de la longueur in vivo et revenir à -2 % de la longueur in vivo. Après avoir répété pour un total de 3 cycles, enregistrer les données. Toutes les données sur les forces seront utilisées à l'article 8.
- Retirez les supports de test KRB et lavez-les avec du KRB sans calcium. Remplacez le support par une solution KRB sans calcium complétée par 2 mM EGTA. Incuber le tissu pendant 30 minutes. Retirez la solution et remplacez le support par du KRB frais sans calcium.
6. Essais mécaniques passifs
REMARQUE : Si vous commencez par des tests passifs, commencez à l'étape 1. Si des tests de tonalité basale ont été effectués avant le démarrage passif à l'étape 6. Si vous commencez avec du tissu congelé, prévoyez une période d'équilibre de 30 minutes à température ambiante avant de canniser l'organe.
- Trouver la géométrie déchargée: Étirer l'organe de sorte que la paroi de l'organe n'est pas en tension. Mesurez l'organe cannulé de la suture à la suture et enregistrez-le comme la longueur déchargée.
- Trouver la pression déchargée: Après avoir appuyé sur Démarrer, augmenter la pression de 0 à 10 mmHg par incréments de 1 mmHg. Tout en passant par ce processus, déterminer la pression dans laquelle l'organe n'est pas en tension. À l'aide du moniteur de programme informatique, cela peut être déterminé à partir du plus grand saut dans le diamètre extérieur. Après la réduction à zéro de la force, enregistrez cette pression ainsi que le diamètre extérieur et notez que c'est le premier point dans lequel l'organe n'est pas effondré.
- Estimation de l'étirement in vivo : Calculez l'étirement in vivo estimé en divisant la longueur mesurée in vivo par la longueur mesurée post-explantation.
- Préconditionnement du diamètre de pression : Après avoir appuyé sur Démarrer, définir la pression à 0 mmHg, la longueur comme la longueur in vivo estimée, et le gradient à 1,5 mmHg/s. Commencez à exécuter une séquence qui prend la pression de 0 mmHg à la pression maximale et de retour à 0 Mmhg. Répétez ce processus à travers 5 cycles avec un temps de prise de 30 secondes.
- Préconditionnement de la longueur de la force : Ajustez l'organe à la longueur in vivo et entrez manuellement la pression déchargée dans le programme informatique pour les deux pressions. Après avoir appuyé sur Démarrer, définir le gradient à 2 mmHg et la pression à 1/3 du maximum. Étirez l'orgue jusqu'à 2 % et redescendez à -2 % à 10 m/s. Répétez ce cycle pour un total de 5 fois et appuyez sur Arrêt.
- Trouver la longueur expérimentale in vivo: Trouver et tracer des valeurs de force à -2% de la longueur in vivo, la longueur in vivo, et de 2% de la longueur in vivo. Prenez des forces à des pressions uniformément espacées allant de 0 mmHg à la pression maximale. L'étirement in vivo expérimental sera la valeur extensible qui présente une ligne relativement plate sur une gamme de pressions.
- Répétez le diamètre de pression et les étapes de préconditionnement axiale à la nouvelle longueur in vivo.
- Équilibre : Avec l'organe à la longueur in vivo déterminée, régler la pression d'auremaret et de sortie à la pression déchargée. Laisser l'orgue ré-équilibrer pendant 15 minutes. Après 15 minutes, ramener lentement l'inlet et la pression de sortie à 0 mmHg.
- Réévaluer la configuration déchargée : Amenez l'organe à la longueur déchargée et réestimez la longueur déchargée. Enregistrez la longueur déchargée et le diamètre extérieur alors que la pression est de 0 mmHg, la pression déchargée, et 1/3 de la pression maximale. Zéro la force à la pression déchargée. Le diamètre à la pression déchargée est le diamètre in vivo.
REMARQUE : La réestimation de la longueur déchargée est nécessaire car de petites déformations plastiques ont été observées précédemment dans les tissus biologiques mous après le préconditionnement. Cette configuration déchargée sera celle utilisée à la section 8. - Ultrasons : Effectuez l'imagerie par ultrasons en mode B à la longueur et à la pression déchargées.
- Essai de diamètre de pression : Avec l'organe à -2% de la longueur in vivo expérimentalement déterminée et la pression à 0 mmHg, appuyez sur Démarrer. Augmenter la pression de 0 mmHg à la pression maximale et revenir à 0 mmHg. Maintenez l'étape de 2-0 mmHg pendant 20 secondes. Après avoir répété pour un total de 5 fois, appuyez sur le bouton Stop dans l'interface et enregistrer le fichier.
REMARQUE : Répétez à la longueur in vivo expérimentale, 2 % de la longueur in vivo expérimentale. - Test de longueur de force : Réglez la pression à la pression nominale et ajustez l'organe à -2% de la longueur in vivo. Étirez l'organe jusqu'à 2 % de la longueur in vivo et remontez à -2 % de la longueur in vivo à un taux de 10 m/s. Après avoir répété pour un total de 3 fois, enregistrer les données. Répétez cette opération pour une pression maximale de 1/3, une pression maximale de 2/3 et à la pression maximale.
- Calculez l'épaisseur déchargée à partir d'images ultrasons en mode B. À l'aide d'un logiciel d'imagerie, tracez une ligne pour indiquer la profondeur de pénétration. Fixez l'échelle à la longueur de la ligne (c.-à-d. 2000 m comme le montre la figure 6B et 6D).
- Calculs de l'épaisseur du mur : À l'aide d'un logiciel informatique, tracez et mesurez le diamètre intérieur et externe de l'organe. Ensuite, tracez et mesurez une ligne entre les diamètres. Dessinez un total de 25 lignes transmuros. Moyenne de tous les points de données et répéter pour un total de 3 fois.
7. Nettoyer
- Assurez-vous que la pression est de 0 mmHg et éteinte. Fermez l'entrée principale et déversez-la pour les deux soupapes à trois voies. Aspirez le liquide restant du bassin du dispositif de cannulation.
- Retirez l'organe de la scène et remplissez la bouteille du réservoir d'eau déionisée. À l'aide d'une seringue, rincer la canule à l'eau. Connectez le tube pour contourner la canule.
- Activez la pression et l'écoulement, fixez la pression d'entrée à 200 mmHg, la pression de sortie à 0 mmHg, gradientz à 10 mmHg/s, et laissez le flux courir pendant 5 minutes. Laissez le système fonctionner pendant que la bouteille du réservoir est vide et laissez couler l'air pendant 5 minutes ou jusqu'à ce que les lignes soient sèches.
8. Analyse des données
- Pour les essais de diamètre de pression, recueillir des données à partir de l'endroit où la pression commence à augmenter de la valeur minimale jusqu'au maximum. Pour les essais de longueur de force, recueillir des données juste en dessous du maximum en vigueur jusqu'à ce que la force cesse de diminuer.
- Ouvrez le fichier de données pour chaque test de diamètre de pression et sélectionnez l'onglet de pression moyen. Naviguez vers la région de chargement de la dernière courbe, 0 mmHg à la pression maximale, et déposez les données dans une feuille de calcul. Sélectionnez la même région sur le diamètre extérieur, la pression d'entrée, la pression de sortie, la force, la température, le pH et l'onglet de débit plaçant chaque élément dans le même document.
- Ouvrez les données pour chaque test de longueur de force. Naviguez jusqu'à la région de chargement de la courbe, -2 % à 2 %, et faites glisser et déposer les données dans une feuille de calcul. Sélectionnez la même région pour les autres variables mesurées et placez chaque élément dans la même feuille de calcul.
- Pour le diamètre de pression et l'essai de longueur de force soustraire l'UP de toutes les valeurs de pression.
- Moyenne des données de diamètre de pression tous les 1 mmHg (c.-à-d., 0 '/- 0.5, 1 '/-0.5, 2 '/- 0.5).
- Trouver le volume déchargé de l'orgue (V). L'équation 1 peut être utilisée pour trouver V, étant donné que R02 est le rayon externe déchargé mesuré par le microscope, L est la longueur déchargée, et H est l'épaisseur déchargée telle que détectée par l'échographie. L'hypothèse de l'incompressibilité est mise à profit, ce qui signifie que l'organe conserve le volume lorsqu'il est soumis à des déformations.
REMARQUE : La longueur déchargée est mesurée avec des étriers de la suture à la suture. Le diamètre déchargé est mesuré au microscope, à la caméra et au logiciel, suivi du calcul du rayon (Figure 5) L'épaisseur déchargée est calculée à partir des images à ultrasons (Figure 6).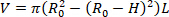 Équation 1
Équation 1 - En utilisant l'hypothèse de l'incompressibilité, utilisez
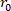 le volume
le volume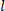 déchargé, le rayon
déchargé, le rayon 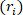 extérieur déformé ( ), et la longueur ( ) pour déterminer le rayon intérieur déformé.
extérieur déformé ( ), et la longueur ( ) pour déterminer le rayon intérieur déformé.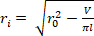 Équation 2
Équation 2 - Utilisez les équations 3, 4 et 5 pour calculer chaque stress, respectivement. Dans les équations 3-5, P est défini comme la pression intraluminale et Ft est la force mesurée par le transducteur.
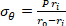 Équation 3
Équation 3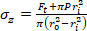 Équation 4
Équation 4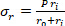 Équation 5
Équation 5 - Tracer la relation pression-diamètre, la relation force-pression, la relation circonférence stress-étirement circonférence, et le stress axial et les valeurs d'étirement circonférence (figure7, figure 8). Les valeurs d'étirement peuvent être calculées à l'aide du rayon de la paroi médiane. Les calculs des contraintes circonférences et axiales peuvent être trouvés dans les équations 6 et 7, respectivement.
 Équation 6
Équation 6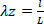 Équation 7
Équation 7 - Calculer la conformité près de la plage de pression physiologique et à l'étirement in vivo. La limite de pression inférieure (LPB) est 1 écart type en dessous de la pression mesurée moyenne. La limite de pression supérieure (UPB) est 1 déviation standard au-dessus de la pression mesurée moyenne9.
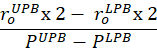
- Calculez le moduli tangenpour quantifier la rigidité du matériau. Identifiez l'effort circonférence calculé qui correspond à la pression inférieure liée et à la pression supérieure de la limite. Adaptez une ligne linéaire à la courbe d'étirement circonférence de stress-cirifère dans la plage de contrainte identifiée à la longueur in vivo. Calculer la pente de la ligne9.
Résultats
L'analyse réussie des propriétés mécaniques des organes reproducteurs féminins est subordonnée à la dissection appropriée d'organe, à l'annulation, et à l'essai. Il est impératif d'explanter les cornes utérines au vagin sans aucun défaut (Figure 1). Selon le type d'organe, la taille de la canule variera (Figure 2). Cannulation doit être fait de sorte que l'organe ne peut pas se déplacer pendant l'expérience, mais aussi ne pas endommager la paroi de l'orga...
Discussion
Le protocole fourni dans cet article présente une méthode pour déterminer les propriétés mécaniques du vagin murine et du col de l'utérus. Les propriétés mécaniques analysées dans ce protocole comprennent à la fois les conditions de tonalité passive et basale des organes. Les conditions de tonalité passive et basale sont induites par la modification de l'environnement biochimique dans lequel l'organe est submergé. Pour ce protocole, les médias impliqués dans les tests basaux contiennent du calcium. L'ess...
Déclarations de divulgation
aucun.
Remerciements
Les travaux ont été financés par la subvention de la NSF CAREER #1751050.
matériels
| Name | Company | Catalog Number | Comments |
| 2F catheter | Millar | SPR-320 | catheter to measure cervical pressure |
| 6-0 Suture | Fine Science Tools | 18020-60 | larger suture ties |
| CaCl2 (anhydrous) | VWR | 97062-590 | HBSS concentration: 140 mg/ mL |
| CaCl2-2H20 | Fischer chemical | BDH9224-1KG | KRB concentration: 3.68 g/L |
| Dextrose (D-glucose) | VWR | 101172-434 | HBSS concentration: 1000 mg/mL KRB concentration: 19.8 g/L |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | curved forceps |
| Dumont SS Forceps | Fine Science Tools | 11203-25 | straight forceps |
| Eclipse | Nikon | E200 | microscope used for imaging |
| Flow meter | Danish MyoTechnologies | 161FM | flow meter within the testing apparatus |
| Force Transducer - 110P | Danish MyoTechnologies | 100079 | force transducer |
| ImageJ | SciJava | ImageJ1 | used to measure volume |
| Instrument Cases | Fine Science Tools | 20830-00 | casing to hold dissection tools |
| KCl | Fisher Chemical | 97061-566 | HBSS concentration: 400 mg/ mL KRB concentration: 3.5 g/L |
| KH2PO4 | G-Biosciences | 71003-454 | HBSS concentration: 60 mg/ mL |
| MgCl2 | VWR | 97064-150 | KRB concentration: 1.14 g/L |
| MgCl2-6H2O | VWR | BDH9244-500G | HBSS concentration: 100 mg/ mL |
| MgSO4-7H20 | VWR | 97062-134 | HBSS concentration: 48 mg/ mL |
| Mircosoft excel | Microsoft | 6278402 | program used for spreadsheet |
| Na2HPO4 (dibasic anhydrous) | VWR | 97061-588 | HBSS concentration: 48 mg/mL KRB concentration: 1.44 g/L |
| NaCl | VWR | 97061-274 | HBSS concentration: 8000 mg/mL KRB concentration: 70.1 g/L |
| NaHCO3 | VWR | 97062-460 | HBSS concentration: 350 mg/ mL KRB concentration: 21.0 g/L |
| Pressure myograph systems | Danish MyoTechnologies | 110P and 120CP | Pressure myograph system: prorgram, cannulation device, and controller unit |
| Pressure Transducer | Danish MyoTechnologies | 100106 | pressure transducer |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | straight forceps |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | micro-scissors |
| Tissue dye | Bradley Products | 1101-3 | ink to measure in vivo stretch |
| Ultrasound transducer | FujiFilm Visual Sonics | LZ-550 | ultrasound transducer used; 256 elements, 40 MHz center frequency |
| VEVO2100 | FujiFilm Visual Sonics | VS-20035 | ultrasound used for imaging |
| Wagner Scissors | Fine Science Tools | 14069-12 | larger scissors |
Références
- Capone, D., et al. Evaluating Residual Strain Throughout the Murine Female Reproductive System. Journal of Biomechanics. 82, 299-306 (2019).
- Danforth, D. The fibrous nature of the human cervix, and its relation to the isthmic segment in gravid and nongravid uteri. American Journal of Obstetrics and Gynecology. 53 (4), 541-560 (1947).
- Hughesdon, P. The fibromuscular structure of the cervix and its changes during pregnancy and labour. Journal of Obstetrics and Gynecology of the British Commonwealth. 59, 763-776 (1952).
- Bryman, I., Norstrom, A., Lindblo, B. Influence of neurohypophyseal hormones on human cervical smooth muscle cell contractility in vitro. Obstetrics and Gynecology. 75 (2), 240-243 (1990).
- Joy, V., et al. A New Paradigm for the Role of Smooth Muscle Cells in the Human Cervix. Obstetrics. 215 (4), e471-e478 (2016).
- Xu, X., Akgul, Y., Mahendroo, M., Jerschow, A. Ex vivo assessment of mouse cervical remodeling through pregnancy via Na (23) MRS. NMR Biomedical. 23 (23), 907-912 (2014).
- Leppert, P. Anatomy and Physiology of cervical ripening. Clinical Obstetrics and Gynecology. 43 (43), 433-439 (2000).
- Schlembach, D., et al. Cervical ripening and insufficiency: from biochemical and molecular studies to in vivo clinical examination. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 144, S70-S79 (2000).
- Stoka, K., et al. Effects of Increased Arterial Stiffiness on Atherosclerotic Plaque Amounts. Journal of Biomechanical Engineering. 140 (5), (2018).
- Mohram, D., Heller, L. Ch. 7. Cardiovascular Physiology. , (2006).
- Yoshida, K., et al. Quantitative Evaluation of Collagen Crosslinks and Corresponding Tensile Mechanical Properties in Mouse Cervical Tissue during Normal Pregnancy. PLoS One. 9, e112391 (2014).
- Mahendroo, M. Cervical remodeling in term and preterm birth: insight from an animal model. Society for Reproduction and Fertility. 143 (4), 429-438 (2012).
- Elovitz, M., Miranlini, C. Can medroxyprogesterone acetate alter Toll-like receptor expression in a mouse model of intrauterine inflammation?. American Journal of Obstetrics and Gynecology. 193 (3), 1149-1155 (2005).
- Ripperda, C., et al. Vaginal estrogen: a dual-edged sword in postoperative healing of the vaginal wall. North American Menopause Society. 24 (7), 838-849 (2017).
- Nelson, J., Felicio, P., Randall, K., Sims, C., Finch, E. A Longitudinal Study of Estrous Cyclicity in Aging C57/6J Mice: Cycle, Frequency, Length, and Vaginal Cytology. Biology of Reproduction. 27 (2), 327-339 (1982).
- Ferruzzi, J., Collins, M., Yeh, A., Humphrey, J. Mechanical assessment of elastin integrity in fibrillin-1-deficient carotid arteries: implications for Marfan Syndrome. Cardiovascular Research. 92 (2), 287-295 (2011).
- Mariko, B., et al. Fribrillin-1 genetic deficiency leads to pathological ageing of arteries in mice. The Journal of Pathology. 224 (1), 33-44 (2011).
- Rahn, D., Ruff, M., Brown, S., Tibbals, H., Word, R. Biomechanical Properties of The Vaginal Wall: Effect of Pregnancy, Elastic Fiber Deficiency, and Pelvic Organ Prolapse. American Urogynecological Society. 198 (5), (2009).
- Caulk, A., Nepiyushchikh, Z., Shaw, R., Dixon, B., Gleason, R. Quantification of the passive and active biaxial mechanical behavior and microstructural organization of rat thoracic ducts. Royal Society Interface. 12 (108), 20150280 (2015).
- Amin, M., Le, V., Wagenseil, J. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. Journal of Visualized Experiments. (60), e3733 (2012).
- Sokolis, D., Sassani, S., Kritharis, E., Tsangaris, S. Differential histomechanical response of carotid artery in relation to species and region: mathematical description accounting for elastin and collagen anisiotropy. Medical and Biological Engineering and Computing. 49 (8), 867-879 (2011).
- Kim, J., Baek, S. Circumferential variations of the mechanical behavior of the porcine thoracic aorta during the inflation test. Journal of Biomechanics. 44 (10), 1941-1947 (2011).
- Faury, G., et al. Developmental adaptation of the mouse cardiovascular system to elastin haploinsufficency. Journal of Clinical Investigation. 11 (9), 1419-1428 (2003).
- Naito, Y., et al. Beyond Burst Pressure: Initial Evaluation of the Natural History of the Biaxial Mechanical Properties of Tissue-Engineered Vascular Grafts in the Venous Circulation Using a Murine Model. Tissue Engineering. 20, 346-355 (2014).
- Sommer, G., et al. Multaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
- Sokolis, D., Orfanidis, I., Peroulis, M. Biomechanical testing and material characterization for the rat large intestine: regional dependence of material parameters. Physiological Measurement. 32 (12), 1969-1982 (2011).
- Martins, P., et al. Prediction of Nonlinear Elastic Behavior of Vaginal Tissue: Experimental Results and Model Formation. Computational Methods of Biomechanics and Biomedical Engineering. 13 (3), 317-337 (2010).
- Feola, A., et al. Deterioration in Biomechanical Properties of the Vagina Following Implantation of a High-stiffness Prolapse Mesh. BJOG: An International Journal of Obstetrics and Gynaecology. 120 (2), 224-232 (2012).
- Huntington, A., Rizzuto, E., Abramowitch, S., Prete, Z., De Vita, R. Anisotropy of the Passive and Active Rat Vagina Under Biaxial Loading. Annals of Biomedical Engineering. 47, 272-281 (2018).
- Tokar, S., Feola, A., Moalli, P., Abramowitch, S. Characterizing the Biaxial Mechanical Properties of Vaginal Maternal Adaptations During Pregnancy. ASME 2010 Summer Bioengineering Conference, Parts A and B. , 689-690 (2010).
- Feloa, A., et al. Impact of Pregnancy and Vaginal Delivery on the Passive and Active Mechanics of the Rat Vagina. Annals of Biomedical Engineering. 39 (1), 549-558 (2010).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical Analysis of the Uterosacral Ligament: Swine vs Human. Annual Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Champlin, A. Determining the Stage of the Estrous Cycle in the Mouse by the Appearance. Biology of Reproduction. 8 (4), 491-494 (1973).
- Byers, S., Wiles, M., Dunn, S., Taft, R. Mouse Estrous Cycle Identification Tool and Images. PLoS One. 7 (4), e35538 (2012).
- McLean, A. Performing Vaginal Lavage, Crystal Violet Staining and Vaginal Cytological Evaluation for Mouse Estrous Cycle Staging Identification. Journal of Visualized Experiments. 67, e4389 (2012).
- Bugg, G., Riley, M., Johnston, T., Baker, P., Taggart, M. Hypoxic inhibition of human myometrial contractions in vitro: implications for the regulation of parturition. European Journal of Clinical Investigation. 36 (2), 133-140 (2006).
- Taggart, M., Wray, S. Hypoxia and smooth muscle function: key regulatory events during metabolic stress. Journal of Physiology. 509, 315-325 (1998).
- Yoo, K., et al. The effects of volatile anesthetics on spontaneous contractility of isolated human pregnant uterine muscle: a comparison among sevoflurane, desflurane, isoflurane, and halothane. Anesthesia and Analgesia. 103 (2), 443-447 (2006).
- de Souza, L., et al. Effects of redox disturbances on intentional contractile reactivity in rats fed with a hypercaloric diet. Oxidative Medicine and Cellular Longevity. , 6364821 (2018).
- Jaue, D., Ma, Z., Lee, S. Cardiac muscarinic receptor function in rats with cirrhotic cardiomyopathy. Hepatology. 25, 1361-1365 (1997).
- Xu, Q., Shaffer, E. The potential site of impaired gallbladder contractility in an animal mode of cholesterol gallstone disease. Gastroenterology. 110 (1), 251-257 (1996).
- Rodriguez, U., et al. Effects of blast induced Neurotrauma on pressurized rodent middle cerebral arteries. Journal of Visualized Experimentals. (146), e58792 (2019).
- Rubod, C., Boukerrou, M., Brieu, M., Dubois, P., Cosson, M. Biomechanical Properties of Vaginal Tissue Part 1: New Experimental Protocol. Journal of Urology. 178, 320-325 (2007).
- Robison, K., Conway, C., Desrosiers, L., Knoepp, L., Miller, K. Biaxial Mechanical Assessment of the Murine Vaginal Wall Using Extension-Inflation Testing. Journal of Biomechanical Engineering. 139 (10), 104504 (2017).
- Van loon, P. Length-Force and Volume-Pressure Relationships of Arteries. Biorheology. 14 (4), 181-201 (1977).
- Fernandez, M., et al. Investigating the Mechanical Function of the Cervix During Pregnancy using Finite Element Models Derived from High Resolution 3D MRI. Computational Methods Biomechanical and Biomedical Engineering. 19 (4), 404-417 (2015).
- House, M., Socrate, S. The Cervix as a Biomechanical Structure. Ultrasound Obstetric Gynecology. 28 (6), 745-749 (2006).
- Martins, P., et al. Biomechanical Properties of Vaginal Tissue in Women with Pelvic Organ Prolapse. Gynecologic and Obstetrics Investigation. 75, 85-92 (2013).
- Rada, C., Pierce, S., Grotegut, C., England, S. Intrauterine Telemetry to Measure Mouse Contractile Pressure In vivo. Journal of Visualized Experiments. (98), e52541 (2015).
- Lumsden, M. A., Baird, D. T. Intra-uterine pressure in dysmenorrhea. Acta Obstectricia at Gynecologica Scandinavica. 64 (2), 183-186 (1985).
- Milsom, I., Andersch, B., Sundell, G. The Effect of Flurbiprofen and Naproxen Sodium On Intra-Uterine Pressure and Menstrual Pain in Patients With Primary Dysmennorrhea. Acta Obstetricia et Gynecologica Scandinavica. 67 (8), 711-716 (1988).
- Park, K., et al. Vasculogenic female sexual dysfunction: the hemodynamic basis for vaginal engorgement insufficiency and clitoral erectile insufficiency. International Journal of Impotence Journal. 9 (1), 27-37 (1997).
- Bulletti, C., et al. Uterine Contractility During Menstrual Cycle. Human Reproduction. 15, 81-89 (2000).
- Kim, N. N., et al. Effects of Ovariectomy and Steroid Hormones on Vaginal Smooth Muscle Contractility. International Journal of Impotence Research. 16, 43-50 (2004).
- Giraldi, A., et al. Morphological and Functional Characterization of a Rat Vaginal Smooth Muscle Sphincter. International Journal of Impotence Research. 14, 271-282 (2002).
- Gleason, R., Gray, S. P., Wilson, E., Humphrey, J. A Multiaxial Computer-Controlled Organ Culture and Biomechanical Device for Mouse Carotid Arteries. Journal of Biomechanical Engineering. 126 (6), 787-795 (2005).
- Swartz, M., Tscumperlin, D., Kamm, R., Drazen, J. Mechanical Stress is Communicated Between Different Cell Types to Elicit Matrix Remodeling. Proceedings of the National Academy of Sciences of the United States of America. 98 (11), 6180-6185 (2001).
- Rachev, A. Remodeling of Arteries in Response to Changes in their Mechanical Environment. Biomechanics of Soft Tissue in Cardiovascular Systems. 441, 221-271 (2003).
- Lee, E. J., Holmes, J., Costa, K. Remodeling of Engineered Tissue Anisotropy in Response to Altered Loading Conditions. Annals of Biomedical Engineering. 36 (8), 1322-1334 (2008).
- Akintunde, A., et al. Effects of Elastase Digestion on the Murine Vaginal Wall Biaxial Mechanical Response. Journal of Biomechanical Engineering. 141 (2), 021011 (2018).
- Griffin, M., Premakumar, Y., Seifalian, A., Butler, P., Szarko, M. Biomechanical Characterization of Human Soft Tissues Using Indentation and Tensile Testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Myers, K., Socrate, S., Paskaleva, A., House, M. A Study of the Anisotripy and Tension/Compression Behavior of Human Cervical Tissue. Journal of Biomechanical Engineering. 132 (2), 021003 (2010).
- Murtada, S., Ferruzzi, J., Yanagisawa, H., Humphrey, J. Reduced Biaxial Contractility in the Descending Thoracic Aorta of Fibulin-5 Deficent Mice. Journal of Biomechanical Engineering. 138 (5), 051008 (2016).
- Berkley, K., McAllister, S., Accius, B., Winnard, K. Endometriosis-induced vaginal hyperalgesia in the rat: effect of estropause, ovariectomy, and estradiol replacement. Pain. 132, s150-s159 (2007).
- van der Walt, I., Bø, K., Hanekom, S., Rienhardt, G. Ethnic Differences in pelvic floor muscle strength and endurance in South African women. International Urogynecology Journal. 25 (6), 799-805 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon