需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用压力表谱对毛质生殖系统的双轴基底音和被动测试
摘要
该协议使用市售的压力子宫内科系统对鼠阴道和子宫颈进行压力阴唇测试。利用有钙和无钙的介质,在估计的生理条件下,对器官分离出平滑肌细胞(SMC)基底色和被动细胞外基质(ECM)的贡献。
摘要
女性生殖器官,特别是阴道和子宫颈,由各种细胞成分和独特的细胞外基质(ECM)组成。平滑肌细胞在阴道和宫颈壁内表现出收缩功能。根据生化环境和器官壁的机械分裂,平滑肌细胞改变收缩条件。平滑肌细胞在基线生理条件下的贡献被归类为基底音。更具体地说,基础色调是在没有荷尔蒙和神经刺激的情况下平滑肌细胞的基线部分收缩。此外,ECM 为器官壁提供结构支持,并充当生化线索的储层。这些生化线索对各种器官功能至关重要,例如促进生长和维持平衡。每个器官的ECM主要由胶原纤维(主要是胶原蛋白I、III和V型)、弹性纤维和糖甘油糖/蛋白酶组成。ECM 的组成和组织决定了每个器官的机械特性。ECM成分的变化可能导致生殖疾病的发展,如骨盆器官脱垂或过早的宫颈重塑。此外,ECM微结构和刚度的变化可能会改变平滑肌细胞活动和表型,从而导致收缩力的丧失。
在这项工作中,报告的协议用于评估非怀孕的鼠阴道和宫颈在4-6个月大时在estrus的基础色调和被动机械特性。这些器官安装在市售的压力表上,并进行了压力直径和力长测试。包括用于生殖器官机械表征的样本数据和数据分析技术。这些信息可能有助于构建数学模型和合理设计治疗妇女健康病理的干预措施。
引言
阴道壁由四层组成,即上皮、拉米那皮、肌肉和新发。上皮主要由上皮细胞组成。拉米纳蛋白片有大量的弹性和纤维胶原纤维。肌肉也由乳原和胶原纤维组成,但有增加的平滑肌肉细胞量。Adventiia 由电子莱他、胶原蛋白和成纤维细胞组成,尽管与前一层相比浓度降低。平滑肌细胞对生物力学动机的研究组感兴趣,因为它们在器官的收缩性质中发挥作用。因此,量化平滑肌细胞面积分数和组织是理解机械功能的关键。先前的研究表明,阴道壁内的平滑肌含量主要组织在圆周和纵轴。组织学分析表明,1号墙近端和远端的平滑肌面积分数约为35%。
子宫颈是一种高度胶原蛋白的结构,直到最近,被认为有最小的平滑肌细胞含量2,3。然而,最近的研究表明,平滑肌细胞在子宫颈4,5中可能具有更大的丰度和作用。子宫颈显示平滑肌细胞的梯度。内部 os 包含 50-60% 平滑肌肉细胞,其中外部 os 仅包含 10%。然而,小鼠研究报告子宫颈由10-15%平滑肌肉细胞和85-90%纤维结缔组织组成,而没有提到区域差异6,7,8。鉴于鼠标模型不同于经常报告的人类模型,需要进一步调查小鼠子宫颈。
该协议的目的是阐明鼠阴道和子宫颈的机械特性。这是通过使用压力表线仪实现,该装置能够同时评估圆周和轴向的机械性能,同时保持原生细胞基质相互作用和器官几何。器官安装在两个定制管上,用丝质6-0缝合线固定。围绕估计的生理轴向拉伸进行压力直径测试,以确定符合性和切线莫杜利9。进行了力长度测试,以确认估计的轴向拉伸,并确保机械性能在生理范围内量化。实验方案在4-6个月大的非怀孕的鼠阴道和子宫颈上进行。
该协议分为两个主要的机械测试部分:基音和被动测试。基底色调被定义为平滑肌细胞的基线部分收缩,即使在没有外部局部,荷尔蒙和神经刺激10。阴道和子宫颈的这种基线收缩性质产生典型的机械行为,然后通过压力阴骨系统测量。被动特性通过去除维持收缩基线状态的细胞间钙进行评估,从而放松平滑肌细胞。在被动状态下,胶原蛋白和乳胶纤维为器官的机械特性提供主要贡献。
鼠模型被广泛用于研究妇女生殖健康的病理学。小鼠提供了几个优势,以量化ECM和免疫系统11,12,13,14中ECM和机械特性之间的演变关系。这些优势包括周期短、特征好、成本相对较低、操作方便、妊娠时间相对较短15。此外,实验鼠的基因组绘制良好,转基因小鼠是检验机械假说16、17、18的宝贵工具。
市售的压力表线系统被广泛用于量化各种组织和器官的机械反应。一些值得注意的结构分析的压力骨髓系统包括弹性动脉19,20,21,22,静脉和组织工程血管移植23,24,食道25和大肠26。压力显影技术允许同时评估轴向和圆周方向的特性,同时保持原生细胞-ECM相互作用和体内几何体。尽管在软组织和器官力学中广泛使用了阴唇系统,但以前还没有为阴道和子宫颈开发过利用压力性阴唇技术的协议。先前对阴道和子宫颈的机械特性的调查被评估为单轴27,28。然而,这些器官在体内经历多轴负荷29,30,因此量化其双轴机械反应是重要的。
此外,最近的研究表明,平滑肌细胞可能在软组织病理学5,28,31,32中起到潜在的作用。这为利用压力肌图技术提供了另一个吸引力,因为它保留了原生细胞基质的相互作用,从而允许划定平滑肌细胞在生理和病理生理学中所起作用的贡献条件。在此,我们提出了一个协议,以量化阴道和子宫颈在基础音和被动条件下的多轴机械性能。
研究方案
本研究使用雌性C57BL6J小鼠(29.4~6.8克)进行本研究。所有程序都得到杜兰大学动物护理和使用研究所委员会的批准。分娩后,小鼠在安乐死前适应一周,并处于标准条件下(12小时光/暗周期)。
1. 在埃斯特鲁斯的老鼠牺牲
- 确定周期:根据以前的研究15,33,34,通过视觉评估监测的周期。周期由四个阶段组成:孕原、丝丝、美特鲁斯和死龙。在孕期,生殖器肿胀、粉红色、潮湿和起皱。estrus 阶段是皱纹,但肿胀较少,粉红色和潮湿。梅斯特鲁斯和死龙都报告表现出没有肿胀和皱纹,缺乏粉红色的色调,和干34,35。
- 在 estrus 执行实验:所有机械测试都是在小鼠在 estrus 时进行的,因为这是最容易可视化的,并且提供了一致且可重复的时间点。
- 对于接受基底音测试的小鼠,通过断头台实施安乐死。对于仅在被动条件下试验的小鼠,使用二氧化碳(CO2)吸入进行安乐死。断头台用于保持生殖道平滑肌细胞的功能,因为CO2气体改变平滑肌细胞的收缩特性36,37,38, 39,40,41,42.必须在30分钟内进行解剖,以尽量减少细胞凋亡的机会。
2. 生殖系统解剖
- 设置:在工作站上放置吸水垫,用 4°C 汉克平衡盐溶液 (HBSS) 溶液填充培养皿和注射器。使用抹布处理脂肪组织。将鼠标腹腔侧向上放置,并用胶带将爪子和尾巴胶带上。打开显微镜灯,并设置微剪刀,剪刀,两对直钳,和两对弯曲的钳子。
- 使用倾斜的钳子和剪刀,抬起腹部周围的皮肤,并在腹部底部,阴骨上方进行切口。切口应足够浅,不会刺穿腹部肌肉壁。继续使用剪刀,以优越的切割对肋骨笼和深通过腹部肌肉。
- 用弯曲的钳子和微剪刀轻轻拉上脂肪,去除表面脂肪。脂肪组织会以闪闪发光的外观异质反射光线。将所有去除的脂肪和组织放在抹布上。识别子宫角和阴骨。
- 在阴道壁和阴骨之间放置封闭的剪刀。小心地切下阴骨的中间(阴骨)。在切割的阴骨的两端放置弯曲的钳子。横向拉两端,以便更好地进入生殖器官。
- 从阴道壁上取出膀胱和尿道。这可以通过使用直钳和微剪刀来完成。用直钳保持膀胱,以产生紧张,并使用钝解剖技术将周围组织与阴道分离。一旦膀胱和尿道被解剖走,切下底座,从体腔中取出。
- 确定生殖系统:子宫角从子宫颈分叉。由于几何形状和刚度的差异,子宫颈可以从阴道识别。子宫颈的外径比阴道小。子宫颈比阴道更硬,感觉类似于珠子(图1)。
- 使用墨水和卡钳沿器官标记 3 毫米点。从子宫管上的卵巢下方开始,并低劣地标记点以到达子宫颈。使用中心子宫颈点开始点到阴道介绍的点路径。
- 让墨水干燥,将生殖器官与周围的脂肪组织、结缔组织和结肠分离。清洁阴道尽可能靠近阴道介绍。使用剪刀,在阴道外向周围切开。
注:在此过程中,器官可能会变干。如果这是一个问题,可以使用装有4°C HBSS的注射器向器官添加水分。 - 切子宫角立即不如卵巢。请注意,当结缔组织被移除和器官反冲时,器官将从植后长度中缩回。将解剖的生殖器官放入装有4°C HBSS的培养皿中。这种长度变化可用于计算估计体内长度(第 5 节)。
注:我们已经确定,在解剖和可切除期间在此温度下使用HBSS不会影响平滑肌细胞的生存能力。然而,保持pH7.4对于维持平滑肌细胞的生存能力至关重要。在此温度下,HBSS 的 pH 级为 7.4。 - 在 4°C HBSS 中经过 15 分钟的平衡期后,使用卡钳测量点之间的空间。将每个距离的测量值记录到电子表格中。这些值将用于计算体内拉伸比(原始长度/外植长度)。
- 将含有腹部区域丢弃组织的抹布与小鼠体内的多余组织放在一起,然后浸泡在 4°C HBSS 中。将鼠标和多余的组织包裹在铝箔中,放入冷冻安全袋中,以在-20°C处存放。阴道的被动机械行为在一次冷冻解冻周期43后没有显著差异。所有测试的器官在安乐死后或冷冻解冻周期后立即使用。
3. 可调节
- 确定器官类型的正确管状尺寸。在典型的C57BL6J鼠标中,阴道使用直径为3.75毫米且铆接的管状。子宫颈使用一个导管,即阴道端为3.75毫米,子宫端直径为0.75毫米(图2),0.75毫米的导管是光滑的。
注:上述直径尺寸用于典型的无效4-6个月C57BL6小鼠、C57BL6 x 129SvEv和7-9个月的非角小鼠。然而,某些情况,如脱垂或怀孕,可能需要更大的尺寸的管状。 - 在每个器官上,将宫颈侧安装在罐装置的力传感器部分。将器官的另一端(阴道或子宫)安装在设备的微米部分。用缝合线拧紧两端。
- 由于阴道和子宫颈的厚度和收缩程度不同,可以使用不同的技术来执行最有效的气罐。对于阴道,以"X"的方式在管的2个和第3个铆钉之间放置2个缝合线。当可以宫颈,管状不铆接,所以器官最好放在管的背面与3水平缝合在子宫端和4缝合在外部os。对于两个器官,缝合线之间的最大长度不应超过 7 mm(图3)。
4. 压力表图设置
- 为了设置压力近影系统,打开测试系统电源,并在储液罐中填充200 mL的HBSS(图4)。将热量"打开",让储液罐中的 HBSS 加热。接下来,打开显微镜并打开计算机程序。确保可分管器官的图像、压力接口、流量计读数和定序器功能工具都可见(图5)。
5. 底音机械测试
注:子宫颈在测试的初期阶段表现出相位性质。但是,在预置后,这种情况就减少了。基底音测试是在DMT器件的盆地中利用克雷布斯环铃缓冲器(KRB)进行的。缓冲液加气,95% O2和 5% CO2。基础音部分完成后,使用无钙KRB。
- 查找未卸载的几何体:拉伸器官,使墙壁不处于张力状态。对于阴道,观察阴道壁上的凹槽。对于子宫颈,切在中央子宫颈标记上方和下方的墨点下方。这设计了一种可重复的方法,用于宫颈原位长度为6mm444。使用卡钳测量从缝合到缝合的长度
- 查找卸载压力 (UP):以 1 mmHg 的增量将压力从 0 增加到 10 mmHg。确定器官不再坍塌的压力。这可以确定为在给定压力下外径的最大跃进,如程序监视器上所展示的那样。记录压力和外径后,请注意,这是器官不折叠并使力归零的第一点。
- 体内拉伸估计:通过将体内测得的长度除以除植物后测量的长度来计算体内拉伸的估计:

- 压力直径预调:将压力设置为 0 mmHg,将估计体内长度
 和梯度设置为 1.5 mmHg/s。 运行一个序列,将压力从 0 mmHg 到体内压力 = 卸载 (表1),保持 30秒,并在 30 秒的保持周期下将压力降低到 0 mmHg。重复共 5 个循环后,在计算机程序中按"停止"并保存文件。
和梯度设置为 1.5 mmHg/s。 运行一个序列,将压力从 0 mmHg 到体内压力 = 卸载 (表1),保持 30秒,并在 30 秒的保持周期下将压力降低到 0 mmHg。重复共 5 个循环后,在计算机程序中按"停止"并保存文件。 - 找到实验在体内拉伸:调整器官在估计体内长度,而在卸载的压力和按开始。评估从卸载压力到最大压力的压力值的压力与力值(表 1)。按计算机程序中的"停止"按钮并保存文件。
注: 测量的拉伸值是原位计算的。这伴随着限制,它只能在分解阴性共生后测量。因此,自然系绳丢失,这可能会改变长度。然而,理论的延伸是基于先前引入的理论,即当暴露于生理压力以节省能量时,器官的力变化最小。在协议中,在体内拉伸中测量的拉伸值是使用实验确定的长度计算的拉伸值,其中在暴露于生理压力范围时,力变化最小。 - 压力直径预调理:将压力设置为 0 mmHg,将长度设置为实验体内长度,以及 1.5 mmHg/s 的梯度。 运行一个序列,将压力从 0 mmHg 到最大压力 + UP,保持 30 秒,然后通过广告返回 0 mmHgditional 30 秒的持有期。重复此项共 5 个周期后,按程序界面中的"停止"按钮并保存文件。
注:5.4 对于在压力增大时实现更一致的轴向力读数至关重要。这一步有助于找到正确的体内拉伸,这往往被低估基于视觉线索。5.6 作为预防措施,以尽量减少迟滞,实现器官的一致、可重复、数学解释性的反应。 - 力长度预调节:输入 1/3 最大压力 + UP,用于进气和出口压力。将器官调整到体内长度的-2%,然后按"开始"。 将长度调整到体内长度为+2%,然后在 10 μm/s 时降至 -2%。 重复轴向延伸共 5 个周期。按计算机程序中的停止并保存文件。
- 平衡:在器官处于确定体内长度时,将入口和出口压力设置为最大压力的 1/3 = UP。将器官平衡10分钟。缓慢地将两个压力降低到 0 mmHg,梯度设置为 1.5 mmHg/s。
- 重新评估未卸载的几何形状:将器官设置为体内长度,将压力设置为卸载压力。以 10 μm/s 的速率减小估计卸载长度的轴向长度,直到力发生最小变化。这种相应的长度称为卸载长度,或器官不处于张力或压缩状态的地方。在将力归零之前,记录卸载的长度、外径和力值。
注: 先前未加载的几何体由视觉提示确定,这是纯粹的定性。重新评估对于定量方法是必要的,并考虑到在预处理期间可能发生的长度变化。此几何体将在第 8 节中使用。 - 超声波设置:使用常规成像腹部包来可视化测试设备中的器官。(图6)在测试之前,尽量减少压力近影金属盆底部的伪影。将导管调节到与底部的最大距离的高度,组织仍完全浸没在测试解决方案中。自定义支架是 3D 打印,以在成像过程中将传感器稳定在垂直位置。
- 超声成像:识别力传感器附近的导管,并调整显微镜的台次,以沿组织的长度进行成像。在整个测试过程中,沿长度的中间区域被跟踪 (图6A,C)。成像后,查看由一系列 B 模式帧组成的图像"Cine 存储"循环,并识别外径最大的帧。所作的厚度计算将在第8节使用。
- 压力直径测试(2%在体内长度):按下启动并调整器官,使其为体内长度的-2%,将压力设置为0 mmHg,梯度设置为1.5 mmHg/s。将压力从0 mmHg增加到最大压力。在 20 秒的保持周期内将压力降低到 0 mmHg。重复 5 个循环。
- 压力直径测试(体内长度):按下启动并调整器官,使其处于活体长度,将压力设置为 0 mmHg,梯度设置为 1.5 mmHg/s。将压力从 0 mmHg 增加到最大压力。在 20 秒的保持周期内将压力降低到 0 mmHg。重复 5 个循环。
- 压力直径测试(体内长度为±2%):调整器官,使其在体内长度为±2%,将压力设置为0 mmHg,梯度为1.5 mmHg/s。将压力从0 mmHg增加到最大压力,然后在20秒的保持周期下降至0 mmHg。重复 5 个循环。所有三个长度的压力数据将在第 8 节中使用。
- 力长度测试(标称压力):将卸载压力和器官的压力设置为体内长度的-2%。将器官拉伸至体内长度的±2%,以10μm/s的速度恢复到体内长度的±2%。
- 力长度测试(1/3 最大压力 + UP):将压力设置为最大压力的 1/3 + UP,并将器官调整到体内长度的 -2%。按下"开始"后,将器官拉伸到体内长度的±2%,以10μm/s的速度将体内长度拉回到-2%。重复共 3 个循环后,按"停止"并保存数据。
- 力长度测试(2/3 最大压力 + UP):将压力设置为最大压力的 2/3 + UP,并将器官调整到体内长度的 -2%。按下启动并拉伸器官到+2%的体内长度和回-2%的体内长度以10μm/s的速度。重复共 3 个循环后,按"停止"并保存数据。
- 力长度测试(最大压力 + UP):将压力设置为最大压力 + UP,并将器官调整到体内长度的 -2%。以10μm/s的速度,将器官拉伸到体内长度的+2%,回到体内长度的-2%。重复共 3 个循环后,保存数据。所有力数据将在第 8 节中使用。
- 去除KRB测试介质,用无钙KRB清洗。用不含钙的KRB溶液更换介质,辅以2mM EGTA。孵育组织30分钟。取出溶液,用新鲜的无钙KRB更换介质。
6. 被动机械测试
注:如果从被动测试开始,则从步骤 1 开始。如果在步骤 6 被动启动之前执行基底音测试。如果从冷冻组织开始,在室温下留出30分钟的平衡期,然后使器官脱光。
- 找到未卸下的几何体:拉伸器官,使器官的墙壁不处于紧张状态。测量从缝合到缝合的可凝固器官,并将其记录为卸载长度。
- 查找卸载压力:按下"开始"后,将压力从 0 增加到 10 mmHg,增量为 1 mmHg。在进行此过程时,确定器官不处于紧张状态的压力。使用计算机程序监视器,可以从外径的最大跃点确定。将力归零后,记录此压力和外径,并记下为器官未折叠的第一个点。
- 估计体内拉伸:通过将体内测得的长度除以植物后测量的长度来计算体内拉伸的估计。
- 压力直径预调:按下"开始"后,将压力设置为0 mmHg,长度为估计体内长度,梯度为1.5 mmHg/s。开始运行一个序列,将压力从0 mmHg到最大压力,然后回到0毫米汞。在 30 秒的保持时间内重复此过程 5 个周期。
- 力长度预调:将器官调整到体内长度,并手动输入计算机程序中的卸载压力,以承受这两种压力。按下"开始"后,将梯度设置为 2 mmHg,将压力设置为最大值的 1/3。伸展器官高达+2%,在10μm/s下向下拉伸至-2%。重复此循环共5次,然后按停止。
- 查找体内实验长度:查找和绘制在体内长度的 -2%、体内长度和体内长度的 ±2% 的力值。在从 0 mmHg 到最大压力的均匀间隔压力下施加力。体内拉伸的实验将是拉伸值,在一系列压力上显示相对平坦的线。
- 在新的体内长度重复压力直径和轴向预调节步骤。
- 平衡:在器官处于确定体内长度时,将入口和出口压力设置为卸载压力。让器官重新平衡15分钟。15 分钟后,缓慢地将入口和出口压力降至 0 mmHg。
- 重新评估卸载配置:将器官带到卸载长度并重新估计卸载的长度。当压力为 0 mmHg 时,记录卸载的长度和外径,而卸载的压力为 1/3,最大压力为 1/3。在卸载压力处将力归零。卸载压力的直径是体内直径。
注:重新估计卸载长度是必要的,因为以前在预处理后在软生物组织中观察到了小的塑性变形。此卸载配置将是第 8 节中使用的配置。 - 超声波:在未加载的长度和压力下执行超声波 B 模式成像。
- 压力直径测试:在实验确定的器官长度为 -2% 时,在 0 mmHg 处,按"开始"。 将压力从 0 mmHg 增加到最大压力,然后增加到 0 mmHg。按住 2-0 mmHg 步长 20 秒。重复共 5 次后,按界面中的"停止"按钮并保存文件。
注:在实验体内长度重复,+2%的实验性体内长度。 - 力长度测试:将压力设定为标称压力,并将器官调节到体内长度的-2%。以10μm/s的速度将器官拉伸至体内长度的±2%,并回到体内长度的-2%。重复共 3 次后,保存数据。对 1/3 最大压力、2/3 最大压力和最大压力重复此操作。
- 计算超声波图像 B 模式图像中卸载的厚度。使用成像软件,绘制一条线来表示穿透深度。将刻度设置为线的长度(即 2000 μm,如图6B 和 6D所示)。
- 壁厚计算:使用计算机软件,跟踪和测量器官的内外直径。然后,绘制并测量直径之间的直线。共绘制 25 条跨壁画线。平均所有数据点,重复共 3 次。
7. 清理
- 确保压力为 0 mmHg 并关闭。关闭两个三向阀的主入口和出口。从罐化装置的盆地中吸出剩余的液体。
- 从舞台上取下器官,向储液罐中注满去离子水。使用注射器,用水冲洗管。连接油管以绕过管路。
- 打开压力和流量,将进气压力设置为 200 mmHg,出口压力设置为 0 mmHg,梯度为 10 mmHg/s,让流量运行 5 分钟。在储液罐瓶空时让系统运行,让空气运行 5 分钟或直到管路干燥。
8. 数据分析
- 对于压力直径测试,从压力开始从最小值到最大值处收集数据。对于力长度测试,从刚到最大生效的峰值以下收集数据,直到力停止减小。
- 打开每个压力直径测试的数据文件,然后选择平均压力选项卡。导航到最后一条曲线的加载区域,0 mmHg 到最大压力,并将数据放入电子表格中。在外径、入口压力、出口压力、力、温度、pH 和流量选项卡上选择相同的区域,将每个项目放在同一文档中。
- 打开每个力长度测试的数据。导航到曲线的加载区域,-2% 到 +2%,并将数据拖放到电子表格中。为其他测量变量选择相同的区域,并将每个项目放在同一电子表格中。
- 对于压力直径和力长度测试,从所有压力值中减去 UP。
- 每 1 mmHg 平均压力直径数据(即 0+/- 0.5、1+/-0.5、2+/- 0.5)。
- 找到器官的卸载体积 (V).公式1可用于查找V,因为R 02是显微镜测量的未卸载的外部半径,L是卸载长度,H是超声波检测到的卸载厚度。 不可压缩的假设被利用,这意味着器官在变形时保存体积。
注: 卸载长度用卡钳从缝合到缝合进行测量。通过显微镜、照相机和软件测量卸载的直径,然后计算半径(图5),卸载的厚度是根据超声波图像计算的(图6)。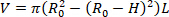 公式 1
公式 1 - 使用不可压缩性假设,使用卸载体积、变形外半径()
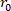 和长度()
和长度() 来确定变形的内半径。
来确定变形的内半径。 
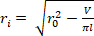 公式 2
公式 2 - 分别使用公式 3、4 和 5 计算每个应力。在方程 3-5 中,P 定义为电内压力,Ft是传感器测量的力。
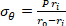 公式 3
公式 3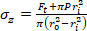 公式 4
公式 4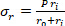 公式 5
公式 5 - 绘制压力-直径关系、力-压力关系、圆周应力-圆周拉伸关系以及轴向应力和圆周拉伸值(图 7,图 8)。可以使用中壁半径计算拉伸值。圆周应力和轴向应力的计算分别位于方程 6 和 7 中。
 公式 6
公式 6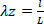 公式 7
公式 7 - 计算生理压力范围和体内拉伸的符合性。下压力边界 (LPB) 比均值测量压力低 1 个标准偏差。上压力边界 (UPB) 比平均测量压力9高出 1 个标准偏差。
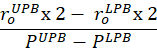
- 计算切线调节力以量化材料刚度。确定与下压力边界和上限压力对应的计算的圆周应力。将直线拟合到体内长度的确定应力范围内的圆周应力拉伸曲线。计算线9的斜率。
结果
女性生殖器官的机械特性的成功分析取决于适当的器官解剖、可分离和测试。有必要将子宫角切除阴道,没有任何缺陷(图1)。根据器官类型,管状大小会有所不同(图2)。必须进行排泄,使器官在实验期间不能移动,但不得在手术过程中损坏器官的墙壁(图3)。任一步骤的失败都会导致容器无法保持压力。测试程序标准化对于协议的成功至关重要,以便产生...
讨论
本文提供的方案提出了一种测定鼠阴道和子宫颈的机械特性的方法。该协议分析的机械特性包括器官的被动和基底色调条件。被动和基底色调条件是通过改变器官被淹没的生化环境引起的。对于该协议,参与基础测试的介质含有钙。测试基础色调条件允许分离平滑肌细胞机械贡献在女性生殖器官54,55。执行被动机械测试时,介质不含钙。钙的缺乏会抑制平?...
披露声明
没有。
致谢
这项工作由NSF CAREER奖授予#1751050资助。
材料
| Name | Company | Catalog Number | Comments |
| 2F catheter | Millar | SPR-320 | catheter to measure cervical pressure |
| 6-0 Suture | Fine Science Tools | 18020-60 | larger suture ties |
| CaCl2 (anhydrous) | VWR | 97062-590 | HBSS concentration: 140 mg/ mL |
| CaCl2-2H20 | Fischer chemical | BDH9224-1KG | KRB concentration: 3.68 g/L |
| Dextrose (D-glucose) | VWR | 101172-434 | HBSS concentration: 1000 mg/mL KRB concentration: 19.8 g/L |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | curved forceps |
| Dumont SS Forceps | Fine Science Tools | 11203-25 | straight forceps |
| Eclipse | Nikon | E200 | microscope used for imaging |
| Flow meter | Danish MyoTechnologies | 161FM | flow meter within the testing apparatus |
| Force Transducer - 110P | Danish MyoTechnologies | 100079 | force transducer |
| ImageJ | SciJava | ImageJ1 | used to measure volume |
| Instrument Cases | Fine Science Tools | 20830-00 | casing to hold dissection tools |
| KCl | Fisher Chemical | 97061-566 | HBSS concentration: 400 mg/ mL KRB concentration: 3.5 g/L |
| KH2PO4 | G-Biosciences | 71003-454 | HBSS concentration: 60 mg/ mL |
| MgCl2 | VWR | 97064-150 | KRB concentration: 1.14 g/L |
| MgCl2-6H2O | VWR | BDH9244-500G | HBSS concentration: 100 mg/ mL |
| MgSO4-7H20 | VWR | 97062-134 | HBSS concentration: 48 mg/ mL |
| Mircosoft excel | Microsoft | 6278402 | program used for spreadsheet |
| Na2HPO4 (dibasic anhydrous) | VWR | 97061-588 | HBSS concentration: 48 mg/mL KRB concentration: 1.44 g/L |
| NaCl | VWR | 97061-274 | HBSS concentration: 8000 mg/mL KRB concentration: 70.1 g/L |
| NaHCO3 | VWR | 97062-460 | HBSS concentration: 350 mg/ mL KRB concentration: 21.0 g/L |
| Pressure myograph systems | Danish MyoTechnologies | 110P and 120CP | Pressure myograph system: prorgram, cannulation device, and controller unit |
| Pressure Transducer | Danish MyoTechnologies | 100106 | pressure transducer |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | straight forceps |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | micro-scissors |
| Tissue dye | Bradley Products | 1101-3 | ink to measure in vivo stretch |
| Ultrasound transducer | FujiFilm Visual Sonics | LZ-550 | ultrasound transducer used; 256 elements, 40 MHz center frequency |
| VEVO2100 | FujiFilm Visual Sonics | VS-20035 | ultrasound used for imaging |
| Wagner Scissors | Fine Science Tools | 14069-12 | larger scissors |
参考文献
- Capone, D., et al. Evaluating Residual Strain Throughout the Murine Female Reproductive System. Journal of Biomechanics. 82, 299-306 (2019).
- Danforth, D. The fibrous nature of the human cervix, and its relation to the isthmic segment in gravid and nongravid uteri. American Journal of Obstetrics and Gynecology. 53 (4), 541-560 (1947).
- Hughesdon, P. The fibromuscular structure of the cervix and its changes during pregnancy and labour. Journal of Obstetrics and Gynecology of the British Commonwealth. 59, 763-776 (1952).
- Bryman, I., Norstrom, A., Lindblo, B. Influence of neurohypophyseal hormones on human cervical smooth muscle cell contractility in vitro. Obstetrics and Gynecology. 75 (2), 240-243 (1990).
- Joy, V., et al. A New Paradigm for the Role of Smooth Muscle Cells in the Human Cervix. Obstetrics. 215 (4), e471-e478 (2016).
- Xu, X., Akgul, Y., Mahendroo, M., Jerschow, A. Ex vivo assessment of mouse cervical remodeling through pregnancy via Na (23) MRS. NMR Biomedical. 23 (23), 907-912 (2014).
- Leppert, P. Anatomy and Physiology of cervical ripening. Clinical Obstetrics and Gynecology. 43 (43), 433-439 (2000).
- Schlembach, D., et al. Cervical ripening and insufficiency: from biochemical and molecular studies to in vivo clinical examination. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 144, S70-S79 (2000).
- Stoka, K., et al. Effects of Increased Arterial Stiffiness on Atherosclerotic Plaque Amounts. Journal of Biomechanical Engineering. 140 (5), (2018).
- Mohram, D., Heller, L. Ch. 7. Cardiovascular Physiology. , (2006).
- Yoshida, K., et al. Quantitative Evaluation of Collagen Crosslinks and Corresponding Tensile Mechanical Properties in Mouse Cervical Tissue during Normal Pregnancy. PLoS One. 9, e112391 (2014).
- Mahendroo, M. Cervical remodeling in term and preterm birth: insight from an animal model. Society for Reproduction and Fertility. 143 (4), 429-438 (2012).
- Elovitz, M., Miranlini, C. Can medroxyprogesterone acetate alter Toll-like receptor expression in a mouse model of intrauterine inflammation?. American Journal of Obstetrics and Gynecology. 193 (3), 1149-1155 (2005).
- Ripperda, C., et al. Vaginal estrogen: a dual-edged sword in postoperative healing of the vaginal wall. North American Menopause Society. 24 (7), 838-849 (2017).
- Nelson, J., Felicio, P., Randall, K., Sims, C., Finch, E. A Longitudinal Study of Estrous Cyclicity in Aging C57/6J Mice: Cycle, Frequency, Length, and Vaginal Cytology. Biology of Reproduction. 27 (2), 327-339 (1982).
- Ferruzzi, J., Collins, M., Yeh, A., Humphrey, J. Mechanical assessment of elastin integrity in fibrillin-1-deficient carotid arteries: implications for Marfan Syndrome. Cardiovascular Research. 92 (2), 287-295 (2011).
- Mariko, B., et al. Fribrillin-1 genetic deficiency leads to pathological ageing of arteries in mice. The Journal of Pathology. 224 (1), 33-44 (2011).
- Rahn, D., Ruff, M., Brown, S., Tibbals, H., Word, R. Biomechanical Properties of The Vaginal Wall: Effect of Pregnancy, Elastic Fiber Deficiency, and Pelvic Organ Prolapse. American Urogynecological Society. 198 (5), (2009).
- Caulk, A., Nepiyushchikh, Z., Shaw, R., Dixon, B., Gleason, R. Quantification of the passive and active biaxial mechanical behavior and microstructural organization of rat thoracic ducts. Royal Society Interface. 12 (108), 20150280 (2015).
- Amin, M., Le, V., Wagenseil, J. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. Journal of Visualized Experiments. (60), e3733 (2012).
- Sokolis, D., Sassani, S., Kritharis, E., Tsangaris, S. Differential histomechanical response of carotid artery in relation to species and region: mathematical description accounting for elastin and collagen anisiotropy. Medical and Biological Engineering and Computing. 49 (8), 867-879 (2011).
- Kim, J., Baek, S. Circumferential variations of the mechanical behavior of the porcine thoracic aorta during the inflation test. Journal of Biomechanics. 44 (10), 1941-1947 (2011).
- Faury, G., et al. Developmental adaptation of the mouse cardiovascular system to elastin haploinsufficency. Journal of Clinical Investigation. 11 (9), 1419-1428 (2003).
- Naito, Y., et al. Beyond Burst Pressure: Initial Evaluation of the Natural History of the Biaxial Mechanical Properties of Tissue-Engineered Vascular Grafts in the Venous Circulation Using a Murine Model. Tissue Engineering. 20, 346-355 (2014).
- Sommer, G., et al. Multaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
- Sokolis, D., Orfanidis, I., Peroulis, M. Biomechanical testing and material characterization for the rat large intestine: regional dependence of material parameters. Physiological Measurement. 32 (12), 1969-1982 (2011).
- Martins, P., et al. Prediction of Nonlinear Elastic Behavior of Vaginal Tissue: Experimental Results and Model Formation. Computational Methods of Biomechanics and Biomedical Engineering. 13 (3), 317-337 (2010).
- Feola, A., et al. Deterioration in Biomechanical Properties of the Vagina Following Implantation of a High-stiffness Prolapse Mesh. BJOG: An International Journal of Obstetrics and Gynaecology. 120 (2), 224-232 (2012).
- Huntington, A., Rizzuto, E., Abramowitch, S., Prete, Z., De Vita, R. Anisotropy of the Passive and Active Rat Vagina Under Biaxial Loading. Annals of Biomedical Engineering. 47, 272-281 (2018).
- Tokar, S., Feola, A., Moalli, P., Abramowitch, S. Characterizing the Biaxial Mechanical Properties of Vaginal Maternal Adaptations During Pregnancy. ASME 2010 Summer Bioengineering Conference, Parts A and B. , 689-690 (2010).
- Feloa, A., et al. Impact of Pregnancy and Vaginal Delivery on the Passive and Active Mechanics of the Rat Vagina. Annals of Biomedical Engineering. 39 (1), 549-558 (2010).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical Analysis of the Uterosacral Ligament: Swine vs Human. Annual Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Champlin, A. Determining the Stage of the Estrous Cycle in the Mouse by the Appearance. Biology of Reproduction. 8 (4), 491-494 (1973).
- Byers, S., Wiles, M., Dunn, S., Taft, R. Mouse Estrous Cycle Identification Tool and Images. PLoS One. 7 (4), e35538 (2012).
- McLean, A. Performing Vaginal Lavage, Crystal Violet Staining and Vaginal Cytological Evaluation for Mouse Estrous Cycle Staging Identification. Journal of Visualized Experiments. 67, e4389 (2012).
- Bugg, G., Riley, M., Johnston, T., Baker, P., Taggart, M. Hypoxic inhibition of human myometrial contractions in vitro: implications for the regulation of parturition. European Journal of Clinical Investigation. 36 (2), 133-140 (2006).
- Taggart, M., Wray, S. Hypoxia and smooth muscle function: key regulatory events during metabolic stress. Journal of Physiology. 509, 315-325 (1998).
- Yoo, K., et al. The effects of volatile anesthetics on spontaneous contractility of isolated human pregnant uterine muscle: a comparison among sevoflurane, desflurane, isoflurane, and halothane. Anesthesia and Analgesia. 103 (2), 443-447 (2006).
- de Souza, L., et al. Effects of redox disturbances on intentional contractile reactivity in rats fed with a hypercaloric diet. Oxidative Medicine and Cellular Longevity. , 6364821 (2018).
- Jaue, D., Ma, Z., Lee, S. Cardiac muscarinic receptor function in rats with cirrhotic cardiomyopathy. Hepatology. 25, 1361-1365 (1997).
- Xu, Q., Shaffer, E. The potential site of impaired gallbladder contractility in an animal mode of cholesterol gallstone disease. Gastroenterology. 110 (1), 251-257 (1996).
- Rodriguez, U., et al. Effects of blast induced Neurotrauma on pressurized rodent middle cerebral arteries. Journal of Visualized Experimentals. (146), e58792 (2019).
- Rubod, C., Boukerrou, M., Brieu, M., Dubois, P., Cosson, M. Biomechanical Properties of Vaginal Tissue Part 1: New Experimental Protocol. Journal of Urology. 178, 320-325 (2007).
- Robison, K., Conway, C., Desrosiers, L., Knoepp, L., Miller, K. Biaxial Mechanical Assessment of the Murine Vaginal Wall Using Extension-Inflation Testing. Journal of Biomechanical Engineering. 139 (10), 104504 (2017).
- Van loon, P. Length-Force and Volume-Pressure Relationships of Arteries. Biorheology. 14 (4), 181-201 (1977).
- Fernandez, M., et al. Investigating the Mechanical Function of the Cervix During Pregnancy using Finite Element Models Derived from High Resolution 3D MRI. Computational Methods Biomechanical and Biomedical Engineering. 19 (4), 404-417 (2015).
- House, M., Socrate, S. The Cervix as a Biomechanical Structure. Ultrasound Obstetric Gynecology. 28 (6), 745-749 (2006).
- Martins, P., et al. Biomechanical Properties of Vaginal Tissue in Women with Pelvic Organ Prolapse. Gynecologic and Obstetrics Investigation. 75, 85-92 (2013).
- Rada, C., Pierce, S., Grotegut, C., England, S. Intrauterine Telemetry to Measure Mouse Contractile Pressure In vivo. Journal of Visualized Experiments. (98), e52541 (2015).
- Lumsden, M. A., Baird, D. T. Intra-uterine pressure in dysmenorrhea. Acta Obstectricia at Gynecologica Scandinavica. 64 (2), 183-186 (1985).
- Milsom, I., Andersch, B., Sundell, G. The Effect of Flurbiprofen and Naproxen Sodium On Intra-Uterine Pressure and Menstrual Pain in Patients With Primary Dysmennorrhea. Acta Obstetricia et Gynecologica Scandinavica. 67 (8), 711-716 (1988).
- Park, K., et al. Vasculogenic female sexual dysfunction: the hemodynamic basis for vaginal engorgement insufficiency and clitoral erectile insufficiency. International Journal of Impotence Journal. 9 (1), 27-37 (1997).
- Bulletti, C., et al. Uterine Contractility During Menstrual Cycle. Human Reproduction. 15, 81-89 (2000).
- Kim, N. N., et al. Effects of Ovariectomy and Steroid Hormones on Vaginal Smooth Muscle Contractility. International Journal of Impotence Research. 16, 43-50 (2004).
- Giraldi, A., et al. Morphological and Functional Characterization of a Rat Vaginal Smooth Muscle Sphincter. International Journal of Impotence Research. 14, 271-282 (2002).
- Gleason, R., Gray, S. P., Wilson, E., Humphrey, J. A Multiaxial Computer-Controlled Organ Culture and Biomechanical Device for Mouse Carotid Arteries. Journal of Biomechanical Engineering. 126 (6), 787-795 (2005).
- Swartz, M., Tscumperlin, D., Kamm, R., Drazen, J. Mechanical Stress is Communicated Between Different Cell Types to Elicit Matrix Remodeling. Proceedings of the National Academy of Sciences of the United States of America. 98 (11), 6180-6185 (2001).
- Rachev, A. Remodeling of Arteries in Response to Changes in their Mechanical Environment. Biomechanics of Soft Tissue in Cardiovascular Systems. 441, 221-271 (2003).
- Lee, E. J., Holmes, J., Costa, K. Remodeling of Engineered Tissue Anisotropy in Response to Altered Loading Conditions. Annals of Biomedical Engineering. 36 (8), 1322-1334 (2008).
- Akintunde, A., et al. Effects of Elastase Digestion on the Murine Vaginal Wall Biaxial Mechanical Response. Journal of Biomechanical Engineering. 141 (2), 021011 (2018).
- Griffin, M., Premakumar, Y., Seifalian, A., Butler, P., Szarko, M. Biomechanical Characterization of Human Soft Tissues Using Indentation and Tensile Testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Myers, K., Socrate, S., Paskaleva, A., House, M. A Study of the Anisotripy and Tension/Compression Behavior of Human Cervical Tissue. Journal of Biomechanical Engineering. 132 (2), 021003 (2010).
- Murtada, S., Ferruzzi, J., Yanagisawa, H., Humphrey, J. Reduced Biaxial Contractility in the Descending Thoracic Aorta of Fibulin-5 Deficent Mice. Journal of Biomechanical Engineering. 138 (5), 051008 (2016).
- Berkley, K., McAllister, S., Accius, B., Winnard, K. Endometriosis-induced vaginal hyperalgesia in the rat: effect of estropause, ovariectomy, and estradiol replacement. Pain. 132, s150-s159 (2007).
- van der Walt, I., Bø, K., Hanekom, S., Rienhardt, G. Ethnic Differences in pelvic floor muscle strength and endurance in South African women. International Urogynecology Journal. 25 (6), 799-805 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。