Method Article
تحليل وظيفة الخلية الفضائية أثناء تجديد العضلات الهيكلية عن طريق إصابة السموم القلبية وحقن siRNA ذاتية التسليم في فيفو
In This Article
Summary
نحن نصف طريقة في الجسم الحي للتحقيق في فقدان وظيفي لجين معين في الخلايا الساتلية باستخدام مزيج من إصابة القلب بوساطة من العضلات الهيكلية وحقن siRNA ذاتية التسليم.
Abstract
العضلات الهيكلية تمتلك قدرة هائلة على تجديد بعد الإصابة. والدافع الرئيسي لهذه العملية من الخلايا الجذعية العضلات، وتسمى أيضا الخلايا الساتلية. وتتميز الخلايا الساتلية بالتعبير عن عامل النسخ Pax7 وموقعها تحت اللامينا القاعدية في العضلات الهيكلية يستريح. عند الإصابة، يتم تنشيط الخلايا الساتلية، والخضوع للتجديد الذاتي أو التمايز إما لتشكيل myofibers جديدة أو لصهر مع تلك التالفة. يمكن التحقيق في وظائف الخلايا الساتلية في الجسم الحي باستخدام نموذج إصابة القلب والسم القائم على العضلات الهيكلية. لدراسة وظيفة جين واحد أثناء تجديد العضلات الهيكلية، وتستخدم في الغالب نماذج الماوس المعدلة وراثيا. هنا، نقدم طريقة بديلة للفئران المعدلة وراثيا، للتحقيق في وظيفة الجينات في الخلايا الساتلية أثناء التجدد، على سبيل المثال، في الحالات التي لا تتوفر فيها الفئران المعدلة وراثيا. نحن الجمع بين إصابة القلب بوساطة من العضلات الهيكلية محددة مع حقن siRNA ذاتية التسليم في العضلات المجددة التي يتم تناولها بعد ذلك من قبل الخلايا الساتلية بين الخلايا الأخرى. وبالتالي، نحن نقدم طريقة لتحليل وظيفة الجينات في الخلايا الساتلية أثناء التجدد في ظل الظروف الفسيولوجية دون الحاجة إلى الفئران المعدلة وراثيا.
Introduction
العضلات الهيكلية هي أكبر أنسجة الجسم التي تمثل ما يقرب من 40٪ من إجمالي وزن الجسم تمكين الحركة الطوعية. تتكون بنية الأنسجة من العضلات الهيكلية أساسا من ما بعد الأنسجة، المتمايزة بشكل نهائي، myofibers multinucleated، فضلا عن مختلف الخلايا الأخرى من الجهاز العصبي المحيطي، ونظام الأوعية الدموية، والخلايا الخلالية1. الأهم من ذلك، العضلات الهيكلية لديها قدرة هائلة على تجديد واستعادة وظيفة عند الإصابة أو الضرر2. هذه العملية تعتمد على الخلايا الجذعية العضلات المقيمة في الأنسجة وتسمى أيضا الخلايا الساتلية3،4. وتقع الخلايا الساتلية بين myofiber واللامينا القاعدية وتتميز بالتعبير عن عامل النسخ Pax75و6و7. في ظل الظروف المثلية ، تكون الخلايا الساتلية هادئة ولكن يتم تفعيلها بسبب الإصابة الصادمة ، على سبيل المثال ، من خلال ممارسة غريب الأطوار أو تجريبيا من خلال حقن سم الأفعى والسم القلبي6،8. بمجرد تفعيلها، وPax7 خلايا الأقمار الصناعية الإيجابية تشارك في التعبير عن MyoD وMyf5، الذي يلزم الخلايا الجذعية إلى التمايز myogenic. وستحتفظ الخلايا الساتلية التي تقاوم رفع تنظيم عوامل الالتزام بإمكاناتها الجذعية وتعود إلى الارتجاف لتجديد مجمع الخلايا الجذعية لتلبية الطلبات في المستقبل. بعد توسيع تجمع الذرية المسببة للسرطان، يتم تنشيط الشبكات النسخية من قبل عوامل التمايز مثل Myogenin لبدء خروج دورة الخلية والتمايز النهائي. هذه myoprogenitors ثم الصمامات إلى بعضها البعض أو إلى myofibers القائمة المساهمة myonuclei للحفاظ على حجم المجال النووي الماينوالنووي. ال [موفيبرس] عبّر عن انتهائيّة عضلة تمايز مورثات مثل [موسين] سلسلة ثقيلة. وأخيرا، myofibers شكلت حديثا تنمو وناضجة لبناء وحدات وظيفية من العضلات الهيكلية9،10.
تجديد العضلات الهيكلية يمكن أن تتأثر بظروف مختلفة بما في ذلك أمراض العضلات أو الشيخوخة11،12، بدءا من العاهات خفيفة لظروف تهدد الحياة ، على سبيل المثال ، في ضمور العضلات دوشين13 , 14.ولذلك، يهدف الطب التجديدي إلى استعادة أنسجة العضلات الهيكلية التالفة أو المعطلة باستخدام قوتها التجديدية المتأصلة من خلال استهداف وظيفة الخلية الساتلية15،16. ولاستخدام إمكاناتها الكاملة، يلزم فهم شامل للخلايا الساتلية في مكانتها الذاتية أثناء تجديد العضلات الهيكلية. وعلى الرغم من وجود نُهُج تجريبية لعزل الخلايا الساتلية المجاورة لـ myofibers17،فإن التعقيد الكامل للتفاعلات الخلوية والنظامية للخلايا الساتلية مع بيئتها لا يمكن تلخيصه إلا في الجسم الحي. في هذا الصدد، تم الحصول على معرفة كبيرة حول تجديد العضلات والهيكل العظمي باستخدام نماذج إصابة الماوس2،18.
هنا نقدم نموذج إصابة الماوس التجريبية محددة لدراسة الخلايا الجذعية بوساطة تجديد الأضرار الناجمة عن السموم القلبية من العضلات الأمامية tibialis في الجسم الحي. يتم حقن السموم القلبية، وهي مادة سامة مقوسة مشتقة من الأفعى تسبب إزالة الاستقطاب والنخر في عضلة الساقية الأمامية، والتي بدورها سوف تؤدي إلى انحطاط الأنسجة متبوعاً بالتجدد. لتحليل وظيفة الجينات أثناء التجدد الحاد، يتم حقن siRNAs ذاتية التسليم في اليوم 3 بعد الإصابة، في ذروة توسع الخلايا الساتلية. يتم التضحية الحيوانات التجريبية في نقاط زمنية مختلفة ويتم جمع العضلات الأمامية tibialis. يتم تجميد العضلات تشريح ومعالجتها لمزيد من التبريد. ثم يتم استخدام الفحص المجهري المناعي لتحليل علامات التجديد. تسمح هذه الطريقة للتحقيق في وظيفة جين واحد أثناء تجديد الخلايا الفضائية مدفوعة من العضلات الهيكلية باستخدام الفئران من النوع البري.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل إدارة رعاية الحيوان في Thüringer Landesamt für Lebensmittelsicherheit und Verbraucherschutz (03-048/16; TLV; باد لانغينسالزا، ألمانيا).
1. إصابة العضلات الناجمة عن السموم القلبية
ملاحظة: إجراء جميع التجارب التي تشمل الفئران الحية وفقا للقانون الوطني لرعاية الحيوان وفي ظل ظروف مطهرة مناسبة. كما يجب أن يتم التضحية بالحيوانات وفقاً للقانون الوطني لرعاية الحيوان.
- تطهير مربع الاستنشاق المستخدمة للتخدير الاستنشاق ومنطقة الجراحة مع الإيثانول 70٪. ضع قطعة قماش جراحية معقمة على لوحة التدفئة حيث ستجري الجراحة.
- تشغيل وسادة التدفئة في 37 درجة مئوية.
- إعطاء المسكنات (على سبيل المثال، 1 ملغ / كغ من وزن الجسم ميلوكسيكام تحت الجلد) 15 دقيقة قبل بدء الجراحة.
ملاحظة: لتجربة نموذجية، واستخدام الفئران التي لا تقل عن 6 أسابيع من العمر، والجنس المتطابقة وفي حالة بدنية عامة جيدة. - إعداد محلول السموم القلبية (20 درجة مئوية في 0.9٪ حمض الهيدروكلوريك)، تخزين الحل في -20 درجة مئوية.
- السماح للحل التوكسين القلب للوصول إلى درجة حرارة الغرفة (RT).
- نقل الماوس إلى مربع الاستنشاق والحث على التخدير مع isoflurane (بدء 3.5 - 5٪ في الأكسجين النقي). تحقق من عمق التخدير مع عدم الاستجابة لقرصة اصبع القدم.
- ضع الماوس على منشفة ورقية نظيفة وحافظ على التخدير مع قناع الأنف (1.5 - 3٪ isoflurane في الأكسجين النقي). اخفض منطقة حقن الساق السفلية القحفية (من الركبة إلى الكفة، الشكل 1A). إزالة جميع الشعر فضفاضة المفرطة.
ملاحظة: الفصل المادي في منطقة الحلاقة والحقن في الغرفة سيوفر المزيد من الظروف المعقمة للحقن. - ضع الفأر في وضع التحريك الجانبي على لوحة التدفئة المغطاة بقطعة قماش جراحية معقمة وحافظ على التخدير مع قناع الأنف (1.5 - 3٪ isoflurane في الأكسجين النقي).
- تطهير منطقة حقن الساق السفلية القحفية (من الركبة إلى مخلب) مع الإيثانول 70٪.
- إجراء قرصة اصبع القدم قبل البدء في الحقن العضلي لضمان عمق كاف من التخدير.
- حقن 50 ميكرولتر من توكسين القلب (20 ميكرومتر في 0.9٪ حمض الكل) في العضلات الأمامية الساقية باستخدام حقنة الأنسولين مع إبرة قياس 29. أولا، ثقب الجلد فقط القاصية من الركبة.
- أدخل الإبرة بالكامل في العضلات (في اتجاه myofiber / موازية لعظم الساق) وحقن السموم القلبية ببطء (10-20 ق) على طول كامل للعضلة في حين تتحرك الإبرة ذهابا وإيابا للسماح بتوزيع حتى من السموم القلبية وبالتالي إصابة كامل عضلة الساقية الأمامية(الشكل 1B, C).
ملاحظة: إصابة العضلات الأمامية tibialis من ساق واحدة فقط، يمكن أن تكون العضلات الأمامية tibialis contralateral كسيطرة داخلية لتحديد أن العضلات الهيكلية لم تتأثر بشكل مرضي قبل إصابة السموم القلبية. - نقل الماوس مرة أخرى إلى قفصها وضعت على وسادة التدفئة ومراقبة عملية الانتعاش حتى الحيوان واعية ويصبح المتنقلة.
ملاحظة: الفئران سوف تظهر فقط يعرج طفيف. إذا كانت الفئران يعرج بشدة ولا تضع الوزن على الساق على الإطلاق، التضحية الماوس. - إعطاء المسكنات خلال اليومين التاليين (على سبيل المثال، 1 ملغ / كغ من وزن الجسم ميلوكسيكام تحت الجلد، كل 24 ساعة) ورصدها على أساس أسبوعي.
2. حقن سيرنا ذاتية التسليم في العضلات الأمامية تيبياليس مجددة (في اليوم 3 بعد إصابة القلب)
- إعداد حل siRNA عن طريق إعادة تعليق siRNA (على سبيل المثال، siRNA تجمع الذكية) في 0.9٪ NaCl (التركيز النهائي من 2 ميكروغرام / ميكرولتر) وفقا لتعليمات الشركة المصنعة.
ملاحظة: يتم تعديل siRNA كيميائيا لتسهيل التناول السلبي من قبل الخلايا وحمايتها من تدهور النوكل. ولا حاجة إلى الكواشف المتحولة، مما يقلل من السمية. استخدام تجمع الذكية من أربعة تسلسل siRNA مستقلة تستهدف نفس الجينات يزيد من كفاءة الضربة القاضية. - تخزين siRNA في -20 درجة مئوية ونقله على الجليد إلى غرفة الجراحة.
- تطهير مربع الاستنشاق المستخدمة للتخدير الاستنشاق ومنطقة الجراحة مع الإيثانول 70٪. ضع قطعة قماش جراحية معقمة على لوحة التدفئة حيث ستجري الجراحة.
- تشغيل وسادة التدفئة في 37 درجة مئوية.
- نقل الماوس إلى مربع الاستنشاق والحث على التخدير مع isoflurane (بدء 3.5 - 5٪ في الأكسجين النقي). تحقق من عمق التخدير مع عدم الاستجابة لقرصة اصبع القدم.
- ضع الفأر في وضع التحريك الجانبي على لوحة التدفئة المغطاة بقطعة قماش جراحية معقمة وحافظ على التخدير مع قناع الأنف (1.5 - 3٪ isoflurane في الأكسجين النقي).
- تطهير منطقة الحقن في الساق السفلية القحفية (من الركبة إلى مخلب).
- إجراء قرصة اصبع القدم قبل البدء في الحقن العضلي لضمان عمق كاف من التخدير.
- حقن ما يصل إلى 50 ميكرولتر siRNA الحل (ما يصل إلى 100 ميكروغرام المجموع في 0.9٪ حمض الكلس؛ موجهة ضد الجين المستهدف؛ استخدام siRNA سارعت كسيطرة) في العضلات الأمامية tibialis المصابة باستخدام حقنة الأنسولين مع إبرة 29 G. أولا، ثقب الجلد فقط القاصي للركبة، ثم إدراج الإبرة في العضلات الأمامية tibialis.
- أدخل الإبرة بالكامل في العضلات (في اتجاه myofiber / موازية لعظم الساق) وحقن حل siRNA ببطء (10 - 20 ق) على طول كامل للعضلة في حين تتحرك الإبرة ذهابا وإيابا للسماح بتوزيع حتى من siRNA على طول كامل عضلة الساقية الأمامية.
- نقل الماوس مرة أخرى إلى قفصها وضعت على وسادة التدفئة ومراقبة عملية الانتعاش حتى الحيوان واعية ويصبح المتنقلة.
ملاحظة: التسكين ليس بالضرورة بعد حقن siRNA.
3. تشريح العضلات الأمامية تيبياليس
- إعداد حل التجميد (2 أجزاء مجمع أكتوبر و 1 جزء 30٪ السكروز في الماء منزوع الأيونات) على الأقل 12 ساعة قبل الاستخدام لتجنب فقاعات الهواء.
- إعداد قوالب التجميد عن طريق التفاف رقائق الألومنيوم حول قلم رصاص وختم ه مع الشريط. من المهم أن الجزء السفلي من القالب يوفر سطح امن، مغلقة.
ملاحظة: قوالب التجميد أصغر تسمح تجميد أسرع من العضلات تجنب تجميد القطع الأثرية. - التضحية الماوس، على سبيل المثال، عن طريق استنشاق CO2، في نقطة زمنية كل من التجديد ورذاذ الماوس كله وأدوات تشريح مع الإيثانول 70٪.
ملاحظة: يمكن تطبيق خلع عنق الرحم، بالإضافة إلى ذلك، لتجنب النزيف المفرط في الساق عند عزل عضلة الساق ية الأمامية. - إزالة الفراء والجلد من الطرف الخلفي المصاب عن طريق قطع الجلد في الكاحل مع مقص حاد غرامة اضافية (حافة القطع: 13 ملم) وسحب ما يصل الجلد نحو الركبة باستخدام ملقط.
- لفضح الوتر الأمامي للعظم في الكاحل، اسحب الجلد المتبقي نحو القدم أو قطع بمقص حاد.
ملاحظة: يمكن تثبيت الماوس على لوحة دعم للسماح بتثبيت أفضل. - قبل حصاد عضلة الساقية الأمامية، قم بإزالة اللفافة باستخدام ملقط ناعم (Dumont 5 أو 7، مستقيم أو منحني). قرصة ملقط مغلقة من خلال اللفافة بجوار عظم الساق في الكاحل من الساق المصابة(الشكل 2A). تحريك الملقط نحو الركبة وبالتالي تمزيق اللفافة وتعريض العضلات الأمامية الساقية الساقية(الشكل 2B).
- لعزل عضلة الساقية الأمامية، قم بفضح الوتر القاصي والاستيلاء عليه بملقط ناعم (Dumont 7، منحني). قطع الوتر باستخدام مقص الربيع (حافة القطع: 5 ملم، قطر الطرف: 0.35 ملم) وسحب العضلات (عقد في الوتر) نحو الركبة.
- لحصاد عضلة الساقية الأمامية، قطعها أقرب ما يمكن إلى الركبة باستخدام مقص حاد.
- قبل التجميد، قطع عضلة الساقية الأمامية في منطقة البطن الوسطى من العضلات مع مقص مستقيم إلى نصفين من حجم متساو للسماح بتحليل منطقة البطن الوسطى(الشكل 2C، D).
- ملء قالب التجميد في منتصف الطريق مع حل التجميد.
- إدراج النصفين من العضلات الأمامية tibialis في قالب التجميد مع منطقة البطن الوسطى التي تواجه الجزء السفلي من القالب(الشكل 2E). تأكد من إدخال النصفين الأماميين في وضع مستقيم يميل ضد جدار قالب التجميد لتجنب البقشيش من العضلات.
ملاحظة: الحل أكثر تجميد هو في القالب، وأطول سوف يستغرق التجميد، وبالتالي زيادة خطر التحف المبردة. - عقد قالب التجميد باستخدام ملقط ونقله في منتصف الطريق إلى النيتروجين السائل(الشكل 2F). تأكد من عدم دخول النيتروجين السائل في قالب التجميد أثناء عملية التجميد.
- مراقبة عملية التجميد، والمجمدة المتوسطة يتغير اللون من شفاف إلى أبيض ويصبح صلبا. الغاطسة العفن تجميد في النيتروجين السائل لبضع ثوان ونقل العفن تجميد إلى -80 درجة مئوية الفريزر أو لتجفيف الجليد للمعالجة في المستقبل.
- تخزين العضلات المجمدة في قوالب التجميد في -80 درجة مئوية حتى مزيد من الاستخدام.
ملاحظة: قوالب التجميد تناسب بشكل جيد في لوحات 24 جيدا أو 1.5 مل أنابيب رد فعل السماح وضع العلامات والتخزين المنظم. - التعامل مع العضلات في قوالب التجميد لمزيد من الاستخدام دائما على الجليد الجاف.
4. الاستئصال بالتبريد من العضلات الأمامية التيبيالا
- قبل البدء في القسم، تعيين درجة حرارة الغرفة من cryostat إلى -21 درجة مئوية، ودرجة حرارة الكائن إلى -20 درجة مئوية وسمك القطع إلى 10، 12 أو 14 درجة مئوية (اعتمادا على التطبيقات المستقبلية)(الشكل 3A).
- نقل عينة العضلات في قالب التجميد في cryostat والسماح لها التكيف مع درجة الحرارة لعدة دقائق. خلال هذا الوقت، تسمية الشرائح المجهر.
- إزالة احباط حول العضلات جزءا لا يتجزأ من استخدام ملقط المبردة مسبقا داخل cryostat. تجنب لمس العينة كما cryomedium يبدأ في ذوبان بسهولة.
- جبل العينة مع منطقة البطن الوسطى من العضلات الأمامية tibialis الموجهة صعودا على حامل عينة معدنية من cryostat باستخدام cryomedium. وهذا يضمن أن موقع قطع العضلات (الجزء السفلي من القالب) يواجه المجرب.
- أدخل حامل العينة مع العينة المثبتة في آلية القسم.
ملاحظة: لضمان تقسيم العينة بشكل صحيح، استخدم شفرة جديدة قبل البدء. - أولا، تقليم كتلة عينة (30 درجة مئوية) للحصول على طائرة حتى تقسيم والوصول إلى المنطقة المعنية من العضلات(الشكل 3B).
- بعد التشذيب، وقطع أقسام متتالية من سمك كل منهما (على سبيل المثال، 14 درجة مئوية).
- جمع المقاطع على الشرائح الزجاج المجهر عن طريق عقد وجه الشريحة إلى أسفل على القسم. يتم إرفاق القسم إلى الشريحة(الشكل 3C).
- تخزين أقسام في -80 درجة مئوية أو -20 درجة مئوية حتى مزيد من الاستخدام أو الاستخدام مباشرة للمناعة أو الكيمياء المناعية.
5. تلطيخ المناعة لعلامات التجديد
- تنفيذ جميع الخطوات الأخرى في غرفة رطبة.
- باختصار، معادلة المقاطع في درجة حرارة الغرفة.
- إصلاح المقاطع مع 1 مل من 2٪ PFA (في PBS، pH 7.4) لكل شريحة لمدة 5 دقائق في RT.
- إزالة محلول PFA 2٪ عن طريق صب في حاوية النفايات المعنية.
- اغسل 3 مرات مع 1 مل من PBS (pH 7.4) لمدة 5 دقائق في RT.
- إزالة PBS عن طريق صب في حاوية النفايات.
- لكل شريحة، إضافة 1 مل من حل نفاذيبيليت (0.1٪ تريتون X-100، 0.1 م غليسين في PBS درجة الحموضة 7.4) لمدة 10 دقائق.
- إزالة حل نفاذية عن طريق صب في حاوية النفايات.
- إضافة 150 درجة مئوية من محلول الحظر (M.O.M. 1:40 في PBS p PH 7.4) لكل شريحة وتغطية مع غطاء. حضانة لمدة ساعة واحدة في RT.
- إزالة غطاء ومحلول حظر، وتطبيق 100 درجة مئوية من محلول الأجسام المضادة الأولية [PAX7، DSHB، الماوس IgG1، غير مخفف أو devMHC، DSHB، غير مخفف، الماوس IgG1and لامينين (أرنب، 1:100)] لكل شريحة. يُغطّى بغطاء. حضانة O/N (بين عشية وضحاها) عند 4 درجة مئوية.
ملاحظة: قم بإجراء تلطيخ عنصر تحكم عن طريق حذف الأجسام المضادة الأساسية، واحتضان القسم مع حل حظر بدلاً من ذلك. - اغسل 3 مرات مع 1 مل من PBS (pH 7.4) لمدة 5 دقائق في RT.
- إزالة PBS عن طريق صب في حاوية النفايات.
- إضافة 100 درجة مئوية من محلول الأجسام المضادة الثانوية (اليكسا فلور 546 الماعز المضادة للماوس IgG1 واليكسا فلور 488 حمار المضادة للأرنب IgG في حل حجب، 1: 1000) لكل شريحة وتغطية مع غطاء. حضانة لمدة ساعة واحدة في RT.
- احتضان الشرائح في الظلام، على سبيل المثال، استخدام رقائق الألومنيوم لتغطية أو استخدام غرفة سوداء رطبة.
ملاحظة: من الآن فصاعدا ينبغي تنفيذ جميع الخطوات في ظروف ضوء أقل لأن بعض الأجسام المضادة الثانوية حساسة للضوء. - إزالة غطاء ومحلول الأجسام المضادة الثانوية.
- اغسل 3 مرات مع 1 مل من PBS (pH 7.4) لمدة 5 دقائق في RT.
- إزالة PBS عن طريق صب في حاوية النفايات.
- أداء DAPI تلطيخ عن طريق إضافة 1 مل من الحل لكل شريحة إلى تركيز نهائي من 10 ميكروغرام / مل لمدة 5 دقائق في RT.
- إزالة الحل تلطيخ DAPI عن طريق صب في حاوية النفايات.
- اغسل 3 مرات مع 1 مل PBS (pH 7.4) لمدة 5 دقائق في RT.
- إزالة تماما PBS المستخدمة لغسل.
- تطبيق 2 - 3 قطرات من متوسط تصاعد مائي وتغطية مباشرة الشريحة مع غطاء جديد.
- دع الشرائح تجف لمدة ساعة واحدة في RT في الظلام.
- تخزين المقاطع الملونة في 4 درجة مئوية في الظلام حتى مزيد من التحليل باستخدام المجهر الفلورية.
6. هيماتوكسيلين وإيوسين تلطيخ
- تنفيذ جميع الخطوات الأخرى في غرفة رطبة.
- إصلاح المقاطع مع 1 مل من 2٪ PFA (في PBS، pH 7.4) لكل شريحة لمدة 5 دقائق في RT.
- إزالة محلول PFA 2٪ عن طريق صب في حاوية النفايات المعنية.
- نقل الشرائح إلى جرة كوبلين.
- شطف بلطف الشرائح مع مياه الصنبور.
ملاحظة: لا تتحول على صنبور عالية جدا لأن ذلك قد يضر الأقسام. - نقل الشرائح إلى غرفة رطبة. إزالة السائل.
- تطبيق 1 مل من محلول تلطيخ هيماتوإكسلين (جيل رقم 3) لمدة 2 دقيقة.
- نقل الشرائح إلى جرة كوبلين.
- شطف بلطف الشرائح مع مياه الصنبور حتى النواة تتحول إلى اللون الأزرق.
ملاحظة: لا تقم بتشغيل صنبور عالية جدا لأن ذلك قد يضر الأقسام الخاصة بك. - نقل الشرائح إلى غرفة رطبة. إزالة السائل.
- تطبيق 1 مل من محلول Eosin Y وحضانة لمدة 2 دقيقة.
- نقل الشرائح إلى جرة كوبلين.
- شطف بلطف الشرائح مع مياه الصنبور حتى مياه الصنبور الخروج من الشرائح واضحة.
- إزالة جميع السائل والسماح للشرائح الجافة لمدة 2 دقيقة.
- جبل في تصاعد المتوسطة مناسبة لالكيمياء المناعية.
النتائج
يتم عرض نتيجة نموذجية من الهيماتوكسيلين ويوسين (H & E) تلطيخ العضلات الأمامية tibialis قبل وبعد إصابة بوساطة القلب في الشكل 4A، B. في عضلات التحكم ، فإن بنية العضلات سليمة كما يتضح من توطين النوى في محيط myofibers وعدم تراكم الخلايا mononucleated في الفضاء الخلالي (الشكل 4A). بعد 7 أيام من إصابة القلب بوساطة يتم تشكيل myofibers جديدة تتميز النوى الموجودة مركزيا(الشكل 4B). وعلاوة على ذلك، يمكن ملاحظة تراكم الخلايا mononucleated، تتكون في الغالب من الخلايا الساتلية ولكن أيضا الخلايا غير المسببة للسرطان مثل الخلايا المناعية. يجب أن تجرح العضلات بأكملها تتميز بالموقع المركزي لجميع myonuclei وتراكم الخلايا mononucleated على قسم العضلات كله.
لتوصيف تطور ونجاح عملية التجديد، يمكن تنفيذ العديد من تلطيخ الفلورسنت المناعي باستخدام علامات التجديد. ويمكن تقييم عدد الخلايا الساتلية عن طريق تلطيخ Pax7، العلامة الكنسية للخلايا الساتلية(الشكل 4C,D). بعد ثلاثة أيام من الإصابة يزيد عدد الخلايا الساتلية(الشكل 4D)،لا توجد الخلايا الساتلية تحت اللامينا القاعدية بعد الآن. لمزيد من تحليل عملية التجديد، يمكن أن تكون ملطخة myofibers شكلت حديثا مع الأجسام المضادة الموجهة إلى myosin التنمية(الشكل 4E). myofibers شكلت حديثا عرض النوى في موقع مركزي وتعبير قوي من myosin التنموية. كما myofibers ناضجة، والتعبير عن myosin التنموية يقلل، يزيد قطر myofiber في حين أن النوى تهاجر إلى محيط myofibers.
ويمكن التحقيق في تأثير جين واحد على عملية التجديد باستخدام الفئران المعدلة وراثيا أو كما هو مبين هنا عن طريق حقن سيرنا ذاتية التسليم. تم حقن سيرنا الذاتي تسليم الفلورسنت في العضلات الأمامية تيبيالاليس تجديد في اليوم 3 بعد الإصابة، نقطة زمنية عندما يبلغ انتشار الخلايا الساتلية ذروتها. بعد يومين من حقن خلايا الأقمار الصناعية siRNA تم تحليلها لوجود siRNA المسمى الفلورسنت(الشكل 4F). قمنا بتحليل عدد خلايا الأقمار الصناعية التي تناولت siRNA المسمى بفلورسنت بعد يومين من الحقن في العضلات المجددة(الشكل 5). حوالي 75٪ من جميع الخلايا الساتلية في العضلات المجددة كانت إيجابية لsiRNA المسمى الفلورسنت. وعلاوة على ذلك، قررنا أن حوالي 74٪ من جميع myofibers تجديد كانت إيجابية لsiRNA المسمى الفلورسنت مما يشير إلى أن إما 74٪ من myofibers تجديد قد اتخذت siRNA أو أن الخلايا الساتلية siRNA إيجابية إما قد انصهرت مع بعضها البعض لتشكيل myofibers جديدة أو أن الانصهار مع وجود بالفعل تجديد myofibers وقعت(الشكل 5). وهذا يشير إلى أن الخلايا الساتلية تأخذ سيرنا ذاتية التسليم وأن السيرنا لا تزال في الخلايا الساتلية لمدة يومين على الأقل.
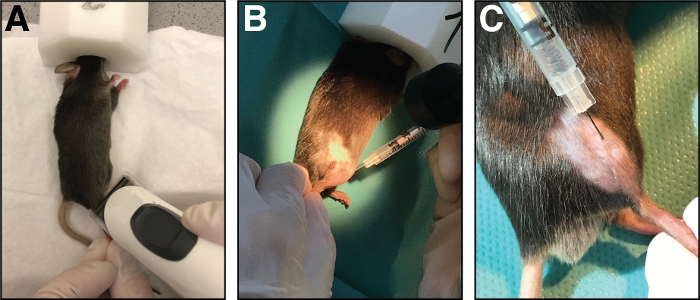
الشكل 1: حقن سم القلب في العضلات الأمامية الساقية. (أ)يتم التخدير الفئران عن طريق استنشاق isoflurane ويتم حلق الطرف السفلي. (ب)يتم حقن إبرة 29 G في العضلات الأمامية الساقية (C)وانتقلت على طول عظم الساق أثناء حقن محلول السموم القلبية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الخطوات التي ينطوي عليها تشريح وتجميد العضلات الأمامية الساقية الساقية المصابة. (أ)يتم الكشف عن عضلات الطرف الخلفي(B)ويتم تمزيق اللفافة المحيطة بالعضلات الأمامية الساقية لتعريض العضلات. (ج)بعد إزالة العضلات، يتم قطعها في منطقة منتصف البطن إلى نصفين من حجم مماثل باستخدام مقص مستقيم حاد(D). (E)يتم تضمين نصفي العضلات تشريح في قالب رقائق الألومنيوم مليئة محلول التجميد والمجمدة في النيتروجين السائل(F). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: المعدات والخطوات التي ينطوي عليها تشريح العضلات الأمامية للعظم. (أ)يتم تعيين درجة حرارة الغرفة من cryostat إلى -21 درجة مئوية. (ب)يتم تركيب العضلات الأمامية في حل التجميد على حامل العينة. (C)يتم إرفاق أقسام من سمك 14 درجة مئوية إلى الشرائح المجهر الزجاج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
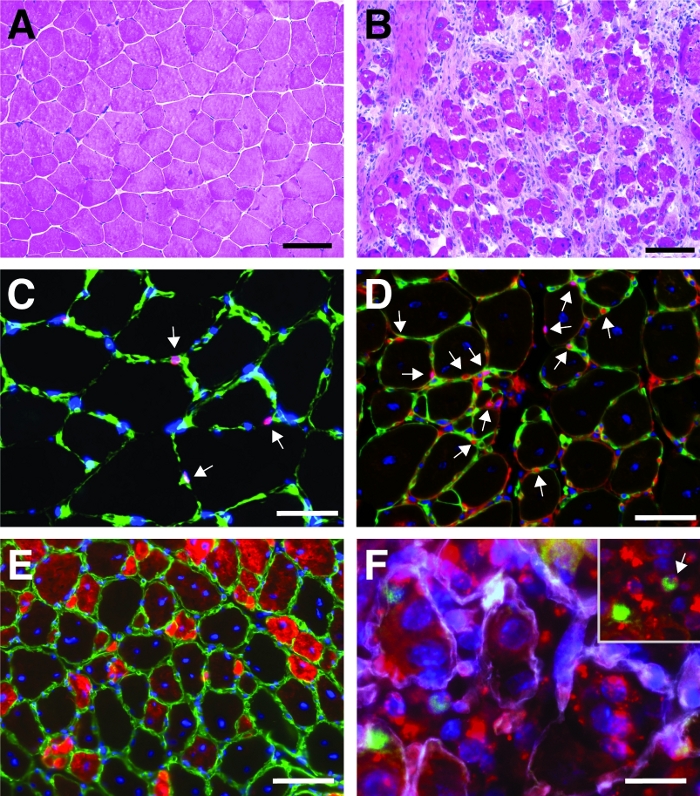
الشكل 4: الصور التمثيلية للعضلات الأمامية التى تجدد العضلة الصدّقة. H & E تلطيخ من عضلات الساقية الأمامية قبل(أ)و 7 أيام بعد إصابة السموم القلبية(B). (C)في العضلات غير المصابة Pax7 إيجابية (باللون الأحمر) تقع الخلايا الساتلية تحت لامينا القاعدية التي تميزها لامينين (باللون الأخضر). النوى ملطخة بـ DAPI (باللون الأزرق). يتم وضع علامة على الخلايا الإيجابية Pax7 بواسطة سهم. (D)بعد 10 أيام من التجديد، وتتميز myofibers من قبل النوى في موقع مركزي (باللون الأزرق)، ويظهر Pax7 باللون الأحمر، لامينين باللون الأخضر. يتم وضع علامة على الخلايا الإيجابية Pax7 بواسطة سهم. (E)myofibers شكلت حديثا التعبير عن النمو myosin (باللون الأحمر)، لامينين باللون الأخضر، والنوى هي مضادة ملطخة DAPI (باللون الأزرق). (F)لا يزال يوجد في الخلايا الساتلية (Pax7 إيجابية، باللون الأخضر، تتميز بسهم في الدخول) بعد يومين من حقن سيرنا ذاتية التسليم في إعادة توليد الساقية الأمامية العضلات (حقن في اليوم 3 بعد إصابة القلب بوساطة). يظهر لامينين باللون الأبيض، والنوى ملطخة DAPI (باللون الأزرق). شريط المقياس = 100 ميكرومتر (A و B)، 50 ميكرومتر (C-E)، 25 ميكرومتر (F). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
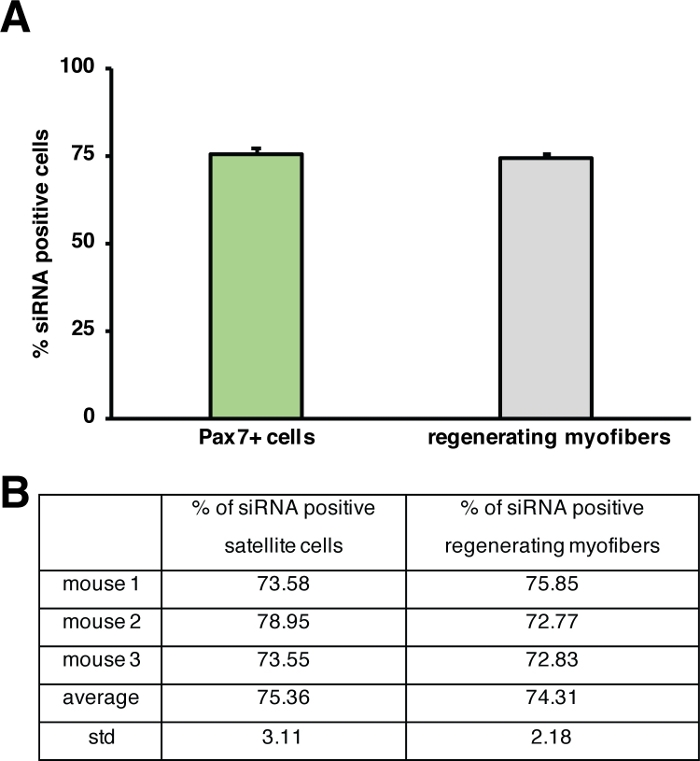
الشكل 5: القياس الكمي لكمية الاستفادة من siRNA المسمى الفلورسنت. (أ)القياس الكمي لكمية من الكمية من قبل الخلايا الساتلية (Pax7 + الخلايا) وتجديد myofibers 2 أيام بعد الحقن في تجديد العضلات الهيكلية. تم إجراء الحقن في اليوم 3 بعد إصابة القلب بوساطة. n = 3، تظهر أشرطة الخطأ SEM.(B)القياس الكمي الكامنوراء الرسم البياني الموضح في (A). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا نقدم طريقة للتحقيق في وظيفة جين معين أثناء تجديد العضلات الهيكلية دون الحاجة إلى الحيوانات المعدلة وراثيا. ويتم ذلك من خلال الجمع بين إصابة العضلات الناجمة عن القلب السم مع حقن siRNA ذاتية التسليم في العضلات الهيكلية المجددة في اليوم 3 بعد الإصابة. لقد وصفنا بالتفصيل إجراءات إصابة العضلات عن طريق السموم القلبية، وحقن siRNA ذاتية التسليم ومعالجة العضلات التي تم حصادها لتحليل تقدم التجديد. نثبت أن حقن سم الأفعى في العضلات الهيكلية يصيب العضلات بأكملها بشكل فعال، وأنه تم العثور على siRNAs ذاتية التسليم في حوالي 75٪ من جميع الخلايا الساتلية من بين أنواع الخلايا الأخرى بعد يومين من حقنها في تجديد العضلات الهيكلية(الشكل 4، الشكل 5).
وينبغي تركيز اهتمام خاص على إصابة متجانسة من العضلات الأمامية tibialis منذ درجات متفاوتة من الإصابة تؤثر على نتيجة التجديد وبالتالي أيضا تأثير siRNA قد تتأثر. وعلاوة على ذلك، من الأهمية بمكان أن يتم حقن منطقة التجديد بأكملها مع سيرنا ذاتية التسليم. لتحليل عملية التجديد، فمن المستحسن أن تقارن دائما مناطق مماثلة من العضلات الهيكلية المجددة، وبالتالي، ينبغي قطع العضلات الأمامية tibialis في النصف لمقارنة دائما منطقة منتصف البطن من العضلات. عند تحليل العضلات، يحتاج استئصال التبريد بأكمله إلى تحليل لأن تكوين myofiber يختلف في العضلات الأمامية tibialis، وبالتالي قد تجدد بشكل مختلف.
وظيفة الخلايا الساتلية يمكن التحقيق فيها من خلال إجراءات تجريبية مختلفة بما في ذلك ثقافتها على myofibers واحدة معزولة المجاورة17، عن طريق زرع وتحليل تجديد العضلات الهيكلية بعد الإصابة المستحثة 18،19. التحقيق في وظيفة الخلايا الساتلية باستخدام نموذج الإصابة المستحثة في الجسم الحي، على سبيل المثال، حقن السموم القلبية، يوفر القدرة على تحليل وظيفة الخلايا الساتلية أيضا من حيث تفاعلها مع أنواع الخلايا الأخرى مثل الضامة و التحقيق في تأثير العوامل النظامية2. يمكن تحقيق إصابة العضلات الهيكلية بوسائل مختلفة، على سبيل المثال، ممارسة غريب الأطوار، وإصابة التجميد، وحقن BaCl2 أو حقن سم الأفعى مثل سم القلب أو notexin18. في حين أن ممارسة غريب الأطوار هو على الارجح طريقة الإصابة الأكثر فسيولوجية، وإصابة عضلة واحدة معينة محدودة فقط20. ويمكن تطبيق إصابات التجميد عندما تكون هجرة الخلايا الساتلية نحو موقع الإصابة هي الهدف من الدراسة أو ينبغي إصابة جزء محدد فقط من العضلات. من الناحية التجريبية العيب من إصابات التجميد هو الجراحة المفتوحة التي تحتاج إلى إجراء لتطبيق التحقيق المعدني المبردة مسبقا. حقن BaCl2 أو سم الأفعى هو الأسلوب الأكثر دراماتيكية للإصابة، وبالتالي تحدي وظيفة الخلية الفضائية أكثر من غيرها. وعلاوة على ذلك، فإن الحقن طفيف التوغل، ووقت الجراحة، بشكل عام، هو أقل من خمس دقائق ولا ينطوي على الخياطة، وما إلى ذلك مما يقلل من خطر العدوى.
وتستخدم إصابة العضلات في الغالب للتحقيق في العواقب الوظيفية لفقدان وظائف الجينات، على سبيل المثال، فقدان Pax77،21. خاصة إذا كانت الفئران الذين تتراوح أعمارهم بين هي محور المسألة العلمية، وتوليد أو استخدام الفئران المعدلة وراثيا في كثير من الأحيان غير ممكن. حقن siRNAs ذاتية الإيصال التي تستهدف جين معين هو بديل قابل للتطبيق في تلك الحالات، وقد استخدمت بنجاح22. وباختصار، أصيب في اليوم الثالث من الإصابة بالعضلات الأمامية للفئران، تم حقن عضلة الساقية الأمامية عن طريق حقن سموم القلب وsiRNAs ذاتية التسليم الموجهة ضد الفيبرونيكتين (FN). تم تحليل العضلات بعد 10 أيام من الإصابة ولوحظ انخفاض كبير في أرقام الخلايا الفضائية في siFN مقابل شروط التحكم siRNA المخفوقة. تم تحديد كفاءة الضربة القاضية في lysates العضلات كلها من قبل PCR الوقت الحقيقي الكمية 2 أيام بعد حقن siRNA، تم تحقيق انخفاض في مستويات التعبير من 58٪ مما يشير إلى أن كفاءة التسليم والضربة القاضية كافية للوظيفية التحليلات22. بدائل لاختبار كفاءة الضربة القاضية هي إما تحليلات المناعة أو الفلورة المناعية مع الأجسام المضادة الموجهة ضد الجين المستهدف. وينبغي تحديد كفاءة وخصوصية الرنا المستخدمة في الحقن في الجسم الحي قبل الحقن في الفئران، على سبيل المثال، عن طريق اختبار الكفاءة في الخلايا الساتلية المعزولة أو الخصائص الأساسية. استخدام تجمع الذكية تتكون من 4 siRNAs مختلفة مقابل siRNA واحد يزيد من كفاءة الضربة القاضية ولكن أيضا يزيد من خطر استهداف غير محدد. وينبغي اختبار خصوصية جميع تسلسلات siRNA المستخدمة في ثقافة الخلايا لتجنب الآثار خارج الهدف. كتحكم, وينبغي استخدام siRNA سارعت غير المستهدفة منذ حقن siRNA في حد ذاته قد تؤثر على عملية التجديد بسبب الحقن، وبالتالي، ضرر إضافي للعضلة. النقطة الزمنية لحقن siRNA يعتمد على السؤال العلمي وعلى ملف التعبير عن الجين المستهدف. وبوجه عام، فإن حقن السيرنا ذاتية التسليم في اليوم الثالث بعد إصابة السموم القلبية يستهدف معظم الجينات الهامة لانتشار الخلايا الساتلية لأن انتشار الخلايا الساتلية يبلغ ذروته في اليوم الثالث بعد الإصابة. يجب ألا تقل النقطة الزمنية لحقن siRNA الأول عن 48 ساعة بعد إصابة توكسين القلب لأن حجم حقن توكسين القلب مرتفع جداً وينبغي أن تتم إعادة امتصاص السائل قبل حقن حلول إضافية في العضلات. بشكل عام, حقن متعددة من siRNAs أو مزيج من siRNAs مختلفة ممكن على الرغم من أن المرء يجب أن تنظر في أن كل حقن في العضلات المجددة يسبب ضررا إضافيا.
أحد قيود الطريقة الموصوفة هو حقيقة أن التأثير الذي لوحظ لا يعتمد بالضرورة على الضربة القاضية للجين المستهدف في الخلايا الساتلية فحسب، بل يمكن أن يعزى إلى أنواع خلايا أخرى مثل الخلايا المناعية أو خلايا السلف الليفية الأديبية. ولذلك، من الضروري الجمع بين تلك التجارب والتجارب التي تحقق في مجموعة نقية من الخلايا الساتلية. يمكن للمرء إما إجراء تجارب باستخدام الثقافات myofiber العائمة، حيث يتم زرع الخلايا الساتلية على myofibers المجاورة لها أو إجراء تجارب زرع باستخدام خلايا الأقمار الصناعية المعزولة17.
بديل لحقن siRNAs ذاتية التسليم هو حقن مثبطات جزيء صغير أو البروتينات المؤتلفة التي يمكن القيام بها، اعتمادا على السؤال العلمي. على سبيل المثال، تم بنجاح حقن فيبرونكتين بروتين مصفوفة خارج الخلية أو مثبطات جزيء صغير من إشارات JAK / STAT في الفئران الذين تتراوح أعمارهم بين15،16. ولا يمكن تحليل وظيفة جينية معينة في نوع معين من الخلايا أثناء تجديد العضلات الهيكلية، على سبيل المثال، في الخلايا الساتلية، إلا من خلال استخدام نموذج فأر وراثي لا يمكن التنفّس. حقن siRNAs ذاتية التسليم، والبروتينات المؤتلفة أو مثبطات جزيء صغير قد تؤثر على أنواع الخلايا متعددة في تجديد العضلات الهيكلية.
Disclosures
ونود أن نشكر كريستينا بيكر وكريستين بوزر على المساعدة التقنية الممتازة وساسكيا شتاينر للمساعدة في تحديد كفاءة التغوط في الأعشاب. نشكر الأنسجة الخدمة الأساسية على الدعم التقني الكبير، وخاصة سابين لاندمان وليندا Rothenburger. ونحن نشكر أيضا الماوس مرفق الحيوان في FLI للحصول على دعم ممتاز. وقد تم دعم هذا العمل بمنح من شركة فورشونججيمينشافت الألمانية (MA-3975/2-1) وشركة Deutsche Krebshilfe (DKH-JvM-861005) إلى J.v.M.
Acknowledgements
ولا يعلن صاحبا البلاغ عن أي مصالح مالية متنافسة.
Materials
| Name | Company | Catalog Number | Comments |
| Isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| Shaver for rodents | isis | GT420 | |
| Cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| Insulin syringe (29 g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| Laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 |
References
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198(2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved