Method Article
カーディオトキシン損傷による骨格筋再生中の衛星細胞機能の解析と生体内での自己送出型siRNAの注射
要約
骨格筋のカルタトキシン媒介損傷と自己送出型siRNAの注射を組み合わせて、衛星細胞における特定の遺伝子の機能的損失を調べるためのインビボ法について述べた。
要約
骨格筋は、怪我の後に再生する巨大な能力を持っています。このプロセスは、主に筋肉幹細胞によって駆動され、衛星細胞とも呼ばれます。衛星細胞は、転写因子Pax7の発現および安静時骨格筋における基底ラミナの下の位置によって特徴付げられる。損傷時に、衛星細胞が活性化し、自己更新または分化を受け、新しい筋線維を形成するか、損傷したものと融合する。生体内の衛星細胞の機能性は、骨格筋のカーディオトキシンベースの傷害モデルを用いて調べることができる。骨格筋の再生中に1つの遺伝子の機能を研究するために、トランスジェニックマウスモデルが主に使用されます。ここで、トランスジェニックマウスに代わる方法を提示し、再生時の衛星細胞における遺伝子機能を調べ、例えば、トランスジェニックマウスが利用できない場合に。特定の骨格筋のカートトキシン媒介損傷と自己送出型siRNAを再生筋に注入し、他の細胞の間で衛星細胞によって取り込まれる。そこで、トランスジェニックマウスを必要とせずに生理的条件下での再生時に衛星細胞の遺伝子機能を解析する方法を提供する。
概要
骨格筋は、体全体の約40%を占む体の最大の組織であり、自発的な移動を可能にします。骨格筋の組織構造は、主に、末端分化、多核化筋線維、ならびに末梢神経系、血管系、および間質細胞1からなる様々な他の細胞から構成される。重要なことに、骨格筋は、怪我や損傷2の際に機能を再生し、復元する膨大な能力を持っています。このプロセスは、サテライトセル3、4とも呼ばれる組織常駐筋幹細胞に依存する。衛星細胞は、筋線維と基底ラミナの間に位置し、転写因子Pax75、6、7の発現によって特徴付けされる。恒静性条件下では、衛星細胞は静止しているが、外傷性損傷のために活性化される、例えば、偏心運動を通じて、またはヘビ毒カーディオトキシン6、8の注射を通じて実験的に。一旦活性化されると、Pax7陽性衛星細胞はMyoDとMyf5を共発現し、幹細胞を筋原分化にコミットする。コミットメント因子のアップレギュレーションに抵抗する衛星細胞は、その幹細胞の可能性を保持し、将来の需要のために幹細胞プールを補充するために静止に戻ります。ミオゲン前駆体プールの拡大後、転写ネットワークはミオゲニンのような分化因子によって活性化され、細胞周期の出口および末端分化を開始する。これらの筋生殖器は、お互いに融合するか、またはミオ核ドメインの大きさを維持するためにミオヌクレイに寄与する既存の筋線維に融合する。筋線維は、ミオシンヘビーチェーンのような末端筋分化遺伝子を発現する。最後に、新たに形成された筋線維は成長し、骨格筋9、10の機能単位を構築するために成熟する。
骨格筋の再生は、軽度の障害から生命を脅かす状態に至るまで、筋肉疾患や老化11、12を含む様々な状態の影響を受ける可能性があります13,したがって、再生医療は、衛星細胞機能15,16を標的とすることにより、本来の再生力を用いて損傷または機能不全の骨格筋組織を回復することを目指す。その可能性を最大限に活用するには、骨格筋の再生中に内因性のニッチで衛星細胞を包括的に理解することが必要です。ミオファイバー17に隣接する衛星細胞を単離する実験的アプローチは存在するが、衛星細胞と環境との細胞と全身的相互作用の完全な複雑さは、生体内でのみ要約することができる。その点で、骨格筋再生に関する大きな知識は、マウス傷害モデル2,18を用いて獲得されている。
ここでは、生体内の脛骨前筋のカーディオトキシン誘発損傷の幹細胞媒介再生を研究する特定の実験的マウス傷害モデルを紹介する。心筋線脱分極と壊死を引き起こすヘビ由来の細胞溶解性毒素であるカーディオトキシンは、脛骨前筋に注入され、その後、組織変性を引き起こし、再生が続く。急性再生時の遺伝子の機能を解析するために、自己送達型siRNAは、人工衛星細胞膨張のピーク時に、損傷後3日目に注入される。実験動物は様々な時点で犠牲になり、脛骨前筋が採取される。解剖された筋肉は凍結され、さらに凍結断面のために処理される。免疫蛍光顕微鏡は、再生のマーカーを分析するために使用されます。この方法は、野生型マウスを用いて人工筋の人工筋肉の人工的な再生中に単一遺伝子の機能を調べた。
プロトコル
すべての動物の手順は、チューリンガーランデサムトフュル・レベンスミッテルヒュアハイト・ウンド・ヴェルブラウチャーシュツ(03-048/16)の動物福祉部によって承認されました。TLV;バート・ランゲンサルツァ(ドイツ)。
1. 心電毒誘発性筋損傷
注:動物福祉法に基づき、適切な無菌条件下で生きたマウスを含むすべての実験を行う。また、動物の犠牲は、動物福祉法に従って行わなければならない。
- 吸入麻酔に使用される吸入ボックスと70%のエタノールで手術領域を消毒します。手術が行われる加熱パッドに滅菌手術布を置きます。
- 37 °Cで加熱パッドをオンにします。
- 鎮痛薬(例えば、1mg/kg体重のメロキシカム皮下)を手術開始の15分前に投与する。
注:典型的な実験では、少なくとも6週齢のマウスを使用し、性別に一致し、良好な一般的な体調で。 - カージアトキシン溶液(0.9%NaClで20μM)を調製し、-20°Cで溶液を保存する。
- カート毒素溶液が室温(RT)に達するようにします。
- 吸入ボックスにマウスを移し、イソファラン(純粋な酸素で開始3.5-5%)で麻酔を誘発する。つま先のピンチに対する応答の欠如と麻酔の深さを確認してください。
- きれいなペーパータオルの上にマウスを置き、鼻マスク(純粋な酸素中の1.5-3%イソファラン)で麻酔を維持します。頭蓋下肢の注射領域を剃る(膝から足まで、図1A)。過度のゆるい髪をすべて取り除きます。
注:物理的に部屋の剃削および注入区域を分離することは注射のためのより無菌条件を提供する。 - 無菌の外科布で覆われた加熱パッドの横方向のリカンベント位置にマウスを置き、鼻マスク(純粋な酸素中の1.5-3%イソファルラン)で麻酔を維持します。
- 70%のエタノールで頭蓋下肢(膝から足まで)の注射領域を消毒する。
- 麻酔の十分な深さを確保するために筋肉内注射を開始する前につま先のピンチを実行します。
- 29ゲージの針を持つインスリン注射器を使用して脛骨前筋に50 μLカーディオトキシン(0.9%NaClで20 μM)を注入します。まず、皮膚を突き刺すだけで膝を遠位にします。
- 筋肉に完全に針を挿入し(筋線維の向き/脛骨骨と平行に)、それによって心臓毒素の均等な分布を可能にするために、筋肉の全長に沿ってゆっくりと(10-20 s)カージアトキシンを注入します。脛骨前筋全体を傷つける(図1B,C)。
注:片方の脚から脛骨前筋を損傷し、反対方線維新前筋は、骨格筋がカーディオトキシン損傷の前に病理学的に影響を受けていなかったことを決定する内部制御として役立つことができる。 - マウスを加熱パッドに置かれたケージに戻し、動物が意識を持って歩行できるようになるまで回復プロセスを監視します。
注:マウスはわずかなひだしか見せない。マウスがひどく引っ張っていて、脚に体重をかけない場合は、マウスを犠牲にしてください。 - 次の2日間(例えば、1mg/kgの体重メロキシカム皮下、24時間ごと)の間に鎮痛薬を投与し、毎週それらを監視します。
2. 再生脛骨前筋への自己送出siRNAの注射(3日目の心電毒損傷後)
- siRNA(例えば、siRNAスマートプール)を0.9%NaCl(最終濃度2μg/μL)で再中断して、siRNA溶液を製造元の指示に従って準備します。
注:siRNAは、細胞による受動的取り込みを容易にし、ヌクレアーゼの分解から保護するために化学的に修飾されます。トランスフェクション試薬は不要で、毒性を低減します。同じ遺伝子を標的とする4つの独立したsiRNA配列のスマートプールを使用すると、ノックダウン効率が向上します。 - siRNAを-20°Cで保存し、氷の上で手術室に移します。
- 吸入麻酔に使用される吸入ボックスと70%のエタノールで手術領域を消毒します。手術が行われる加熱パッドに滅菌手術布を置きます。
- 37 °Cで加熱パッドをオンにします。
- 吸入ボックスにマウスを移し、イソファラン(純粋な酸素の開始3.5-5%)で麻酔を誘発する。つま先のピンチに対する応答の欠如と麻酔の深さを確認してください。
- 無菌の外科布で覆われた加熱パッドの横方向のリカンベント位置にマウスを置き、鼻マスク(純粋な酸素中の1.5-3%イソファルラン)で麻酔を維持します。
- 頭蓋下肢(膝から足まで)の注射領域を消毒する。
- 麻酔の十分な深さを確保するために筋肉内注射を開始する前につま先のピンチを実行します。
- 最大50 μL siRNA溶液(0.9%NaClで合計100μgまで、標的遺伝子に対して向けられ、コントロールとしてスクランブルsiRNAを使用)を29G針でインスリン注射器を使用して負傷した脛骨前筋に注入する。まず、皮膚を膝の遠位に突き刺し、脛骨前筋に針を挿入する。
- 筋筋に完全に針を完全に挿入し(筋繊維の方に完全に挿入し、筋に沿沿を通して、針を前後に沿に沿に沿に挿入します。全身脛骨前筋。
- マウスを加熱パッドに置かれたケージに戻し、動物が意識を持って歩行できるようになるまで回復プロセスを監視します。
注:鎮鎮薬は必ずしもsiRNAの注射に続くものではありません。
3. 脛骨前筋の解剖
- 凍結溶液(2部OCT化合物と1部30%ショ糖を脱イオン水中)を使用前に少なくとも12時間前に準備し、気泡を避けます。
- 鉛筆の周りにアルミ箔を巻いて金型を冷凍し、テープで密封します。金型の底部は均一な閉じた表面を提供することが重要です。
注:より小さい凍結の金型は凍結のアーティファクトを避ける筋肉のより速い凍結を可能にする。 - マウスを犠牲にし、例えば、CO2吸入によって、それぞれの再生の時点で、70%のエタノールでマウス全体および解剖ツールをスプレーする。
注:子宮頸部脱臼は、脛骨前筋を単離する際に脚の過度の出血を避けるために、加えて適用することができる。 - 足首の皮膚を細かく鋭いはさみで切り取り(刃先:13mm)し、鉗子を使って膝に向かって皮膚を引き上げることによって、傷ついた後肢から毛皮と皮膚を取り除きます。
- 足首の脛骨前腱を露出させるには、残りの皮膚を足の方に引っ張るか、鋭いはさみで切ります。
注:マウスをサポートボードにピン留めして、より良い固定を可能にします。 - 脛骨前筋を収穫する前に、細かい鉗子(Dumont 5または7、まっすぐまたは湾曲)を使用して筋膜を取り除く。負傷した脚の足首の脛骨骨の隣の筋膜を通して閉じた鉗子をつまむ(図2A)。鉗子を膝の方に動かして筋膜を裂き、脛骨前筋を露出させる(図2B)。
- 脛骨前筋を分離するには、遠位腱を露出させ、細かい鉗子(Dumont 7、湾曲)でそれをつかむ。スプリングハサミ(刃先:5mm、先端直径:0.35mm)を使用して腱を切り、筋肉を膝に向かって引っ張ります(腱で保持します)。
- 脛骨前筋を収穫するには、鋭いはさみを使ってできるだけ膝に近づける。
- 凍結する前に、筋肉の中腹領域の脛骨前筋をストレートハサミで2つの半分に切断し、中腹領域の分析を可能にする(図2C,D)。
- 冷凍金型を冷凍液で半分に充填します。
- 脛骨前筋の2つの半分を、金型の底に面した中腹領域を持つ凍結型に挿入する(図2E)。脛骨前半分が筋肉の転倒を避けるために凍結型の壁に寄りかかっている直立した位置に挿入されていることを確認してください。
注:金型内の凍結溶液が多いほど、凍結にかかる時間が長くなるため、クライオアーティファクトのリスクが高くなります。 - 鉗子を使用して凍結型を保持し、液体窒素(図2F)の途中で転送します。凍結プロセス中に液体窒素が凍結型に入っていないことを確認してください。
- 凍結プロセスを観察すると、凍結媒体は透明から白に色が変化し、固体になります。液体窒素中の凍結型を数秒間浸し、凍結金型を-80°C冷凍庫またはドライアイスに移して将来の処理を行います。
- 冷凍筋肉を-80°Cの凍結型に保存し、さらに使用してください。
注:凍結金型は24ウェルプレートまたは1.5 mL反応管によくフィットし、ラベリングと組織化された保管を可能にします。 - ドライアイスで常にさらなる使用のために凍結型の筋肉を処理します。
4. 脛骨前筋再生の凍結切除
- 断面を開始する前に、クライオスタットのチャンバー温度を-21 °Cに設定し、物体温度を-20 °Cに、切断厚さを10、12または14μmに設定します(図3A)。
- 凍結カビの筋肉サンプルをクライオスタットに移し、数分間温度に調整させます。この間、顕微鏡スライドにラベルを付けます。
- クライオスタット内の予め冷却された鉗子を使用して、埋め込まれた筋肉の周りのホイルを取り除きます。凍結中が容易に解凍し始めるので、サンプルに触れないようにしてください。
- チビアリス前筋の中腹領域をクライオミディアムを用いてクライオスタットの金属サンプルホルダーに上方に向けてサンプルを取り付ける。これは、筋肉(金型の底部)の切断部位が実験者に直面していることを保証する。
- 取り付けられたサンプルを持つサンプルホルダーを断面機構に挿入します。
注:サンプルの適切な断面を確保するには、開始する前に新しいブレードを使用します。 - まず、サンプルブロック(30μm)をトリムして偶数断面を取得し、筋肉のそれぞれの領域に到達する(図3B)。
- トリミング後、それぞれの厚さの連続した切片(例えば、14μm)を切断する。
- 顕微鏡ガラススライドのセクションを、スライドの面を下に押し付けます。セクションがスライドに取り付けられています (図 3C)。
- さらに使用するか、免疫蛍光または免疫組織化学に直接使用するまで-80 °Cまたは-20 °Cでセクションを保存します。
5. 再生マーカーの免疫染色
- 加湿された部屋のすべてのそれ以上のステップを行う。
- 簡単に言えば、室温でセクションを平衡化します。
- RTで5分間スライドあたり2%PFA(PBS、pH 7.4)の1 mLのセクションを修正します。
- 2%のPFA溶液をそれぞれの廃棄物容器に注いで取り出します。
- RTで5分間PBS(pH 7.4)の1 mLで3回洗浄します。
- 廃棄物容器に注いでPBSを取り除きます。
- スライドごとに、透過性溶液の1 mL(0.1%トリトンX-100、PBS pH 7.4で0.1 Mグリシン)を10分間追加します。
- 浸透液を廃容器に注いで取り除きます。
- ブロッキング溶液の150 μL(PBS pH 7.4のM.O.M.1:40)をスライドごとに追加し、カバースリップでカバーします。RTで1時間インキュベートします。
- カバースリップおよびブロッキング溶液を取り除き、一次抗体溶液[PAX7,DSHB,マウスIgG1、未希釈またはdevMHC,DSHB、希釈されていない、マウスIgG1およびラミニン(ウサギ、1:1,000)]をスライドごとに100μLに塗布する。カバースリップでカバー。4°CでO/N(一晩)をインキュベートします。
注:一次抗体を省略して対照染色を行い、代わりにブロッキング溶液で断面をインキュベートする。 - RTで5分間PBS(pH 7.4)の1 mLで3回洗浄します。
- 廃容器に入れてPBSを取り除きます。
- 二次抗体溶液の100 μL(Alexa Fluor 546ヤギの抗マウスIgG1およびAlexa Fluor 488ロバ抗ウサギIgGをブロッキング溶液に追加し、1:1,000)スライドごとにカバースリップでカバーします。RTで1時間インキュベートします。
- 例えば、暗いところでスライドをインキュベートし、例えば、黒い加湿室を覆うか、または使用するためにアルミニウム箔を使用する。
注:一部の二次抗体は光に敏感であるため、これからはすべてのステップを低光条件で実行する必要があります。 - カバースリップおよび二次抗体溶液を取り外します。
- RTで5分間PBS(pH 7.4)の1 mLで3回洗浄します。
- 廃棄物容器に注いでPBSを取り除きます。
- RTで5分間10μg/mLの最終濃度にスライドあたり1mLの溶液を加えてDAPI染色を行います。
- DAPI染色液を廃容器に注いで取り除きます。
- RTで5分間1 mL PBS(pH 7.4)で3回洗浄します。
- 洗浄に使用するPBSを完全に取り除く。
- 水性取り付け媒体の2 -3滴を適用し、新しいカバースリップでスライドを直接カバーします。
- 暗闇の中でRTで1時間スライドを乾燥させてください。
- 蛍光顕微鏡を用いてさらに分析するまで、染色した切片を暗闇の中で4°Cに保管する。
6. ヘマトキシリンとエオシン染色
- 加湿された部屋のすべてのそれ以上のステップを行う。
- RTで5分間スライドあたり2%PFA(PBS、pH 7.4)の1 mLのセクションを修正します。
- 2%のPFA溶液をそれぞれの廃棄物容器に注いで取り出します。
- スライドをコプリン瓶に移します。
- 水道水でスライドをゆっくりとすすいでください。
注:蛇口を高くしすぎないようにしてください。 - スライドを加湿室に移します。液体を取り除きます。
- ヘマトキシリン染色液(ギル3)を1mLで2分間塗布します。
- スライドをコプリン瓶に移します。
- 核が青色になるまで、水道水でスライドを静かに洗い流します。
注:それはあなたのセクションを損傷する可能性があるため、あまりにも高い蛇口をオンにしないでください。 - スライドを加湿室に移します。液体を取り除きます。
- エオシンY溶液の1 mLを適用し、2分間インキュベートします。
- スライドをコプリン瓶に移します。
- スライドから流れる水道水がはっきりするまで、水道水でスライドを静かに洗い流します。
- すべての液体を取り除き、スライドを2分間乾燥させます。
- 免疫組織化学に適した取付け媒体に取り付ける。
結果
ヘマトキシリンおよびエオシン(H&E)のチビアリス前筋の染色の典型的な結果は、カーディオトキシン媒介損傷の前後に、図4A、Bに提示される。対照筋において、筋筋の構造は、筋線維の周辺における核の局在化および間質空間における単核細胞の蓄積の欠如によって見られるように無傷である(図4A)。心電毒媒介損傷後7日目に新しい筋線維が中央に位置する核によって特徴付けて形成される(図4B)。さらに、人工細胞の蓄積は、主に衛星細胞だけでなく、免疫細胞のような非筋生細胞からなる。全筋肉は、すべてのミオヌクレイの中心的な位置と筋肉セクション全体の単核細胞の蓄積によって特徴づけられる必要があります。
再生プロセスの進行および成功を特徴付けるために、再生のマーカーを用いた複数の免疫蛍光染色を行うことができる。衛星細胞の数は、衛星細胞の正規マーカーであるPax7の染色によって評価することができる(図4C,D)。損傷から3日後に衛星細胞の数が増える(図4D)、衛星細胞はもはや基底ラミナの下に位置していない。再生プロセスをさらに分析するために、新たに形成されたミオファイバーは、発達ミオシンに向けられた抗体で染色することができる(図4E)。新たに形成された筋線維は、中央に位置する核と発達ミオシンの強い発現を示す。筋線維が成熟するにつれて、発達ミオシンの発現が減少し、核が筋線維の周辺に移行する間、筋線維の直径が大きくなる。
再生の過程に対する単一遺伝子の影響は、トランスジェニックマウスを用いて、または自己送出型siRNAの注射によってここに示すように調べることができる。蛍光標識された自己送達性スクランブルコントロールsiRNAは、損傷後3日目に再生脛骨前筋に注入され、衛星細胞の増殖がピークに達した時点である。siRNA衛星細胞の注射の2日後に蛍光標識siRNAの存在について分析した(図4F)。再生筋への注射の2日後に蛍光標識されたsiRNAを取り込んだ衛星細胞の数を分析した(図5)。再生筋内のすべての衛星細胞の約75%は、蛍光標識されたsiRNAに対して陽性であった。さらに、再生ミオファイバーの約74%が蛍光標識されたsiRNAに陽性であると判断し、再生ミオファイバーの74%がsiRNAを占めていたか、siRNA陽性衛星細胞が融合していたことを示唆した。新しい筋線維を形成したり、既存の再生筋線維との融合が起こった(図5)。これは、衛星細胞が自己送出型siRNAを取り上げ、siRNAが少なくとも2日間衛星細胞に持続することを示唆している。
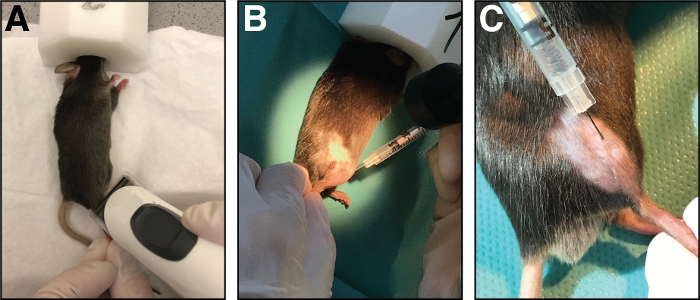
図1:脛骨前筋へのカーディオトキシンの注射。(A)マウスはイソルランの吸入によって麻酔され、下肢を剃る。(B)A29G針を脛骨前筋(C)に注入し、心臓毒素溶液の注射中に脛骨骨に沿って移動する。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:負傷した脛骨前筋の解剖および凍結に関与するステップ。(A)後肢の筋肉が露出し(B)、脛骨前筋を取り巻く筋膜が裂けて筋肉を露出させる。(C)筋肉を取り除き、鋭いまっすぐなはさみを用いて、中腹領域を同じ大きさの2つの半分に切断する(D)。(E)解剖した筋肉の半分は、凍結溶液で満たされたアルミ箔型に埋め込まれ、液体窒素(F)で凍結する。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:脛骨前筋の凍結切除に関与する装置およびステップ。(A)クライオスタットの室温は-21 °Cに設定されている。(B)凍結溶液中の脛骨前筋がサンプルホルダーに取り付けられている。(C)厚さ14μmの断面はガラス顕微鏡スライドに取り付けられています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
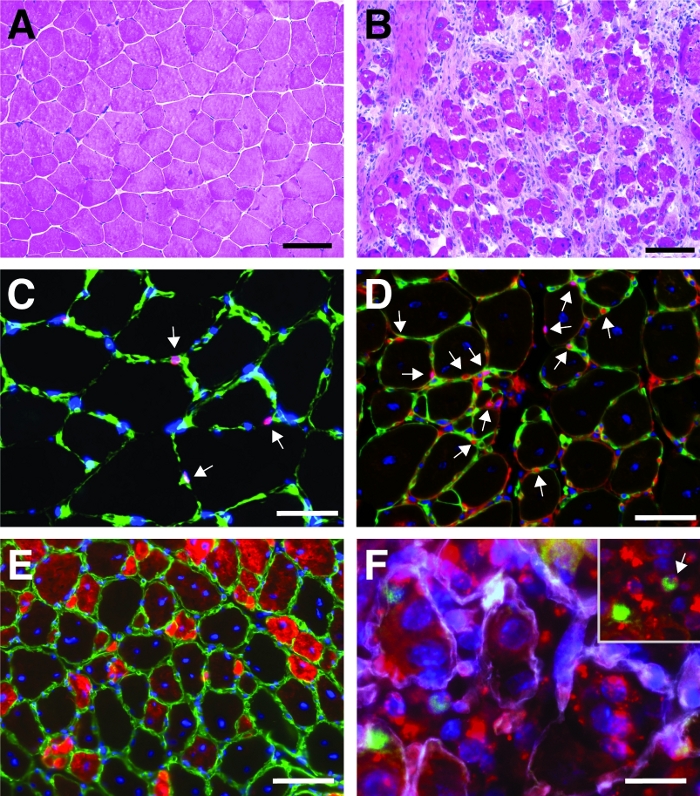
図4:脛骨前筋を再生する代表的な画像。脛骨前筋のH&E染色(A)およびカーディオトキシン損傷後7日目(B)。(C)無傷の筋肉Pax7陽性(赤色)衛星細胞は、ラミニン(緑色)でマークされた基底層の下に位置する。核はDAPI(青色)で逆染色されます。Pax7 陽性セルは矢印でマークされています。(D)再生の10日後、ミオファイバーは中央に位置する核(青色)によって特徴付けられ、Pax7は赤色、ラミニンは緑色で示される。Pax7 陽性セルは矢印でマークされています。(E)新たに形成されたミオファイバーは発達ミオシン(赤色)を発現し、ラミニンは緑色、核はDAPI(青色)で反染色される。(F)蛍光標識された自己送出型siRNA(siRED、赤で描かれた)は、衛星細胞(Pax7陽性、緑色、インセットの矢印でマーク)にまだ見出される) 自己送出型siRNAを再生成脛骨前部に注入した2日後筋肉(カーディオトキシン媒介損傷後3日目に注射)。ラミニンは白色で示され、核はDAPI(青色)で逆染色される。スケールバー = 100 μm (A および B)、50 μm (C-E)、25 μm (F)この図のより大きなバージョンを表示するには、ここをクリックしてください。
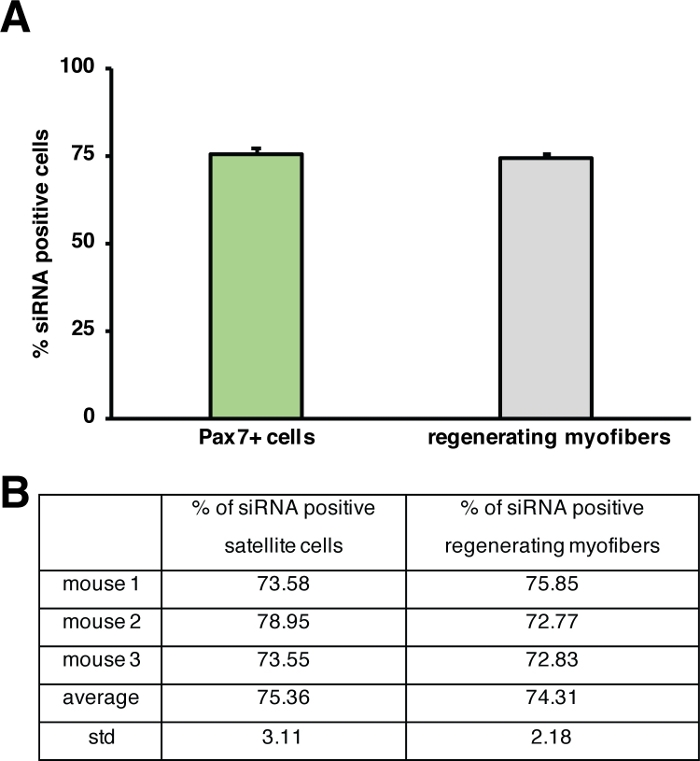
図5:蛍光標識siRNAの取り込みの定量化。(A)衛星細胞(Pax7+細胞)によるsiRNA取り込みを定量し、骨格筋を再生する注射の2日後に筋線維を再生する。注射は、心臓毒素媒介損傷後3日目に行った。n = 3、誤差バーは(A)に描かれたグラフの下にあるSEM.(B)定量を示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、トランスジェニック動物を必要とせずに骨格筋の再生中に特定の遺伝子の機能を調べるための方法を紹介する。これは、カーディオトキシン誘発筋損傷の組み合わせと、損傷後3日目に再生骨格筋に自己送達siRNAを注入することによって達成される。カーディオトキシンによる筋肉損傷の手順、自己送出型siRNAの注射、収穫した筋肉の処理を詳細に説明し、再生の進行を分析した。我々は、骨格筋へのヘビ毒カーディオトキシンの注入が効果的に全筋肉を傷つけ、自己送出siRNAが他の細胞タイプの中で全ての衛星細胞の約75%に見つかることを実証する。骨格筋の再生(図4、図5)。
特に注意は、様々な程度の損傷が再生結果に影響を与え、それによってsiRNAの効果が影響を受ける可能性があるため、脛骨前筋の均質な損傷に焦点を当てる必要があります。さらに、再生領域全体に自己送出型siRNAを注入することが極極む極大な重要である。再生プロセスの分析のために、常に再生骨格筋の同様の領域を比較することをお勧めします, したがって、脛骨前筋は、常に筋肉の中腹領域を比較するために半分にカットする必要があります.筋肉を分析する際には、筋線維組成が脛骨前筋で異なるため、異なる再生が生じる可能性があるため、凍結切除全体を分析する必要があります。
衛星細胞の機能は、隣接する単一筋線維17上の培養を含む様々な実験手順により、移植や誘発後の骨格筋の再生解析によって調べることができる。18、19.生体内誘導傷害モデルを用いて衛星細胞の機能を調べると、例えば、カージアトキシンの注入は、マクロファージなどの他の細胞型との相互作用の観点からも衛星細胞機能を解析する能力を提供し、全身要因の影響の調査2.骨格筋の損傷は、様々な手段によって達成することができ、例えば、偏心運動、凍結損傷、BaCl2の注射またはカーディオトキシンまたはノテキシン18などのヘビ毒の注射。偏心運動はおそらく最も生理的傷害法であるが、1つの特定の筋肉への傷害は限られた20である。凍結傷害は、損傷部位に向かう衛星細胞の移動が研究の目的である場合、または筋肉の特定の部分だけが負傷する必要がある場合に適用することができる。実験的に凍結傷害の欠点は、予調整された金属プローブを適用するために行う必要がある開いた手術です。BaCl2またはヘビ毒の注入は、傷害の最も劇的な方法であり、それによって最も困難な衛星細胞機能に挑戦する。さらに、注射は最小限に侵襲的であり、手術時間は、一般に、5分未満であり、縫合等を伴わないことにより、感染のリスクを最小限に抑える。
筋肉損傷は、主に遺伝子機能の喪失の機能的結果を調査するために使用され、例えば、Pax77、21の喪失。特に老化したマウスが科学的な問題の焦点である場合、トランスジェニックマウスの生成または使用はしばしば実現不可能である。特定の遺伝子を標的とする自己送達siRNAの注射は、これらの場合に実行可能な代替手段であり、正常に使用されている22.簡単に言えば、マウスの脛骨前筋は、カルタトキシンの注射によって損傷を受け、フィブロネクチン(FN)に対して向けられた自己送出型siRNAは、損傷後3日目に注射された。筋肉は傷害の10日後に分析され、siFN対スクランブルsiRNA制御条件で衛星細胞数の有意な減少が観察された。ノックダウン効率は、siRNA注射の2日後に定量的リアルタイムPCRにより全筋肉分解能で判定し、58%の発現レベルの低下が達成され、送達およびノックダウン効率が機能のために十分であることを示唆した分析22.ノックダウン効率をテストするための代替手段は、標的遺伝子に対する抗体を用いて免疫ブロットまたは免疫蛍光分析のいずれかである。生体内注射に使用されるsiRNAの効率および特異性は、例えば、単離された衛星細胞または原発性筋芽細胞における効率を試験することによって、マウスへの注射前に決定されるべきである。4つの異なるsiRNAと単一のsiRNAで構成されるスマートプールを使用すると、ノックダウンの効率が向上するだけでなく、非特異的ターゲティングのリスクも高まります。使用されるすべてのsiRNA配列の特異性は、オフターゲット効果を避けるために細胞培養で試験されるべきである。コントロールとして、非標的型スクランブルsiRNAは、siRNA当たりの注入が注射による再生プロセスに影響を与え、それによって筋肉の追加損傷に影響を与える可能性があるため、使用されるべきである。siRNAを注入する時間は、科学的な質問と標的遺伝子の発現プロファイルに依存する。一般に、カーディオトキシン損傷後の3日目に自己送達するsiRNAを注射することは、衛星細胞増殖が傷害後3日目にピークを迎えるので、衛星細胞増殖に重要なほとんどの遺伝子を標的とする。最初のsiRNA注射の時点は、カーディオトキシンの注射量が非常に高く、液体の再吸収が筋肉に追加の溶液を注入する前に行われるべきであるので、カーディオトキシン損傷後48時間未満であるべきである。一般に、siRNAの複数の注射または異なるsiRNAの組み合わせが可能であるが、再生筋肉への各注射が追加の損傷を引き起こしていることを考慮しなければならない。
記載された方法の1つの制限は、観察される効果が必ずしも衛星細胞における標的遺伝子のノックダウンに依存するのではなく、免疫細胞または線維脂肪殖前駆細胞などの他の細胞型に起因する可能性があるという事実である。したがって、これらの実験を衛星細胞の純粋な集団を調べた実験と組み合わせる必要がある。1つは、衛星細胞が隣接する筋線維上で培養される浮遊筋線培養を用いて実験を行うか、単離衛星細胞17を用いて移植実験を行うことができる。
自己送出型siRNAの注射に代わりは、科学的な質問に応じて実行できる低分子阻害剤または組換えタンパク質の注入である。例えば、JAK/STATシグナル伝達の細胞外マトリックスタンパク質フィブロネクチンまたは低分子阻害剤の注入は、老化マウス15,16において正常に行われている。骨格筋の再生中に1つの特定の細胞型における特定の遺伝子機能の解析は、例えば、衛星細胞において、誘導可能な遺伝的マウスモデルの使用によってのみ可能である。自己送出siRNA、組換えタンパク質または小分子阻害剤の注射は、骨格筋の再生において複数の細胞タイプに影響を与える可能性がある。
開示事項
クリスティーナ・ピッカーとクリスティン・ポーザーに対して、優れた技術支援とSaskia SteinerにsiRNAトランスフェクション効率の決定にご協力いただき、感謝申し上げます。私たちは、優れた技術サポート、特にサビーヌ・ランドマンとリンダ・ローテンバーガーのためのコアサービスの専門技術学に感謝します。我々はまた、優れたサポートのためにFLIの動物施設のマウスに感謝します。この作品は、ドイツ・フォルシュンゲミンシャフト(MA-3975/2-1)とドイツ・クレブシルフ(DKH-JvM-861005)からJ.v.Mへの助成金によって支えられた。
謝辞
著者は、競合する金銭的利益を宣言しません。
資料
| Name | Company | Catalog Number | Comments |
| isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| shaver for rodents | isis | GT420 | |
| cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| insulin syringe (29g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 | |
参考文献
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198 (2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved