Method Article
Analyse der Satellitenzellfunktion während der Skelettmuskelregeneration durch Kardiotoxinverletzung und Injektion von selbstliefernder siRNA In Vivo
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben eine In-vivo-Methode zur Untersuchung des funktionellen Verlustes eines bestimmten Gens in Satellitenzellen mithilfe einer Kombination aus kardiotoxinvermittelter Verletzung des Skelettmuskels und der Injektion einer selbstliefernden siRNA.
Zusammenfassung
Der Skelettmuskel besitzt eine enorme Fähigkeit, sich nach Verletzungen zu regenerieren. Dieser Prozess wird hauptsächlich von Muskelstammzellen angetrieben, die auch als Satellitenzellen bezeichnet werden. Satellitenzellen zeichnen sich durch die Expression des Transkriptionsfaktors Pax7 und ihre Position unterhalb der Basallamina im ruhenden Skelettmuskel aus. Bei Verletzungen werden Satellitenzellen aktiviert, durchlaufen selbstErneuerung oder Differenzierung, um entweder neue Myofiber zu bilden oder mit beschädigten zu verschmelzen. Die Funktionalität von Satellitenzellen in vivo kann mit einem kardiotoxinbasierten Verletzungsmodell des Skelettmuskels untersucht werden. Um die Funktion eines Gens während der Regeneration des Skelettmuskels zu untersuchen, werden meist transgene Mausmodelle verwendet. Hier stellen wir eine alternative Methode zu transgenen Mäusen vor, um die Genfunktion in Satellitenzellen während der Regeneration zu untersuchen, z. B. in Fällen, in denen transgene Mäuse nicht verfügbar sind. Wir kombinieren die kardiotoxinvermittelte Verletzung eines bestimmten Skelettmuskels mit der Injektion einer selbsttragenden siRNA in den regenerierenden Muskel, der dann von Satellitenzellen unter anderen Zellen aufgenommen wird. Dabei bieten wir eine Methode zur Analyse der Genfunktion in Satellitenzellen während der Regeneration unter physiologischen Bedingungen, ohne dass transgene Mäuse benötigt werden.
Einleitung
Skelettmuskel ist das größte Gewebe des Körpers, das etwa 40% des gesamten Körpergewichts ausmacht und eine freiwillige Fortbewegung ermöglicht. Die Gewebearchitektur des Skelettmuskels besteht hauptsächlich aus postmitotischen, endlos differenzierten, multinukleierten Myofikern sowie verschiedenen anderen Zellen aus dem peripheren Nervensystem, dem Gefäßsystem und den interstitiellen Zellen1. Wichtig ist, Skelettmuskel hat eine enorme Fähigkeit zu regenerieren und wieder funktionsfähig bei Verletzungen oder Schäden2. Dieser Prozess hängt von den Gewebe-Resident Muskelstammzellen auch als Satellitenzellen3,4. Satellitenzellen befinden sich zwischen dem Myofiber und der Basallamina und zeichnen sich durch die Expression des Transkriptionsfaktors Pax75,6,7aus. Unter atostatischen Bedingungen sind Satellitenzellen still, werden aber durch traumatische Verletzungen aktiviert, z.B. durch exzentrisches Training oder experimentell durch Injektion des Schlangengifteskardiotoxin6,8. Einmal aktiviert, koprimieren Pax7-positive Satellitenzellen MyoD und Myf5, was die Stammzellen zu einer myogenen Differenzierung verpflichtet. Satellitenzellen, die der Upregulation von Verpflichtungsfaktoren widerstehen, werden ihr Stammkraftpotenzial behalten und zur Ruhe zurückkehren, um den Stammzellpool für zukünftige Anforderungen aufzufüllen. Nach der Erweiterung des myogenen Vorläuferpools werden Transkriptionsnetzwerke durch Differenzierungsfaktoren wie Myogenin aktiviert, um den Zellzyklusausgang und die Terminaldifferenzierung zu initiieren. Diese Myoprogenitoren verschmelzen dann miteinander oder zu bestehenden Myofibiden, die Myonuclei beisteuern, um die Größe der myonuklearen Domäne zu erhalten. Die Myofibers drücken terminale Muskeldifferenzierungsgene wie Myosin Heavy Chain aus. Schließlich wachsen und reifen die neu gebildeten Myofiber, um die funktionellen Einheiten des Skelettmuskels9,10zu bauen.
Die Regeneration des Skelettmuskels kann durch verschiedene Erkrankungen wie Muskelerkrankungen oder Alterung11,12beeinflusst werden, von leichten Beeinträchtigungen bis hin zu lebensbedrohlichen Erkrankungen, z.B. bei Duchenne-Muskeldystrophie13 , 14. Daher zielt die regenerative Medizin darauf ab, beschädigtes oder fehlerhaftes Skelettmuskelgewebe mit seiner inhärenten regenerativen Kraft wiederherzustellen, indem die Satellitenzellfunktion15,16ins Visier genommen wird. Um sein volles Potenzial auszuschöpfen, ist ein umfassendes Verständnis der Satellitenzellen in ihrer endogenen Nische bei der Regeneration des Skelettmuskels erforderlich. Obwohl experimentelle Ansätze existieren, um Satellitenzellen neben ihren Myofibers zu isolieren17, kann die volle Komplexität der zellulären und systemischen Wechselwirkungen von Satellitenzellen mit ihrer Umgebung nur in vivo rekapituliert werden. In dieser Hinsicht wurde großes Wissen über die Regeneration der Skelettmuskulatur mit den Mausverletzungsmodellen2,18erworben.
Hier stellen wir ein spezifisches experimentelles Mausverletzungsmodell vor, um die stammzellenvermittelte Regeneration von kardiotoxininduzierten Schäden des tibialis vorderen Muskels in vivo zu untersuchen. Kardiotoxin, ein von einer Schlange abgeleitetes zytolytisches Toxin, das Myofiberdepolarisation und Nekrose verursacht, wird in den tibialis vorderen Muskel injiziert, was wiederum eine Gewebedegeneration mit anschließender Regeneration auslösen wird. Um die Funktion von Genen während der akuten Regeneration zu analysieren, werden selbstliefernde siRNAs am 3. Tag nach einer Verletzung, auf dem Höhepunkt der Satellitenzellexpansion, injiziert. Versuchstiere werden an verschiedenen Zeitpunkten geopfert und die tibialis vorderen Muskeln gesammelt. Die sezierten Muskeln werden eingefroren und für weitere Kryo-Sektionen verarbeitet. Die Immunfluoreszenzmikroskopie wird dann verwendet, um Marker der Regeneration zu analysieren. Diese Methode ermöglicht die Untersuchung der Funktion eines einzelnen Gens während der satellitenzellgesteuerten Regeneration des Skelettmuskels mit Wildtypmäusen.
Protokoll
Alle Tierverfahren wurden vom Tierschutzamt des Thüringer Landesamtes für Lebensmittelsicherheit und Verbraucherschutz genehmigt (03-048/16; TLV; Bad Langensalza).
1. Kardiotoxin-induzierte Muskelverletzung
HINWEIS: Führen Sie alle Experimente mit lebenden Mäusen gemäß dem nationalen Tierschutzgesetz und unter geeigneten aseptischen Bedingungen durch. Außerdem muss das Opfern von Tieren in Übereinstimmung mit dem nationalen Tierschutzgesetz erfolgen.
- Desinfizieren Sie die Inhalationsbox zur Inhalationsanästhesie und den Operationsbereich mit 70% Ethanol. Legen Sie ein steriles chirurgisches Tuch auf das Heizkissen, wo die Operation stattfinden wird.
- Schalten Sie das Heizkissen bei 37 °C ein.
- Analgetika (z. B. 1 mg/kg Körpergewicht Meloxicam subkutan) 15 min vor Beginn der Operation verabreichen.
HINWEIS: Für ein typisches Experiment verwenden Sie Mäuse, die mindestens 6 Wochen alt sind, geschlechtsgerecht und in einer guten allgemeinen körperlichen Verfassung. - Bereiten Sie die Kardiotoxinlösung (20 m in 0,9 % NaCl) vor, lagern Sie die Lösung bei -20 °C.
- Lassen Sie die Kardiotoxinlösung Raumtemperatur (RT) erreichen.
- Die Maus in die Inhalationsbox überführen und Anästhesie mit Isofluran induzieren (Einleitung 3,5 – 5 % in reinem Sauerstoff). Überprüfen Sie die Tiefe der Anästhesie mit einem Mangel an Reaktion auf eine Zehenprise.
- Legen Sie die Maus auf ein sauberes Papiertuch und halten Sie die Anästhesie mit einer Nasenmaske (1,5 – 3 % Isofluran in reinem Sauerstoff). Rasieren Sie den Injektionsbereich des Schädelunterschenkels (vom Knie bis zur Pfote, Abbildung 1A). Entfernen Sie alle übermäßig enden losen Haare.
HINWEIS: Die physikalische Trennung des Rasier- und Injektionsbereichs im Raum sorgt für sterilere Bedingungen für die Injektionen. - Legen Sie die Maus in die seitliche Liegeposition auf dem mit einem sterilen chirurgischen Tuch bedeckten Heizkissen und halten Sie die Anästhesie mit einer Nasenmaske (1,5 – 3% Isofluran in reinem Sauerstoff).
- Desinfizieren Sie den Injektionsbereich des Schädelunterschenkels (vom Knie bis zur Pfote) mit 70% Ethanol.
- Führen Sie eine Zehenprise vor Beginn der intramuskulären Injektion durch, um eine ausreichende Tiefe der Anästhesie zu gewährleisten.
- Injizieren Sie mit einer Insulinspritze mit 29-Spur-Nadel 50 L-Kardiotoxin (20 m in 0,9% NaCl) in den tibialis vorderen Muskel. Zuerst durchbohren Sie die Haut nur distal des Knies.
- Setzen Sie die Nadel vollständig in den Muskel (in myofiber-Orientierung/Parallel zum Tibiaknochen) und injizieren Sie das Kardiotoxin langsam (10-20 s) entlang der gesamten Länge des Muskels, während Sie die Nadel hin und her bewegen, um eine gleichmäßige Verteilung des Kardiotoxins zu ermöglichen Verletzung des gesamten tibialis vorderen Muskels (Abbildung 1B,C).
HINWEIS: Verletzen Sie den tibialis vorderen Muskel von nur einem Bein, kann der kontralaterale tibialis vordere Muskel als interne Kontrolle dienen, um festzustellen, dass Skelettmuskeln nicht pathologisch vor der Kardiotoxinverletzung betroffen waren. - Übertragen Sie die Maus zurück in ihren Käfig auf einem Heizkissen platziert und überwachen Sie den Genesungsprozess, bis das Tier bei Bewusstsein ist und ambulant wird.
HINWEIS: Die Mäuse zeigen nur einen leichten Schlappen. Wenn Mäuse stark humpeln und überhaupt kein Gewicht auf das Bein legen, opfern Sie die Maus. - Analgetika während der folgenden 2 Tage verabreichen (z. B. 1 mg/kg Körpergewicht Meloxicam subkutan, alle 24 h) und überwachen Sie sie wöchentlich.
2. Injektion von selbstliefernder siRNA in den regenerierenden Tibialis Anteriormuskel (am Tag 3 Post-Kardiotoxin-Verletzung)
- Bereiten Sie die siRNA-Lösung vor, indem Sie die siRNA (z.B. siRNA smart pool) in 0,9% NaCl (Endkonzentration von 2 g/l) gemäß der Anweisung des Herstellers wieder aufhängen.
HINWEIS: Die siRNA wird chemisch modifiziert, um die passive Aufnahme durch Zellen zu erleichtern und sie vor Nukleaseabbau zu schützen. Es werden keine Transfektionsreagenzien benötigt, wodurch die Toxizität reduziert wird. Die Verwendung eines intelligenten Pools von vier unabhängigen siRNA-Sequenzen, die auf dasselbe Gen abzielen, erhöht die Knockdown-Effizienz. - Bewahren Sie die siRNA bei -20 °C auf und übertragen Sie sie auf Eis in den Operationssaal.
- Desinfizieren Sie die Inhalationsbox zur Inhalationsanästhesie und den Operationsbereich mit 70% Ethanol. Legen Sie ein steriles chirurgisches Tuch auf das Heizkissen, wo die Operation stattfinden wird.
- Schalten Sie das Heizkissen bei 37 °C ein.
- Die Maus in die Inhalationsbox überführen und Anästhesie mit Isofluran induzieren (Einleitung 3,5 – 5% in reinem Sauerstoff). Überprüfen Sie die Tiefe der Anästhesie mit einem Mangel an Reaktion auf eine Zehenprise.
- Legen Sie die Maus in die seitliche Liegeposition auf dem mit einem sterilen chirurgischen Tuch bedeckten Heizkissen und halten Sie die Anästhesie mit einer Nasenmaske (1,5 – 3% Isofluran in reinem Sauerstoff).
- Desinfizieren Sie den Injektionsbereich des Schädelunterschenkels (vom Knie bis zur Pfote).
- Führen Sie eine Zehenprise vor Beginn der intramuskulären Injektion durch, um eine ausreichende Tiefe der Anästhesie zu gewährleisten.
- Injizieren Sie mit einer Insulinspritze mit einer 29 G-Nadel bis zu 50 L siRNA-Lösung (bis zu 100 g insgesamt in 0,9% NaCl; gegen das Zielgen gerichtet; verwenden Sie RührsiRNA als Kontrolle) in den verletzten tibialis vorderen Muskel. Zuerst durchbohren Sie die Haut nur distal des Knies, dann setzen Sie die Nadel in den tibialis vorderen Muskel.
- Setzen Sie die Nadel vollständig in den Muskel (in myofiber-Orientierung/Parallel zum Tibiaknochen) und injizieren Sie die siRNA-Lösung langsam (10 – 20 s) entlang der gesamten Länge des Muskels, während Sie die Nadel hin und her bewegen, um eine gleichmäßige Verteilung der siRNA entlang der ganze tibialis vorderer Muskel.
- Übertragen Sie die Maus zurück in ihren Käfig auf einem Heizkissen platziert und überwachen Sie den Genesungsprozess, bis das Tier bei Bewusstsein ist und ambulant wird.
HINWEIS: Analgesie ist nicht unbedingt nach der Injektion von siRNA.
3. Zerlegung des Tibialis Anteriormuskels
- Bereiten Sie die Gefrierlösung (2 Teile OCT-Verbindung und 1 Teil 30% Saccharose in entionisiertem Wasser) mindestens 12 h vor dem Gebrauch, um Luftblasen zu vermeiden.
- Bereiten Sie Gefrierformen vor, indem Sie eine Aluminiumfolie um einen Bleistift wickeln und mit Klebeband versiegeln. Es ist wichtig, dass der Boden der Form eine gleichmäßige, geschlossene Oberfläche bietet.
HINWEIS: Kleinere Gefrierformen ermöglichen das schnellere Einfrieren des Muskels, um das Einfrieren von Artefakten zu vermeiden. - Opfern Sie die Maus, z.B. durch CO2-Inhalation, am jeweiligen Zeitpunkt der Regeneration und sprühen Sie die ganze Maus und Sezierwerkzeuge mit 70% Ethanol.
HINWEIS: Zervikale Dislokation kann zusätzlich angewendet werden, um übermäßige Blutungen am Bein zu vermeiden, wenn der tibialis vordere Muskel isoliert wird. - Entfernen Sie das Fell und die Haut aus dem verletzten Hinterglied, indem Sie die Haut am Knöchel mit einer extra feinen scharfen Schere (Schneide: 13 mm) schneiden und die Haut mit Zangen zum Knie hochziehen.
- Um die tibialis vordere Sehne am Knöchel freizulegen, ziehen Sie die restliche Haut zum Fuß oder schneiden Sie sie mit einer scharfen Schere.
HINWEIS: Die Maus kann an eine Stützplatine gepinnt werden, um eine bessere Fixierung zu ermöglichen. - Vor der Ernte des tibialis vorderen Muskels, entfernen Sie die Faszie mit feinen Zangen (Dumont 5 oder 7, gerade oder gekrümmt). Kneifen Sie die geschlossenen Zangen durch die Faszien neben dem Schienbeinknochen am Knöchel des verletzten Beins (Abbildung 2A). Bewegen Sie die Zange in Richtung Knie, wodurch die Faszien gerissen und der tibialis vordere Muskel freigelegt wird (Abbildung 2B).
- Um den tibialis vorderen Muskel zu isolieren, setzen Sie die distale Sehne aus und greifen Sie sie mit feinen Zangen (Dumont 7, gekrümmt). Schneiden Sie die Sehne mit einer Federschere (Schneide: 5 mm, Spitzendurchmesser: 0,35 mm) und ziehen Sie den Muskel (an der Sehne haltend) in Richtung Knie.
- Um den tibialis vorderen Muskel zu ernten, schneiden Sie ihn so nah wie möglich am Knie mit einer scharfen Schere.
- Vor dem Einfrieren den tibialis vorderen Muskel im mittleren Bauchbereich des Muskels mit gerader Schere in zwei halbgleiche Hälften schneiden, um die Analyse des mittleren Bauchbereichs zu ermöglichen (Abbildung 2C,D).
- Füllen Sie die Gefrierform auf halbem Weg mit der Gefrierlösung.
- Legen Sie die beiden Hälften des tibialis vorderen Muskels in die gefrierende Form mit dem mittleren Bauchbereich mit Blick auf den Boden der Form(Abbildung 2E). Stellen Sie sicher, dass die tibialis vorderen Hälften in einer aufrechten Position an der Wand der gefrierenden Form gelehnt eingesetzt werden, um ein Kippen des Muskels zu vermeiden.
HINWEIS: Je mehr Gefrierlösung in der Form ist, desto länger dauert das Einfrieren, was das Risiko von Kryo-Artefakten erhöht. - Halten Sie die Gefrierform mit Zangen und übertragen Sie sie auf halbem Weg in flüssigen Stickstoff (Abbildung 2F). Stellen Sie sicher, dass während des Gefriervorgangs kein flüssiger Stickstoff in die Gefrierform gelangt.
- Beobachten Sie den Gefrierprozess, das Gefriermedium ändert die Farbe von transparent zu weiß und wird fest. Submerse die Gefrierform für einige Sekunden in flüssigen Stickstoff und überträgt die Gefrierform in einen -80 °C Gefrierschrank oder in Trockeneis für die zukünftige Verarbeitung.
- Die gefrorenen Muskeln in den gefrierenden Formen bei -80 °C bis zur weiteren Verwendung lagern.
HINWEIS: Die Gefrierformen passen gut in 24-Well-Platten oder 1,5 ml Reaktionsrohre, die eine Kennzeichnung und organisierte Lagerung ermöglichen. - Behandeln Sie den Muskel in den Gefrierformen für den weiteren Einsatz immer auf Trockeneis.
4. Kryosektion des regenerierenden Tibialis Anteriormuskels
- Stellen Sie vor Beginn der Schnitte die Kammertemperatur des Kryostats auf -21 °C, die Objekttemperatur auf -20 °C und die Schnittdicke auf 10, 12 oder 14 m (je nach zukünftiger Anwendung) ein (Abbildung 3A).
- Übertragen Sie die Muskelprobe in der gefrierenden Form in den Kryostat und lassen Sie sie für einige Minuten an die Temperatur anpassen. Beschriften Sie während dieser Zeit die Mikroskop-Dias.
- Entfernen Sie die Folie um den eingebetteten Muskel mit vorgekühlten Zangen im Inneren des Kryostats. Vermeiden Sie das Berühren der Probe, da das Kryomedium leicht zu tauen beginnt.
- Montieren Sie die Probe mit dem mittleren Bauchbereich des tibialis vorderen Muskels nach oben auf den Metallprobenhalter des Kryomediums mit Kryomedium gerichtet. Dadurch wird sichergestellt, dass die Schneidstelle des Muskels (unten der Form) dem Experimentator gegenübersteht.
- Setzen Sie den Probenhalter mit der montierten Probe in den Schnittmechanismus ein.
HINWEIS: Um eine ordnungsgemäße Schnittung der Probe zu gewährleisten, verwenden Sie vor dem Start eine neue Klinge. - Trimmen Sie zunächst den Probenblock (30 m), um eine gleichmäßige Schnittebene zu erhalten und den jeweiligen Bereich des Muskels zu erreichen (Abbildung 3B).
- Nach dem Schneiden aufeinanderfolgende Abschnitte der jeweiligen Dicke (z.B. 14 m) schneiden.
- Sammeln Sie die Abschnitte auf Mikroskopglasrutschen, indem Sie die Folie nach unten über den Abschnitt halten. Der Abschnitt wird an die Folie angefügt (Abbildung 3C).
- Abschnitte bei -80 °C oder -20 °C lagern, bis sie weiter verwendet oder direkt für die Immunfluoreszenz oder Immunhistochemie verwendet werden.
5. Immunostainierung für Marker der Regeneration
- Führen Sie alle weiteren Schritte in einer befeuchteten Kammer durch.
- Kurz gesagt, die Abschnitte bei Raumtemperatur ausdemieren.
- Befestigen Sie Abschnitte mit 1 ml 2% PFA (in PBS, pH 7,4) pro Schlitten für 5 min bei RT.
- Entfernen Sie die 2% PFA-Lösung, indem Sie sie in den jeweiligen Abfallbehälter gießen.
- Waschen Sie 3 mal mit 1 ml PBS (pH 7.4) für 5 min bei RT.
- Entfernen Sie die PBS, indem Sie sie in einen Abfallbehälter gießen.
- Pro Folie 1 ml der Permeabilisationslösung (0,1 % Triton X-100, 0,1 M Glycin in PBS pH 7,4) für 10 min hinzufügen.
- Entfernen Sie die Permeabilisationslösung, indem Sie sie in einen Abfallbehälter gießen.
- Fügen Sie 150 l der Blockierlösung (M.O.M. 1:40 in PBS pH 7.4) pro Schlitten und Abdeckung mit dem Deckelschlupf hinzu. 1 h bei RT inkubieren.
- Entfernen Sie den Abdeckzettel und die Blockierlösung, wenden Sie 100 L Primärantikörperlösung [PAX7, DSHB, Maus IgG1, unverdünnt oder devMHC, DSHB, unverdünnt, Maus IgG1und Laminin (Kaninchen, 1:1.000)] pro Schlitten an. Abdeckung mit Deckelschlupf. O/N (über Nacht) bei 4 °C inkubieren.
HINWEIS: Führen Sie eine Kontrollfärbung durch Auslassen der primären Antikörper durch, und inkubieren Sie den Abschnitt stattdessen mit einer blockierenden Lösung. - Waschen Sie 3 mal mit 1 ml PBS (pH 7.4) für 5 min bei RT.
- Entfernen Sie PBS, indem Sie es in einen Abfallbehälter gießen.
- Fügen Sie 100 l der sekundären Antikörperlösung (Alexa Fluor 546 Ziege Anti-Maus IgG1 und Alexa Fluor 488 Esel Anti-Kaninchen-IgG in Blockierlösung, 1: 1.000) pro Schlitten und Abdeckung mit dem Deckelschlupf hinzu. 1 h bei RT inkubieren.
- Inkubieren Sie die Dias im Dunkeln, z.B. verwenden Sie eine Aluminiumfolie, um eine schwarze befeuchtete Kammer zu bedecken oder zu verwenden.
HINWEIS: Von nun an sollten alle Schritte unter reduzierten Lichtverhältnissen durchgeführt werden, da einige sekundäre Antikörper lichtempfindlich sind. - Entfernen Sie den Deckelschlupf und die sekundäre Antikörperlösung.
- Waschen Sie 3 mal mit 1 ml PBS (pH 7.4) für 5 min bei RT.
- Entfernen Sie die PBS, indem Sie sie in einen Abfallbehälter gießen.
- Führen Sie die DAPI-Färbung durch Hinzufügen von 1 ml der Lösung pro Folie zu einer Endkonzentration von 10 g/ml für 5 min bei RT durch.
- Entfernen Sie die DAPI-Färbelösung, indem Sie sie in einen Abfallbehälter gießen.
- Waschen Sie 3 mal mit 1 ml PBS (pH 7.4) für 5 min bei RT.
- Entfernen Sie die zum Waschen verwendete PBS vollständig.
- Tragen Sie 2 – 3 Tropfen wässriges Montagemedium auf und bedecken Sie den Schlitten direkt mit einem neuen Deckel.
- Lassen Sie die Dias für 1 h bei RT im Dunkeln trocknen.
- Bewahren Sie die gebeizten Abschnitte bei 4 °C im Dunkeln auf, bis sie mit einem Fluoreszenzmikroskop weiter analysiert werden.
6. Hämatoxylin und Eosin Färbung
- Führen Sie alle weiteren Schritte in einer befeuchteten Kammer durch.
- Befestigen Sie Abschnitte mit 1 ml 2% PFA (in PBS, pH 7,4) pro Schlitten für 5 min bei RT.
- Entfernen Sie die 2% PFA-Lösung, indem Sie sie in den jeweiligen Abfallbehälter gießen.
- Übertragen Sie die Dias in ein Coplin-Glas.
- Spülen Sie die Dias vorsichtig mit Leitungswasser ab.
HINWEIS: Schalten Sie den Wasserhahn nicht zu hoch ein, da dies die Abschnitte beschädigen könnte. - Übertragen Sie die Dias in die befeuchtete Kammer. Entfernen Sie die Flüssigkeit.
- 1 ml Hematoxylin-Färbungslösung (Gill Nr. 3) für 2 min auftragen.
- Übertragen Sie die Dias in ein Coplin-Glas.
- Spülen Sie die Dias vorsichtig mit dem Leitungswasser ab, bis die Kerne blau werden.
HINWEIS: Schalten Sie den Wasserhahn nicht zu hoch ein, da dies Ihre Abschnitte beschädigen könnte. - Übertragen Sie die Dias in die befeuchtete Kammer. Entfernen Sie die Flüssigkeit.
- 1 ml Eosin Y-Lösung auftragen und 2 min inkubieren.
- Übertragen Sie die Dias in ein Coplin-Glas.
- Spülen Sie die Rutschen vorsichtig mit Leitungswasser ab, bis das Leitungswasser, das von den Rutschen kommt, klar ist.
- Entfernen Sie alle Flüssigkeit und lassen Sie die Dias für 2 min trocknen.
- Montage in Montagemedium geeignet für die Immunhistochemie.
Ergebnisse
Ein typisches Ergebnis einer Hämatoxylin- und Eosinfärbung (H&E) eines tibialis vorderen Muskels vor und nach einer kardiotoxinvermittelten Verletzung ist in Abbildung 4A,Bdargestellt. In den Kontrollmuskeln ist die Architektur des Muskels intakt, wie die Lokalisierung der Kerne in der Peripherie der Myofiber und der Mangel an Akkumulation von mononukleierten Zellen im interstitiellen Raum sehen (Abbildung 4A). 7 Tage nach der Kardiotoxin-vermittelten Verletzung bilden sich neue Myofiber, die durch zentral gelegene Kerne gekennzeichnet sind (Abbildung 4B). Darüber hinaus kann eine Ansammlung mononukleierter Zellen beobachtet werden, die hauptsächlich aus Satellitenzellen, aber auch aus nicht-myogenen Zellen wie Immunzellen bestehen. Der gesamte Muskel sollte verletzt werden, gekennzeichnet durch die zentrale Lage aller Myonukleien und die Ansammlung von mononukleierten Zellen auf dem gesamten Muskelabschnitt.
Um das Fortschreiten und den Erfolg des Regenerationsprozesses zu charakterisieren, können mehrere immunfluoreszierende Färbungen mit Markern der Regeneration durchgeführt werden. Die Anzahl der Satellitenzellen kann durch Färbung für Pax7, den kanonischen Marker für Satellitenzellen , ausgewertet werden (Abbildung 4C,D). Drei Tage nach der Verletzung nimmt die Zahl der Satellitenzellen zu (Abbildung 4D), Satellitenzellen befinden sich nicht mehr unter der Basallamina. Um den Regenerationsprozess weiter zu analysieren, können neu gebildete Myofiber mit Antikörpern gefärbt werden, die auf Entwicklungsmyosin gerichtet sind (Abbildung 4E). Neu gebildete Myofiber zeigen zentral gelegene Kerne und einen starken Ausdruck von entwicklungsischem Myosin. Wenn die Myofiber reifen, nimmt der Ausdruck von entwicklungsischem Myosin ab, der Durchmesser des Myofibers nimmt zu, während Die Kerne an die Peripherie der Myofiber wandern.
Der Einfluss eines einzelnen Gens auf den Regenerationsprozess kann mit transgenen Mäusen oder, wie hier durch Injektion einer selbstliefernden siRNA gezeigt wird, untersucht werden. Fluoreszierend bezeichnet selbstliefernde Scrambled Control siRNA wurde in den regenerierenden tibialis vorderen Muskel am Tag 3 nach der Verletzung injiziert, dem Zeitpunkt, an dem die Proliferation von Satellitenzellen ihren Höhepunkt erreicht. Zwei Tage nach der Injektion der siRNA-Satellitenzellen wurden das Vorhandensein der fluoreszierend siRNA (Abbildung 4F) analysiert. Wir analysierten, wie viele Satellitenzellen die fluoreszierend markierte siRNA zwei Tage nach der Injektion in den regenerierenden Muskel aufgenommen hatten (Abbildung 5). Etwa 75% aller Satellitenzellen im regenerierenden Muskel waren positiv für die fluoreszierend markierte siRNA. Darüber hinaus stellten wir fest, dass etwa 74 % aller regenerierenden Myofiber positiv auf die fluoreszierend markierte siRNA reagierten, was darauf hindeutet, dass entweder 74 % der regenerierenden Myofiber die siRNA in Anspruch genommen hatten oder dass siRNA-positive Satellitenzellen entweder mit sich gegenseitig neue Myofiber zu bilden oder diese Fusion mit bereits bestehenden regenerierenden Myofien aufgetreten ist (Abbildung 5). Dies deutet darauf hin, dass Satellitenzellen die selbstliefernde siRNA aufnehmen und dass die siRNA mindestens zwei Tage in den Satellitenzellen verbleibt.
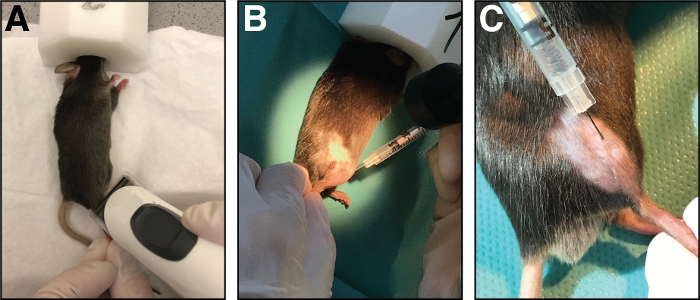
Abbildung 1: Injektion von Kardiotoxin in den tibialis vorderen Muskel. (A) Mäuse werden durch Einatmen von Isofluran befruchtet und die untere Extremität rasiert. (B) Eine 29 G Nadel wird in den tibialis vorderen Muskel (C) injiziert und während der Injektion der Kardiotoxinlösung entlang des Tibiaknochens bewegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schritte bei der Zerlegung und dem Einfrieren des verletzten tibialis vorderen Muskels. (A) Die Hinterbeinige Muskeln sind exponiert (B) und die Faszien um den tibialis vorderen Muskel werden gerissen, um den Muskel freizulegen. (C) Nach dem Entfernen des Muskels wird er im mittleren Bauchbereich mit einer scharfen geraden Schere in zwei Hälften ähnlicher Größe geschnitten (D). (E) Die Hälften des sezierten Muskels sind in eine Aluminiumfolienform eingebettet, die mit Gefrierlösung gefüllt und in flüssigem Stickstoff eingefroren ist (F). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Ausrüstung und Schritte, die an der Kryosektion der tibialis vorderen Muskeln beteiligt sind. (A) Die Kammertemperatur des Kryostats ist auf -21 °C eingestellt. (B) Der tibialis vordere Muskel in der Gefrierlösung ist auf dem Probenhalter montiert. (C) Abschnitte von 14 m Dicke sind an Glasmikroskop-Dias befestigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
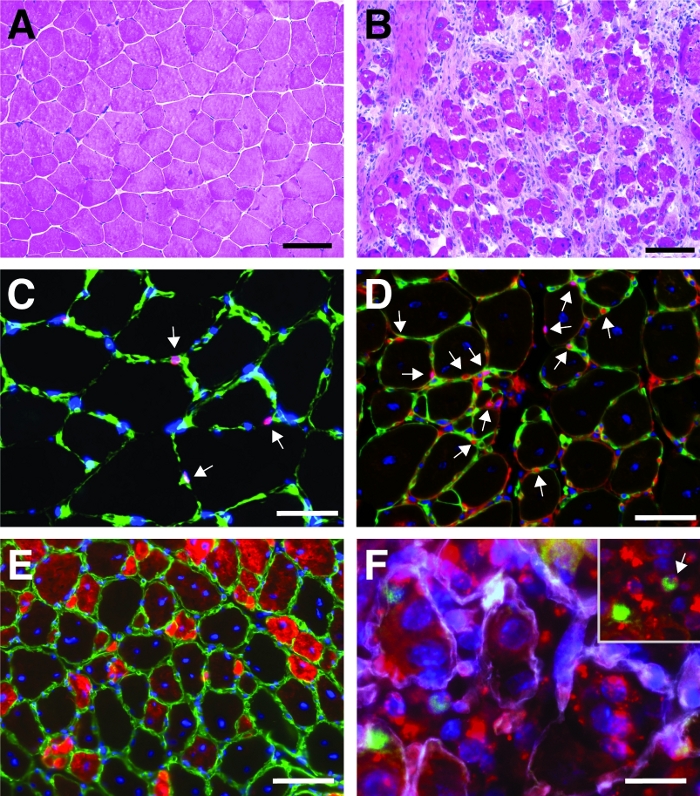
Abbildung 4: Repräsentative Bilder regenerierender tibialis vorderer Muskeln. H&E Färbung der tibialis vorderen Muskeln vor (A) und 7 Tage nach der Kardiotoxinverletzung (B). (C) Im unverletzten Muskel Pax7 positiv (in rot) satellitenzellen befinden sich unter der Basallamina durch Laminin markiert (in grün). Kerne werden mit DAPI (blau) kontert. Pax7-positive Zellen sind durch einen Pfeil gekennzeichnet. (D) Nach 10 Tagen Regeneration zeichnen sich Myofiber durch zentral gelegene Kerne (blau) aus, Pax7 ist in rot, Laminin in grün dargestellt. Pax7-positive Zellen sind durch einen Pfeil gekennzeichnet. (E) Neu gebildete Myofiber sexpressen Entwicklungsmyosin (in rot), Laminin in grün, Kerne sind mit DAPI (blau) kontrastainiert. (F) Fluoreszierend beschriftete selbstliefernde siRNA (siRED, rot dargestellt) findet sich noch 2 Tage nach Injektion der selbstliefernden siRNA in regenerierende Tibialis anterior in Satellitenzellen (Pax7-positiv, grün, markiert durch einen Pfeil im Einbau). Muskel (Injektion an Tag 3 nach kardiotoxinvermittelter Verletzung). Laminin ist weiß dargestellt, Kerne sind mit DAPI (blau) kontrastainiert. Skala bar = 100 'm (A und B), 50 'm (C-E), 25 'm (F). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
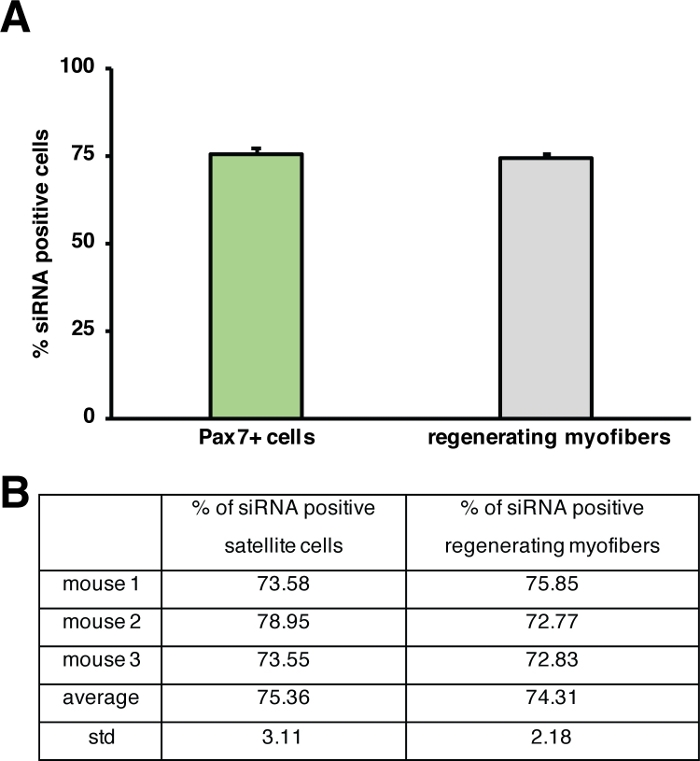
Abbildung 5: Quantifizierung der Aufnahme von fluoreszierend beschrifteter siRNA. (A) Quantifizierung der siRNA-Aufnahme durch Satellitenzellen (Pax7+-Zellen) und regenerierender Myofiber 2 Tage nach der Injektion in regenerierende Skelettmuskeln. Die Injektion erfolgte am 3. Tag nach einer kardiotoxinvermittelten Verletzung. n = 3, Fehlerbalken zeigen SEM. (B) Quantifizierung, die dem in (A) dargestellten Diagramm zugrunde liegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier stellen wir eine Methode vor, um die Funktion eines bestimmten Gens während der Regeneration des Skelettmuskels ohne transgene Tiere zu untersuchen. Dies wird durch die Kombination von Kardiotoxin induzierten Muskelverletzungen mit der Injektion einer selbsttragenden siRNA in den regenerierenden Skelettmuskel an Tag 3 nach Verletzungen erreicht. Wir haben detailliert die Verfahren der Muskelverletzung durch Kardiotoxin, die Injektion der selbstliefernden siRNA und die Verarbeitung der geernteten Muskeln beschrieben, um den Fortschritt der Regeneration zu analysieren. Wir zeigen, dass die Injektion des Schlangengiftkardiotoxins in den Skelettmuskel effektiv den gesamten Muskel verletzt und dass selbsttragende siRNAs in rund 75% aller Satellitenzellen unter anderen Zelltypen zwei Tage nach ihrer Injektion in die regenerierenden Skelettmuskel (Abbildung 4, Abbildung 5).
Besonderes Augenmerk sollte auf eine homogene Verletzung des tibialis vorderen Muskels gerichtet werden, da unterschiedliche Verletzungsgrade das Regenerationsergebnis beeinflussen und dadurch auch die Wirkung der siRNA beeinflusst werden könnte. Darüber hinaus ist es von entscheidender Bedeutung, dass der gesamte regenerierende Bereich mit der selbstliefernden siRNA injiziert wird. Für die Analyse des Regenerationsprozesses wird empfohlen, immer ähnliche Bereiche des regenerierenden Skelettmuskels zu vergleichen, daher sollte der tibialis vordere Muskel halbiert werden, um immer den mittleren Bauchbereich des Muskels zu vergleichen. Bei der Analyse des Muskels muss die gesamte Kryosektion analysiert werden, da sich die Myofiberzusammensetzung im tibialis vorderen Muskel unterscheidet und sich daher anders regenerieren könnte.
Die Funktion von Satellitenzellen kann durch verschiedene experimentelle Verfahren einschließlich ihrer Kultur auf den angrenzenden isolierten einzelmyofibers17untersucht werden, durch Transplantation und durch Dieanalyse der Regeneration des Skelettmuskels nach induzierten Verletzungen 18,19. Die Untersuchung der Funktion von Satellitenzellen mithilfe eines in vivo induzierten Verletzungsmodells, z. B. der Injektion von Kardiotoxin, bietet die Möglichkeit, die Satellitenzellfunktion auch in Bezug auf ihre Interaktion mit anderen Zelltypen wie Makrophagen und Untersuchung des Einflusses systemischer Faktoren2. Verletzungen des Skelettmuskels können auf verschiedene Weise erreicht werden, z.B. exzentrische Übung, Gefrierverletzung, Injektion von BaCl2 oder Injektion von Schlangengiften wie Kardiotoxin oder Notexin18. Während exzentrische Bewegung ist wahrscheinlich die physiologische Verletzung saniert, ist die Verletzung eines bestimmten Muskels nur begrenzt20. Frostverletzungen können angewendet werden, wenn die Migration von Satellitenzellen zum Ort der Verletzung das Ziel der Studie ist oder nur ein bestimmter Teil des Muskels verletzt werden sollte. Experimentell ist der Nachteil von Frostverletzungen die offene Operation, die durchgeführt werden muss, um die vorgekühlte Metallsonde anzuwenden. Die Injektion von BaCl2 oder Schlangengifte ist die dramatischste Verletzungsmethode, wodurch die Satellitenzellfunktion am meisten in Frage kommt. Darüber hinaus ist die Injektion minimal-invasiv, die Operationszeit beträgt im Allgemeinen weniger als fünf Minuten und beinhaltet keine Naht usw. und minimiert so das Infektionsrisiko.
Muskelverletzungen werden hauptsächlich verwendet, um die funktionellen Folgen des Verlusts von Genfunktionen zu untersuchen, z.B. Verlust von Pax77,21. Gerade wenn gealterte Mäuse im Fokus der wissenschaftlichen Frage stehen, ist die Erzeugung oder Verwendung transgener Mäuse oft nicht machbar. Die Injektion von selbstliefernden siRNAs, die auf ein bestimmtes Gen abzielen, ist in diesen Fällen eine praktikable Alternative und wurde erfolgreicheingesetzt 22. Kurz gesagt, der tibialis vordere Muskel von Mäusen wurde durch Injektion von Kardiotoxin verletzt und selbstliefernde SiRNAs gegen Fibronectin (FN) wurden am 3. Tag nach einer Verletzung injiziert. Die Muskeln wurden 10 Tage nach der Verletzung analysiert und eine signifikante Abnahme der Satellitenzellzahlen wurde bei siFN im Vergleich zu verwirrten siRNA-Kontrollbedingungen beobachtet. Die Knockdown-Effizienz wurde in ganzen Muskellysaten durch quantitative Real Time PCR 2 Tage nach siRNA-Injektion bestimmt, eine Verringerung der Expressionsniveaus von 58% wurde erreicht, was darauf hindeutet, dass die Liefer- und K.o.-Effizienz für die funktionelle analysiert22. Alternativen zum Testen der Knockdown-Effizienz sind entweder Immunoblot- oder Immunfluoreszenzanalysen mit Antikörpern, die gegen das Zielgen gerichtet sind. Die Effizienz und Spezifität der siRNA, die für In-vivo-Injektionen verwendet wird, sollte vor der Injektion in Mäuse bestimmt werden, z. B. durch Die Prüfung der Effizienz in isolierten Satellitenzellen oder primären Myoblasten. Die Verwendung eines intelligenten Pools, der aus 4 verschiedenen siRNAs im Vergleich zu einer einzelnen siRNA besteht, erhöht die Effizienz von Knockdown, erhöht aber auch das Risiko unspezifischer Targeting. Die Spezifität aller verwendeten siRNA-Sequenzen sollte in der Zellkultur getestet werden, um Off-Target-Effekte zu vermeiden. Als Kontrolle sollte eine nicht zielgerichtete Scrambled siRNA verwendet werden, da die Injektion einer siRNA per se den Regenerationsprozess durch die Injektion und damit zusätzliche Schäden des Muskels beeinflussen könnte. Der Zeitpunkt der Injektion der siRNA hängt von der wissenschaftlichen Frage und dem Expressionsprofil des Zielgens ab. Im Allgemeinen zielt eine Injektion von selbstliefernder siRNA an Tag 3 nach einer Kardiotoxinverletzung auf die meisten Gene ab, die für die Proliferation von Satellitenzellen wichtig sind, da die Proliferation von Satellitenzellen um Tag 3 nach einer Verletzung ihren Höhepunkt erreicht. Der Zeitpunkt für die erste siRNA-Injektion sollte nach einer Kardiotoxinverletzung nicht weniger als 48 h betragen, da das Injektionsvolumen von Kardiotoxin recht hoch ist und die Resorption der Flüssigkeit vor der Injektion zusätzlicher Lösungen in den Muskel hätte erfolgen müssen. Im Allgemeinen sind mehrfache Injektionen von siRNAs oder eine Kombination verschiedener siRNAs möglich, obwohl man berücksichtigen muss, dass jede Injektion in den regenerierenden Muskel zusätzliche Schäden verursacht.
Eine Einschränkung der beschriebenen Methode ist die Tatsache, dass der beobachtete Effekt nicht unbedingt nur vom Knockdown des Zielgens in Satellitenzellen abhängt, sondern auch anderen Zelltypen wie Immunzellen oder fibro-adipogenen Vorläuferzellen zugeschrieben werden könnte. Daher ist es notwendig, diese Experimente mit Experimenten zu kombinieren, die eine reine Population von Satellitenzellen untersuchen. Man kann entweder Experimente mit schwimmenden Myofiberkulturen durchführen, bei denen Satellitenzellen auf ihren angrenzenden Myofibern kultiviert werden, oder Transplantationsexperimente mit isolierten Satellitenzellen durchführen17.
Eine Alternative zur Injektion von selbstliefernden siRNAs ist die Injektion von kleinen Molekülinhibitoren oder rekombinanten Proteinen, die je nach wissenschaftlicher Frage durchgeführt werden können. Zum Beispiel wurde die Injektion des extrazellulären Matrixproteins Fibronectin oder kleiner Molekülinhibitoren der JAK/STAT-Signalisierung bei gealterten Mäusen15,16erfolgreich durchgeführt. Die Analyse einer bestimmten Genfunktion in einem bestimmten Zelltyp während der Regeneration des Skelettmuskels, z.B. in Satellitenzellen, ist nur durch den Einsatz eines induzierbaren genetischen Mausmodells möglich. Injektionen von selbst liefernden siRNAs, rekombinanten Proteinen oder kleinen Molekülinhibitoren könnten mehrere Zelltypen bei regenerierenden Skelettmuskeln beeinflussen.
Offenlegungen
Wir danken Christina Picker und Christine Poser für die hervorragende technische Unterstützung und Saskia Steiner für die Unterstützung bei der Bestimmung der siRNA-Transfektionseffizienz. Wir danken der Kerndienst-Histologie für die tolle technische Unterstützung, insbesondere Sabine Landmann und Linda Rothenburger. Wir danken auch der Tieranlage Maus am FLI für die hervorragende Unterstützung. Diese Arbeit wurde durch Zuschüsse der Deutschen Forschungsgemeinschaft (MA-3975/2-1) und der Deutschen Krebshilfe (DKH-JvM-861005) an J.v.M. unterstützt.
Danksagungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Materialien
| Name | Company | Catalog Number | Comments |
| Isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| Shaver for rodents | isis | GT420 | |
| Cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| Insulin syringe (29 g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| Laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 |
Referenzen
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198(2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten