Method Article
Análisis de la función de células satelitales durante la regeneración muscular esquelética por lesión de cardiotoxina e inyección de siRNA autoentregado In Vivo
* Estos autores han contribuido por igual
En este artículo
Resumen
Describimos un método in vivo para investigar la pérdida funcional de un gen específico en células satélite mediante el uso de una combinación de lesión mediada por cardiotoxina del músculo esquelético y la inyección de un siRNA autosuficiente.
Resumen
El músculo esquelético posee una enorme capacidad para regenerarse después de una lesión. Este proceso es impulsado principalmente por células madre musculares, también llamados células satélite. Las células satelitales se caracterizan por la expresión del factor de transcripción Pax7 y su ubicación debajo de la lámina basal en el músculo esquelético en reposo. Tras lesiones, las células satélite se activan, se auto-renovan o diferencian para formar nuevas miofibers o para fusionarse con las dañadas. La funcionalidad de las células satélite in vivo se puede investigar utilizando un modelo de lesión basada en cardiotoxinas del músculo esquelético. Para estudiar la función de un gen durante la regeneración del músculo esquelético, se utilizan principalmente modelos de ratón transgénicos. Aquí, presentamos un método alternativo a los ratones transgénicos, para investigar la función génica en las células satélite durante la regeneración, por ejemplo, en los casos en que no hay ratones transgénicos disponibles. Combinamos la lesión mediada por cardiotoxina de un músculo esquelético específico con la inyección de un siRNA autoentregante en el músculo regenerador que luego es tomado por células satélite entre otras células. De este modo, proporcionamos un método para analizar la función génica en células satélite durante la regeneración en condiciones fisiológicas sin necesidad de ratones transgénicos.
Introducción
El músculo esquelético es el tejido más grande del cuerpo que representa aproximadamente el 40% del peso corporal total, lo que permite la locomoción voluntaria. La arquitectura tisular del músculo esquelético se compone principalmente de miofibras multinucleadas, diferenciadas terminalmente, y varias otras células del sistema nervioso periférico, el sistema vascular y las células intersticiales1. Es importante destacar que el músculo esquelético tiene una enorme capacidad para regenerar y restaurar la función tras lesiones o daños2. Este proceso depende de las células madre musculares residentes en el tejido también llamadas células satélite3,4. Las células satélite se encuentran entre la miofiber y la lámina basal y se caracterizan por la expresión del factor de transcripción Pax75,6,7. En condiciones homeostáticas, las células satélite están en reposo pero se activan debido a lesiones traumáticas, por ejemplo, a través de ejercicio excéntrico o experimentalmente a través de la inyección de la cardiopatía venenosa de serpiente6,8. Una vez activadas, las células satelitales positivas de Pax7 co-expresan MyoD y Myf5, que compromete las células madre a la diferenciación miogénica. Las células satelitales que resisten la resenreglación de los factores de compromiso conservarán su potencial de stemness y volverán a la reposo para reponer la reserva de células madre para futuras demandas. Después de la expansión de la agrupación de progenitores miogénicos, las redes transcripcionales se activan mediante factores de diferenciación como la miogenina para iniciar la salida del ciclo celular y la diferenciación terminal. Estos mioprogenitors luego se fusionan entre sí o con miofibers existentes que contribuyen a myonuclei para mantener el tamaño del dominio mionuclear. Las miofibers expresan genes de diferenciación muscular terminal como Myosin Heavy Chain. Finalmente, las miofibers recién formadas crecen y maduran para construir las unidades funcionales del músculo esquelético9,10.
La regeneración del músculo esquelético puede verse afectada por diversas afecciones, incluyendo enfermedades musculares o envejecimiento11,12, que van desde deficiencias leves a condiciones potencialmente mortales, por ejemplo, en la distrofia muscular de Duchenne13 , 14. Por lo tanto, la medicina regenerativa tiene como objetivo restaurar el tejido muscular esquelético dañado o defectuoso utilizando su poder regenerativo inherente apuntando a la función de célula sofocada por satélite15,16. Para utilizar todo su potencial se requiere una comprensión integral de las células satélite en su nicho endógeno durante la regeneración del músculo esquelético. Aunque existen enfoques experimentales para aislar las células satélite adyacentes a sus miofibers17, la complejidad completa de las interacciones celulares y sistémicas de las células satélite con su entorno sólo puede ser recapitulada in vivo. En este sentido, se ha adquirido un gran conocimiento sobre la regeneración muscular esquelética utilizando modelos de lesión del ratón2,18.
Aquí presentamos un modelo de lesión de ratón experimental específico para estudiar la regeneración mediada por células madre del daño inducido por cardiotoxinas del músculo anterior tibialis in vivo. La cardiotoxina, una toxina citolítica derivada de la serpiente que causa la despolarización de la miofibra y la necrosis, se inyecta en el músculo anterior de tibialis, lo que a su vez desencadenará la degeneración del tejido seguida de la regeneración. Para analizar la función de los genes durante la regeneración aguda, los siRNAs autosuficientes se inyectan en el día 3 después de una lesión, en el pico de la expansión de la célula satélite. Los animales experimentales se sacrifican en varios puntos de tiempo y se recogen los músculos anteriores de los tibialis. Los músculos diseccionados se congelan y procesan para una mayor crio-sección. La microscopía de inmunofluorescencia se utiliza para analizar marcadores de regeneración. Este método permite la investigación de la función de un solo gen durante la regeneración del músculo esquelético impulsada por células satelitales utilizando ratones de tipo salvaje.
Protocolo
Todos los procedimientos de los animales fueron aprobados por el Departamento de Bienestar Animal del Tresringer Landesamt f'r Lebensmittelsicherheit und Verbraucherschutz (03-048/16; TLV; Bad Langensalza, Alemania).
1. Lesión muscular inducida por cardiotoxina
NOTA: Realizar todos los experimentos con ratones vivos de acuerdo con la Ley Nacional de Bienestar Animal y bajo las condiciones asépticas apropiadas. Asimismo, el sacrificio de animales debe realizarse de conformidad con la Ley Nacional de Bienestar Animal.
- Desinfectar la caja de inhalación utilizada para la anestesia por inhalación y el área de cirugía con 70% de etanol. Coloque un paño quirúrgico estéril en la almohadilla de calentamiento donde se llevará a cabo la cirugía.
- Encienda la almohadilla de calefacción a 37 oC.
- Administrar analgésicos (p. ej., 1 mg/kg de peso corporal meloxicam por vía subcutánea) 15 minutos antes del inicio de la cirugía.
NOTA: Para un experimento típico, utilice ratones que sean al menos 6 semanas de edad, que coincidan con el sexo y que estén en una buena condición física general. - Preparar la solución de cardiotoxina (20 m en 0,9 % de NaCl), almacenar la solución a -20 oC.
- Permita que la solución de cardiotoxina alcance la temperatura ambiente (RT).
- Transfiera el ratón a la caja de inhalación e induzca anestesia con isoflurano (iniciación 3,5 – 5 % en oxígeno puro). Compruebe la profundidad de la anestesia con una falta de respuesta a un pellizco del dedo del dedo del dedo del dedo del tiempo.
- Coloque el ratón sobre una toalla de papel limpia y mantenga la anestesia con una máscara nasal (1,5 – 3 % de isoflurano en oxígeno puro). Afeitar el área de inyección de la parte inferior de la pierna craneal (de rodilla a pata, Figura 1A). Retire todo el exceso de cabello suelto.
NOTA: La separación física del área de afeitado e inyección en la habitación proporcionará condiciones más estériles para las inyecciones. - Coloque el ratón en la posición lateral reclinada en la almohadilla de calentamiento cubierta con un paño quirúrgico estéril y mantenga la anestesia con una máscara nasal (1,5 – 3% de isoflurano en oxígeno puro).
- Desinfectar el área de inyección de la parte inferior de la pierna craneal (de rodilla a pata) con 70% de etanol.
- Realice un pellizco de dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del tiempo antes de iniciar la inyección intramuscular para asegurar una profundidad adecuada de la anestesia.
- Inyectar una cardiotoxina de 50 l (20 m en 0,9% de NaCl) en el músculo anterior de tibialis utilizando una jeringa de insulina con una aguja calibre 29. Primero, perfora rinde la piel simplemente distal de la rodilla.
- Inserte la aguja completamente en el músculo (en orientación de miofibra/paralelo al hueso de la tibia) e inyecte la cardiotoxina lentamente (10-20 s) a lo largo de toda la longitud del músculo mientras mueve la aguja hacia adelante y hacia atrás para permitir una distribución uniforme de la cardiotoxina lesionar todo el músculo anterior tibialis(Figura 1B,C).
NOTA: Lesion el músculo anterior tibialis de una sola pierna, el músculo anterior tibialis contralateral puede servir como un control interno para determinar que los músculos esqueléticos no se vieron afectados patológicamente antes de la lesión cardiotoxina. - Transfiera el ratón de vuelta a su jaula colocada en una almohadilla de calentamiento y monitoree el proceso de recuperación hasta que el animal esté consciente y se vuelva ambulatorio.
NOTA: Los ratones sólo mostrarán una ligera cojera. Si los ratones cojean fuertemente y no ponen peso en la pierna en absoluto, sacrifique el ratón. - Administrar analgésicos durante los siguientes 2 días (p. ej., 1 mg/kg de peso corporal meloxicam por vía subcutánea, cada 24 h) y controlarlos semanalmente.
2. Inyección de siRNA autoentregante en el músculo anterior de Tibialis regenerador (en el día 3 después de la lesión de cardiotoxina)
- Preparar la solución de siRNA resuponiendo el siRNA (p. ej., siRNA smart pool) en 0.9% NaCl (concentración final de 2 g/L) de acuerdo con las instrucciones del fabricante.
NOTA: El siRNA se modifica químicamente para facilitar la toma pasiva por parte de las células y protegerlo de la degradación de la nucleasa. No se necesitan reactivos de transfección, lo que reduce la toxicidad. El uso de un grupo inteligente de cuatro secuencias de SIRNA independientes dirigidas al mismo gen aumenta la eficiencia de derribo. - Almacene el siRNA a -20 oC y transfiera sobre hielo a la sala de cirugía.
- Desinfectar la caja de inhalación utilizada para la anestesia por inhalación y el área de cirugía con 70% de etanol. Coloque un paño quirúrgico estéril en la almohadilla de calentamiento donde se llevará a cabo la cirugía.
- Encienda la almohadilla de calefacción a 37 oC.
- Transfiera el ratón a la caja de inhalación e induzca anestesia con isoflurano (iniciación 3,5 – 5% en oxígeno puro). Compruebe la profundidad de la anestesia con una falta de respuesta a un pellizco del dedo del dedo del dedo del dedo del tiempo.
- Coloque el ratón en la posición lateral reclinada en la almohadilla de calentamiento cubierta con un paño quirúrgico estéril y mantenga la anestesia con una máscara nasal (1,5 – 3% de isoflurano en oxígeno puro).
- Desinfectar el área de inyección de la parte inferior de la pierna craneal (de rodilla a pata).
- Realice un pellizco de dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del tiempo antes de iniciar la inyección intramuscular para asegurar una profundidad adecuada de la anestesia.
- Inyectar hasta 50 l de solución de siRNA (hasta 100 g en total en 0,9% de NaCl; dirigida contra el gen objetivo; utilizar siRNA revuelto como control) en el músculo anterior de tibialis lesionados utilizando una jeringa de insulina con una aguja de 29 G. Primero, perforar la piel simplemente distal de la rodilla, luego insertar la aguja en el músculo anterior tibialis.
- Inserte la aguja completamente en el músculo (en orientación de miofibra/paralelo al hueso de la tibia) e inyecte la solución de siRNA lentamente (10 – 20 s) a lo largo de toda la longitud del músculo mientras mueve la aguja hacia adelante y hacia atrás para permitir una distribución uniforme del siRNA a lo largo de la músculo anterior tibialis entero.
- Transfiera el ratón de vuelta a su jaula colocada en una almohadilla de calentamiento y monitoree el proceso de recuperación hasta que el animal esté consciente y se vuelva ambulatorio.
NOTA: La analgesia no está necesariamente después de la inyección de siRNA.
3. Disección del músculo anterior de Tibialis
- Preparar la solución de congelación (2 partes compuesto OCT y 1 parte 30% sacarosa en agua desionizada) al menos 12 h antes de su uso para evitar burbujas de aire.
- Prepare moldes de congelación envolviendo una lámina de aluminio alrededor de un lápiz y séllela con cinta adhesiva. Es importante que la parte inferior del molde proporcione una superficie uniforme y cerrada.
NOTA: Los moldes de congelación más pequeños permiten la congelación más rápida del músculo evitando artefactos de congelación. - Sacrificar el ratón, por ejemplo, por inhalación de CO2, en el momento respectivo de la regeneración y rociar todo el ratón y las herramientas de disección con 70% de etanol.
NOTA: La luxación cervical se puede aplicar, además, para evitar el sangrado excesivo en la pierna al aislar el músculo anterior de tibialis. - Retire el pelaje y la piel de la extremidad posterior lesionada cortando la piel en el tobillo con tijeras afiladas extra finas (borde de corte: 13 mm) y tirando hacia arriba de la piel hacia la rodilla usando fórceps.
- Para exponer el tendón anterior tibialis en el tobillo, tire de la piel restante hacia el pie o corte con tijeras afiladas.
NOTA: El ratón se puede fijar a una placa de soporte para permitir una mejor fijación. - Antes de cosechar el músculo anterior tibialis, retire la fascia usando fórceps finos (Dumont 5 o 7, recto o curvo). Pellizcar los fórceps cerrados a través de la fascia junto al hueso de la tibia en el tobillo de la pierna lesionada(Figura 2A). Mover los fórceps hacia la rodilla rompiendo así la fascia y exponiendo el músculo anterior tibialis(Figura 2B).
- Para aislar el músculo anterior de tibialis, exponga el tendón distal y agítelo con fórceps finos (Dumont 7, curvado). Cortar el tendón con tijeras de resorte (borde de corte: 5 mm, diámetro de la punta: 0,35 mm) y tire del músculo (sosteniéndolo en el tendón) hacia la rodilla.
- Para cosechar el músculo anterior tibialis, córtalo lo más cerca posible de la rodilla usando tijeras afiladas.
- Antes de congelarse, cortar el músculo anterior tibialis en la región media del vientre del músculo con tijeras rectas en dos mitades de igual tamaño para permitir el análisis de la región media del vientre(Figura 2C,D).
- Llene el molde de congelación hasta la mitad con la solución de congelación.
- Inserte las dos mitades del músculo anterior tibialis en el molde de congelación con la región media del vientre mirando hacia la parte inferior del molde(Figura 2E). Asegúrese de que las mitades anteriores de tibialis se insertan en una posición vertical apoyada contra la pared del molde de congelación para evitar la inclinación del músculo.
NOTA: Cuanto más congelante esté la solución en el molde, más tiempo tardará la congelación, aumentando así el riesgo de crioartefactos. - Sostenga el molde de congelación usando fórceps y transfiera hasta la mitad en nitrógeno líquido(Figura 2F). Asegúrese de que no haya nitrógeno líquido entrando en el molde de congelación durante el proceso de congelación.
- Observe el proceso de congelación, el medio de congelación cambia de color de transparente a blanco y se vuelve sólido. Sumerja el molde de congelación en nitrógeno líquido durante unos segundos y transfiera el molde de congelación a un congelador de -80 oC o a hielo seco para su procesamiento futuro.
- Almacene los músculos congelados en los moldes de congelación a -80 oC hasta su uso posterior.
NOTA: Los moldes de congelación encajan bien en placas de 24 pocillos o tubos de reacción de 1,5 ml que permiten el etiquetado y el almacenamiento organizado. - Manipule el músculo en los moldes de congelación para un uso posterior siempre en hielo seco.
4. Criosección de la Regeneración del Músculo Anterior tibialis
- Antes de iniciar el corte, ajuste la temperatura de la cámara del criostato a -21 oC, la temperatura del objeto a -20 oC y el espesor de corte a 10, 12 o 14 m (dependiendo de las futuras aplicaciones)(Figura 3A).
- Transfiera la muestra muscular en el molde de congelación en el criostato y déjela ajustarse a la temperatura durante varios minutos. Durante este tiempo, etiquete las diapositivas del microscopio.
- Retire la lámina alrededor del músculo incrustado usando fórceps preenfriados dentro del criostato. Evite tocar la muestra a medida que el criomedium comienza a descongelarse fácilmente.
- Monte la muestra con la región media del vientre del músculo anterior tibialis dirigido hacia arriba en el soporte de muestra de metal del criostato usando criomedium. Esto asegura que el sitio de corte del músculo (parte inferior del molde) está mirando hacia el experimentador.
- Inserte el soporte de muestra con la muestra montada en el mecanismo de sección.
NOTA: Para garantizar una sección adecuada de la muestra, utilice una cuchilla nueva antes de empezar. - En primer lugar, recortar el bloque de muestra (30 m) para obtener un plano de sección uniforme y para llegar a la región respectiva del músculo(Figura 3B).
- Después de recortar, corte secciones consecutivas del espesor respectivo (p. ej., 14 m).
- Recoja las secciones de las diapositivas de vidrio del microscopio sosteniendo la diapositiva boca abajo sobre la sección. La sección se adjunta a la diapositiva (Figura 3C).
- Almacene las secciones a -80 oC o -20 oC hasta su uso posterior o uso directo para la inmunofluorescencia o la inmunohistoquímica.
5. Inmunostaining para marcadores de regeneración
- Realice todos los pasos adicionales en una cámara humidificada.
- Brevemente, equilibre las secciones a temperatura ambiente.
- Arreglar secciones con 1 ml de 2% de PFA (en PBS, pH 7.4) por diapositiva durante 5 min en RT.
- Retire la solución de PFA al 2% vertándola en el contenedor de residuos respectivo.
- Lavar 3 veces con 1 ml de PBS (pH 7.4) durante 5 min a RT.
- Retire el PBS vertiéndolo en un contenedor de residuos.
- Por diapositiva, añadir 1 ml de la solución de permeabilización (0,1 % Triton X-100, 0,1 M de glicina en PBS pH 7,4) durante 10 min.
- Retire la solución de permeabilización vertiéndola en un contenedor de residuos.
- Añadir 150 s de la solución de bloqueo (M.O.M. 1:40 en PBS pH 7.4) por diapositiva y cubrir con la cubierta. Incubar durante 1 h a RT.
- Retire el cubreobjetos y la solución de bloqueo, aplique 100 ml de solución de anticuerpos primarios [PAX7, DSHB, ratón IgG1, sin diluir o devMHC, DSHB, sin diluir, ratón IgG1 y laminin (conejo, 1:1,000)] por diapositiva. Cubierta con cubreportada. Incubar O/N (durante la noche) a 4oC.
NOTA: Realice una tinción de control omitiendo los anticuerpos primarios, incubar la sección con solución de bloqueo en su lugar. - Lavar 3 veces con 1 ml de PBS (pH 7.4) durante 5 min a RT.
- Retire el PBS vertiéndolo en un contenedor de residuos.
- Añadir 100 l de la solución de anticuerpos secundaria (Alexa Fluor 546 cabra antiratón IgG1 y Alexa Fluor 488 burro anticonejo IgG en solución de bloqueo, 1: 1.000) por diapositiva y cubierta con el cubreobjetos. Incubar durante 1 h a RT.
- Incubar los portaobjetos en la oscuridad, por ejemplo, utilice una lámina de aluminio para cubrir o utilizar una cámara humidificada negra.
NOTA: A partir de ahora todos los pasos deben realizarse en condiciones de luz reducida, ya que algunos anticuerpos secundarios son sensibles a la luz. - Retire el cubreobjetos y la solución secundaria de anticuerpos.
- Lavar 3 veces con 1 ml de PBS (pH 7.4) durante 5 min a RT.
- Retire el PBS vertiéndolo en un contenedor de residuos.
- Realice la tinción dAPI añadiendo 1 ml de la solución por diapositiva a una concentración final de 10 g/ml durante 5 min a RT.
- Retire la solución de tinción DAPI vertiéndola en un contenedor de residuos.
- Lavar 3 veces con 1 mL PBS (pH 7.4) durante 5 min a RT.
- Retire completamente el PBS utilizado para el lavado.
- Aplique de 2 a 3 gotas de medio de montaje acuoso y cubra directamente la corredera con un nuevo cubreobjetos.
- Deje que las diapositivas se sequen durante 1 h en RT en la oscuridad.
- Almacene las secciones teñidas a 4 oC en la oscuridad hasta su posterior análisis utilizando un microscopio de fluorescencia.
6. Hematoxilina y Tinción de Eosina
- Realice todos los pasos adicionales en una cámara humidificada.
- Arreglar secciones con 1 ml de 2% de PFA (en PBS, pH 7.4) por diapositiva durante 5 min en RT.
- Retire la solución de PFA al 2% vertándola en el contenedor de residuos respectivo.
- Transfiera las diapositivas a un frasco de Coplin.
- Enjuague suavemente los portaobjetos con agua del grifo.
NOTA: No encienda el grifo demasiado alto, ya que podría dañar las secciones. - Transfiera los portaobjetos a la cámara humidificada. Retire el líquido.
- Aplicar 1 ml de solución de tinción de hematoxilina (Gill No 3) durante 2 min.
- Transfiera las diapositivas a un frasco de Coplin.
- Enjuague suavemente los portaobjetos con el agua del grifo hasta que los núcleos se vuelvan azules.
NOTA: No encienda el grifo demasiado alto, ya que podría dañar sus secciones. - Transfiera los portaobjetos a la cámara humidificada. Retire el líquido.
- Aplicar 1 ml de solución de Eosin Y e incubar durante 2 min.
- Transfiera las diapositivas a un frasco de Coplin.
- Enjuague suavemente los portaobjetos con agua del grifo hasta que el agua del grifo salga clara de los portaobjetos.
- Retire todo el líquido y deje que las diapositivas se sequen durante 2 min.
- Soporte en medio de montaje adecuado para inmunohistoquímica.
Resultados
Un resultado típico de una tinción de hematoxilina y eosina (H&E) de un músculo anterior tibialis antes y después de la lesión mediada por cardiotoxina se presenta en la Figura 4A,B. En los músculos de control, la arquitectura del músculo está intacta como se ve por la localización de los núcleos en la periferia de las miofibers y la falta de acumulación de células mononucleadas en el espacio intersticial(Figura 4A). 7 días después de una lesión mediada por cardiotoxina se forman nuevas miofibers marcadas por núcleos ubicados centralmente(Figura 4B). Además, se puede observar una acumulación de células mononucleadas, que consisten principalmente en células satélite, pero también células no miogénicas como las células inmunitarias. Todo el músculo debe lesionarse caracterizado por la ubicación central de todos los myonuclei y la acumulación de células mononucleadas en toda la sección muscular.
Para caracterizar la progresión y el éxito del proceso de regeneración, se pueden realizar varias tinción inmunofluorescentes utilizando marcadores de regeneración. El número de células satélite se puede evaluar mediante la tinción de Pax7, el marcador canónico para las células satélite(Figura 4C,D). Tres días después de la lesión el número de células satélite aumenta(Figura 4D),las células satélite ya no se encuentran bajo la lámina basal. Para analizar más a fondo el proceso de regeneración, las miofibers recién formadas se pueden teñir con anticuerpos dirigidos a la miosina del desarrollo(Figura 4E). Las miofibers recién formadas muestran núcleos situados en el centro y una fuerte expresión de miosina de desarrollo. A medida que las miofibers maduran, la expresión de la miosina del desarrollo disminuye, el diámetro de la miofiber aumenta mientras que los núcleos están migrando a la periferia de las miofibers.
La influencia de un solo gen en el proceso de regeneración se puede investigar utilizando ratones transgénicos o como se muestra aquí mediante la inyección de un siRNA autosuficiente. El siRNA de control codificado con etiqueta fluorescente se inyectó en el músculo anterior de tibialis regenerador esen el día 3 después de una lesión, el momento en que la proliferación de células satélite alcanza su punto máximo. Dos días después de la inyección de las células satélite siRNA se analizaron para detectar la presencia del siRNA con etiqueta fluorescente(Figura 4F). Analizamos cuántas células satélite habían tomado el siRNA con etiqueta fluorescente dos días después de la inyección en el músculo regenerador(Figura 5). Alrededor del 75% de todas las células satélite en el músculo regenerador fueron positivas para el siRNA etiquetado fluorescentemente. Además, determinamos que alrededor del 74% de todas las miofibers regeneradoras eran positivas para el siRNA con etiqueta fluorescente, lo que sugiere que el 74% de las miofibers regeneradoras habían tomado el siRNA o que las células satélite positivas con siRNA se habían fusionado con entre sí para formar nuevas miofibers o esa fusión con miofibers regeneradoras ya existentes se produjo (Figura 5). Esto sugiere que las células satélite toman el siRNA auto-entregayen y que el siRNA persiste en las células satélite durante al menos dos días.
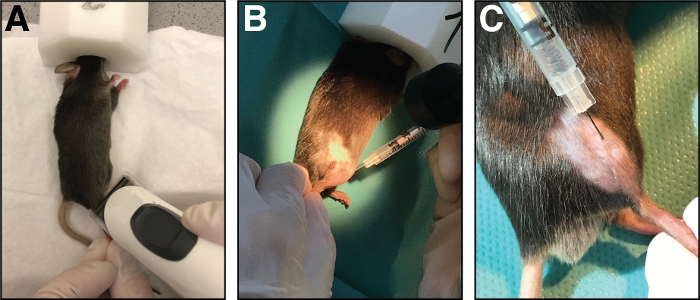
Figura 1: Inyección de cardiotoxina en el músculo anterior de tibialis. (A) Los ratones son anestesiados por inhalación de isoflurano y la extremidad inferior se ablanda. (B) Se inyecta una aguja de 29 G en el músculo anterior de tibialis(C)y se mueve a lo largo del hueso de la tibia durante la inyección de la solución de cardiotoxina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Pasos involucrados en la disección y congelación del músculo anterior tibialis lesionado. (A) Los músculos de las extremidades posteriores están expuestos (B) y la fascia que rodea el músculo anterior tibialis se rasga para exponer el músculo. (C) Después de extraer el músculo, se corta en la región media del vientre en dos mitades de tamaño similar utilizando tijeras rectas afiladas (D). (E) Las mitades del músculo diseccionado están incrustadas en un molde de aluminio lleno de solución de congelación y congelado en nitrógeno líquido (F). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Equipo y pasos involucrados en la criosección de los músculos anteriores de tibialis. (A) La temperatura de la cámara del criostato se establece en -21 oC. (B) El músculo anterior de tibialis en la solución de congelación se monta en el soporte de la muestra. (C) Las secciones de 14 m de espesor están unidas a las diapositivas del microscopio de vidrio. Haga clic aquí para ver una versión más grande de esta figura.
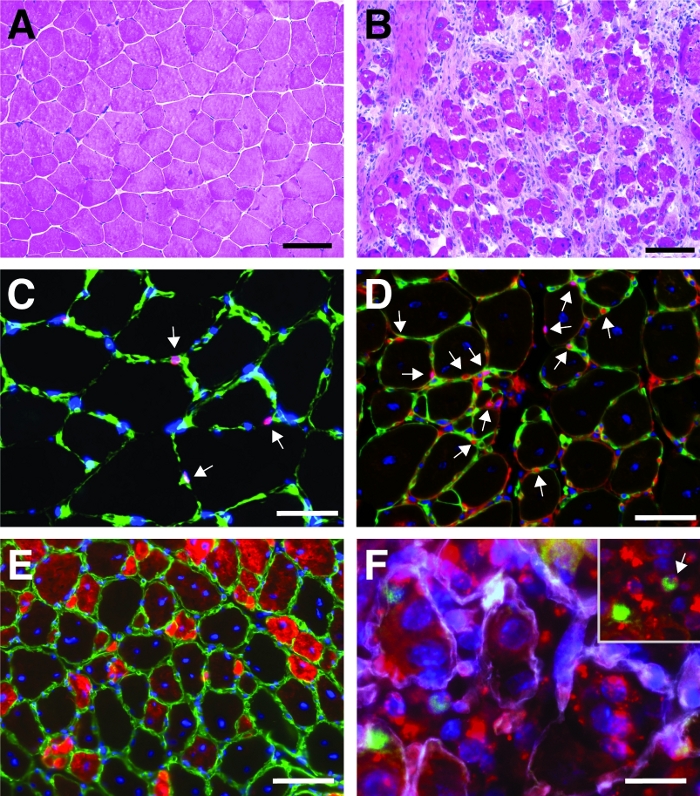
Figura 4: Imágenes representativas de los músculos anteriores tibialis regeneradores. Tinción de H&E de los músculos anteriores de tibialis antes (A) y 7 días después de la lesión cardiotoxina (B). (C) En el músculo no lesionado Pax7 positivo (en rojo) las células satélite se encuentran debajo de la lámina basal marcada por laminina (en verde). Los núcleos están contrapuntos con DAPI (en azul). Las celdas positivas de Pax7 están marcadas por una flecha. (D) Después de 10 días de regeneración, las miofibers se caracterizan por núcleos situados en el centro (en azul), Pax7 se muestra en rojo, laminina en verde. Las celdas positivas de Pax7 están marcadas por una flecha. (E) Las miofibers recién formadas expresan miosina de desarrollo (en rojo), laminina en verde, los núcleos se contratienen con DAPI (en azul). (F) SiRNA autoentregado con etiqueta fluorescente (siRED, representado en rojo) todavía se encuentra en las células satélite (Pax7 positivo, en verde, marcado por una flecha en el recuadro) 2 días después de la inyección del siRNA autoentregante en tibialis regeneradores anteriores músculo (inyección en el día 3 después de una lesión mediada por cardiotoxina). Laminin se muestra en blanco, los núcleos se contratienen con DAPI (en azul). Barra de escala a 100 m (A y B), 50 m (C-E), 25 m (F). Haga clic aquí para ver una versión más grande de esta figura.
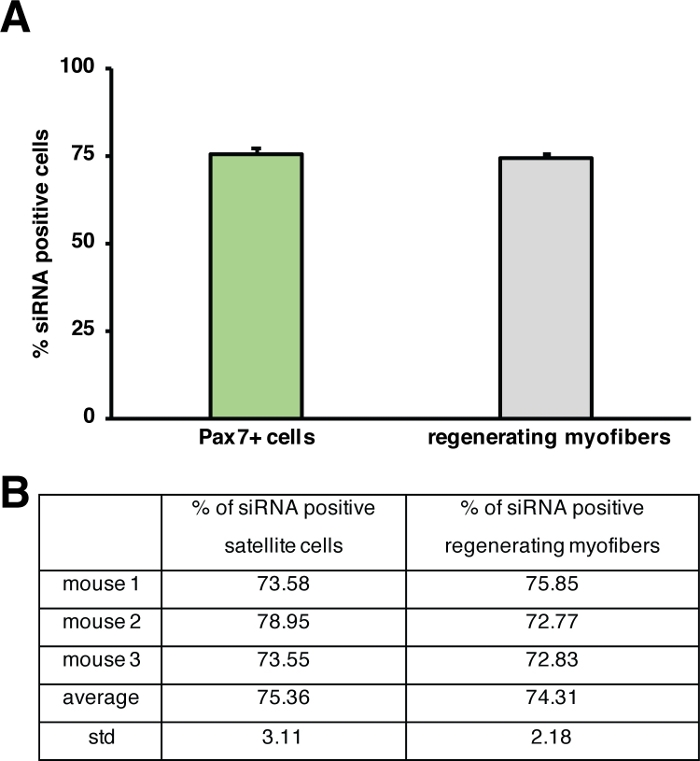
Figura 5: Cuantificación de la absorción de siRNA con etiqueta fluorescente. (A) Cuantificación de la acumulación de siRNA por células satélite (células Pax7+) y regeneración de miofibers 2 días después de la inyección en el músculo esquelético regenerador. La inyección se realizó en el día 3 después de una lesión mediada por cardiotoxina. n . 3, las barras de error muestran sem. (B) Cuantificación subyacente al gráfico representado en (A). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí presentamos un método para investigar la función de un gen específico durante la regeneración del músculo esquelético sin necesidad de animales transgénicos. Esto se logra mediante la combinación de una lesión muscular inducida por cardiotoxina con la inyección de un siRNA autoentregante en el músculo esquelético regenerador en el día 3 después de la lesión. Hemos descrito en detalle los procedimientos de lesión muscular por cardiotoxina, la inyección del siRNA auto-entrega y el procesamiento de los músculos cosechados para analizar el progreso de la regeneración. Demostramos que la inyección de la serpiente veneno cardiotoxina en el músculo esquelético daña eficazmente todo el músculo y que los siRNAs auto-entregados se encuentran en alrededor del 75% de todas las células satélite entre otros tipos de células dos días después de su inyección en el regeneración del músculo esquelético(Figura 4, Figura 5).
Se debe prestar especial atención a una lesión homogénea del músculo anterior de los tibialis, ya que diversos grados de lesión influyen en el resultado de la regeneración y, por lo que también, el efecto del SIRNA podría verse afectado. Además, es de vital importancia que toda el área regeneradora se inyecte con el siRNA autoentregante. Para el análisis del proceso de regeneración, se recomienda comparar siempre áreas similares del músculo esquelético regenerador, por lo tanto, el músculo anterior tibialis debe cortarse por la mitad para comparar siempre la región del vientre medio del músculo. Al analizar el músculo, toda la criosección necesita ser analizada ya que la composición de la miofibra difiere en el músculo anterior tibialis y por lo tanto podría regenerarse de manera diferente.
La función de las células satélite puede ser investigada por varios procedimientos experimentales incluyendo su cultivo en las miofibers individuales aisladas adyacentes17,por trasplante y analizando la regeneración del músculo esquelético después de una lesión inducida 18,19. Investigar la función de las células satélite mediante el uso de un modelo de lesión inducida in vivo, por ejemplo, inyección de cardiotoxina, proporciona la capacidad de analizar la función de las células satélite también en términos de su interacción con otros tipos de células como macrófagos y investigación de la influencia de los factores sistémicos2. La lesión del músculo esquelético se puede realizar por diversos medios, por ejemplo, ejercicio excéntrico, lesión por congelación, inyección de BaCl2 o inyección de venenos de serpiente como cardiotoxina o noexin18. Mientras que el ejercicio excéntrico es probablemente el método de lesión más fisiológica, la lesión a un músculo en particular es sólo limitada20. Las lesiones por congelación se pueden aplicar cuando la migración de células satélite hacia el lugar de la lesión es el objetivo del estudio o sólo una parte específica del músculo debe lesionarse. Experimentalmente la desventaja de las lesiones por congelación es la cirugía abierta que debe realizarse para aplicar la sonda de metal preenfriado. La inyección de BaCl2 o venenos de serpiente es el método más dramático de lesión, lo que desafía la mayor función de células satelitales. Además, la inyección es mínimamente invasiva, el tiempo de cirugía, en general, es inferior a cinco minutos y no implica sutura, etc. minimizando así el riesgo de infecciones.
La lesión muscular se utiliza principalmente para investigar las consecuencias funcionales de la pérdida de funciones genéticas, por ejemplo, la pérdida de Pax77,21. Especialmente si los ratones envejecidos son el foco de la cuestión científica, la generación o el uso de ratones transgénicos a menudo no es factible. La inyección de siRNAs autoentregables dirigida a un gen específico es una alternativa viable en esos casos y se ha utilizado con éxito22. En resumen, el músculo anterior de los tibialis de los ratones se lesionó por inyección de cardiotoxina y siRNAs autoentregados dirigidos contra la fibronectina (FN) se inyectaron en el día 3 después de una lesión. Los músculos se analizaron 10 días después de una lesión y se observó una disminución significativa en el número de células satelitales en las condiciones de control de siFN en comparación con el siRNA revuelto. La eficiencia de derribo se determinó en los grupos musculares enteros mediante PCR cuantitativo en tiempo real 2 días después de la inyección de siRNA, se logró una reducción en los niveles de expresión del 58% lo que sugiere que la eficiencia de entrega y derribo son suficientes para la funcionalidad análisis22. Las alternativas para probar la eficiencia de derribo son análisis de inmunoblot o inmunofluorescencia con anticuerpos dirigidos contra el gen objetivo. La eficiencia y especificidad del siRNA utilizado para las inyecciones in vivo debe determinarse antes de la inyección en ratones, por ejemplo, probando la eficiencia en células satélite aisladas o mioblastos primarios. El uso de una piscina inteligente que consta de 4 siRNAs diferentes frente a un solo siRNA aumenta la eficiencia del derribo, pero también aumenta el riesgo de segmentación inespecífica. La especificidad de todas las secuencias de siRNA utilizadas debe probarse en el cultivo celular para evitar efectos fuera de destino. Como control, se debe utilizar un siRNA revuelto no objetivo ya que la inyección de un siRNA per se podría influir en el proceso de regeneración debido a la inyección y, por lo tanto, daño adicional del músculo. El punto de tiempo de inyectar el siRNA depende de la cuestión científica y del perfil de expresión del gen objetivo. Generalmente, una inyección de siRNA autosuficiente en el día 3 después de la lesión de cardiotoxina se dirige a la mayoría de los genes importantes para la proliferación de células satelitales, ya que la proliferación de células satelitales alcanza su punto máximo alrededor del día 3 después de una lesión. El punto de tiempo para la primera inyección de siRNA no debe ser inferior a 48 h después de una lesión de cardiotoxina, ya que el volumen de inyección de cardiotoxina es bastante alto y la reabsorción del líquido debe haber tenido lugar antes de inyectar soluciones adicionales en el músculo. En general, múltiples inyecciones de siRNAs o una combinación de diferentes siRNAs es posible aunque uno debe considerar que cada inyección en el músculo regenerador está causando daño adicional.
Una limitación del método descrito es el hecho de que el efecto observado no es necesariamente sólo dependiendo de la desconexión del gen diana en las células satélite, sino que podría atribuirse a otros tipos de células como las células inmunitarias o las células progenitoras fibro-adipogénicas. Por lo tanto, es necesario combinar esos experimentos con experimentos que investigan una población pura de células satélite. Uno puede realizar experimentos utilizando cultivos flotantes de miofibra, donde las células satélite se cultivan en sus miofibers adyacentes o realizar experimentos de trasplante utilizando células satélite aisladas17.
Una alternativa a la inyección de siRNAs auto-entregados es la inyección de pequeños inhibidores de moléculas o proteínas recombinantes que se pueden realizar, dependiendo de la cuestión científica. Por ejemplo, la inyección de la matriz extracelular de fibronectina o inhibidores de moléculas pequeñas de señalización JAK/STAT se ha realizado con éxito en ratones envejecidos15,16. El análisis de una función génica particular en un tipo de célula específica durante la regeneración del músculo esquelético, por ejemplo, en células satélite, sólo es posible mediante el uso de un modelo de ratón genético inducible. Las inyecciones de siRNAs autoentregables, proteínas recombinantes o inhibidores de moléculas pequeñas pueden afectar a múltiples tipos de células en la regeneración del músculo esquelético.
Divulgaciones
Nos gustaría agradecer a Christina Picker y Christine Poser por su excelente asistencia técnica y a Saskia Steiner por su ayuda con la determinación de la eficiencia de la transfección de siRNA. Agradecemos al servicio principal histología por su gran apoyo técnico, especialmente a Sabine Landmann y Linda Rothenburger. También agradecemos al ratón de la instalación animal en el FLI por su excelente apoyo. Este trabajo fue apoyado por subvenciones de la Deutsche Forschungsgemeinschaft (MA-3975/2-1) y la Deutsche Krebshilfe (DKH-JvM-861005) a J.v.M.
Agradecimientos
Los autores no declaran intereses financieros en competencia.
Materiales
| Name | Company | Catalog Number | Comments |
| isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| shaver for rodents | isis | GT420 | |
| cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| insulin syringe (29g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 | |
Referencias
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198 (2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados