Method Article
Analyse de la fonction des cellules satellitaires pendant la régénération musculaire squelettique par des lésions cardiotoxines et l'injection de siRNA In Vivo
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons une méthode in vivo pour étudier la perte fonctionnelle d'un gène spécifique dans les cellules satellites en utilisant une combinaison de la blessure médiée par cardiotoxine du muscle squelettique et l'injection d'un siRNA auto-livrant.
Résumé
Le muscle squelettique possède une énorme capacité à se régénérer après une blessure. Ce processus est principalement piloté par des cellules souches musculaires, également appelées cellules satellites. Les cellules satellites sont caractérisées par l'expression du facteur de transcription Pax7 et leur emplacement sous la lame basale dans le muscle squelettique au repos. Lors d'une blessure, les cellules satellites s'activent, subissent un auto-renouvellement ou une différenciation pour former de nouvelles myofibres ou fusionner avec des cellules endommagées. La fonctionnalité des cellules satellites in vivo peut être étudiée à l'aide d'un modèle de blessure à base de cardiotoxine du muscle squelettique. Pour étudier la fonction d'un gène pendant la régénération du muscle squelettique, des modèles de souris transgéniques sont principalement utilisés. Ici, nous présentons une méthode alternative aux souris transgéniques, pour étudier la fonction génique dans les cellules satellites pendant la régénération, par exemple, dans les cas où les souris transgéniques ne sont pas disponibles. Nous combinons la blessure médiée par cardiotoxine d'un muscle squelettique spécifique avec l'injection d'un siRNA auto-livrant dans le muscle régénérant qui est alors pris par des cellules satellites parmi d'autres cellules. Par conséquent, nous fournissons une méthode pour analyser la fonction génique dans les cellules satellites pendant la régénération dans des conditions physiologiques sans avoir besoin de souris transgéniques.
Introduction
Le muscle squelettique est le plus grand tissu du corps représentant environ 40% du poids total du corps permettant la locomotion volontaire. L'architecture tissulaire du muscle squelettique est principalement composée de myofibres postmitotiques, terminalement différenciées, multinucléées ainsi que de diverses autres cellules du système nerveux périphérique, du système vasculaire et des cellules interstitiels1. Fait important, le muscle squelettique a une capacité énorme de régénérer et de restaurer la fonction sur les blessures ou les dommages2. Ce processus dépend des cellules souches musculaires résidentes de tissu également appelées cellules satellites3,4. Les cellules satellites sont situées entre la myofibre et la lame basale et caractérisées par l'expression du facteur de transcription Pax75,6,7. Dans des conditions homéostatiques, les cellules satellites sont calmes mais s'activent en raison de blessures traumatiques, par exemple, par l'exercice excentrique ou expérimentalement par injection de la cardiotoxine de venin de serpent6,8. Une fois activées, les cellules satellites positives Pax7 co-expriment MyoD et Myf5, qui engage les cellules souches à la différenciation myogénique. Les cellules satellites qui résistent à l'upregulation des facteurs d'engagement conserveront leur potentiel de tige et reviendront à la quiétude pour reconstituer le pool de cellules souches pour les demandes futures. Après l'expansion du pool d'ancêtres myogéniques, les réseaux transcriptionnels sont activés par des facteurs de différenciation comme la myogénine pour initier la sortie du cycle cellulaire et la différenciation terminale. Ces myogènes fusionnent ensuite les uns aux autres ou aux myofibres existantes contribuant myonuclei pour maintenir la taille du domaine myonucléaire. Les myofibers expriment des gènes de différenciation musculaire terminale comme Myosin Heavy Chain. Enfin, les myofibres nouvellement formées se développent et mûrissent pour construire les unités fonctionnelles du muscle squelettique9,10.
La régénération du muscle squelettique peut être affectée par diverses conditions comprenant des maladies de muscle ou vieillissement11,12,s'étendant des affaiblissements doux aux conditions représentant un danger pour la vie, par exemple, dans la dystrophie musculaire de Duchenne13 , 14. Par conséquent, la médecine régénérative vise à restaurer les tissus musculaires squelettiques endommagés ou défectueux en utilisant sa puissance régénératrice inhérente en ciblant la fonction cellulaire satellite15,16. Pour utiliser son plein potentiel, une compréhension complète des cellules satellites dans leur niche endogène lors de la régénération du muscle squelettique est nécessaire. Bien qu'il existe des approches expérimentales pour isoler les cellules satellites adjacentes à leurs myofibres17, la complexité complète des interactions cellulaires et systémiques des cellules satellites avec leur environnement ne peut être récapitulée qu'in vivo. À cet égard, une grande connaissance de la régénération des muscles squelettiques a été acquise à l'aide de modèles de blessures de souris2,18.
Ici nous introduisons un modèle expérimental spécifique de blessure de souris pour étudier la régénération médiée de cellules souches des dommages cardiotoxine-induits du muscle antérieur de tibialis in vivo. La cardiotoxine, une toxine cytolytique dérivée du serpent qui provoque la dépolarisation et la nécrose myofibres, est injectée dans le muscle antérieur de la tibialis, qui à son tour déclenchera la dégénérescence tissulaire suivie de la régénération. Pour analyser la fonction des gènes pendant la régénération aigue, les siARN auto-livrants sont injectés au jour 3 après la blessure, au plus fort de l'expansion des cellules satellites. Les animaux expérimentaux sont sacrifiés à divers moments et les muscles antérieurs de tibialis sont rassemblés. Les muscles disséqués sont congelés et traités pour une cryo-sectionnement ultérieur. La microscopie d'immunofluorescence est alors employée pour analyser des marqueurs de régénération. Cette méthode permet d'enquêter sur la fonction d'un seul gène pendant la régénération par cellule satellite du muscle squelettique à l'aide de souris de type sauvage.
Protocole
Toutes les procédures relatives aux animaux ont été approuvées par le Département du bien-être animal de la ville de L'Homme landesamt f'r Lebensmittelsicherheit und Verbraucherschutz (03-048/16; TLV; Bad Langensalza, Allemagne).
1. Blessures musculaires induites par la cardiotoxine
REMARQUE: Effectuer toutes les expériences impliquant des souris vivantes conformément à la Loi nationale sur le bien-être des animaux et dans des conditions aseptiques appropriées. De plus, le sacrifice d'animaux doit être effectué conformément à la Loi nationale sur le bien-être des animaux.
- Désinfecter la boîte d'inhalation utilisée pour l'anesthésie par inhalation et la zone de chirurgie avec 70% d'éthanol. Placez un chiffon chirurgical stérile sur le coussin chauffant où la chirurgie aura lieu.
- Allumez le coussin chauffant à 37 oC.
- Administrer des analgésiques (p. ex., 1 mg/kg de méloxicam corporel sous-cutané) 15 minutes avant le début de la chirurgie.
REMARQUE: Pour une expérience typique, utilisez des souris qui sont au moins 6 semaines, sexe assorti et dans une bonne condition physique générale. - Préparer la solution de cardiotoxine (20 M en 0,9 % NaCl), stocker la solution à -20 oC.
- Laissez la solution de cardiotoxine atteindre la température ambiante (RT).
- Transférer la souris dans la boîte d'inhalation et induire une anesthésie avec de l'isoflurane (initiation 3,5 à 5 % en oxygène pur). Vérifiez la profondeur de l'anesthésie avec un manque de réponse à une pincée d'orteil.
- Placez la souris sur un essuie-tout propre et maintenez l'anesthésie avec un masque nasal (1,5 à 3 % d'isoflurane en oxygène pur). Raser la zone d'injection de la jambe inférieure crânienne (du genou à la patte, figure 1A). Enlever tous les poils lâches excessifs.
REMARQUE: La séparation physique de la zone de rasage et d'injection dans la pièce fournira des conditions plus stériles pour les injections. - Placez la souris en position latérale couchée sur le coussin chauffant recouvert d'un tissu chirurgical stérile et maintenez l'anesthésie avec un masque nasal (1,5 à 3 % d'isoflurane en oxygène pur).
- Désinfecter la zone d'injection de la jambe inférieure crânienne (du genou à la patte) avec 70% d'éthanol.
- Effectuer une pincée d'orteil avant de commencer l'injection intramusculaire pour assurer une profondeur adéquate de l'anesthésie.
- Injecter 50 cardiotoxines ll (20 m en 0,9 % De NaCl) dans le muscle antérieur du tibialis à l'aide d'une seringue à insuline munie d'une aiguille de calibre 29. Tout d'abord, percer la peau juste distal du genou.
- Insérez l'aiguille entièrement dans le muscle (dans l'orientation myofibre/parallèle à l'os du tibia) et injectez la cardiotoxine lentement (10-20 s) le long de la longueur complète du muscle tout en déplaçant l'aiguille d'avant en arrière pour permettre une distribution égale de la cardiotoxine ainsi blessant l'ensemble du muscle antérieur du tibialis (Figure 1B,C).
REMARQUE: Blesser le muscle antérieur de tibialis d'une seule jambe, le muscle antérieur contralatéral de tibialis peut servir de contrôle interne pour déterminer que les muscles squelettiques n'ont pas été pathologiquement affectés avant des dommages de cardiotoxine. - Transférer la souris dans sa cage placée sur un coussin chauffant et surveiller le processus de récupération jusqu'à ce que l'animal soit conscient et devienne ambulatoire.
REMARQUE: Les souris ne montreront qu'une légère boiterie. Si les souris boitent fortement et ne mettent pas de poids sur la jambe du tout, sacrifiez la souris. - Administrer les analgésiques pendant les 2 jours suivants (p. ex., 1 mg/kg de méloxicam de poids corporel sous-cutané, toutes les 24 h) et les surveiller sur une base hebdomadaire.
2. Injection de siRNA auto-livrant dans le muscle antérieur de Tibialis régénérant (au jour 3 blessure de cardiotoxine de poteau)
- Préparer la solution siRNA en rependant le siRNA (p. ex., piscine intelligente siRNA) dans 0,9 % de NaCl (concentration finale de 2 g/L) selon les instructions du fabricant.
REMARQUE: Le siRNA est chimiquement modifié pour faciliter l'apport passif par les cellules et le protéger contre la dégradation de la nucléase. Aucun réactif de transfection n'est nécessaire, réduisant ainsi la toxicité. L'utilisation d'un pool intelligent de quatre séquences de siRNA indépendantes ciblant le même gène augmente l'efficacité de knockdown. - Conserver le siRNA à -20 oC et le transférer sur glace à la salle de chirurgie.
- Désinfecter la boîte d'inhalation utilisée pour l'anesthésie par inhalation et la zone de chirurgie avec 70% d'éthanol. Placez un chiffon chirurgical stérile sur le coussin chauffant où la chirurgie aura lieu.
- Allumez le coussin chauffant à 37 oC.
- Transférer la souris dans la boîte d'inhalation et induire l'anesthésie avec de l'isoflurane (initiation 3,5 à 5% en oxygène pur). Vérifiez la profondeur de l'anesthésie avec un manque de réponse à une pincée d'orteil.
- Placez la souris en position latérale couchée sur le coussin chauffant recouvert d'un tissu chirurgical stérile et maintenez l'anesthésie avec un masque nasal (1,5 à 3 % d'isoflurane en oxygène pur).
- Désinfecter la zone d'injection de la jambe inférieure crânienne (du genou à la patte).
- Effectuer une pincée d'orteil avant de commencer l'injection intramusculaire pour assurer une profondeur adéquate de l'anesthésie.
- Injecter jusqu'à 50 l de solution siRNA (jusqu'à 100 g au total en 0,9 % NaCl; dirigé contre le gène cible; utiliser le siRNA brouillé comme contrôle) dans le muscle antérieur tibialis blessé à l'aide d'une seringue à insuline avec une aiguille de 29 G. Tout d'abord, percer la peau juste distal du genou, puis insérer l'aiguille dans le muscle antérieur tibialis.
- Insérez l'aiguille entièrement dans le muscle (dans l'orientation myofibre/parallèle à l'os du tibia) et injectez la solution de siRNA lentement (10 - 20 s) le long de la longueur complète du muscle tout en déplaçant l'aiguille d'avant en arrière pour permettre une distribution égale du siRNA le long de la tibialis muscle antérieur.
- Transférer la souris dans sa cage placée sur un coussin chauffant et surveiller le processus de récupération jusqu'à ce que l'animal soit conscient et devienne ambulatoire.
REMARQUE: L'analgésie ne suit pas nécessairement l'injection de siRNA.
3. Dissection du muscle antérieur de Tibialis
- Préparer la solution de congélation (2 parties composé OCT et 1 partie 30% saccharose dans l'eau déionisée) au moins 12 h avant l'utilisation pour éviter les bulles d'air.
- Préparer les moules de congélation en enveloppant une feuille d'aluminium autour d'un crayon et les sceller avec du ruban adhésif. Il est important que le fond du moule offre une surface fermée uniforme.
REMARQUE: De plus petits moules de congélation permettent la congélation plus rapide du muscle évitant des artefacts de congélation. - Sacrifiez la souris, par exemple, par inhalation de CO2, au moment de régénération et pulvérisez la souris entière et les outils de dissection avec 70% d'éthanol.
REMARQUE: La dislocation cervicale peut être appliquée, en outre, pour éviter des saignements excessifs à la jambe lors de l'isoler le muscle antérieur tibialis. - Retirez la fourrure et la peau de l'arrière blessé en coupant la peau à la cheville avec des ciseaux tranchants extra fins (bord de coupe : 13 mm) et en tirant la peau vers le genou à l'aide de forceps.
- Pour exposer le tendon antérieur de tibialis à la cheville, tirez la peau restante vers le pied ou coupez avec des ciseaux pointus.
REMARQUE: La souris peut être épinglée sur un panneau de support pour permettre une meilleure fixation. - Avant de récolter le muscle antérieur de tibialis, retirez le fascia à l'aide de forceps fins (Dumont 5 ou 7, droits ou courbés). Pincez les forceps fermés à travers le fascia à côté de l'os du tibia à la cheville de la jambe blessée (Figure 2A). Déplacer les forceps vers le genou déchirant ainsi le fascia et exposant le muscle antérieur de tibialis (figure 2B).
- Pour isoler le muscle antérieur de tibialis, exposez le tendon distal et saisissez-le avec de fines forceps (Dumont 7, courbé). Couper le tendon à l'aide de ciseaux à ressort (bord de coupe : 5 mm, diamètre de la pointe : 0,35 mm) et tirer le muscle (le tenant au tendon) vers le genou.
- Pour récolter le muscle antérieur de tibialis, coupez-le aussi près que possible du genou à l'aide de ciseaux pointus.
- Avant la congélation, couper le muscle antérieur de tibialis à la région du ventre moyen du muscle avec des ciseaux droits en deux moitiés de taille égale pour permettre l'analyse de la région du ventre moyen (figure 2C,D).
- Remplissez le moule de congélation à mi-chemin avec la solution de congélation.
- Insérer les deux moitiés du muscle antérieur tibialis dans le moule gelé avec la région du ventre moyen face au fond du moule (Figure 2E). Assurez-vous que les moitiés antérieures de tibialis sont insérées dans une position verticale appuyée contre la paroi du moule gelé pour éviter le basculement du muscle.
REMARQUE: Plus la solution de congélation est dans le moule, plus la congélation prendra, augmentant ainsi le risque de cryo-artefacts. - Maintenez le moule de congélation à l'aide de forceps et transférez-le à mi-chemin dans de l'azote liquide (figure 2F). Assurez-vous qu'aucun azote liquide n'entre dans le moule de congélation pendant le processus de congélation.
- Observez le processus de congélation, le milieu de congélation change la couleur de transparent au blanc et devient solide. Submerser le moule de congélation dans de l'azote liquide pendant quelques secondes et transférer le moule de congélation dans un congélateur de -80 oC ou dans de la glace sèche pour un traitement futur.
- Conserver les muscles gelés dans les moules gelés à -80 oC jusqu'à ce qu'ils soient plus loin.
REMARQUE: Les moules de congélation s'adaptent bien dans des plaques de 24 puits ou des tubes de réaction de 1,5 ml permettant l'étiquetage et le stockage organisé. - Manipulez le muscle dans les moules de congélation pour une utilisation ultérieure toujours sur la glace sèche.
4. Cryosectioning du muscle antérieur de Tibialis régénérant
- Avant de commencer la sectionnement, fixer la température de la chambre du cryostat à -21 oC, la température de l'objet à -20 oC et l'épaisseur de coupe à 10, 12 ou 14 m (selon les applications futures) (Figure 3A).
- Transférer l'échantillon musculaire dans le moule de congélation dans le cryostat et le laisser ajuster à la température pendant plusieurs minutes. Pendant ce temps, étiquetez les lames de microscope.
- Retirez le papier d'aluminium autour du muscle incorporé à l'aide de forceps pré-réfrigérés à l'intérieur du cryostat. Évitez de toucher l'échantillon lorsque le cryomédium commence à dégeler facilement.
- Montez l'échantillon avec la région du ventre moyen du muscle antérieur tibialis dirigé vers le haut sur le support de l'échantillon métallique du cryostat à l'aide de cryomédium. Cela garantit que le site de coupe du muscle (en bas du moule) est face à l'expérimentateur.
- Insérez le support de l'échantillon avec l'échantillon monté dans le mécanisme de sectionnement.
REMARQUE: Pour assurer une section adéquate de l'échantillon, utilisez une nouvelle lame avant de commencer. - Tout d'abord, tailler le bloc d'échantillon (30 m) pour obtenir un plan de sectionnement uniforme et pour atteindre la région respective du muscle (Figure 3B).
- Après l'élagage, couper les sections consécutives de l'épaisseur respective (p. ex., 14 m).
- Recueillir les sections sur les diapositives en verre microscope en tenant la diapositive face vers le bas sur la section. La section est jointe à la diapositive (Figure 3C).
- Entreposez les sections à -80 oC ou -20 oC jusqu'à ce qu'elles soient utilisées ou qu'elles soient utilisées directement pour l'immunofluorescence ou l'immunohistochimie.
5. Immunostaining pour les marqueurs de régénération
- Effectuer toutes les étapes supplémentaires dans une chambre humidifiée.
- En bref, équilibrez les sections à température ambiante.
- Fixer les sections avec 1 ml de 2% PFA (en PBS, pH 7.4) par diapositive pendant 5 min à RT.
- Retirez la solution PFA de 2 % en la versant dans le contenant de déchets respectif.
- Laver 3 fois avec 1 ml de PBS (pH 7,4) pendant 5 min à RT.
- Retirez le PBS en le versant dans un conteneur à déchets.
- Par diapositive, ajouter 1 ml de la solution de perméabilisation (0,1 % Triton X-100, 0,1 M glycine en PBS pH 7,4) pendant 10 min.
- Retirez la solution de perméabilisation en la versant dans un contenant à déchets.
- Ajouter 150 l de la solution de blocage (M.O.M. 1:40 en PBS pH 7.4) par diapositive et couvrir avec le bordereau. Incuber pour 1 h à RT.
- Retirez le bordereau de couverture et la solution de blocage, appliquez 100 l de solution d'anticorps primaire [PAX7, DSHB, souris IgG1, non dilué ou devMHC, DSHB, non dilué, souris IgG1et laminin (lapin, 1:1,000)] par diapositive. Couvrir de couverture. Incuber O/N (nuit) à 4 oC.
REMARQUE: Effectuer une coloration de contrôle en omettant les anticorps primaires, incuber la section avec la solution de blocage à la place. - Laver 3 fois avec 1 ml de PBS (pH 7,4) pendant 5 min à RT.
- Retirez le PBS en le versant dans un contenant à déchets.
- Ajoutez 100 l de la solution d'anticorps secondaire (Alexa Fluor 546 chèvre anti-souris IgG1 et Alexa Fluor 488 âne anti-lapin IgG dans la solution de blocage, 1: 1000) par diapositive et couvrir avec le coverslip. Incuber pour 1 h à RT.
- Incuber les glissières dans l'obscurité, par exemple, utiliser une feuille d'aluminium pour couvrir ou utiliser une chambre humidifiée noire.
REMARQUE: Désormais, toutes les étapes doivent être effectuées dans des conditions de lumière réduite puisque certains anticorps secondaires sont sensibles à la lumière. - Retirez le bordereau et la solution d'anticorps secondaire.
- Laver 3 fois avec 1 ml de PBS (pH 7,4) pendant 5 min à RT.
- Retirez le PBS en le versant dans un conteneur à déchets.
- Effectuer la coloration DAPI en ajoutant 1 ml de la solution par diapositive à une concentration finale de 10 g/mL pendant 5 min à RT.
- Retirez la solution de coloration DAPI en la versant dans un conteneur à déchets.
- Laver 3 fois avec 1 mL de PBS (pH 7,4) pendant 5 min à RT.
- Retirez complètement le PBS utilisé pour le lavage.
- Appliquer 2 à 3 gouttes de milieu de montage aqueux et couvrir directement la glissière d'un nouveau bordereau.
- Laisser sécher les toboggans pendant 1 h à RT dans l'obscurité.
- Conserver les sections tachées à 4 oC dans l'obscurité jusqu'à une analyse plus approfondie à l'aide d'un microscope à fluorescence.
6. Hematoxylin et Eosin Staining
- Effectuer toutes les étapes supplémentaires dans une chambre humidifiée.
- Fixer les sections avec 1 ml de 2% PFA (en PBS, pH 7.4) par diapositive pendant 5 min à RT.
- Retirez la solution PFA de 2 % en la versant dans le contenant de déchets respectif.
- Transférer les diapositives dans un bocal Coplin.
- Rincer délicatement les toboggans à l'eau du robinet.
REMARQUE: Ne pas allumer le robinet trop haut car cela pourrait endommager les sections. - Transférer les toboggans dans la chambre humidifiée. Retirer le liquide.
- Appliquer 1 ml de solution de coloration Hematoxylin (Gill No 3) pendant 2 min.
- Transférer les diapositives dans un bocal Coplin.
- Rincer délicatement les glissières avec l'eau du robinet jusqu'à ce que les noyaux deviennent bleus.
REMARQUE: N'allumez pas le robinet trop haut car cela pourrait endommager vos sections. - Transférer les toboggans dans la chambre humidifiée. Retirer le liquide.
- Appliquer 1 ml de solution Eosin Y et incuber pendant 2 min.
- Transférer les diapositives dans un bocal Coplin.
- Rincer délicatement les glissières à l'eau du robinet jusqu'à ce que l'eau du robinet qui sort des glissières soit claire.
- Retirer tout le liquide et laisser sécher les lames pendant 2 min.
- Mont dans le milieu de montage approprié pour l'immunohistochimie.
Résultats
Un résultat typique d'une hematoxylin et d'une éosine (H et E) coloration d'un muscle antérieur tibialis avant et après la blessure médiée par cardiotoxine est présenté dans la figure 4A,B. Dans les muscles témoins, l'architecture du muscle est intacte comme en témoigne la localisation des noyaux à la périphérie des myofibres et le manque d'accumulation de cellules mononucléées dans l'espace interstitiel (Figure 4A). 7 jours après la cardiotoxine médiée blessures nouvelles myofibres sont formés marqués par des noyaux situés au centre (Figure 4B). En outre, une accumulation de cellules mononucléées peut être observée, composée principalement de cellules satellites, mais aussi de cellules non myogéniques comme les cellules immunitaires. Le muscle entier devrait être blessé caractérisé par l'emplacement central de tous les myonuclei et l'accumulation des cellules mononucléées sur toute la section de muscle.
Pour caractériser la progression et le succès du processus de régénération, plusieurs taches immunofluorescentes utilisant des marqueurs de régénération peuvent être exécutées. Le nombre de cellules satellites peut être évalué par coloration pour Pax7, le marqueur canonique pour les cellules satellites (Figure 4C,D). Trois jours après la blessure, le nombre de cellules satellites augmente(figure 4D),les cellules satellites ne sont plus situées sous la lame basale. Pour analyser davantage le processus de régénération, les myofibres nouvellement formées peuvent être tachées d'anticorps dirigés vers la myosine développementale (Figure 4E). Les myofibers nouvellement formés affichent des noyaux situés au centre et une forte expression de la myosine développementale. À mesure que les myofibres mûrissent, l'expression de la myosine développementale diminue, le diamètre de la myofibre augmente tandis que les noyaux migrent vers la périphérie des myofibres.
L'influence d'un seul gène sur le processus de régénération peut être étudiée à l'aide de souris transgéniques ou comme le montre ici l'injection d'un siRNA auto-livrant. Fluorescently étiqueté auto-livrant le siRNA brouillé de commande a été injecté dans le muscle antérieur de tibialis régénérant au jour 3 après blessure, le point de temps où la prolifération des cellules satellites culmine. Deux jours après l'injection des cellules satellites de siRNA ont été analysées pour la présence du siRNA étiqueté fluorescent(figure 4F). Nous avons analysé le nombre de cellules satellites qui avaient pris le siRNA étiqueté fluorescent deux jours après l'injection dans le muscle régénérant (Figure 5). Environ 75% de toutes les cellules satellites dans le muscle régénérant étaient positives pour le siRNA fluorescent. En outre, nous avons déterminé qu'environ 74 % de toutes les myofibres régénératrices étaient positives pour le siRNA étiqueté fluorescent, ce qui suggère que 74 % des myofibres régénératrices avaient pris le siRNA ou que les cellules satellites siRNA-positives avaient fusionné avec l'un l'autre pour former de nouveaux myofibers ou cette fusion avec des myofibers régénérants déjà existants s'est produite (Figure 5). Ceci suggère que les cellules satellites prennent le siRNA auto-livrant et que le siRNA persiste dans les cellules satellites pendant au moins deux jours.
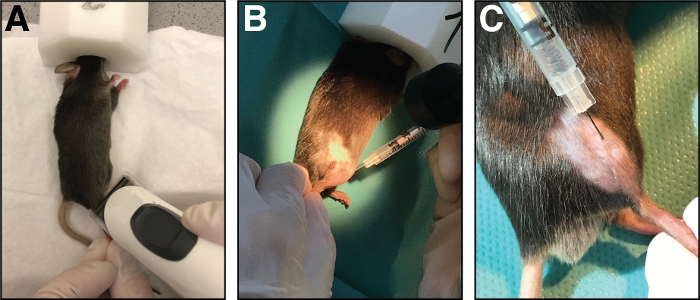
Figure 1 : Injection de cardiotoxine dans le muscle antérieur de tibialis. (A) Les souris sont anesthésiés par inhalation d'isoflurane et le membre inférieur est rasé. (B) Une aiguille de 29 G est injectée dans le muscle antérieur de tibialis (C) et déplacée le long de l'os de tibia pendant l'injection de la solution de cardiotoxine. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Étapes de dissection et de congélation du muscle antérieur du tibialis blessé. (A) Les muscles des membres postérieurs sont exposés (B) et le fascia entourant le muscle antérieur tibialis est déchiré pour exposer le muscle. (C) Après avoir enlevé le muscle, il est coupé à la région du ventre moyen en deux moitiés de taille similaire à l'aide de ciseaux droits pointus (D). (E) Les moitiés du muscle disséqué sont enchâssées dans un moule en papier d'aluminium rempli de solution de congélation et congelé dans de l'azote liquide (F). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Équipement et étapes impliqués dans la cryosection des muscles antérieurs de tibialis. (A) La température de la chambre du cryostat est fixée à -21 oC. (B) Le muscle antérieur de tibialis dans la solution de congélation est monté sur le support d'échantillon. (C) Des sections d'une épaisseur de 14 m sont fixées à des lames de microscope en verre. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
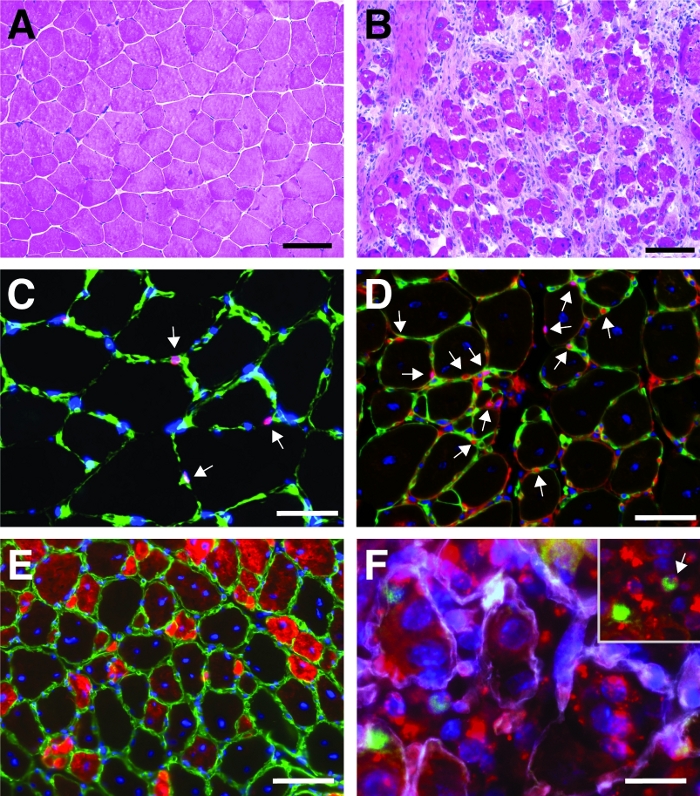
Figure 4 : Images représentatives de la régénération des muscles antérieurs de la tibialis. Coloration de la tibialis avant (A) et 7 jours après une blessure à la cardiotoxine (B). (C) Dans le muscle non blessé Pax7 positif (en rouge) cellules satellites sont situés sous la lame basale marquée par la laminin (en vert). Les noyaux sont contrecarrés avec DAPI (en bleu). Les cellules positives Pax7 sont marquées par une flèche. (D) Après 10 jours de régénération, les myofibres sont caractérisées par des noyaux situés au centre (en bleu), Pax7 est représenté en rouge, lamininin en vert. Les cellules positives Pax7 sont marquées par une flèche. (E) Les myofibres nouvellement formées expriment la myosine développementale (en rouge), la lamininentine en vert, les noyaux sont contrecarrés avec dAPI (en bleu). (F) L'ARNre auto-liivrant étiqueté fluorescent (siRED, représenté en rouge) se trouve encore dans les cellules satellites (Pax7 positif, en vert, marqué par une flèche dans l'encours) 2 jours après l'injection du siRNA auto-livrant dans la régénération tibialis antérieure (injection au jour 3 après une blessure médiée par cardiotoxine). Laminin est représenté en blanc, les noyaux sont contrecarrés avec DAPI (en bleu). Barre d'échelle de 100 m (A et B), 50 m (C-E), 25 m (F). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
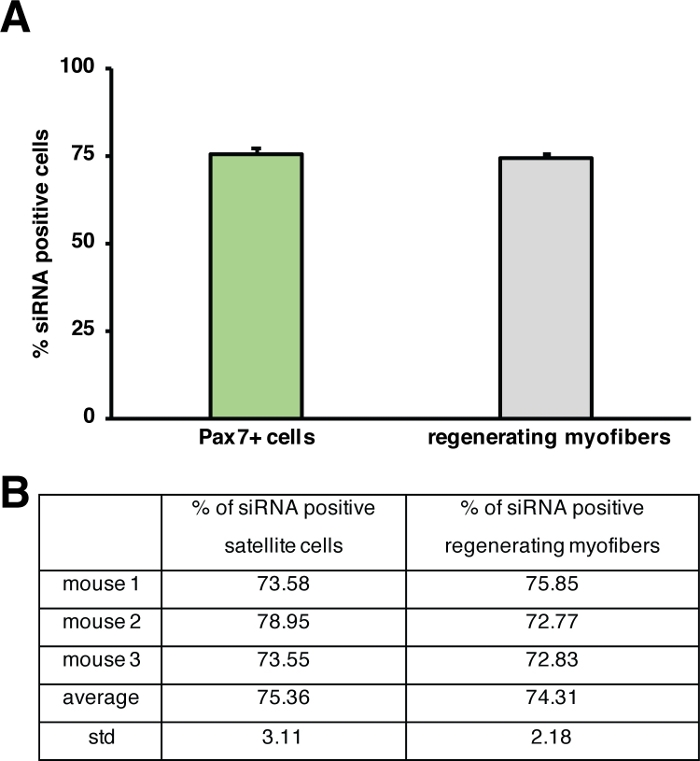
Figure 5 : Quantification de l'apport en siRNA étiquetés fluorescents. (A) Quantification de l'apport en siRNA par les cellules satellites (cellules Pax7) et régénération des myofibres 2 jours après l'injection dans la régénération du muscle squelettique. L'injection a été exécutée au jour 3 après que la blessure de médiation de cardiotoxine. n 3, les barres d'erreur montrent SEM. (B) Quantification sous-jacente au graphique représenté dans (A). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Ici nous présentons une méthode pour étudier la fonction d'un gène spécifique pendant la régénération du muscle squelettique sans avoir besoin des animaux transgéniques. Ceci est accompli par la combinaison de la cardiotoxine induite des dommages de muscle avec l'injection d'un siRNA auto-livrant dans le muscle squelettique régénérant au jour 3 après blessure. Nous avons décrit en détail les procédures des dommages de muscle par cardiotoxine, l'injection du siRNA d'auto-livraison et le traitement des muscles moissonnés pour analyser les progrès de la régénération. Nous démontrons que l'injection de la cardiotoxine de venin de serpent dans le muscle squelettique blesse effectivement le muscle entier et que les siARN auto-livrants sont trouvés dans environ 75% de toutes les cellules satellites parmi d'autres types de cellules deux jours après leur injection dans le régénérer le muscle squelettique (Figure 4, Figure 5).
Une attention particulière devrait être concentrée sur une blessure homogène du muscle antérieur de tibialis puisque des degrés variables de blessure influencent le résultat de régénération et ainsi également l'effet du siRNA pourrait être affecté. En outre, il est d'une importance cruciale que toute la zone de régénération soit injectée avec le siRNA auto-livrant. Pour l'analyse du processus de régénération, il est recommandé de toujours comparer des zones similaires du muscle squelettique régénérateur, par conséquent, le muscle antérieur tibialis doit être coupé en deux pour toujours comparer la région du ventre moyen du muscle. Lors de l'analyse du muscle, toute la cryosection doit être analysée puisque la composition de myofiber diffère dans le muscle antérieur de tibialis et pourrait donc se régénérer différemment.
La fonction des cellules satellites peut être étudiée par diverses procédures expérimentales, y compris leur culture sur les myofibers isolées adjacentes17, par transplantation et en analysant la régénération du muscle squelettique après des blessures induites 18,19. L'étude de la fonction des cellules satellitaires à l'aide d'un modèle de lésions induites in vivo, par exemple, l'injection de cardiotoxine, permet d'analyser la fonction des cellules satellitaires également en termes d'interaction avec d'autres types de cellules tels que les macrophages et l'influence des facteurs systémiques2. Les blessures du muscle squelettique peuvent être accomplies par divers moyens, par exemple, exercice excentrique, blessure de gel, injection de BaCl2 ou injection de venins de serpent tels que la cardiotoxine ou la notexine18. Alors que l'exercice excentrique est probablement la méthode de blessure la plus physiologique, la blessure à un muscle particulier est seulement limitée20. Les blessures par gel peuvent être appliquées lorsque la migration des cellules satellites vers le site de la blessure est le but de l'étude ou que seule une partie spécifique du muscle doit être blessée. Expérimentalement, l'inconvénient des blessures de gel est la chirurgie ouverte qui doit être effectuée pour appliquer la sonde métallique prérefroidie. L'injection de veins De BaCl2 ou de serpent est la méthode de blessure la plus spectaculaire, ce qui remet le plus en question la fonction des cellules satellites. En outre, l'injection est peu invasive, le temps de chirurgie, en général, est de moins de cinq minutes et ne comporte pas de suture, etc. minimisant ainsi le risque d'infections.
Les lésions musculaires sont principalement utilisées pour étudier les conséquences fonctionnelles de la perte des fonctions génétiques, par exemple, la perte de Pax77,21. Surtout si les souris âgées sont au centre de la question scientifique, la génération ou l'utilisation de souris transgéniques n'est souvent pas faisable. L'injection de siARN auto-livrants ciblant un gène spécifique est une alternative viable dans ces cas et a été utilisée avec succès22. En bref, le muscle antérieur de tibialis des souris a été blessé par injection de cardiotoxine et les siRNAs auto-livrants dirigés contre la fibronectin (FN) ont été injectés au jour 3 après des dommages. Les muscles ont été analysés 10 jours après des dommages et une diminution significative des nombres de cellules de satellite a été observée dans les conditions de commande de siFN contre brouillées de siRNA. L'efficacité de knockdown a été déterminée dans les lysates entiers de muscle par PCR en temps réel quantitatif 2 jours après injection de siRNA, une réduction des niveaux d'expression de 58% a été réalisé suggérant que la livraison et l'efficacité de knockdown sont suffisantes pour fonctionnel analyses22. Les solutions de rechange pour tester l'efficacité de knockdown sont des analyses immunoblot ou immunofluorescence avec des anticorps dirigés contre le gène cible. L'efficacité et la spécificité du siRNA utilisé pour les injections in vivo doivent être déterminées avant l'injection chez la souris, par exemple en testant l'efficacité dans des cellules satellites isolées ou des myoblastes primaires. L'utilisation d'un pool intelligent composé de 4 siRNAs différents par rapport à un seul siRNA augmente l'efficacité de knockdown mais augmente également le risque de ciblage non spécifique. La spécificité de toutes les séquences de siRNA utilisées doit être testée dans la culture cellulaire afin d'éviter les effets hors cible. Comme un contrôle, un siRNA brouillé non-ciblage devrait être utilisé puisque l'injection d'un siRNA en soi pourrait influencer le processus de régénération due à l'injection et, par conséquent, des dommages supplémentaires du muscle. Le moment d'injection du siRNA dépend de la question scientifique et du profil d'expression du gène cible. En général, une injection de siRNA auto-livrant au jour 3 après des dommages de cardiotoxine cible la plupart des gènes importants pour la prolifération de cellules satellites puisque la prolifération de cellules satellites culmine autour du jour 3 après des dommages. Le délai pour la première injection de siRNA ne devrait pas être inférieur à 48 h après une blessure cardiotoxine puisque le volume d'injection de cardiotoxine est assez élevé et la réabsorption du liquide aurait dû avoir lieu avant d'injecter des solutions supplémentaires dans le muscle. En général, des injections multiples de siARN ou une combinaison de différents siRNAs est possible, bien qu'il faut considérer que chaque injection dans le muscle régénérateur cause des dommages supplémentaires.
Une limitation de la méthode décrite est le fait, que l'effet observé n'est pas nécessairement seulement en fonction de l'élimination du gène cible dans les cellules satellites, mais pourrait être attribuée à d'autres types de cellules telles que les cellules immunitaires ou les cellules progénitrices fibro-adipogenic. Par conséquent, il est nécessaire de combiner ces expériences avec des expériences sur une population pure de cellules satellites. On peut soit effectuer des expériences à l'aide de cultures de myofibre flottantes, où les cellules satellites sont cultivées sur leurs myofibres adjacentes ou effectuer des expériences de transplantation à l'aide de cellules satellites isolées17.
Une alternative à l'injection de siARN auto-livrants est l'injection d'inhibiteurs de petites molécules ou de protéines recombinantes qui peuvent être effectuées, selon la question scientifique. Par exemple, l'injection de la fibronectine extracellulaire de protéine de matrice ou des inhibiteurs de petite molécule de la signalisation de JAK/STAT ont été avec succès exécutées chez les souris âgées15,16. L'analyse d'une fonction génétique particulière dans un type de cellule spécifique lors de la régénération du muscle squelettique, par exemple, dans les cellules satellites, n'est possible que par l'utilisation d'un modèle de souris génétique inductible. Les injections de siARN auto-livrants, de protéines recombinantes ou d'inhibiteurs de petites molécules peuvent affecter plusieurs types de cellules dans la régénération du muscle squelettique.
Déclarations de divulgation
Nous tenons à remercier Christina Picker et Christine Poser pour l'excellente assistance technique et Saskia Steiner pour leur aide dans la détermination de l'efficacité de la transfection siRNA. Nous remercions l'histologie de service de base pour le grand soutien technique, en particulier Sabine Landmann et Linda Rothenburger. Nous remercions également la souris d'installation animale au FLI pour l'excellent soutien. Ce travail a été soutenu par des subventions de la Deutsche Forschungsgemeinschaft (MA-3975/2-1) et de la Deutsche Krebshilfe (DKH-JvM-861005) à J.v.M.
Remerciements
Les auteurs ne déclarent aucun intérêt financier concurrent.
matériels
| Name | Company | Catalog Number | Comments |
| isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| shaver for rodents | isis | GT420 | |
| cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| insulin syringe (29g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 | |
Références
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198 (2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon