A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس الكمي للبروتينات التركيبية داخل الفئران
In This Article
Summary
يمكن ان تكون مستويات بروتين السائل الشوكي مرتفعه اما نتيجة لانتشار بروتين البلازما عبر حاجز الدم في الدماغ المتغيرة أو توليف داخل البراز. يتم تقديم بروتوكول الاختبار الأمثل في هذه المقالة التي تساعد علي التمييز بين الحالتين ويوفر قياسات كميه من البروتينات توليفها داخل المركبة.
Abstract
السائل النخاعي (السائل الدماغي الشوكي) ، وهو السوائل الموجودة في الدماغ والحبل الشوكي ، له اهميه كبيره للعلوم الاساسيه والسريرية علي حد سواء. تحليل تكوين بروتين السائل الدماغي الشوكي يوفر معلومات حاسمه في البحوث الاساسيه لعلوم الأعصاب وكذلك الامراض العصبية. ويتمثل أحد التحذيرات في ان البروتينات المقيسة في السائل الدماغي الشوكي قد تستمد من كل من التوليف داخل البراز والاستخلاص من المصل ، وان تحليل البروتين في السائل الدماغي الشوكي لا يمكن الا ان يحدد مجموع هذين المكونين. ان يميز بين [ترنسسوايشن] بروتين من الدم وينتج [اينترثيكلي] بروتينات في نماذج حيوانيه [اس ول س] في أناس, يجب ان تشمل قياسات البروتين السائل الدماغي الشوكي باستخدام أدوات تحليل البروتين التقليدية حساب الزلال السائل الدماغي الشوكي/مصل الدم (سالزلال) ، وهو علامة علي سلامه واجهه الدماغ (ابي) ، ومؤشر البروتين (سبروتين/سالزلال) ، وهو تقدير لتخليق البروتين داخل البراز. يوضح هذا البروتوكول الاجراء بأكمله ، من السائل الدماغي الشوكي وجمع الدم إلى حسابات الحواصل والمؤشرات ، للقياس الكمي لتخليق البروتين داخل البراز وضعف الكلي في نماذج الفئران من الاضطرابات العصبية.
Introduction
السائل الدماغي الشوكي ، وهو سائل واضح وعديم اللون المحيطة الدماغ والحبل النخاعي ، يحمل اهميه كبيره السريرية والعلمية الاساسيه. وهكذا ، وبما ان تكوين السائل الدماغي الشوكي يعكس نشاط النفثالينات العصبية المركزية ، فان هذا السائل يوفر وصولا قيما ، وان كان غير مباشر ، لتوصيف الحالة الفسيولوجية والمرضية للجهاز العصبي المركزي.
وقد استخدم السائل الدماغي الشوكي لتشخيص الحالات التي تؤثر علي النفثالينات العصبي المركزي لأكثر من مائه سنه ، وفي معظم الوقت ، تمت دراسته في المقام الأول من قبل الأطباء كاداه تشخيصيه. ومع ذلك ، في السنوات الاخيره وقد اعترف علماء البيولوجيا العصبية إمكانات السائل الدماغي الشوكي لدراسة الفيزيولوجيا المرضية للجهاز العصبي المركزي. وعلي وجه الخصوص ، تم إدخال العديد من أدوات تحليل البروتين عاليه الانتاجيه في مجال علوم الأعصاب مما يسمح باجراء دراسة مفصله لتكوين البروتين في السائل الدماغي الشوكي ، مع توقع ان هذا التحليل قد يساعد في توفير نظره ثاقبه علي التغيرات الديناميكية التي تحدث داخل النفثالينات العصبية.
التطورات التكنولوجية في تقنيات الفحص متعددة المناعة مثل لومينكس وتقنيات سيموا 2،3، تزودالباحثيناليوم بالقدرة علي اكتشاف المئات من البروتينات بتركيزات منخفضه جدا. وعلاوة علي ذلك ، تسمح هذه التكنولوجيات نفسها باستخدام كميات صغيره من العينات ، مما يشجع علي اجراء دراسات في الكائنات الصغيرة ، بما في ذلك الفئران ، التي حالت فيها احجام العينات المحدودة من السائل الدماغي الشوكي دون التوصيف المفصل للسائل حتى وقت قريب.
ومع ذلك ، فان أحد التحذيرات هو ان البروتينات المقيسة في السائل الدماغي الشوكي قد تستمد من التوليف داخل البراز و/أو من المصل بسبب وجود واجهه تالفة في الدم والدماغ (آيبي). لسوء الحظ ، تحليل البروتين من السائل الدماغي الشوكي وحده لا يمكن الا ان يحدد مجموع هذين العنصرين. للتمييز بين البروتينات المنتجة والبروتينية داخل الدم ، يجب تعديل قياسات بروتين السائل الدماغي الشوكي باستخدام اي أداه تحليل البروتين المتاحة للتغير الفردي في تركيزات المصل وكذلك سلامه الحاجز. ومع ذلك ، علي الرغم من ان هذا التعديل يستخدم عاده في الممارسة السريرية ، علي سبيل المثال ، مؤشر السائل الدماغي الشوكي ، الذي لديه حساسية عاليه للكشف عن التوليف داخل البراز4،5،6، حتى الآن الدراسات البحثية قليله جدا تصحيح تركيزات بروتينالسائل النخاعي لتركيزالمصل
وفي الوقت الراهن ، فان نهج ريبرغرام هو أفضل طريقه لتحديد وظيفة الحاجز وتوليف البروتينات داخل البراز. وهو تقييم رسومي في مخططات السائل الدماغي الشوكي/المصل الذي يحلل ، بطريقه متكاملة ، كل من وظيفة الحاجز (dys) وتخليق البروتين داخل البراز ، في اشاره إلى بروتين مشتق من الدم حصرا9،10. وعاده ما يتم اختيار الزلال البروتين وفيرة للغاية كمرجع البروتين لأنه يتم إنتاجه فقط في الكبد ولان حجمه ، تقريبا 70 كده ، هو وسيط بين البروتينات الصغيرة والكبيرة11. تم تعريف الرسم التخطيطي التحليل لأول مره من قبل رييبر وفينشهاور في 1987 للفئات الرئيسية من الغلوبولين المناعي (Igs)11, يجري تجريبيا استنادا إلى النتائج التي تم الحصول عليها من تحليل آلاف من العينات البشرية9. وقد تاكد هذا النهج في وقت لاحق من خلال تطبيق قوانين Fick الخاصة بالنشر في نظرية الانتشار الجزيئي/معدل التدفق12. مثل هذه النظرية يدل علي انتشار البروتين من خلال الحاجز لديه توزيع القطعي ويمكن ان تفسر كميا ديناميات البروتينات في الCNS9,13. وعموما ، فان ميزه استخدام ريبرجرام لإظهار تخليق البروتين داخل البراز هو انه يحدد في نفس الوقت كسر البروتين الذي يدخل السائل الدماغي الشوكي من المصل وكذلك كميه البروتين الموجودة في السائل الدماغي الشوكي بسبب الإنتاج المحلي.
تصف هذه المادة والبروتوكول المتعلق بها الاجراء بأكمله ، من السائل الدماغي الشوكي وجمع الدم إلى الحسابات النهائية لتصحيح مستويات بروتين السائل النخاعي ، للقياس الكمي لتخليق البروتين داخل البراز في نماذج الفئران من العصبية اضطرابات. ويوفر هذا الاجراء أساسا لتقييم (1) الأصل الباثولوجي لأي بروتين سائل نخاعي و (2) الاستقرار والاهميه الوظيفية لسلامه الحاجز. هذا الاجراء والبروتوكول ليست مفيده فقط لتقييم عينات الماوس السائل الدماغي الشوكي ولكنها مفيده أيضا في تحليل السائل الدماغي الشوكي في العديد من النماذج الحيوانية من الامراض العصبية والمرضي البشريين.
Protocol
تستخدم جميع الاعمال الحيوانية البروتوكولات التي استعرضتها ووافقت عليها اللجنة المؤسسية للعناية بالماشية واستخدامها في كليه جيسيل للطب في دارتموث.
1-جمع السوائل
ملاحظه: كل من المصل والسائل الدماغي الشوكي مطلوبه. هناك حاجه إلى بروتوكولين لكل مجموعه السوائل للبقاء علي قيد الحياة والانحلال الشوكي.
- جمع المصل والسائل الدماغي الشوكي باستخدام إجراءات البقاء
ملاحظه: لجمع السوائل البقاء علي قيد الحياة ، يجب ان تسبق جمع المصل السائل الدماغي الشوكي جمع كما هو اجراء اقل الغازية. يجب الحصول علي السائل الدماغي الشوكي خلال أسبوع واحد من سحب المصل.- الرجعية المدارية النزيف الاجراء لجمع المصل.
ملاحظه: هذا الاجراء هو من أجل البقاء علي قيد الحياة نزيف الفئران14. ينطبق الاجراء الموصوف علي اي عمر ، ونوع الجنس ، وسلاله من الفئران. منذ قواعد IACUC تملي ان حجم الدم الأقصى من 1 ٪ من وزن الجسم يمكن ازالتها كسحب دم واحد ، فمن المستحسن ان يتم تنفيذ الاجراء فقط علي الفئران وزنها أكثر من 15 غرام.- نقل الأقفاص التي تحتوي علي الفئران من الرف إلى منطقه العمل المناسبة. اعداد اله الغاز التخدير عن طريق تشغيل متر تدفق الأكسجين إلى 1 لتر/دقيقه.
- وضع الحيوانية في الغرفة التعريفي وإغلاق الغطاء باحكام. بدوره علي المبخر ايزوفلواني إلى 3.5 ٪ ومراقبه الحيوانية حتى recumbent.
- أزاله الحيوانية من الغرفة وتقييم مستوي التخدير عن طريق المنعكس دواسة ، اي ، قرصه منصة الشركة. ضمان عمق كاف من التخدير قبل اجراء العملية: عدم وجود استجابه لقرصه قويه يشير إلى التخدير الكافي.
- كبح جماح الماوس تخدير عن طريق استيعاب الجلد فضفاضة وراء الاذنين مع الإبهام والسبابة من اليد غير المهيمنة. انتفاخ العينين باستخدام السبابة لسحب الجلد فوق العين والإبهام لسحب الجلد تحت العينين.
- ضع طرف ماصه باستور في مقبس العين الموجود تحت المقلة (الشكل 1، اللوحة اليسرى) ، وتوجيه الطرف عند حوالي 45 درجه مئوية نحو منتصف مقبس العين (الشكل 1، اللوحة اليمني). تدوير الماصة بين الأصابع اثناء المرور إلى الامام. ضعي ضغطا لطيفا ثم حرريه حتى يدخل الدم إلى الماصة.
ملاحظه: الحد الأقصى لكميه الدم التي قد يتم سحبها في وقت واحد من هذا الموقع حوالي 1 ٪ من وزن الجسم ، علي سبيل المثال ، 0.2 mL من الماوس 20 ز. - أزاله الشعرية برفق لمنع أصابه العين ووضع الدم الذي تم جمعه في أنبوب الطرد المركزي 1.5 mL. إغلاق الجفن وتطبيق ضغط خفيف مع الشاش لمنع مزيد من النزيف. مره واحده تماما في حاله تاهب والمتنقلة (عاده 3 − 5 دقيقه) ، وأعاده الماوس إلى قفصه القابضة.
- السماح للدم لتجلط لمده 30 − 60 دقيقه في درجه حرارة الغرفة (RT) ، ثم الدم الطارد المركزي لمده 10 دقيقه في 2,000 x g في 4 درجه مئوية المبردة الطرد المركزي. باستخدام تقنيه ماصه نظيفه ، وجمع المصل في قارورة جديده ، المسمي 0.5 mL. فورا تجميد قارورة من المصل في-80 درجه مئوية.
- جمع السائل الدماغي الشوكي مع اجراء البقاء
ملاحظه: هذا الاجراء هو لعمليه البقاء علي قيد الحياة ، ويستند إلى البروتوكول الذي نشرته ليو و داف في 200815. يتم تخدير الفئران بواسطة الكيتامين (20 ملغ/مل) ، اكسيليازين (0.5 ملغ/مل) ، و اسيبرومازين (0.5 mg/ml) كوكتيل تدار داخل الصفاق.- نقل الأقفاص التي تحتوي علي الفئران من الرف إلى منطقه العمل جراحه معينه. اعداد مساحة الجراحة في بيئة معقمه. التاكد من تعقيم جميع الاداات والمواد المستخدمة قبل الجراحة.
- تزن الماوس وحساب حجم التخدير اللازمة (0.1 مل من كوكتيل التخدير لماوس 20 ز). حقن التخدير داخل الصفاق16. بعد بضع دقائق ، اختبر الفاره بالنقر علي مسند القدم لضمان التخدير الكافي. في حاله الحاجة إلى المزيد من التخدير ، قم بحقن 0.01 − 0.03 مل من كوكتيل التخدير.
- استخدمي اما مقص أو ماكينة حلاقه لحلاقه منطقه صغيره من الراس ، علي الطرف الوسطي ، الإنسي علي الجمجمة ، للكشف عن مساحة عمل كبيره بما يكفي لجمع السائل الدماغي الشوكي. ضع الماوس في الموضع المعرض علي الجهاز الفراغي ، وثبت الراس باستخدام قضبان الاذن (الشكل 2 ا).
ملاحظه: يتم وضع الماوس أسفل بحيث يشكل الراس تقريبا 135 درجه زاوية مع الجسم (الشكل 2A). وبمجرد وضع الحيوانية ، يتم استخدام الستارة الجراحية للحفاظ علي حقل معقم في الموقع الجراحي. ويفضل الستائر اللاصقة واضحة لجمع السائل الدماغي الشوكي في الفئران ، كما انها تسمح لتصور مباشر وأكثر تركيزا من الحيوانية. - مسحه الموقع الجراحي مع 30 ٪ ثنائي خلات الكلورهسيدين. باستخدام مشرط عقيمه ، وجعل شق السهمي من الجلد ادني من القذبوت لفضح العضلات المبالغة في ماجنا.
- بواسطة تشريح حاد مع ملقط ، فصل الانسجه تحت الجلد والعضلات للكشف عن ماجنا (الشكل 2B). استخدام الجرارات المجهرية لعقد العضلات بعيدا (الشكل 2B) وفضح الطبقة السحائية الام الجافية علي ماجنا.
- يغسل برفق بالفوسفات المعقم-المحلول الملحي المخزن لأزاله اي تلوث دم محتمل. لطخه جافه الام الجافية مع مسحه القطن المعقمة وثقب بلطف الغشاء الذي يغطي الغلاف الشوكي ماجنا مع ابره 30 G. بسرعة وبلطف ادراج أنبوب الشعرية الزجاجية الصغيرة لجمع السائل الدماغي الشوكي (الشكل 2C).
ملاحظه: يسمح الضغط داخل الجمجمة بتدفق السائل الدماغي الشوكي تلقائيا إلى الشعيرات الشعرية (الشكل 2C). اعتمادا علي عمر وحجم الماوس ، يتم الحصول علي ما يقرب من 5 − 12 μL من السائل الدماغي الشوكي من كل ماوس. - أزاله بعناية أنبوب الشعرية من الغشاء. توصيل الأنبوب إلى حقنه 3 مل من خلال أنابيب البولي إيثيلين (جدول المواد) وحقن السائل الدماغي الشوكي التي تم جمعها في أنبوب 0.5 المسمي ml (الشكل 2d). حافظ علي القنينات في الثلج.
- إغلاق شق باستخدام خياطه بوليديوكسانون (الدخل القومي) مع ابره القابل للتصرف واستخدام الغرز المدفونة17. تنظيف المنطقة من اي الدم المجفف أو الانسجه.
- حقن الفئران, جلد أو داخل الصفاق16, مع 0.05 − 0.1 مغ/كغ من هيدروكلوريد البوبرينورفين كعلاج مسكن. أيضا ، حقن جلد 1 مل من المحلول الملحي المعقم لمنع الجفاف.
- وضع الماوس مره أخرى في قفص نظيفه ودافئه للانتعاش. مره واحده في الماوس المحمول وقادره علي الوصول إلى الغذاء والماء ، ووضع القفص مره أخرى علي الرف.
- الطرد المركزي السائل النخاعي لمده 10 دقيقه في 1,000 x g في 4 °c المبردة الطرد المركزي. التحقق من درجه تلوث الدم عن طريق الفحص البصري لتحديد صفار ووجود بيليه حمراء في الجزء السفلي من الأنبوب. تخلص من العينات الملوثة بالدم.
ملاحظه: تستند الصيغة المستخدمة لتصحيح كميات بروتين السائل النخاعي في العينات الملوثة بالدم إلى بارامترات المعادلة التي تشمل محتوي البروتين في السائل الدماغي الشوكي والمصل والدم وخلايا الدم الحمراء التي تحسب في السائل الدماغي الشوكي والدماء18. ومع ذلك ، لا يمكن تطبيق استراتيجية التصحيح هذه بسهوله علي عينات الماوس السائل الدماغي الشوكي بسبب الحجم الصغير ، مما يحد من استراتيجية التصحيح للتفتيش البصري. - باستخدام تقنيه ماصه نظيفه ، وجمع السائل الدماغي الشوكي في أنبوب جديد 0.2 mL ، تاركا وراءها بيليه مع الخلايا. تمييع 1:3 السائل الدماغي الشوكي مع تلفزيوني للحد من فقدان الحجم بسبب الهباء. تجميد علي الفور قارورة من السائل الدماغي الشوكي في-80 درجه مئوية.
- الرجعية المدارية النزيف الاجراء لجمع المصل.
- جمع المصل والسائل الدماغي الشوكي باستخدام إجراءات عدم البقاء
ملاحظه: لجمع السوائل غير البقاء علي قيد الحياة ، مجموعه السائل الدماغي الشوكي تسبق جمع المصل والماوس يحتاج إلى نبض.- مجموعه السائل الدماغي الشوكي في العنكبوت
ملاحظه: هذا الاجراء هو لجراحه عدم البقاء علي قيد الحياة ، ويتم الحصول علي ما يقرب من 10 − 20 μL من السائل الدماغي الشوكي من كل ماوس. ينصح بالمجال الجراحي المعقم ، ولكن ليس مطلوبا للجراحة غير البقاء علي قيد الحياة.- نقل الأقفاص التي تحتوي علي الفئران من الرف إلى مساحة عمل مريحه. اتبع الخطوات 1.1.2.2 − 1.1.2.7 و 1.1.2.11 − 1.1.2.12 لمجموعه السائل الدماغي الشوكي. انتقل إلى القسم 1-2-2 لجمع المصل.
- جمع الدم عن طريق ثقب داخل الداخل (نهج مفتوح)
ملاحظه: حجم الدم المتوقع هو حوالي 3 ٪ من وزن الجسم ، علي سبيل المثال ، 0.6 mL من الماوس 20 ز.- بعد جمع السائل الدماغي الشوكي ضمان الماوس لا يزال تخدير بما فيه الكفاية عن طريق معسر القدم. إذا لوحظ اي رد فعل ، وأداره جرعه ثانيه من التخدير. إذا لم يلاحظ اي رد فعل ، والمضي قدما.
- وضع الحيوانية علي الظهر ومسحه الجلد علي البطن مع 70 ٪ الكحول. مع المقص الجراحي ، افتح التجويف الصدري واكشف القلب. ادراج ابره 25 G (تعلق علي حقنه 3 مل) في البطين الأيسر وتطبيق بلطف الضغط السلبي علي المكبس حقنه. سحب الابره بعد جمع الدم.
- تنفيذ طريقه ثانويه من القتل الرحيم مثل قطع الراس أو خلع عنق الرحم للتاكد من ان الحيوانية هو المتوفي.
- دفع الغطاس من حقنه أسفل وحقن الدم التي تم جمعها في قارورة 1.5 mL. السماح للدم لتجلط لمده 30-60 دقيقه في RT ومن ثم الطرد المركزي لمده 10 دقيقه في 2,000 x g في 4 °c المبردة الطرد المركزي.
- باستخدام تقنيه ماصه نظيفه ، وجمع المصل في قارورة جديده ، المسمي 0.5 mL. تجميد علي الفور قارورة من المصل في 80 درجه مئوية الفريزر.
- مجموعه السائل الدماغي الشوكي في العنكبوت
2. تحليل البروتين
- استخدم طريقه مفضله ، مثل تقنيه لولومينكس ، لتحديد كميه البروتين المستهدف والزلال في المصل المطابق وعينات السائل الدماغي الشوكي.
ملاحظه: هنا ، يتم إعطاء مثال مع التكنولوجيا المغناطيسية لومينكس ، ولكن تقريبا اي تقنيه يقيس كميات البروتين ، بما في ذلك الاختبارات المناعية المرتبطة بالانزيم (ELISAs) ، يمكن تطبيقها علي البروتوكول الحالي. ومن الناحية المثالية ، يتم تشغيل عينات السائل الدماغي الشوكي والمصل لكل من الزلال والبروتينات المستهدفة علي نفس المنصة. يجب ان تكون ظروف الفحص مثاليه للخطوات الحاسمة في البروتوكول مثل تركيز اقتران الحبة مستضد ، والمصل والسائل الدماغي الشوكي ، والمنحنيات القياسية الأنسب لكل التحاليل ، وتركيب العازل لتقليل التفاعلات غير المحددة. إذا تم استخدام مجموعه تجاريه للبروتين (ق) القياس ، علي سبيل المثال ، المناعية الغلوبولين الجيني عده (جدول المواد) المستخدمة للحصول علي البيانات المقدمة فيالشكل 3، يجب اتباع تعليمات المصنعين.- عند الذوبان وقبل التحليل ، السائل المركزي النخاعي وعينات المصل (2,000 x g لمده 10 دقيقه) واستخدام ماده طافي لمنع انسداد لوحات فلتر و/أو التحقيق. اتبع اجراء الفحص المقدم مع الطقم للحصول علي المخففات المناسبة للعينه. والا ، تحديد التخفيف المناسب لكل التحليلية والسوائل. تمييع عينات في الاذاعه التلفزيونية وفقا لذلك.
ملاحظه: إذا لم تكن هناك إرشادات أو إرشادات محدده ، يجب ان يتم إنشاء المخففات لكل تحليل والسوائل قبل اختبار الدراسة ، من خلال تحديد نطاقات التخفيف المناسبة اللازمة للحصول علي تقديرات التركيز التي تقع ضمن أكثر مجموعه موثوقه من منحني القياسية. معرفه خصائص العينة البيولوجية التي يجب تحليلها ، علي سبيل المثال ، التركيزات الفسيولوجية والمرضية في السائل ، يسمح بمحاولة التخفيفات المختلفة مع عينات من المحتوي المنخفض والمتوسط والتحليلي العالي. إذا كان النطاق المتوقع للتركيزات في العينات يعرف مسبقا ، يمكن تحديد المخففات بعد حساب عدد المرات التي يجب ان تضعف العينة من أجل ان تكون ضمن نطاق المنحني القياسي المختار.
تحذير: من خلال حساب عوامل التخفيف ، تذكر ان السائل الدماغي الشوكي قد تم بالفعل تخفيف 1:3. - اعداد منحني قياسي لكل بروتين من الفائدة ، علي سبيل المثال ، الزلال ومفتش كما تستخدم لتوليد البيانات في الشكل 3، عن طريق المسلسل تمييع البروتينات القياسية المرجعية. خلال اعداد المنحنيات القياسية ، تخلط بدقه كل تركيز اعلي قبل اتخاذ التخفيف المقبل.
ملاحظه: بغض الانتباه عن الطريقة المختارة للقياس الكمي ، فمن الضروري تضمين منحني قياسي في كل مره يتم فيها اجراء الفحص لتقدير تركيز البروتين (ق) في العينات. الخيار الأفضل لمعيار مرجعي هو تنقيه ، والتركيز المعروف من البروتين من الفائدة. يعتمد اتخاذ قرار بشان التخفيفات المحددة ، بالاضافه إلى عدد نقاط البيانات والنسخ المتماثلة المستخدمة لتحديد المنحني القياسي ، علي درجه عدم الخطية في المنحني القياسي. - حدد مجموعات الخرز المغناطيسي المناسبة التي تقترن بالأجسام المضادة (جدول المواد). لقوارير الفردية من الخرز ، ويصوت كل قارورة ل 30 ثانيه ودوامه لمده 1 دقيقه. اعداد "خليط حبات العمل" عن طريق تمييع الأسهم حبه للتركيز النهائي من 50 الخرز من كل مجموعه/μL في المخزن المؤقت لفحص/غسل (تلفزيوني ، 1 ٪ الزلال مصل الأبقار [جيش الصرب البوسني]). أضافه 50 μL من الخرز مختلطة لكل بئر في لوحه مسطحه القاع 96-بئر (جدول المواد).
تحذير: الخرز الفلورسنت حساسة للضوء. ولذلك ، ينبغي حمايتها من التعرض المطول للضوء طوال الاجراء. - رسم تخطيطي لموضع الخلفيات والمعايير والعينات في ورقه عمل الخريطة جيدا.
- أضافه 50 μL من المخزن المؤقت لفحص/غسل لكل الخلفية جيدا ، و 50 μL من كل معيار لآبار لمنحني القياسية. تحميل 50 mL من كل عينه المخفف في الآبار المناسبة الماضي. التفاف لوحه مع إحباط واحتضان مع الانفعالات (~ 800 لفه في الدقيقة) علي لوحه شاكر لمده 30 دقيقه في RT.
- وضع لوحه علي المغناطيس المحمولة (جدول المواد) وبقية لوحه علي المغناطيس ل ~ 60 s للسماح الاعداد الكامل من الخرز المغناطيسي. أزاله محتويات جيدا عن طريق التخلص بلطف لوحه والصنبور لوحه علي منصات ماصه لأزاله السائل المتبقية.
- غسل لوحه عن طريق ازالته من المغناطيس ، عن طريق أضافه 200 μL من المخزن المؤقت لفحص/غسل ، عن طريق الاهتزاز ل ~ 30 ثانيه ، وأخيرا عن طريق أعاده إرفاقه إلى المغناطيس. كرر غسل 3x.
- تمييع الأجسام المضادة للكشف عن التعكر الإحيائي ، اي الأجسام المضادة المسمية البيوتين المرفوعة ضد الأنواع البروتينية المضيفة ، إلى 4 ميكروغرام/مل في مخزن الفحص/الغسل. أضافه 50 μL من الأجسام المضادة الكشف المخفف لكل بئر. تغطيه لوحه واحتضان لمده 30 دقيقه في RT علي لوحه شاكر في ~ 800 دوره في الدقيقة. ضع اللوحة علي المغناطيس وكرر الخطوات 2-1-6 و 2-1-7.
- تمييع فيكوريميثرين (PE)-مترافق العقديات (SAPE) إلى 4 ميكروغرام/مل في مقايسة/غسل العازلة. أضافه 50 μL من المخفف SAPE لكل بئر. تغطيه لوحه واحتضان لمده 30 دقيقه في RT علي لوحه شاكر في ~ 800 دوره في الدقيقة. ضع اللوحة علي المغناطيس وكرر الخطوات 2-1-6 و 2-1-7.
- أزاله لوحه من المغناطيس وأعاده تعليق الخرز في 100 μL من المخزن المؤقت لفحص/غسل. قراءه الآبار مع جهاز الكشف عن الليزر المزدوج القائم علي التدفق الذي يسمح للكشف عن حجم الكثافة الفلورية PE (FI).
ملاحظه: الاشاره ، علي سبيل المثال ، FI ، التي تم إنشاؤها يتناسب مع كميه مستضد الهدف المرتبطة بسطح الخرز. - تصدير البيانات الخام وإنشاء منحنيات قياسيه بواسطة اشاره الكشف عن الرسوم البيانية FI مقابل تركيزات البروتين القياسية. استخدم المنحني القياسي (ق) لحساب تركيز التحاليل في العينات.
ملاحظه: يتم التعبير عن ألبومين بشكل تفضيلي في g/dL ، بينما يتم التعبير عن البروتينات ذات الفائدة بشكل تفضيلي في mg/dL.
- عند الذوبان وقبل التحليل ، السائل المركزي النخاعي وعينات المصل (2,000 x g لمده 10 دقيقه) واستخدام ماده طافي لمنع انسداد لوحات فلتر و/أو التحقيق. اتبع اجراء الفحص المقدم مع الطقم للحصول علي المخففات المناسبة للعينه. والا ، تحديد التخفيف المناسب لكل التحليلية والسوائل. تمييع عينات في الاذاعه التلفزيونية وفقا لذلك.
3-حسابات المؤشر داخل البراز
- تنظيم قيم تركيز البروتين في جدول بيانات وتحليل النتائج عن طريق تطبيق الصيغ التالية.
- حسابألبومينQ:

حيث الزلالالسائل الدماغي الشوكي والزلال المصل هي تركيزات الزلال في المصل المتطابقة وعينات السائل الدماغي الشوكي ، علي التوالي. - حسابالبروتينس:
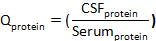
حيث بروتينالسائل الدماغي الشوكيوبروتين المصل هي تركيزات البروتين المستهدف في المصل المطابق وعينات السائل الدماغي الشوكي ، علي التوالي. - حساب مؤشر البروتين:
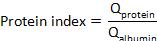
النتائج
وتهدف هذه التجربة التمثيلية لمقارنه التوليف داخل البراز من مفتش في اثنين من نماذج القوارض ذات الصلة سريريا من التصلب المتعدد (MS): الانتكاس139-151المستحثة الدماغية المناعية الذاتية التجريبية (R-eae) والتقدمية المزمنة, theiler في الدماغ الدماغية R-EAE هو نموذج مفيد لفهم الانتكاس-تحويل MS ، في حين ...
Discussion
الطرق الكمية لتقييم زيادة تركيزات البروتين السائل الدماغي الشوكي هي أدوات مفيده في توصيف الحالة الفسيولوجية والمرضية للجهاز العصبي المركزي. ومع ذلك ، وبعد التحديد الكمي الموثوقه لمستويات بروتين السائل النخاعي ، يتطلب الكشف عن بروتينات السائل الدماغي الشوكي التعبير عن النتائج التي تميز...
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
ويشكر المؤلفون موظفي مركز الطب المقارن والبحوث (CCMR) في دارتموث علي رعايتهم الخبيرة للفئران المستخدمة في هذه الدراسات. ومول صندوق بحوث بورنشتاين هذا البحث.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
References
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved