A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידה כמותית של מתוך מסונתז חלבונים בעכברים
In This Article
Summary
רמת החלבון של נוזל השדרה הגבוה יכול להיות תוצאה של דיפוזיה של חלבון פלזמה על פני מחסום דם-מוח שונה או סינתזה התוך. פרוטוקול בדיקה מיטבי מוצג במאמר זה, המסייע להפלות את שני המקרים ומספק מדידות כמותית של חלבונים מסונתז באופן פנימי.
Abstract
נוזל מוחי שדרתי, נוזל שנמצא במוח ואת חוט השדרה, הוא בעל חשיבות רבה למדע בסיסי וקליני. ניתוח הרכב חלבון שדרתי מספק מידע חיוני במחקר בסיסי במדעי המוח, כמו גם מחלות נוירולוגיות. אזהרה אחת היא כי חלבונים הנמדדים בתוך שדרתי עשוי לנבוע הן סינתזה הפנימי והטראנזפה מן הנסיוב, וניתוח חלבונים של שדרתי יכול רק לקבוע את הסכום של שני רכיבים אלה. על מנת להפלות בין החלבון המופק מהדם לבין החלבונים המיוצרים בדגמי בעלי חיים, כמו גם בבני אדם, מדידות חלבון שדרתי פרופיל באמצעות כלים קונבנציונליים ניתוח חלבון חייב לכלול את החישוב של המנה האלקטרוליציונלית/סרום (Qאלבומין), סמן של השלמות של הממשק בדם-מוח (bbi), ואת מדד החלבון (Qחלבון/qאלבומין), הערכה של סינתזה החלבון הפנימי. פרוטוקול זה ממחיש את ההליך כולו, מ שדרתי ואיסוף דם לחישובי quotients ואינדקסים, עבור המדידה הכמותית של סינתזה החלבון הפנימי וליקוי BBI בדגמי העכבר של הפרעות נוירולוגיות.
Introduction
נוזל מוחי שדרתי, נוזל ברור וחסר צבע סביב המוח וחוט השדרה, מחזיק בחשיבות מדעית קלינית ובסיסית גדולה. המוח השדרתי משמר את הסביבה האלקטרוטית של מערכת העצבים המרכזית (CN), מאזנת את הסטטוס בסיס חומצה מערכתית, אספקת חומרים מזינים לתאי העצבי והגליאל, פונקציות כמו מערכת הלימפה עבור ה-CN, ו הובלות הורמונים, נוירוטרנסמיטורים, ציטוקינים ונוירופפטידים אחרים ברחבי ה-CN1 לפיכך, כאשר הרכב הנוזל הנוזלי משקף את הפעילות של ה-CN, החומר הזה מציע מגוון בעל ערך, אם כי עקיף, גישה לאפיון המצב הפיזיולוגי והפתולוגי של ה-CN.
שדרתי שימוש כדי לאבחן את התנאים המשפיעים על ה-CN למעלה ממאה שנים, ובמשך רוב הזמן הזה, הוא למד בעיקר על ידי מטפלים ככלי אבחון. עם זאת, בשנים האחרונות נוירוביולוגים הכירו את הפוטנציאל של שדרתי לחקר הפתופסולוגיה של ה-CN. בפרט, מספר כלי ניתוח חלבון בתפוקה גבוהה הוצגו בתחום מדעי המוח המאפשר מחקר מפורט של הרכב החלבון של שדרתי, עם הציפייה כי ניתוח זה עשוי לעזור לספק תובנה שינויים דינמיים תרחשות בתוך ה-CN.
התפתחויות טכנולוגיות בשיטות חיסוני מולטיפלקס כגון לומיקס וסימוע טכנולוגיות2,3, לספק לחוקרים היום עם היכולת לזהות מאות חלבונים בריכוזים נמוכים מאוד. כמו-כן, אותן טכנולוגיות מאפשרות שימוש באמצעי אחסון קטנים לדוגמה, ובכך לקדם מחקרים בבעלי חיים קטנים, כולל עכברים, בהם כמויות מוגבלות של מדגם שדרתי מנעה באופן מוגבל תווים מפורטים של הנוזל עד לאחרונה.
אף על פי כן, אזהרה אחת היא כי חלבונים הנמדדים בתוך שדרתי עשוי לנבוע סינתזה הפנימי ו/או ההמרה מן הנסיוב בשל ממשק דם פגום מוח (BBI). למרבה הצער, ניתוח חלבונים של שדרתי בלבד יכול רק לקבוע את הסכום של שני רכיבים אלה. כדי להפלות בין transudate ובין הייצור חלבונים, מדידות חלבון שדרתי באמצעות כל הכלי הזמין ניתוח חלבון חייב להיות מותאם לשונות בודדות ריכוזי סרום, כמו גם שלמות המכשול. עם זאת, למרות התאמה זו משמשת בדרך כלל בפרקטיקה קלינית, למשל, המדד igg שדרתי, אשר יש רגישות גבוהה לזיהוי הפנימי סינתזה igg4,5,6, עד תאריך מחקרים מעטים מאוד מתוקן ריכוזי חלבון שדרתי לריכוז סרום ושלמות המכשול7,8.
כיום, הגישה הרייברגרמה היא הדרך הטובה ביותר לקבוע את תפקוד המכשול וסינתזה של חלבונים. זהו הערכה גרפית בדיאגרמות שדרתי/סרום מנה אשר מנתחת, באופן משולב, הן המכשול (dys) פונקציה סינתזה חלבון הפנימי, המתייחס חלבון בלעדי דם נגזר9,10. אלבומין החלבון העשיר ביותר נבחר בדרך כלל חלבון התייחסות כי הוא מיוצר רק בכבד ובגלל גודלו, כ 70 kDa, הוא ביניים בין חלבונים קטנים וגדולים11. דיאגרמת הניתוח הוגדרה לראשונה על ידי "רייבר ופלינהאואר" ב-1987 לכיתות הגדולות של האימונוגלובונים11, המבוססות על התוצאות שהתקבלו מניתוח של אלפי דגימות אדם9. הגישה אושרה לאחר מכן על ידי יישום שני חוקי הדיפוזיה של Fick בתאוריה של דיפוזיה מולקולרית/שיעור זרימה12. תיאוריה מעין זו ממחישה את הדיפוזיה של חלבון דרך המכשול יש התפלגות היפרבולי יכול להסביר את הדינמיקה של חלבונים ב-cn9,13. בסך הכל, היתרון של שימוש ברייברגרמה לצורך הוכחת סינתזה החלבון הפנימי הוא שהוא במקביל מזהה את שבר החלבון הנכנס השדרתי מן הנסיוב, כמו גם את כמות החלבון שנמצא השדרתי בגלל הייצור המקומי.
המאמר הנוכחי והפרוטוקול הקשור מתארים את ההליך כולו, מתוך מתקן שדרתי ואיסוף דם לחישובים הסופיים לתיקון שדרתי את רמות החלבון, עבור המדידה הכמותית של סינתזת החלבון הפנימי במודלים של העכבר הנוירולוגי פרעות. הליך זה מספק תוכנית בסיסית שממנה יש להעריך (1) את המקור הפתופסולוגי של חלבון שדרתי כלשהו ו-(2) את היציבות והמשמעות הפונקציונלית של שלמות המכשול. הליך זה ופרוטוקול אינם שימושיים רק להערכת דגימות של העכבר, אבל הם גם שימושיים בניתוח שדרתי בהמון מודלים בעלי חיים של מחלות נוירולוגיות וחולים אנושיים.
Protocol
כל העבודה בעלי חיים מנצל פרוטוקולים שנבדקו ואושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים (IACUC) בבית הספר של גייזל לרפואה בדרתמות.
1. איסוף נוזלים
הערה: הסרום והשדרתי הינם נדרשים. שני פרוטוקולים עבור כל אוסף נוזלים נחוצים להישרדות ונקרופסי.
- אוסף של נסיוב ושדרתי שימוש בהליכי הישרדות
הערה: לאיסוף נוזלי הישרדות, הסרום צריך להקדים את האוסף שדרתי כפי שהוא הליך פולשני פחות. יש להשיג בתוך שבוע. של משיכה בסרום- רטרו-המסלול דימום הליך עבור אוסף הנסיוב.
הערה: הליך זה מיועד לדימום הישרדות של עכברים14. ההליך המתואר חל על כל גיל, מין, והזן של עכברים. מאז הכללים IACUC להכתיב כי נפח דם מקסימלי של 1% ממשקל הגוף ניתן להסיר כמו לצייר דם יחיד, מומלץ ההליך מבוצע רק על עכברים במשקל יותר 15 g.- הזז את הכלובים המכילים עכברים מארון התקשורת לאזור עבודה מתאים. הכינו את מכונת הגז ההרדמה על ידי הפעלת מד זרימת החמצן ל-1 L/min.
- הציבו את החיה בחדר האינדוקציה וסגרו את המכסה בחוזקה. הפעל את מכשיר האידוי ל3.5% ונטר את בעל החיים עד שכיבה.
- הסר את בעל החיים מן החדר ולהעריך את רמת ההרדמה על ידי הדוושה רפלקס, כלומר, המשרד לצבוט footpad. להבטיח עומק הולם של הרדמה לפני ביצוע ההליך: חוסר תגובה לצביטה איתנה מעיד על הרדמה נאותה.
- רסן את העכבר המורדם על ידי האוחז בעור רופף מאחורי האוזניים עם האגודל והאצבע המורה של היד הלא-דומיננטית. הבליטה את העיניים באמצעות האצבע המורה כדי לצייר בחזרה את העור מעל העין ואת האגודל כדי למשוך בחזרה את העור מתחת לעיניים.
- מניחים את קצהו של פיפטה פסטר לתוך שקע העין מתחת לעין (איור 1, הלוח השמאלי), ומכוון את הטיפ כ-45 ° לכיוון מרכז שקע העין (איור 1, הלוח הימני). סובב את הפיפטה בין האצבעות במהלך המעבר הקדמי. הפעילו לחץ עדין ושחררו עד שהדם נכנס לפיפטה.
הערה: כמות מקסימלית של דם שניתן לפרק בבת אחת מן המיקום הזה הוא כ 1% ממשקל הגוף, למשל, 0.2 mL מ 20 גרם העכבר. - בעדינות להסיר את הנימים כדי למנוע פגיעה בעין ומניחים את הדם שנאסף בשפופרת צנטריפוגה 1.5 mL. לסגור את העפעף ולהחיל לחץ קל עם גזה כדי למנוע דימום נוסף. לאחר התראה מלאה וניידים (בדרך כלל 3-5 דקות), להחזיר את העכבר לכלוב ההחזקה שלו.
- אפשר לקריש דם במשך 30 עד 60 דקות בטמפרטורת החדר (RT), ולאחר מכן הצנטריפוגה דם עבור 10 דקות ב 2,000 x g ב -4 ° c צנטריפוגה בקירור. באמצעות טכניקת צנרת נקייה, לאסוף סרום לתוך חדש, המסומן בקבוקון 0.5 mL. בקבוקון מיידי של סרום ב-80 ° c.
- אוסף שדרתי בתהליך הישרדות
הערה: הליך זה מיועד לניתוח הישרדות, והוא מבוסס על הפרוטוקול שפורסם על ידי ליו ו דאף ב-200815. העכברים מורדם על ידי קטמין (20 מ"ג/ml), xylazine (0.5 mg/ml), ו-איזופרומאזין (0.5 mg/ml) קוקטייל מנוהל intraperitoneally.- הזז את הכלובים המכילים עכברים מהמדף לאזור עבודה מיועד לניתוח. הכן מרחב ניתוח בסביבה סטרילית. ודא כי כל המכשירים והחומרים המשמשים הם מעוקר לפני הניתוח.
- שוקלים את העכבר ולחשב את נפח ההרדמה הדרוש (0.1 mL של קוקטייל הרדמה עבור 20 גרם עכבר). . הכנס intraperitoneally הרדמה16 אחרי כמה דקות, לבדוק את העכבר על ידי צובט את footpad כדי להבטיח הרדמה נאותה. אם נדרש יותר הרדמה, הכנסה נוספת 0.01 ל0.03 mL של קוקטייל הרדמה.
- השתמש או מספריים או מכונת גילוח כדי לגלח אזור קטן של הראש, על קצה caudal, המדיאלי על הגולגולת, כדי לחשוף שטח עבודה גדול מספיק לאוסף שדרתי. הצב את העכבר בתנוחה הנוטה על המכשיר הסטריאוטקאלי, והגבר את הראש באמצעות פסיהאוזן (איור 2 א).
הערה: העכבר מונח כך שהראש יוצר זווית כמעט 135 ° עם הגוף (איור 2A). לאחר שבעל החיים מוצב, משתמשים בעטוף כירורגי כדי לשמור על שדה סטרילי באתר הכירורגי. וילונות דבק ברור הם העדיפו עבור אוסף שדרתי בעכברים, כפי שהם מאפשרים ויזואליזציה ישירה וממוקדת יותר של החיה. - לנגב את האתר כירורגי עם 30% כלורהקאיטין diacetate. באמצעות אזמל סטרילי, לעשות חתך משונן של העור נחות occiput לחשוף את השרירים על גבי cisterna מגנה.
- על ידי ניתוח קהה עם מלקחיים, להפריד את הרקמה התת עורית ואת השרירים כדי לחשוף את cisterna מגנה (איור 2B). השתמש בטרקטורים כדי להחזיק את השרירים בנפרד (איור 2B) ולחשוף את השכבה המנcisterna של דורא מאטר על פני הגנה.
- שטוף בעדינות עם תמיסת מלח מוזרמת פוספט סטרילית (PBS) כדי להסיר זיהום דם אפשרי. כתם יבש מאטר דורא עם ספוגית כותנה סטרילית בעדינות לנקב את הקרום המכסה את cisterna מגנה עם המחט 30 G. במהירות ובעדינות להוסיף צינור זכוכית קטנה נימי לאסוף שדרתי (איור 2C).
הערה: לחץ תוך-גולגולתי מאפשר לזרם באופן ספונטני לזרום בצורה ספונטנית לקפילר (איור 2C). בהתאם לגיל ולגודל של העכבר, כ 5 למעלה-12 μL של שדרתי מתקבל מכל עכבר. - הסירו בזהירות את צינורית הקפילר מהקרום. לחבר את הצינור ל 3 מ ל מזרק דרך אבובים פוליאתילן (טבלה של חומרים) ולהזריק את המבחנה שנאספו לתוך מתויג 0.5 mL צינור (איור 2d). . שמור על הבקבוקונים בקרח
- סגירת חתך באמצעות תפר polydioxanone (PDS) עם מחט חד פעמי באמצעות תפרים קבורים17. לנקות את האזור של דם יבש או רקמות.
- הכנס עכברים, תת-עורי או intraperitoneally16, עם 0.05-0.1 מ"ג/ק"ג של בופרינורפין הידרוכלוריד כטיפול כאבים. כמו כן, להזריק תת-עורי 1 מ ל של תמיסת מלח סטרילי כדי למנוע התייבשות.
- מניחים את העכבר חזרה בכלוב נקי וחמים להחלמה. ברגע שהעכבר נייד ומסוגל להגיע למזון ולמים, הנח את הכלוב בחזרה על המדף.
- צנטריפוגה שדרתי עבור 10 דקות ב 1,000 x g ב 4 מעלות צלזיוס צנטריפוגה בקירור. בדוק את מידת זיהום הדם על ידי בדיקה חזותית לזיהוי של קסנטוכרומיה ונוכחות של גלולה אדומה בתחתית הצינור. . התעלם מדגימות מזוהמות דם
הערה: הנוסחה המשמשת לתיקון כמויות חלבון מתוך שדרתי בדגימות דם מזוהמות מבוססת על פרמטרי המשוואה הכוללים תוכן חלבון ב שדרתי וסרום, המטוקריט (HCT), ותאי דם אדומים (RBC) לספור ב שדרתי דם18. עם זאת, אסטרטגיית תיקון כזו לא יכולה להיות מוחלת בקלות על דגימות שדרתי של העכבר בגלל הנפח הקטן, ולכן להגביל את אסטרטגיית התיקון לבדיקה חזותית. - באמצעות טכניקת צנרת נקייה, לאסוף את שפופרת הזרע לתוך צינור חדש 0.2 mL, משאיר מאחורי הגלולה עם תאים. דלל את שדרתי 1:3 עם PBS כדי להפחית את אובדן נפח עקב תרסיס. להקפיא מיד את המבחנה של שדרתי ב-80 ° c.
- רטרו-המסלול דימום הליך עבור אוסף הנסיוב.
- אוסף של סרום ומלא שדרתי באמצעות הליכי אי-הישרדות
הערה: עבור אוסף נוזלים שאינם להישרדות, אוסף שדרתי מקודם אוסף הנסיוב כמו העכבר צריך להיות דופק.- איסוף שדרתי
הערה: הליך זה מיועד לניתוח אי-הישרדות, ובערך 10-20 μL של שדרתי מתקבל מכל עכבר. שדה כירורגי סטרילי מומלץ, אך אינו נדרש ניתוח שאינו הישרדות.- הזז את הכלובים המכילים עכברים מארון התקשורת למרחב עבודה נוח. בצע את השלבים 1.1.2.2-1.1.2.7 ו 1.1.2.11-1.1.2.12 עבור אוסף שדרתי. המשך למדור 1.2.2. עבור אוסף הנסיוב
- איסוף דם באמצעות ניקוב תאיים (גישה פתוחה)
הערה: כמויות הדם הצפויות הוא כ 3% ממשקל הגוף, למשל, 0.6 mL מ 20 גרם עכבר.- האוסף העוקב אחר השדרתי מבטיחים שהעכבר עדיין מורדם מספיק על ידי צביפת הרגליים. אם כל תגובה היא נצפתה, לתת מנה שנייה של הרדמה. . אם התגובה לא נצפתה, המשך
- מניחים את החיה על הגב לנקות את העור על הבטן עם 70% אלכוהול. עם מספריים כירורגיים, פתחו את חלל. החזה וחשפו את הלב הכנס מחט של 25 גרם (המצורפת ל 3 מזרק mL) לתוך החדר השמאלי ולהחיל בעדינות לחץ שלילי על המזרק מזרק. משיכת המחט לאחר דם נאסף.
- לבצע שיטה משנית של המתת חסד כגון עריפת ראש או פריקה צוואר הרחם כדי להבטיח כי החיה הוא נפטר.
- לדחוף את הבוכנה של המזרק למטה ולהזריק את הדם שנאסף לתוך בקבוקון 1.5 mL. אפשר דם כדי קריש 30-60 דקות ב RT ולאחר מכן צנטריפוגה אותו עבור 10 דקות ב 2,000 x g ב-4 מעלות של צנטריפוגה בקירור.
- באמצעות טכניקת הפיפטה נקי, לאסוף סרום לתוך בקבוקון חדש, המסומן 0.5 mL. בקבוקון הקפאה מיידי של סרום במקפיא של 80 ° c.
- איסוף שדרתי
2. אנליזת חלבון
- השתמש בשיטה מועדפת, לדוגמה, טכנולוגיית לומיקס, עבור כימות חלבון היעד (ים) ואלבומין בדגימות שדרתי.
הערה: הנה, דוגמה ניתנת עם טכנולוגיה מגנטית של לומיקס, אך כמעט כל טכניקה המודד כמויות חלבונים, כולל חיסוני הקשורות לאנזימים (אליפי), ניתן להחיל על הפרוטוקול הנוכחי. באופן אידיאלי, דגימות שדרתי וסרום מופעל לשני אלבומין והיעד חלבונים על אותה פלטפורמה. תנאי שילובים חייב להיות ממוטב עבור צעדים מכריעים בפרוטוקול כגון, אנטיגן מצמד הריכוז, סרום ו שדרתי לדוגמה דילול, עקומות סטנדרטיות התאמה הטובה ביותר עבור כל אנליטה, והרכב המאגר כדי להפחית את הפעילות החוזרת לא ספציפית. אם משתמשים בערכה מסחרית למדידת חלבונים, לדוגמה, ערכת הקלדה החיסוני האיזובולין (רשימת חומרים) המשמש לקבלת נתונים המוצגים באיור 3, הוראות היצרנים יש לעקוב.- עם הפשרה ולפני ניתוח, צנטריפוגה שדרתי ודגימות סרום (2,000 x g עבור 10 דקות) ולהשתמש supernatant כדי למנוע סתימת לוחיות הסינון ו/או לחקור. בצע את תהליך הטיפול שסופק עם הערכה עבור מדלל דגימה המתאימות. אחרת, לקבוע את הדילול המתאים עבור כל האנליטה ונוזל. . לדלל דגימות בערוץ הPBS בהתאם
הערה: אם אין הנחיות מסוימות או הוראות, מדלל עבור כל אנליטה ונוזל צריך להיות מוקם לפני הבדיקה המחקר, על ידי קביעת טווחי דילול המתאים הדרושים כדי להשיג הערכות ריכוז הנופלים בתוך ה טווח אמין של עקומה סטנדרטית. הכרת המאפיינים של המדגם הביולוגי להיות מנותח, למשל, ריכוזים פיזיולוגיים ופתולוגיים בנוזל, מאפשר לנסות מדלל שונים עם דגימות של תוכן נמוך, בינוני, וגבוה. אם הטווח הצפוי של ריכוזים בדגימות ידוע פריורי, הדילול ניתן לבחור לאחר חישוב כמה פעמים המדגם צריך להיות מדולל כדי להיות בתוך טווח העיקול הרגיל הנבחר.
התראה: על-ידי חישוב גורמי הדילול, זכור כי שדרתי כבר מדולל 1:3. - הכן עקומה סטנדרטית עבור כל חלבון של עניין, למשל, אלבומין ו IgG כפי שנעשה שימוש כדי ליצור נתונים באיור 3, על ידי התייחסות מדלל סדרתי חלבונים סטנדרטיים. במהלך הכנת עקומות סטנדרטיות, לערבב ביסודיות כל ריכוז גבוה לפני ביצוע הדילול הבא.
הערה: ללא קשר לשיטה שנבחרה לכמת, הכרחי לכלול עיקול סטנדרטי בכל פעם שההערכה מבוצעת להערכת החלבון (עם) ריכוז בדגימות. הבחירה הטובה ביותר עבור תקן התייחסות היא ריכוז מזוקק, ידוע של חלבון הריבית. ההחלטה על הדילול הספציפי, כמו גם על מספר נקודות הנתונים והמשכפלת המשמשות להגדרת העקומה הסטנדרטית, תלויה בדרגת היניאריות בעקומה הסטנדרטית. - בחר את התאים המתאימים לנוגדנים מגנטיים מצמידים (טבלת חומרים). עבור מבחנות בודדות של חרוזים, sonicate כל בקבוקון עבור 30 s ומערבולת עבור 1 דקות. להכין "תערובת חרוזים עבודה" על ידי דילול מניות חרוז לריכוז הסופי של 50 חרוזים של כל סט/μL בתוך שיטת העבודה/שטיפת מאגר (PBS, 1% הסרום בימין). הוסף 50 μL של החרוזים מעורבים לכל באר בתחתית שטוח 96-באר (לוח חומרים).
התראה: חרוזי הפלורסנט רגישים לאור. לכן, הם צריכים להיות מוגנים מפני חשיפה ממושכת לאור במהלך ההליך. - דיאגרמת מיקום של רקעים, תקנים ודגימות בגליון עבודה של מפה טובה.
- הוסף 50 μL של מאגר התקן/לשטוף את כל הרקע היטב, ו 50 μL של כל תקן לבארות עבור העקומה הרגילה. טען 50 mL של כל מדגם מדולל לתוך הבארות המתאימות אחרון. לעטוף את הצלחת עם רדיד מנייר ו-דגירה עם עצבנות (~ 800 rpm) על שייקר צלחת עבור 30 דקות ב RT.
- מניחים את הצלחת על מגנט כף יד (טבלה של חומרים) ולהניח את הצלחת על המגנט של ~ 60 s כדי לאפשר הגדרה מלאה של חרוזים מגנטיים. הסירו את התוכן היטב בעזרת היין העדין של הצלחת ולוחית ההקשה על רפידות ספיגה כדי להסיר נוזל שיורית.
- לשטוף את הצלחת על ידי הסרת אותו מן המגנט, על ידי הוספת 200 μL של שיטת החישוב/לשטוף מאגר, על ידי טלטול עבור ~ 30 s, ולבסוף על ידי הצמדת אותו מחדש למגנט. חזור על כביסה 3x.
- לדלל את נוגדן זיהוי biotinylated, כלומר, ביוטין התווית נוגדן העלה נגד מינים מארחים חלבון, כדי 4 μg/mL בתוך מאגר בדיקות/לשטוף. הוסף 50 μL של נוגדן לזיהוי מדולל לכל טוב. לכסות את הצלחת ו דגירה עבור 30 דקות ב-RT על שייקר צלחת ב ~ 800 rpm. הנח את הצלחת על המגנט וחזור על הצעדים 2.1.6 ו 2.1.7.
- לדלל את הפיקוארירין (PE)-streptavidin מצומנת (SAPE) עד 4 μg/mL בתוך מאגר הערכה/שטיפת. הוסף 50 μL של SAPE מדולל לכל טוב. לכסות את הצלחת ו דגירה עבור 30 דקות ב-RT על שייקר צלחת ב ~ 800 rpm. הנח את הצלחת על המגנט וחזור על הצעדים 2.1.6 ו 2.1.7.
- הסר את הצלחת מהמגנט והשהה מחדש את החרוזים ב-100 μL של מאגר השוטף. לקרוא בארות עם מכשיר לייזר כפול תזרים מבוסס איתור המאפשר זיהוי של הגודל של עוצמת הזריחה PE (FI).
הערה: האות, למשל, FI, שנוצר פרופורציונלי על כמות אנטיגן היעד המצורפת למשטח של החרוזים. - לייצא נתונים גולמיים וליצור עקומות סטנדרטיות על-ידי אות זיהוי גרפים מסוג FI לעומת ריכוזי חלבון סטנדרטיים. השתמש בעקומות הסטנדרטיות כדי לחשב את ריכוז האנליט (ות) בדגימות.
הערה: אלבומין מבוטא ב-g/dL, ואילו חלבונים של עניין מבוטאים לידי ביטוי ב-mg/dL.
- עם הפשרה ולפני ניתוח, צנטריפוגה שדרתי ודגימות סרום (2,000 x g עבור 10 דקות) ולהשתמש supernatant כדי למנוע סתימת לוחיות הסינון ו/או לחקור. בצע את תהליך הטיפול שסופק עם הערכה עבור מדלל דגימה המתאימות. אחרת, לקבוע את הדילול המתאים עבור כל האנליטה ונוזל. . לדלל דגימות בערוץ הPBS בהתאם
3. חישובי המדד הפנימי
- ארגן ערכי ריכוז חלבונים בגיליון אלקטרוני ונתח את התוצאות על-ידי החלת הנוסחאות הבאות.
- חישובשאלה:

כאשראלבומין השדרתי והסרוםאלבומין הם ריכוזים של אלבומין מתאים בסרום ובדגימות שדרתי, בהתאמה. - חישובחלבוןQ:
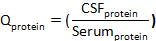
בוחלבון שדרתיוחלבון סרום הם ריכוזים של חלבון מטרה (s) בתאים ודגימות שדרתי, בהתאמה. - חשב את אינדקס החלבון:
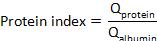
תוצאות
זה ניסוי מייצג שנועד להשוות את הסינתזה הפנימי של IgG בשני מודלים מכרסמים רלוונטיים קלינית של טרשת נפוצה (MS): המושרה PLP139-151הנגרמת אוטואימוניות Encephalomyelitis (R-השני) ואת כרונית מתקדמת, מורלין encephalomyelitis הנגרמת וירוס המושרה המחלה deמחלות (TMEV-IDD). R-הם מודל שימושי להבנת הישנות-MS, ואילו מודל TMEV-IDD תכו...
Discussion
שיטות כמותיים להערכת ריכוזי חלבון שדרתי מוגברת הם כלים שימושיים באפיון המצב הפיזיולוגי והפתולוגי של ה-CN. עם זאת, מעבר לקוונפיקציה אמין של רמות חלבון שדרתי, הזיהוי של חלבונים מתוך שדרתי מחייב ביטוי של תוצאות המפלה בין שברים דם ומערכת התחתית של שדרתי. עם זאת, עד כה, כימות החלבון הנפוץ בשימוש ?...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים מודים לצוות המרכז לרפואה השוואתית ומחקר (CCMR) ב דארטמאות עבור הטיפול המומחים שלהם העכברים המשמשים למחקרים אלה. קופת המחקר של בורנשטיין מימנה את המחקר הזה.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
References
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved