É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição quantitativa de proteínas sintetizadas intrathecally em camundongos
Neste Artigo
Resumo
Níveis elevados de proteína do fluido espinhal podem ser o resultado da difusão da proteína plasmática através de uma barreira hemato-cerebral alterada ou síntese intratérica. Um protocolo de teste otimizado é apresentado neste artigo que ajuda a discriminar ambos os casos e fornece medições quantitativas de proteínas sintetizadas intrathecally.
Resumo
O líquido cefalorraquidiano (CSF), um fluido encontrado no cérebro e na medula espinhal, é de grande importância para a ciência básica e clínica. A análise da composição da proteína CSF fornece informações cruciais na pesquisa básica de neurociência, bem como doenças neurológicas. Uma ressalva é que as proteínas medidas em CSF podem derivar da síntese intrathecal e da transudação do soro, e a análise da proteína de CSF pode somente determinar a soma destes dois componentes. Para discriminar entre a transudação de proteínas do sangue e proteínas intrathecally produzidas em modelos animais, bem como em seres humanos, as medições de perfil de proteína CSF usando ferramentas convencionais de análise de proteínadevem incluir o cálculo do quociente de csf/soro albumina(q albumina),um marcador da integridade da interface sangue-cérebro (BBI) e do índice de proteína(q proteína/q albumina), uma estimativa de síntese de proteína intrathecal. Este protocolo ilustra todo o procedimento, desde csf e coleta de sangue para quocientes e cálculos de índices, para a medição quantitativa da síntese intratês de proteínas e imparidade BBI em modelos de camundongos de distúrbios neurológicos.
Introdução
O líquido cefalorraquidiano (CSF), um líquido claro e incolor em torno do cérebro e da medula espinhal, tem grande importância científica clínica e básica. O CSF preserva o ambiente eletrólitico do sistema nervoso central (SNC), equilibra o estado sistêmico de base ácida, fornece nutrientes para células neuronais e gliais, funciona como um sistema linfático para o SNC, e transporta hormônios, neurotransmissores, citocinas e outros neuropeptídeos em todo o CNS1. Assim, como a composição do CSF reflete a atividade do SNC, esse fluido oferece um acesso valioso, embora indireto, para caracterizar o estado fisiológico e patológico do SNC.
A CSF tem sido usada para diagnosticar condições que afetam o SNC há mais de cem anos, e durante a maior parte desse tempo, foi estudada principalmente pelos clínicos como uma ferramenta de diagnóstico. No entanto, nos últimos anos, os neurobiólogos reconheceram o potencial da CSF para estudar a fisiopatologia do SNC. Em particular, várias ferramentas de análise de proteína de alta taxa de vesperção foram introduzidas no reino da neurociência, permitindo um estudo detalhado da composição proteica do CSF, com a expectativa de que esta análise possa ajudar a fornecer informações sobre as mudanças dinâmicas ocorrendo dentro do SNC.
Desenvolvimentos tecnológicos em técnicas de imunoensaio multiplex, como luminex e simoa tecnologias2,3, fornecer pesquisadores hoje com a capacidade de detectar centenas de proteínas em concentrações muito baixas. Além disso, essas mesmas tecnologias permitem o uso de pequenos volumes de amostras, promovendo assim estudos em pequenos animais, incluindo camundongos, nos quais volumes de amostras limitados de CSF impediram caracterizações detalhadas do fluido até recentemente.
No entanto, uma ressalva é que as proteínas medidas em CSF podem derivar da síntese intrathecal e/ou transudação do soro devido a uma interface sangue-cérebro danificada (BBI). Infelizmente, a análise de proteínas da CSF por si só só pode determinar a soma desses dois componentes. Para discriminar entre proteínas produzidas transudate e intrathecally, as medidas da proteína de CSF usando toda a ferramenta disponível da análise da proteína devem ser ajustadas para a variabilidade individual em concentrações do soro assim como a integridade da barreira. No entanto, embora esse ajuste seja comumente usado na prática clínica, por exemplo, o índice CSF IgG, que tem alta sensibilidade para detectar a síntese intrathecal igg4,5,6, até o momento, muito poucos estudos de pesquisa corrigiram concentrações de proteína CSF para concentração de soro e integridade de barreira7,8.
Atualmente, a abordagem Reibergram é a melhor maneira de determinar a função de barreira e síntese intratérica de proteínas. É uma avaliação gráfica em diagramas quocientes csf/sérico que analisa, de forma integrada, tanto a função de barreira (dys) quanto a síntese intratais de proteínas, referindo-se a uma proteína exclusivamente derivada do sangue9,10. A albumina de proteína altamente abundante é geralmente escolhida como proteína de referência porque é produzida apenas no fígado e porque seu tamanho, aproximadamente 70 kDa, é intermediário entre proteínas pequenas e grandes11. O diagrama de análise foi definido pela primeira vez por Reiber e Felgenhauer em 1987 para as principais classes de imunoglobulinas (Igs)11, sendo empiricamente com base nos resultados obtidos a partir da análise de milhares de amostras humanas9. A abordagem foi posteriormente confirmada pela aplicação das duas leis de difusão de Fick na teoria da difusão molecular/taxa de fluxo12. Tal teoria demonstra que a difusão de uma proteína através da barreira tem uma distribuição hiperbólica e pode explicar quantitativamente a dinâmica das proteínas no SNC9,13. No geral, a vantagem de usar o Reibergram para demonstrar a síntese intrathecal de proteínaé que ela identifica simultaneamente a fração de proteína que entra no CSF do soro, bem como a quantidade de proteína encontrada no CSF por causa da produção local.
O presente artigo e o protocolo relacionado descrevem todo o procedimento, desde csf e coleta de sangue até os cálculos finais corrigindo os níveis de proteína CSF, para a medição quantitativa da síntese intrathecal de proteínas em modelos de camundongos de Distúrbios. Este procedimento fornece uma linha de base contra a qual avaliar (1) a origem fisiopatológica de qualquer proteína CSF e (2) a estabilidade e o significado funcional da integridade da barreira. Este procedimento e protocolo não são apenas úteis para avaliar amostras de CSF de camundongos, mas também são úteis na análise de CSF em uma infinidade de modelos animais de doenças neurológicas e pacientes humanos.
Protocolo
Todo o trabalho animal utiliza protocolos revisados e aprovados pelo Institutional Animal Care and Use Committee (IACUC) da Geisel School of Medicine em Dartmouth.
1. Coleta de fluidos
NOTA: Tanto o soro quanto o CSF são necessários. Dois protocolos para cada coleta de fluidos são necessários para a sobrevivência e necropsia.
- Coleta de soro e CSF usando procedimentos de sobrevivência
NOTA: Para a coleta de fluidos de sobrevivência, a coleta de soro deve preceder a coleta de CSF, pois é um procedimento menos invasivo. CSF deve ser obtido dentro de uma semana de sorteio de soro.- Procedimento retro-orbital do sangramento para a coleção do soro.
NOTA: Este procedimento é para a sobrevivência sangrando de ratos14. O procedimento descrito aplica-se a qualquer idade, sexo e cepa de camundongos. Uma vez que as regras da IACUC ditam que um volume máximo de sangue de 1% do peso corporal pode ser removido como um único levantamento de sangue, recomenda-se que o procedimento seja realizado apenas em camundongos com peso superior a 15 g.- Mova as gaiolas contendo ratos do rack para uma área de trabalho apropriada. Prepare a máquina de gás da anestesia girando sobre o medidor de fluxo do oxigênio a 1 L/min.
- Coloque o animal na câmara de indução e feche a tampa firmemente. Ligue o vaporizador isoflurano para 3,5% e monitorar o animal até reclinar.
- Retire o animal da câmara e avalie o nível de anestesia por reflexo do pedal, ou seja, pitada firme de footpad. Assegurar profundidade adequada de anestesia antes de realizar o procedimento: a falta de resposta a uma pitada firme indica anestesia adequada.
- Contenha o rato anestesiado agarrando a pele solta atrás das orelhas com o polegar e o dedo indicador da mão não dominante. Aprotuberância os olhos usando o dedo indicador para desenhar para trás a pele acima do olho e do polegar para desenhar para trás a pele abaixo dos olhos.
- Coloque a ponta de uma pipeta Pasteur na órbita ocular debaixo do globo ocular(Figura 1,painel esquerdo), direcionando a ponta em aproximadamente 45° em direção ao meio da órbita ocular(Figura 1,painel direito). Gire a pipeta entre os dedos durante a passagem para a frente. Aplique pressão suave e, em seguida, solte até que o sangue está entrando na pipeta.
NOTA: A quantidade máxima de sangue que pode ser retirada ao mesmo tempo a partir deste local é de cerca de 1% do peso corporal, por exemplo, 0,2 mL de um rato de 20 g. - Retire suavemente o capilar para evitar lesões no olho e coloque o sangue coletado em um tubo de centrífuga de 1,5 mL. Feche a pálpebra e aplique pressão leve com gaze para evitar mais sangramento. Uma vez totalmente alerta e móvel (geralmente 3-5 min), devolva o mouse à sua gaiola de espera.
- Permita que o sangue coagule por 30 a 60 min à temperatura ambiente (RT), depois o sangue centrífuga por 10 min a 2.000 x g em uma centrífuga refrigerada de 4 °C. Usando uma técnica de pipeta limpa, coletar soro em um novo frasco de 0,5 mL rotulado. Congele imediatamente o frasco do soro em -80 °C.
- Coleção CSF com procedimento de sobrevivência
NOTA: Este procedimento é para cirurgia de sobrevivência, e é baseado no protocolo publicado por Liu e Duff em 200815. Os camundongos são anestesiados por um coquetel de cetamina (20 mg/mL), xilazine (0,5 mg/mL) e acepromazine (0,5 mg/mL) administrado intraperitoneally.- Mova as gaiolas contendo ratos do rack para uma área de trabalho de cirurgia designada. Prepare o espaço da cirurgia em um ambiente estéril. Certifique-se de que todos os instrumentos e materiais utilizados sejam esterilizados antes da cirurgia.
- Pese o mouse e calcule o volume de anestesia necessário (0,1 mL de coquetel de anestesia para um mouse de 20 g). Injetar anestesia intraperitoneally16. Depois de alguns minutos, teste o mouse apertando o bloco de pouso para garantir anestesia adequada. Se for necessário mais anestésico, injete ainda mais 0,01 a 0,03 mL do coquetel anestésico.
- Use uma tesoura ou um barbeador para raspar uma pequena área da cabeça, na extremidade caudal, medial no crânio, para expor grande área de trabalho suficiente para a coleta de CSF. Posicione o mouse na posição prona no instrumento estereotipado, e estabilize a cabeça usando barras de ouvido (Figura 2A).
NOTA: O rato é colocado de modo que a cabeça dá forma a um ângulo de quase 135° com o corpo (figura 2A). Uma vez que o animal é posicionado, uma cortina cirúrgica é usada para manter um campo estéril no local cirúrgico. Cortinas adesivas claras são preferidas para a coleta de CSF em camundongos, pois permitem a visualização direta e mais focada do animal. - Cotonete o local cirúrgico com 30% de cloroxina diacetate. Usando um bisturi estéril, faça uma incisão softal da pele inferior ao occiput para expor os músculos sobrepondo a cisterna magna.
- Por dissecação contundente com fórceps, separe o tecido subcutâneo e músculos para expor a cisterna magna (Figura 2B). Use micrortratores para manter os músculos separados(Figura 2B)e expor a camada meningeal dura mater sobre a cisterna magna.
- Lave delicadamente com soline fosfato-amortecedor estéril (PBS) para remover toda a contaminação possível do sangue. Borrar secar a dura mater com um cotonete estéril e delicadamente perfurar a membrana que cobre a cisterna magna com uma agulha de 30 G. Rapidamente e delicadamente inserir um pequeno tubo capilar de vidro para coletar CSF (Figura 2C).
NOTA: A pressão intracraniana permite que a CSF flua espontaneamente para o capilar(Figura 2C). Dependendo da idade e tamanho do mouse, aproximadamente 5 a 12 μL de CSF é obtido de cada mouse. - Retire cuidadosamente o tubo capilar da membrana. Conecte o tubo a uma seringa de 3 mL através de uma tubulação de polietileno(Mesa de Materiais)e injete o CSF coletado em um tubo de 0,5 mL rotulado(Figura 2D). Mantenha frascos no gelo.
- Close incisão usando sutura de polidioxanona (PDS) com agulha descartável e usando suturas enterradas17. Limpe a área de qualquer sangue seco ou tecido.
- Injetar camundongos, subcutânea ou intraperitoneally16, com 0,05-0,1 mg /kg de cloridrato de buprenorfina como tratamento analgésico. Além disso, injetar subcutâneamente 1 mL de soline estéril para evitar a desidratação.
- Coloque o rato de volta em uma gaiola limpa e quente para a recuperação. Uma vez que o mouse é móvel e capaz de alcançar comida e água, coloque a gaiola de volta no rack.
- Centrífuga CSF por 10 min a 1.000 x g em uma centrífuga refrigerada de 4 °C. Verifique o grau de contaminação do sangue por inspeção visual para identificação de xantocromia e presença de uma pelota vermelha no fundo do tubo. Descarte amostras contaminadas com sangue.
NOTA: A fórmula utilizada para a correção de quantidades de proteína CSF em espécimes contaminados pelo sangue é baseada em parâmetros de equação que incluem teor de proteína em CSF e soro, hematócrito (HCT) e glóbulos vermelhos (RBC) contam em CSF e sangue18. No entanto, essa estratégia de correção não pode ser facilmente aplicada aos espécimes de CSF de camundongos devido ao pequeno volume, limitando assim a estratégia de correção a uma inspeção visual. - Usando uma técnica de pipeta limpa, coletar CSF em um novo tubo de 0,2 mL, deixando para trás a pelota com células. Diluir CSF 1:3 com PBS para reduzir a perda de volume devido ao aerossol. Congele imediatamente o frasco de CSF em -80 °C.
- Procedimento retro-orbital do sangramento para a coleção do soro.
- Coleta de soro e CSF usando procedimentos de não sobrevivência
NOTA: Para a coleta de fluidos de não sobrevivência, a coleta de CSF precede a coleta de soro, pois o mouse precisa ter pulso.- Coleção CSF na necropsia
NOTA: Este procedimento é para cirurgia de não sobrevivência, e aproximadamente 10 a 20 μL de CSF é obtido de cada mouse. Um campo cirúrgico estéril é recomendado, mas não necessário para a cirurgia da não-sobrevivência.- Mova as gaiolas contendo ratos do rack para um espaço de trabalho confortável. Siga os passos 1.1.2.2-1.1.2.7 e 1.1.2.11-1.1.2.12 para a coleta de CSF. Agvire-se à seção 1.2.2 para a coleção do soro.
- Coleta de sangue por perfuração intracardíaca (aproximação aberta)
NOTA: Os volumes de sangue esperados é de aproximadamente 3% do peso corporal, por exemplo, 0,6 mL de um mouse de 20 g.- Após a coleta de CSF garantir que o mouse ainda é suficientemente anestesiado, beliscando o footpad. Se alguma reação for observada, administrar uma segunda dose de anestesia. Se nenhuma reação for observada, prossiga.
- Coloque o animal nas costas e pele de cotonete no abdômen com 70% de álcool. Com tesoura cirúrgica, abra a cavidade torácica e exponha o coração. Insira uma agulha de 25 G (presa a uma seringa de 3 mL) no ventrículo esquerdo e aplique suavemente pressão negativa sobre o desentupidor de seringa. Retire a agulha depois que o sangue foi coletado.
- Realize um método secundário de eutanásia, como decapitação ou luxação cervical, para garantir que o animal seja falecido.
- Empurre o desentupidor da seringa para baixo e injetar o sangue coletado em um frasco de 1,5 mL. Permitir que o sangue coagular por 30-60 min em RT e, em seguida, centrífuga por 10 min a 2.000 x g em uma centrífuga refrigerada de 4 °C.
- Usando a técnica de pipeta limpa, coletar soro em um frasco novo, rotulado 0,5 mL. Congele imediatamente o frasco do soro em um congelador de -80°C.
- Coleção CSF na necropsia
2. Análise de proteínas
- Use um método preferido, por exemplo, a tecnologia Luminex, para quantificar a proteína alvo (s) e albumina em espécimes combinados de soro e CSF.
NOTA: Aqui, um exemplo é dado com a tecnologia magnética Luminex, mas praticamente qualquer técnica que meça quantidades de proteínas, incluindo ensaios imunosorbentligados por enzimas (ELISAs), pode ser aplicada ao protocolo atual. Idealmente, as amostras de CSF e soro são executadas para proteínas de albumina e alvo na mesma plataforma. As condições de ensaio devem ser otimizadas para etapas cruciais no protocolo, como concentração de acoplamento de antígeno, diluições de amostras de soro e CSF, curvas padrão mais adequadas para cada análito e composição tampão para reduzir a reatividade não específica. Se um kit comercial é usado para medição de proteínas, por exemplo, o kit de isotipagem de imunoglobulina (Tabela de Materiais) utilizados para obter dados apresentadosFigura 3, as instruções dos fabricantes têm de ser seguidas.- Ao descongelar e antes da análise, a centrífuga CSF e amostras de soro (2.000 x g por 10 minutos) e usam o supernatant para evitar entupimento das placas de filtro e/ou sonda. Siga o procedimento de ensaio fornecido com o kit para diluições de amostra apropriadas. Caso contrário, determinar a diluição adequada para cada anályte e fluido. Diluir amostras em PBS em conformidade.
NOTA: Se não houver orientações ou instruções específicas, as diluições para cada analita e fluido devem ser estabelecidas antes do teste do estudo, determinando as faixas de diluição apropriadas necessárias para obter estimativas de concentração que se enquadram mais alcance confiável de uma curva padrão. Conhecer as características da amostra biológica a ser analisada, por exemplo, concentrações fisiológicas e patológicas no fluido, permite tentar diferentes diluições com amostras de baixo, médio e alto teor de análise. Se a faixa esperada de concentrações nas amostras for conhecida a priori, as diluições podem ser selecionadas após o cálculo de quantas vezes a amostra precisa ser diluída para estar dentro da faixa de curva padrão escolhida.
CUIDADO: Ao calcular os fatores de diluição, lembre-se que a CSF já foi diluída 1:3. - Prepare uma curva padrão para cada proteína de interesse, por exemplo, albumina e IgG como usado para gerar dados na Figura 3, por proteínas padrão de referência de diluição em série. Durante a preparação das curvas padrão, misture completamente cada concentração mais alta antes de fazer a próxima diluição.
NOTA: Independentemente do método escolhido de quantificação, é essencial incluir uma curva padrão cada vez que o ensaio é realizado para estimar a concentração de proteínas em amostras. A melhor escolha para um padrão de referência é uma concentração purificada e conhecida da proteína de interesse. Decidir sobre as diluições específicas, bem como o número de pontos de dados e replicações usadas para definir a curva padrão, depende do grau de não linearidade na curva padrão. - Selecione os conjuntos de contas magnéticas acoplados ao anticorpo apropriados(Mesa de Materiais). Para frascos individuais de contas, sonicate cada frasco para 30 s e vórtice para 1 min. Prepare uma "mistura de contas de trabalho", diluindo os estoques de contas para uma concentração final de 50 contas de cada conjunto / μL em ensaio / tampão de lavagem (PBS, 1% albumina soro bovina [BSA]). Adicione 50 μL das contas mistas a cada poço em uma placa de 96 poços de fundo chato(Mesa de Materiais).
CUIDADO: As contas fluorescentes são sensíveis à luz. Portanto, eles devem ser protegidos da exposição prolongada à luz durante todo o procedimento. - Diagrame a colocação de fundos, padrões e amostras em uma planilha de mapa de poços.
- Adicione 50 μL de ensaio / tampão de lavagem para cada fundo bem, e 50 μL de cada padrão para os poços para a curva padrão. Carregue 50 mL de cada amostra diluída nos poços apropriados por último. Envolva a placa com papel alumínio e incubação com agitação (~ 800 rpm) em uma agitação placa por 30 min em RT.
- Coloque a placa em um ímã portátil(Mesa de Materiais)e descansar a placa sobre o ímã por ~ 60 s para permitir a configuração completa de contas magnéticas. Retire o conteúdo bem, decantando suavemente a placa e a placa de toque em almofadas absorventes para remover o líquido residual.
- Lave a placa removendo-a do ímã, adicionando 200 μL do amortecedor do ensaio/lavagem, agitando para ~30 s, e finalmente recolocando a ao ímã. Repita a lavagem 3x.
- Diluir o anticorpo de detecção biotinylated, ou seja, anticorpo etiquetado biotina levantadas contra a espécie hospedeira de proteína, para 4 μg/mL em ensaio / tampão de lavagem. Adicione 50 μL do anticorpo de detecção diluído a cada poço. Cubra a placa e incubar por 30 min em RT na agitação placa em ~ 800 rpm. Coloque a placa no ímã e repita os passos 2.1.6 e 2.1.7.
- Diluir a ficoerytrina (PE) conjugada streptavidin (SAPE) a 4 μg/mL em ensaio/tampão de lavagem. Adicione 50 μL de SAPE diluído a cada poço. Cubra a placa e incubar por 30 min em RT na agitação placa em ~ 800 rpm. Coloque a placa no ímã e repita os passos 2.1.6 e 2.1.7.
- Retire a placa do ímã e resuspenda as contas em 100 μL de buffer de ensaio/lavagem. Leia poços com um instrumento de detecção baseado em fluxo a laser duplo que permite a detecção da magnitude da intensidade da fluorescência de PE (FI).
NOTA: O sinal, por exemplo, FI, gerado é proporcional à quantidade de antígeno alvo ligado à superfície das contas. - Exportar dados brutos e criar curvas padrão por meio do sinal de detecção de gráficos FI versus concentrações de proteína padrão. Use a curva padrão (s) para calcular a concentração do anályte (s) nas amostras.
NOTA: Albumina é expressa preferencialmente em g / dL, enquanto as proteínas de interesse são expressas preferencialmente em mg / dL.
- Ao descongelar e antes da análise, a centrífuga CSF e amostras de soro (2.000 x g por 10 minutos) e usam o supernatant para evitar entupimento das placas de filtro e/ou sonda. Siga o procedimento de ensaio fornecido com o kit para diluições de amostra apropriadas. Caso contrário, determinar a diluição adequada para cada anályte e fluido. Diluir amostras em PBS em conformidade.
3. Cálculos do índice intrathecal
- Organize valores de concentração de proteínas em uma planilha e analise os resultados aplicando as seguintes fórmulas.
- Calculeo albuminaq:

ondecsf albumina eserum albuminsão concentrações de albumina em combinados soro e csf espécimes, respectivamente. - Calculea proteínaQ :
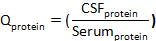
onde aproteína CSF ea proteína soro são concentrações de proteína-alvo (s) em espécimes de soro e CSF combinados, respectivamente. - Calcule o índice de proteína:
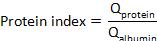
Resultados
Este experimento representativo teve como objetivo comparar a síntese intratítica do IgG em dois modelos de roedores clinicamente relevantes de esclerose múltipla (EM): a PLP139-151-induzida pela encefalomielite autoimune experimental (TMEV-IDD) e a doença de desmielinação induzida pelo vírus de Theiler. R-EAE é um modelo útil para a compreensão de EmS remitindo-remitindo-remitindo, visto que o modelo de TMEV-IDD caracteriza oM9progressivo crônico.
Discussão
Métodos quantitativos para a avaliação do aumento das concentrações de proteínas CSF são ferramentas úteis na caracterização do estado fisiológico e patológico do SNC. No entanto, além da quantificação confiável dos níveis de proteína CSF, a detecção de proteínas CSF requer uma expressão de resultados que discrimina entre frações derivadas do sangue e do SNC no CSF. No entanto, até à data, os ensaios de quantificação de proteínas comumente utilizados não permitem a discriminação entre os d...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem à equipe do Centro de Medicina e Pesquisa Comparativa (CCMR) em Dartmouth por seu cuidado especializado com os camundongos usados para esses estudos. O Fundo de Pesquisa Bornstein financiou esta pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
Referências
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados