Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantitative Messung von intrathecally Synthetisierten Proteinen bei Mäusen
In diesem Artikel
Zusammenfassung
Erhöhte Spinalflüssigkeitsproteinspiegel können entweder das Ergebnis der Diffusion von Plasmaprotein über eine veränderte Blut-Hirn-Schranke oder intrathekale Synthese sein. In diesem Artikel wird ein optimiertes Testprotokoll vorgestellt, das hilft, beide Fälle zu unterscheiden und quantitative Messungen von intrathekalen synthetisierten Proteinen liefert.
Zusammenfassung
Cerebrospinalfluid (CSF), eine Flüssigkeit im Gehirn und im Rückenmark gefunden, ist von großer Bedeutung für die grundlegende und klinische Wissenschaft. Die Analyse der CSF-Proteinzusammensetzung liefert wichtige Informationen in der grundlagenspezifischen neurowissenschaftlichen Forschung sowie neurologischen Erkrankungen. Eine Einschränkung besteht darin, dass Proteine, die in CSF gemessen werden, sowohl aus der intrathekalen Synthese als auch aus der Transudation aus Serum stammen können, und die Proteinanalyse von CSF kann nur die Summe dieser beiden Komponenten bestimmen. Um zwischen Proteintransudation aus dem Blut und intrathekal produzierten Proteinen in Tiermodellen sowie beim Menschen zu unterscheiden, müssen CSF-Proteinprofilierungsmessungen mit herkömmlichen Proteinanalysewerkzeugen die Berechnung des Albumin-CSF/Serumquotienten(Q-Albumin), eines Markers für die Integrität der Blut-Hirn-Schnittstelle (BBI) und des Proteinindex (Q-Protein/Q-Albumin ), eine Schätzung der intrathekalen Proteinsynthese umfassen. Dieses Protokoll veranschaulicht das gesamte Verfahren, von der CSF- und Blutentnahme bis hin zu Quotienten und Indexberechnungen, zur quantitativen Messung der intrathekalen Proteinsynthese und BBI-Beeinträchtigung in Mausmodellen neurologischer Störungen.
Einleitung
Cerebrospinalflüssigkeit (CSF), eine klare und farblose Flüssigkeit, die das Gehirn und das Rückenmark umgibt, hat eine große klinische und grundlegende wissenschaftliche Bedeutung. Das CSF bewahrt die elektrolytische Umgebung des Zentralnervensystems (ZNS), gleicht den systemischen Säure-Basenstatus aus, versorgt neuronale und gliale Zellen mit Nährstoffen, fungiert als Lymphsystem für das ZNS und transportiert Hormone, Neurotransmitter, Zytokine und andere Neuropeptide durch das ZNS1. Da die CSF-Zusammensetzung die Aktivität des ZNS widerspiegelt, bietet diese Flüssigkeit einen wertvollen, wenn auch indirekten Zugang, um den physiologischen und pathologischen Zustand des ZNS zu charakterisieren.
CSF wurde verwendet, um Bedingungen zu diagnostizieren, die das ZNS seit über hundert Jahren beeinflussen, und für die meiste Zeit wurde es in erster Linie von Ärzten als diagnostisches Werkzeug untersucht. In den letzten Jahren haben Neurobiologen jedoch das Potenzial von CSF für die Untersuchung der Pathophysiologie des ZNS erkannt. Insbesondere wurden im bereich der Neurowissenschaften mehrere Werkzeuge zur Proteinanalyse mit hohem Durchsatz eingeführt, die eine detaillierte Untersuchung der Proteinzusammensetzung des GFK ermöglichen, mit der Erwartung, dass diese Analyse dazu beitragen kann, Einblicke in die dynamischen Veränderungen zu geben. innerhalb des CNS auftreten.
Technologische Entwicklungen in Multiplex-Immunoassay-Techniken wie Luminex und Simoa-Technologien2,3, bieten Forschern heute die Möglichkeit, Hunderte von Proteinen in sehr niedrigen Konzentrationen zu erkennen. Darüber hinaus ermöglichen dieselben Technologien die Verwendung kleiner Probenvolumina und fördern damit Studien an Kleintieren, einschließlich Mäusen, bei denen begrenzte Probenmengen von GFK bis vor kurzem detaillierte Charakterisierungen der Flüssigkeit verhindert haben.
Eine Einschränkung ist jedoch, dass Proteine, die in CSF gemessen werden, aufgrund einer beschädigten Blut-Hirn-Schnittstelle (BBI) aus der intrathekalen Synthese und/oder Transudation aus Serum stammen können. Leider kann die Proteinanalyse von CSF allein nur die Summe dieser beiden Komponenten bestimmen. Um zwischen transudate und intrathecally produzierten Proteinen zu unterscheiden, müssen CSF-Proteinmessungen mit einem verfügbaren Proteinanalyse-Tool an die individuelle Variabilität der Serumkonzentrationen sowie die Barriereintegrität angepasst werden. Obwohl diese Anpassung häufig in der klinischen Praxis verwendet wird, z. B. der CSF-IgG-Index, der eine hohe Empfindlichkeit für den Nachweis der intrathekalen IgG-Synthese4,5,6hat bisher nur sehr wenige Studien die CSF-Proteinkonzentrationen für die Serumkonzentration und Barriereintegrität korrigiert7,8.
Derzeit ist der Reibergram-Ansatz der beste Weg, um die Barrierefunktion und intrathekale Synthese von Proteinen zu bestimmen. Es handelt sich um eine grafische Auswertung in CSF/Serumquotientendiagrammen, die auf integrierte Weise sowohl die Barrierefunktion (Dys)-Funktion als auch die intrathekale Proteinsynthese analysiert und sich auf ein ausschließlich blutabgeleitetes Protein9,10bezieht. Das reichlich reichlich eiternreiche Proteinalbumin wird in der Regel als Referenzprotein ausgewählt, da es nur in der Leber produziert wird und weil seine Größe, ca. 70 kDa, zwischen kleinen und großen Proteinen11liegt. Das Analysediagramm wurde erstmals 1987 von Reiber und Felgenhauer für die wichtigsten Klassen von Immunglobulinen (Igs)11definiert, wobei empirisch auf den Ergebnissen aus der Analyse tausender menschlicher Proben9. Der Ansatz wurde später durch die Anwendung der beiden Fick-Gesetze der Diffusion in der Theorie der molekularen Diffusion/Durchflussrate12bestätigt. Eine solche Theorie zeigt die Diffusion eines Proteins durch die Barriere hat eine hyperbolische Verteilung und kann quantitativ die Dynamik von Proteinen in der ZNS9,13erklären. Insgesamt besteht der Vorteil der Verwendung des Reibergram zum Nachweis der intrathekalen Proteinsynthese darin, dass es gleichzeitig die Proteinfraktion identifiziert, die aus dem Serum in das CSF gelangt, sowie die Menge an Protein, die im CSF aufgrund der lokalen Produktion gefunden wird.
Der vorliegende Artikel und das zugehörige Protokoll beschreiben das gesamte Verfahren, von der CSF- und Blutentnahme bis zu den endgültigen Berechnungen zur Korrektur des CSF-Proteinspiegels, für die quantitative Messung der intrathekalen Proteinsynthese in Mausmodellen neurologischer Störungen. Dieses Verfahren bietet eine Ausgangsbasis, anhand derer (1) der pathophysiologische Ursprung eines CSF-Proteins und (2) die Stabilität und funktionelle Bedeutung der Barriereintegrität beurteilt werden können. Dieses Verfahren und Protokoll sind nicht nur nützlich für die Beurteilung von Maus-CSF-Proben, sondern auch nützlich bei der Analyse von CSF in einer Vielzahl von Tiermodellen von neurologischen Erkrankungen und menschlichen Patienten.
Protokoll
Alle Tierarbeiten verwenden Protokolle, die vom Institutional Animal Care and Use Committee (IACUC) an der Geisel School of Medicine in Dartmouth überprüft und genehmigt wurden.
1. Sammlung von Flüssigkeiten
HINWEIS: Sowohl Serum als auch CSF sind erforderlich. Für das Überleben und die Nekropsie werden zwei Protokolle für jede Flüssigkeitssammlung benötigt.
- Serum- und CSF-Sammlung unter Verwendung von Überlebensverfahren
HINWEIS: Für die Survival-Flüssigkeitssammlung sollte die Serumsammlung der CSF-Sammlung vorausgehen, da es sich um ein weniger invasives Verfahren handelt. CSF muss innerhalb einer Woche nach der Ziehung des Serums erhalten werden.- Retro-orbitale Blutungsverfahren für die Serumsammlung.
HINWEIS: Dieses Verfahren ist für ÜberlebenBlutungen von Mäusen14. Das beschriebene Verfahren gilt für jedes Alter, Geschlecht und Geschlecht von Mäusen. Da die IACUC-Regeln vorschreiben, dass ein maximales Blutvolumen von 1 % des Körpergewichts als einzelne Blutentnahme entfernt werden kann, wird empfohlen, dass das Verfahren nur an Mäusen mit einem Gewicht von mehr als 15 g durchgeführt wird.- Bewegen Sie die Käfige mit Mäusen aus dem Rack in einen geeigneten Arbeitsbereich. Bereiten Sie die Anästhesie-Gasmaschine vor, indem Sie den Sauerstoffdurchflussmesser auf 1 l/min einschalten.
- Legen Sie das Tier in die Induktionskammer und schließen Sie den Deckel fest. Schalten Sie den Isofluran-Verdampfer auf 3,5% ein und überwachen Sie das Tier bis zum Liegerad.
- Entfernen Sie das Tier aus der Kammer und bewerten Sie den Grad der Anästhesie durch Pedalreflex, d.h. feste Fußpolster-Pinch. Sicherstellen einer angemessenen Tiefe der Anästhesie vor der Durchführung des Verfahrens: Mangel an Reaktion auf eine feste Prise deutet auf eine ausreichende Anästhesie.
- Halten Sie die anästhesierte Maus zurück, indem Sie die lockere Haut hinter den Ohren mit dem Daumen und Zeigefinger der nicht-dominanten Hand greifen. Wölben Sie die Augen, indem Sie den Zeigefinger verwenden, um die Haut über dem Auge und den Daumen zurückzuziehen, um die Haut unter den Augen zurückzuzeichnen.
- Legen Sie die Spitze einer Pasteur-Pipette in die Augenhöhle unter dem Augapfel(Abbildung 1, linkes Panel), und lenken Sie die Spitze bei ca. 45° in Richtung der Mitte der Augenhöhle(Abbildung 1, rechte sam), die Spitze beträgt ca. 45°. Drehen Sie die Pipette zwischen den Fingern während des Vorwärtsgangs. Tragen Sie sanften Druck auf und geben Sie dann frei, bis Blut in die Pipette gelangt.
HINWEIS: Die maximale Blutmenge, die gleichzeitig von diesem Ort entnommen werden kann, beträgt etwa 1% des Körpergewichts, z. B. 0,2 ml von einer 20 g Maus. - Entfernen Sie die Kapillare vorsichtig, um Verletzungen des Auges zu verhindern, und legen Sie das gesammelte Blut in ein 1,5 ml Zentrifugenrohr. Schließen Sie das Augenlid und wenden Sie leichten Druck mit Gaze an, um weitere Blutungen zu verhindern. Sobald vollständig wachsam und mobil (in der Regel 3-5 min), kehren Sie die Maus zu seinem Haltekäfig zurück.
- Lassen Sie das Blut für 30 bis 60 min bei Raumtemperatur (RT) gerinnen, dann Zentrifugieren sie Blut für 10 min bei 2.000 x g in einer gekühlten Zentrifuge von 4 °C. Mit einer sauberen Pipettentechnik sammpere Serum in eine neue, beschriftete 0,5 ml Durchstechflasche. Durchserlegen Sie die Durchserbflasche Serum bei -80 °C sofort einfrieren.
- CSF-Sammlung mit Überlebensverfahren
HINWEIS: Dieses Verfahren ist für Überlebensoperationen und basiert auf dem Protokoll, das von Liu und Duff im Jahr 2008 veröffentlicht wurde.15. Die Mäuse werden durch einen Ketamin (20 mg/ml), Xylazin (0,5 mg/ml) und Acepromazin (0,5 mg/ml) Cocktail intraperitoneal verabreicht anbeet.- Bewegen Sie die Käfige mit Mäusen aus dem Rack in einen ausgewiesenen Operationsarbeitsbereich. Bereiten Sie den Operationsraum in einer sterilen Umgebung vor. Stellen Sie sicher, dass alle verwendeten Instrumente und Materialien vor der Operation sterilisiert werden.
- Wiegen Sie die Maus und berechnen Sie das benötigte Anästhesievolumen (0,1 ml Anästhesiecocktail für eine 20 g Maus). Injizieren Anästhesie intraperitoneal16. Testen Sie nach einigen Minuten die Maus, indem Sie das Fußpolster kneifen, um eine ausreichende Anästhesie zu gewährleisten. Wenn mehr Anästhetikum erforderlich ist, spritzen Sie den Anästhetikum-Cocktail weiter 0,01 bis 0,03 ml.
- Verwenden Sie entweder eine Schere oder einen Rasierer, um einen kleinen Bereich des Kopfes zu rasieren, am kaudalen Ende, medial auf dem Schädel, um groß genug Arbeitsbereich für DIE CSF-Sammlung zu belichten. Positionieren Sie die Maus in der anfälligen Position auf dem stereotaxic Instrument, und stabilisieren Sie den Kopf mit Ohrleisten(Abbildung 2A).
HINWEIS: Die Maus ist so ausgelegt, dass der Kopf mit dem Körper einen Winkel von fast 135° bildet (Abbildung 2A). Sobald das Tier positioniert ist, wird ein chirurgischer Vorhang verwendet, um ein steriles Feld an der chirurgischen Stelle zu erhalten. Klare Klebevorhänge werden für die CSF-Sammlung bei Mäusen bevorzugt, da sie eine direkte und gezieltere Visualisierung des Tieres ermöglichen. - Die chirurgische Stelle mit 30% Chlorhexidin-Diacetat abwischen. Mit einem sterilen Skalpell, machen Sie einen sagittalen Schnitt der Haut schlechter als der Okziput, um Muskeln über der Zisterne magna auszusetzen.
- Durch stumpfe Zerlegung mit Zangen, trennen Sie das unterkutane Gewebe und Muskeln, um die Zisternen magna zu belichten (Abbildung 2B). Verwenden Sie Mikroretraktoren, um die Muskeln auseinander zu halten (Abbildung 2B) und setzen Sie die Dura mater Meningealschicht über der Zisternen magna aus.
- Waschen Sie vorsichtig mit steriler Phosphat-gepufferter Saline (PBS), um eine mögliche Blutkontamination zu entfernen. Trocknen Sie die Dura mater mit einem sterilen Wattestäbchen und punktieren Sie die Membran, die die Zisterne magna bedeckt, sanft mit einer 30 G Nadel. Fügen Sie schnell und vorsichtig ein kleines Glaskapillarrohr ein, um CSF zu sammeln (Abbildung 2C).
HINWEIS: Der intrakranielle Druck ermöglicht es CSF, spontan in die Kapillare zu fließen (Abbildung 2C). Je nach Alter und Größe der Maus werden von jeder Maus ca. 5 x 12 l CSF erhalten. - Entfernen Sie vorsichtig das Kapillarrohr aus der Membran. Schließen Sie das Rohr durch einen Polyethylenschlauch(Materialtabelle) an eine 3 ml Spritze an und injizieren Sie das gesammelte CSF in ein markiertes 0,5 ml-Rohr (Abbildung 2D). Fläschchen im Eis aufbewahren.
- Schließen Sie den Schnitt durch Verwendung von Polydioxanon-Nähte (PDS) mit Einwegnadel und mit vergrabenen Nähten17. Reinigen Sie den Bereich von getrocknetem Blut oder Gewebe.
- Injizieren Sie Mäuse subkutan oder intraperitoneal16, mit 0,05,0,1 mg/kg Buprenorphinhydrochlorid als analgetische Behandlung. Auch subkutan 1 ml sterile Saline injizieren, um Austrocknung zu verhindern.
- Legen Sie die Maus wieder in einen sauberen und warmen Käfig für die Erholung. Sobald die Maus mobil ist und in der Lage ist, Nahrung und Wasser zu erreichen, legen Sie den Käfig wieder auf das Rack.
- Zentrifuge CSF für 10 min bei 1.000 x g in einer 4 °C gekühlten Zentrifuge. Überprüfen Sie den Grad der Blutkontamination durch visuelle Inspektion zur Identifizierung von Xanthochromie und Vorhandensein eines roten Pellets im Boden des Rohres. Entsorgen Sie blutverunreinigte Proben.
HINWEIS: Die Formel für die Korrektur von CSF-Proteinmengen in blutverunreinigten Proben basiert auf Gleichungsparametern, die den Proteingehalt in CSF und Serum, Hämatokrit (HCT) und rote Blutkörperchen (RBC) in CSF und Blut18umfassen. Eine solche Korrekturstrategie kann jedoch aufgrund des geringen Volumens nicht ohne weiteres auf Maus-CSF-Proben angewendet werden, wodurch die Korrekturstrategie auf eine Sichtprüfung beschränkt wird. - Mit einer sauberen Pipettentechnik, sammeln CSF in einem neuen 0,2 ml Rohr, hinter dem Pellet mit Zellen. Verdünnen Sie CSF 1:3 mit PBS, um den Volumenverlust durch Aerosol zu reduzieren. Die Durchstechflasche mit CSF sofort bei -80 °C einfrieren.
- Retro-orbitale Blutungsverfahren für die Serumsammlung.
- Serum- und CSF-Sammlung unter Verwendung von Nicht-Überlebensverfahren
HINWEIS: Für die Nicht-Überlebensflüssigkeitssammlung geht die CSF-Sammlung der Serumsammlung voraus, da die Maus einen Puls haben muss.- CSF-Sammlung bei Necropsy
HINWEIS: Dieses Verfahren ist für nicht-Überlebens-Chirurgie, und etwa 10-20 L CSF wird von jeder Maus erhalten. Ein steriles Operationsfeld wird empfohlen, ist aber für eine Nicht-Überlebensoperation nicht erforderlich.- Bewegen Sie die Käfige mit Mäusen aus dem Rack in einen komfortablen Arbeitsbereich. Befolgen Sie die Schritte 1.1.2.2-1.1.2.7 und 1.1.2.11-1.1.2.12 für die CSF-Sammlung. Fahren Sie mit Abschnitt 1.2.2 für die Serumsammlung fort.
- Blutentnahme durch intrakardiale Punktion (offener Ansatz)
HINWEIS: Das erwartete Blutvolumen beträgt ca. 3% des Körpergewichts, z. B. 0,6 ml von einer 20 g Maus.- Nach der CSF-Sammlung stellen Sie sicher, dass die Maus durch Kneifen des Fußpolsters noch ausreichend beäscht ist. Wenn eine Reaktion beobachtet wird, eine zweite Dosis Anästhetikum verabreichen. Wenn keine Reaktion beobachtet wird, fahren Sie fort.
- Legen Sie das Tier auf den Rücken und tupfer Haut auf den Bauch mit 70% Alkohol. Mit einer chirurgischen Schere die Brusthöhle öffnen und das Herz freilegen. Legen Sie eine 25 G Nadel (an einer 3 ml Spritze befestigt) in den linken Ventrikel ein und setzen Sie den Spritzenkolben vorsichtig unter Druck. Nadel zurückziehen, nachdem Blut entnommen wurde.
- Führen Sie eine sekundäre Methode der Euthanasie wie Enthauptung oder zervikale Dislokation durch, um sicherzustellen, dass das Tier verstorben ist.
- Drücken Sie den Kolben der Spritze nach unten und injizieren Sie das gesammelte Blut in eine 1,5 ml Durchstechflasche. Lassen Sie das Blut 30-60 min bei RT gerinnen und zentrieren Sie es dann 10 min bei 2.000 x g in einer gekühlten Zentrifuge von 4 °C.
- Mit sauberer Pipettentechnik sammpere Serum in eine neue, beschriftete 0,5 ml-Durchstechflasche. Durchserlegen Sie die Durchserbflasche Serum sofort in einem Gefrierschrank von -80 °C einfrieren.
- CSF-Sammlung bei Necropsy
2. Proteinanalyse
- Verwenden Sie eine bevorzugte Methode, z. B. Luminex-Technologie, um Zielproteine und Albumin in übereinstimmenden Serum- und CSF-Proben zu quantifizieren.
HINWEIS: Hier wird ein Beispiel mit der Luminex-Magnettechnologie gegeben, aber praktisch jede Technik, die Proteinmengen misst, einschließlich enzymgebundener Immunsorbent-Assays (ELISAs), kann auf das aktuelle Protokoll angewendet werden. Idealerweise werden CSF- und Serumproben sowohl für Albumin- als auch für Zielproteine auf derselben Plattform ausgeführt. Die Assay-Bedingungen müssen für entscheidende Schritte im Protokoll optimiert werden, wie z. B. Antigen-Perlen-Kopplungskonzentration, Serum- und CSF-Probenverdünnungen, am besten passgenaue Standardkurven für jeden Analyten und Pufferzusammensetzung, um die unspezifische Reaktivität zu reduzieren. Wird ein kommerzielles Kit für die Protein-Messung verwendet, z. B. das Immunglobulin-Isotypisierungs-Kit (Materialtabelle) zur Erfassung von Daten, die inAbbildung 3müssen die Anweisungen der Hersteller befolgt werden.- Beim Auftauen und vor der Analyse Zentrifugen-CSF- und Serumproben (2.000 x g für 10 min) und verwenden sie den Überstand, um eine Verstopfung der Filterplatten und/oder Sonde zu verhindern. Befolgen Sie das mit dem Kit gelieferte Assay-Verfahren für geeignete Probenverdünnungen. Andernfalls bestimmen Sie die geeignete Verdünnung für jeden Analyten und Flüssigkeit. Proben in PBS entsprechend verdünnen.
ANMERKUNG: Wenn es keine spezifischen Leitlinien oder Anweisungen gibt, müssen vor der Studie Verdünnungen für jeden Analyt und jede Flüssigkeit festgestellt werden, indem die geeigneten Verdünnungsbereiche bestimmt werden, die erforderlich sind, um Konzentrationsschätzungen zu erhalten, die zuverlässigen Bereich einer Standardkurve. Die Kenntnis der Eigenschaften der zu analysierenden biologischen Probe, z. B. physiologische und pathologische Konzentrationen in der Flüssigkeit, ermöglicht es, verschiedene Verdünnungen mit Proben mit niedrigem, mittlerem und hohem Analytgehalt auszuprobieren. Wenn der erwartete Konzentrationsbereich in den Proben von vornherein bekannt ist, können die Verdünnungen nach der Berechnung ausgewählt werden, wie oft die Probe verdünnt werden muss, um innerhalb des gewählten Standardkurvenbereichs zu liegen.
VORSICHT: Denken Sie bei der Berechnung der Verdünnungsfaktoren daran, dass CSF bereits 1:3 verwässert wurde. - Bereiten Sie eine Standardkurve für jedes Protein von Interesse vor, z. B. Albumin und IgG, wie sie zur Generierung von Daten in Abbildung 3verwendet werden, durch serielle Verdünnung von Referenzstandardproteinen. Mischen Sie bei der Vorbereitung von Standardkurven jede höhere Konzentration gründlich, bevor Sie die nächste Verdünnung machen.
HINWEIS: Unabhängig von der gewählten Methode der Quantifizierung ist es wichtig, bei jeder Testierung eine Standardkurve einzuschließen, um die Proteinkonzentration in Proben zu schätzen. Die beste Wahl für einen Referenzstandard ist eine gereinigte, bekannte Konzentration des Proteins von Interesse. Die Entscheidung über die spezifischen Verdünnungen sowie die Anzahl der Datenpunkte und Replikationen, die zur Definition der Standardkurve verwendet werden, hängt vom Grad der Nichtlinearität in der Standardkurve ab. - Wählen Sie die entsprechenden Antikörper-gekoppelten magnetischen Perlensätze (Tabelle der Materialien). Für einzelne Perlenfläschchen jede Durchstechflasche für 30 s und Wirbel für 1 min. Bereiten Sie eine "Arbeitsperlenmischung" vor, indem Sie die Perlenbestände auf eine Endkonzentration von 50 Perlen jedes Sets/L im Assay/Waschpuffer verdünnen (PBS, 1% Rinderserumalbumin [BSA]). Fügen Sie 50 l der gemischten Perlen zu jedem Brunnen in einer flachen 96-Well-Platte(Materialtabelle).
VORSICHT: Die leuchtstofffreien Perlen sind lichtempfindlich. Daher sollten sie während des gesamten Verfahrens vor längerer Lichteinwirkung geschützt werden. - Diagramm emittieren Sie die Platzierung von Hintergründen, Standards und Beispielen in einem gut zugeordneten Arbeitsblatt.
- Fügen Sie jedem Hintergrundbrunnen 50 l Assay/Waschpuffer und für die Standardkurve 50 l von jedem Standard hinzu. Laden Sie 50 ml jeder verdünnten Probe in die entsprechenden Bohrungen zuletzt. Die Platte mit Folie umwickeln und mit Rührung (ca. 800 Rpm) auf einem Plattenschüttler für 30 min bei RT inkubieren.
- Legen Sie die Platte auf einen Handmagneten(Materialtabelle) und legen Sie die Platte auf den Magneten für 60 s, um eine vollständige Einstellung der magnetischen Perlen zu ermöglichen. Entfernen Sie den Brunneninhalt, indem Sie die Platte sanft dekantieren und auf saugfähige Pads tippen, um Restflüssigkeit zu entfernen.
- Waschen Sie die Platte, indem Sie sie vom Magneten entfernen, indem Sie 200 L Assay/Waschpuffer hinzufügen, 30 s schütteln und schließlich wieder am Magneten anbringen. Waschen 3x wiederholen.
- Verdünnen Sie den biotinylierten Detektionsantikörper, d.h. biotinmarkierten Antikörper, der gegen die Proteinwirtsart aufgezogen wird, auf 4 g/ml im Test-/Waschpuffer. Fügen Sie jedem Bohrkörper 50 l des verdünnten Detektionsantikörpers hinzu. Bedecken Sie die Platte und brüten Sie 30 min bei RT auf dem Plattenschüttler bei 800 Umdrehungen von 15.00 00.00 00.00 00.000 Min.. Legen Sie die Platte auf den Magneten und wiederholen Sie die Schritte 2.1.6 und 2.1.7.
- Phycoerythrin (PE)-konjugiertes Streptavidin (SAPE) im Assay/Waschpuffer auf 4 g/ml verdünnen. Fügen Sie jedem Brunnen 50 L verdünnten SAPE hinzu. Bedecken Sie die Platte und brüten Sie 30 min bei RT auf dem Plattenschüttler bei 800 Umdrehungen von 15.00 00.00 00.00 00.000 Min.. Legen Sie die Platte auf den Magneten und wiederholen Sie die Schritte 2.1.6 und 2.1.7.
- Entfernen Sie die Platte vom Magneten und setzen Sie die Perlen in 100 l Assay/Waschpuffer wieder auf. Lesen Sie Brunnen mit einem Dual-Laser-Flow-basierten Detektionsgerät, das die Erkennung der Größe der PE-Fluoreszenzintensität (FI) ermöglicht.
HINWEIS: Das erzeugte Signal, z. B. FI, ist proportional zur Menge des Zielantigens, das an der Oberfläche der Perlen befestigt ist. - Exportieren Sie Rohdaten und erstellen Sie Standardkurven durch Graphikerkennungssignal FI im Vergleich zu Standardproteinkonzentrationen. Verwenden Sie die Standardkurve(en), um die Konzentration der Analyten in den Stichproben zu berechnen.
HINWEIS: Albumin wird bevorzugt in g/dL ausgedrückt, während Proteine von Interesse bevorzugt in mg/dL ausgedrückt werden.
- Beim Auftauen und vor der Analyse Zentrifugen-CSF- und Serumproben (2.000 x g für 10 min) und verwenden sie den Überstand, um eine Verstopfung der Filterplatten und/oder Sonde zu verhindern. Befolgen Sie das mit dem Kit gelieferte Assay-Verfahren für geeignete Probenverdünnungen. Andernfalls bestimmen Sie die geeignete Verdünnung für jeden Analyten und Flüssigkeit. Proben in PBS entsprechend verdünnen.
3. Intrathekale Indexberechnungen
- Organisieren Sie Proteinkonzentrationswerte in einer Kalkulationstabelle, und analysieren Sie die Ergebnisse, indem Sie die folgenden Formeln anwenden.
- Qalbuminberechnen :

wobeiCSF-Albumin und Serum-Albumin Konzentrationen von Albumin in übereinstimmenden Serum- bzw. CSF-Proben sind. - Berechnen SieQ-Protein:
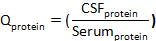
wobeiCSF-Protein und Serumprotein Konzentrationen von Zielproteinen in aufeinander abgestimmten Serum- bzw. CSF-Proben sind. - Berechnen Sie den Proteinindex:
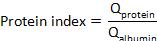
Ergebnisse
Dieses repräsentative Experiment zielte darauf ab, die intrathekale Synthese von IgG in zwei klinisch relevanten Nagetiermodellen der Multiplen Sklerose (MS) zu vergleichen: die PLP139-151-induzierte schubförmige experimentelle Autoimmunenzephalomyelitis (R-EAE) und die chronisch progressive, Theiler-Murinen-Enzephalomyelitis-Virus-induzierte Demyelinating-Krankheit (TMEV-IDD). R-EAE ist ein nützliches Modell zum Verständnis schubförmiger MS, während das TMEV-IDD-Modell chronisch progressive MS
Diskussion
Quantitative Methoden zur Bewertung erhöhter CSF-Proteinkonzentrationen sind nützliche Werkzeuge zur Charakterisierung des physiologischen und pathologischen Zustands des ZNS. Über die zuverlässige Quantifizierung des CSF-Proteinspiegels hinaus erfordert der Nachweis von CSF-Proteinen jedoch eine Expression von Ergebnissen, die zwischen blut- und zNS-abgeleiteten Fraktionen im CSF unterscheiden. Bislang erlauben die häufig verwendeten Proteinquantifizierungstests jedoch keine Diskriminierung zwischen den beiden Prot...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken den Mitarbeitern des Center for Comparative Medicine and Research (CCMR) in Dartmouth für ihre fachkundige Betreuung der Mäuse, die für diese Studien verwendet werden. Der Bornsteiner Forschungsfonds finanzierte diese Forschung.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
Referenzen
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten