Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественное измерение интратекалливых синтезированных белков у мышей
В этой статье
Резюме
Повышенный уровень белка спинномозговой жидкости может быть результатом распространения белка плазмы через измененный гематоэнцефалический барьер или внутритекаальный синтез. В этой статье представлен оптимизированный протокол тестирования, который помогает дискриминировать оба случая и обеспечивает количественные измерения синтезированных белков интратеколли.
Аннотация
Цереброспинальная жидкость (CSF), жидкость, найденная в головном и спинном мозге, имеет большое значение как для основных, так и для клинической науки. Анализ состава белка CSF предоставляет важную информацию в фундаментальных неврологических исследованиях, а также неврологических заболеваниях. Одно предостережение что протеины измеренные в CSF могут вытекать от обоих intrathecal синтеза и transudation от сыворотки, и анализ протеина CSF может только обусловить сумму этих 2 компонентов. Чтобы различать перенос протеина из крови и интратэколли, производимые белками в животных моделях, а также в организме человека, измерения профилирования белка CSF с использованием обычных инструментов анализа белка должны включать в себя расчет альбумина CSF/сыворотки коэффициента (qalbumin), маркер целостности интерфейса кровяного мозга (BBI), и индекс белка (qбелок/альбом) Этот протокол иллюстрирует всю процедуру, от CSF и сбора крови до расчетов коэффициентов и индексов, для количественного измерения синтеза внутриклеточного белка и нарушения BBI в моделях мыши неврологических расстройств.
Введение
Цереброспинальная жидкость (CSF), прозрачная и бесцветная жидкость, окружающая мозг и спинной мозг, имеет большое клиническое и фундаментанное научное значение. CSF сохраняет электролитическую среду центральной нервной системы (ЦНС), уравновешивает системный кислотно-базовый статус, поставляет питательные вещества в нейрональные и глиальные клетки, функционирует как лимфатическая система для ЦНС, и транспортирует гормоны, нейротрансмиттеры, цитокины и другие нейропептиды по всей ЦНС1. Таким образом, поскольку состав CSF отражает активность ЦНС, эта жидкость предлагает ценный, хотя и косвенный, доступ к характеристике физиологического и патологического состояния ЦНС.
CSF был использован для диагностики заболеваний, которые влияют на ЦНС на протяжении более ста лет, и на протяжении большей части этого времени, он был в первую очередь изучался врачами в качестве диагностического инструмента. Однако в последние годы нейробиологи признали потенциал CSF для изучения патофизиологии ЦНС. В частности, несколько высокопроизводительных инструментов анализа белка были введены в области нейронауки, что позволяет детально изучить состав белка CSF, с расчетом на то, что этот анализ может помочь дать представление о динамических изменениях происходящих в ЦНС.
Технологические разработки в мультиплексных методах иммуноанализа, таких как Luminex и Simoa технологий2,3, предоставить исследователям сегодня возможность обнаружить сотни белков в очень низких концентрациях. Кроме того, эти же технологии позволяют использовать небольшие объемы выборки, тем самым способствуя исследованиям на мелких животных, в том числе мышах, в которых ограниченные объемы образцов CSF до недавнего времени исключали подробные характеристики жидкости.
Тем не менее, одно предостережение заключается в том, что белки, измеренные в CSF, могут вытекать из внутритебного синтеза и/или трансудаляции из сыворотки из-за поврежденного интерфейса кровеносного мозга (BBI). К сожалению, анализ белка CSF только может определить сумму этих двух компонентов. Чтобы различать трансудатии и интратеколли, измерения белка CSF с использованием любого доступного инструмента анализа белка должны быть скорректированы с учетом индивидуальной изменчивости концентраций в сыворотке крови, а также барьерной целостности. Однако, хотя эта корректировка широко используется в клинической практике, например, индекс CSF IgG, который имеет высокую чувствительность для обнаружения внутритекового синтеза IgG4,5,6, на сегодняшний день очень немногие исследования исправили концентрации белка CSF для концентрации сыворотки и барьерцелостности7,8.
В настоящее время подход Рейберграм является лучшим способом определения барьерной функции и внутритекового синтеза белков. Это графическая оценка в CSF / сыворотки фактор диаграммы, которая анализирует, в комплексном порядке, как барьер (дис) функции и синтез внутритебного белка, ссылаясь на исключительно кровеоток протеина9,10. Высоко обильный протеиновый альбумин обычно выбирается в качестве эталонного белка, потому что он производится только в печени и потому, что его размер, приблизительно 70 kDa, является промежуточным между малыми и большими белками11. Диаграмма анализа была впервые определена Рейбером и Фельгенгауэр в 1987 году для основных классов иммуноглобулинов (Igs)11, будучи эмпирически основана на результатах, полученных в результате анализа тысяч образцов человека9. Подход был впоследствии подтвержден применением двух законов Fick диффузии в теории молекулярной диффузии / скорости потока12. Такая теория демонстрирует диффузию белка через барьер имеет гиперболическое распределение и может количественно объяснить динамику белков в ЦНС9,13. В целом, преимущество использования Рейберграма для демонстрации синтеза внутритекового белка заключается в том, что он одновременно определяет белковую фракцию, которая попадает в CSF из сыворотки, а также количество белка, найденного в CSF из-за местного производства.
В настоящей статье и соответствующем протоколе описывается вся процедура, от CSF и сбора крови до окончательных расчетов коррекции уровней белка CSF, для количественного измерения синтеза внутритебного белка в моделях мыши неврологических Расстройств. Эта процедура обеспечивает базовый уклад, на основе которого для оценки (1) патофизиологического происхождения любого белка CSF и (2) стабильности и функциональной значимости барьерной целостности. Эта процедура и протокол не только полезны для оценки образцов мышь CSF, но также полезны в анализе CSF в множестве животных моделей неврологических заболеваний и человеческих пациентов.
протокол
Вся работа животных использует протоколы, рассмотренные и одобренные Институциональным комитетом по уходу за животными и использованию (IACUC) в Медицинской школе Гейзела в Дартмуте.
1. Сбор жидкостей
ПРИМЕЧАНИЕ: Требуется сыворотка и CSF. Для выживания и некропсии необходимы два протокола для каждой коллекции жидкости.
- Коллекция сыворотки и CSF с использованием процедур выживания
ПРИМЕЧАНИЕ: Для сбора жидкости выживания, сбор сыворотки должен предшествовать коллекции CSF, как это менее инвазивной процедурой. CSF должен быть получен в течение одной недели после розыгрыша сыворотки.- Процедура ретро-орбитального кровотечения для сбора сыворотки.
ПРИМЕЧАНИЕ: Эта процедура для выживания кровотечение мышей14. Описанная процедура применяется к любому возрасту, полу и штамму мышей. Поскольку правила IACUC диктуют, что максимальный объем крови в 1% от массы тела может быть удален в виде одного анализа крови, рекомендуется, что процедура проводится только на мышах весом более 15 г.- Переместите клетки, содержащие мышей из стойки в соответствующую рабочую зону. Подготовьте газодвигательную анестезию, включив счетчик потока кислорода до 1 л/мин.
- Поместите животное в индукционную камеру и плотно закройте крышку. Включите испаритель изофруран до 3,5% и следите за животным до лежачего.
- Выньте животное из камеры и оцените уровень анестезии с помощью педали рефлекса, т.е. твердой щепотки подножки. Обеспечьте достаточную глубину анестезии перед выполнением процедуры: отсутствие реакции на твердую щепотку указывает на адекватную анестезию.
- Сдержать обезопсаниваемых мышей, схватив свободную кожу за ушами большим и указательным пальцем не доминирующей руки. Выпуклость глаза с помощью указательного пальца, чтобы оттянуть кожу над глазом и большой палец, чтобы оттянуть кожу ниже глаз.
- Поместите кончик пипетки Pasteur в глазницу под глазным яблоком(рисунок 1, левая панель), направляя кончик примерно на 45 "к середине глазницы (Рисунок 1, правая панель). Поверните пипетку между пальцами во время переднего прохода. Применить мягкое давление, а затем отпустить, пока кровь входит пипетка.
ПРИМЕЧАНИЕ: Максимальное количество крови, которая может быть снята в одно время из этого места составляет около 1% от массы тела, например, 0,2 мл из 20 г мыши. - Аккуратно удалите капилляр, чтобы предотвратить повреждение глаза и поместите собранную кровь в центрифугу 1,5 мл. Закройте веко и нанесите мягкое давление марлей, чтобы предотвратить дальнейшее кровотечение. После полной боевой и мобильной связи (обычно 3,5 мин) верните мышь в клетку для хранения.
- Разрешить сгусток крови в течение 30-60 минут при комнатной температуре (RT), затем центрифуги крови в течение 10 минут при 2000 х г в 4 C охлажденной центрифуги. Используя чистую технику пипетки, соберите сыворотку в новый флакон с этикеткой 0,5 мл. Немедленно заморозить флакон сыворотки при -80 градусах Цельсия.
- Коллекция CSF с процедурой выживания
ПРИМЕЧАНИЕ: Эта процедура предназначена для хирургии выживания, и она основана на протоколе, опубликованном Лю и Даффом в 2008 году15. Мышей обезболивают кетамином (20 мг/мл), ксилазином (0,5 мг/мл) и ацепромазином (0,5 мг/мл) коктейль, вводимый интраперитонеально.- Переместите клетки, содержащие мышей из стойки в назначенную рабочую зону хирургии. Подготовка хирургии пространство в стерильной среде. Убедитесь, что все инструменты и материалы, используемые стерилизованы до операции.
- Взвесьте мышь и расчислите необходимый объем анестезии (0,1 мл анестезии для 20 г мыши). Инъекционная анестезия интраперитонетически16. Через несколько минут, проверить мышь, щипать подножку, чтобы обеспечить адекватную анестезию. Если требуется больше анестезии, вводят дополнительно 0,01-0,03 мл анестезируемого коктейля.
- Используйте либо ножницы или бритву, чтобы побрить небольшую область головы, на каудальном конце, медиаль на черепе, чтобы разоблачить достаточно большую рабочую зону для коллекции CSF. Расположите мышь в положении лежа на стереотаксическом инструменте и стабилизировать голову с помощью ушных прутьев(рисунок 2A).
ПРИМЕЧАНИЕ: Мышь заложена так, что голова образует почти 135 "угол с телом (Рисунок 2A). После того, как животное расположено, хирургическая драпировка используется для поддержания стерильного поля в хирургическом месте. Прозрачные клеевые шторы предпочтительнее для коллекции CSF у мышей, так как они позволяют для прямой и более целенаправленной визуализации животного. - Swab хирургического сайта с 30% хлоргексидина диацетата. Используя стерильный скальпель, сделать сагитальный разрез кожи уступает occiput подвергать мышцы над цистерной magna.
- По тупой рассечение с щипками, отдельные подкожной ткани и мышц, чтобы разоблачить цистерны magna (Рисунок 2B). Используйте микроретракторы, чтобы держать мышцы друг от друга(Рисунок 2B) и разоблачить dura mater менингеального слоя над цистерна магна.
- Аккуратно промыть стерильным фосфатным сольниковым сольнием (PBS) для удаления любого возможного заражения крови. Подьем высушите дюрова с помощью стерильного ватного тампона и аккуратно проколить мембрану, покрывающую цистерну магна, иглой 30 Г. Быстро и осторожно вставьте небольшую стеклянную капиллярную трубку, чтобы собрать CSF(рисунок 2C).
ПРИМЕЧАНИЕ: Внутричерепное давление позволяет CSF самопроизвольно течь в капилляр(рисунок 2C). В зависимости от возраста и размера мыши, примерно от 5 до 12 л CSF получается от каждой мыши. - Аккуратно снимите капиллярную трубку с мембраны. Подключите трубку к 3 мл шприца через полиэтиленовые трубки(Таблица материалов) и введите собранные CSF в помечены 0,5 мл трубки(рисунок 2D). Храните флаконы во льду.
- Закрыть разрез с помощью полидооксанона шов (PDS) с одноразовой иглой и с использованием похоронен швы17. Очистите область любой высохшей крови или ткани.
- Вводят мышей, подкожно или интраперитонеально16, с 0,05-0,1 мг/кг гидрохлорида бупренорфина в качестве обезболиващее лечение. Кроме того, вводят подкожно 1 мл стерильного сольядлядляго раствора для предотвращения обезвоживания.
- Поместите мышь обратно в чистую и теплую клетку для восстановления. После того, как мышь мобильна и сможет достичь пищи и воды, поместите клетку обратно на стойку.
- Центрифуга CSF в течение 10 мин при 1000 х г в охлажденной центрифуге 4 градусов По Цельсию. Проверьте степень загрязнения крови путем визуального осмотра для выявления ксантхохромии и наличие красного гранулы в нижней части трубки. Отбросьте зараженные кровью образцы.
ПРИМЕЧАНИЕ: Формула, используемая для коррекции количества белка CSF в зараженных кровью образцах, основана на параметрах уравнения, которые включают содержание белка в CSF и сыворотке крови, гематокрит (HCT), и красные кровяные клетки (РБК) в CSF и крови18. Однако такая стратегия коррекции не может быть легко применена к образцам CSF мыши из-за небольшого объема, что ограничивает стратегию коррекции визуальным осмотром. - Используя чистую технику пипетки, соберите CSF в новую трубку 0,2 мл, оставив позади гранулы с клетками. Разбавить CSF 1:3 с PBS, чтобы уменьшить потери объема из-за аэрозоля. Немедленно заморозить флакон CSF при -80 градусах По Цельсию.
- Процедура ретро-орбитального кровотечения для сбора сыворотки.
- Коллекция сыворотки и CSF с использованием процедур невыживания
ПРИМЕЧАНИЕ: Для не-выживания жидкости сбора, коллекция CSF предшествует коллекции сыворотки, как мышь должна иметь пульс.- Коллекция CSF при некропсии
ПРИМЕЧАНИЕ: Эта процедура предназначена для операции без выживания, и примерно 10-20 Л CSF получается от каждой мыши. Рекомендуется стерильное хирургическое поле, но не обязательно для операции, не связанных с выживанием.- Переместите клетки, содержащие мышей из стойки в удобное рабочее пространство. Выполните шаги 1.1.2.2-1.1.2.7 и 1.1.2.11-1.1.12 для коллекции CSF. Перейдите к разделу 1.2.2 для сбора сыворотки.
- Сбор крови через внутрикардийный прокол (открытый подход)
ПРИМЕЧАНИЕ: Объемы крови, как ожидается, составляет около 3% от массы тела, например, 0,6 мл от 20 г мыши.- После коллекции CSF убедитесь, что мышь по-прежнему достаточно обезопадона, щипать подножку. Если какая-либо реакция наблюдается, вводят вторую дозу анестетика. Если реакции не наблюдается, продолжайте.
- Поместите животное на спину и тампон кожи на животе с 70% алкоголя. Хирургическими ножницами откройте грудную полость и разоблачите сердце. Вставьте 25 G иглу (прилагается к 3 мл шприца) в левый желудочек и осторожно нанесите отрицательное давление на шприц поршень. Снять иглу после того, как кровь была собрана.
- Выполните вторичный метод эвтаназии, такой как обезглавливание или вывих шейки матки, чтобы убедиться, что животное умер.
- Нажмите поршень шприца вниз и вводить собранную кровь в 1,5 мл флакон. Разрешить крови сгусток в течение 30-60 мин на RT, а затем центрифуги его в течение 10 минут при 2000 х г в 4 C охлажденной центрифуги.
- Используя чистую технику пипетки, соберите сыворотку в новый флакон с этикеткой 0,5 мл. Немедленно заморозить флакон сыворотки на -80 градусов морозильник.
- Коллекция CSF при некропсии
2. Анализ белка
- Используйте предпочтительный метод, например, технологию Luminex, для количественной оценки целевого белка (ы) и альбумина в соответствующих образцах сыворотки и CSF.
ПРИМЕЧАНИЕ: Здесь приводится пример с магнитной технологией Luminex, но практически любой метод, который измеряет количество белка, в том числе фермент-связанных иммуносорбентных анализов (ELISAs), могут быть применены к текущему протоколу. В идеале, CSF и сыворотки образцы запускаются как для альбумина и целевых белков на той же платформе. Условия асссея должны быть оптимизированы для важных шагов в протоколе, таких как концентрация сцепления антиген-бисера, разбавления образцов сыворотки и CSF, наиболее подходящие стандартные кривые для каждого анализа и буферный состав для уменьшения неспецифической реактивности. Если коммерческий комплект используется для измерения белка (ы), например, набор изотипификации иммуноглобулина (Таблица материалов) используется для получения данных, представленных вРисунок 3, инструкции производителей должны быть выполнены.- При оттаивании и до анализа, центрифуга CSF и сыворотки образцов (2000 х г в течение 10 мин) и использовать супернатант, чтобы предотвратить засорение фильтра пластин и / или зонда. Следуйте процедуре ассеа, предоставленной комплектом для соответствующего разбавления образцов. В противном случае определите соответствующее разбавление для каждого анализа и жидкости. Разбавить образцы в PBS соответственно.
ПРИМЕЧАНИЕ: Если нет конкретных указаний или инструкций, разбавления для каждого анализа и жидкости должны быть установлены до проведения исследования, путем определения соответствующих диапазонов разбавления, необходимых для получения оценок концентрации, которые подпадают под наиболее надежный диапазон стандартной кривой. Зная характеристики биологического образца для анализа, например, физиологические и патологические концентрации в жидкости, позволяет пробовать различные разбавления с образцами низкого, среднего и высокого содержания анализа. Если ожидаемый диапазон концентраций в образцах известен априори, разбавления могут быть выбраны после расчета, сколько раз образец должен быть разбавлен, чтобы быть в пределах выбранного стандартного диапазона кривой.
ПРЕДЕСЛЕНгИЯ: Вычисляя факторы разбавления, помните, что CSF уже разбавлен 1:3. - Подготовьте стандартную кривую для каждого интересующего белка, например, альбумина и IgG, используемую для генерации данных на рисунке 3,путем последовательного разбавления эталонных стандартных белков. Во время подготовки стандартных кривых тщательно перемешайте каждую более высокую концентрацию перед следующим разбавлением.
ПРИМЕЧАНИЕ: Независимо от выбранного метода количественной оценки, важно включать стандартную кривую каждый раз, когда анализ выполняется для оценки концентрации белка (ы) в образцах. Лучшим выбором для эталонного стандарта является очищенная, известная концентрация интересуемого белка. Решение о конкретных разбавлениях, а также количество точек данных и репликаций, используемых для определения стандартной кривой, зависит от степени нелинейности в стандартной кривой. - Выберите подходящие наборы из магнитного биса, связанного с антителами(Таблица материалов). Для отдельных флаконов из бисера, sonicate каждый флакон для 30 с и вихрь в течение 1 мин. Подготовка "рабочий шарик смеси" путем разбавления запасов бисера до окончательной концентрации 50 шариков каждого набора / Л в обзоре / мытье буфера (PBS, 1% бычьей сыворотки альбомов "BSA"). Добавьте 50 кл смешанных шариков к каждому колодцу в плоской нижней 96-хорошо пластины(Таблица материалов).
ВНИМАНИЕ: флуоресцентные бусы светочувствительны. Таким образом, они должны быть защищены от длительного воздействия света на протяжении всей процедуры. - Диаграмма размещения фонов, стандартов и образцов на листе карты скважины.
- Добавьте 50 юл буфера асссея/мытья к каждому фону скважины и 50 кЛ каждого стандарта к скважинам для стандартной кривой. Загрузите 50 мл каждого разбавленного образца в соответствующие скважины в последнюю силу. Оберните тарелку фольгой и нависните с возбуждением (800 об/мин) на шейкере на 30 мин на РТ.
- Поместите пластину на портативный магнит(Таблица материалов) и остальные пластины на магнит для 60 с, чтобы обеспечить полное установление магнитных бусинок. Удалите содержимое скважины, аккуратно декантируя пластину и кран пластины на абсорбирующие прокладки, чтобы удалить остаточную жидкость.
- Вымойте пластину, удалив его из магнита, добавив 200 злицита / мыть буфера, встряхивая для 30 с, и, наконец, прикрепив его к магниту. Повторите стирку 3x.
- Разбавить биоинтинилафтированных антител обнаружения, т.е. биотин-маркированные антитела, поднятые против белковых видов хозяина, до 4 мкг/мл в анализе / мыть буфер. Добавьте 50 зл разбавленных антител обнаружения к каждому колодцу. Накройте тарелку и инкубировать в течение 30 минут на RT на тарелке шейкер на 800 евро в минуту. Поместите пластину на магнит и повторите шаги 2.1.6 и 2.1.7.
- Разбавленный фикоэритрин (PE)-конъюгированный стрептавидин (SAPE) до 4 мкг/мл в буфере асссе/мытья. Добавьте 50 л разбавленного SAPE к каждой скважине. Накройте тарелку и инкубировать в течение 30 минут на RT на тарелке шейкер на 800 евро в минуту. Поместите пластину на магнит и повторите шаги 2.1.6 и 2.1.7.
- Снимите пластину с магнита и resuspend шарики в 100 зл исссечения / мыть буфера. Читайте скважины с двойным лазерным прибором обнаружения потока, который позволяет обнаруживать величину интенсивности ФЛуоресценции PE (FI).
ПРИМЕЧАНИЕ: Сигнал, например, FI, генерируемый пропорционально количеству целевого антигена, прикрепленного к поверхности бисера. - Экспортировать необработанные данные и создавать стандартные кривые, нагноивая сигнал обнаружения FI по сравнению со стандартными концентрациями белка. Используйте стандартную кривую (ы) для расчета концентрации аналита (ы) в образцах.
ПРИМЕЧАНИЕ: Альбумин преимущественно выражается в g/dL, в то время как белки, представляющие интерес, преимущественно выражены в мг/дл.
- При оттаивании и до анализа, центрифуга CSF и сыворотки образцов (2000 х г в течение 10 мин) и использовать супернатант, чтобы предотвратить засорение фильтра пластин и / или зонда. Следуйте процедуре ассеа, предоставленной комплектом для соответствующего разбавления образцов. В противном случае определите соответствующее разбавление для каждого анализа и жидкости. Разбавить образцы в PBS соответственно.
3. Расчеты внутрииндексного индекса
- Организуйте значения концентрации белка в электронную таблицу и проанализируйте результаты, применяя следующие формулы.
- Рассчитайтеи альбумин:

где csFальбумин и сывороточныйальбумин являются концентрации альбумина в соответствующих образцов сыворотки и CSF, соответственно. - Рассчитайтебелок:
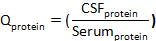
гдебелок CSF ибелок сыворотки являются концентрациями целевого белка (ы) в соответствующих образцах сыворотки и CSF, соответственно. - Рассчитайте индекс белка:
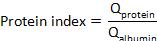
Результаты
Этот репрезентативный эксперимент был направлен на сравнение внутриклеточного синтеза IgG в двух клинически значимых моделях грызунов рассеянного склероза (МС): PLP139-151-индуцированныйрецидивирующий экспериментальный аутоиммунный энцефаломиелит (R-EAE) и хронический прогрессивный,...
Обсуждение
Количественные методы оценки повышенной концентрации белка CSF являются полезными инструментами в характеристике физиологического и патологического состояния ЦНС. Однако, помимо надежной количественной оценки уровней белка CSF, обнаружение белков CSF требует выражения результатов, кот...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарят сотрудников Центра сравнительной медицины и исследований (CCMR) в Дартмуте за их экспертную заботу о мышах, используемых для этих исследований. Научно-исследовательский фонд Борнштейна финансировал это исследование.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
Ссылки
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены