A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
حضانة الخوف باستخدام بروتوكول تكييف الخوف الموسعة للفئران
In This Article
Summary
نحن نصف بروتوكول تكييف الخوف الموسعة التي تنتج الإفراط في التدريب والخوف من الحضانة في الفئران. ويتضمن هذا البروتوكول دورة تدريبية واحدة مع 25 نغمة صدمة الاقتران (أي الإفراط في التدريب) ومقارنة الاستجابات تجميد مشروط خلال السياق واختبارات جديلة 48 ساعة (قصيرة الأجل) و 6 أسابيع (على المدى الطويل) بعد التدريب.
Abstract
وقد درست الذاكرة العاطفية في المقام الأول مع نماذج تكييف الخوف. الخوف تكييف هو شكل من أشكال التعلم من خلالها الأفراد تعلم العلاقات بين الأحداث الانفعالية ومحفزات محايدة خلاف ذلك. الإجراءات الأكثر استخداما على نطاق واسع لدراسة الذكريات العاطفية تنطوي على الخوف تكييف في الفئران. في هذه المهام، التحفيز غير مشروط (الولايات المتحدة) هو هزة قدم مرة أو عدة مرات عبر جلسات واحدة أو عدة، والاستجابة المشروطة (CR) هو تجميد. في نسخة من هذه الإجراءات، تسمى تكييف الخوف cued، يتم إقران نغمة (التحفيز المشروط، CS) مع هزات القدم (الولايات المتحدة) خلال مرحلة التدريب. خلال الاختبار الأول، تتعرض الحيوانات لنفس السياق الذي تم فيه التدريب، ويتم اختبار استجابات التجميد في حالة عدم وجود هزات قدم ونغمات (أي اختبار السياق). خلال الاختبار الثاني، يتم قياس التجميد عند تغيير السياق (على سبيل المثال، عن طريق التلاعب برائحة وحوائط الغرفة التجريبية) ويتم عرض النغمة في غياب الهزات الرّبعية (أي اختبار جديلة). معظم إجراءات تكييف الخوف من الزهد تنطوي على عدد قليل من أزواج النغمات والصدمة (على سبيل المثال، 1-3 تجارب في جلسة واحدة). وهناك اهتمام متزايد في الإصدارات الأقل شيوعا التي تنطوي على عدد كبير من أزواج (أي الإفراط في التدريب) المتعلقة بتأثير طويل الأمد يسمى حضانة الخوف (أي، استجابات الخوف تزيد مع مرور الوقت دون مزيد من التعرض لأحداث فظة أو المحفزات المشروطة). كانت مهام تكييف الخوف الموسعة مفتاحًا لفهم الجوانب السلوكية والعصبية لاحتضان حاضنات الخوف، بما في ذلك علاقتها بالظواهر النفسية الأخرى (مثل اضطراب ما بعد الصدمة). هنا، نحن وصف بروتوكول تكييف الخوف الموسعة التي تنتج الإفراط في التدريب والخوف من الحضانة في الفئران. ويتضمن هذا البروتوكول دورة تدريبية واحدة مع 25 نغمة صدمة الاقتران (أي الإفراط في التدريب) ومقارنة الاستجابات تجميد مشروط خلال السياق واختبارات جديلة 48 ساعة (قصيرة الأجل) و 6 أسابيع (على المدى الطويل) بعد التدريب.
Introduction
الذاكرة هي عملية نفسية تشمل مراحل مختلفة: اكتساب المعلومات، الدمج (يسمح بالاستقرار للمعلومات المكتسبة)، واسترجاع (الأدلة لعملية الدمج)1. خلال مرحلة الدمج، يتم إنشاء اتصالات متشابكة جديدة وتعديل الاتصالات الموجودة من قبل. وهذا يشير إلى ضرورة لفترة من الزمن تحدث خلالها الأحداث الجزيئية والفسيولوجية المسؤولة عن هذه التغيرات1،2. تختلف هذه التغيرات الفسيولوجية أو الجزيئية ما إذا كانت الأحداث المستردة مشحونة عاطفيًا أم لا (أي الذاكرة العاطفية). على سبيل المثال، أظهرت الأبحاث أن النواة الجانبيه و مجمع اللوزه البصينية ذات صلة خاصة بالذاكرة العاطفية3،4،5.
وقد درست ظواهر الذاكرة العاطفية في المقام الأول مع الخوف تكييف النماذج5,6. إنّ تكييف الخوف هو شكل من أشكال التعلم الذي من خلاله يتعلم الأفراد العلاقات بين الأحداث المُرَكِدة والمُحفّزات المحايدة7. نماذج تكييف الخوف تنتج التغيرات الجزيئية، الخلوية، والهيكلية في اللوزة. وبالإضافة إلى ذلك، تكييف الخوف بتعديل الاتصال من قرن آمون أثناء عمليات الدمج واسترجاع الذاكرة العاطفية.
واحدة من الإجراءات الأكثر استخداما لدراسة ذكريات الخوف هو الكلاسيكية (بافلوفيان) تكييف في الفئران. يستخدم هذا الإجراء عادةً هزة القدم (الولايات المتحدة) كحافز مُرَكِّر، والذي يتم تسليمه مرة أو عدة مرات عبر جلسة واحدة أو عدة جلسات. الاستجابة المشروطة (CR) من الفئران المعرضة لهذا الإجراء هو تجميد (أي، "الجمود المعمم الناجم عن استجابة منشط معممة من العضلات الهيكلية للحيوانات باستثناء تلك العضلات المستخدمة في التنفس"7 ). ويمكن تقييم هذه الاستجابة على نوعين من الاختبارات: اختبارات السياق واختبارات الإشارات. بالنسبة لاختبار السياق، يخضع الموضوع لعدد معين من الهزات خلال الدورة التدريبية، ثم يتم إزالته من الغرفة التجريبية لفترة محددة. وخلال الاختبار، يُعاد الموضوع إلى السياق نفسه الذي جرى فيه التدريب، وتُجمع تدابير مختلفة لتجميد الاقدام في غياب الاقدام (مثل مدة أو نسبة مئوية أو تواتر نوبات التجميد)، ومقارنة بمستويات خط الأساس التي تم تحديدها خلال مرحلة التدريب. بالنسبة للنوع الثاني من الاختبار، اختبار جديلة، يتم إقران التحفيز (عادة نغمة) مع الهزات خلال مرحلة التدريب (أي، التحفيز المشروط، CS). بعد اكتمال التدريب، يتم إزالة الحيوان من سياق التدريب لفترة محددة ثم يوضع في سياق معدل (على سبيل المثال، غرفة تجريبية مختلفة لها أشكال مختلفة من الجدران ورائحة مختلفة). ثم يتم عرض الإشارة لعدد معين من المرات، ويتم قياس الردود على الردود على الإشارات ومقارنتها بمستويات خط الأساس التي يتم جمعها أثناء التدريب. النسخة الأكثر شيوعا من هذا النموذج يستخدم 1 إلى 3 نغمة صدمة أزواج خلال دورة تدريبية واحدة، تليها السياق واختبارات جديلة أجريت بعد عدة ساعات أو بضعة أيام في وقت لاحق.
وتشمل إجراءات تكييف الخوف الأخرى الأقل تنفيذًا والتي يتم تنفيذها عددًا كبيرًا من أزواج الصدمة (أي التجارب) ، والتي غالبًا ما تسمى إجراءات الإفراط في التدريب8. ويرتبط الاهتمام المتزايد في هذه المهام طويلة الأمد وزيادة آثار الذاكرة دعا حضانة الخوف (أي، استجابة الخوف مشروطة زيادة مع مرور الوقت في غياب مزيد من التعرض لأحداث aversive أو المحفزات مشروطة)9,10,11. مثال على إجراءات التدريب المفرطة هذه ينطوي على مرحلة تدريب من 100 نغمة صدمة أزواج موزعة على 10 جلسات، تليها اختبارات السياق وجديلة أجريت 48 ساعة و 30 يوما في وقت لاحق11،12. ولتجنب انتشار التدريب المكثف عبر عدة أيام، أفاد مارين (1998) أنه يمكن إنشاء التدريب الزائد وتحسينه في جلسة واحدة مع 25زوجاً 8. ويتجلى تأثير الحضانة في مستويات أعلى بكثير من الخوف مشروطة في الفئران اختبار 31 يوما بعد التدريب، بالمقارنة مع الفئران اختبار 48 ساعة بعد. كانت مهام تكييف الخوف الموسعة أساسية لفهم الجوانب السلوكية والعصبية الحيوية الكامنة في حضانة الخوف ، بما في ذلك علاقتها مع الظواهر النفسية الأخرى (على سبيل المثال ، اضطراب ما بعد الصدمة المتأخرة)11،12،13.
هنا، نحن وصف بروتوكول تكييف الخوف الموسعة التي تحفز الإفراط في التدريب والخوف الحضانة في الفئران. مختلفة عن النماذج الأخرى التي تتطلب عدة أيام من التدريب11، ويركز البروتوكول الحالي على دورة تدريبية واحدة8. استخدمنا 25 نغمة صدمة أزواج لإنتاج أعلى الاستجابات تجميد مشروط خلال السياق واختبارات جديلة أجريت بعد 6 أسابيع من التدريب، بالمقارنة مع الاختبارات التي أجريت بعد 48 ساعة.
Access restricted. Please log in or start a trial to view this content.
Protocol
وقد وافقت على البروتوكول التالي من قبل لجنة الرعاية واستخدام الحيوانات المؤسسية التابعة لمنظمة جامعة كونراد لورنز (IACUC-KL). وقد تم احترام الإعلان العالمي لحقوق الحيوان الصادر عن الرابطة الدولية لحقوق الحيوان، جنيف، سويسرا (1989)، والمبادئ الأخلاقية للتجريب على الحيوانات الصادرة عن ICLAS.
1- إعداد الموضوع
- حدد ذكور فئران Wistar البالغين (n = 12). منزل لهم في مجموعات من أربعة قفص لمدة ثلاثة أيام من التأقلم، قبل بداية التدريب واختبار البروتوكول. توفير الجرذان مع حرية الوصول إلى المياه طوال التجربة. التحكم في درجة حرارة الغرفة بين 20 °C إلى 25 °C، في إطار دورة 12 ساعة الضوء الظلام (أضواء على الساعة 07:00 ساعة).
ملاحظة: أظهرت سلالات الفئران أداءً تفاضليًا أثناء تكييف الخوف. على سبيل المثال، أفاد Schaap وآخرون (2013) أن سلالات ويستار ولويس أظهرت فترات أطول من السلوك التجميد مقارنة مع فئران فاون هود وبراون النرويج12. وهكذا، ينبغي تقييم الاختلافات في الألم والعتبة الحرارية لضبط شدة وفترة الصدمات. - الحفاظ على الفئران في 85٪ من الأوزان الخاصة بهم تغذية مجانية (الوزن العادي بين 350-400 غرام) عن طريق إعطاء وصول محدود للغذاء في نفس الساعة كل يوم. وزن الفئران كل يوم في نفس الساعة خلال دورة الضوء. احسب وزن الإعلان lib (100٪ weight) لمدة ثلاثة أيام قبل بدء التدريب الموسع لتكييف الخوف.
ملاحظة: تم اختبار الحيوانات المستخدمة في هذه التجربة على اختبارات إضافية مفيدة لم يتم الإبلاغ عنها هنا. وكان الحرمان من الطعام مطلوباً لهذه الاختبارات الإضافية. ويفترض أن هذا الاختلاف الإجرائي من المرجح أن يوسع نطاق الإجراء الحالي، لأنه يوحي باحتمال وجود اختبارات مشتركة للخوف. ومع ذلك، فإن الدراسات التي تستخدم اختبارات تكييف الخوف فقط لن تتطلب الحرمان من الطعام. - تعيين المواضيع عشوائيا إلى واحدة من المجموعات التالية: اختبار العاطفي 6 أسابيع بعد التدريب (ن = 6)؛ اختبار العاطفي 48 ساعة بعد التدريب (ن = 6).
- إجراء التدريب والاختبارات في ساعات مماثلة، خلال مرحلة الضوء من دورة الضوء الداكن. تعيين الحيوانات إلى نفس الغرفة التجريبية والحفاظ على نفس الترتيب من الحيوانات أثناء التدريب والاختبار.
ملاحظة: هناك عنصر تحكم إضافي يمكن تنفيذه هو موازنة ترتيب الحيوانات أثناء التدريب ومراحل الاختبار. نوصي باستخدام هذه التقنية عند تقييم مجموعات المضاعفات، أو تطبيق مهام مختلفة عبر التجارب، لتقليل التأثير المحتمل لترتيب المهام على السلوك.
2. جهاز الإعداد ومعايرة الصدمة
- تنظيف جميع الأسطح الداخلية للغرفة التجريبية وأرضية شبكة الفولاذ المقاوم للصدأ مع الإيثانول 10٪. كرر قبل اختبار كل.
- توصيل المعدات إلى جهاز كمبيوتر باستخدام كابل USB وبدء معدات نظام الكشف تجميد: وحدة المعالجة المركزية، ومجلس الوزراء المسيطر، والضوء الأشعة تحت الحمراء، وحافز / الهرولة، ومعايرة شدة الصدمة.
ملاحظة: على الرغم من أن هذا البروتوكول تم تنفيذه باستخدام الأدوات المتاحة تجارياً (جدول المواد)، يمكن استخدام المعدات والبرامج من مختلف العلامات التجارية. ويتكون الجهاز من غرفة داخلية مربعة الاكريليك (29.53 سم × 23.5 سم × 20.96 سم، تسمى الغرفة التجريبية) جزءا لا يتجزأ في مربع خشبي مغطى بالفورميك البلاستيكي. الأبواب الخارجية تسمح بعزل الصوت أو الضوضاء أو الضوء (أبواب الصندوق المخفف). تقع الكاميرا بشكل جانبي في الجزء الداخلي من الباب الخارجي. مربع الاكريليك الداخلية مع الشبكات المعدنية الكلمة (36 قضبان الفولاذ المقاوم للصدأ، كل واحد من 3 مم قطر ومسافات 8 ملم، مركز إلى مركز) يسمح تسليم هزة القدم. في أحد الجدران الداخلية، يقع مكبر الصوت على بعد 6 سم من الأرض لتقديم إشارة سمعية. - قم بتوصيل المقاطع الحمراء والسوداء لمعايرة شدة الصدمة (أي الموصلات الإيجابية والسلبية) بقضيبين مختلفين على أرضية الشبكة. قم بتوصيل كبل USB بالمنفذ المقابل للكمبيوتر. تأكد من توصيل المقاطع الحمراء والسوداء بالقضبان التي يفصلها شريط آخر.
ملاحظة: يصف هذا القسم عملية معايرة شدة الصدمة باستخدام نوع معين من المعدات المذكورة في جدول المواد. ومع ذلك، يمكن إجراء عملية المعايرة باستخدام ماركات مختلفة من المعدات. يوصى بمعايرة شدة الصدمة في ثلاثة قطاعات من أرضية الشبكة للتحقق من اتساقها. بالإضافة إلى ذلك ، قم دائمًا بإزالة بقايا البراز والبول من أرضية الشبكة لتجنب التداخل أثناء تسليم الصدمة. - بدء برنامج معايرة الصدمة شدة (جدول المواد). اختر كثافة قدرها 1.0 mA في التطبيق بالنقر على سهم النطاق. ثم قم بتغيير مفتاح التشغيل/الإيقاف إلى تشغيل.
ملاحظة: نقترح 1.0 mA على أساس دراساتنا مع نماذج القوارض في مختبرنا والأدب الذي يبلغ مجموعة من 0.75 إلى 1.5 mA على النحو المناسب لدراسات تكييف الخوف33،34،35. - قم بالتبديل على المحفز المُناف أو المعدات المستخدمة في توصيل الحفّازات، وانظر إلى شدة الصدمة المعروضة على لوحة التطبيق. إذا لزم الأمر، ضبط كثافة إلى 1.0 ماي إم أي باستخدام مقبض على محفز aversive.
ملاحظة: يجب تعيين محفز Aversive إلى "OUT" لاختبار التجربة ومعايرتها وتشغيلها بشكل مناسب.
3. تجميد معايرة نظام الكشف
- أغلق الغرفة التجريبية وأبواب صندوق مُخفف للصوت. لا تقدم الحيوان في هذه المرحلة ، حيث سيتم وضعه في الغرفة بعد اكتمال معايرة نظام الكشف عن التجميد. تأكد من أن شدة الضوء داخل الصندوق تتراوح بين 20 و 30 لوكس.
- بدء برنامج نظام الكشف عن تجميد وفتح إطار الحوار إعداد التجربة. أدخل تفاصيل كل موضوع (مثل رقم تعريف الموضوع والتاريخ والمجموعة) ثم قم بتحميل الملف الذي يحمل عنوان "VFC.pro بروتوكول التدريب" (متوفر في http://doi.org/10.17605/OSF.IO/4NKFQ).
ملاحظة: اختبار السياق و جديلة استخدام تكوين برنامج مختلف; وهكذا، تأكد من استخدام الملف الصحيح على كل اختبار. عند هذه النقطة الملف الصحيح يتوافق مع "تدريب بروتوكول VFC.pro". تذكر أنه خلال مراحل الاختبار الملف المقابل سيكون مختلفا عن دورة التدريب. - اختر الكاميرا (الكاميرا) المقابلة وتحقق من خيار حفظ الفيديو (إذا لزم الأمر). تعيين عتبة الحركة إلى 100، ومدة تجميد الحد الأدنى إلى 30 إطار.
ملاحظة: تستند قيمة عتبة الحركة هذه إلى حجم الأنواع المستخدمة (استناداً إلى عدد وحدات البكسل). الحد الأدنى من قيمة المدة التجميد المستحسن من قبل الشركة المصنعة. وتستخدم هذه القيم لضمان الاعتراف السليم للحيوان في الغرفة. - تحقق من أن البث المباشر من الكاميرا (الكاميرا المختارة) يظهر على الشاشة، مع الرسم البياني لعتبة الحركة والجدول الزمني للمحفزات المختلفة التي يتم عرضها أثناء التدريب (مثل الصوت والصدمة).
ملاحظة: باستخدام علامة تجارية مختلفة، يجب أن يوفر إعداد المعدات إمكانية قياس حركات الحيوان للكشف عن "مؤشر" الحركة التي يجب أن تسمح بالمقارنة حول مقدار الوقت الذي يتحرك أو يتجمد. وهناك احتمال آخر هو استخدام البرمجيات التي مع مصدر الفيديو فقط (أثناء أو بعد التجربة) يمكن الكشف عن مقدار الوقت الحيوان هو في الحركة أو تجميد، مثل البرمجيات الحرة ImageFZ13، مفتوحة المصدر أدوات في Matlab14، أو مصنف حر من السلوك الحيواني كما JAABA15. - انقر فوق خيار معايرة ثلاث مرات، مع التحقق من أن مؤشر الحركة يظل أقل من 100 (الحد الأدنى). ثم، تعيين المعدات لقفل عن طريق النقر على الزر المقابلة على الشاشة.
ملاحظة: يصف هذا القسم عملية معايرة نظام الكشف عن التجميد باستخدام علامة تجارية محددة من المعدات المدرجة في جدول المواد. وكما ذكر من قبل، يمكن إجراء عملية المعايرة باستخدام أنواع مختلفة من المعدات (لاستعراض الخيارات المختلفة في المعدات والبرمجيات انظر Anagnostaras et al. 2010)16.
4. تمديد تدريب تكييف الخوف
- نقل الفئران في أقفاص منازلهم، مغطاة بقطعة قماش، من منشأة رعاية الحيوانات إلى غرفة التدريب السلوكي في المختبر. تجنب التعرض للضوضاء أو الظروف التي تولد الإجهاد أثناء نقل الحيوانات إلى غرفة التدريب السلوكي. إذا تم نقل العديد من الحيوانات في نفس الوقت، فقط جلب الحيوانات ليتم اختبارها والحفاظ على الفئران الأخرى في غرفة احتجاز لتعزيز السيطرة التجريبية. التعامل بلطف الحيوانات لمدة 2 دقيقة قبل بدء التدريب.
ملاحظة: في البروتوكول، تم التعامل مع الحيوانات كل يوم لمدة 2 دقيقة قبل التدريب السلوكي. بعد المناولة، تم إدخال الحيوانات في غرفة التجريبية. أوصينا بالتلاعب بالحيوانات لجعل الفئران معتادة على الباحث. - أدخل الجرذ إلى غرفة التجارب. التعامل معها بلطف من قاعدة ذيله ووضعها في منتصف الغرفة. أغلق الغرفة التجريبية وأبواب صندوق مُخفف للصوت.
- ابدأ الجلسة بالنقر على الزر تسجيل. السماح للجرذ تتأقلم إلى الغرفة لمدة 3 دقائق. هذه الفترة 3 دقيقة هو المعيار الموصى بها من قبل الشركة المصنعة للمعدات، ويعمل كخط أساس ووقت التعود على الغرفة.
- تقديم خمسة وعشرين نغمة صدمة أزواج (المحاكمات) مع 60 s بين المحاكمات الفاصلة (ITI)، بدءا من الدقيقة 3 من الدورة. تقديم لهجة (مشروط التحفيز – CS; 90 ديسيبل SPL, 2000 هرتز, 50-ms ارتفاع الوقت) خلال 10 ق الأخيرة من كل ITI, والصدمة (التحفيز غير مشروط – الولايات المتحدة) خلال 2 S الأخيرة من كل ITI.
ملاحظة: تنشيط الزر سجل مشروط بالكاميرات التي يتم معايرتها بشكل صحيح ومؤمن. - إزالة الفئران من غرفة التجريبية عندما انتهت الدورة 28 دقيقة. عودة الحيوانات إلى قفص المنزل على التوالي. نقل الفئران في أقفاص منازلهم مغطاة بقطعة قماش من غرفة التدريب السلوكي إلى منشأة رعاية الحيوانات.
- تكرار معايرة نظام الكشف عن التجميد (الخطوات 3.1-3.5) وتكييف الخوف (الخطوتين 4.1 و 4.3) لتدريب جميع الموضوعات.
ملاحظة: نوصي بشدة بإعادة معايرة نظام الكشف لكل للتأكد من أن البرنامج يحافظ على نفس المعلمات عند معالجة المعلومات لتجميد الكشف. - فترة الراحة: خلال هذه الفترة، يكون الحيوانات بقية بشكل فردي في أقفاص منازلهم. مراقبة وزن الحيوانات مرتين في الأسبوع خلال 6 أسابيع من فترة الحضانة. التلاعب بلطف كل لمدة دقيقتين في حين أنها مرجحة.
5. اختبار السياق – جلسة واحدة 10 دقيقة
- بعد مرحلة التدريب، قم بكشف الحيوانات لأول اختبار للذاكرة يسمى اختبار السياق. خلال هذه المرحلة 10 دقيقة، يعرض الفئران لنفس السياق الذي تم فيه التدريب ولكن لا تقدم إشارات أو الصدمات. نقل الفئران في أقفاصها المنزلية المغطاة (على سبيل المثال، بقطعة قماش) من مرفق رعاية الحيوانات إلى غرفة التدريب السلوكي. نضع في اعتبارنا أن الحيوانات كانت مقسمة إلى مجموعات، وبالتالي يتم اختبار مجموعة واحدة 48 ساعة بعد مرحلة التدريب ويتم اختبار المجموعة الأخرى بعد 6 أسابيع من التدريب (انظر الشكل 1).
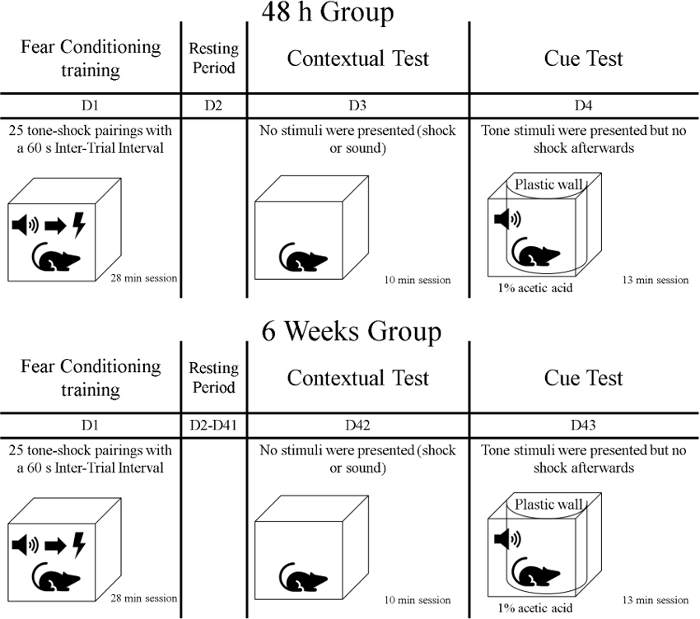
الشكل 1: الجدول الزمني للتجربة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تنظيف جميع الأسطح الداخلية للغرفة التجريبية وأرضية شبكة الفولاذ المقاوم للصدأ مع الإيثانول 10٪. كرر قبل اختبار كل.
- تكرار معايرة نظام الكشف عن التجميد (الخطوات من 3.1 إلى 3.5). افتح نافذة حوار إعداد التجربة ثم قم بتحميل الملف المسمى "protocol.pro اختبار السياق"، والذي يتوفر من http://doi.org/10.17605/OSF.IO/4NKFQ.
ملاحظة: يحتوي هذا الملف على الإعداد لهذه المرحلة التجريبية التي تتكون من أي الصدمات أو النغمات. - تقديم الحيوان إلى غرفة التجريبية. التعامل معها بلطف من قاعدة ذيله ووضعها في منتصف الغرفة. أغلق الغرفة التجريبية وأبواب صندوق مُخفف للصوت.
- ابدأ الجلسة بالنقر على الزر تسجيل. خلال هذه الدورة اختبار سياق 10 دقيقة واحدة، يتم عرض أي محفزات (صدمة لا صوت).
- إزالة الموضوع من غرفة التجريبية عندما تكون الدورة 10 دقيقة هو أكثر. إعادة الحيوانات إلى أقفاص كل منها ونقل الفئران في أقفاصها الرئيسية المغطاة من غرفة التدريب السلوكي إلى منشأة رعاية الحيوان. كرر الخطوات 5.2-5.5 لاختبار جميع المواضيع.
6. اختبار جديلة – واحد 13 دقيقة الدورة
- بعد يوم واحد من اختبار السياق، والحيوانات الخضوع للاختبار الثاني من الذاكرة يسمى اختبار جديلة. خلال هذه المرحلة، فإن الفئران تكون في سياق مختلف من التدريب خلال 13 دقيقة. يتم تقديم العظة (نغمات) ، ولكن لا يتم تسليم أي صدمات. نقل الفئران في أقفاص منازلهم مغطاة بغطاء من منشأة رعاية الحيوانات إلى غرفة التدريب السلوكي. اختبار مجموعة 72 ح بعد تدريب تكييف الخوف، واختبار مجموعة أخرى 6 أسابيع ويوم واحد بعد التدريب (الشكل 1).
ملاحظة: يمكن تنفيذ نظام نقل مختلف (من مرفق رعاية الحيوانات إلى الغرفة التجريبية) للتمييز أكثر بين اختبارات السياق والإشارات. وبما أن الحيوانات نُقلت إلى دورة التدريب وجلسة اختبار السياق في أقفاصها المنزلية، يمكن استخدام قفص نقل مختلف و/أو فراش و/أو غطاء أثناء النقل إلى جلسة اختبار الإشارات. - تنظيف جميع الأسطح الداخلية للغرفة التجريبية وأرضية شبكة الفولاذ المقاوم للصدأ مع الإيثانول 10٪. كرر قبل اختبار كل.
- لتغيير السياق البصري، أدخل الجدار المحيط بالبلاستيك إلى الغرفة التجريبية.
- لتغيير سياق الشم، وتطبيق حمض الخليك 1٪ على مسحة القطن يميل، ووضعها في علبة معدنية تحت أرضية الشبكة17،18،19.
- كرر معايرة نظام الكشف عن التجميد (الخطوات 3.1-3.5). تحميل الملف المسمى ملف "جديلة اختبار protocol.pro" الملف، والذي يتوفر من http://doi.org/10.17605/OSF.IO/4NKFQ.
ملاحظة: يحتوي هذا الملف على الإعداد لهذه المرحلة التجريبية، والذي يتكون من تسليم نفس النغمات المقدمة أثناء مرحلة التدريب (CS)، ولكن في حالة عدم وجود الصدمات (الولايات المتحدة). - تقديم الحيوان إلى غرفة التجريبية. التعامل معها بلطف من قاعدة ذيله ووضعها في منتصف الغرفة. أغلق الغرفة التجريبية وأبواب صندوق مُخفف للصوت.
- ابدأ الجلسة بالنقر على الزر تسجيل. خلال جلسة اختبار جديلة 13 دقيقة واحدة، يتم تقديم التحفيز CS (نغمة) 10 مرات، بدءا من الدقيقة 3 من الدورة.
ملاحظة: أول 3 دقائق تتوافق مع خط الأساس لهذه الدورة، تليها 10 تجارب اختبار جديلة (أي 10 s لكل منهما) التي تم تسليمها مع 50 s ITIs في غياب الصدمات. تسليم النغمات هو تلقائي، عن طريق استخدام الملف الذي تم تحميله سابقا. - إزالة الحيوان من غرفة التجريبية عندما انتهت الدورة 13 دقيقة. إعادة الحيوانات إلى قفص كل منهما ونقلها مغطاة إلى مرفق رعاية الحيوان. كرر الخطوات من 6.2 إلى 6.5 لاختبار جميع المواضيع.
7 - تحليل البيانات
- الحصول على مؤشر النشاط العام (أي مؤشر الحركة) المشتق من تدفق الفيديو باستخدام برنامج نظام الكشف عن التجميد. هذا البرنامج يحول تلقائيا مؤشر الحركة لتوفير نسبة من الوقت تجميد في كل دورة وعدد من الحلقات تجميد. تعيين حد التجميد إلى الإعداد الافتراضي الحد الأدنى من مدة التجميد للنظام (1 s = 30 إطار).
- استخدم البرنامج المخصص (الملف المتوفر من http://doi.org/10.17605/OSF.IO/4NKFQ)للحصول على:
- استخدم البرنامج لتحديد نسبة التجميد خلال الدقائق الثلاث الأولى من الدورة التدريبية (أي التجميد الأساسي، حيث لم يتم تقديم أي صدمات أو نغمات قبل أو خلال تلك الفترة الثلاث دقائق) وخلال الدقائق الثلاث الأولى من جلسة اختبار الإشارات.
- استخدم البرنامج لتحديد نسبة التجميد لكل من 3 صناديق دقيقة من الدورة التدريبية.
- استخدام البرنامج لتحديد النسبة المئوية لتجميد خلال العروض جديلة (أي، تجميد خلال نغمات) وفترات عدم جديلة (فترات بينية; ITIs)، لكل من التدريب وجلسات اختبار الإشارات.
- للحصول على هذه البيانات، افتح برنامج نظام الكشف عن التجميد.
- حدد الملف | تقارير | ملخص مكون الدفعة.
- حدد الملف الذي له ملحق . (ج) برنامج الرصد العالمي متاح من http://doi.org/10.17605/OSF.IO/4NKFQ.
- اسم ملف الإخراج وتغيير عتبة الحركة إلى 100. ثم انقر فوق موافق.
- حدد الملفات التي سيتم تحليلها (الملحق . خام). يتم إنشاء هذه الملفات تلقائياً من برنامج نظام الكشف عن التجميد عند تجاوز جلسة العمل وتطابق البيانات الأولية لكل جلسة عمل. في البداية، يتم حفظ الملفات في سطح المكتب من الكمبيوتر، ولكن يمكن تخزينها في مجلد مخصص (على سبيل المثال، المستندات- الخوف تكييف) لتسهيل تحديدها وفتحها في وقت لاحق عندما تحتاج إلى تحليل.
- فتح ملفات الإخراج (ملحق . CSV). ويمكن تحريرها في برنامج جداول بيانات لمزيد من التحليل. يحتوي هذا الملف على نتائج التجميد أثناء جلسة العمل التجريبية.
ملاحظة: للحصول على النسبة المئوية الإجمالية للتجميد، قم بتقسيم الوقت الذي استغرقه الموضوع غير متحرك عبر وقت جلسة العمل الإجمالي. يمكن حساب عدد حلقات التجميد عدد أحداث التجميد خلال الدورة. وفي كلتا الحالتين، من الضروري تحديد عتبة للحركة تستند إلى حد أدنى من مدة التجميد. هذا هو المعيار الزمني الذي يحدد ما إذا كان يتم تسجيل حلقة التجميد. يمكن للأنظمة الآلية للتسجيل استخدام كمية معينة من الإطارات في الثانية (FPS) كمقياس للحد الأدنى من مدة التجميد. على سبيل المثال، مع معدل عينة 30 إطارا في الثانية، والحد الأدنى لمدة تجميد 15 سوف يسجل الإطارات كتجميد مثيل من الجمود التي تستمر لمدة 30 ثانية.
- حساب متوسط مدة كل حلقة تجميد لكل دورة (التدريب والاختبارات والسياق والإشارات) عن طريق تقسيم المدة الإجمالية للتجميد (بالثواني) على العدد الإجمالي لنوبات التجميد.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تحليل الاختلافات في النسبة المئوية لوقت التجميد خلال المراحل المختلفة من الدورة التدريبية لجميع الموضوعات (n = 12) باستخدام اختبار t التابع(الجدول 1). كانت الحيوانات نشطة واستكشفت الغرفة التجريبية خلال الدقائق الثلاث الأولى من الدورة التدريبية (اليوم الأول م...
Access restricted. Please log in or start a trial to view this content.
Discussion
بروتوكول تكييف الخوف الممتد الحالي هو نهج فعال وصحيح لتقييم الذاكرة العاطفية عبر فترات قصيرة (48 ساعة) وفترات طويلة الأجل (6 أسابيع). وهكذا، يسمح البروتوكول لدراسة الإفراط في التدريب والخوف من ظواهر الحضانة في الفئران. ومن بين المزايا المختلفة لهذا البروتوكول ما يلي. وهو يقدم نوعين من اختبا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقدمت الدعم المالي لهذا البحث من قبل مؤسسة جامعة كونراد لورنز - منحة رقم 9IN15151. ويود المؤلفان أن يشكرا قسم الاتصالات في جامعة كونراد لورينز على مساعدتهما في تسجيل وتحرير الفيديو، ولا سيما ناتاليا ريفيرا وأندريس سيرانو (المنتجان). كما أن نيكول بلير سادوفسكي ولوسيا مدينا لتعلّماهما على المخطوطة، وجوانا باريرو، عميدة جامعة كوربوراسيون إيبيرأمريكانا، للتعاون المؤسسي. ولا يوجد لدى أصحاب البلاغ أي تضارب في المصالح.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid (ethanoic acid) | https://pubchem.ncbi.nlm.nih.gov/compound/acetic_acid | ||
| Aversive Stimulation Current Package | MED Associates Inc | ENV-420 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Contextual test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Cue test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Curved Wall Insert | MED Associates Inc | VFC-008-CWI | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Data processing.zip | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| NIR/White Light Control Box | MED Associates Inc | NIR-100 | |
| Quick Change Floor/Pan Unit for Mouse | MED Associates Inc | ENV-005FPU-M | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Small Tabletop Cabinet and Power Supply | MED Associates Inc | SG-6080D | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standalone Aversive Stimulator/Scrambler (115 V / 60 Hz) | MED Associates Inc | ENV-414S | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standard Fear Conditioning Chamber | MED Associates Inc | VFC-008 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Training protocol VFC.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Video Fear Conditioning Package for Rat | MED Associates Inc | MED-VFC-SCT-R | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
References
- Frankland, P. W., Bontempi, B. The organization of recent and remote memories. Nature Reviews Neuroscience. 6 (2), 119-130 (2005).
- Suzuki, A., Mukawa, T., Tsukagoshi, A., Frankland, P. W., Kida, S. Activation of LVGCCs and CB1 receptors required for destabilization of reactivated contextual fear memories. Learning & Memory. 15 (6), 426-433 (2008).
- Hermans, E. J., et al. How the amygdala affects emotional memory by altering brain network properties. Neurobiology of Learning and Memory. 112, 2-16 (2014).
- Moryś, J., Berdel, B., Jagalska-Majewska, H., ŁUczyńSka, A. The basolateral amygdaloid complex -its development, morphology and functions. Folia Morphologica. 58 (3), 29-46 (1998).
- LeDoux, J. E. Emotional memory systems in the brain. Behavioural Brain Research. 58 (1-2), 69-79 (1993).
- Labar, K. S. Beyond fear: Emotional memory mechanisms in the human brain. Current Directions in Psychological Science. 16 (4), 173-177 (2007).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Maren, S. Overtraining Does Not Mitigate Contextual Fear Conditioning Deficits Produced by Neurotoxic Lesions of the Basolateral Amygdala. The Journal of Neuroscience. 18 (8), 3097-3097 (1998).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, Unit-6.27 (2013).
- Morrow, J. D., Saunders, B. T., Maren, S., Robinson, T. E. Sign-tracking to an appetitive cue predicts incubation of conditioned fear in rats. Behavioural Brain Research. 276, 59-66 (2015).
- Pickens, C. L., Golden, S. A., Adams-Deutsch, T., Nair, S. G., Shaham, Y. Long-lasting incubation of conditioned fear in rats. Biological Psychiatry. 65 (10), 881-886 (2009).
- Schaap, M. W. H., et al. Nociception and Conditioned Fear in Rats: Strains Matter. PLoS ONE. 8 (12), 83339(2013).
- Shoji, H., Takao, K., Hattori, S., Miyakawa, T. Contextual and Cued Fear Conditioning Test Using a Video Analyzing System in Mice. Journal of Visualized Experiments. (85), e50871(2014).
- Patel, T. P., et al. An open-source toolbox for automated phenotyping of mice in behavioral tasks. Frontiers in Behavioral Neuroscience. 8, 349(2014).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: Interactive machine learning for automatic annotation of animal behavior. Nature Methods. 10 (1), 64-67 (2013).
- Anagnostaras, S. G. Automated assessment of Pavlovian conditioned freezing and shock reactivity in mice using the VideoFreeze system. Frontiers in Behavioral Neuroscience. 4 (58), (2010).
- Moyer, J. R., Brown, T. H. Impaired Trace and Contextual Fear Conditioning in Aged Rats. Behavioral Neuroscience. 120 (3), 612-624 (2006).
- Schuette, S. R., Hobson, S. Conditioned contextual fear memory to assess natural forgetting and cognitive enhancement in rats. Journal of Biological Methods. 5 (3), 99(2018).
- Chang, C. H., et al. Fear extinction in rodents. Current Protocols in Neuroscience. , Chapter 8 (SUPPL. 47) (2009).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, 1-18 (2013).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Vetere, G., et al. Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice Article Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice. Neuron. 94 (2), 363-374 (2017).
- Koob, G. F., Zimmer, A. Chapter 9 - Animal models of psychiatric disorders. Neurobiology of Psychiatric Disorders. 106, 137-166 (2012).
- Bourin, M. Animal models for screening anxiolytic-like drugs: a perspective. Dialogues in clinical neuroscience. 17 (3), 295-303 (2015).
- Murray, S. B., et al. Fear as a translational mechanism in the psychopathology of anorexia nervosa. Neuroscience & Biobehavioral Reviews. 95, 383-395 (2018).
- Pamplona, F. A., et al. Prolonged fear incubation leads to generalized avoidance behavior in mice. Journal of Psychiatric Research. 45 (3), 354-360 (2011).
- Török, B., Sipos, E., Pivac, N., Zelena, D. Modelling posttraumatic stress disorders in animals. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 90, 117-133 (2019).
- Bhakta, A., Gavini, K., Yang, E., Lyman-Henley, L., Parameshwaran, K. Chronic traumatic stress impairs memory in mice: Potential roles of acetylcholine, neuroinflammation and corticotropin releasing factor expression in the hippocampus. Behavioural Brain Research. 335, 32-40 (2017).
- Uniyal, A., et al. Pharmacological rewriting of fear memories: A beacon for post-traumatic stress disorder. European Journal of Pharmacology. , 172824(2019).
- Barad, M. Fear extinction in rodents: basic insight to clinical promise. Current Opinion in Neurobiology. 15 (6), 710-715 (2005).
- Haaker, J., et al. Making translation work: Harmonizing cross-species methodology in the behavioural neuroscience of Pavlovian fear conditioning. Neuroscience & Biobehavioral Reviews. 107, 329-345 (2019).
- Heroux, N. A., Horgan, C. J., Pinizzotto, C. C., Rosen, J. B., Stanton, M. E. Medial prefrontal and ventral hippocampal contributions to incidental context learning and memory in adolescent rats. Neurobiology of Learning and Memory. 166, 107091(2019).
- Rossi, M. A., Yin, H. H. Methods for Studying Habitual Behavior in Mice. Current Protocols in Neuroscience. 60 (1), 8-29 (2012).
- Brady, A. M., Floresco, S. B. Operant Procedures for Assessing Behavioral Flexibility in Rats. Journal of Visualized Experiments. (96), (2015).
- Zoccolan, D., Di Filippo, A. Methodological Approaches to the Behavioural Investigation of Visual Perception in Rodents. Handbook of Behavioral Neuroscience. , Elsevier B.V. (2018).
- Lguensat, A., Bentefour, Y., Bennis, M., Ba-M'hamed, S., Garcia, R. Susceptibility and Resilience to PTSD-Like Symptoms in Mice Are Associated with Opposite Dendritic Changes in the Prelimbic and Infralimbic Cortices Following Trauma. Neuroscience. 418, 166-176 (2019).
- Li, Q., et al. N-Acetyl Serotonin Protects Neural Progenitor Cells Against Oxidative Stress-Induced Apoptosis and Improves Neurogenesis in Adult Mouse Hippocampus Following Traumatic Brain Injury. Journal of Molecular Neuroscience. 67 (4), 574-588 (2019).
- Pantoni, M. M., Carmack, S. A., Hammam, L., Anagnostaras, S. G. Dopamine and norepinephrine transporter inhibition for long-term fear memory enhancement. Behavioural Brain Research. 378 (112266), 112266(2020).
- Smith, K. L., et al. Microglial cell hyper-ramification and neuronal dendritic spine loss in the hippocampus and medial prefrontal cortex in a mouse model of PTSD. Brain, Behavior, and Immunity. 80, 889-899 (2019).
- Liu, X., Zheng, X., Liu, Y., Du, X., Chen, Z. Effects of adaptation to handling on the circadian rhythmicity of blood solutes in Mongolian gerbils. Animal Models and Experimental. 2 (2), 127-131 (2019).
- Landgraf, D., McCarthy, M. J., Welsh, D. K. The role of the circadian clock in animal models of mood disorders. Behavioral Neuroscience. 128 (3), 344-359 (2014).
- Refinetti, R., Kenagy, G. J. Diurnally active rodents for laboratory research. Laboratory annimals. 52 (6), 577-587 (2018).
- Hurtado-Parrado, C., et al. Assessing Mongolian gerbil emotional behavior: effects of two shock intensities and response-independent shocks during an extended inhibitory-avoidance task. PeerJ. 5, (2017).
- Frey, P., Eng, S., Gavinf, W. Conditioned suppression in the gerbil. Behavior Research Methods & Instrumentation. 4 (5), 245-249 (1972).
- Woolley, M. L., Haman, M., Higgins, G. A., Ballard, T. M. Investigating the effect of bilateral amygdala lesions on fear conditioning and social interaction in the male Mongolian gerbil. Brain Research. 1078 (1), 151-158 (2006).
- Ballard, T. M., Sänger, S., Higgins, G. a Inhibition of shock-induced foot tapping behaviour in the gerbil by a tachykinin NK1 receptor antagonist. European Journal of Pharmacology. 412 (3), 255-264 (2001).
- Luyten, L., Schroyens, N., Hermans, D., Beckers, T. Parameter optimization for automated behavior assessment: plug-and-play or trial-and-error. Frontiers in Behavioral Neuroscience. 8 (28), (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved